El beneficio de la duodenopancreatectomía cefálica (DPC) con resección de la vena mesentérica superior/vena porta (RVP) para el adenocarcinoma de páncreas (ADCP) es controvertido en cuanto a la morbilidad, mortalidad y supervivencia. Se analizan los resultados de la DPC con RVP en un centro terciario español.
MétodosEntre 2002 y 2012, 10 pacientes fueron tratados mediante RVP (RVP+) y 68 con DPC estándar (RVP−). La morbilidad, mortalidad, supervivencia global (SG) y supervivencia libre de enfermedad (SLE) se compararon entre pacientes RVP+/RVP−. Los factores pronósticos fueron identificados con regresión de Cox.
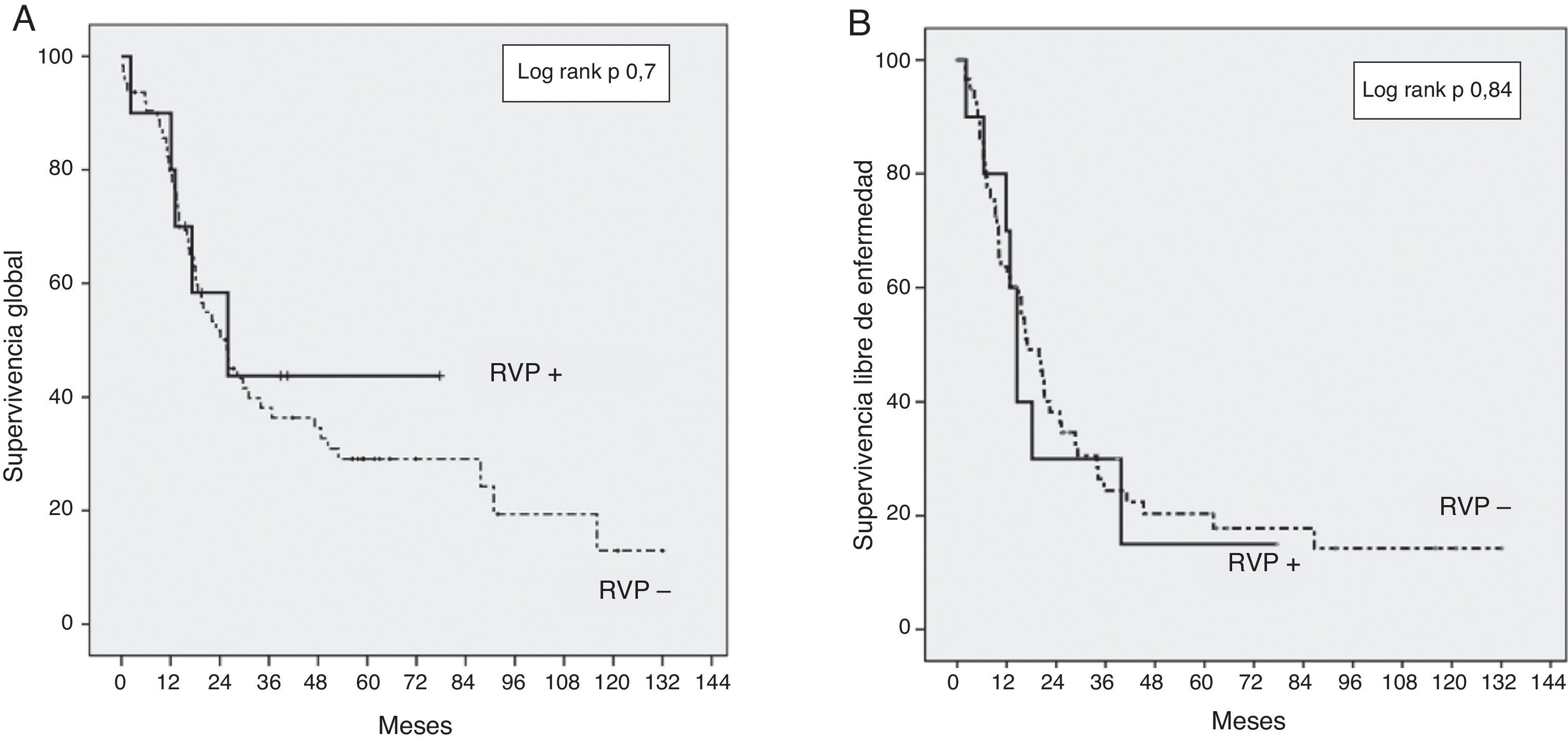
ResultadosLa mortalidad postoperatoria fue del 5% (4/78), todos los pacientes en el grupo RVP−. La morbilidad fue mayor en el grupo RVP− comparado con RVP+ (63 vs. 30%; p=0,04). La SG a 3 y 5 años fue 43 y 43% en el grupo RVP+, 35 y 29% en RVP− (p=0,7). La SLE a 3 y 5 años fue 28 y 15% en RVP+, 25 y 20% en RVP− (p=0,84). La mediana de supervivencia fue de 23,1 meses en el grupo RVP− y de 22,8 meses en el grupo RVP+ (p=0,73). Los factores relacionados con la SG fueron ausencia de tratamiento adyuvante (OR 2,9; IC95%: 1,39-6,14; p=0,003), resección R1 (OR 2,3; IC95%: 1,2-4,43; p=0,006), CA 19.9 ≥ 170 UI/mL (OR 2,3; IC95%: 1,22-4,32; p=0,01). Los factores de riesgo para SLE fueron resección R1 (OR 2,6; IC95%: 1,41-4,95; p=0,002); tumores pobremente diferenciados (OR 2,7; IC95%: 1,23-6,17; p=0,01); tumores N1 (OR 1,8; IC95%: 1,02-3,19; p=0,04); CA 19.9 ≥ 170 UI/mL (OR 2,4; IC95%: 1,30-4,54; p=0,005).
ConclusionesLa RVP para ADCP puede realizarse con seguridad. Pacientes con RVP tienen una supervivencia comparable a los pacientes tratados mediante DPC estándar si se obtienen márgenes libres.
The benefit of pancreaticoduodenectomy (PD) with superior mesenteric-portal vein resection (PVR) for pancreatic adenocarcinoma (PA) is still controversial in terms of morbidity, mortality and survival. We conducted a retrospective study to analyze outcomes of PD with PVR in a Spanish tertiary centre.
MethodsBetween 2002 and 2012, 10 patients underwent PVR (PVR+ group) and 68 standard PD (PVR− group). Morbidity, mortality, overall survival (OS) and disease-free survival (DFS) were compared between PVR+ and PVR− group. Prognostic factors were identified by a Cox regression model.
ResultsPostoperative mortality was 5% (4/78), all patients in PVR− group. Morbidity was higher in the PVR− group compared to PVR+ (63 vs. 30%, P=.004). OS at 3 and 5 years was 43 and 43% in PVR+ group, 35 and 29% in PVR− group (P=.07). DFS at 3 and 5 years DFS were 28 and 15% in PVR+ group, 25 and 20% in PVR− group (P=.84). Median survival was 23.1 months in PVR− group, and 22.8 months in PVR+ group (P=.73). Factors related with OS were absence of adjuvant treatment (OR 2.9, 95%IC: 1.39-6.14, P=.003), R1 resection (OR 2.3, 95%IC: 1.2-4.43, P=.006), preoperative CA 19.9 level ≥ 170 UI/mL (OR 2.3, 95%IC: 1.22-4.32, P=.01). DFS risk factors were R1 resection (OR 2.6, 95%IC: 1.41-4.95, P=.002); moderate or poor tumor differentiation grade (OR 2.7, 95%IC: 1.23-6.17, P=.01); N1 lymph node status (OR 1.8, 95%IC: 1.02-3.19, P=.04); CA 19.9 level ≥ 170 UI/mL (OR 2.4, 95%IC: 1.30-4.54, P=.005).
ConclusionsPVR for PA can be performed safely. Patients with PVR have a comparable survival to patients undergoing standard PD if disease-free margins can be obtained.
El adenocarcinoma ductal de la cabeza del páncreas (ADCP) es la cuarta causa de muerte por cáncer en España, con aproximadamente 4.000 nuevos casos diagnosticados cada año1. La duodenopancreatectomía cefálica (DPC) para el ADCP es el único tratamiento potencialmente curativo para este tipo de cáncer agresivo. Sin embargo solo el 10-20% de estos pacientes son tratados mediante cirugía. Esto es principalmente debido a la presencia de enfermedad metastásica y localmente avanzada en forma de compromiso vascular en el momento del diagnóstico2,3. Los resultados a largo plazo después de la cirugía siguen siendo pobres, con una supervivencia global a los 5 años entre el 10 y el 27%, y con una supervivencia media de entre 14 y 33 meses en las series más recientes, incluso con quimioradioterapia neoadyuvante (CRTNA) o adyuvante4–9. La terapia oncoquirúrgica multimodal ha aumentado la tasa de resecabilidad, particularmente para pacientes con ADCP clasificados como borderline10. La extensión tumoral retroperitoneal a menudo implica la invasión de la vena mesentérica superior/vena porta (VMS/VP), que en tal caso se debe resecar para lograr una escisión completa (R0), y permitir una posibilidad de cura11,12. Los resultado de supervivencia a largo plazo de las DPC con resección venosa parecen, por lo menos, comparables con los de los pacientes sin resección vascular, pero el beneficio efectivo de este procedimiento continúa siendo debatido13–17.
El objetivo de este estudio es analizar los resultados de la DPC asociada a resección de la VMS/VP, en comparación con DPC sin resección venosa en un hospital universitario europeo.
MétodosSelección de pacientesEntre 2002 y 2012, 252 pacientes fueron tratados mediante DPC en nuestro centro. Todos los datos relativos a los pacientes se registraron en una base de datos de forma prospectiva. Se excluyó a los pacientes que requirieron resección pancreática por una enfermedad benigna, con cáncer periampular, colangiocarcinoma de la vía biliar distal, tumores neuroendocrinos y neoplasia papilar mucinosa intraductal. Se realizó un análisis retrospectivo de 78 DPC con intento curativo para ADCP: 10 pacientes con resección de la VMS/VP (RVP+) se compararon con 68 pacientes sin resección venosa (RVP−). Se registraron datos demográficos, quirúrgicos y anatomopatológicos, complicaciones, estancia hospitalaria, la supervivencia global (SG) y la supervivencia libre de enfermedad (SLE). La mediana del tiempo de seguimiento fue de 23 meses (rango 1-132). La evaluación preoperatoria de los pacientes consistió en una historia clínica detallada y un examen físico, el nivel de CA 19.9 y una tomografía computarizada (TC) toracoabdominal. La colangiopancreatografía por resonancia magnética, la colangiopancreatografía retrógrada endoscópica y la ecografía endoscópica con o sin biopsia del tumor se realizaron de forma selectiva. El Comité de Ética del hospital aprobó el estudio.
Criterios de resecabilidad, terapia neoadyuvante y adyuvanteLa ausencia de afectación vascular en las imágenes con invasión <180° de la circunferencia de la vena sin afectación arterial fue aceptada como indicación para la cirugía directa. Las metástasis a distancia, así como la invasión del tronco celíaco/arteria mesentérica superior (AMS), la afectación >180° de la circunferencia o trombosis completa del sistema mesentérico-portal sin opciones reconstructivas establecidos en la evaluación preoperatoria se consideraron contraindicaciones para la cirugía.
Un estrechamiento unilateral o bilateral >180° del eje mesentérico-portal, un contacto ≤180° de la AMS, la participación de un segmento corto de la arteria hepática (AH) sin la extensión al tronco celíaco fueron considerados lesiones borderline, con indicación de recibir CRTNA18,19. Los pacientes candidatos a tratamiento con CRTNA tuvieron una biopsia guiada por ecoendoscopia. Los pacientes recibieron quimioterapia basada en gemcitabina o oxaliplatino/gemcitabina durante 3 meses, seguida de radioterapia en caso de exclusión de progresión de la enfermedad; evaluaciones de estadificación se realizaron cada 4 semanas. La radiación externa consistió en 50,4Gy combinada con 5-fluorouracilo o capecitabina; 4 a 6 semanas después de la finalización del tratamiento, los pacientes tuvieron una nueva evaluación multidisciplinaria con TC y evaluación fisiológica para determinar la operabilidad. Los pacientes fueron considerados aptos para la intervención quirúrgica en caso de enfermedad estable.
Los pacientes con ictericia obstructiva se drenaron de preferencia de forma endoscópica en caso de retraso de la cirugía superior a 10 días desde el diagnóstico por motivos diagnósticos o terapéuticos, en aquellos pacientes sintomáticos (colangitis, prurito intenso), con alteración de la función renal o con importantes comorbilidades cardiovasculares. El drenaje biliar interno se realizó con endoprótesis plástica extraíble. Una endoprótesis biliar temporal se colocó de forma sistemática en aquellos pacientes candidatos a recibir CRTNA. El drenaje percutáneo radiológico interno-externo se realizó de forma muy selectiva en caso de fracaso o contraindicación del drenaje endoscópico. La cirugía fue diferida en caso de drenaje biliar de 3-6 semanas hasta resolución de la ictericia en el grupo RVP−, y hasta la finalización del protocolo de CRTNA en el grupo RVP+.
Después de la cirugía, los pacientes con factores de riesgo de recidiva (resección microscópicamente incompleta, compromiso de los ganglios linfáticos, invasión perineural o microvascular) fueron evaluados para recibir quimioterapia basada en gemcitabina sobre una base individual hasta el año 2008. En el período sucesivo todos los pacientes resecados fueron evaluados para recibir un protocolo adyuvante basado en gemcitabina según el estado general, las comorbilidades y la edad9,20.
Técnica quirúrgicaUn equipo de 3 cirujanos expertos ha realizado todas las operaciones. La DPC con preservación del píloro (DPCPP) es el procedimiento más común en nuestro centro. Realizamos una linfadenectomía estándar de la cabeza pancreática y periduodenal con disección del pedículo hepático y AH común, exéresis de la lámina pancreática retroportal y el tejido linfático situado en el lado derecho de la AMS, sin linfadenectomía extendida descrita por otros autores21,22. La pancreaticoyeyunostomía ducto-mucosa se tutoriza de forma sistemática con un catéter de diámetro adaptado al Wirsung, externalizado a través de la pared del asa yeyunal. Una hepaticoyeyunostomía terminolateral se realiza a los 20 a 30cm distal en el mismo segmento de yeyuno; una gastroyeyunostomía terminolateral se realiza 30cm distal en la misma ansa, de preferencia de forma antecólica. Los pacientes con ADCP con invasión del sistema mesentérico-portal se trataron mediante disección retroperitoneal, seguida de sección digestiva, biliar y pancreática; todas las secciones digestivas se realizaron antes de la resección vascular. En caso de resección segmentaria >2cm, se movilizó la raíz del mesenterio antes del pinzamiento vascular para facilitar la reconstrucción sin tensión. Cuando se resecó la confluencia VMS/VP con la vena esplénica, la continuidad axial fue restaurada en primer lugar, y en segundo lugar se realizó el reimplante de la vena esplénica bajo pinzamiento lateral solo en el caso de drenaje de la vena mesentérica inferior en la VMS/VP.
Morbilidad y mortalidad postoperatoriaLa morbimortalidad postoperatoria define los eventos que ocurren en los 90 días después de la cirugía. Las complicaciones se clasifican según Dindo-Clavien (DC); las complicaciones graves se definieron ≥grado III23. Las definiciones del Grupo Internacional de Estudios de Cirugía de Páncreas se aplicaron para la fístula pancreática, la hemorragia y el retraso del vaciamiento gástrico24–26.
Evaluación anatomopatológicaLos tumores se clasifican de acuerdo con el sistema AJCC-TNM. Los hallazgos patológicos incluyen el tamaño del tumor, la diferenciación, la metástasis linfática, microvascular, perineural. Los márgenes se definen como pancreático (sección cuello de páncreas), biliar (sección vía biliar) y radial (margen retroperitoneal). Un margen de resección inferior a 1mm se consideró como invadido (R1).
Análisis estadísticoLas variables continuas se compararon con la prueba de t de Student. Las variables categóricas se compararon mediante la prueba de chi cuadrado. El método de Kaplan-Meier se utilizó para estimar las SG y SLE de los pacientes, comparadas con la prueba de log-rank. Los factores relacionados con la supervivencia se analizaron con el modelo de regresión de Cox. Un valor de p<0,05 fue considerado significativo. Los análisis se realizaron utilizando el programa SPSS, versión 15.0.
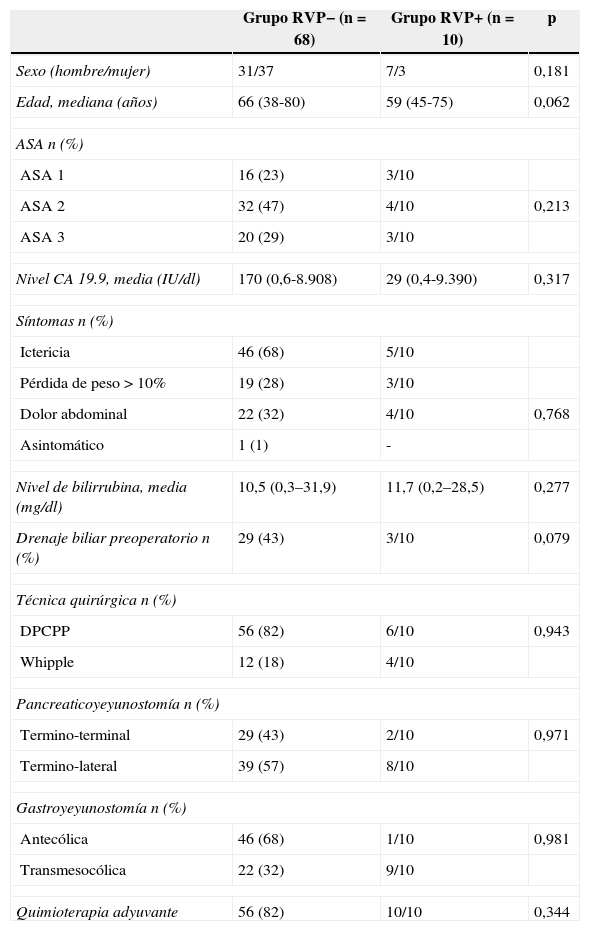
ResultadosDurante el período de estudio se analizaron los datos relativos a 78 pacientes. Diez pacientes del grupo RVP+ se compararon con 68 pacientes del grupo RVP−. Las características de los pacientes se muestran en la tabla 1. De los 68 pacientes del grupo RVP−, 29 (43%) presentaron ictericia con indicación de un drenaje biliar preoperatorio: 22 de ellos se drenaron con endoprótesis endoscópica plástica y 7 pacientes recibieron drenaje radiológico percutáneo transhepático de tipo interno-externo en todos los casos. Tres pacientes en el grupo RVP+ recibieron CRTNA: gemcitabina-capecitabina en 2 casos y gemcitabina-oxaliplatino-5-fluorouracilo en un caso; a todos ellos se les realizó un drenaje biliar endoscópico preoperatorio con prótesis plástica. Entre los pacientes en el grupo RVP+, la TC preoperatoria detectó infiltración vascular en 4; compresión extrínseca en 2; estrechamiento <180° de la circunferencia de la vena en 2; estenosis >180° en 2; un paciente tenía un contacto con la AMS <180°. Resecciones venosas laterales se realizaron en 4 pacientes y segmentarias en 6. La longitud mediana fue de 2,1cm (1-3cm). El reimplante de la vena esplénica se realizó en 2 pacientes. La duración mediana del pinzamiento del sistema mesentérico-portal fue de 26min (20-55min). El tiempo operatorio mediano en el grupo RVP+ fue de 355 min (240-510min), con unas pérdidas hemáticas medianas de 700 cc (200-3.500 cc).
Datos demográficos y operatorios
| Grupo RVP− (n=68) | Grupo RVP+ (n=10) | p | |
|---|---|---|---|
| Sexo (hombre/mujer) | 31/37 | 7/3 | 0,181 |
| Edad, mediana (años) | 66 (38-80) | 59 (45-75) | 0,062 |
| ASA n (%) | |||
| ASA 1 | 16 (23) | 3/10 | |
| ASA 2 | 32 (47) | 4/10 | 0,213 |
| ASA 3 | 20 (29) | 3/10 | |
| Nivel CA 19.9, media (IU/dl) | 170 (0,6-8.908) | 29 (0,4-9.390) | 0,317 |
| Síntomas n (%) | |||
| Ictericia | 46 (68) | 5/10 | |
| Pérdida de peso>10% | 19 (28) | 3/10 | |
| Dolor abdominal | 22 (32) | 4/10 | 0,768 |
| Asintomático | 1 (1) | - | |
| Nivel de bilirrubina, media (mg/dl) | 10,5 (0,3–31,9) | 11,7 (0,2–28,5) | 0,277 |
| Drenaje biliar preoperatorio n (%) | 29 (43) | 3/10 | 0,079 |
| Técnica quirúrgica n (%) | |||
| DPCPP | 56 (82) | 6/10 | 0,943 |
| Whipple | 12 (18) | 4/10 | |
| Pancreaticoyeyunostomía n (%) | |||
| Termino-terminal | 29 (43) | 2/10 | 0,971 |
| Termino-lateral | 39 (57) | 8/10 | |
| Gastroyeyunostomía n (%) | |||
| Antecólica | 46 (68) | 1/10 | 0,981 |
| Transmesocólica | 22 (32) | 9/10 | |
| Quimioterapia adyuvante | 56 (82) | 10/10 | 0,344 |
ASA: American Society of Anesthesiology; CA 19.9: carbohydrate antigen 19.9; DPCPP: duodenopancreatectomía cefálica con preservación pilórica.
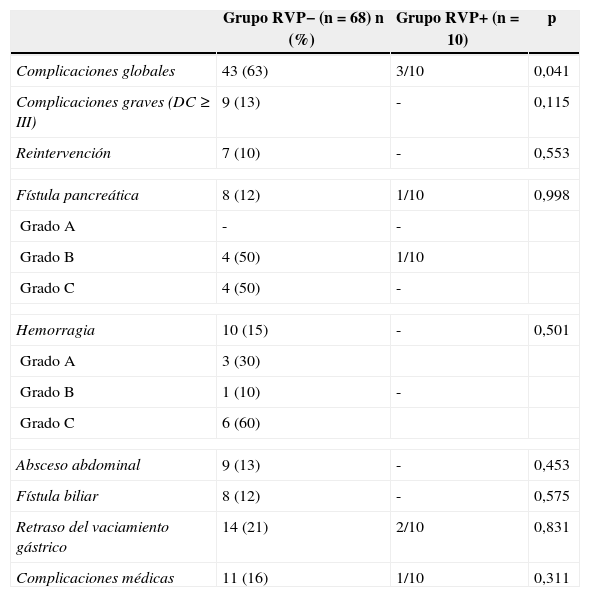
Las complicaciones postoperatorias se muestran en la tabla 2. La morbilidad global fue mayor en el grupo RVP−. Nueve pacientes (13%) del grupo RVP− tuvieron complicaciones de grado III-IV: 7 pacientes requirieron reintervención (5 por hemorragia relacionada con fístula pancreática, uno por desbridamiento de abscesos abdominales y otro por coleperitoneo), un paciente tuvo drenaje radiológico de absceso abdominal y otro una embolización arterial. Ningún paciente tuvo complicaciones graves en el grupo RVP+. La estancia hospitalaria fue significativamente mayor en el grupo RVP− que en el grupo RVP+ (23±14 frente a 15±6 días; p=0,02). La mortalidad global fue del 5% (4/78), todos los pacientes en el grupo RVP− a consecuencia de fístula pancreática de grado C.
Complicaciones postoperatorias
| Grupo RVP− (n=68) n (%) | Grupo RVP+ (n=10) | p | |
|---|---|---|---|
| Complicaciones globales | 43 (63) | 3/10 | 0,041 |
| Complicaciones graves (DC ≥ III) | 9 (13) | - | 0,115 |
| Reintervención | 7 (10) | - | 0,553 |
| Fístula pancreática | 8 (12) | 1/10 | 0,998 |
| Grado A | - | - | |
| Grado B | 4 (50) | 1/10 | |
| Grado C | 4 (50) | - | |
| Hemorragia | 10 (15) | - | 0,501 |
| Grado A | 3 (30) | ||
| Grado B | 1 (10) | - | |
| Grado C | 6 (60) | ||
| Absceso abdominal | 9 (13) | - | 0,453 |
| Fístula biliar | 8 (12) | - | 0,575 |
| Retraso del vaciamiento gástrico | 14 (21) | 2/10 | 0,831 |
| Complicaciones médicas | 11 (16) | 1/10 | 0,311 |
DC: clasificación de Dindo-Clavien.
Las características anatomopatológicas están resumidas en la tabla 3. Hubo 3 resecciones R1 en el grupo RVP+ y 15 (22%) en el grupo RVP− (p = 0,68); en la mayoría de los casos estuvo implicado el margen radial. El diámetro del tumor fue significativamente mayor en el grupo RVP+ respecto al grupo RVP− (3,1±1 frente a 2,5±0,8cm; p = 0,03).
Hallazgos anatomopatológicos
| Grupo RVP− (n=68) | Grupo RVP+ (n=10) | p | |
|---|---|---|---|
| Resección R1 n (%) | 15 (22) | 3/10 | 0,686 |
| Margen radial | 13 (87) | 3/3 | |
| Margen pancreático | 2 (13) | - | |
| Diámetro tumoral, media (cm) | 2,5±0,8 | 3,1±1 | 0,036 |
| Estadio TNM n (%) | |||
| T1 | 10 (15) | 2/10 | |
| T2 | 10 (15) | 1/10 | |
| T3 | 47 (69) | 6/10 | 0,537 |
| T4 | 1 (1) | 1/10 | |
| N0 | 25 (37) | 4/10 | 0,911 |
| N1 | 43 (63) | 6/10 | |
| Diferenciación tumoral n (%) | |||
| Bien diferenciado (G1) | 14 (21) | - | |
| Moderadamente diferenciado (G2) | 43 (63) | 8/10 | 0,275 |
| Pobremente diferenciado (G3) | 11 (16) | 2/10 | |
| Invasión microvascular n (%) | 17 (25) | 3/10 | 0,712 |
| Invasión linfática | 32 (47) | 4/10 | 0,744 |
| Invasión perineural | 51 (75) | 6/10 | 0,449 |
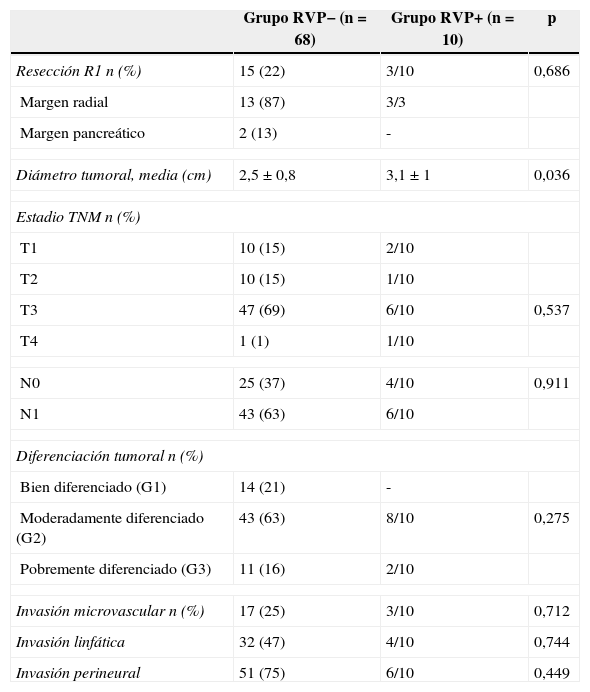
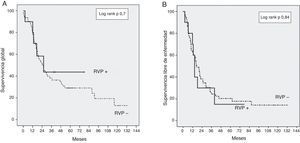
La SG de toda la serie fue de 37 y 30% a los 3 y 5 años, respectivamente. La SG a los 3 y 5 años en el grupo RVP+ fue de 43 y 43% respectivamente, en comparación con el 35 y el 29% en el grupo RVP− (p=0,7) (fig. 1). La SLE a los 3 y 5 años en el grupo RVP+ fue de 28 y 15% respectivamente, sin diferencias significativas en comparación con el grupo RVP−: 25 y 20% a los 3 y 5 años (p=0,84). La mediana de supervivencia fue de 23,1 meses en el grupo RVP− y 22,8 meses en el grupo RVP+ (p=0,73).
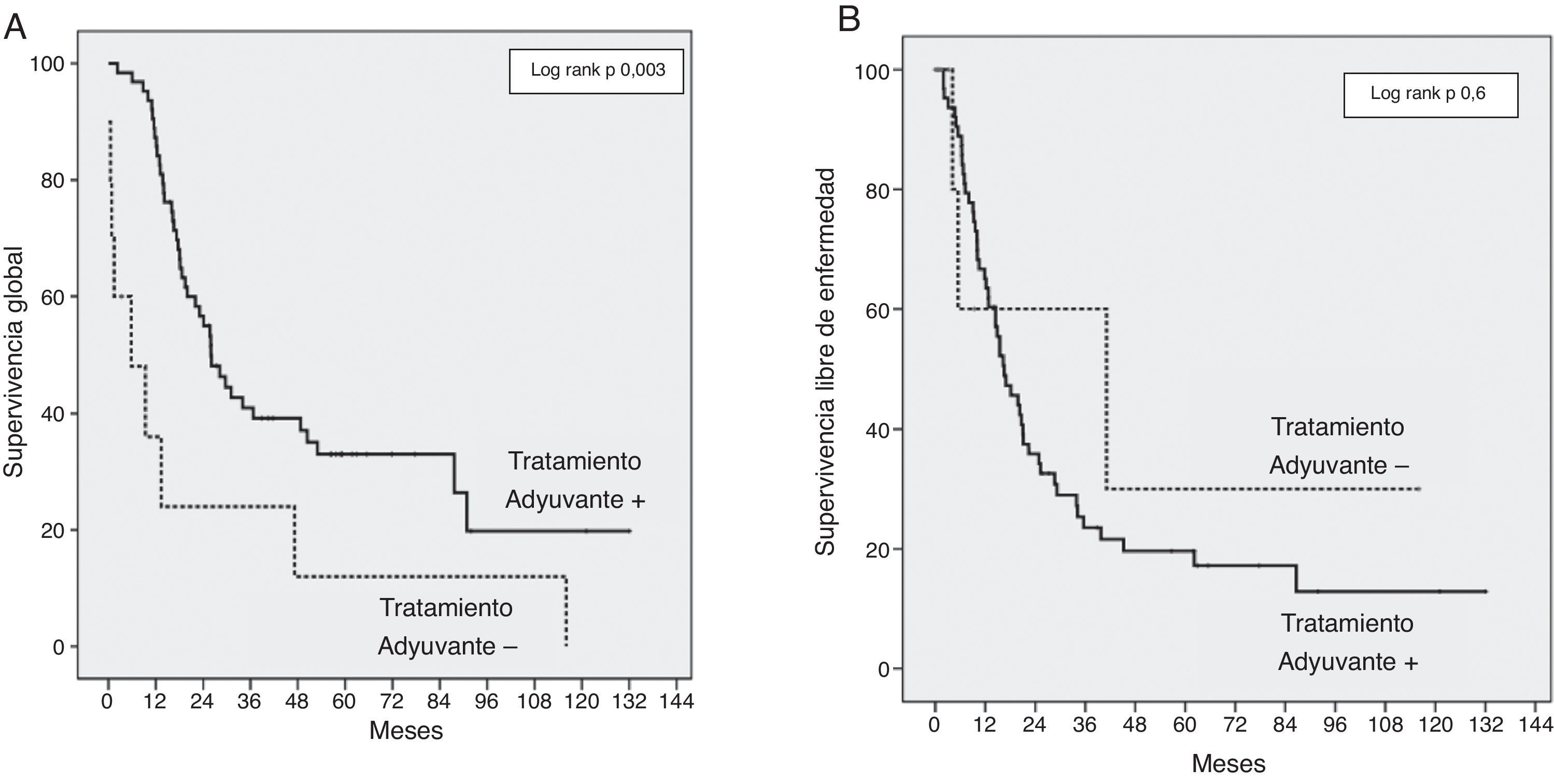
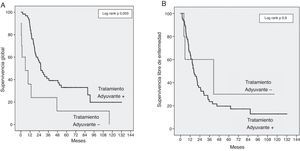
Los factores de riesgo estudiados para la supervivencia y la recidiva fueron: edad, sexo, niveles de CA 19.9 y de bilirrubina preoperatorios, la morbilidad global, la resección R0/R1, la resección de VMS/VP, el diámetro del tumor y la diferenciación, la estadificación (T/N), la invasión microvascular, linfática y perineural, y la ausencia de tratamiento adyuvante. Los factores relacionados con una menor SG fueron ausencia de tratamiento adyuvante (OR 2,9; IC95%: 1,39-6,14; p = 0,003), resección R1 (OR 2,3; IC95%: 1,27-4,43; p = 0,006) y niveles preoperatorios de CA 19.9 ≥ 170 UI/mL (OR 2,3; IC95%: 1,22-4,32; p = 0,01). El riesgo de recidiva también estaba relacionado con la resección R1 (OR 2,6; IC95%: 1,41-4,95; p = 0,002); tumores moderada o pobremente diferenciados (OR 2,7; IC95%: 1,23-6,17; p = 0,01); estado N1 (OR 1,8; IC95%: 1,02-3,19; p = 0,04); niveles de CA 19.9 ≥ 170 UI/mL (OR 2,4; IC95%: 1,30-4,54; p = 0,005). La ausencia de tratamiento adyuvante fue el factor de riesgo de supervivencia más importante en nuestra serie, aunque sin influencia sobre la SLE (fig. 2).
DiscusiónMoore describió por primera vez la DPC con resección de la VMS/VP para ADCP en 1951, pero la primera serie de 18 pacientes fue publicada en 1977, con una mortalidad a los 30 días del 17%27. Los primeros estudios reportaron resultados muy pobres de supervivencia; estaban incluidas resecciones tanto venosas como arteriales, con elevada morbilidad. Gracias a crecientes pruebas en la literatura se definieron mejores indicaciones y la resección de la VMS/VP se convirtió en un procedimiento bien establecido con resultados a largo plazo comparables con las DPC estándar, sin aumento de la morbilidad en medio experto14,16. Nuestra serie demuestra la seguridad y la factibilidad del procedimiento, con una morbilidad global comparable a la literatura existente, que varía entre 16 y 54%15.
Nuestra serie ha mostrado una tasa de complicaciones en el grupo RVP+ significativamente inferior a la DPC estándar (63 vs. 30%; p=0,04), aunque la tasa de complicaciones graves no difirió entre los 2 grupos (13 vs. 0%; p=0,11). Esta menor proporción de morbilidad global en el grupo RVP+, aunque debida a complicaciones menores (DC grado I y II), se podría en parte explicar con un efecto temporal, dado que los pacientes en este grupo son intervenidos en años más recientes respecto a los del grupo RVP−, con un aumento relativo de experiencia del equipo quirúrgico.
Reportamos una mortalidad global a los 90 días del 5%, sin fallecimientos en el grupo RVP+. La mortalidad perioperatoria en la DPC por ADCP se sitúa entre el 2,9 y el 7,7% en la literatura, sin diferencias entre DPC y DPC con resección venosa13,15,16. Al contrario, un reciente metaanálisis de 3.582 DPC (7,8% con resección venosa, n = 281), registró una mayor tasa de mortalidad a los 30 días para la DPC con resección VMS/VP, en comparación con DPC estándar: 5,7 frente a 2,9%, respectivamente (p=0,008); también se informó de una mayor tasa global de morbilidad: 39,9 versus 33,3%, respectivamente (p=0,02)17.
En nuestra serie hemos utilizado la CRTNA en pacientes con lesiones borderline y quimioterapia adyuvante basada en gemcitabina, según lo descrito en la literatura9,20. Reportamos una SG a 3 años en el grupo RVP+ del 43%, frente a un 35% en el grupo RVP− (p=0,7) (fig. 1). La SG a 5 años es igualmente superior en el grupo RVP+ (43%) respecto al grupo RVP− (29%). Aunque esta diferencia de supervivencia no sea significativa, este aumento relativo de SG podría ser un reflejo de la mayor proporción de pacientes que reciben quimioterapia adyuvante en el grupo RVP+. Aunque sin diferencias significativas, solo el 82% de los pacientes en el grupo RVP− recibe tratamiento adyuvante, contra el 100% de los enfermos RVP+. Sin embargo la quimioterapia adyuvante en nuestra serie es un factor determinante de SG, aunque sin efecto en la SLE (fig. 2).
La SLE a 3 años en el grupo RVP+ fue del 28%, comparado con el 25% en el grupo RVP− (p=0,84) (fig. 1). Estos datos están en consonancia con datos recientes para esta enfermedad16. No se han realizado todavía ensayos controlados aleatorizados para evaluar los beneficios de la CRTNA frente a cirugía en el cáncer de páncreas borderline. No obstante, estudios retrospectivos han demostrado la eficacia de CRTNA en este contexto en términos de 1) aumento de la resecabilidad, 2) ahorro de cirugía innecesaria en caso de progresión durante el tratamiento y 3) retraso del tratamiento adyuvante a causa de las complicaciones28–31. El factor de riesgo principal relacionado de forma independiente con la supervivencia en nuestra serie es la falta de tratamiento adyuvante, dato que confirma el papel esencial de la quimioterapia en el tratamiento del ADCP5,9,32. La resección R1 se asoció con una menor supervivencia y un mayor riesgo de recurrencia; la resección completa es el factor determinante para el pronóstico de esta enfermedad y la única posibilidad de cura2,4,6,9,11,22,32. Encontramos un nivel de CA 19.9 con significativo valor pronóstico: un nivel preoperatorio del marcador superior a 170 U/ml se asocia con un mayor riesgo de recurrencia y menor supervivencia. Otros estudios identificaron un nivel sérico de CA 19.9 superior a 370 U/ml como factor pronóstico para cualquier estadio de ADCP y también como marcador de respuesta a la quimioterapia33,34.
La principal limitación de este estudio es el tamaño de la muestra estudiada y su naturaleza retrospectiva. Los resultados descritos tiene que ser interpretados con precaución. A pesar de que el número de pacientes de este estudio es limitado, demostramos la seguridad de la DPC con resección venosa en el ADCP en un centro español de tercer nivel. Los resultados de nuestra experiencia inicial demuestran la importancia de un enfoque multidisciplinar en una enfermedad oncológica compleja, y la necesidad de elaborar una estrategia multimodal para garantizar al paciente una mayor supervivencia. En nuestra experiencia la SG y la SLE de la DPC con resección venosa es comparable con la DPC estándar en pacientes seleccionados. Por esta razón, en caso de invasión del eje VMS/VP, la resección vascular se debe siempre considerar en ausencia de otras contraindicaciones, con la condición de poder realizar una resección tumoral completa.
Autoría/colaboradoresFilippo Landi: Diseño, adquisición, recogida e interpretación de datos, redacción del artículo. Revisión crítica y aprobación de la versión final.
Cristina Dopazo: Diseño, adquisición, recogida y análisis de datos. Revisión crítica y aprobación de la versión final.
Gonzalo Sapisochin: Recogida e interpretación de datos. Revisión crítica y aprobación de la versión final.
Marc Beisani: Recogida e interpretación de datos. Revisión crítica y aprobación de la versión final.
Laia Blanco: Recogida e interpretación de datos. Revisión crítica y aprobación de la versión final.
Mireia Caralt: Recogida e interpretacio¿n de datos, Revision crıtica y aprobacion de la version final.
Joaquim Balsells: Diseño, adquisición, interpretación de datos, redacción del artículo. Revisión crítica y aprobación de la versión final.
Ramón Charco: Diseño, interpretación de datos. Revisión crítica y aprobación de la versión final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los resultados de esta serie fueron presentados en parte como comunicación oral en el 29° Congreso Nacional Español de Cirugía. Asociación Española de Cirujanos, AEC, celebrado en Madrid (España) del 12 al 15 de noviembre de 2012.