La radioterapia preoperatoria corta (RTC) para el tratamiento del cáncer de recto (CR) ha sido poco utilizada en España. El objetivo del presente trabajo es describir los resultados oncológicos tras tratamiento con RTC y cirugía por CR.
MétodosEstudio retrospectivo que incluye una serie consecutiva de pacientes tratados por CR (1999-2012). Se recogieron datos epidemiológicos, estadificación, complicaciones de la RTC, intervalo RTC-cirugía, abordaje quirúrgico, tasa de dehiscencia de anastomosis o herida perineal e histológicos (grado de regresión y estadificación). Se analizan la supervivencia global, supervivencia libre de enfermedad, tasa de recurrencia local e incidencia de toxicidad, respuesta y complicaciones del tratamiento combinado con RTC y cirugía.
ResultadosDe 1.229 pacientes tratados, 209 pacientes recibieron RTC y cirugía. La mediana de seguimiento fue de 6,2 años. La edad media fue de 68 años y el 66% fueron hombres. El 88% eran cT3-4 y el 44% cN+. Un total de 17 pacientes (8,1%) tenían metástasis síncronas resecables. La toxicidad aguda y crónica por RTC fue inferior al 5%. En el 75% de los pacientes el intervalo RTC-cirugía fue inferior a 15 días y en el 9%, superior a 4 semanas. Fueron 7 los pacientes (3,3%) que presentaron respuesta completa. La mediana de supervivencia fue de casi 10 años. Nueve (4,3%) pacientes presentaron una recurrencia local. La supervivencia global a 5, 10 y 15 años fue del 67,8, 49,2 y 37,5%, respectivamente. La supervivencia libre de enfermedad a 5, 10 y 15 años fue del 66,1; 47,1 y 33%, respectivamente.
ConclusionesLos resultados se comparan favorablemente con las series históricas multicéntricas. La RTC ofrece ciertas ventajas que pueden ampliarse incrementando el intervalo RTC-cirugía o si se intercala con quimioterapia secuencial.
Short-term radiotherapy (STR) for rectal cancer (RC) has rarely been used in Spain. The aim of the present study is to describe oncological results after RTC and surgery for RC.
MethodsThis is a retrospective analysis of a consecutive series of patients treated with STR and surgery for RC (1999-2012). Epidemiological data, staging, complications of STR, STR-surgery interval, surgical approach, rate of anastomotic/perineal wound dehiscence, and pathological data (regression degree and staging) were collected. Global survival, disease free survival, local recurrence rate and incidence of toxicity, response and complications of combined treatment are reported.
ResultsOf 1229 patients treated, 209 patients received STR and surgery. The median follow-up was 6.2 years. Mean age was 68 years and 66% of the patients were men. A total of 88% were cT3-4 and 44% cN+17 (8.1%) patients had resectable synchronous metastases. Acute and chronic toxicity due to STR was <5%. In 75% of the cases the STR-surgery interval was <15 days, and in 9%> 4 weeks. Seven patients (3.3%) presented complete response. Nine (4.3%) patients presented an local recurrence rate. Global survival at 5, 10 and 15 years was 67.8, 49.2 and 37.5%, respectively. Disease free survival at 5, 10 and 15 years was 66.1, 47.1 and 33%, respectively.
ConclusionsThe results compare favorably with multicentric historical series. STR offers certain advantages that could be increased by increasing the STR-surgery interval and/or interspersed with sequential chemotherapy.
La estrategia preferida para el tratamiento del cáncer de recto hoy día es un enfoque multidisciplinario que puede incluir una combinación de cirugía, radioterapia (RT) y quimioterapia (QT)1. La variabilidad en la técnica quirúrgica, un fenómeno bien documentado, afecta significativamente el resultado del cáncer rectal, en particular a las tasas de recurrencia local. La adopción de la escisión mesorrectal total (EMT) circunferencial ha reducido las tasas de recaída pélvica; por otra parte, varios ensayos multicéntricos de finales de los años 90 y principio del siglo XXI demostraron que la RT preoperatoria reduce aún más las tasas de recurrencia local, incluso en pacientes con ETM2,3.
El efecto biológico de la RT, así como el riesgo de efectos adversos agudos o tardíos, está relacionado con la dosis, volumen de blanco, fraccionamiento, energía de haz o arreglos de portal utilizados para su administración. Esto hace que la RT pueda utilizarse con varios fines en el contexto del tratamiento del cáncer de recto.
Hay 2 formas mayoritarias de utilizar la RT para el cáncer de recto resecable: la RT corta (RTC) y la quimiorradioterapia larga (QRT). La RTC administra 25Gy de manera acelerada e hipofraccionada de 5Gy en 5 días (siguiendo una fórmula cuadrática lineal, este esquema equivale a una dosis de 42Gy administrada en 21 fracciones de 2Gy4). Con la QRT se administran 50,4Gy hiperfraccionadas en 1,8Gy en 28 sesiones, concurrentemente con QT radiosensibilizante.
Ambos abordajes han evolucionado de manera paralela: la RTC se desarrolló principalmente en Escandinavia, Holanda y Gran Bretaña, mientras que la QRT se adoptó en Estados Unidos y en el centro y sur de Europa, sobre todo tras el estudio alemán CAO/ARO/AIO-945. Hay 2ensayos clínicos aleatorizados que comparan la RTC con la QRT6,7 y, aunque con matices, en ninguno se observaron diferencias significativas relativas a la frecuencia de recurrencia local, metástasis o supervivencia.
Existe poca información sobre el uso y resultados de la RTC en España, donde de manera mayoritaria se emplea la QRT.
El principal objetivo del presente trabajo es analizar retrospectivamente la supervivencia global (SG) y libre de enfermedad (SLE), así como de la tasa bruta y actuarial de recurrencia locorregional y metástasis a largo plazo en una serie unicéntrica de pacientes con cáncer de recto tratados mediante RTC y cirugía radical. La tasa y tipo de complicaciones agudas y crónicas de la RTC, el grado de regresión o respuesta tumoral a la RTC y la tasa de dehiscencia anastomótica o de la herida perineal constituyen los objetivos secundarios.
MétodosEstudio observacional para cuya realización se han seguido las recomendaciones STROBE.
Se analizan de manera retrospectiva los datos introducidos prospectivamente en una base de datos específica de RTC diseñada y mantenida por el Servicio de Radioterapia del hospital durante el periodo que abarca del 1 de enero de 1999 al 31 de diciembre de 2012, que se complementan con otros datos obtenidos restrospectivamente de la base del registro de tumores del hospital y del registro de la Sección de Cirugía Colorrectal que participa en el proyecto «Vikingo».
Todos los pacientes estudiados tenían confirmación histológica de adenocarcinoma de recto previamente al tratamiento. Se consideró rectal cuando el borde inferior del tumor se situaba a menos de 15cm del margen anal (medido por rectoscopia rígida) o debajo de la unión S1-S2 (imagen lateral del enema o resonancia magnética [RM]).
De 1999 a 2006 los pacientes fueron valorados en sesión clínica conjunta de tumores digestivos entre cirujanos y oncólogos. A partir de 2007 los pacientes fueron valorados por un equipo multidisciplinario específico de cáncer colorrectal que se creó a tal efecto.
Para la evaluación y estadificación preoperatoria, además de la colonoscopia y, eventualmente, de un enema opaco, se determinaron el antígeno carcinoma embrionario (CEA), una radiografía de tórax, una tomografía computarizada (TC) abdominopélvica y una ecografía endorrectal o RM pélvica. De manera paulatina, pero definitiva, a partir de 2007, se dejó de utilizar el enema, la TC pasó a ser toracoabdominopélvica y la RM de alta resolución, con informe protocolizado, pasó a ser utilizada en todos los casos, dejando la ecografía endorrectal solo para tumores aparentemente iniciales o superficiales.
Entre 1999 y 2006 se indicó RTC para aquellos tumores clasificados desde el unto de vista clínico (por tacto rectal o por ecografía/TC/RM) como localmente avanzados y con una cirugía clara y definida antes de la RT, bien mediante resección anterior baja, bien amputación abdominoperineal. A partir de 2006, y de manera progresiva, se reservó la RTC para tumores de recto superior avanzado, para tumores de recto medio igualmente avanzados pero sin fascia mesorrectal amenazada o para pacientes no susceptibles de QT y, ocasionalmente, para tumores en el recto inferior con infiltración de estructuras adyacentes. Así mismo, se indicó la RTC intercalada en la estrategia «curativa» de pacientes con metástasis hepáticas y en casos individuales acordados por el equipo multidisciplinario.
La RTC se administró conformada en 3D, mediante un haz posterior y 2laterodorsales, con el paciente en posición prono. El volumen-diana terapéutico incluyó toda la parte dorsal de la cavidad pélvica, desde L4 hasta 3cm por debajo del límite caudal del tumor (dependiendo de la altura del tumor), incluyendo en los márgenes laterales las cadenas ilíacas internas y los obturadores.
La cirugía se programó entre 2 y 15 días tras la finalización de la RTC, con variaciones relativas a condicionantes organizativos asistenciales o fisiológicas de los pacientes; en otras ocasiones se retrasó intencionadamente y por diversos motivos (administrativos, por enfermedad intercurrente, por optimización preoperatoria, etc.) la intervención más allá de 4 semanas (RTC «delayed» o retardada). La cirugía se realizó con extirpación parcial o total del mesorrecto en función de la altura del tumor.
De la RTC se recogieron las complicaciones agudas (gastrointestinales, urinarias y dérmicas) y tardías (dolor pélvico o estenosis-fistulización intestinal) según la definición de SOMA/LENT, de la escala de toxicidad de la RTOG y la EORTC8.
Se registraron los datos relativos al tipo de cirugía, vía de abordaje, realización o no de estoma de protección y la existencia de dehiscencia anastomótica clínica, o de la herida perineal en caso de amputación abdominoperineal, durante el postoperatorio. Así mismo, se registró el número de pacientes que recibieron QT postoperatoria y el número de ciclos.
Las variables anatomopatológicas analizadas fueron el grado de diferenciación tumoral, la extensión circunferencial del tumor, la afectación del margen radial circunferencial (MRC) (considerándose como afecto cuando el tumor está a menos de 1mm de la fascia mesorrectal), la afectación del margen distal al tumor, el infiltrado linfático, vascular o perineural, el número de ganglios resecados o afectados, así como el grado de regresión de Mandard. El grado de regresión de Mandard no se recogió en los años comprendidos entre 1999 y 2004, por lo que se recuperaron las laminillas para ser revisadas por 2anatomopatólogos dedicados de forma especial a las dolencias digestivas.
El seguimiento de los pacientes en consultas externas se realizó mediante visitas periódicas (cada 3-4 meses los 2 primeros años, cada 6 meses hasta los 5 años y anualmente después) y con revisión de pruebas de imagen y marcadores tumorales.
En ausencia de biopsia, se consideraron recidiva locorregional las imágenes de nueva aparición o sugestivas de recurrencia, y la recidiva a distancia, como tumor en cualquier otra área, incluida la región inguinal, ganglionar ilíaca y retroperitoneal.
Para el análisis de SG y SLE se ha revisado el programa informático de asistencia integrada de esta comunidad, que permite rastrear la fecha de última visita en la consulta de Oncología Médica, Oncología Radioterápica, Sección de Cirugía Colorrectal o de contacto en cualquier centro sanitario, consulta de atención especializada o primaria. Se han recogido las recidivas locorregionales, a distancia y las combinaciones de ellas.
Análisis estadísticoLos análisis se realizaron utilizando el paquete estadístico STATA versión 14.0. Se describen las variables mediante el estadístico más apropiado para la naturaleza y escala de medición de cada una: media y desviación estándar (o mediana y rango intercuartil) para variables cuantitativas y frecuencias absolutas y relativas en porcentaje para variables cualitativas. Para estimar la curva de supervivencia se empleó el procedimiento de Kaplan-Meier.
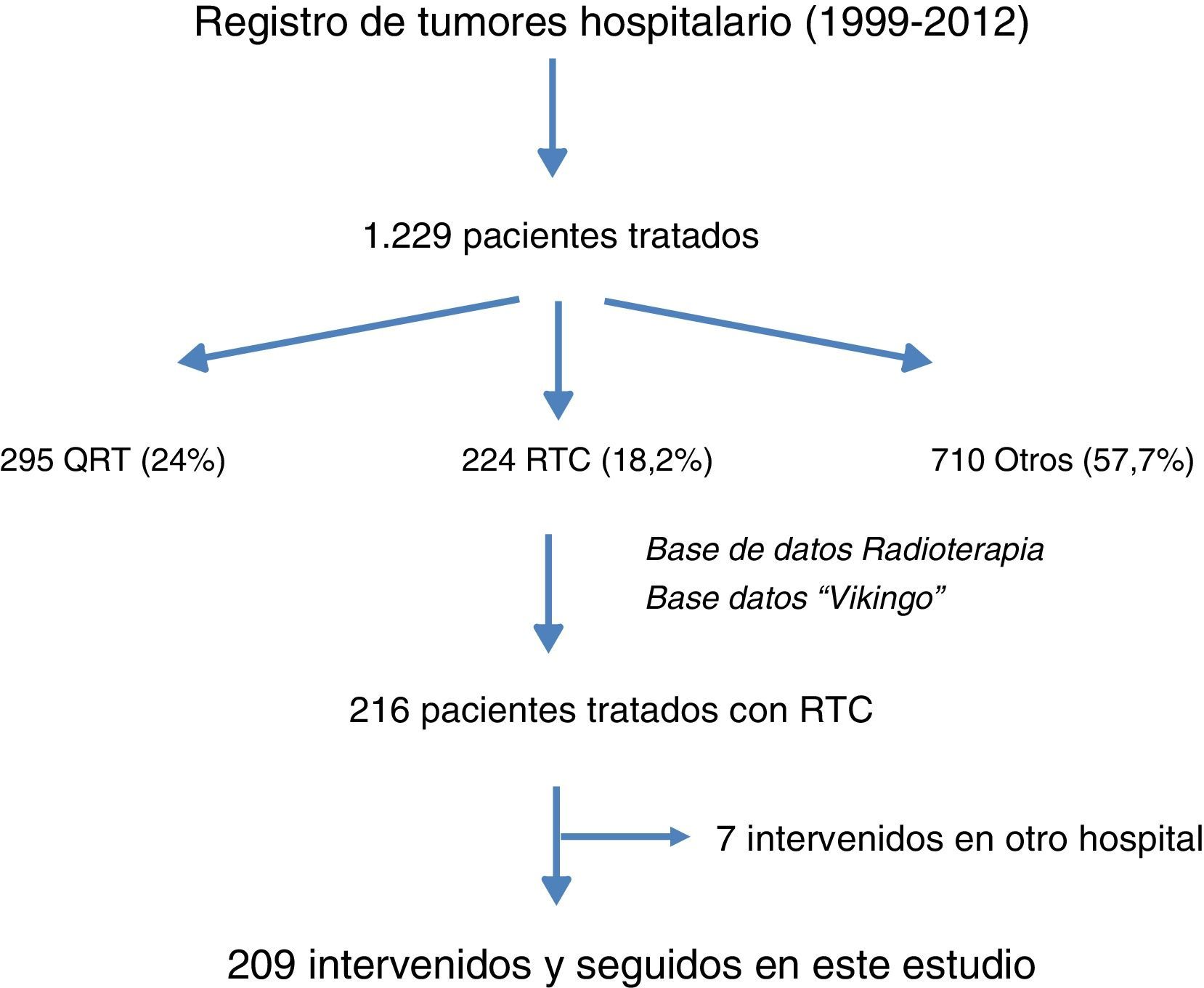
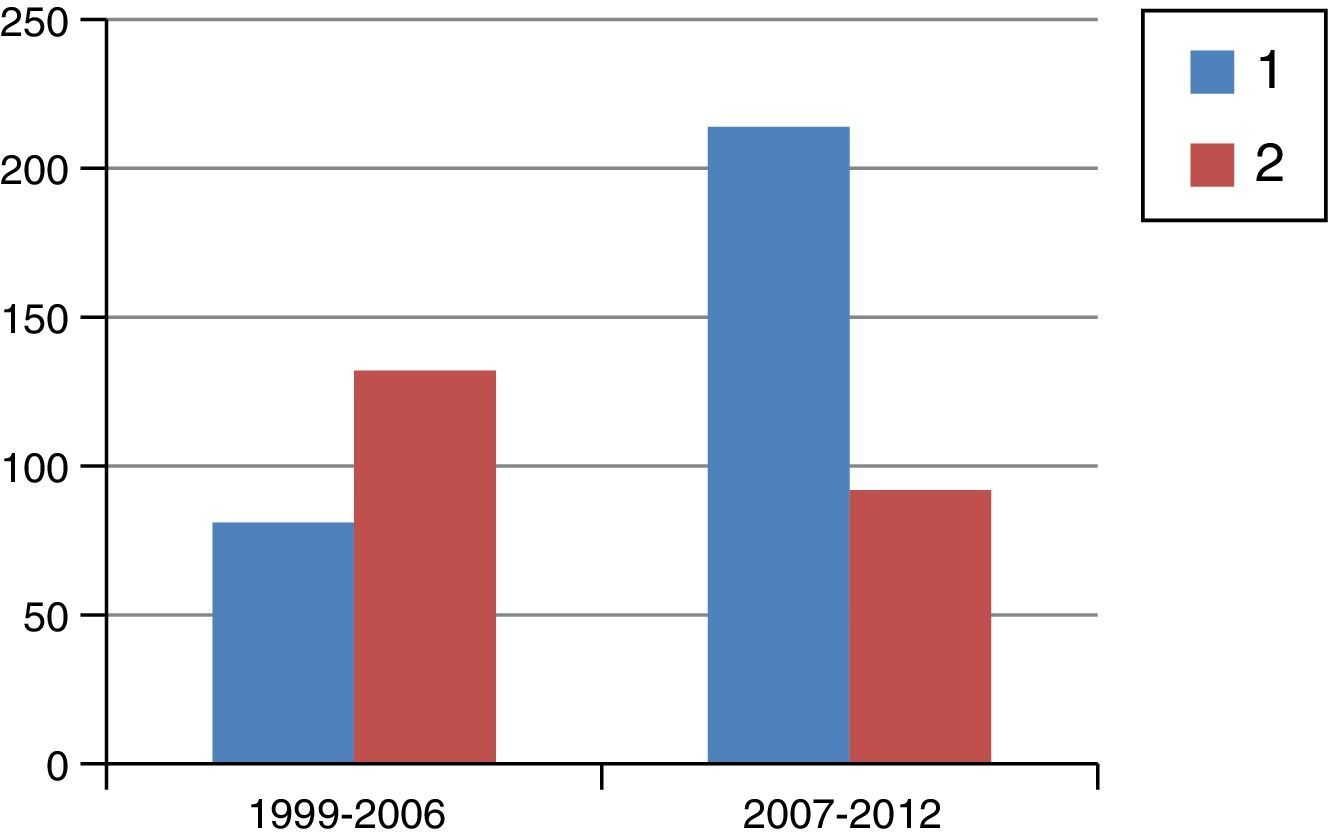
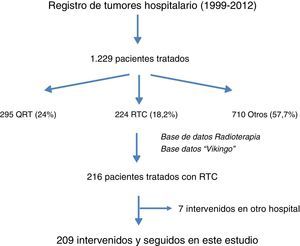
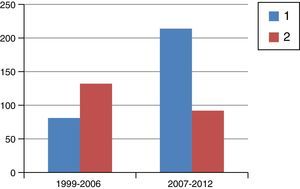
ResultadosEn la figura 1 se muestra el diagrama de flujo de pacientes objeto de este estudio. Entre 1999 y 2012 se trató a 1.229 pacientes con cáncer de recto en este hospital, de los cuales 209 recibieron RTC neoadyuvante y cirugía posterior. En la figura 2 se muestra el porcentaje de pacientes tratados con QRT y RTC en los periodos de tiempo señalados. Entre 1999 y 2006 el 61% recibió RTC; entre 2007 y 2012 el 30% recibió RTC.
Número de pacientes tratados con quimiorradioterapia de ciclo largo (1, azul) y radioterapia de ciclo corto (2, rojo) en los periodos de tiempo señalados. El porcentaje de pacientes que recibieron radioterapia de ciclo corto fue del 61% en el primer periodo y disminuyó al 30% en el segundo periodo.
En la tabla 1 se muestran los datos epidemiológicos y clínicos de la serie. De estos 209 pacientes, 138 (66%) eran varones. La edad media fue de 68 años (40-88). De los 209 casos, 17 (8,1%) presentaban metástasis hepáticas síncronas potencialmente resecables (cM1). El tumor afectaba al recto medio en la mayoría de los casos (60,2%). De los 135 pacientes que tuvieron una estadificación pretratamiento por RMN pélvica, el 88% eran rmT3-4 y el 44% tenían presencia de ganglios sospechosos por infiltración tumoral. El 40,7% presentaba cifras de CEA>5mcg/l.
Características epidemiológicas y clínicas de los pacientes
| Edad (n=209) |
| Edad media: 68 años (rango: 40-88) |
| Sexo (n=209) |
| 138 varones (66%) |
| Localización del tumor n (%) |
| 1/3 superior 43 (20,5) |
| 1/3 medio 126 (60,2) |
| 1/3 inferior 40 (19,1) |
| CEA preoperatorio (n=172) n (%) |
| < 5 mcg/l 102 (59,3) |
| > 0=5 mcg/l 70 (40,7) |
| Categoría cT (n=135) n (%) |
| cT2 15 (11,1) |
| cT3 113 (83,7) |
| cT4 5 (3,7) |
| No valorable 2 (1,5) |
| Categoría cN (n=144) n (%) |
| cN+ 64 (44) |
| cN- 74 (51,3) |
| No valorable 6 (4,1) |
| Categoría cM (n=209) n (%) |
| M1 17 (8,1) |
| M0 192 (91,8) |
Se muestra la categoría cT y obtenida por resonancia magnética; en la categoría cN se muestran los datos obtenidos por resonancia magnética, ecografía transrectal o tomografía computarizada.
En la tabla 2 se muestran los datos relativos a la toxicidad de la RTC, así como los datos referidos al tipo de cirugía, abordaje quirúrgico e incidencia de dehiscencia anastomótica o de la herida perineal. Las complicaciones gastrointestinales, urinarias o dérmicas de la RTC fueron poco frecuentes (el 80% se clasificaron como G0 de la RTOG/EORTC) y el dolor crónico persistente ocurrió en un 5,5% de los pacientes; en un solo caso (con RCT «delayed») se registró una estenosis ileal (0,6%). El intervalo de tiempo entre el fin de la RTC y la cirugía fue inferior a 2 semanas en el 74,1%, y en el 9% el lapso fue superior a 5 semanas («delayed»).
Complicaciones de la RTC, cirugía practicada, dehiscencia de anastomosis o herida perineal y tasa de quimioterapia adyuvante (1999-2012)
| Complicaciones agudas RTC (n=165) n (%) |
| Gastrointestinales G0 134 (81,2) |
| G1 12 (7,3) |
| G2 18 (10,9) |
| G4 1 (0,6) |
| Dermatitis 4 (2,4) |
| Polaquiuria/disuria 7 (4,2) |
| Complicaciones tardías RTC (n=163) n (%) |
| Dolor 9 (5,5) |
| Ileítis/estenosis ileal 1 (0,6) |
| Intervalo de tiempo RTC-cirugía (n=209) n (%) |
| Menos de 15 días 155 (74,1) |
| Entre 15 y 30 días 35 (16,7) |
| Más de 4 semanas 19 (9,2) |
| Tipo de cirugía (n=209) n (%) |
| Resección y anastomosis 162 (77,5) |
| Amputación abdominoperineal 36 (17,2) |
| Exenteración pélvica total 4 (1,9) |
| Intervención de Hartman 4 (1,9) |
| Resección local 3 (1,4) |
| Vía de abordaje quirúrgico (n=200) n (%) |
| Laparotomía 96 (48) |
| Laparoscopia 104 (52) |
| Ostomías derivativa/definitiva (n=209) n (%) |
| Ileostomía temporal 86 (51,8) |
| Sin ileostomía temporal 80 (48,7) |
| Colostomía definitiva 43 (20,6) |
| Dehiscencia anastomótica (n=163) 7 (4,2%) |
| Dehiscencia de herida perineal (n=36) 9 (25%) |
| Quimioterapia adyuvante (n=209) n (%) |
| Recibieron QT 111 (53) |
| No recibieron QT 98 (46,8) |
QT: quimioterapia; RTC: radioterapia de ciclo corto.
En el 79,4% de los pacientes se realizó una preservación esfinteriana y el 20,6% tuvieron una colostomía definitiva. Al 51,8% de los pacientes con cirugía reconstructiva se les practicó una ileostomía derivativa. El índice de dehiscencia clínica anastomótica y de la herida perineal fue del 4,2 y 25%, respectivamente. El 53% de la serie recibió QT adyuvante posterior.
En la tabla 3 se presentan los datos relativos a la anatomía patológica. El 70% presentaban ypT3-4 y el 37,7% tenían ypN+. La mediana de ganglios resecados en las piezas quirúrgicas fue de 12,2 (4-37). En 7 pacientes (3,6%) se observó un Mandard grado 1 o respuesta patológica completa (pCR) y en 110 pacientes (62,2%) la respuesta fue escasa o nula (Mandard 4-5). De los 7 casos con ypT0, ypN0, 5 habían tenido RTC retardada, pero en 2casos se observó respuesta patológica completa a las 2 semanas del fin de la RCT. El 8,1 y el 1,9% tenían, respectivamente, el MRC y el margen distal afectados por tumor.
Datos anatomopatológicos: histología y grado de regresión pos-RTC
| Infiltración de la pared intestinal (pT) (n=209) n (%) |
| T0 7 (3,3) |
| T1 8 (3,8) |
| T2 49 (23,4) |
| T3 138 (66) |
| T4 7 (3,3) |
| Número de ganglios aislados (n=207) |
| Mediana (rango) 12,2 (4-37) |
| Ganglios afectos (pN) (n=207) n (%) |
| pN0 129 (62,3) |
| pN1 44 (21,2) |
| pN2 34 (16,4) |
| Grado de diferenciación (n=197) n (%) |
| G I 88 (44,6) |
| G II 100 (50,7) |
| G III 9 (4,5) |
| Afectación circunferencial por tumor (n = 137) n (%) |
| Un tercio 53 (38,7) |
| Dos tercios 46 (33,6) |
| Tres tercios 38 (27,7) |
| Margen radial circunferencial (n=185) n (%) |
| No afectado 170 (91,8) |
| Afectado 15 (8,1) |
| Margen distal del tumor (n=204) n (%) |
| No afectado 200 (98,0) |
| Afectado 4 (2,0) |
| Infiltrado linfovascular-perineural (n = 35) n (%) |
| No 26 (80) |
| Sí 7 (20) |
| Grado de regresión de Mandard (n=194) n (%) |
| Ausencia de tumor (Mandard 1) 7 (3,3) |
| Presencia de células tumorales aisladas (grado 2) 10 (5,1) |
| Presencia de fibrosis y células tumorales (grado 3) 57 (29,5) |
| Presencia mayor de tumor (Mandard 4 y 5) 120 (62,1) |
No se produjeron pérdidas en el seguimiento. Con una mediana de seguimiento de 6 años (3 meses-16 años) un total de 9 pacientes (4,3%) tuvieron una recidiva locorregional, 55 pacientes (26,3%) una recidiva a distancia y 6 pacientes (2,9%) presentaron recidivas combinadas, locorregional y a distancia. En el momento del análisis (noviembre de 2016), 107 pacientes estaban vivos (51,1%), 7 (3,3%) con enfermedad, y 102 habían fallecido (48,8%), 51 (24,4%) por la enfermedad.
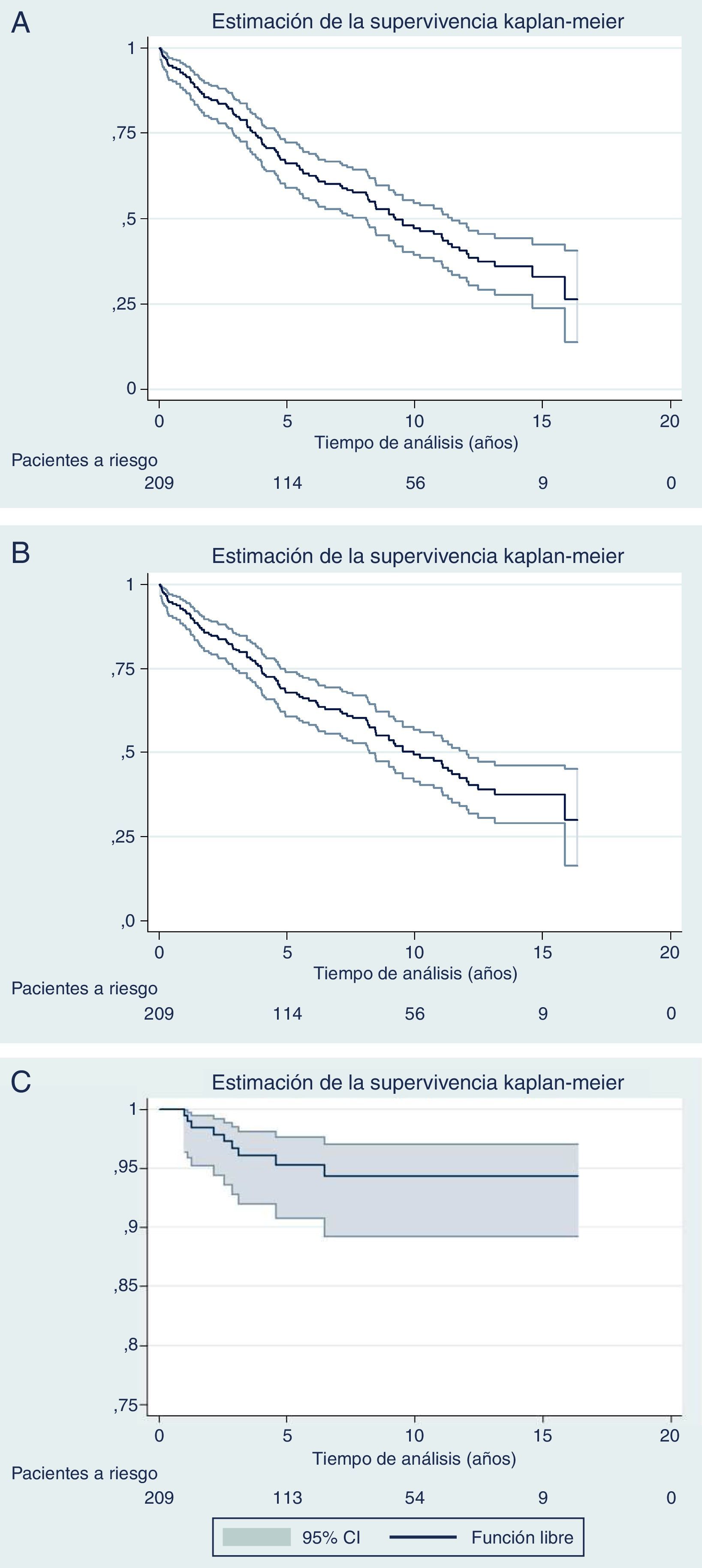
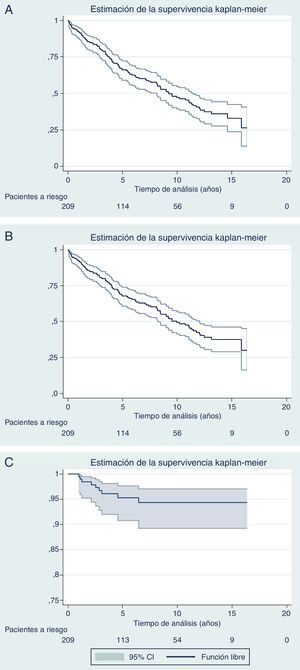
La figura 3 muestra las curvas de SG, SLE y recidiva local de Kaplan-Meier. La mediana de supervivencia es de casi 10 años. La SG a 5 años ha sido de un 67,8%, a 10 años del 49,2% y a los 15 años del 37,5%. La SLE a 5 años fue del 66,1%, a 10 años del 47,1% y a los 15 años del 33%. La tasa de recurrencia local a 5 años fue de 4,7% (IC 95%: 2,4-8,2).
DiscusiónCon una mediana de seguimiento superior a 6 años, la tasa actuarial de recurrencia local a 5 años del 4,7% obtenida en la presente serie es similar a las publicadas en ensayos multicéntricos2,3, con una mediana de supervivencia de casi 10 años y una SG (68, 50 y 38% a los 5, 10 y 15 años, respectivamente) y una SLE algo superior (66, 47 y 33% a los 5, 10 y 15 años, respectivamente). No obstante, el presente estudio abarca 13 años, durante los cuales hemos introducido modificaciones relativas al manejo del cáncer de recto, entre ellas, las indicaciones de la RT (RTC vs. QRT), reflejo del progreso y evolución del conocimiento en esta entidad.
A partir de 2007 comenzamos a basar las decisiones terapéuticas en las imágenes de la RMN preoperatoria. El estudio multicéntrico MERCURY demostró que la medida del crecimiento transmural por RMN era equivalente a su medida anatomopatológica en la pieza quirúrgica, además de identificar la invasión venosa extramural y el riesgo de afectación del MRC (< 1mm)9. Por otra parte, conocida la capacidad de la QRT para reducir el tamaño y degradar el estadio clínico del tumor, empezó a valorarse la respuesta a la QRT como un importante factor pronóstico. De esta manera, a partir de 2007, y con el objetivo puesto en el MRC, empezamos a indicar la QRT con mayor frecuencia que la RTC, como puede verse en la figura 2, que muestra la evolución de ambas modalidades de RT en nuestra práctica. Probablemente debido a la exclusión de casos con MRC amenazado para la RTC, a partir de esa fecha y con la realización de exenteraciones pelvianas en casos de MRC invadido, obtuvimos una tasa de afectación histológica del MRC de 8,1%, la mitad que en el estudio holandés2,10.
La RTC seguida de cirugía inmediata (dentro de la semana posterior a finalizarla) no deja intervalo para que se exprese la reacción del tejido pélvico a la radiación, lo que, unido a la ausencia de QT concomitante, hace que la frecuencia de toxicidades agudas por la administración de RTC sea muy escasa11,12. Las complicaciones observadas (<5%) consistieron principalmente en disuria o polaquiuria; las toxicidades dérmicas y gastrointestinales fueron infrecuentes y, en todo caso, asociadas al mayor intervalo entre la RT y la cirugía. Por lo tanto, y como cabe esperar, el cumplimiento del tratamiento por los pacientes fue completo.
La incidencia de dehiscencia anastomótica clínica y de la herida perineal fue del 4,2% (>50% de los casos con ileostomía derivativa) y del 25%, respectivamente. El efecto de la RT (larga o corta) sobre el índice de dehiscencia o la fístula anastomótica es controvertido. En los ensayos clínicos holandés o sueco no se encontraron diferencias relativas a la dehiscencia anastomótica entre los pacientes con cirugía sola y los pacientes con RTC2,3. No obstante, el aumento de dehiscencia de la herida perineal tras la RTC es un dato bien documentado, sobre todo cuando el intervalo RTC-cirugía es superior a 3 días o no se realiza una RTC retardada2,4,12. El efecto deletéreo de la RT sobre la función genitourinaria o gastrointestinal es bien conocido, pero no se estudió específicamente en el presente estudio. Sin embargo, no parecen existir diferencias importantes en este sentido entre la RTC y la QRT13,14.
La respuesta histológica a la RTC comienza a poder observarse a partir de los 10 días de finalizarla13,15. En el 75% de nuestros pacientes el lapso RT-cirugía fue menor de 15 días y, consecuentemente, en las piezas estudiadas predominó la ausencia de regresión tumoral (grado 4 y 5 de Mandard). No obstante, en 7 pacientes (3,3% del total de la serie) se observó una ypCR tras la RTC; en 5 de estos casos el intervalo RCT-cirugía fue superior a 4 semanas, lo que hace que el 9,5% de los casos con un intervalo superior a 4 semanas tuviera una ypCR. Estas cifras son similares a las obtenidas en el estudio Stockholm III15, que examinó el efecto del incremento del intervalo entre la RTC y la cirugía. En un ensayo clínico que compara el «downstaging» alcanzado por la QRT y la RTC retardada se ha puesto de manifiesto que el intervalo que permitiría la máxima respuesta a la RTC sería de 10-12 semanas16.
A diferencia de la QRT y RTC retardada, la RTC de intervalo mínimo permite valorar la histología de la pieza con mínimas alteraciones o sin ellas, lo que facilitaría la decisión de administrar QT adyuvante4,11,13. En la serie presentada, el 54% de los pacientes recibieron QT adyuvante, lo que contrasta con la indicación prácticamente sistemática cuando se realiza QRT.
Las 2razones tradicionales para no recomendar la RTC han sido: a) la ausencia de «downstaging», por lo que no facilitaría la preservación esfinteriana y no reduciría la tasa de MRC afecto y b) la imposibilidad (por toxicidad) de administrar QT simultánea o concurrentemente.
En nuestra serie el porcentaje de cirugía reconstructiva fue de casi un 80%, si bien, y sobre todo desde 2007, la mayoría de nuestros pacientes con cáncer avanzado de recto inferior recibieron QRT. Es cierto que en las series holandesa y suecas el porcentaje de preservación esfinteriana fue comparativamente bajo. No obstante, con un intervalo entre la RTC-cirugía de 4-8 semanas en el Stockholm III se consigue una cifra similar de cirugía preservadora de esfínteres15. En todo caso, en el ensayo polaco que compara la RTC con la QRT no se observaron diferencias en la preservación esfinteriana entre ambos grupos6.
Por tanto, el «downstaging» y la reducción tumoral per se no son tan importantes en tumores resecables si la cirugía radical es la estrategia que se va a emplear y no otra, como sería la preservación de órgano. Cabe señalar que en este último caso incrementar el intervalo RTC-cirugía a 8-10 semanas es la estrategia que se emplea en el ensayo UK-TREK para el cáncer de recto inicial (T1-2, N0)17.
El desarrollo de una recidiva local se explica hoy por la presencia microscópica de células tumorales dentro de un centímetro del MRC y, aunque la tasa de MRC afecto histológicamente es inferior cuando se emplea QRT y RTC retardada respecto a la RTC sin intervalo, no está clara la superioridad de una de estas estrategias respecto a las otras10,13, si bien se ha mostrado que la RTC solo compensa parcialmente un MRC positivo2. Por otra parte, la QRT facilitaría la resección curativa en los casos en los que el cirujano considere que el tumor es irresecable o de resecabilidad «bordeline» (MRC afecto).
El argumento de que la RTC no permite la QT concurrente puede rebatirse señalando que la QRT estándar utiliza QT a dosis radiosensibilizante o subsistémicas y que, además, al tener mayor toxicidad, el cumplimiento de la terapia completa es menor que con la RTC. Los intentos de incrementar la quimiorradiosensibilidad añadiendo otros fármacos, como el oxaliplatino o el irinotecan, al régimen estándar de QRT, no han demostrado beneficio y sí un incremento notable de la toxicidad18.
La RTC, por otra parte, puede combinarse con QT neoadyuvante (antes) o secuencialmente (después), lo que tiene relevancia debido a que hoy son las metástasis y no la recurrencia locorregional la principal causa de fallo en el tratamiento del cáncer de recto.
La estrategia de utilizar QT secuencial en aquellos pacientes con buena respuesta inicial a la RT ha demostrado ser prometedora18. La RTC se adecúa bien a las estrategias de administrar QT secuencial y es la base del ensayo, aún en marcha, de fase III RAPIDO que utiliza RTC seguida de CAPOXx6 y cirugía radical vs. QRT y cirugía radical19.
Por otra parte, la RTC con QT secuencial y cirugía posterior es una estrategia empleada en casos de metástasis síncronas resecables, con un acortamiento del tiempo total de tratamiento, como ha demostrado el estudio del Dutch Colorectal Group20. Nosotros realizamos una estrategia similar en los 17 casos de la serie que presentaban metástasis síncronas resecables, mediante la administración de QT neoadyuvante de inducción y RTC posterior seguida de cirugía radical.
En definitiva, y de acuerdo con la bibliografía revisada, la RTC ofrece ventajas relativas a la utilización de recursos, costes, duración del tratamiento, escasa toxicidad, alto grado de cumplimiento y permite evaluar la histología sin modificar. Además, mediante el incremento del intervalo RTC-cirugía y el empleo de QT secuencial podría superar las desventajas comparativas con la QRT convencional.
Concluimos señalando que los resultados oncológicos obtenidos en la presente serie se comparan positivamente con los estudios aleatorizados multicéntricos históricos sobre la RTC, sin embargo, hemos de considerar que el trabajo presentado abarca un periodo de tiempo largo durante el cual se han implementado modificaciones en la estadificación preoperatoria y en las indicaciones relativas a la selección de QRT y RTC.
Autoría/colaboracionesY. Saralegui y C. Placer diseñaron el contenido del trabajo; M. Garmendia revisó todas las láminas de histología. M. Osorio y G. Elorza realizaron la adquisición e interpretación de los datos. J.P. Ciria y A. Lacasta analizaron los datos y realizaron revisiones críticas; J.M. Enríquez-Navascués escribió el artículo; J.P. Ciria aprobó la versión final del artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.