La siembra tumoral tras un procedimiento quirúrgico es un hallazgo infrecuente, que sucede tras la extracción de la pieza quirúrgica o la entrada y salida de instrumental a través de la herida durante la cirugía, a diferencia de la metástasis cutánea que se da por infiltración de la piel o tejidos blandos circundantes por vía linfovascular1.
La primera siembra tumoral en un herida quirúrgica realizada por laparoscopía se publicó en 1978, en una cirugía por cáncer de ovario2. Su incidencia varía entre el 0,6-1,6% y en el cáncer de pulmón entre el 1-12%, presentándose desde los 14 días a varios meses después3. El mecanismo aceptado es la siembra directa de células neoplásicas durante la cirugía.
El manejo de las siembras tumorales incluyen la cirugía, la quimioterapia y la radioterapia. El uso de dispositivos de protección cutánea transoperatorio y bolsas de extracción pueden disminuir el riesgo de esta complicación.
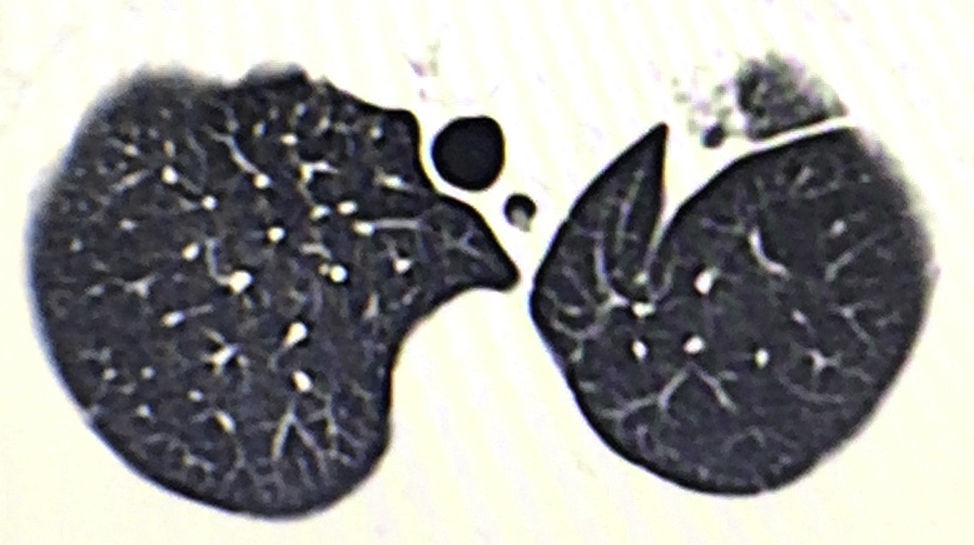
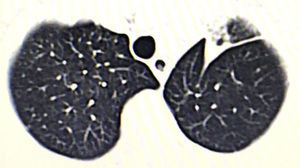
Se trata de un varón de 76 años, con un tumor en el lóbulo superior izquierdo (fig. 1). Se realizan una videotoracoscopia por 2 puertos de 15mm y 45mm en octavo y quinto espacio intercostal línea axilar anterior, respectivamente. Se realiza una culmenectomía, más linfadenectomía lóbulo específica de las estaciones ganglionares 5, 7, 10 y 11. Anatomopatológicamente se reporta una lesión de 2×2cm, umbilicada, que corresponde a un adenocarcinoma pulmonar mucoproductor con patrón predominantemente acinar (90%), ganglios con hiperplasia mixta (T1a, N0, M0; estadio IA). Tras 3 días de internamiento el paciente es dado de alta a su domicilio sin complicaciones postoperatorias y con reexpansión pulmonar del 100%.
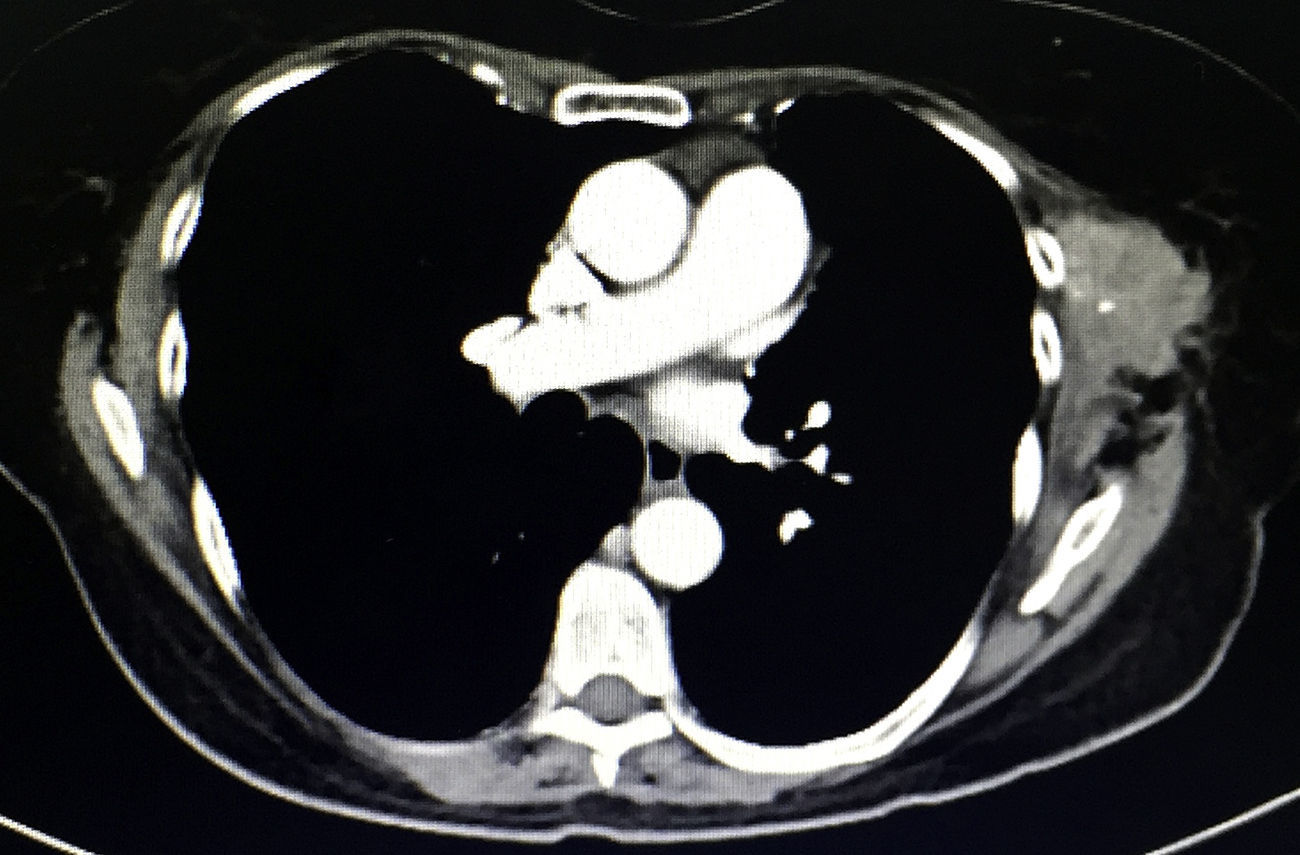
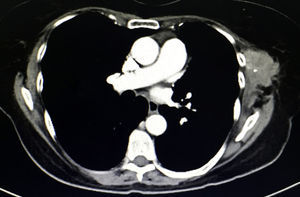
Tras 18 meses de la cirugía se detecta en la exploración física una masa palpable de 6×4cm por debajo de la cicatriz quirúrgica previa, adherida a tejido adyacente, fija y dolorosa, que a decir del paciente ha aumentado de tamaño en las últimas semanas. La TAC (fig. 2), muestra una tumoración en tejidos blandos heterogénea multilobulada en la herida quirúrgica previa.
Se reseca por completo una lesión de 6×4cm con márgenes libres de enfermedad, que infiltra el tejido celular subcutáneo y el plano muscular, que se extiende hasta los músculos intercostales, anatomopatológicamente se reporta como adenocarcinoma mucoproductor en músculo estriado, inmunohistoquímica TTF1+, CK7+ y CK20+. Tras la retirada de un drenaje subcutáneo al segundo día el paciente es dado de alta sin complicaciones al tercer día de la cirugía.
Downey et al.4, a través de una encuesta, incluyeron 55 cirujanos, para determinar siembra tumoral tras videotoracoscopia. Respondieron 48, reportándose 21 casos. El intervalo desde la cirugía a la recurrencia cutánea varió de 14 días a 29 meses (media: 7,6 meses). La incisión fue el sitio de recurrencia más frecuente (14), de estos fueron (6 adenocarcinomas, 3 de células escamosas y 5 mesoteliomas). No reporta el total de pacientes por lo que no se puede determinar la incidencia. Con relación a las técnicas para prevenir el contacto del tejido tumoral retirado con los tejidos cutáneos, tales como puertos o bolsas colectoras se utilizaron en 7 pacientes, no se utilizaron en 9, y no reportaron en 5.
Parekh et al.5, sobre 410 pacientes sometidos a videotoracoscopia por malignidad, con seguimiento del 91% de los casos, a 25 meses promedio, solo reportan un caso de siembra tumoral (0,26%). No se especifica si las piezas quirúrgicas fueron retiradas o no con bolsa colectora. Jancovici et al.6 (1996) informaron de 2 recurrencias en puerto sobre 148 procedimientos (1,4%). Un año más tarde, Swanson et al.7 (1997) informaron de 475 toracoscopias sin recurrencias en puertos de trabajo. En nuestra experiencia, es el primer caso de siembra tumoral por implantación directa en resecciones pulmonares por videotoracoscopia. El uso de bolsas colectoras para retirar la pieza está estandarizado en nuestra práctica; sin embargo, la utilización de protectores cutáneos transoperatorios no es un hábito, aspecto que debería tomarse en cuenta, ya que el momento de implantación en herida quirúrgica directa de una neoplasia, no solamente ocurre al retirar la pieza, sino también durante la manipulación de la misma y al intercambiar instrumentos por los puertos, como en nuestro caso.
Collard y Reymond8 proponen medidas preventivas: extracción utilizando un dispositivo protector, ampliación de la incisión de extracción, irrigación de la cavidad y aspiración del lavado al final del procedimiento, uso de instrumentos lisos en lugar de utilizar fórceps (disección sin contacto), entre otras. Muchas cuestiones siguen en debate, como la negatividad de los márgenes quirúrgicos de la pieza, la estadificación del tumor al momento de la resección y la frecuencia de implantes comparado con cirugía abierta.
La literatura recogida precisa de comparativa con estudios más recientes, pero dichos estudios son muy escasos.
En conclusión, la videotoracoscopia es el procedimiento de elección para el cáncer pulmonar en estadio temprano y los tumores metastásicos; por lo que deben tenerse en cuenta las ventajas, las desventajas y las posibles complicaciones; tales como, el desarrollo de siembra tumoral en el sitio quirúrgico. El uso de protectores de herida quirúrgica y la bolsa extractora son recomendables, aunque aún no se ha consensuado universalmente. Series más numerosas y con seguimiento más largo serán necesarios para normar una conducta.