Las enzimas proteolíticas han adquirido recientemente un gran interés en fisiopatología tumoral debido a su papel potencial en la degradación de los componentes principales de la matriz extracelular y membrana basal facilitando, de esa forma, la invasión tumoral y las metástasis. Las enzimas proteolíticas que son expresadas por los carcinomas humanos se agrupan en cuatro grandes familias: metaloproteinasas, aspartil-proteinasas, cisteín-proteinasas y serín-proteinasas. La expresión tumoral de la mayoría de estas enzimas ha sido asociada con un comportamiento más agresivo de los carcinomas humanos y un pronóstico desfavorable de los pacientes. Sin embargo, su expresión tumoral no siempre implica un pronóstico adverso, ya que enzimas como el activador tisular del plasminógeno, el antígeno prostático específico y el pepsinógeno C han sido asociadas con un pronóstico favorable en pacientes con cáncer de mama. Además, existen datos que sugieren que estas expresiones tumorales pueden estar rela cionadas con una vía específica de respuesta hormonal, lo que resulta demostrativo del complejo papel que pueden desempeñar las enzimas proteolíticas en la fisiopatología tumoral. Por otra parte, el resultado final de la acción de las enzimas pro teolíticas dependerá en gran medida del balance con sus inhibidores naturales, producidos por las propias células tumorales para coordinar su acción invasiva, o bien por las células estromales como mecanismo de defensa ante la progresión tumoral. Finalmente, existen datos recientes que indican que la utilización de inhibidores sintéticos de las enzimas proteolíticas puede representar una nueva y prometedora alternativa terapéutica para los carcinomas humanos.
Proteolytic enzymes have recently become a subject of great interest in the study of tumor physiopathology owing to their potential role in the degradation of the major components of the extracellular matrix and basal membrane, thus facilitating tumor invasion and metastases. The proteolytic enzymes expressed by human carcinomas are grouped into four large families: metalloproteinases, aspartyl proteinases, cysteine proteinases and serine proteinases. Expression of most of these enzymes by human carcinomas is associated with a more aggressive behavior and a poor prognosis. However, some of them, such as tissue-type plasminogen activator, prostate-specific antigen and pepsinogen C, have been associated with a favorable prognosis in breast cancer patients. In addition, there are data suggesting that their expression by tumors may be related to a specific pathway of hormone responsiveness, which would demonstrate the complex role that proteolytic enzymes may play in tumor physiopathology. On the other hand, the final results of the action of these enzymes would depend to a great extent on their equilibrium with respect to their natural inhibitors, produced either by the tumor cells themselves to coordinate their invasive action or by stromal cells as a defense mechanism against tumor progression. Finally, recent findings indicate that the utilization of synthetic inhibitors of proteolytic enzymes may represent a promising, new therapeutic alternative for human carcinomas.
Introducción
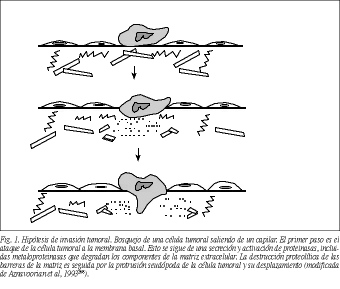
El cáncer se ha definido como una serie progresiva de alteraciones genéticas que ocurren en un único clon de células a causa de alteraciones en un número limitado de genes: los oncogenes y los genes supresores tumorales1. Sin embargo, podemos también considerar al cáncer como una forma aberrante de vida, de extraordinaria complejidad, y que no puede explicarse únicamente por lesiones genéticas aisladas2. Así, tras el proceso de transformación de la célula normal en cancerosa, la evolución secuencial de las células transformadas hacia la invasión tumoral y la metastatización implican una serie de acontecimientos celulares y moleculares relacionados con las células tumorales mismas y con la estroma adyacente al tejido lesionado3,4. De esa concepción más global del proceso canceroso, han surgido un buen número de parámetros biológicos que nos permiten conocer mejor la historia natural del cáncer. Uno de esos nuevos aspectos de la biología molecular de los carcinomas humanos son las enzimas proteolíticas que, producidas por las propias células tumorales, o bien por las de la estroma peritumoral, han adquirido en la presente década un interés especial. Esto es debido a su papel potencial en la degradación de la matriz extracelular y la membrana basal, facilitando así la invasión tumoral y las metástasis, que son aspectos absolutamente claves en la historia natural del cáncer5,6.
La matriz extracelular está compuesta de una amplia variedad de moléculas cuyos componentes principales son: fibronectina, laminina, vitronectina, colágeno tipo IV, trombospondina, elastina, ácido hialurónico, factor de von Willebrand y heparansulfato de proteoglicano. Pues bien, para cada uno de esos componentes estructurales existen enzimas degradativas específicas, pero cuya participación en el proceso tumoral es muy diversa. Así, observaciones recientes han permitido concluir que los diversos tipos de tumores utilizan distintas proteinasas o combinaciones de ellas para penetrar en el tejido adyacente y desencadenar la aparición de metástasis. Sin embargo, también hay que considerar que la degradación de la matriz extracelular y membrana basal en el contexto tumoral es, además, un proceso dinámico que depende, en buena medida, del balance entre las propias proteinasas y sus inhibidores naturales específicos. Estos últimos pueden ser producidos por las propias células tumorales con el fin de coordinar su acción invasiva, o bien por las células de la estroma tumoral con el objeto de delimitar la lesión tumoral7. A todo ello podemos añadir que las enzimas proteolíticas pueden actuar a través de otros mecanismos que también tienen importancia en la patología tumoral. Así, estas enzimas pueden estimular la proliferación y diferenciación celular, activar hormonas y factores de crecimiento, reducir la adhesividad de las células malignas, alterar la membrana celular, promover la migración celular o estimular la secreción y activación de otras proteinasas8.
En años recientes, se han multiplicado los esfuerzos de diferentes grupos de investigadores sobre el papel de las enzimas proteolíticas en la patología tumoral. Estas investigaciones han generado mucha información clínica acerca de la significación pronóstica de la expresión de estas proteínas en los carcinomas humanos y, quizá lo más importante, también han permitido abrir nuevas posibilidades para su tratamiento mediante el bloqueo o inhibición de su acción degradativa.
Las enzimas proteolíticas que están implicadas en los carcinomas humanos pertenecen a cuatro diferentes grandes familias: metaloproteinasas, aspartil-proteinasas, serín-proteinasas y cisteín-proteinasas. Además, también cabe destacar el papel de sus inhibidores naturales, cuya implicación en la fisiopatología tumoral trasciende en algunos casos, incluso, la de mera inhibición de las proteinasas.
Metaloproteinasas de la matriz extracelular
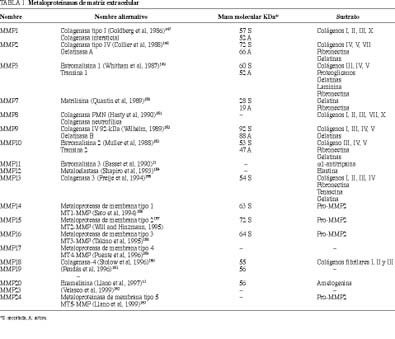
Las metaloproteinasas de la matriz extracelular (MMP) pertenecen a una familia de al menos 19 miembros que son el producto de genes relacionados entre sí9. Estas enzimas pueden ser clasificadas, de acuerdo con criterios estructurales y funcionales, en cuatro grandes familias de diferente especificidad de sustrato: colagenasas, gelatinasas, estromalisinas y metaloproteinasas de membrana (tabla 1). Además, también hay algunos miembros de la familia de MMP, como la macrófago metalo elastasa10, la estromalisina-311, la MMP-1912 y la enamelisina13, que poseen características especiales que impiden su clasificación en alguno de los citados grupos.
Todas la MMP tienen unas características comunes, incluyendo la presencia de dos átomos de cinc en el sitio activo de la molécula y un residuo característico de cisteína, esencial para el mantenimiento de su latencia enzimática14. Además, todas las MMP son secretadas como proenzimas que requieren un pH neutro para poder actuar y son inhibidas por una familia específica de proteínas, que se denominan inhibidores tisulares de MMP (TIMP)15. Las MMP están ampliamente distribuidas en el organismo humano, donde desempeñan una serie de funciones fisiológicas como la cicatrización16, la reabsorción ósea17, la involución mamaria18 y otras funciones fisiológicas asociadas al embarazo y al parto19. Además, más recientemente se ha demostrado que estas enzimas también están implica dos en multitud de variados procesos patológicos como la artritis reumatoide20, enfermedad periodontal21, la esclerosis múltiple22, las enfermedades cardiovasculares23 o ciertas alteraciones hematológicas24. El mecanismo fisiopatológico por el que las MMP y los TIMP están implicados en estos procesos es a través de una alteración del recambio de la matriz extracelular. Todos esos hallazgos han motivado un cambio sustancial en la concepción fisiopatológica de muchos de esos procesos benignos. Pero, sin duda, el aspecto que ha generado mayor interés en investigación clínica es el papel de las MMP en la fisiopatología tumoral. Esto se debe a que la expresión tumoral de estas enzimas ha sido relacionada con el potencial metastásico de las células cancerosas, ya que el proceso de invasión tumoral conlleva la degradación de determinados elementos de la membrana basal y de la estroma intersticial, como colágenos, laminina, fibronectina, tenascina, gelatinas y proteoglicanos, que son todos ellos sustrato de las MMP6.
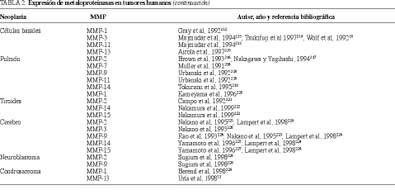
Por otra parte, un aspecto relevante de la dinámica de las MMP en la fisiopatología tumoral es que su expresión puede tener lugar no sólo en las propias células cancerosas, sino también en las células estromales peritumorales. Así, por ejemplo, se ha demostrado que el ARN y la proteína estromalisina-3 se detectan específicamente en los fibroblastos circundantes a las células neoplásicas mamarias, pero no en los fibroblastos de la glándula mamaria normal11,25. Además, diversos estudios demostraron la expresión de gelatinasa A (MMP-2), mediante estudios de inmunohistoquímica o bien de hibridación in situ, por las células tumorales en una amplia variedad de carcinomas humanos (tabla 2). Estas investigaciones parecen indicar que las células tumorales mismas son las principales productoras de gelatinasa A en los tumores malignos in vivo. Sin embargo, los estudios de hibridación in situ han señalado que el ARNm de la gelatinasa A se expresa en las células estromales adyacentes a tumores humanos de piel26, colon27 y cérvix uterino28, y no por las propias células tumorales. Se ha sugerido que esa aparente discrepancia entre los estudios de inmunotinción y de hibridación in situ puede deberse a la unión y/o interiorización en las células cancerosas de la MMP producida por los fibroblastos peritumorales29. Además, a esto podemos añadir que existen datos que indican que la producción de MMP por las células estromales peritumorales está motivada por determinadas señales bioquímicas originadas en las propias células cancerosas. En este sentido, estudios realizados en el cáncer de mama demostraron que la colagenasa-3 (MMP-13) es expresada por los fibroblastos peritumorales mediante activación por factores difusibles liberados por las células cancerosas, como la in terleucina-1 alfa y el factor transformante del crecimiento ß (TGF-ß)30,31 (fig. 2). Así pues, esto resulta indicativo de un papel relevante de la relación células tumorales-células estromales en el contexto de la progresión tumoral, que representa un nuevo paradigma con importantes implicaciones para la fisiopatología y terapia del cáncer.
Pero, independientemente del origen celular de la producción de las MMP en el marco tumoral, estudios recientes demostraron una asociación significativa entre una expresión tumoral aumentada de diferentes metaloproteinasas y un peor pronóstico de los pacientes afectados de diferentes tumores, en términos de supervivencia libre de enfermedad y de supervivencia total. Así, se ha descrito que la expresión tumoral de estromalisina-3 está asociada a un peor pronóstico en el cáncer de mama32,33 y de colon34; la colagenasa intersticial en el cáncer colorrectal35, esofágico36 y en condrosarcomas37; la gelatinasa B en el cáncer colorrectal38; la gelatinasa A en el cáncer gástrico39, de ovario40, de mama41 y de vejiga urinaria42, y la colagenasa-3 en el cáncer de mama43.
Aspartil-proteinasas
En este grupo de enzimas proteolíticas se encuentra la catepsina D (cat-D), que es una proteasa ácida lisosomal presente en todas las células a bajas concentraciones, y el pepsinógeno C (pep-C), que es una enzima proteolítica normalmente involucrada en la digestión de proteínas en el estómago y en la pro teólisis del líquido seminal en la vagina.
La cat-D se ha propuesto como un marcador de dependencia estrogénica de los tumores, como un factor de crecimiento y como una proteasa importante en la invasión tumoral. Esta propuesta se basa en estudios in vitro que demostraron que distintas líneas celulares de tumores humanos secretan activamente una forma precursora de la cat-D (pro-cat-D) que, tras autoactivación a pH ácido, puede promover la proliferación celular actuando como mitógeno autocrino, favorecer la capacidad invasiva y metastatizante de los tumores, y degradar distintos componentes de la matriz extracelular, incluyendo proteínas de adhesión44-46. Además, en ese tipo de estudios también se ha demostrado que la cat-D puede activar formas precursoras latentes de otras enzimas proteolíticas implicadas en la cascada metastásica, como la cat-B y L. Aunque no existen, en la actualidad, pruebas evidentes de que la cat-D pueda también facilitar in vivo esos procesos, distintas investigaciones clínicas aportan datos sobre una relación positiva entre los niveles de la enzima y la progresión tumoral en distintos tipos de carcinomas humanos (tabla 3), si bien no existe acuerdo total sobre el valor clínico de la expresión tumoral de la enzima en algunos carcinomas humanos como, por ejemplo, los colorrectales47,48 y mamarios49-51.
Desde el punto de vista clínico, destacan por su número y relevancia los estudios realizados sobre la significación pronóstica de la cat-D en el cáncer de mama. Diversos estudios realizados en este sentido sugieren que los valores elevados de la enzima podrían ser un factor predictivo de temprana recurrencia tumoral y muerte en las pacientes con cáncer de mama y, en especial, en aquellas con ganglios negativos52-55. Sin embargo, esos resultados tan esperanzadores de cara a identificar a mujeres con mal pronóstico y, por tanto, candidatas a alternativas terapéuticas más agresivas, contrastan con los resultados de otros estudios que no encuentran relación entre la enzima y el pronóstico de la enfermedad49-51, o que, al contrario, detectan un posible valor pronóstico favorable de los valores intratumorales elevados de cat-D en determinados subgrupos de pacientes56-58. Pero otros estudios también sugieren que la significación biológica de la cat-D puede ser diferente en función del origen celular de su producción en el contexto tumoral. Así, se ha señala-do que la expresión de la enzima por las células estromales, más que por las células tumorales mismas, puede afectar de forma importante al pronóstico del cáncer de mama59-61. No obstante, estos resultados conflictivos que se desprenden de la bibliografía acerca de la significación pronóstica de la cat-D en los carcinomas humanos hacen necesarias futuras investigaciones sobre el método más apropiado para la determinación de la enzima, y en relación con su expresión por determinados tipos celulares de la estroma tumoral.
Por otra parte, un aspecto de probable interés futuro de la cat-D en el cáncer de mama es el de su posible valor diagnóstico en esta neoplasia. Ello se basa en resultados preliminares que indican la presencia de niveles significativamente más elevados de la enzima en el fluido mamario obtenido a través del pezón de mujeres con cáncer de mama en relación con mujeres controles62.
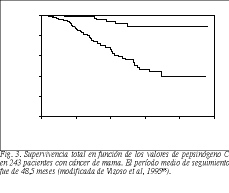
A diferencia de la proteinasa lisosomal cat-D, que se expresa en todos los tipos celulares, el pep-C es una enzima proteolítica principalmente involucrada en la digestión de proteínas en el estómago, y de expresión muy restringida en los tejidos humanos. Sin embargo, se ha demostrado que también el epitelio de los quistes mamarios y un porcentaje significativo de carcinomas mamarios muestran la capacidad de producir pep-C63. Además, en este mismo tipo de neoplasia con posterioridad se ha demostrado también una asociación significativamente positiva entre la expresión tumoral de la enzima y la buena diferenciación tumoral y el estado positivo de los receptores hormonales64, así como también con un pronóstico favorable de las pacientes independientemente del estado ganglionar65 (fig. 3). Así pues, contrariamente a muchos estudios sobre la significación pronóstica de las enzimas proteolíticas en el cáncer, la producción de pep-C por las células cancerosas mamarias está asociada a lesiones de evolución favorable. Una consideración que podría explicar el hecho de que la expresión de pep-C no esté asociada a lesiones de peor pronóstico procede de la observación de que la enzima es secretada como un precursor de alto peso molecular que requiere un pH muy bajo para desempeñar su activación proteolítica63. Puesto que esas condiciones ácidas son muy difíciles de alcanzar en el medio extracelular, parece muy poco probable que el pep-C presente actividad proteolítica y, por tanto, facilite la expansión tumoral. Sin embargo, la expresión de la enzima por los tumores mamarios podría ser indicativa de dependencia androgénica, ya que existen datos que demuestran que el pep-C es inducido por andrógenos en células T-47D de cáncer de mama66. Otro aspecto que apunta la posibilidad de un papel de los andrógenos en la expresión tumoral de pep-C, es que los carcinomas mamarios del varón parecen tener unos valores más elevados de la enzima en relación con los de la mujer67,68. Por otra parte, más recientemente también se ha descrito la expresión de pep-C por tumores de origen extragástrico como de próstata, ovario, endometrio, páncreas y melanomas (tabla 3). Además, también se ha detectado una asociación significativa entre la expresión tumoral de la enzima y parámetros morfológicos indicativos de una menor agresividad tumoral en carcinomas de endometrio69, próstata70 y melanomas71..
Serín-proteinasas
Dentro de este grupo de enzimas proteolíticas se encuentran los activadores del plasminógeno, que convierten el plasminógeno en plasmina y desempeñan un papel importante en el proceso de coagulación. Pero el sistema de la activación del plasminógeno es, además, un complejo sistema de cascada proteolítica que, junto a otros sistemas enzimáticos, participa en la degradación de la matriz extracelular durante los procesos de remodelación tisular en condiciones normales y patológicas, incluyendo la invasión cancerosa72,73. Hasta el momento, se han descrito dos tipos genética e inmunológicamente diferentes de estas enzimas: el tipo urocinasa (uPA) y el tipo tisular (tPA).
El uPA es una enzima que cataliza la conversión de plasminógeno en plasmina activa74. La plasmina, una proteinasa neutra de amplia especificidad, tiene la capacidad de unirse a diferentes receptores de la superficie de las células tumorales75 y desarrolla una amplia actividad fibrinolítica que cataliza la degradación de diferentes componentes de la matriz extracelular. Además, se ha demostrado que la plasmina puede activar otras enzimas proteolíticas, conduciendo a una amplificación de la reacción. Así pues, como resultado de la activación del uPA se produce la rotura de una amplia variedad de proteínas de la matriz extracelular. El uPA se sintetiza y secreta por una amplia variedad de células tumorales y estromales en forma de una proenzima inactiva (pro-uPA) que se une a receptores específicos de la superficie de las células tumorales72. Tras esa unión, la proenzima puede ser activada por la plasmina y otras enzimas como la calicreína76, o las catepsinas B y L77,78. Así pues, los receptores del uPA también son un componente esencial de la migración de la célula tumoral, ya que permiten la regulación continua de la actividad proteolítica en los contactos celulares mediante las diferentes localizaciones de uPA y sus inhibidores79. De esa forma, la célula coordina sus esfuerzos de migración mediante modificación escalonada del mapa de la actividad proteolítica en la superficie celular.
Diversos estudios sugieren que el uPA puede desempeñar un papel relevante en la progresión de diversos carcinomas humanos (tabla 3). Además, los valores intratumorales elevados de uPA han sido asociados con una menor supervivencia de pacientes afectados de cáncer de mama80-83, colorrectal84,85, gástrico86, pulmonar87, vejiga urinaria88 y gliomas89. Sin embargo, la actividad resultante del uPA dependerá, en gran medida, del equilibrio con su inhibidor natural específico (PAI-1) también producido por las células tumorales, y cuyos principales aspectos comentaremos más adelante. Además, se ha observado que los valores intratumorales del receptor específico para la enzima también tienen importancia en el proceso de invasión tumoral90,91.
El tipo tisular del activador del plasminógeno (tPA) está primordialmente involucrado en la disolución de los coágulos intravasculares72. Sin embargo, también se ha detectado la expresión del tPA en carcinomas de mama y colorrectales. Pero, al contrario del uPA, los valores intratumorales elevados de tPA se han asociado a un pronóstico favorable de los carcinomas mamarios83,92,93. Así pues, a pesar de estar emparentadas bioquímicamente, estas dos enzimas muestran un comportamiento diferente en el cáncer de mama, incluso sus valores tisulares muestran una relación inversa en este tipo de neoplasia93. Esa correlación observada de los valores elevados de tPA en el cáncer de mama con el pronóstico favorable puede estar relacionada con el hecho de que esta serín-proteinasa es una enzima inducible por estrógenos en el cáncer de mama94. De hecho, en este tipo de neoplasia se ha observado una relación significativamente positiva entre los valores de tPA y los receptores estrogénicos95. Por ello, la expresión tumoral de tPA puede ser indicativa de carcinomas mamarios que tienen un sistema de receptores estrogénicos biológicamente activo, que es una condición misma asociada con pronóstico favorable en esos tu mores. Por otra parte, también se ha descrito que los valores descendidos de tPA en la mucosa normal adyacente a los carcinomas colorrectales están sorprendentemente asociados de manera significativa con una supervivencia más corta de los pacientes85. Ese hallazgo sugiere que los cambios en la mucosa normal que rodea los carcinomas colorrectales pueden influir en el comportamiento biológico de esos tumores. De acuerdo con ello, se ha propuesto que los valores elevados de tPA en la mucosa normal circundante a los tumores podrían facilitar un incremento de la neovascularización peritumoral, propiciando, de esa forma, reacciones inflamatorias que servirían como defensa ante el avance invasivo de las células tumorales96. Así pues, todo ello resulta indicativo del complejo papel que pueden desempeñar las enzimas proteolíticas en la fisiopatología tumoral, independientemente de su acción degradativa sobre la matriz extracelular y membrana basal.
Otro miembro de la familia de las serín-proteasas, presente en altas concentraciones en el líquido seminal y de especial interés en la patología tumoral, es el antígeno prostático específico (PSA). Esta enzima presenta actividad proteolítica similar a la tripsina y quimotripsina97, y su producción está regulada por los andrógenos98. Hasta hace poco tiempo se consideraba que esta enzima era producida exclusivamente por las células epiteliales de la glándula prostática99, pero estudios recientes demuestran que otros tejidos, como las glándulas periuretrales100, anales101, salivales102 y mamaria103, pueden producir PSA. Así pues, todos esos datos sugieren que el término "prostático específico" inicialmente asignado a este antígeno no se ajusta ni mucho menos a la realidad. En el ámbito de la patología tumoral, el PSA ha demostrado ser un marcador sérico útil para la detección, pronóstico y seguimiento de pacientes con cáncer de próstata99. Sin embargo, la expresión tumoral de esta glucoproteína también se ha detectado en carcinomas mamarios, pulmonares, parotideos, adrenales renales, ováricos, colorrectales y melanomas (tabla 3). De especial importancia son los estudios realizados en el cáncer de mama, donde el 30% de esos tumores tienen una expresión positiva para el PSA104, que se asocia con la positividad de los receptores de estrógenos y progesterona105, así como a un pronóstico favorable de las pacientes106. También se ha demostrado que el PSA puede ser producido por los tumores mamarios y por el tejido mamario normal tras estimulación esteroide107, y que sus concentraciones séricas en pacientes con cáncer de mama metastásico pueden predecir la respuesta al tratamiento hormonal con acetato de megestrol108. Además, muy recientemente se ha descrito que la expresión tumoral del antígeno se correlaciona positivamente con una peor respuesta a la terapia con tamoxifeno en pacientes con recurrencias de cáncer mamario109.
Cisteín-proteinasas
Las cisteín-proteinasas son un grupo de enzimas proteolíticas lisosomales que desempeñan un papel importante en muchos procesos celulares normales, especialmente en relación con el recambio tisular110. Además, estas enzimas parecen es-tar involucradas en determinados procesos patológicos benignos111, así como en el proceso de invasión cancerosa y las metástasis112. Hasta el momento, se han aislado y caracterizado 10 cisteín-proteinasas lisosomales humanas: catepsinas B, L, H, S, O, K, C, W, L2 y Z. Todas ellas contienen un residuo de cisteína en el centro activo de la molécula y, en prácticamente todos los casos, se sintetizan como proenzimas que deben ser activadas para su actuación, pero que difieren en algunas características enzimáticas, incluyendo su especificidad de sustrato y su estabilidad en función del pH.
Se ha demostrado que las catepsinas B, L y O pueden ser secretadas por una variedad de tumores humanos o anima les113-115. Además, existen estudios que demuestran que las cat-B y L están involucradas en la degradación de constituyentes de la membrana basal, como la laminina, fibronectina y el colágeno tipo IV114,116, y que la cat-B puede favorecer la angiogénesis117. De acuerdo con esas observaciones experimentales, existen también estudios que indican una asociación significativa entre los valores de expresión tumoral de las cat-B118 o L119 con ciertos parámetros de agresividad tumoral en carcinomas de colon y próstata. Además, la expresión tumoral de la cat-B ha sido también asociada con un peor pronóstico de los pacientes afectados de carcinoma de colon120 o mama121,122. Sin embargo, también existen datos en la bibliografía que contradicen estas últimas observaciones en relación con el cáncer de mama123.
Inhibidores de las enzimas proteolíticas
La actividad de las enzimas proteolíticas en patología tumoral depende en gran medida del balance con sus inhibidores naturales, que pueden ser producidos por las células tumorales mismas, o bien por las células estromales adyacentes al tejido lesionado. Para cada familia de enzimas proteolíticas se han descrito inhibidores específicos (tabla 4). De esos inhibidores naturales, los que más han sido estudiados en patología tumoral son los inhibidores tisulares metaloproteinasas (TIMP) y los inhibidores de los activadores del plasminógeno (PAI).
Hasta el momento, se han identificado cuatro TIMP. Se trata de glucoproteínas que se unen estrechamente a las formas activas de las MMP, ocasionando una inhibición de su actividad124. La importancia de los TIMP en fisiopatología tumoral viene avalada por diferentes estudios experimentales, que demostraron que la administración exógena de TIMP puede bloquear o inhibir la invasión o progresión tumoral en diversos modelos experimentales125-127. Además, independientemente de la acción inhibitoria de las MMP, se han señalado otras acciones de los TIMP que, como la inducción de la apoptosis o su capacidad de bloquear la formación de nuevos vasos sanguíneos128-130, condicionan también una disminución del crecimiento tumoral. Sin embargo, a pesar de esos datos que indican una regulación negativa de los TIMP en el proceso de invasión tumoral y metástasis, la significación biológica de la expresión tumoral de estos inhibidores parece, al menos, controvertida. Así, también se ha demostrado que la elevada expresión tumoral de ARNm de TIMP se relaciona con un incremento del potencial invasivo y metastásico de los carcinomas de origen gástrico, colorrectal, pancreático, cabeza y cuello131-133. Además, recientemente se ha demostrado que la expresión tumoral de TIMP-1 en el carcinoma gástrico134 y mamario135 está asociada de forma independiente con un peor pronóstico de los pacientes. Estas discrepancias en la función de los TIMP entre los estudios in vivo e in vitro y la significación clínica de su expresión tumoral pueden deberse a diversos motivos. Así, existen datos que sugieren que el TIMP-1 tiene dos actividades distintas: una inhibidora de las MMP, y otra como factor de crecimiento136,137. Esos datos, sin duda, resultan indicativos del complejo papel que parecen desempeñar los inhibidores de las enzimas proteolíticas en el proceso tumoral.
En este mismo sentido, destacan los estudios clínicos que demuestran la significación pronóstica de los inhibidores de los activadores del plasminógeno (PAI). Así, en relación con el inhibidor del uPA (PAI-1) se ha descrito que, sorprendentemente, los valores elevados del mismo están asociados con un pronóstico adverso en el cáncer de mama93,81,138 y de cérvix uterino139. Por el contrario, se ha señalado que los valores elevados del inhibidor del tPA (PAI-2) están asociados a un pronóstico favorable en el cáncer de mama140. Aunque estos datos pueden resultar desconcertantes, debemos considerar, como ya señalamos anteriormente, que cada vez resultan más los efectos asignados a los inhibidores de las enzimas proteolíticas en patología tumoral. Así, por ejemplo, se ha demostrado que el PAI-1 también desempeña un papel importante en la promoción de la angiogénesis141, proceso que está ampliamente considerado como un factor de pronóstico adverso de los tumores. Además, también se considera que la excesiva liberación del PAI-1 podría ser importante de cara a la reimplantación de las células tumorales circulantes, teniendo en cuenta que la formación de la nueva estroma en el lugar de las metástasis requiere el bloqueo temporal de la degradación de la matriz extracelular ocasionado por el uPA81. En definitiva, de acuerdo con estas observaciones, que apuntan la importancia de la dinámica de los parámetros del sistema activador del plasminógeno en la fisiopatología tumoral, diversas investigaciones recientes indican que la evaluación combinada de todos esos parámetros aporta una mejor precisión pronóstica en los carcinomas de mama93,142,138,83, gástricos86, de pulmón87 y colorrectales96,85.
Finalmente, cabe señalar que la utilización de los inhibidores de las enzimas proteolíticas representa una nueva alternativa terapéutica de los carcinomas humanos. En este sentido, diversos estudios en modelos animales demostraron el efecto inhibidor de la invasión tumoral y antimetastásico del TIMP-2 recombinante143. Sin embargo, la utilización de los inhibidores naturales de las enzimas proteolíticas parece tener poca utilidad para la aplicación farmacológica anticancerosa debido a su baja vida media. Por ello, se está investigando en la actualidad la posible utilidad de inhibidores sintéticos de las enzimas proteolíticas (tabla 4), algunos de los cuales, como el batimastato y marimastato, que son activos contra las metaloproteinasas, se ha demostrado que puden frenar el crecimiento y reducir las metástasis pulmonares de carcinomas mamarios en modelos experimentales144,145. Además, se han iniciado ya una gran variedad de estudios clínicos en estado de fase I, II o III, basados en el uso terapéutico de inhibidores sintéticos de las MMP en pacientes afectados de diversos tipos de carcinomas humanos146.
Conclusiones
En la presente década se ha generado muchísima información acerca de la expresión y significación clínica de las enzimas proteolíticas en los carcinomas humanos. De toda esa información se puede concluir que los diferentes tumores humanos utilizan distintas enzimas proteolíticas o combinaciones de ellas en el proceso de invasión y metástasis. Además, estas proteinasas pueden ser producidas por las propias células tumorales o inducidas en las células de la estroma tumoral en el contexto de una relación dinámica entre ambos tipos celulares, que parece adquirir cada vez mayor auge en la comprensión de la fisiopatología tumoral. Por otra parte, no cabe duda del papel complejo de las enzimas proteolíticas en la biología de los tumores humanos, ya que no sólo parecen estar involucrados en la degradación de la membrana basal y matriz extracelular, así como en otros mecanismos que propician la progresión tumoral, sino que también, en algunos casos, su expresión se relaciona con una menor agresividad tumoral, presumiblemente enmarcada en el ámbito de una vía específica de respuesta hormonal. De cualquier forma, la expresión tumoral de muchas enzimas proteolíticas parece aportar información pronóstica útil en pacientes afectados de diversos tipos de neoplasias. En este sentido, futuros estudios que realicen una evaluación combinada de diferentes proteinasas, así como de sus inhibidores, pueden aportar una mayor precisión sobre el comportamiento biológico y clínico de los diferentes tumores. Finalmente, la utilización de inhibidores sintéticos de las enzimas proteolíticas en patología tumoral puede significar una nueva e importante alternativa terapéutica en los carcinomas humanos.
Bibliografía