Los sarcomas de partes blandas (SFTS) conforman un grupo de neoplasias poco frecuentes y heterogéneas (menos del 1% en adultos y 15% en pediátricos), de los cuales no se cuenta con registros actualizados en población latinoamericana. El estudio tiene como objetivo describir la situación actual de los pacientes tratados en un instituto oncológico de Latinoamérica.
MétodosSe obtuvo un registro de 250 pacientes con diagnóstico de SFTS, tratados en el Instituto de Enfermedades Neoplásicas del Perú (INEN), durante el periodo 2009-2013, con una media de seguimiento de 62 meses, registrándose datos: epidemiológicos, clínicos, tratamiento y seguimiento; realizándose el análisis de sobrevida global mediante el modelo proporcional de Cox.
ResultadosLos SFTS mostraron una mayor frecuencia en género masculino (60,8%), con un pico incidencia a partir de los 50 años (69,6%), la localización tumoral predominante fue en extremidades inferiores (64,4%), siendo los subtipos histológicos más frecuentes: sarcoma pleomórfico indiferenciado (34%) y liposarcomas (25,6%); el estadio clínico iii es el de mayor registro (30,8%). Se obtuvo una tasa de sobrevida global a 5 años del 63,9%, encontrándose en el análisis estadístico asociación significativa entre la sobrevida global y las variables: edad (> 50 años), tamaño tumoral (> 5cm), profundidad (subfascial), grado histológico (G3), recurrencia local y a distancia, mostrando en este grupo rangos menores de sobrevida.
ConclusionesSe ha logrado precisar la epidemiología, el tratamiento y el pronóstico, así como las variables que repercuten en la sobrevida de los pacientes latinoamericanos con SFTS estudiados.
Soft tissue sarcomas (SFT) are a group of rare and heterogeneous neoplasms (representing less than 1% of cancer in adults and 15% in pediatric patients), for which there is no updated records in the Latin American population. This study aims to describe the current situation of patients treated at a cancer institute in Latin America.
MethodsWe obtained records from 250 patients with a diagnosis of SFT, treated at the National Institute of Neoplastic Diseases of Peru (INEN) during the period 2009-2013, with a mean follow-up of 62 months. The following data were recorded: epidemiological, clinical, treatment and follow-up. The analysis of global survival was done with the Cox proportional hazards model.
ResultsSFT showed a greater frequency in males (60.8%), with a peak incidence after 50 years of age (69.6%). Tumor location was predominantly in the lower extremities (64.4%), and the most frequent histologic subtypes were: undifferentiated pleomorphic sarcoma (34%) and liposarcomas (25.6%); clinical stage iii was the most frequent (30.8%). The 5-year overall survival rate was 63.9%, while the statistical analysis found a significant association between global survival and the variables: age (>50 years), tumor size (>5cm), depth (subfascial), histologic grade (G3), local and distant recurrence, showing shorter survival times in these groups.
ConclusionsThis study has clarified the epidemiology, treatment and prognosis, as well as the variables that have an impact on the survival of the Latin American patients with SFT studied.
Los sarcomas son neoplasias mesenquimales, infrecuentes y heterogéneas (representando menos del 1% de las neoplasias en adultos y el 15% en pediátricos), dentro de los cuales se incluyen los sarcomas de partes blandas (SFTS), presentando más de 50 subtipos histológicos; presentándose 10.390 de casos nuevos en Estados Unidos anualmente y una tasa de incidencia global de 6 por 100.000 habitantes1. A nivel nacional hay un subregistro de casos, con una tasa de 2.4 por 100.000 habitantes2, siendo tratados en su mayoría en el Instituto Nacional de Enfermedades Neoplásicas del Perú (INEN).
Se tiene como objetivo conocer el escenario actual enfocado en variables: epidemiológicas, clínicas, modalidades de tratamiento y pronóstico; así como la determinación de variables que tienen impacto en la sobrevida de los pacientes con SFTS tratados en INEN.
MétodosEl presente estudio descriptivo y retrospectivo realizó una revisión sistemática del registro de pacientes del INEN, identificándose 250 pacientes con diagnóstico histológico de SFTS durante el periodo 2009-2013, con una media de seguimiento de 62 meses. Se excluyó a pacientes tratados en otra institución con: neoadyuvancia o adyuvancia, pacientes que no tuvieron tratamiento quirúrgico en la institución y aquellos fuera del rango de cita de seguimiento (> 6 meses), así como los tumores desmoides y dermatofibrosarcoma protuberans.
Se registraron datos epidemiológicos (género y edad de presentación), así como las características clínicas: tamaño tumoral, profundidad de infiltración, localización, estadificación TNM (AJCC Cancer Staging Manual, 7th edition)3.
Los pacientes fueron evaluados en junta multidisciplinaria integrada por: cirujanos oncólogos, especializados en cirugía de tumores de partes blandas, traumatólogos oncólogos, cirujanos plásticos y reconstructivos, radiólogos, oncólogos y radioterapeutas; se decidieron los tratamientos: quirúrgicos (tipo de resección, reconstrucción quirúrgica), neoadyuvancia y adyuvancia (esquema de tratamiento y dosis), basado en las características biológicas del tumor, estadificación, tratamientos previos y comorbilidades, siguiendo las guías de referencias nacionales e internacionales4,5.
Las piezas operatorias fueron orientadas en sala de operaciones, permitiéndose una evaluación de los bordes quirúrgicos: macroscópicos y microscópicos; informándose como: bordes libres de neoplasia maligna, con márgenes macroscópicamente alejados (igual o mayor de 1 cm) como amplio; bordes libres de neoplasia maligna, con márgenes microscópicos cercanos (marginal), bordes en contacto con neoplasia maligna (comprometidos), evaluándose las piezas quirúrgicas con tinciones de hematoxilina-eosina y paneles de inmunohistoquímica.
El seguimiento posterior a la cirugía, consistió en evaluaciones clínicas periódicas cada 3 meses (los 2primeros años), cada 6 meses (hasta cumplir 5 años) y posteriores evaluaciones anuales. Los exámenes auxiliares durante el seguimiento fueron orientados en la evaluación de recurrencia locorregional (ecografía de partes blandas y resonancia magnética [RM] contrastada) y en la evaluación de recurrencia a distancia (estudios tomográficos de tórax, abdomen y pelvis contrastados).
Análisis estadísticoSe realizó un análisis descriptivo de la información a través de frecuencias, porcentajes y medidas resumen (media, mediana y rango). Las curvas de la sobrevida global (SO) según las características en estudio se estimaron con el método de Kaplan-Meier y las diferencias entre ellas se evaluaron con el log rank test; se usó el modelo de riesgos proporcionales de Cox para determinar características pronóstico de SO. Un valor p < 0,05 se consideró para una diferencia significativa y para determinar las características que son importantes para explicar el tiempo desde el diagnóstico hasta el fallecimiento; se consideró que el intervalo de confianza de la hazard ratio (HR) del modelo de Cox no contenga el valor 1. En el análisis de los datos se usó el software R (R Core Team [2017]. R: A language and environment for statistical computing; R Foundation for Statistical Computing, Vienna, Austria).
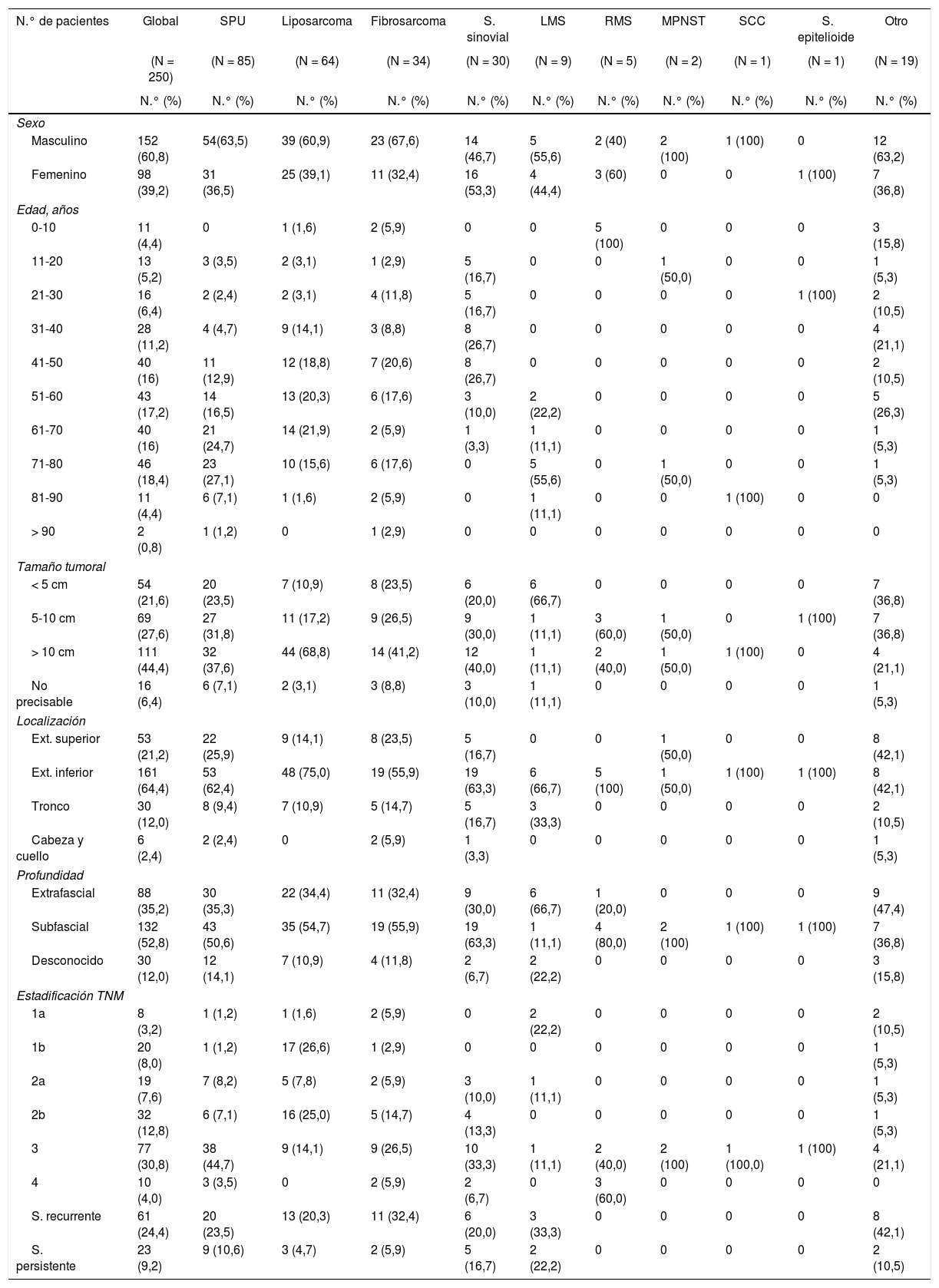
ResultadosSe identificó a 625 pacientes del INEN, los cuales contaban con diagnóstico anatomopatológico de SFTS durante el periodo 2009-2013; 250 cumplieron los criterios de inclusión. La tabla 1 muestra las características clínicas y epidemiológicas; se presentaron una mayor incidencia en el género masculino (60,8%) y una mayor proporción de casos a partir de los 50 años (69,6%), con un pico de incidencia a los 70 años y una media de 52,6 años. Los subtipos histológicos de mayor registro fueron: el sarcoma pleomórfico indiferenciado (SPU) (34%) y los liposarcoma (25,6%), con una mayor proporción de casos en pacientes mayores de 50 años, siendo los rabdomiosarcoma (RMS) y los sarcomas sinoviales los de mayor incidencia en edades pediátricas y adultos jóvenes (< 50 años). Los tumores de más de 5cm representan el 72% de casos, siendo la extremidad inferior la más afectada (64,4%), predominando los subtipos SPU, liposarcoma, fibrosarcoma y sarcoma sinovial en esta localización. El compromiso subfascial evaluado por imágenes de RM mostró un porcentaje de 52,8%, siendo el estadio clínico 3el de mayor registro (30,8%).
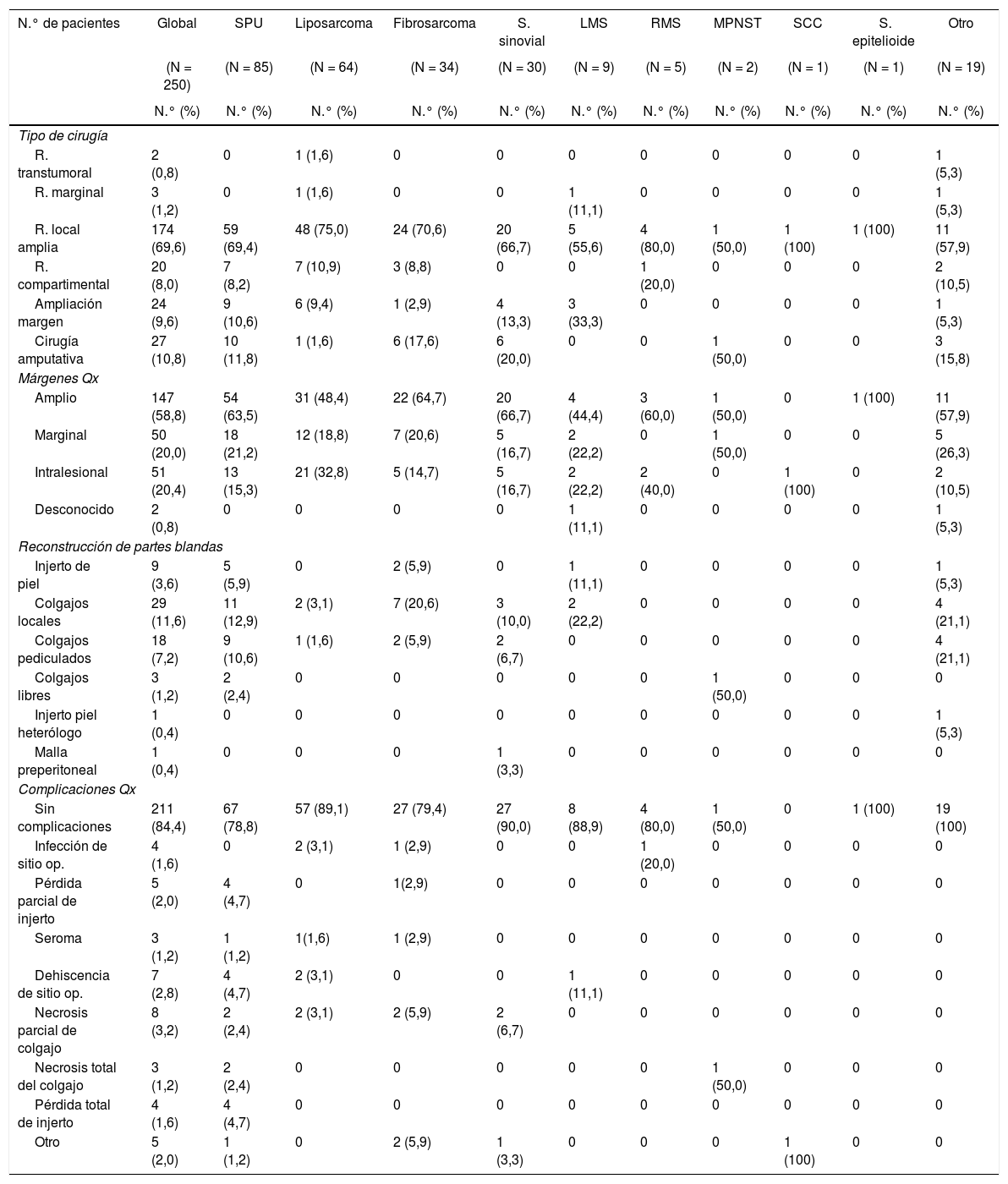
Características clínicas y epidemiológicas según subtipo histológico
| N.° de pacientes | Global | SPU | Liposarcoma | Fibrosarcoma | S. sinovial | LMS | RMS | MPNST | SCC | S. epitelioide | Otro |
|---|---|---|---|---|---|---|---|---|---|---|---|
| (N = 250) | (N = 85) | (N = 64) | (N = 34) | (N = 30) | (N = 9) | (N = 5) | (N = 2) | (N = 1) | (N = 1) | (N = 19) | |
| N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | |
| Sexo | |||||||||||
| Masculino | 152 (60,8) | 54(63,5) | 39 (60,9) | 23 (67,6) | 14 (46,7) | 5 (55,6) | 2 (40) | 2 (100) | 1 (100) | 0 | 12 (63,2) |
| Femenino | 98 (39,2) | 31 (36,5) | 25 (39,1) | 11 (32,4) | 16 (53,3) | 4 (44,4) | 3 (60) | 0 | 0 | 1 (100) | 7 (36,8) |
| Edad, años | |||||||||||
| 0-10 | 11 (4,4) | 0 | 1 (1,6) | 2 (5,9) | 0 | 0 | 5 (100) | 0 | 0 | 0 | 3 (15,8) |
| 11-20 | 13 (5,2) | 3 (3,5) | 2 (3,1) | 1 (2,9) | 5 (16,7) | 0 | 0 | 1 (50,0) | 0 | 0 | 1 (5,3) |
| 21-30 | 16 (6,4) | 2 (2,4) | 2 (3,1) | 4 (11,8) | 5 (16,7) | 0 | 0 | 0 | 0 | 1 (100) | 2 (10,5) |
| 31-40 | 28 (11,2) | 4 (4,7) | 9 (14,1) | 3 (8,8) | 8 (26,7) | 0 | 0 | 0 | 0 | 0 | 4 (21,1) |
| 41-50 | 40 (16) | 11 (12,9) | 12 (18,8) | 7 (20,6) | 8 (26,7) | 0 | 0 | 0 | 0 | 0 | 2 (10,5) |
| 51-60 | 43 (17,2) | 14 (16,5) | 13 (20,3) | 6 (17,6) | 3 (10,0) | 2 (22,2) | 0 | 0 | 0 | 0 | 5 (26,3) |
| 61-70 | 40 (16) | 21 (24,7) | 14 (21,9) | 2 (5,9) | 1 (3,3) | 1 (11,1) | 0 | 0 | 0 | 0 | 1 (5,3) |
| 71-80 | 46 (18,4) | 23 (27,1) | 10 (15,6) | 6 (17,6) | 0 | 5 (55,6) | 0 | 1 (50,0) | 0 | 0 | 1 (5,3) |
| 81-90 | 11 (4,4) | 6 (7,1) | 1 (1,6) | 2 (5,9) | 0 | 1 (11,1) | 0 | 0 | 1 (100) | 0 | 0 |
| > 90 | 2 (0,8) | 1 (1,2) | 0 | 1 (2,9) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Tamaño tumoral | |||||||||||
| < 5 cm | 54 (21,6) | 20 (23,5) | 7 (10,9) | 8 (23,5) | 6 (20,0) | 6 (66,7) | 0 | 0 | 0 | 0 | 7 (36,8) |
| 5-10 cm | 69 (27,6) | 27 (31,8) | 11 (17,2) | 9 (26,5) | 9 (30,0) | 1 (11,1) | 3 (60,0) | 1 (50,0) | 0 | 1 (100) | 7 (36,8) |
| > 10 cm | 111 (44,4) | 32 (37,6) | 44 (68,8) | 14 (41,2) | 12 (40,0) | 1 (11,1) | 2 (40,0) | 1 (50,0) | 1 (100) | 0 | 4 (21,1) |
| No precisable | 16 (6,4) | 6 (7,1) | 2 (3,1) | 3 (8,8) | 3 (10,0) | 1 (11,1) | 0 | 0 | 0 | 0 | 1 (5,3) |
| Localización | |||||||||||
| Ext. superior | 53 (21,2) | 22 (25,9) | 9 (14,1) | 8 (23,5) | 5 (16,7) | 0 | 0 | 1 (50,0) | 0 | 0 | 8 (42,1) |
| Ext. inferior | 161 (64,4) | 53 (62,4) | 48 (75,0) | 19 (55,9) | 19 (63,3) | 6 (66,7) | 5 (100) | 1 (50,0) | 1 (100) | 1 (100) | 8 (42,1) |
| Tronco | 30 (12,0) | 8 (9,4) | 7 (10,9) | 5 (14,7) | 5 (16,7) | 3 (33,3) | 0 | 0 | 0 | 0 | 2 (10,5) |
| Cabeza y cuello | 6 (2,4) | 2 (2,4) | 0 | 2 (5,9) | 1 (3,3) | 0 | 0 | 0 | 0 | 0 | 1 (5,3) |
| Profundidad | |||||||||||
| Extrafascial | 88 (35,2) | 30 (35,3) | 22 (34,4) | 11 (32,4) | 9 (30,0) | 6 (66,7) | 1 (20,0) | 0 | 0 | 0 | 9 (47,4) |
| Subfascial | 132 (52,8) | 43 (50,6) | 35 (54,7) | 19 (55,9) | 19 (63,3) | 1 (11,1) | 4 (80,0) | 2 (100) | 1 (100) | 1 (100) | 7 (36,8) |
| Desconocido | 30 (12,0) | 12 (14,1) | 7 (10,9) | 4 (11,8) | 2 (6,7) | 2 (22,2) | 0 | 0 | 0 | 0 | 3 (15,8) |
| Estadificación TNM | |||||||||||
| 1a | 8 (3,2) | 1 (1,2) | 1 (1,6) | 2 (5,9) | 0 | 2 (22,2) | 0 | 0 | 0 | 0 | 2 (10,5) |
| 1b | 20 (8,0) | 1 (1,2) | 17 (26,6) | 1 (2,9) | 0 | 0 | 0 | 0 | 0 | 0 | 1 (5,3) |
| 2a | 19 (7,6) | 7 (8,2) | 5 (7,8) | 2 (5,9) | 3 (10,0) | 1 (11,1) | 0 | 0 | 0 | 0 | 1 (5,3) |
| 2b | 32 (12,8) | 6 (7,1) | 16 (25,0) | 5 (14,7) | 4 (13,3) | 0 | 0 | 0 | 0 | 0 | 1 (5,3) |
| 3 | 77 (30,8) | 38 (44,7) | 9 (14,1) | 9 (26,5) | 10 (33,3) | 1 (11,1) | 2 (40,0) | 2 (100) | 1 (100,0) | 1 (100) | 4 (21,1) |
| 4 | 10 (4,0) | 3 (3,5) | 0 | 2 (5,9) | 2 (6,7) | 0 | 3 (60,0) | 0 | 0 | 0 | 0 |
| S. recurrente | 61 (24,4) | 20 (23,5) | 13 (20,3) | 11 (32,4) | 6 (20,0) | 3 (33,3) | 0 | 0 | 0 | 0 | 8 (42,1) |
| S. persistente | 23 (9,2) | 9 (10,6) | 3 (4,7) | 2 (5,9) | 5 (16,7) | 2 (22,2) | 0 | 0 | 0 | 0 | 2 (10,5) |
LMS: leiomiosarcoma; MPNST: tumor maligno de la vaina del nervio periférico; RMS: rabdomiosarcoma; S: sarcoma; SCC: sarcoma de células claras; SPU: sarcoma pleomórfico indiferenciado; T: tumoral.
La tabla 2 resume las estadísticas quirúrgicas según el subtipo histológico. La cirugía de preservación de miembros fue la opción de tratamiento más utilizada (89,2%), siendo el porcentaje de cirugía amputativa alcanzado del 10,8%. El estatus de los márgenes quirúrgicos observados: amplio (58,8%), marginal (20%) y comprometidos (20,4%). La reconstrucción quirúrgica en partes blandas fue requerida en 61 pacientes (24,4%), realizándose colgajos locales (11,6%) y colgajos pediculados (7,2%), mayormente utilizados en los casos de SPU (31,8%) y fibrosarcoma (32,4%). El porcentaje de complicaciones quirúrgicas registrado fue del 15,6%, presentándose en mayor frecuencia en pacientes con reconstrucciones quirúrgicas (necrosis parcial del colgajo 3,2% y dehiscencia del sitio operatorio 2,8%).
Estadísticas quirúrgicas según subtipo histológico de SFTS
| N.° de pacientes | Global | SPU | Liposarcoma | Fibrosarcoma | S. sinovial | LMS | RMS | MPNST | SCC | S. epitelioide | Otro |
|---|---|---|---|---|---|---|---|---|---|---|---|
| (N = 250) | (N = 85) | (N = 64) | (N = 34) | (N = 30) | (N = 9) | (N = 5) | (N = 2) | (N = 1) | (N = 1) | (N = 19) | |
| N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | |
| Tipo de cirugía | |||||||||||
| R. transtumoral | 2 (0,8) | 0 | 1 (1,6) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 (5,3) |
| R. marginal | 3 (1,2) | 0 | 1 (1,6) | 0 | 0 | 1 (11,1) | 0 | 0 | 0 | 0 | 1 (5,3) |
| R. local amplia | 174 (69,6) | 59 (69,4) | 48 (75,0) | 24 (70,6) | 20 (66,7) | 5 (55,6) | 4 (80,0) | 1 (50,0) | 1 (100) | 1 (100) | 11 (57,9) |
| R. compartimental | 20 (8,0) | 7 (8,2) | 7 (10,9) | 3 (8,8) | 0 | 0 | 1 (20,0) | 0 | 0 | 0 | 2 (10,5) |
| Ampliación margen | 24 (9,6) | 9 (10,6) | 6 (9,4) | 1 (2,9) | 4 (13,3) | 3 (33,3) | 0 | 0 | 0 | 0 | 1 (5,3) |
| Cirugía amputativa | 27 (10,8) | 10 (11,8) | 1 (1,6) | 6 (17,6) | 6 (20,0) | 0 | 0 | 1 (50,0) | 0 | 0 | 3 (15,8) |
| Márgenes Qx | |||||||||||
| Amplio | 147 (58,8) | 54 (63,5) | 31 (48,4) | 22 (64,7) | 20 (66,7) | 4 (44,4) | 3 (60,0) | 1 (50,0) | 0 | 1 (100) | 11 (57,9) |
| Marginal | 50 (20,0) | 18 (21,2) | 12 (18,8) | 7 (20,6) | 5 (16,7) | 2 (22,2) | 0 | 1 (50,0) | 0 | 0 | 5 (26,3) |
| Intralesional | 51 (20,4) | 13 (15,3) | 21 (32,8) | 5 (14,7) | 5 (16,7) | 2 (22,2) | 2 (40,0) | 0 | 1 (100) | 0 | 2 (10,5) |
| Desconocido | 2 (0,8) | 0 | 0 | 0 | 0 | 1 (11,1) | 0 | 0 | 0 | 0 | 1 (5,3) |
| Reconstrucción de partes blandas | |||||||||||
| Injerto de piel | 9 (3,6) | 5 (5,9) | 0 | 2 (5,9) | 0 | 1 (11,1) | 0 | 0 | 0 | 0 | 1 (5,3) |
| Colgajos locales | 29 (11,6) | 11 (12,9) | 2 (3,1) | 7 (20,6) | 3 (10,0) | 2 (22,2) | 0 | 0 | 0 | 0 | 4 (21,1) |
| Colgajos pediculados | 18 (7,2) | 9 (10,6) | 1 (1,6) | 2 (5,9) | 2 (6,7) | 0 | 0 | 0 | 0 | 0 | 4 (21,1) |
| Colgajos libres | 3 (1,2) | 2 (2,4) | 0 | 0 | 0 | 0 | 0 | 1 (50,0) | 0 | 0 | 0 |
| Injerto piel heterólogo | 1 (0,4) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 (5,3) |
| Malla preperitoneal | 1 (0,4) | 0 | 0 | 0 | 1 (3,3) | 0 | 0 | 0 | 0 | 0 | 0 |
| Complicaciones Qx | |||||||||||
| Sin complicaciones | 211 (84,4) | 67 (78,8) | 57 (89,1) | 27 (79,4) | 27 (90,0) | 8 (88,9) | 4 (80,0) | 1 (50,0) | 0 | 1 (100) | 19 (100) |
| Infección de sitio op. | 4 (1,6) | 0 | 2 (3,1) | 1 (2,9) | 0 | 0 | 1 (20,0) | 0 | 0 | 0 | 0 |
| Pérdida parcial de injerto | 5 (2,0) | 4 (4,7) | 0 | 1(2,9) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Seroma | 3 (1,2) | 1 (1,2) | 1(1,6) | 1 (2,9) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Dehiscencia de sitio op. | 7 (2,8) | 4 (4,7) | 2 (3,1) | 0 | 0 | 1 (11,1) | 0 | 0 | 0 | 0 | 0 |
| Necrosis parcial de colgajo | 8 (3,2) | 2 (2,4) | 2 (3,1) | 2 (5,9) | 2 (6,7) | 0 | 0 | 0 | 0 | 0 | 0 |
| Necrosis total del colgajo | 3 (1,2) | 2 (2,4) | 0 | 0 | 0 | 0 | 0 | 1 (50,0) | 0 | 0 | 0 |
| Pérdida total de injerto | 4 (1,6) | 4 (4,7) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Otro | 5 (2,0) | 1 (1,2) | 0 | 2 (5,9) | 1 (3,3) | 0 | 0 | 0 | 1 (100) | 0 | 0 |
LMS: leiomiosarcoma; MPNST: tumor maligno de la vaina del nervio periférico; op.: operatorio; Qx: quirúrgicos; R: reconstrucción; RMS: rabdomiosarcoma; S.: sarcoma; SCC: sarcoma de células claras; SFTS: sarcoma de partes blandas; SPU: sarcoma pleomórfico indiferenciado.
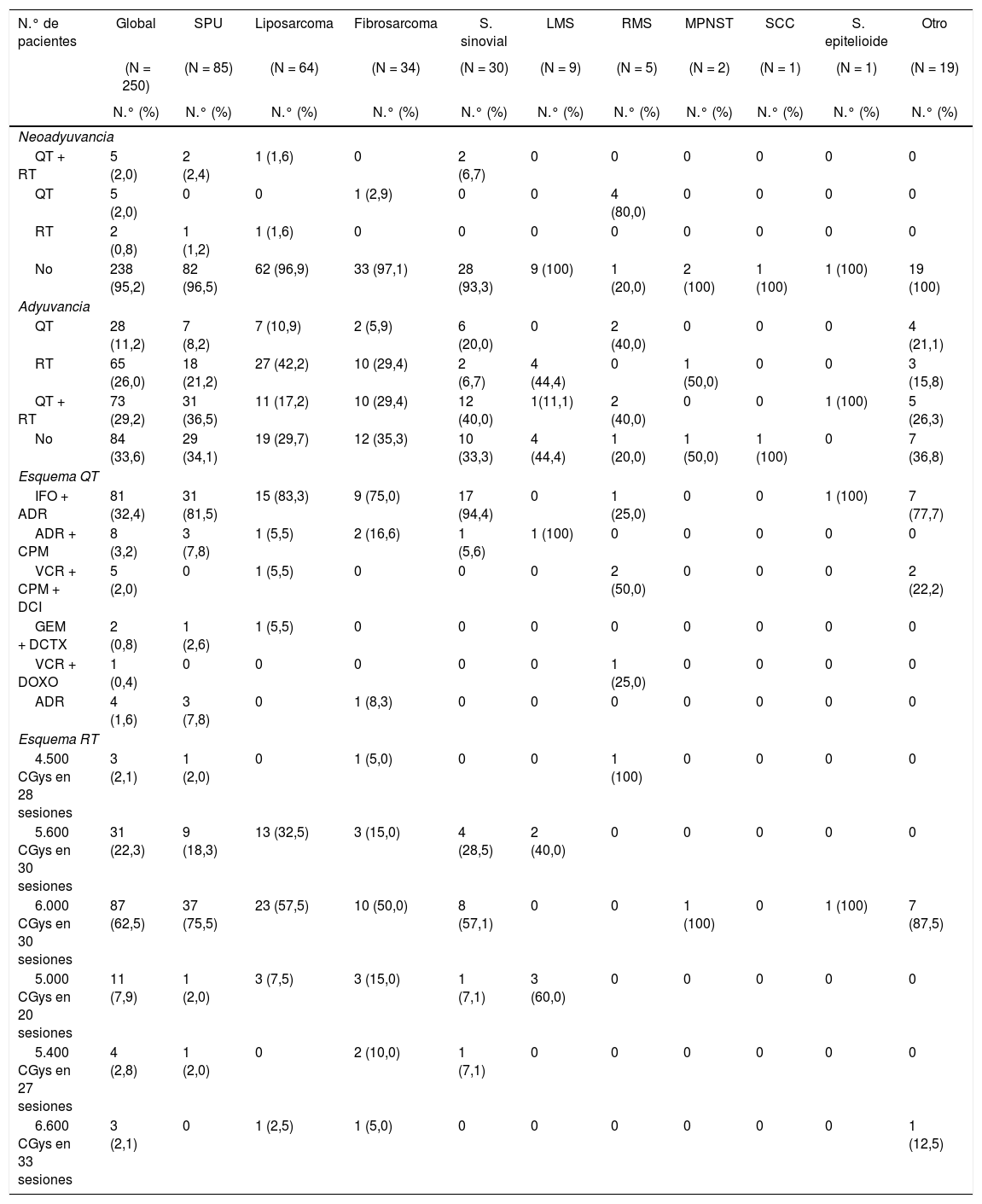
La tabla 3 resume el tratamiento neoadyuvante y adyuvante suministrados.
Datos estadísticos sobre tratamiento neoadyuvante y adyuvante, según subtipo histológico de SFTS
| N.° de pacientes | Global | SPU | Liposarcoma | Fibrosarcoma | S. sinovial | LMS | RMS | MPNST | SCC | S. epitelioide | Otro |
|---|---|---|---|---|---|---|---|---|---|---|---|
| (N = 250) | (N = 85) | (N = 64) | (N = 34) | (N = 30) | (N = 9) | (N = 5) | (N = 2) | (N = 1) | (N = 1) | (N = 19) | |
| N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | N.° (%) | |
| Neoadyuvancia | |||||||||||
| QT + RT | 5 (2,0) | 2 (2,4) | 1 (1,6) | 0 | 2 (6,7) | 0 | 0 | 0 | 0 | 0 | 0 |
| QT | 5 (2,0) | 0 | 0 | 1 (2,9) | 0 | 0 | 4 (80,0) | 0 | 0 | 0 | 0 |
| RT | 2 (0,8) | 1 (1,2) | 1 (1,6) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| No | 238 (95,2) | 82 (96,5) | 62 (96,9) | 33 (97,1) | 28 (93,3) | 9 (100) | 1 (20,0) | 2 (100) | 1 (100) | 1 (100) | 19 (100) |
| Adyuvancia | |||||||||||
| QT | 28 (11,2) | 7 (8,2) | 7 (10,9) | 2 (5,9) | 6 (20,0) | 0 | 2 (40,0) | 0 | 0 | 0 | 4 (21,1) |
| RT | 65 (26,0) | 18 (21,2) | 27 (42,2) | 10 (29,4) | 2 (6,7) | 4 (44,4) | 0 | 1 (50,0) | 0 | 0 | 3 (15,8) |
| QT + RT | 73 (29,2) | 31 (36,5) | 11 (17,2) | 10 (29,4) | 12 (40,0) | 1(11,1) | 2 (40,0) | 0 | 0 | 1 (100) | 5 (26,3) |
| No | 84 (33,6) | 29 (34,1) | 19 (29,7) | 12 (35,3) | 10 (33,3) | 4 (44,4) | 1 (20,0) | 1 (50,0) | 1 (100) | 0 | 7 (36,8) |
| Esquema QT | |||||||||||
| IFO + ADR | 81 (32,4) | 31 (81,5) | 15 (83,3) | 9 (75,0) | 17 (94,4) | 0 | 1 (25,0) | 0 | 0 | 1 (100) | 7 (77,7) |
| ADR + CPM | 8 (3,2) | 3 (7,8) | 1 (5,5) | 2 (16,6) | 1 (5,6) | 1 (100) | 0 | 0 | 0 | 0 | 0 |
| VCR + CPM + DCI | 5 (2,0) | 0 | 1 (5,5) | 0 | 0 | 0 | 2 (50,0) | 0 | 0 | 0 | 2 (22,2) |
| GEM + DCTX | 2 (0,8) | 1 (2,6) | 1 (5,5) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| VCR + DOXO | 1 (0,4) | 0 | 0 | 0 | 0 | 0 | 1 (25,0) | 0 | 0 | 0 | 0 |
| ADR | 4 (1,6) | 3 (7,8) | 0 | 1 (8,3) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Esquema RT | |||||||||||
| 4.500 CGys en 28 sesiones | 3 (2,1) | 1 (2,0) | 0 | 1 (5,0) | 0 | 0 | 1 (100) | 0 | 0 | 0 | 0 |
| 5.600 CGys en 30 sesiones | 31 (22,3) | 9 (18,3) | 13 (32,5) | 3 (15,0) | 4 (28,5) | 2 (40,0) | 0 | 0 | 0 | 0 | 0 |
| 6.000 CGys en 30 sesiones | 87 (62,5) | 37 (75,5) | 23 (57,5) | 10 (50,0) | 8 (57,1) | 0 | 0 | 1 (100) | 0 | 1 (100) | 7 (87,5) |
| 5.000 CGys en 20 sesiones | 11 (7,9) | 1 (2,0) | 3 (7,5) | 3 (15,0) | 1 (7,1) | 3 (60,0) | 0 | 0 | 0 | 0 | 0 |
| 5.400 CGys en 27 sesiones | 4 (2,8) | 1 (2,0) | 0 | 2 (10,0) | 1 (7,1) | 0 | 0 | 0 | 0 | 0 | 0 |
| 6.600 CGys en 33 sesiones | 3 (2,1) | 0 | 1 (2,5) | 1 (5,0) | 0 | 0 | 0 | 0 | 0 | 0 | 1 (12,5) |
ADR: adriamicina; CPM: ciclofosfamida; DCI: dactinomicina; DCTX: docetaxel; DOXO: doxorrubicina, GEM: gemcitabina; IFO: ifosfamida; LMS: leiomiosarcoma; MPNST: tumor maligno de la vaina del nervio periférico; QT: quimioterapia; RMS: rabdomiosarcoma; RT: radioterapia; S.: sarcoma; SCC: sarcoma de células claras; SFTS: sarcoma de partes blandas; SPU: sarcoma pleomórfico indiferenciado; VCR: vincristina.
El tratamiento neoadyuvante fue indicado en la evaluación multidisciplinaria de ingreso: 4,8% (RMS 80% y sarcoma sinovial 6,7%). La terapia adyuvante se suministró en el 66,4%, siendo el uso combinado de quimioterapia y radioterapia el de mayor registro (29,2%). El esquema de quimioterapia más empleado fue: ifosfamida asociada a adriamicina, siendo las dosis de radioterapia externa más utilizada: 6.000 CGys en 30 sesiones.
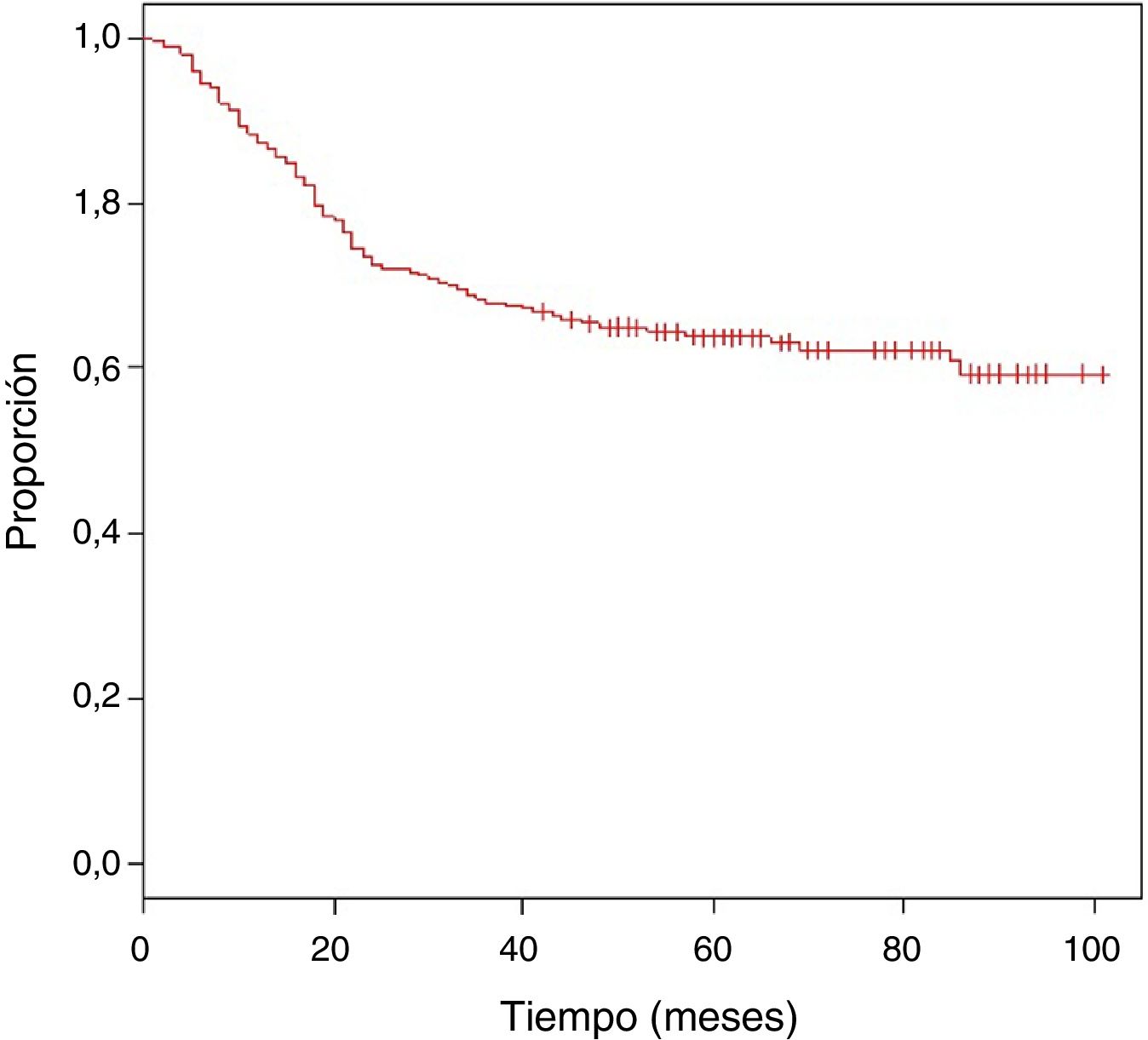
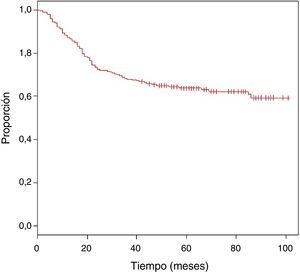
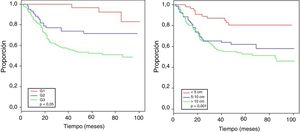
Se obtuvo una media de seguimiento de 62 meses, con una SO estimada del 63,9% (fig. 1).
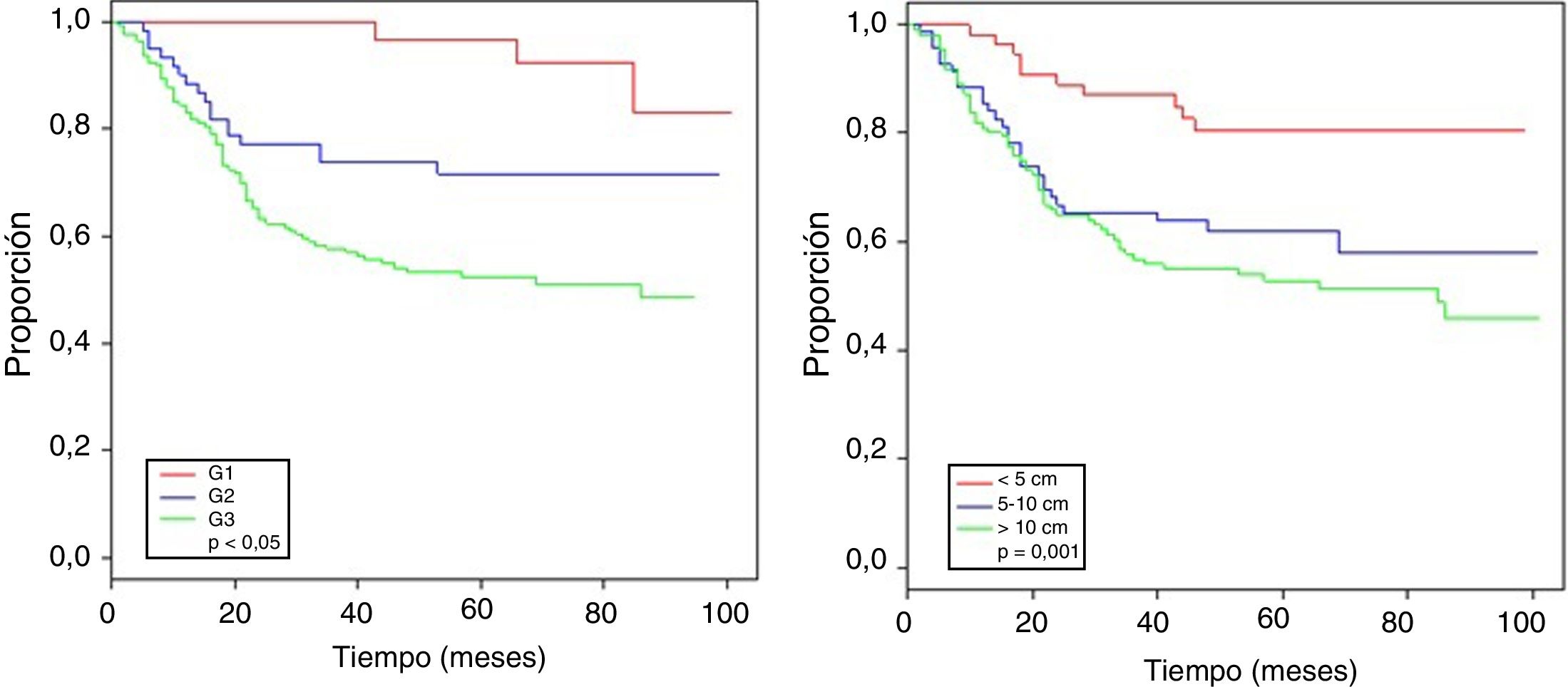
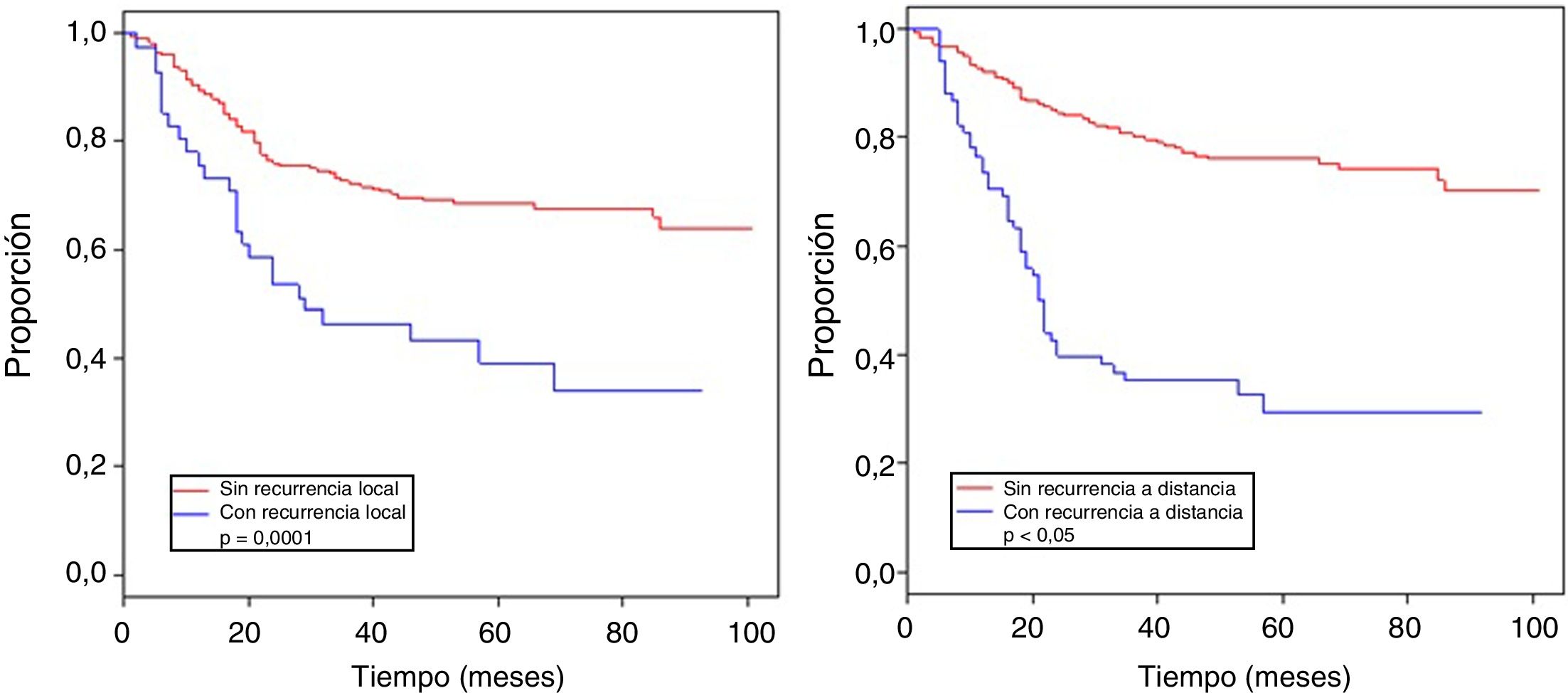
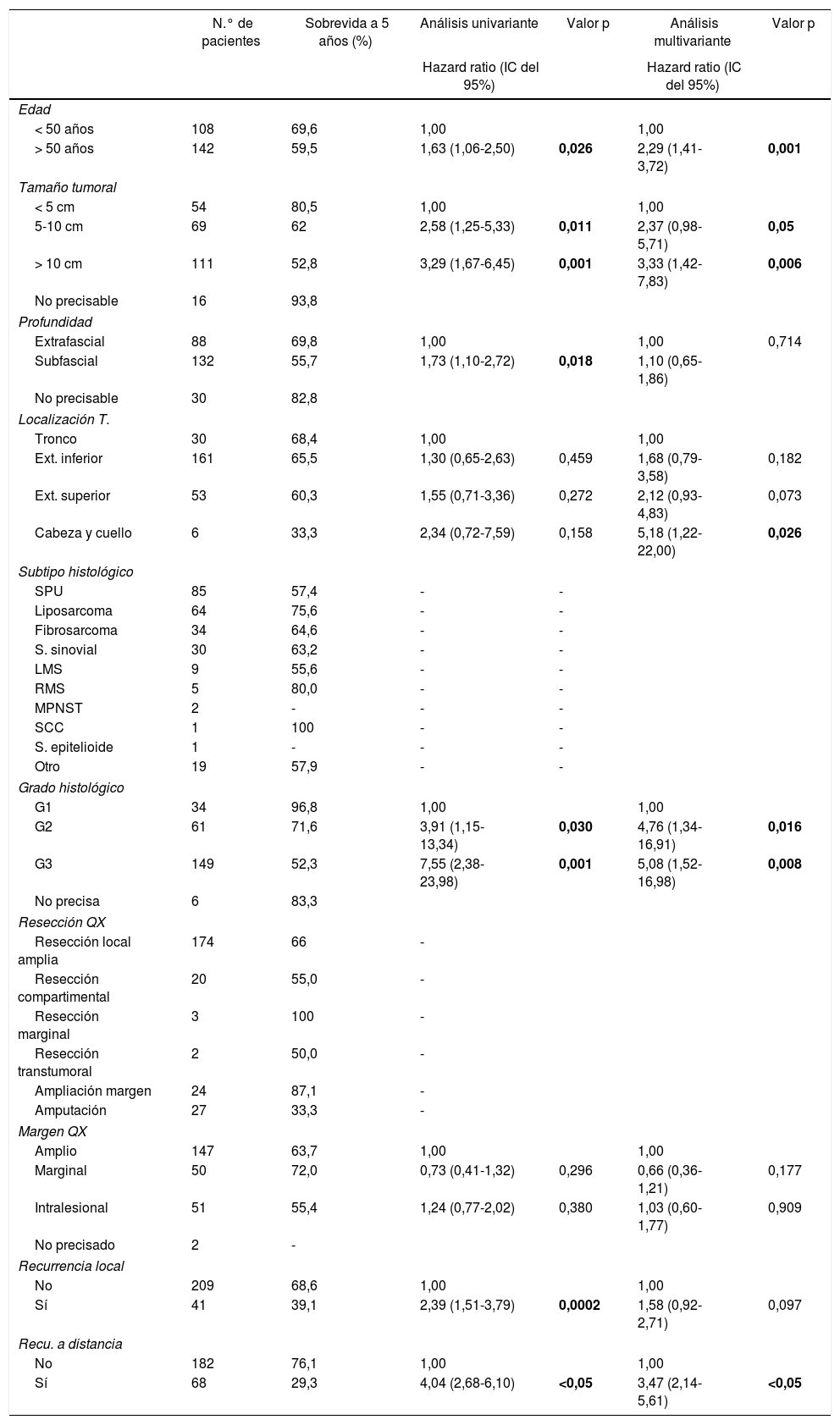
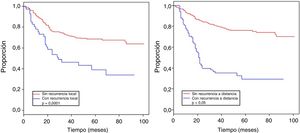
La tabla 4 muestra el análisis proporcional de riesgo de Cox y los rangos ajustados de HR para la SO, basado en 250 casos con relación a las variables: edad, tamaño tumoral, profundidad de infiltración tumoral, localización, subtipo histológico, grado histológico, tipo de resección quirúrgica, márgenes quirúrgicos, recurrencia local y a distancia. En el análisis los pacientes con edades > 50 años mostraron menor sobrevida (59,5%; HR: 1,63, intervalo de confianza [IC] del 95%, 1,06-2,50, p = 0,026), los tumores en rangos > 5-10cm y > 10cm presentaron peor pronóstico de SO con relación a los de menor diámetro (62%; HR: 2,58; IC del 95%, 1,25-5,33; p = 0,011 y 52,8%; HR: 3,29; IC del 95%, 1,67-6,45; p = 0,001) (fig. 2); el compromiso de infiltración tumoral: tumores subfasciales presentaron menor sobrevida (55,7%; HR: 1,73; IC del 95%, 1,10-2,72; p = 0,018). En la evaluación del sitio anatómico de presentación, no se observó diferencia estadística para la SO; sin embargo, en el análisis multivariado se muestra como una variable a considerar, presentando los tumores de cabeza y cuello 5veces más riesgo de muerte que en otras localizaciones (HR: 5,18; IC del 95%, 1,22-22,00; p = 0,026). Los subtipos histológicos que mostraron la menor tasa de SO fueron: el tumor maligno de la vaina del nervio periférico (MPNST) y el sarcoma epitelioide; sin embargo, por el limitado número de pacientes en algunos subtipos histológicos, no se pudo realizar un análisis estadístico. A pesar de ello, se observó que los tumores de grado nuclear alto (G2 y G3), presentaron un peor pronóstico (71,6%; HR: 3,91; IC del 95%, 1,15-13,34; p = 0,030 y 52,3%; HR: 7,55; IC del 95%, 2,38-23,9; p = 0,001) (fig. 2). La cirugía amputativa presentó menor SO comparada con la cirugía de preservación de miembros (33% vs. 66% en pacientes con resección local amplia) y los márgenes quirúrgicos analizados mostraron una afectación en la SO de los pacientes con bordes comprometidos (55,4%; HR: 1,24; IC del 95%, 0,77-2,02; p = 0,38). La tasa de recurrencia local y a distancia (39,1% y 24%, respectivamente) redujo los rangos de SO significativamente en estos pacientes (39,1%; HR: 2,39; IC del 95%, 1,51-3,79; p = 0,0002 y 29,3%; HR: 4,04; IC del 95%, 2,68-6,10, p < 0,05) (fig. 3).
Sobrevida global y modelos de riesgo proporcionales (N = 250)
| N.° de pacientes | Sobrevida a 5 años (%) | Análisis univariante | Valor p | Análisis multivariante | Valor p | |
|---|---|---|---|---|---|---|
| Hazard ratio (IC del 95%) | Hazard ratio (IC del 95%) | |||||
| Edad | ||||||
| < 50 años | 108 | 69,6 | 1,00 | 1,00 | ||
| > 50 años | 142 | 59,5 | 1,63 (1,06-2,50) | 0,026 | 2,29 (1,41-3,72) | 0,001 |
| Tamaño tumoral | ||||||
| < 5 cm | 54 | 80,5 | 1,00 | 1,00 | ||
| 5-10 cm | 69 | 62 | 2,58 (1,25-5,33) | 0,011 | 2,37 (0,98-5,71) | 0,05 |
| > 10 cm | 111 | 52,8 | 3,29 (1,67-6,45) | 0,001 | 3,33 (1,42-7,83) | 0,006 |
| No precisable | 16 | 93,8 | ||||
| Profundidad | ||||||
| Extrafascial | 88 | 69,8 | 1,00 | 1,00 | 0,714 | |
| Subfascial | 132 | 55,7 | 1,73 (1,10-2,72) | 0,018 | 1,10 (0,65-1,86) | |
| No precisable | 30 | 82,8 | ||||
| Localización T. | ||||||
| Tronco | 30 | 68,4 | 1,00 | 1,00 | ||
| Ext. inferior | 161 | 65,5 | 1,30 (0,65-2,63) | 0,459 | 1,68 (0,79-3,58) | 0,182 |
| Ext. superior | 53 | 60,3 | 1,55 (0,71-3,36) | 0,272 | 2,12 (0,93-4,83) | 0,073 |
| Cabeza y cuello | 6 | 33,3 | 2,34 (0,72-7,59) | 0,158 | 5,18 (1,22-22,00) | 0,026 |
| Subtipo histológico | ||||||
| SPU | 85 | 57,4 | - | - | ||
| Liposarcoma | 64 | 75,6 | - | - | ||
| Fibrosarcoma | 34 | 64,6 | - | - | ||
| S. sinovial | 30 | 63,2 | - | - | ||
| LMS | 9 | 55,6 | - | - | ||
| RMS | 5 | 80,0 | - | - | ||
| MPNST | 2 | - | - | - | ||
| SCC | 1 | 100 | - | - | ||
| S. epitelioide | 1 | - | - | - | ||
| Otro | 19 | 57,9 | - | - | ||
| Grado histológico | ||||||
| G1 | 34 | 96,8 | 1,00 | 1,00 | ||
| G2 | 61 | 71,6 | 3,91 (1,15-13,34) | 0,030 | 4,76 (1,34-16,91) | 0,016 |
| G3 | 149 | 52,3 | 7,55 (2,38-23,98) | 0,001 | 5,08 (1,52-16,98) | 0,008 |
| No precisa | 6 | 83,3 | ||||
| Resección QX | ||||||
| Resección local amplia | 174 | 66 | - | |||
| Resección compartimental | 20 | 55,0 | - | |||
| Resección marginal | 3 | 100 | - | |||
| Resección transtumoral | 2 | 50,0 | - | |||
| Ampliación margen | 24 | 87,1 | - | |||
| Amputación | 27 | 33,3 | - | |||
| Margen QX | ||||||
| Amplio | 147 | 63,7 | 1,00 | 1,00 | ||
| Marginal | 50 | 72,0 | 0,73 (0,41-1,32) | 0,296 | 0,66 (0,36-1,21) | 0,177 |
| Intralesional | 51 | 55,4 | 1,24 (0,77-2,02) | 0,380 | 1,03 (0,60-1,77) | 0,909 |
| No precisado | 2 | - | ||||
| Recurrencia local | ||||||
| No | 209 | 68,6 | 1,00 | 1,00 | ||
| Sí | 41 | 39,1 | 2,39 (1,51-3,79) | 0,0002 | 1,58 (0,92-2,71) | 0,097 |
| Recu. a distancia | ||||||
| No | 182 | 76,1 | 1,00 | 1,00 | ||
| Sí | 68 | 29,3 | 4,04 (2,68-6,10) | <0,05 | 3,47 (2,14-5,61) | <0,05 |
LMS: leiomiosarcoma; MPNST: tumor maligno de la vaina del nervio periférico; QT: quimioterapia; RMS: rabdomiosarcoma; S.: sarcoma; SCC: sarcoma de células claras; SPU: sarcoma pleomórfico indiferenciado.
Los datos con significancia estadística se encuentran resaltados con negrita en la tabla de valoración estadística.
El estudio muestra las características clínicas y el tratamiento, así como factores que influyen significativamente en la sobrevida de 250 pacientes tratados en un instituto oncológico de Latinoamérica (INEN) durante el periodo 2009-2013; refleja, además, el tratamiento multidisciplinario de esta patología, siguiendo los estándares internacionales de tratamiento5.
Las características clínicas analizadas presentaron una relación hombre/mujer al momento del diagnóstico de 1,5/1, con predominio del género masculino; a nivel nacional, los pacientes > 60 años representan un 9,2% de la población6; a pesar de ello, los SFTS muestran una elevación en la tasa de incidencia a partir de los 50 años, con un pico a los 70 años, siendo esta variable de impacto en la SO de los pacientes (HR: 1,63; IC del 95%, 1,06-2,50), similar a lo descrito por Brennan et al.7, lo cual podría estar relacionado con comorbilidades y el estatus funcional de este grupo etario. El diámetro tumoral (T), la infiltración tumoral en profundidad y el grado nuclear de los SFTS son factores oncológicos importantes para la estadificación AJCC3; en el registro se evidenciaron estadios clínicos avanzados, predominando el EC III (30,8%), que se correlacionó con tumores de diámetros mayores o iguales a 5cm (72%), subfasciales (52,8%), de grados nucleares 2 y 3 (71,6% y 52,3%, respectivamente); fueron variables con impacto significativo en la sobrevida de estos pacientes en el análisis univariado y multivariado. La localización anatómica más frecuente fue la extremidad inferior (64,4%), similar a lo descrito en una serie de casos reportada a nivel nacional8, siendo importante esta variable en el análisis multivariado, mostrando un incremento en el riesgo de muerte y en las localizaciones de cabeza y cuello; esto guarda relación con los subtipos registrados en este sitio anatómico (SPU, fibrosarcoma), los cuales presentan características de crecimiento acelerado, capacidad de infiltración de estructuras vasculares y nerviosas, así como la dificultad quirúrgica de obtener bordes amplios y de resecciones agresivas por la anatomía critica del área de cabeza y cuello9.
Los procedimientos quirúrgicos siguen siendo la piedra angular del tratamiento en los SFTS; sin embargo, se han visto modificados en el tiempo en busca de preservar la funcionalidad; se ha descrito la seguridad oncológica de la cirugía conservadora de miembros en múltiples publicaciones10-12, la cual fue empleada en la mayoría de las intervenciones quirúrgicas (resección local amplia 69,6%), siguiendo los abordajes recomendados según el sitio anatómico11,13. La utilización de tratamiento neoadyuvante varía según diversos registros de centros oncológicos (2-52%)14, mostrándose un porcentaje del 4,8% en la data actual; dicho porcentaje puede estar infravalorado, tomándose en cuenta que el presente estudio retrospectivo no consideró a aquellos pacientes que progresaron y no fueron tributarios a tratamiento quirúrgico (criterio de exclusión); se valoró el porcentaje de complicaciones cutáneas descrito en el tratamiento neoadyuvante con radioterapia (35%)15 y se optó por cirugías de conservación con reconstrucción quirúrgica de defectos extensos a causa de estadios clínicos avanzados en el 24,4% de pacientes, en quienes se presentó el mayor porcentaje de complicaciones quirúrgicas, las cuales no tuvieron impacto en la sobrevida de los pacientes.
El tratamiento adyuvante incluyó la radioterapia que, junto con la cirugía de preservación de miembros, permite evitar procedimientos amputativos, logrando un control local del 85,6%, lo cual se encuentra entre los rangos descritos por diversos autores (85-90%)16-18. El esquema más utilizado fue de 6.000 CGys en 30 sesiones, similar a lo reportado por O'Sullivan et al.19. El tratamiento sistémico fue utilizado, en vista de los estadios avanzados reportado, siendo el esquema ifosfamida asociado a adriamicina el de mayor frecuencia (32,4%), los cuales son recomendados a nivel internacional20,21, con rangos de respuesta que varían entre el 20 y el 25% en comparación con los regímenes de agentes únicos (< 10%)22.
La importancia de obtener un adecuado control local en los SFTS implica considerar varios factores, ya mencionados: el estadio, el tamaño tumoral, el grado, el sitio anatómico, la obtención de bordes quirúrgicos apropiados, la terapia neoadyuvante y adyuvante; se obtuvo un porcentaje del 39,1% de recurrencia local de enfermedad, a pesar del tratamiento multidisciplinario; se han descrito rangos variables de recurrencia local a nivel mundial, que oscilan entre el 7 y el 24%23; esto estaría relacionado al elevado número de estadios avanzados de nuestra población. La recurrencia a distancia se presentó en el 29,3%, siendo la metástasis pulmonar la más frecuente (90,4%), lo cual es ampliamente descrito en la característica de diseminación hematógena de esta enfermedad24; tanto la recurrencia a distancia como la recurrencia local tuvieron impacto significativo en la sobrevida de los pacientes (tabla 4), similar a lo descrito por Brennan et al.25 y Pisters et al.26, lo cual expone la necesidad de planificación y de tratamiento multidisciplinario, en busca de mejorar la sobrevida de los pacientes con SFTS27.
Se ha descrito la estadística de los pacientes con SFTS, mostrando sus características epidemiológicas y clínicas, el tratamiento y los factores pronóstico de sobrevida, basado en el registro del Instituto de Enfermedades Neoplásicas (INEN, Perú), lo cual permite comprender la importancia de la terapia multidisciplinaria y obtener datos actualizados del comportamiento de los SFTS y de las variables de impacto en la sobrevida de pacientes de Latinoamérica.
Conflicto de interesesLos autores declaramos no presentar conflicto de intereses en el presente trabajo científico.