El presente caso refleja nuestra experiencia en el uso de la terapia de presión negativa intermitente (TPNI) e instilación de antibióticos en un paciente sometido a múltiples intervenciones quirúrgicas a raíz de un hematoma renal sobreinfectado, que ocasionó una fascitis necrosante de pared abdominal y espacio retroperitoneal. Creemos que los excelentes resultados obtenidos pueden propiciar la investigación de esta herramienta potencialmente valiosa.
Se trata de un varón de 58 años ingresado en 04/2012 por sepsis urinaria con un hematoma subcapsular renal derecho tras biopsia renal, tratado de forma conservadora. El paciente reingresa el 02/11/2012 por lumbalgia derecha e hipotensión arterial (92/40mmHg) con insuficiencia renal aguda (creatinina: 5,32mg/dl y urea: 230mg/dl) y leucocitosis (21.400μl y neutrofilia). La tomografía computarizada (TC) identifica una colección heterogénea perirrenal derecha (8,7×6,3×15,2cm) entre fascias pararrenales, afectando el psoas homolateral con compresión renal, compatible con hematoma sobreinfectado. Se inserta un drenaje percutáneo retroperitoneal, a las 24h, con obtención de 310ml de material purulento y se administra imipenem. Sin embargo, el paciente sigue empeorando y la TC del 04/11 muestra extenso enfisema sugestivo de fascitis necrosante. Ante los hallazgos radiológicos, se realiza una lumbotomía exploradora urgente, que identifica una extensa necrosis de fascias pararrenales y se realiza necrosectomía hasta psoas homolateral con nefrectomía parcial superior. Intraoperatoriamente, el paciente presenta shock mixto (séptico/hipovolémico) con síndrome compartimental intraabdominal, precisando una nefrectomía total derecha seguida de embolización de la arteria renal por hemorragia en las primeras 24h postoperatorias. La anatomía patológica halla un tumor de células claras (14mm).
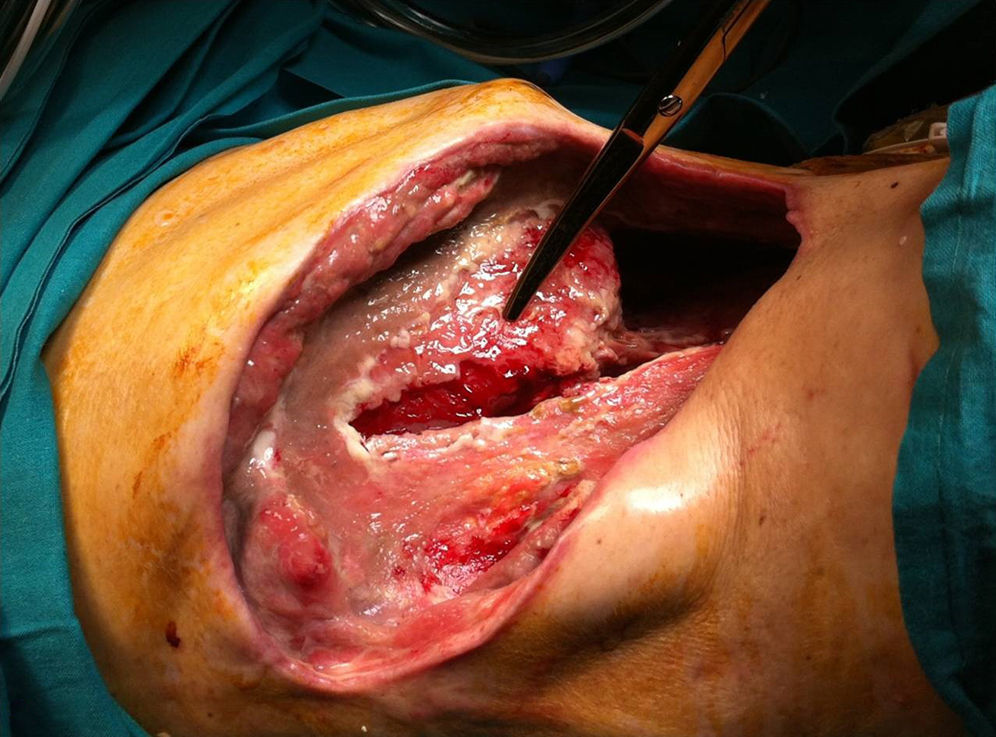
El paciente ingresa en la UCI el 06/11 y se amplía la terapia con daptomicina, metronidazol, vancomicina y fidaxomicina oral por desarrollo de colitis seudomembranosa (C. difficile) y cultivo positivo para E. faecium. El 29/11, el paciente precisa nueva revisión quirúrgica por empeoramiento analítico (leucocitosis; 35.000μl) y necrosis de la herida, momento en que se inicia terapia presión negativa (TPN) continua a −125mmHg (VAC®; KCI, Austin, TX, EE.UU.). En el recambio de VAC® del 04/12, se identifica un megacolon tóxico y fístula fecal a través del VAC®, por lo que se convierte a laparotomía media urgente que objetiva una peritonitis fecaloidea secundaria a perforación cecal. Se realiza colectomía total e ileostomía terminal. Tras varios recambios, el 28/12 se retira la terapia VAC® por buena evolución, prosiguiendo con cura húmeda. Sin embargo, se revisa de nuevo en quirófano por evolución tórpida el 09/01/2013, identificando una fascitis retroperitoneal con miositis de la pared abdominal con un amplio defecto de pared con exposición hepática (fig. 1). Durante este tiempo, se trata con meropenem y linezolid que se desescala a ciprofloxacino ev (400mg/12h durante 25 días) por cultivo positivo persistente para E. faecalis, E. aerogenes y K. pneumoniae, a los que se añade teicoplanina (400mg/24h durante 35 días) y fluconazol por variación de sensibilidad en el antibiograma. Ante la persistencia de cultivos positivos, el 07/02 se inicia TPNI con instilación de gentamicina (240mg/500ml con ciclo de 3min de irrigación y 2min de aspiración, durante 33 días) y, posteriormente, con cefoxitina (mismo régimen, durante 15 días). Tras 8 recambios del sistema, se obtiene un buen tejido de granulación en toda la superficie (fig. 2). Finalmente, el 25/03 se retira la TPN y se reconstruye la pared abdominal con una malla Bio-A® (Gore & Associates, Bio-A® Tissue Reinforcement, EE.UU.) con recuperación funcional excelente a los 19 días.
Existen varias situaciones donde es recomendable el uso de la TPN por sus conocidos beneficios: mejora la perfusión tisular, promueve la formación de tejido de granulación y el inóculo bacteriano1. La TPN proporciona un sistema cerrado y elimina el exceso de fluidos promoviendo la curación de la herida, por lo que acelera la cicatrización de la misma y reduce su volumen2,3. Se ha considerado tratamiento de elección en el abdomen abierto para el control de daños y cuando es necesario repetidas revisiones de la laparostomía4. No obstante, la TPNI (3/2min on-off) parece obtener picos de flujos sanguíneos mejores y más duraderos. La formación de tejido de granulación en comparación es un 63,5% mayor, lo que conlleva mayor proliferación endotelial y angiogénesis1. La instilación consiste en la aplicación de una esponja perforada adaptada a la herida con un apósito sellante cubriendo la extensión de la herida y piel circundante con aplicación de presión durante 2min a −125mmHg y períodos de 3min de irrigación antibiótica a través del tubo de succión. La antibioticoterapia tópica genera controversia, pero ya se aplica en un buen número de especialidades quirúrgicas4–6. La combinación de TPNI e irrigación con antibióticos ha sido descrita de forma esporádica en la literatura, no obstante se ha empezado a usar en cirugía abdominal y se han descritos casos como el D’Hondt et al.7 los resultados de los cuales son alentadores y podrían indicar su uso en el síndrome compartimental abdominal, dehiscencia de sutura de herida postoperatoria o defectos de pared secundarios a fascitis necrosantes8.
Nuestro equipo cree que la TPNI con instilación podría estar indicada en pacientes con persistencia de la contaminación bacteriana a pesar de la antibioticoterapia sistémica adecuada7,9. Los antibióticos y la dosis dilucional más adecuadas, y el momento ideal para iniciar la instilación serán sin duda objeto de intensa investigación en un futuro inmediato.