Antes de que el trasplante hepático fuera una opción terapéutica ampliamente disponible, la tasa de mortalidad del fallo hepático agudo alcanzaba el 85%. En la actualidad, el fallo hepático agudo es una indicación de trasplante relativamente frecuente, pero sus resultados en este contexto son peores cuando se comparan con los de las enfermedades hepáticas crónicas. En este trabajo, tratamos las indicaciones y contraindicaciones para el trasplante hepático urgente. También examinamos el papel del trasplante hepático auxiliar, del incompatible-ABO y del trasplante hepático urgente con donante vivo, así como la utilidad de la realización de una hepatectomía total y un shunt portocava cuando existe síndrome de hígado tóxico en el paciente en alerta cero.
Before liver transplantation became widely applicable as a treatment option, the mortality rate for acute liver failure was as high as 85%. Today, acute liver failure is a relatively common transplant indication in some settings, but the results of liver transplantation in this context appear to be worse than those for chronic forms of liver disease. In this review, we discuss the indications and contraindications for urgent liver transplantation. In particular, we consider the roles of auxiliary, ABO-incompatible, and urgent living donor liver transplantation and address the management of a «status 1» patient with total hepatectomy and portocaval shunt for toxic liver syndrome.
El fallo hepático agudo (FHA) es una de las situaciones más dramáticas que se observan en medicina. Un factor o suceso inductivo origina una necrosis hepática masiva y una plétora de signos y síntomas clínicos secundarios, que incluyen ictericia notable y deterioro neurológico severo, en un periodo de días o semanas. Históricamente, el pronóstico del FHA era demoledor, aunque los avances en materia de cuidados al paciente y el advenimiento y subsiguiente aplicación del trasplante hepático han supuesto mejoras considerables en cuanto a supervivencia. Aunque no existen estudios controlados y aleatorizados que demuestren con evidencia irrefutable la eficacia del trasplante hepático para tratar el FHA, dichos estudios no son justificables desde un punto de vista ético. En la actualidad, la mayor dificultad del manejo del FHA sigue siendo el conocimiento de cuándo pueden bastar los cuidados de soporte, o cuándo se hace improbable la recuperación sin trasplante. En este artículo de revisión, tratamos el modo de enfocar el dilema, así como el papel que pueden desempeñar las formas no tradicionales de trasplante hepático en este contexto.
Fallo hepático agudoEl fallo hepático agudo es un trastorno multisistémico en el que se produce una deficiencia repentina y severa de la función hepática, con o sin encefalopatía, en un paciente sin historia de enfermedad hepática crónica1. En el mundo desarrollado, existen de 1 a 6 casos de FHA por millón de personas al año2–4. Basándonos en su presentación, el FHA puede clasificarse como hiperagudo, agudo, o subagudo, según el tiempo transcurrido entre el desarrollo de ictericia y el inicio del fallo hepático. Sin embargo, la importancia de esta clasificación reside menos en la evolución temporal y más en su asociación con la causa subyacente de la enfermedad5,6.
EtiologíaEn general, la lesión inducida por fármacos es la causa predominante del FHA en los Estados Unidos y en la mayoría de Europa occidental, mientras que las causas virales predominan en el entorno de países en desarrollo7. El grupo español de estudio del FHA ha demostrado que en España no prevalece ninguna etiología particular, con los siguientes porcentajes: hepatitis vírica 37%, causa desconocida 32%, reacciones farmacológicas o tóxicas 20%, correspondiendo el resto a etiologías variadas4.
Aunque representa únicamente una pequeña proporción de casos en España (6%), la intoxicación por acetaminofeno/paracetamol (APAP) es la causa más común del FHA en EE. UU. y el Reino Unido, y su aparición es característicamente hiperaguda8. La lesión hepática es normalmente proporcional a la dosis de APAP consumida. Aunque en la actualidad la mayoría de los casos de FHA inducido por APAP se asocian a muy buenas tasas de recuperación espontánea, otros que cumplen ciertos criterios clínicos, tales como pH arterial < 7,25-7,30 a pesar de la reanimación con líquidos, suponen un elevado riesgo de rápido deterioro y muerte9,10.
Las reacciones idiosincrásicas, que se producen con fármacos diferentes a APAP, no guardan una gran relación con la cantidad consumida. Muchos casos se producen en los primeros 6 meses posteriores al inicio del consumo del fármaco. A pesar de que menos del 10% de los pacientes afectados evolucionarán a FHA, hasta el 80% de aquellos que lo hacen fallecerán, o precisarán un trasplante hepático urgente. Por lo general, el FHA inducido por fármacos se produce en pacientes mayores y cursa de forma subaguda. La ictericia profunda, la elevada tasa de aminotransferasas y la edad avanzada se asocian a unas tasas de mortalidad particularmente altas11–14.
La hepatitis vírica se ha convertido en una causa infrecuente de FHA en EE. UU., donde aproximadamente el 8 y el 4% de los casos se deben a infecciones agudas por virus de hepatitis B (VHB) y de hepatitis A (VHA), respectivamente8. Sin embargo, el VHB representa el 30% del FHA en ciertas partes de Europa y es la causa principal en Asia, África subsahariana y la cuenca Amazónica4,15–18. Aunque menos del 4% de los casos de infección aguda por VHB evolucionan a FHA, la tasa de mortalidad asociada al FHA inducido por VHB es superior a la asociada a la hepatitis por VHA y VHE. El VHB tiene un periodo superior de incubación y pródromo que otras causas de hepatitis vírica y se asocia en los pacientes mayores a un peor pronóstico.
De los cerca de 1,5 millones de casos de VHA agudo por año, < 1% derivan a fallo hepático. El FHA inducido por VHA es más severo en adultos, quienes desarrollan más comúnmente la enfermedad subaguda19. El VHE es la causa más común de FHA en India, Pakistán, China y el Sudeste asiático20. Es más común en mujeres embarazadas, particularmente durante el tercer trimestre, y puede transmitirse verticalmente y originar FHA en el neonato. Otras causas víricas del FHA son infrecuentes e incluyen herpes simplex 1 y 2, herpesvirus humano 6, varicela zóster, Epstein Barr, citomegalovirus y parvovirus B19.
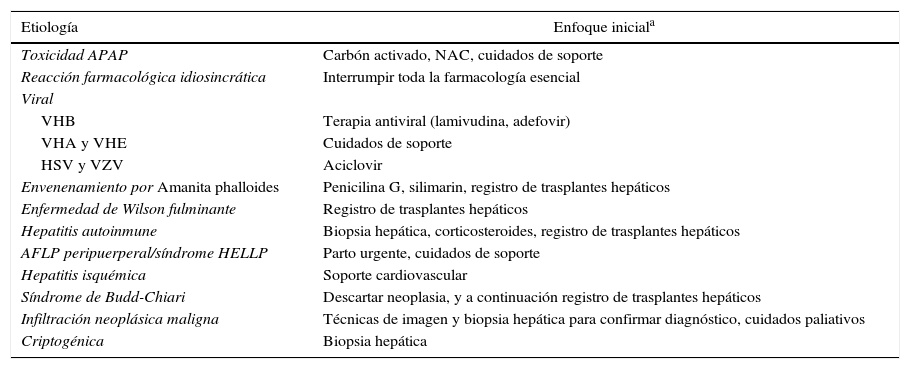
Otras causas menos comunes del FHA incluyen: envenenamiento por Amanita phalloides21,22, enfermedad de Wilson fulminante23,24, hepatitis autoinmune25–27, hígado graso agudo, hemólisis del embarazo con elevación de las enzimas hepáticas y disminución de las plaquetas (síndrome HELLP), hepatitis isquémica, trombosis aguda de la vena hepática (síndrome de Budd-Chiari)28 e infiltración por neoplasia maligna. Dependiendo de la localización geográfica, cerca del 18-35% de los casos puede no tener una causa identificable4,8,19. Los casos criptogénicos del FHA se asocian a una baja supervivencia solo con terapia médica, normalmente se presentan en forma subaguda y precisan con frecuencia un trasplante hepático urgente29,30. En la tabla 1 se relacionan las diferentes causas del FHA y el enfoque terapéutico inicial recomendado para cada una de ellas.
Causas más frecuentes de fallo hepático agudo y enfoque terapéutico inicial recomendado para cada una de ellas
| Etiología | Enfoque iniciala |
|---|---|
| Toxicidad APAP | Carbón activado, NAC, cuidados de soporte |
| Reacción farmacológica idiosincrática | Interrumpir toda la farmacología esencial |
| Viral | |
| VHB | Terapia antiviral (lamivudina, adefovir) |
| VHA y VHE | Cuidados de soporte |
| HSV y VZV | Aciclovir |
| Envenenamiento por Amanita phalloides | Penicilina G, silimarin, registro de trasplantes hepáticos |
| Enfermedad de Wilson fulminante | Registro de trasplantes hepáticos |
| Hepatitis autoinmune | Biopsia hepática, corticosteroides, registro de trasplantes hepáticos |
| AFLP peripuerperal/síndrome HELLP | Parto urgente, cuidados de soporte |
| Hepatitis isquémica | Soporte cardiovascular |
| Síndrome de Budd-Chiari | Descartar neoplasia, y a continuación registro de trasplantes hepáticos |
| Infiltración neoplásica maligna | Técnicas de imagen y biopsia hepática para confirmar diagnóstico, cuidados paliativos |
| Criptogénica | Biopsia hepática |
AFLP: hígado graso agudo del embarazo; APAP: acetaminofeno/paracetamol; HELLP: hemólisis, elevación de enzimas hepáticas, descenso de plaquetas; HSV: virus del herpes simplex; NAC: N-acetilcisteína; VHA: virus de la hepatitis A; VHB: virus de la hepatitis B; VHE: virus de la hepatitis E.
Quizá el mayor dilema asociado al trasplante hepático por FHA es su indicación, ya que si esta se realiza de forma temprana existe el riesgo de practicar un trasplante a un paciente con una disfunción hepática potencialmente reversible, y someterle de forma innecesaria a una cirugía compleja y a inmunosupresión de por vida. De igual modo, existe el riesgo de realizar un uso erróneo de un recurso finito, como en el caso de un órgano trasplantable. Por otro lado, la indicación tardía de un trasplante hepático supone el riesgo de practicar el trasplante a un paciente que ya ha desarrollado sepsis irreversible, fallo orgánico multisistémico o daño cerebral. También se corre el riesgo de muerte del paciente mientras aguarda el trasplante10,31–33. Sin embargo, independientemente de la decisión última, debería someterse a evaluación a todos los pacientes que presentan FHA tan pronto como sea posible.
La supervivencia espontánea se produce en el 40-56% de los pacientes con FHA8,34–36; debe identificarse tempranamente a aquellos que no logran regeneración suficiente en el curso de su enfermedad. La supervivencia sin trasplante de los pacientes con FHA es mala en las personas mayores con presentación subaguda o encefalopatía hepática severa8. Otras indicaciones para el trasplante hepático por FHA podrían incluir el deterioro agudo del estado mental, la disfunción orgánica multisistémica y la hipoglucemia37.
La etiología del FHA es quizá el factor más importante a la hora de predecir la supervivencia espontánea. En general, los resultados son mejores para el FHA asociado a intoxicación por APAP, VHA, isquemia hepática y embarazo (≥ 50% de supervivencia libre de trasplante) que para VHB, reacciones farmacológicas idiosincráticas, enfermedad de Wilson o causas criptogénicas (< 25% de supervivencia libre de trasplante)8,38.
Se han desarrollado diversos modelos pronóstico para determinar la probabilidad de supervivencia espontánea en el FHA (tabla 2). Entre ellos, los criterios del Hospital Kings College, que incluyen modelos para etiologías APAP y no APAP, son los más comúnmente utilizados y más frecuentemente probados9. Incluso la puntuación Model for End-stage Liver Disease (MELD), que se introdujo y validó inicialmente como factor pronóstico en la enfermedad hepática crónica, ha resultado de utilidad para el FHA39,40. En general, a pesar de que la especificidad de estos sistemas de clasificación es adecuada, todos ellos presentan una relativa falta de sensibilidad41, y la precisión varía dependiendo de la localización42. Los modelos dinámicos que tienen en cuenta la evolución de parámetros críticos en el tiempo constituyen un medio atractivo de selección de los pacientes de FHA que se beneficiarían del trasplante, y que permitirían evitar tener que descartar el mismo por no llegar a tiempo43.
Modelos pronósticos para FHA
| Variables utilizadas en modelos pronósticos de FHA no inducido por acetaminofeno | |||||
|---|---|---|---|---|---|
| Kings College9 | Clichy-Villejuif60,76 | Barcelona HCP4,31 | Grupo de estudio de FHA de Japón | CPI39 | |
| PT/INR | ✓ | ✓ | ✓ | ||
| Nivel factor V | ✓ | ||||
| Bilirrubina sérica | ✓ | ✓ | |||
| Creatinina sérica | ✓ | ||||
| Edad | ✓ | ✓ | ✓ | ✓ | |
| Causa | ✓ | ||||
| Duración de la ictericia | ✓ | ✓ | ✓ | ✓ | |
| Grado de encefalopatía | ✓ | ✓ | ✓ | ✓ | |
| Edema cerebral | ✓ | ||||
Criterios para la selección de pacientes con FHA para el trasplante hepático urgente.
CPI: indicadores pronósticos clínicos; HCP: Hospital Clínic i Provincial; INR: ratio internacional normalizado; PT: tiempo de protrombina.
El trasplante hepático urgente es el único tratamiento efectivo para las formas avanzadas del FHA. Dicha situación representa el 6-9% de todos los trasplantes hepáticos realizados en EE. UU. y Europa44,45. En España, el FHA fue indicado en el 4,7% de los trasplantes hepáticos realizados entre 1984 y 2015, cifra que ha permanecido estable durante dicho periodo de 30años46. Las series han reflejado que el 25-51% de los pacientes ingresados por FHA han sido tratados finalmente mediante trasplante hepático urgente8,47,48. Los criterios actuales de inclusión en registros de trasplantes de Organ Procurement and Transplantation Network/United Network for Organ Sharing para el FHA se incluyen en la tabla 3. En España, los pacientes pueden incluirse en los registros de trasplantes hepáticos por FHA cuando la duración del proceso de la enfermedad es < 8 semanas y el paciente no tiene enfermedad hepática crónica subyacente49.
Criterios de Organ Procurement and Transplantation Network/United Network for Organ Sharing para el registro de pacientes con FHA para trasplante hepático (alerta cero)
| Esperanza de vida sin trasplante hepático < 7 días |
| Aparición de encefalopatía hepática en el plazo de 8 semanas desde el inicio de los primeros síntomas de la enfermedad hepática |
| Ausencia de enfermedad hepática preexistentea |
| Ingreso en la unidad de cuidados intensivos |
| Al menos una de las causas siguientes: |
| Dependencia de la ventilación |
| Terapia de sustitución renal con hemodiálisis intermitente, hemofiltración venovenosa continua, o hemodiálisis venovenosa continua |
| Ratio internacional normalizado > 2 |
Es importante identificar, e incluso eliminar de los registros, a aquellos pacientes que se encuentran demasiado enfermos para beneficiarse de un trasplante hepático. Las contraindicaciones incluyen la edad (dependiendo del centro), el cáncer extrahepático y otras situaciones que podrían repercutir en la supervivencia postrasplante, como son el fallo orgánico severo de tipo cardiaco, pulmonar, o multisistémico (infusión continua de norepinefrina>1μg/kg/min, PEEP>12cm H2O y FiO2>60%, presión arterial pulmonar media>40mmHg, o PaO2/FiO2<100), infección bacteriana o fúngica activa y muerte cerebral50–53. Algunas de las contraindicaciones más relativas —tales como la disfunción sistémica orgánica— son sensibles a la edad, ya que en los pacientes más jóvenes existe mayor probabilidad de revertir las complicaciones postoperatoriamente.
Consideraciones especiales para la realización del trasplanteExisten ciertos aspectos que conviene mencionar, con relación a la práctica del trasplante. En general, dada la falta de hipertensión portal y de colaterales portosistémicos de larga duración, la hemorragia intraoperativa es infrecuente. Los parámetros estándar de coagulación miden normal y únicamente los factores procoagulantes, aunque pueden verse reducidos también los niveles de factores anticoagulantes sintetizados hepáticamente (ej.: antitrombina y proteínas C y S). El uso de métodos viscoelásticos para estudiar más ampliamente la coagulación en este contexto indica que existe reequilibrio de hemostasia en muchos pacientes de FHA54.
Las presiones de perfusión intracraneal y cerebral sufren un empeoramiento durante la hepatectomía del hígado nativo, mejoran durante la fase anhepática y vuelven a incrementarse durante la reperfusión55. En la medida de lo posible, la cabeza del paciente deberá mantenerse en alto con respecto al resto del cuerpo durante la cirugía. Deberá prestarse cuidadosa atención al uso de anestésicos volátiles, que pueden originar vasodilatación cerebral53. Aunque la monitorización de la presión intracraneal presenta un riesgo relativamente bajo, su beneficio es poco claro en este contexto56. Se ha pensado que la hipotermia es una técnica que ayuda a prevenir el edema cerebral en el FHA, aunque en un ensayo multicéntrico controlado y aleatorizado no se demostró su beneficio en términos de prevención de la hipertensión intracraneal ni de mejora de la supervivencia57.
Dada la propensión a desarrollar hipoglucemia profunda, se debería monitorizar cuidadosamente la glucosa en sangre en los pacientes con FHA, y corregirse durante la realización del trasplante. También deberán revisarse y restituirse los niveles séricos de potasio, fosfato y magnesio según sea necesario, aunque debe procederse con especial cuidado en los pacientes con fallo renal agudo. En dichos pacientes, probablemente sea necesario realizar hemofiltración venovenosa continua, o hemodiálisis.
Por último, el hígado necrótico constituye un medio excelente de crecimiento microbiano. Aunque el uso empírico de fármacos antibacterianos y antifúngicos en todos los pacientes con FHA es controvertido, muchos facultativos administran dichos agentes a todos los pacientes a los que se indica el trasplante6.
ResultadosLas tasas de supervivencia a un año para el trasplante hepático urgente son por lo general un 7-15% inferiores a las de las indicaciones electivas; sin embargo, son comparables a las observadas en pacientes con enfermedad hepática crónica en cuidados intensivos (64%) o con soporte vital (54%) inmediatamente anterior al trasplante44,45,58,59. Según el Registro Español de Trasplante Hepático, las tasas de supervivencia de injerto y paciente tras el trasplante hepático urgente fueron del 77 y el 85% al mes, y del 70 y el 76% al año, respectivamente. Estas cifras son considerablemente inferiores a las observadas en las indicaciones de trasplante «electivo» (92% injerto y 95% paciente al mes, 81% injerto y 87% paciente al año)46. Muchos fallecimientos se producen dentro de los 3primeros meses y son secundarios a complicaciones neurológicas o sépticas10,34,60–63.
Tres grandes estudios realizados en Europa y EE. UU. han definido las características asociadas a los malos resultados tras el trasplante hepático por FHA10,64,65. La edad del receptor > 45-50 años fue identificada en los 3estudios. Dichos estudios identificaron también los factores asociados a la severidad de la enfermedad en el receptor (la necesidad de soporte vasopresor, o ventilación mecánica, o creatinina>2mg/dL) y la calidad del injerto (edad avanzada del donante, incompatibilidad-ABO, injerto parcial, o esteatosis). Se observó que la acumulación de los factores de riesgo conllevaba una reducción progresiva de la supervivencia.
Alternativas al trasplante hepático convencional en el fallo hepático agudoEl FHA causa un estrés considerable en múltiples sistemas orgánicos, por lo que la mejor oportunidad de satisfacer de manera inmediata las necesidades metabólicas del paciente y revertir la disfunción orgánica multisistémica es utilizar un aloinjerto hepático completo de alta calidad proveniente de un donante del mismo grupo sanguíneo del paciente. Sin embargo, mientras que el paciente de FHA espera un injerto hepático adecuado y óptimo de un donante fallecido, su estado puede deteriorarse, o puede fallecer. Incluso en los centros occidentales con alto número de trasplantes, el 15-30% de los pacientes de FHA en lista de espera para trasplante hepático urgente mueren antes de que pueda realizarse la intervención31,61. Por último, depende de los intensivistas y cirujanos la evaluación de los riesgos y beneficios de la espera, frente a la realización del trasplante con un injerto hepático subóptimo.
Trasplante hepático auxiliarEl trasplante hepático auxiliar (THA) consiste en el implante heterotópico u ortotópico de un injerto hepático parcial o total, junto al que se deja una parte o la totalidad del hígado nativo. El THA es una técnica inadecuada cuando la causa subyacente del fallo hepático es la enfermedad de Wilson fulminante o el síndrome de Budd-Chiari, o cuando se ha desarrollado el síndrome de hígado tóxico. En teoría, el THA debería aportar soporte hepático mientras que el hígado nativo se recupera, en cuyo momento puede retirarse la inmunosupresión y extirparse quirúrgicamente el injerto, o permitir su atrofia. En realidad, este objetivo se logra únicamente en el 25-30% de los pacientes tratados con este procedimiento66–70. Sin embargo, dejar el hígado nativo puede originar un fallo orgánico multisistémico si se necrosa o volverse fibrótico con el tiempo66,71. La regeneración del hígado nativo es más probable en pacientes jóvenes (< 40 años) que padecen enfermedades víricas agudas o sobredosis de APAP, con una presentación hiperaguda71, aunque estos constituyen los mismos pacientes en los que las tasas de recuperación espontánea son también más elevadas.
Cuando el THA se realiza heterotópicamente, el injerto hepático —generalmente parcial— se implanta por debajo del hígado nativo, que se deja en su lugar. Aunque técnicamente es más fácil de realizar, el THA heterotópico se asocia a una tasa elevada de complicaciones postoperatorias67. El injerto heterotópico puede colapsar la vena cava inferior infrahepática y compite también con el hígado nativo en cuanto a circulación portal, lo cual ralentiza la regeneración del hígado nativo y puede originar trombosis de la vena porta67.
En el THA ortotópico, se extirpa una parte del hígado nativo, que se sustituye por un injerto parcial correspondiente (normalmente hemihígado izquierdo o segmento lateral izquierdo en niños, hemihígado derecho en adultos). La circulación se divide entonces entre los hígados auxiliar y nativo, lo que genera preocupación por la distribución final del flujo portal72–74. Se producen complicaciones de tipo biliar, infeccioso y neurológico, a unas tasas más elevadas que las que se producen en el trasplante hepático ortotópico estándar61,68. Al igual que en el trasplante hepático de donante vivo (LDLT), debe aportarse un injerto parcial de tamaño y calidad adecuados (en general, > 1% del peso corporal del receptor). Aunque los resultados tienden a ser mejores para esta técnica que para el THA heterotópico, el THA ortotópico es técnicamente muy exigente, por lo que deben realizarlo únicamente cirujanos con experiencia en cirugía hepática y LDLT.
Trasplante hepático incompatibleOriginalmente, la justificación para realizar un trasplante hepático incompatible-ABO en el contexto del FHA se ha basado en lo siguiente: 1) en presencia de ciertos indicadores clínicos, la mortalidad del FHA era virtualmente del 100%9,75; 2) cuando estaba indicado, el trasplante hepático debía realizarse de inmediato para prevenir el desarrollo de secuelas neurológicas catastróficas76 y 3) no existía terapia hepática sustitutiva de puente para un paciente de FHA en lista de espera para trasplante77. Además, existía evidencia circunstancial y experimental que indicaba que el hígado era relativamente resistente a los efectos de la inmunidad humoral. Sin embargo, la experiencia clínica posterior ha demostrado que el rechazo hiperagudo es, de hecho, un problema serio de los hígados incompatibles-ABO, que se produce en el 20% de los receptores78.
En general, el trasplante hepático incompatible-ABO se asocia a elevadas tasas de complicaciones del receptor, incluyendo rechazo agudo e hiperagudo, trombosis vascular, y lesión biliar78,79. En este contexto, las complicaciones parecen ser relativamente resistentes a la terapia conservadora, siendo necesaria la realización de un retrasplante en la mayoría de las ocasiones78. Además, a pesar de que el uso de plasmaféresis y elevadas dosis de inmunosupresión puede contribuir a disminuir el rechazo, ello se produce a costa del incremento simultáneo de complicaciones infecciosas entre los receptores78. El trasplante hepático incompatible-ABO se asocia también a unas tasas de supervivencia de paciente e injerto considerablemente menores: 75 y 52% frente a > 80 y 75% al mes para injertos idénticos/compatibles-ABO, según datos del Registro Español de Trasplante Hepático46. A la vista de estos datos, muchas Organizaciones Europeas de Trasplante han abandonado la realización del trasplante hepático incompatible-ABO, incluso en situaciones de urgencia58.
Trasplante hepático urgente de donante vivoSe han publicado algunas series de casos sobre el uso de LDLT en pacientes con FHA80–86. La función inmediata del injerto es normalmente excelente cuando se aporta masa hepática adecuada84. Además, el LDLT es la única opción en países que carecen de legislación sobre muerte cerebral. Sin embargo, a fin de evitar una disfunción neurológica progresiva en el receptor, la evaluación del donante se realiza rápidamente, a veces en un tiempo corto de 6 h52,81,84. Muchos donantes potenciales son hermanos, hijos o esposos, quienes se ven influidos por la posible muerte inminente del paciente. La posibilidad de realizar una selección inadecuada del donante es mayor en este contexto, así como la presencia de una coacción sutil al donante dada la gravedad de la situación.
Los pacientes tratados con trasplante hepático urgente dependen de una función del injerto inmediata y excelente en mayor medida que los pacientes tratados con procedimientos electivos. Casi todos los cirujanos que realizan trasplantes urgentes estarían de acuerdo en que en los casos de LDLT urgente se precisa garantizar un tamaño adecuado del injerto (al menos del 0,8% cuando no del 1% del peso corporal del receptor)81,84,86. En los centros médicos de occidente, esto requiere con frecuencia el trasplante de un injerto de hemihígado derecho, que está asociado a unas tasas relativamente superiores de morbilidad del donante (38-44%) y a unas tasas no insignificantes de mortalidad (0,2-0,9%)87–92.
Teniendo en cuenta todos estos factores, algunas organizaciones sanitarias han realizado recomendaciones contra el uso del LDLT en el FHA85,93,94. Sin embargo, existen pocos argumentos acerca de que el LDLT urgente puede jugar un papel esencial en el contexto pediátrico, en el que el procedimiento del donante (normalmente una hepatectomía lateral izquierda) es bastante más seguro y el riesgo de muerte de los donantes es mínimo. Las tasas de supervivencia del receptor a un año oscilan entre el 67 y el 89%, por lo que el LDLT pediátrico urgente parece compensar los riesgos asociados y las cuestiones éticas81,95,96.
Hepatectomía total y shunt portocava por síndrome de hígado tóxicoUna vez que un paciente con FHA es incluido en lista de espera para trasplante, los mayores obstáculos consisten en mantenerlo estable hasta que se disponga de un órgano apropiado. Mientras se espera un nuevo hígado, el hígado necrótico del paciente puede producir componentes vasoactivos tóxicos, que provocan acidosis metabólica refractaria y fallo circulatorio, renal y respiratorio en una situación conocida como «síndrome de hígado tóxico». Sin embargo, se ha propuesto que, extirpando el hígado nativo, podría interrumpirse la producción de toxinas que deterioran el resto de los sistemas del organismo. Ello se vio respaldado mediante la observación de que las presiones de perfusión intracraneal y cerebral tendían a mejorar considerablemente durante la fase anhepática del trasplante hepático55,97–99. Esto ha animado a algunos grupos a practicar trasplantes hepáticos «en 2fases» cuando existe una necrosis hepática que condiciona la aparición del síndrome de hígado tóxico.
En dicho procedimiento en 2tiempos, se realiza una hepatectomía urgente con anterioridad a la llegada del aloinjerto para el trasplante, a menudo sin conocer si se dispondrá de uno. Se crea un shunt portocava, dejando al paciente anhepático. Durante el periodo anhepático, el paciente se halla en situación de hemofiltración o hemodiálisis continua en la unidad de cuidados intensivos, o en el propio quirófano100–102.
En 1993, Ringe et al. describieron la primera y más amplia serie de hepatectomía total y shunt portocava102. Se incluyó a un total de 32 pacientes consecutivos, entre los que la mayor indicación fue síndrome de hígado tóxico (N=25), hemorragia hepática incontrolada (N=6) y tumor no extirpable del conducto biliar proximal (N=1). Trece pacientes fallecieron en fase anhepática, sin reflejar ninguno de ellos signos de estabilización o mejora tras la hepatectomía, y 19 pacientes fueron trasplantados tras un tiempo anhepático medio de 16,5 h (rango 6,6-41,5). Diez de ellos sobrevivieron (31%) y 9 fallecieron, siendo la sepsis la causa de muerte en 7. Los autores apuntaron que, a pesar de que muchos pacientes con traumatismo insalvable y hepatectomía temprana sobrevivieron, la isquemia hepática prolongada y la necrosis hepática extensa conllevaron un incremento del riesgo de muerte debida a sepsis, aun cuando el trasplante hepático pudo realizarse con éxito.
La hepatectomía total y el shunt portocava deben realizarse con anterioridad al inicio de la infección y del fallo orgánico multisistémico e irreversible; sin embargo, el conocimiento de cuándo practicarlo es difícil. En general, la mejora de los parámetros hemodinámicos o la acidosis metabólica y la falta de signos manifiestos de infección al realizar la hepatectomía parecen ser los factores predictivos más importantes del resultado exitoso del trasplante hepático en un segundo tiempo102,103.
ConclusionesEl trasplante hepático ha mejorado considerablemente el pronóstico del FHA pero la mayor dificultad a la que se enfrenta el facultativo reside en el conocimiento del momento adecuado para indicarlo. La valoración continua de la evolución del paciente es esencial para evitar el desarrollo de complicaciones, que afectarán negativamente al curso postoperatorio, o descartarán el trasplante. La mejor opción terapéutica del tratamiento quirúrgico del FHA sigue siendo el trasplante hepático ortotópico con un injerto completo. El THA deberá realizarse con cautela y únicamente en centros con amplia experiencia en cirugía hepática. Deberán evitarse los injertos incompatibles-ABO, en la medida de lo posible. El LDLT urgente plantea dudas, aunque puede ser una buena opción para niños y la única opción para adultos en ciertas partes del mundo. Por último, en ciertos pacientes, la realización oportuna de una hepatectomía y shunt portocava puede resultar beneficiosa, aunque el conocimiento del momento adecuado de practicarla resulta difícil.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.