Introducción
La quimioterapia ha sido el tratamiento estándar del cáncer durante varias décadas. La mayoría de los fármacos quimioterápicos se caracterizan por estar provistos de un amplio perfil de toxicidad y por la aparición de resistencia al tratamiento. Desde hace mucho tiempo se sabe que los tumores, para crecer y desarrollar metástasis, necesitan el desarrollo de un soporte vascular. En los últimos años, la investigación del tratamiento del cáncer se ha centrado de forma predominante en la búsqueda de estrategias dirigidas hacia la inhibición del nuevo lecho vascular del tumor.
Las terapias antiangiogénicas han surgido como una alternativa (o complemento) de gran potencial a las terapias convencionales, como avala el buen funcionamiento de alguno de estos compuestos en las fases iniciales de los estudios clínicos. Sin embargo, el desarrollo de este tipo de agentes debe acompañarse de un mejor entendimiento de su modo de acción.
El objetivo principal de este artículo es hacer una revisión bibliográfica del concepto de angiogénesis y su implicación en el cáncer, así como de las posibilidades terapéuticas derivadas de su inhibición.
Concepto de angiogénesis
Los vasos sanguíneos se han considerado durante mucho tiempo un simple compartimiento de transporte de la sangre. Sin embargo, hoy día se sabe que el tejido vascular es uno de los principales órganos, con una extensión > 900 m2, con una gran actividad metabólica y que ejerce un papel decisivo en el mantenimiento de la integridad del organismo.
Las células del organismo necesitan oxígeno y nutrientes para su supervivencia. En los organismos multicelulares, la distancia límite para la difusión de oxígeno, es decir, la distancia máxima que hay entre una célula y el capilar más cercano es de 100-200 μm. De hecho, si un organismo multicelular quiere crecer más allá de esta distancia necesita formar nuevos vasos1.
El proceso de formación de nuevos vasos a partir de los capilares preexistentes es lo que se denomina angiogénesis. Se diferencia, por tanto, de vasculogénesis, que es la creación de nuevos vasos en el embrión a través de precursores mesodérmicos, como angioblastos y hemangioblastos2.
La angiogénesis es un proceso complejo que involucra a distintas células, componentes solubles y factores de la matriz extracelular (MEC) y tiene gran importancia en una gran variedad de procesos fisiológicos y patológicos del organismo. Así, para el desarrollo embrionario, la curación de las heridas y el ciclo menstrual, procesos que podemos considerar fisiológicos, los tejidos normales precisan la formación de nuevos vasos que aporten los nutrientes y el oxígeno necesarios y, a su vez, retiren los productos de desecho. La regulación de la angiogénesis se lleva a cabo mediante un perfecto equilibrio entre la producción y la liberación de diversos factores estimulantes e inhibidores, que varían en función de las necesidades y el tipo de tejido3.
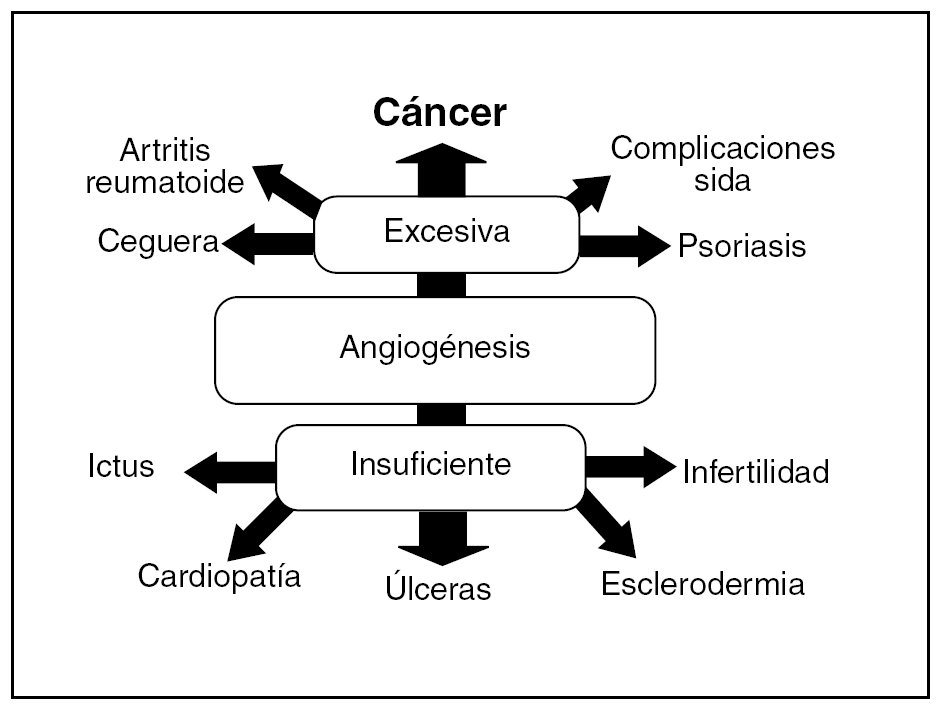
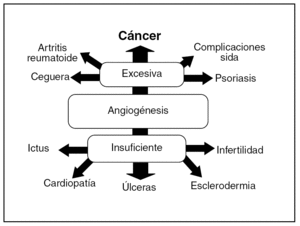
Hay un elevado número de enfermedades caracterizadas por alteraciones del proceso angiogénico debidas a su insuficiencia o a su exceso (fig. 1). De este modo, en la insuficiencia cardíaca, la cardiopatía isquémica, los accidentes cerebrovasculares, la reperfusión del tejido isquémico, las úlceras o las heridas cutáneas que no cicatrizan, etc., hay una neovascularización deficiente y podrían beneficiarse de un aumento de ésta4.
Fig. 1. Algunas enfermedades relacionadas con la angiogénesis.
Por otro lado, en un gran número de enfermedades se produce un exceso de angiogénesis, como sucede en la retinopatía diabética, la degeneración macular, la inflamación crónica (enfermedad inflamatoria intestinal, artritis reumatoide, etc.), la endometriosis y en el crecimiento de los tumores sólidos y hematológicos. Todos estos procesos podrían beneficiarse de la inhibición terapéutica de la angiogénesis5.
Realmente, en la angiogénesis tumoral hay una combinación de angiogénesis y vasculogénesis, y el principal soporte sanguíneo del tumor se deriva de los vasos preexistentes, aunque los precursores de las células endoteliales circulantes pueden contribuir al crecimiento de la masa celular endotelial6.
Factores reguladores de la angiogénesis
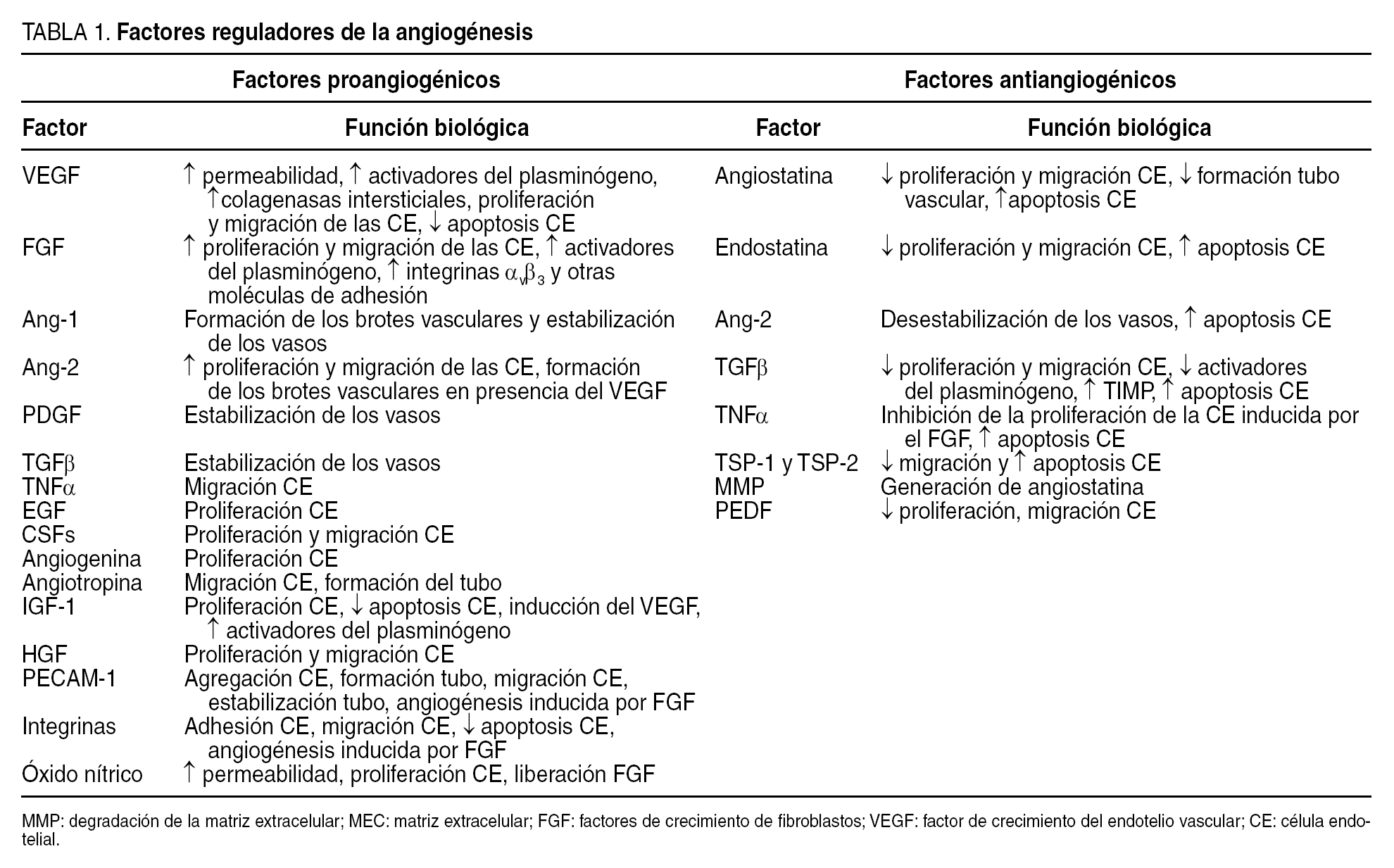
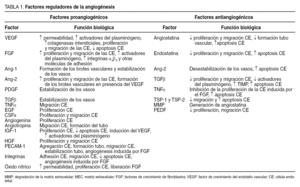
En general, la angiogénesis es un proceso complejo controlado por el equilibrio entre factores proangiogénicos y antiangiogénicos (tabla 1), que pueden coexistir en el mismo tejido. Estos factores pueden ser circulantes o actuar localmente como factores paracrinos.
Hay 2 tipos de factores estimuladores de la angiogénesis: a) factores específicos, liberados por numerosos tipos celulares, que se unen de forma específica a los receptores de las células endoteliales, y b) factores inespecíficos, que se unen a las células endoteliales pero también a otras células. Entre los factores específicos destacan el factor de crecimiento del endotelio vascular (vascular endotelial growth factor [VEGF]) y las angiopoyetinas. Los factores proangiogénicos inespecíficos son numerosos y afectan al crecimiento de la célula endotelial y de otras muchas. Algunos de los más importantes son los factores de crecimiento de fibroblastos (FGF: ácido y básico), factor de crecimiento transformante (TGFα), factor de crecimiento epidérmico (EGF), factor de crecimiento derivado de plaquetas (PDGF), angiogenina, etc.
El VEGF es la molécula mejor caracterizada y más importante del proceso angiogénico. Se han descrito 6 isoformas del VEGF (VEGF121, VEGF145, VEGF165, VEGF183, VEGF189 y VEGF206) que difieren en sus propiedades y funciones. Asimismo, se conocen tres receptores del VEGF: VEGF-R1 (Flt-1), VEGF-R2 (KDR/Flk-1) y VEGF-R3 (KDR/Flt-1). Los 2 principales receptores, Flt-1 y KDR, son expresados en las células endoteliales cuando se encuentran en fase de proliferación. La unión del VEGF con sus receptores, de tipo tirosincinasa, activa diversas vías de señal que intervienen en diferentes pasos en la angiogénesis. Así, el VEGF contribuye a la vasodilatación inicial mediada por óxido nítrico y aumenta la permeabilidad de las células endoteliales, estimula la proliferación y migración de las células endoteliales y disminuye la apoptosis. Además, a través del estímulo de la síntesis de los activadores del plasminógeno, interviene en el remodelado de la matriz perivascular7.
Las angiopoyetinas representan otra familia importante de factores proangiogénicos. Las más decisivas son la Ang-1 y Ang-2, que se unen al receptor de tipo tirosincinasa Tie2 presente en las células endoteliales y favorecen la estabilización y maduración de los vasos neoformados. En presencia del VEGF, la Ang-2 antagoniza los efectos estabilizadores o antiapoptóticos de la Ang-1 sobre las células endoteliales y promueve la proliferación y migración de las células endoteliales. Sin embargo, en ausencia del VEGF, la Ang-2 puede conducir a la apoptosis y a la regresión vascular8.
Sin embargo, el proceso angiogénico no está producido por una sola molécula o familia de moléculas, sino que depende de la cooperación e integración de varios factores que contribuyen a la proliferación, migración, invasión y diferenciación de la célula endotelial.
En el proceso de cambio angiogénico intervienen factores inhibidores endógenos, como la endostatina, la angiostatina, la trombospondina, los inhibidores titulares de las metaloproteasas, etc.9. La endostatina, fragmento de 20 kDa obtenido tras la escisión del colágeno XVIII, es una potente molécula antiangiogénica que inhibe la migración de la célula endotelial e induce su apoptosis. Se une al receptor KDR/Flk-1 e interfiere en el mecanismo de señal del VEGF. La angiostatina, fragmento de 38 kDa del plasminógeno, es otro factor antiangiogénico circulante que inhibe la neovascularización y el crecimiento de las metástasis. La trombospondina 1 (TSP-1) inhibe la angiogénesis y promueve la apoptosis de la célula endotelial a través de un aumento de la expresión de Bax y una disminución de Bcl-2 y de la vía de las caspasas10.
Angiogénesis y cáncer
Hace ya más de un siglo que se observó que la proliferación de los vasos sanguíneos era necesaria para el crecimiento tumoral, pero fue en la década de los setenta, a partir de los trabajos de Judah Folkman, cuando se introdujo el concepto de angiogénesis. Folkman observó que los tumores se desarrollaban hasta alcanzar un tamaño de 1-2 mm3, a partir del cual se estabilizaban y detenían su crecimiento11. La proliferación activa de células tumorales, que habitualmente acompañaba el crecimiento inicial de los tumores, se equilibraba con el proceso de muerte celular producido por el alejamiento del aporte sanguíneo de las células tumorales. Mediante la observación directa del tumor se ha demostrado que el rápido crecimiento exponencial no ocurre hasta que hay una neovascularización y que el proceso de angiogénesis es paralelo al proceso de formación de metástasis12.
Se han propuesto 2 vías por las que los nuevos vasos se pueden formar: a) sprouting o formación de brotes, y b) non sprouting o por inserción de tejido intersticial entre la luz del vaso preexistente1. Además de estos 2 mecanismos, la angiogénesis tumoral puede estar también sustentada por la movilización e incorporación funcional de los precursores de las células hematopoyéticas, que se trasladarían desde la médula ósea para integrarse en los nuevos vasos formados13.
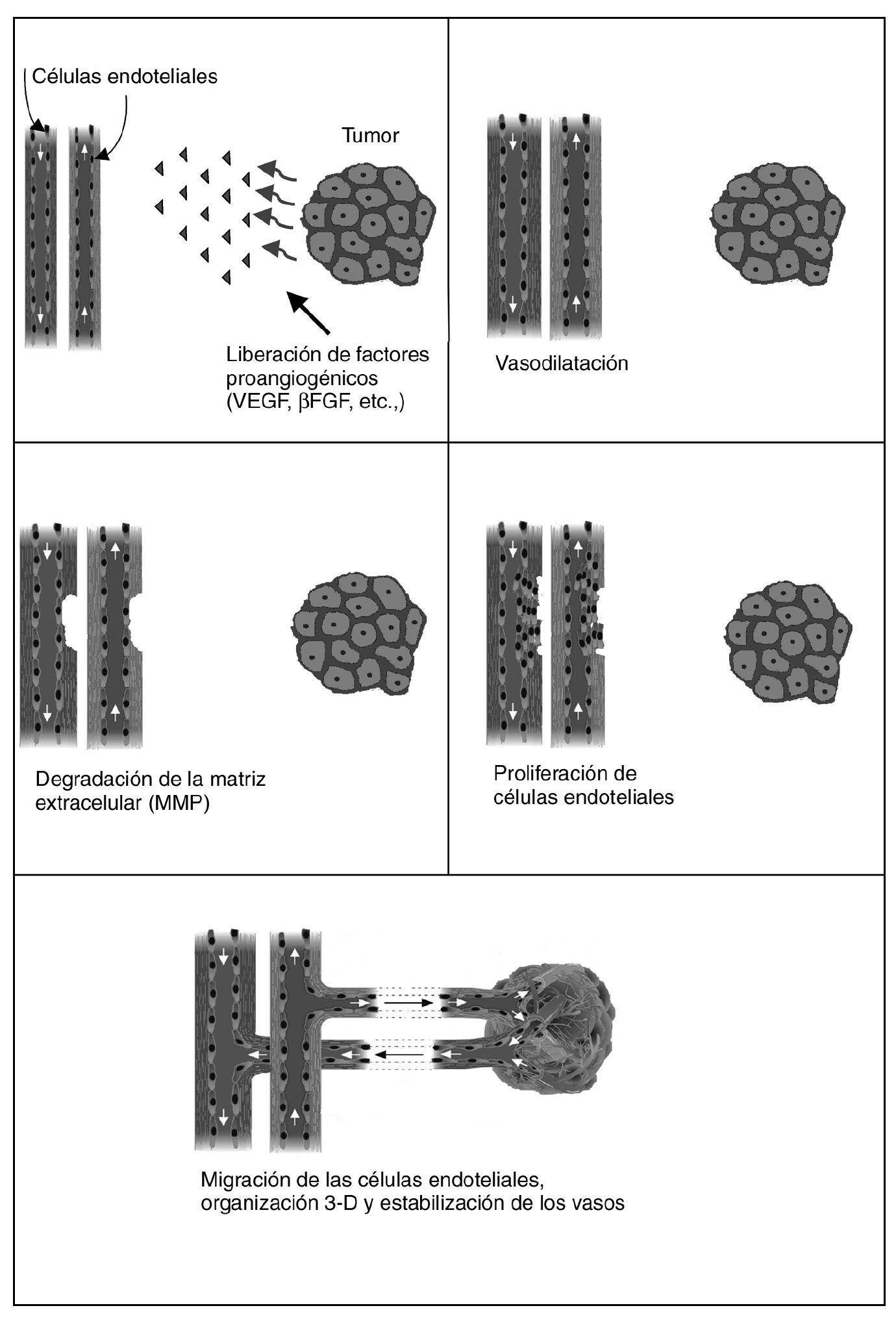
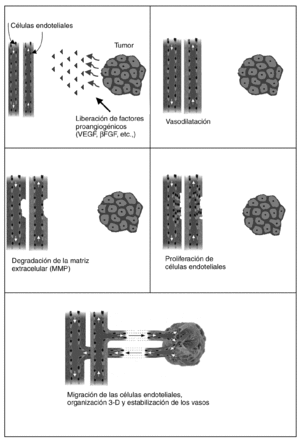
Actualmente se reconocen varias fases para la formación de los vasos (fig. 2). Durante la fase inicial de la angiogénesis se produce una vasodilatación de los vasos preexistentes (capilares y vénulas) mediada por el VEGF, que aumentan su permeabilidad y activan sus células endoteliales (se incrementan las organelas del citoplasma y se reducen las uniones intercelulares). Posteriormente, mediante la acción de diversas enzimas proteolíticas denominadas metaloproteasas, se produce la degradación de la membrana basal y su rotura.
Fig. 2. Fases de la angiogénesis. UEGF: factor de crecimiento del endotelio vascular; βFGF: factor de crecimiento de fibroblastos beta.
En una segunda fase se promueve la proliferación y migración de las células endoteliales para formar los nuevos brotes que penetran entre las redes de las células tumorales en crecimiento. Las células endoteliales migradas se alinean en cordones y brotes sueltos formando una luz entre el brote de avance. Cuando todos los brotes se conectan se restablece el flujo1.
Folkman propuso que la inhibición de la angiogénesis podría ser una estrategia terapéutica efectiva en el tratamiento del cáncer e inició una búsqueda dirigida hacia la purificación de los factores angiogénicos tumorales11.
Activación de la angiogénesis
En la actualidad está ampliamente aceptada la idea del "encendido o interruptor angiogénico" del tumor que, mientras está en la posición "off", hará que el tumor esté en una fase quiescente o dormido, con un tamaño microscópico de 0,2-3 mm3 de diámetro. La fase rápida de crecimiento ocurre cuando éste activa su fenotipo angiogénico12.
Una cuestión pendiente es cómo, cuándo y por qué una célula tumoral durmiente o silente activa el fenotipo angiogénico. En 1996, Hanahan y Folkman propusieron que este "encendido" era el resultado de un desequilibrio entre los factores estimuladores de la angiogénesis y los inhibidores, con un predominio de los primeros de forma sostenida14.
El encendido angiogénico puede estar influido por situaciones ambientales, fundamentalmente la hipoxia, y otros factores del microambiente tumoral, tales como la acidosis y la inflamación. También es importante la base genética del huésped, puesto que pueden ocurrir mutaciones genéticas con activación de protooncogenes (bcl-2, K-ras, H-ras, c-myc, etc.) e inhibición de genes supresores de tumor (p53), que amplifican la expresión de factores proangiogénicos15.
Los tumores de gran tamaño durante su crecimiento pueden experimentar fenómenos de hipoxia y necrosis por compresión de los vasos. La presencia de un pH y una concentración de glucosa bajos en el seno tumoral puede estimular la producción de los factores angiogénicos, especialmente el VEGF12.
Si bien la mayoría de los trabajos apuntan en este sentido, algunos datos preclínicos muestran que la hipoxia y la angiogénesis en el tumor no siempre progresan paralelamente. Aunque la falta de oxigenación es un fuerte estímulo para la angiogénesis del tumor, la patogenia de la hipoxia del tumor es mucho más complicada y puede que no sea necesaria para que se produzca la neovascularización16.
Factor nuclear kappa β
El factor nuclear kappa β (nuclear factor kappa β [NF-κβ]) comprende una familia de factores de transcripción inducibles que actúan como importantes reguladores de las respuestas inmunológica e inflamatoria. Fue descubierto en 1986 y desde entonces su estudio ha cobrado cada vez más interés debido a la variedad de genes y respuestas biológicas que controla y a su aparente intervención en gran número de enfermedades, como la aterosclerosis, el asma, la artritis, la enfermedad inflamatoria intestinal, el sida, el cáncer, etc. Algunos de los factores que regulan la angiogénesis (IL-8, TNF, VEGF) son estimulados por la activación del NF-κβ.
El NF-κβ se activa en respuesta a oncogenes, proteínas virales, diversos carcinógenos, promotores del tumor, marcadores de estrés oxidativo y estímulos inflamatorios. Su activación, por un lado, controla la expresión de genes que median en la transformación, la proliferación, la invasión, la angiogénesis y la metástasis y, por otro, la apotosis, la inmunidad y la hematopoyesis. Numerosos estudios han mostrado que la activación del NF-κβ protege a las células de la apoptosis inducida por el TNF y otros estímulos. Este efecto antiapoptótico es de tipo transcripcional y activa la expresión de genes antiapoptóticos, como TRAF1 y 2, c-IAP1 y 2, Bcl-2, Bcl-xL, IEX-1 y XIAP, y también puede antagonizar la función del p5317. Aunque el NF-κβ es necesario para el funcionamiento normal del sistema inmunológico y la hematopoyesis, no obstante, su desregulación está implicada en gran variedad de tumores en los que se sobreexpresa el NF-κβ.
Muchas compañías farmacéuticas están desarrollando inhibidores de NF-κβ para el tratamiento del cáncer; sin embargo, sería necesario prestar atención a la naturaleza dual del NF-κβ, donde tanto su activación como inactivación pueden contribuir a la formación de tumores, dependiendo de las circunstancias18.
Tratamiento antiangiogénico del cáncer
En los últimos 50 años, la estrategia predominante del tratamiento del cáncer se ha centrado en la célula tumoral. De este modo, cualquier fármaco o sustancia capaz de matar a las células tumorales in vitro era, por definición, un candidato para el tratamiento quimioterapéutico in vivo.
El tratamiento antiangiogénico realizaría la acción antitumoral de forma indirecta mediante la inhibición de la vascularización del tumor e impidiendo de esta forma que se le aporten los nutrientes necesarios para su crecimiento y desarrollo. Con este nuevo concepto, la terapéutica antitumoral no se centra únicamente en la célula cancerígena, sino también en su entorno y, sobre todo, en el proceso de formación de nuevos vasos.
El desarrollo de tratamientos antiangiogénicos para el cáncer está avanzando de manera rápida. El primer inhibidor selectivo de la angiogénesis utilizado en ensayos clínicos fue el TNP-470. Actualmente se han descubierto más de 300 inhibidores de la angiogénesis, muchos de ellos en ensayos clínicos en diferentes fases y otros ya aprobados para su utilización clínica19.
Las ventajas teóricas de los fármacos antiangiogénicos son las siguientes:
1. Estos agentes pueden acceder fácilmente a las células endoteliales del tumor, a diferencia de los fármacos cistostáticos, que tienen que penetrar en grandes masas tumorales.
2. Los fármacos antiangiogénicos no producen citopenias ni toxicidad medular y gastrointestinal, por lo que podemos evitar muchas de las toxicidades asociadas con la quimioterapia estándar.
3. Estos fármacos pueden ser muy específicos, por ejemplo, cuando actúan contra moléculas expresadas en la superficie de la célula endotelial activada, pero no en la célula endotelial quiescente u otras células. Sería el ejemplo de los receptores del VEGF, las angiopoyetinas y algunas moléculas de adhesión (integrinas).
4. En teoría no están sujetos a fenómenos de resistencia al tratamiento al actuar sobre las células endoteliales, que son estables genéticamente y no predispuestas a mutaciones. Sin embargo, las nuevas células endoteliales son estructural y funcionalmente anormales y hace poco se ha descrito que pueden adquirir alteraciones citogenéticas en el microambiente tumoral20. El gen supresor de tumor p53 se encuentra inactivado en la mayoría de los cánceres humanos y las células tumorales deficientes en p53 experimentan una reducción en la tasa de apoptosis bajo condiciones hipóxicas, circunstancia que podrían disminuir su dependencia del soporte vascular y la respuesta al tratamiento antiangiogénico. De este modo, se ha mostrado que las alteraciones genéticas que disminuían la dependencia vascular de las células tumorales (p. ej., células deficientes en p53) podían influir en la respuesta de los tumores al tratamiento antiangiogénico21.
5. Su espectro de acción puede ser amplio, al no depender del tipo de célula tumoral ni de su fase del ciclo celular.
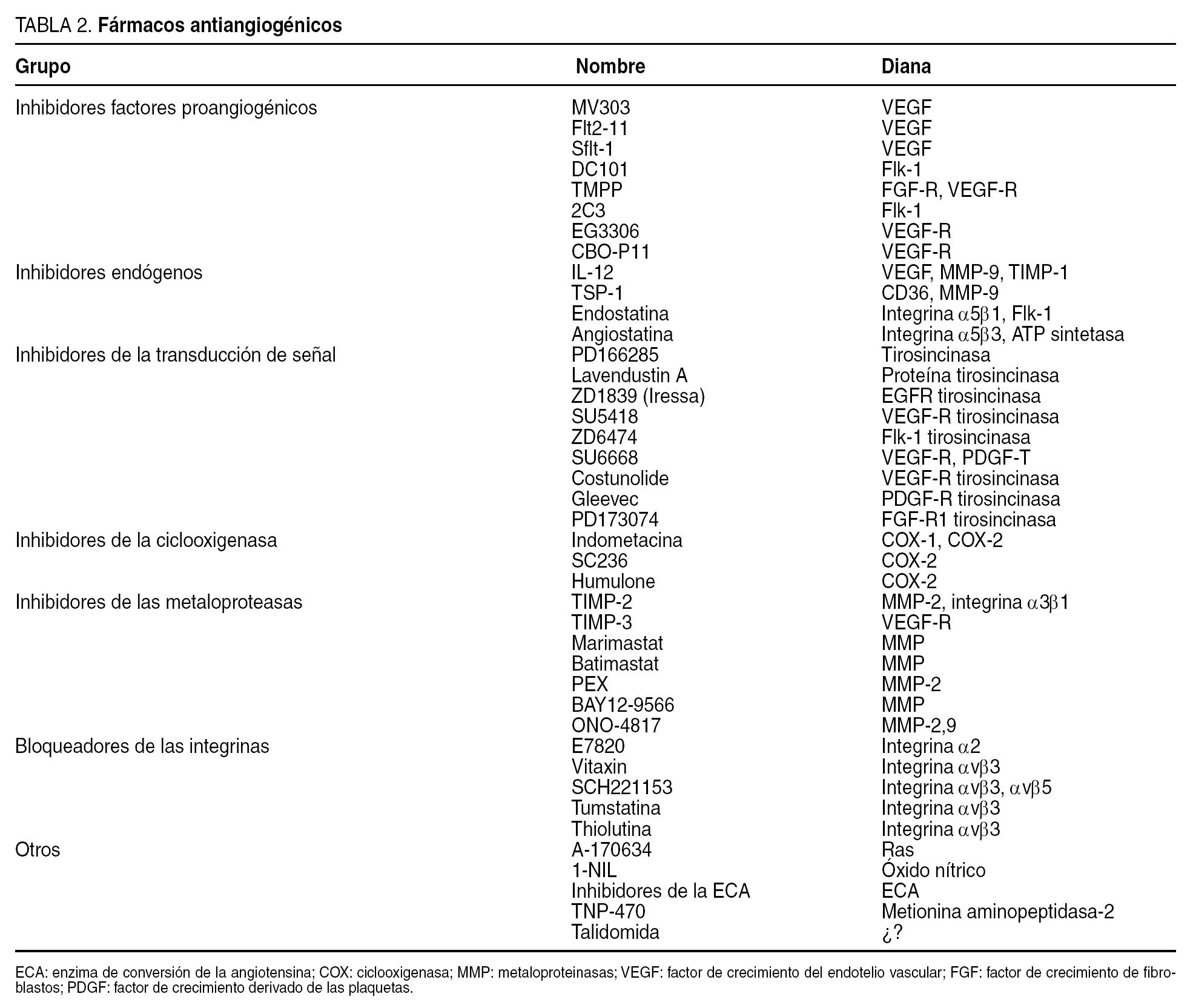
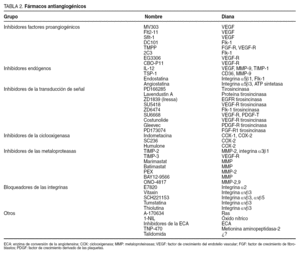
Se ha diseñado una amplia gama de estrategias terapéuticas dirigidas a bloquear uno o más pasos del proceso angiogénico (tabla 2). El término fármaco antiangiogénico se utiliza para describir un grupo diverso de agentes que afectan al crecimiento de nuevos vasos.
Dianas antiangiogénicas
Antagonistas de los factores de crecimiento
Pueden actuar sobre la producción de los factores de crecimiento, sobre el transporte o sobre la unión del factor al receptor. Algunos ejemplos son la suramina, el interferón alfa y la angiozima, que suprimen la producción de los factores de crecimiento angiogénicos.
Hay algunos posibles inconvenientes en los tratamientos dirigidos frente a los factores activadores de la angiogénesis ya que, cuando un tumor crece, produce muchos factores de crecimiento. Si bloqueamos uno de ellos, por ejemplo, el VEGF, el tumor puede escapar a este bloqueo y sintetizar otros factores de crecimiento, como el βFGF. Además, en los tumores hay una gran heterogeneidad microvascular y no todas las células endoteliales activadas expresan los mismos marcadores de superficie. Por ello, un inhibidor de la angiogénesis dirigido hacia un único marcador puede no disminuir el crecimiento del tumor.
En la actualidad, el único agente aprobado por la Food and Drug Administration (FDA) y recientemente por la Unión Europea es el bevacizumab, un anticuerpo monoclonal humanizado anti-VEGF que se une y neutraliza todas las isoformas del VEGF7 y ha mostrado su eficacia asociado con quimioterapia en primera línea del cáncer colorrectal metastático19.
Inhibidores endógenos de la angiogénesis
La angiostatina, el primer agente antiangiogénico endógeno descubierto, inhibe la migración de la célula endotelial e induce su apoptosis. La endostatina, fragmento del colágeno XVIII, inhibe la proliferación y migración de las células endoteliales. La trombospondina 1 (TSP-1), glucoproteína de la MEC, inhibe la proliferación y migración de la célula endotelial a través de la inhibición de la MMP-9 y la movilización del VEGF.
Inhibidores de las metaloproteasas de la matriz
La MEC es un complejo entorno compuesto de proteínas como el fibrinógeno, el colágeno y la gelatina, que aporta el andamiaje de soporte de los tejidos. La MEC continuamente experimenta procesos de remodelado en situaciones fisiológicas y patológicas. La degradación de la MEC se acompaña de un grupo de proteínas denominadas metaloproteasas de la matriz (MMP). Las MMP constituyen una familia de al menos 26 enzimas que se dividen en matrizlisinas, estromalisinas y gelatinasas, de las cuales la MMP-2 (o gelatinasa A) y la MMP-9 (o gelatinasa B) son las más importantes. Hay una serie de inhibidores naturales tisulares de las MMP que se denominan TIMP (tissue inhibitors metallo-proteinases).
Se han desarrollado varios inhibidores de las MMP y se ha investigado su efecto en el crecimiento tumoral y el desarrollo de metástasis18. Los productos más estudiados han sido marimastat, batimastat, pirinomastat y neovastat, que inhiben las MMP al quelar el ion Zn y evitan su unión al lugar catalítico. En modelos animales, estos compuestos inhiben la invasión, la angiogénesis y el crecimiento tumorales, aunque producen toxicidad muscular y articular22.
En general, estos fármacos actuarían tanto frente a la célula endotelial como frente a la invasión de la célula tumoral dentro de la MEC en el seno del tumor primario y en los focos metastásicos.
Fármacos que actúan sobre marcadores de superficie de la célula endotelial
Las integrinas son una gran familia de receptores de la superficie celular expresados por las células endoteliales activadas, para interactuar con su microambiente extracelular. Las interaciones mediadas por las integrinas desempeñan un papel crítico en la regulación de la proliferación, migración y supervivencia celular. Las alteraciones en el repertorio y/o actividad de las integrinas, al igual que en la disponibilidad y en las propiedades estructurales de sus ligandos, intervienen en la regulación de la célula endotelial durante el crecimiento o reparación de los vasos sanguíneos, a veces con efectos diferentes dependiendo del tipo de integrina.
La disrupción de las integrinas por anticuerpos monoclonales o péptidos cíclicos conduce a la activación del p53 y a la apoptosis de la célula endotelial. De forma específica, la αvβ3 es importante para la maduración y supervivencia de los nuevos vasos23.
Algunos ejemplos de estos fármacos son Vitaxin, un anticuerpo humanizado (LM609) dirigido contra la integrina αvβ3 que inhibe la angiogénesis inducida por el FGFβ y favorece la apoptosis de la célula endotelial activada, pero no de la célula endotelial quiescente, EMD121974, que evita la maduración y promueve la apoptosis de la célula endotelial en proliferación, etc.
Inhibidores de la transducción de señal de la célula endotelial
La angiogénesis es promovida a través de citocinas que se unen a receptores de las células endoteliales y desencadenan una cascada de señales. La mayoría de estos receptores son del tipo tirosincinasa y, tras su unión con el factor de crecimiento determinado, son fosforilados y transducen señales proangiogénicas, tales como la vía de las MAPK (mitogen activated protein kinase), FAK (focal adhesión kinase) y AKt.
Se han desarrollado pequeñas moléculas capaces de inhibir la transducción de señal de la célula endotelial. Algunos ejemplos de estos agentes son SU5416, SU101, SU6668 y ZD419024. El ZD1839 (Iressa) es un nuevo agente inhibidor de la angiogénesis que actúa sobre el receptor del factor de crecimiento epidérmico inhibiendo su fosforilación y bloqueando su señal.
Otros inhibidores de la angiogénesis
Hay varios agentes que actúan sobre diferentes dianas y otros con demostrada acción antiangiogénica pero con un mecanismo de acción desconocido. Recientemente han cobrado interés los inhibidores de la ciclooxigenasa-2 (COX-2). La COX-2 es una isoenzima inducible que participa en el metabolismo del ácido araquidónico para formar prostaglandinas. Se ha encontrado un aumento significativo de la concentración de esta enzima en diferentes tumores, por lo que se le ha concedido un papel importante en el proceso de carcinogénesis. Algunos estudios han demostrado el efecto preventivo de los inhibidores de la COX-2 en el cáncer, en especial en el cáncer colorrectal, efecto que estaría mediado por inhibición de la angiogénesis, posiblemente a través de la inhibición de la producción del factor VEGF de la célula endotelial25.
En este cajón de sastre también se incluirían otros agentes, como el TNP-470, la talidomida, los inhibidores de la enzima de conversión de la angiotensina, etc.
TNP-470
El primer inhibidor de la angiogénesis descubierto y uno de los más utilizados en el tratamiento experimental del cáncer es el TNP-470. Es un análogo semisintético de la fumagilina, antibiótico natural secretado por Aspergillus fumigatus fresenius, que fue aislado de forma accidental al observar que cultivos de células endoteliales contaminados por este hongo eran incapaces de proliferar.
Sin embargo, en los primeros trabajos con la fumagilina, su utilidad se vio limitada por los efectos secundarios observados en ratones, los cuales experimentaban de forma sistemática una llamativa pérdida de peso. Por este motivo, se buscaron nuevos análogos sintéticos de ésta. La hidrólisis alcalina de la fumagilina origina varios compuestos, de los que el AGM-1470 (o 6-0-N-cloroacetilcarbaoil-fumagilol) o TNP-470 es el más potente y el que se diseñó para la investigación clínica26.
Se observó que el TNP-470 era 50 veces más potente que la fumagilina para inhibir la proliferación, la migración y la formación del tubo capilar. Además, inhibía la proliferación de la célula endotelial en concentraciones del rango de picogramos, apareciendo toxicidad sobre las células tumorales a concentraciones > 10 μg/ml27.
El TNP-470 inhibe la angiogénesis en varios modelos in vivo y, cuando se administra de forma sistémica, disminuye el crecimiento y la vascularización del tumor primario y de las metástasis en varios cánceres humanos (mama, ovario, próstata, glioblastoma, neurofibrosarcoma) implantados en animales28.
El TNP-470 no sólo ha demostrado actividad cuando se utiliza como agente único, sino que cuando se administra en combinación con quimioterapia y/o radioterapia se obtienen efectos sinérgicos29.
El TNP-470 amplifica la señal de los factores de transcripción nucleares NF-AT, NF-κβ y produce la activación de la proteína 1 en los linfocitos T; además, aumenta la secreción de las interleucinas 2 y 4. Aunque el TNP-470 no inhibe directamente los receptores de los factores VEGF o FGFβ, sí inhibe la angiogénesis inducida por FGFβ. Se ha sugerido que las concentraciones de FGFβ y VEGF pueden servir como marcadores intermedios de angiogénesis, aunque los resultados obtenidos hasta ahora son variables e inconclusos29.
Nuestro equipo30 ha realizado un estudio para comprobar si la inhibición de la angiogénesis tumoral por el TNP-470 va más allá de la simple inhibición de la proliferación de los vasos y de los factores proangiogénicos y se acompaña de alteraciones en la producción de especies reactivas de oxígeno (ROS) y en una reducción del estrés oxidativo. Así, evaluamos el papel desempeñado por estos cambios sobre los efectos terapéuticos antitumorales del inhibidor de la angiogénesis en un modelo experimental de hepatocarcinogénesis en ratas.
Para la inducción de la hepatocarcinogénesis hemos empleado el modelo de Solt y Faber31 modificado. El tratamiento con TNP-470 (inyección subcutánea de 30 mg/kg peso, 3 veces/semana) se comenzó transcurridas 20 semanas desde el inicio y se prolongó durante 8 semanas.
Comprobamos la presencia de alteraciones histopatológicas compatibles con hepatocarcinoma y un incremento de la expresión de la glutatión S-transferasa placentaria en el tejido hepático (marcador bioquímico de lesiones preneoplásicas y neoplásicas). El tratamiento con TNP-470 previene la aparición del hepatocarcinoma y disminuye la expresión de la glutatión S-transferasa. Asimismo, reduce el número de vasos sanguíneos en el seno del tumor y disminuye la concentración sérica del VEGF.
El tratamiento con TNP-470 previno el estrés oxidativo, puesto de manifiesto en la hepatocarcinogénesis, al reducir el incremento de los marcadores de peroxidación lipídica y mantener la actividad de las enzimas antioxidantes. Asimismo, el TNP-470 inhibe la activación del NF-κβ y disminuye la expresión de la enzima óxido nítrico sintetasa inducible. La acción antitumoral del TNP-470 se acompañaba, por tanto, de una acción antiangiogénica y antioxidante30.
Conclusión
En conclusión, las investigaciones que se están realizando en la actualidad sobre los mecanismos de la angiogénesis y su inhibición pueden suponer un importante avance en la terapia contra el cáncer, reduciendo el desarrollo y la metástasis tumoral. A pesar de los potenciales beneficios de la terapia antiangiogénica del cáncer, se hace necesario profundizar más en el conocimiento de los mecanismos de acción, de las dosis más efectivas y de los posibles efectos secundarios de los diferentes fármacos disponibles en la actualidad antes de su utilización en el tratamiento de los pacientes.
Agradecimientos
Agradecemos a la Fundación MMA Investigación Médica su colaboración para continuar la investigación que realiza nuestro equipo sobre el tratamiento del hepatocarcinoma con el antiangiogénico TNP-470.