El tratamiento del carcinoma brongénico es multidisciplinar. Se dispone de diferentes estrategias terapéuticas, siendo la cirugía la que presenta mejores resultados en aquellos pacientes con carcinoma broncogénico en estadios precoces. Otras opciones como la radioterapia estereotáctica quedan relegadas a pacientes con pequeños tumores y mala reserva cardiopulmonar, o a aquellos que rechacen la cirugía. La quimioterapia adyuvante no está justificada en pacientes con enfermedad en estadio i, planteándose doble quimioterapia adyuvante basada en cisplatino tras la cirugía en aquellos con estadios ii y IIIA.
Treatment of lung carcinoma is multidisciplinary. There are different therapeutic strategies available, although surgery shows the best results in those patients with lung carcinoma in early stages. Other options such as stereotactic radiation therapy are relegated to patients with small tumors and poor cardiopulmonary reserve or to those who reject surgery. Adjuvant chemotherapy is not justified in patients with stage i of the disease and so double adjuvant chemotherapy should be considered. This adjuvant chemotherapy should be based on cisplatin after surgery in those patients with stages ii and IIIA.
El cáncer de pulmón de célula no pequeña (CPNM) supone el 85% de los carcinomas de pulmón, dependiendo, el objetivo terapéutico, del estadio de la enfermedad en el momento del diagnóstico: para los pacientes en estadios i, ii y iii el objetivo es la curación, mientras que, en aquellos pacientes en estadio iv, se pretende paliar los síntomas y prolongar la supervivencia.
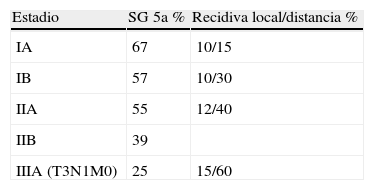
Se consideran carcinomas broncogénicos en estadios iniciales aquellos en los que el tumor está localizado en el pulmón, con o sin afectación ganglionar hiliar (i y ii, y algún caso de IIIA). La supervivencia a los 5 años de pacientes con estadio patológico IA es del 67%, siendo del 57% para el estadio IB y del 25% para el IIIA1 (tabla 1).
En los CPNM en estadios i y ii, las propuestas terapéuticas son fundamentalmente locales (cirugía, radioterapia [RT] convencional, radioterapia corporal estereotáctica [RCE], ablación por radiofrecuencia [ARF], criocirugía y braquiterapia), planteándose en pocos casos tratamientos adyuvantes con quimioterapia.
Tratamiento quirúrgicoSe considera que en torno al 20% de los pacientes con carcinoma broncogénico son diagnosticados en estadio precoz. En estos pacientes el objetivo terapéutico es la curación, la cual se consigue entre el 60 y el 80% en los pacientes en estadio i, y entre el 40 y el 50% en los pacientes en estadio ii.
LobectomíaLa más importante terapia curativa en estos casos es la cirugía, que puede abarcar desde una lobectomía hasta una tumonectomía, según el grado de extensión T y N del tumor.
Desde 1995 se asume que las resecciones sublobares tienen peores resultados en cuanto a recidiva local (el triple) y supervivencia a los 5 años (30% menos) con respecto a las lobectomías, gracias a un ensayo clínico aleatorizado realizado por Ginsgberg en 247 pacientes con CPNM estadio IA que, de forma aleatorizada, fueron operados mediante lobectomía vs. resección sublobar (segmentectomía o resección en cuña)2. Se realizó seguimiento durante 4-5 años. Sin embargo, no se comenta qué pacientes son operados mediante segmentectomía o mediante resección en cuña (con peores resultados), el control evolutivo se realizó mediante Rx Tx (con lo que no se diagnosticaron recidivas precoces en los casos de lobectomía) y el análisis estadístico ha sido criticado. Tras una revisión estadística realizada por Patel en 2003 no se encontraron diferencias estadísticas en supervivencia a los 5 años3.
En 1995, Martini publicó los resultados de 598 pacientes con CPNM estadio i operados mediante cirugía en el Memorial Sloan Ketterin Hospital en un periodo de 15 años. El 4% fueron operados mediante neumonectomía, el 85% mediante lobectomía y el 11% mediante resección sublobar. Solo fueron operados mediante resecciones sublobares aquellos pacientes que no toleraban una cirugía más amplia. Encontraron un índice de recurrencia en las resecciones sublobares del 50% (si bien, en los casos en los que se realizó la estadificación adecuada mediante linfadenectomía, esta recurrencia fue de solo el 5%). Además, se objetivó como factor de riesgo de recurrencia el tamaño tumoral. La supervivencia a los 5 años de las resecciones sublobares fue del 59%, mientras que las lobectomías/neumonectomías alcanzaron el 77%4.
Semejantes resultados fueron publicados en un estudio realizado en la Clínica Mayo en 2002, en el que se compararon los resultados de 100 pacientes con CPNM estadio i y T menor o igual a 1cm, que fueron operados mediante lobectomía, bilobectomía, segmentectomía o resección en cuña. La supervivencia a los 5 años fue del 92% para las lobectomías y del 47% para las resecciones sublobares. Lo interesante es que, al revisar las resecciones sublobares, las segmentectomías anatómicas presentaban una supervivencia del 75% comparadas con el 42% de las resecciones en cuña. De hecho, no se encontraron diferencias significativas entre segmentectomías anatómicas y lobectomías5.
Más recientemente, en diciembre de 2011, Whitson et al., de la Universidad de Minnesota, realizaron un estudio retrospectivo valorando a 6.810 pacientes operados mediante resección pulmonar (segmentectomía anatomía, resección en cuña o lobectomía) con AP de adenoacarcinoma bronquioloalveolar, llegando a la conclusión de que en cualquier caso, la lobectomía presentaba mejores resultados. Tras ajustar los factores de confusión de cada paciente y las características tumorales, objetivaron que la segmentectomía anatómica y la lobectomía gozan de resultados semejantes, no así en el caso de resecciones en cuña, y estos resultados son independientes de la edad, sexo, tamaño tumoral y grado de diferenciación6.
Resecciones sublobaresGracias a la mejora de las técnicas diagnósticas, actualmente se diagnostican con más frecuencia lesiones pequeñas y periféricas, fáciles de extirpar mediante segmentectomía. Por estos motivos se han realizado otros análisis que pretenden comparar nuevamente estas opciones terapéuticas.
En 1995, Landrenau publicó un análisis multicéntrico muy interesante, en el que se comparaban, de forma prospectiva no aleatorizada, los casos de CPNM en estadio i operados mediante lobectomía con aquellos operados mediante resección en cuña abierta o videotoracoscópica. De los 219 pacientes estudiados, a 117 se les realizó lobectomía y a 102 resección en cuña. La tasa de recidiva local fue del 19% para las resecciones sublobares y del 9% para las lobectomías. Sin embargo, no encontró diferencias estadísticamente significativas en cuanto a supervivencia a los 5 años.
Más aún, al valorar la supervivencia cáncer-específica, observó un dato a favor de las resecciones segmentarias al disminuir la morbimortalidad perioperatoria, especialmente en pacientes con mala reserva cardiorrespiratoria. Por último, se comentó ya entonces la posibilidad de RT intraoperatoria en los casos de resección sublobar, para conseguir mejores márgenes de resección y para disminuir la recidiva local7.
El-Sherif publicó en 2006 un análisis retrospectivo con 784 casos de pacientes con CPNM en estadio IA operados mediante lobectomía o segmentectomía, no encontrando diferencias en los resultados8. Otros análisis también retrospectivos han mostrado esos resultados equiparables, pero solo en caso de lesiones menores de 3cm, y muy especialmente menores de 2cm9–11.
Mención especial precisan las lesiones nodulares con patrón radiológico en vidrio deslustrado que han visto incrementada su incidencia gracias a los avances en las técnicas de tomografía y a la implementación de programas de screening mediante tomografía computarizada (TC), como ocurre en Japón. Son muchos los autores, especialmente asiáticos, que han sugerido que en estos casos una resección sublobar sin linfadenectomía es suficiente para el tratamiento de estas lesiones12,13. Según el análisis de Nogushi, las lesiones nodulares con patrón radiológico en vidrio deslustrado puras de menos de 2 cm suelen corresponder con adenocarcinomas sin proliferación fibroblástica, de crecimiento lipídico, sin invasión de la membrana basal, con muy baja probabilidad de metástasis linfática. En estos casos se han publicado supervivencias a los 5 años del 100% tras resección en cuña12.
A partir de ahí, son múltiples los estudios, especialmente japoneses, que obtienen resultados semejantes. De la recopilación de la observación de aquellos estudios retrospectivos que pretenden conocer los resultados oncológicos de las resecciones sublobares, ha surgido la realización de un ensayo clínico aleatorizado en fase iii (908 pacientes), por parte del Cancer and Leukemia Group B. Este estudio se basa en la comparación de pacientes con tumores de 2 cm o menos operados mediante lobectomía versus segmentectomía, con un seguimiento posterior de 3 años14. En cualquier caso, la resección pulmonar segmentaria es la opción en pacientes de edad avanzada15 o con mala reserva cardiopulmonar.
Okada et al. han descrito en un estudio realizado a 1.272 pacientes con CPNM estadio i que, tomando como punto de corte un diámetro igual o menor a 2cm y siendo de localización periférica, las supervivencias a los 5 años tras segmentectomía alcanzan el 90%16. Además, en el caso de tumores sólidos, debe realizarse linfadenectomía como en las resecciones lobares, debido al mayor índice de afectación linfático, con el objetivo de evitar la infraestadificación, con la correspondiente cirugía subóptima17.
Con la idea de minimizar las recurrencias locales en pacientes operados mediante resecciones sublobares, diferentes estudios han estudiado cuáles son los márgenes de resección más adecuados. En un análisis prospectivo multicéntrico realizado por Sawabata et al., se ha determinado que, en pacientes con CPNM operados mediante resección sublobar, no se han encontrado células malignas en los márgenes de resección cuando estos son superiores al diámetro mayor del tumor18. Passlick et al. recomiendan márgenes de al menos 1cm, con análisis intraoperatorio de los mismos y, en caso de ser mayores, recomiendan ampliar la cirugía a bisegmentectomía o a lobectomía19.
Otros cirujanos torácicos recomiendan el uso de braquiterapia intraoperatoria con 125I como terapia adyuvante, con la idea de incrementar los márgenes negativos de resección, siendo baja la toxicidad pulmonar20.
Por otro lado, gracias al perfeccionamiento de la cirugía mínimamente invasiva, pacientes previamente considerados inoperables por su mala reserva ventilatoria han pasado a ser operables, debido al mejor control del dolor postoperatorio y a la menor morbilidad de estas técnicas21.
Además, no se han encontrado diferencias en cuanto a mortalidad, estancia postoperatoria, infección de herida quirúrgica o alteraciones cardiopulmonares al comparar la cirugía abierta con la videotoracoscópica22.
En un estudio prospectivo realizado por Whitson et al., en el que se estudió a 147 pacientes con CPNM en estadio i, operados entre 1998 y 2005, se compararon los resultados obtenidos tras lobectomía abierta y VATS. Se objetivó que, si bien en la lobectomía abierta se obtenían más muestras de regiones ganglionares, la estancia postoperatoria y el índice de neumonías era menor en los operados mediante VATS, y que la supervivencia a los 5 años era la misma23. Esto resultados aportan un rol especial a la lobectomía-VATS en pacientes con comorbilidades.
Criocirugía24La necrosis tumoral inducida mediante congelación ha sido ya utilizada en tumores hepáticos, de mama, renales y prostáticos. En los tumores de origen respiratorio se utilizó inicialmente para el tratamiento de tumores endobronquiales considerados irresecables. Actualmente, gracias a los avances tecnológicos, la crioterapia no solo se puede aplicar de esta manera sino también directamente en el acto quirúrgico, o de forma percutánea. Se considera una técnica segura, siendo infrecuente la hemoptisis y el neumotórax.
Aunque sus indicaciones son más extensas y encaminadas a la enfermedad irresecable, en los casos de CPNM en estadios iniciales, puede ser una opción terapéutica en pequeñas lesiones endobronquiales y en pacientes con lesiones periféricas que no toleran una resección pulmonar.
Para aplicar el tratamiento se requiere de una crioprobeta con la que, mediante 2 o 3 pases de 5-10 min, se consiguen temperaturas de -160°C en el lecho tumoral. En los casos de aplicación directa en el acto quirúrgico y de aplicación percutánea se objetiva una zona de congelación creciente. El tratamiento debe mantenerse hasta que la zona de congelación obtenga unos márgenes de 1cm. La zona necrótica se retira directamente en los casos de tratamiento endoluminal o tratamiento directo intraoperatorio, mientras que en los casos de aplicación percutánea se deja para que sea reabsorbida.
Los resultados de la criocirugía directa son superponibles a la percutánea con una supervivencia media de 5 a 61 meses (media de 23 meses), y una supervivencia general a 1, 2, 3, 4 y 5 años de 68, 52, 34, 26 y 21% respectivamente.
Tratamiento no quirúrgicoRadioterapiaIndicada especialmente en pacientes con CPNM en estadios i y ii, que no son operables, bien por la edad o fundamentalmente por mala reserva respiratoria. En el ensayo clínico RTOG 73-01 se compararon los resultados de pacientes inoperables con CPNM a los que se les aplicó de forma aleatoria diferentes dosis de RT, llegando a la conclusión de que el mejor control local y supervivencia a los 2 años se obtenía con dosis totales de 60Gy administradas en fracciones diarias de 2Gy25.
Al comparar las resecciones sublobares con otras opciones terapéuticas, tales como la RT tradicional en pacientes con mala reserva funcional pulmonar que presentan CPNM en estadio i, se ha evidenciado una superioridad de la cirugía en términos de supervivencia26. En este sentido, la supervivencia media de pacientes con CPNM en estadio i tratados con RT convencional oscila entre el 15 y el 48%, con un índice de recidiva local del 50%27.
La mayor limitación de la RT, probable causante de los peores resultados en comparación con la cirugía, es la lesión de tejido pulmonar sano como consecuencia de altas dosis de radiación. Gracias a las mejoras en TC helicoidal y software actualmente se consigue realizar la localización trimidimensional del tumor y del tejido sano adyacente, mejorando en gran medida la seguridad de la técnica. Otros avances como la coordinación con los movimientos respiratorios (gating), la RT de intensidad modulada y el uso de la PET para guiar la RT hacia el objetivo han permitido mejorar y maximizar la dosis de radiación emitida al tumor, minimizando el daño de tejido sano colindante.
Radioterapia corporal estereotácticaIncorpora múltiples haces de fotones que emiten una alta dosis de radiación hacia un volumen de tumor definido, con un alto nivel de precisión y un pequeño número de fracciones. Además de ser capaz de mejorar la muerte celular causada por la radiación (alteración del ADN), permite disminuir la dosis recibida por los tejidos sanos de alrededor.
La RCE está indicada en tumores de menos de 5cm que precisan coordinar la emisión de radiación hacia la lesión con el ciclo respiratorio. La dosis total de la RCE varía entre 30Gy en una fracción a 60Gy repartidas en 3 o 5 fracciones (hipofraccionamiento extremo), diferencia de las 30 fracciones en 6 semanas de la RT convencional. La dosis efectiva biológica de estos tratamientos es mayor que el valor absoluto de la dosis, de manera que 60Gy en 3 fracciones equivalen a una dosis efectiva biológica de 150Gy emitida en dosis diarias de 2Gy de RT convencional.
En pacientes con CPNM inoperables, la RCE obtiene excelentes resultados con porcentajes de control local del 85 al 96%, y supervivencia a los 5 años del 50%28. Además, los pacientes no necesitan tener una mínima función pulmonar para ser subsidiarios de RCE.
La toxicidad asociada con la RCE generalmente es baja, habiéndose descrito reacciones adversas graves en menos del 5% de los pacientes29. Destacan el daño pulmonar, el dolor torácico y las fracturas costales. Estas complicaciones son más graves al tratar con RCE tumores centrales, debido a la proximidad a bronquios y grandes vasos29.
La indicación fundamental de RCE es el tratamiento de pacientes inoperables con CPNM estadio i30. Dado que la toxicidad es baja y el tratamiento es eficaz, con excelentes tasas de control local, varios investigadores han sugerido que la RCE podría ser eficaz para pacientes de alto riesgo (por lo general tratados con resección sublobar) e incluso, quizás, para pacientes de riesgo quirúrgico estándar (normalmente tratados con lobectomía), sin embargo, se acepta menos. Por tanto, es preciso un estudio. Los investigadores de la American College of Surgeons Oncology Group y el Grupo de Radioterapia Oncológica han colaborado para desarrollar un estudio de fase iii aleatorizado que compare la RCE y la resección sublobar (con o sin braquiterapia) para pacientes de alto riesgo operables con CPNM. Este estudio (American College of Surgeons Oncology Group Z4099/Radiation Therapy Oncology Group 1021) se ha abierto recientemente para el reclutamiento31.
A diferencia de la cirugía, diferentes estudios sobre la calidad de vida tras RCE han mostrado que no existe empeoramiento de aquella, debido a que la RCE minimiza el daño al pulmón sano, sin afectar a la función respiratoria32,33.
Gracias al excelente control local y a la baja toxicidad tras la RCE para pacientes con CPNM en estadios iniciales, algunos pacientes de alto riesgo pero sin contraindicación absoluta para la cirugía están siendo propuestos para este tratamiento. Son los llamados «pacientes operables borderline». En estos casos, la supervivencia es comparable a la de la cirugía34,35. Actualmente se están llevando a cabo ensayos clínicos aleatorizados que comparan la resección quirúrgica con el tratamiento mediante RCE en pacientes con CPNM en estadio i operables y borderlines (NCT00840749 y NCT01336894).
Siguiendo esta línea, se describen cada vez con más frecuencia casos de pacientes borderline que inicialmente no aceptan la cirugía, siendo tratados mediante RCE, que desarrollan posteriormente una recurrencia local, tras la cual son operados mediante la resección quirúrgica de forma satisfactoria, con excelentes resultados36.
Ablación por radiofrecuenciaEn la ARF, se introduce una aguja-electrodo dentro del tumor cancerígeno, gracias a la guía de técnicas de imagen tales como el ultrasonido, la TC o la resonancia magnética nuclear (RMN). A través de esta aguja se emite energía electromagnética mediante corriente alterna de alta frecuencia.
Con ello se consiguen muy altas temperaturas dentro del tumor, con la consecuente necrosis tisular.
Mediante estudios de anatomía patológica se ha demostrado que produce un área de necrosis coagulativa en torno al electrodo. Uno de los principales problemas de la ARF es la pérdida de calor por convección a través de la circulación sanguínea en la zona, el efecto de «disipador de calor». Este efecto es particularmente problemático cuando el tumor se sitúa en la proximidad de vasos sanguíneos de más de 3mm de diámetro.
La complicaciones más frecuentes de la ARF son el neumotórax con necesidad de drenaje (11%), el derrame pleural y la hemorragia intrapulmonar. Sin embargo, no se ha descrito un deterioro significativo de la función pulmonar como consecuencia de la ARF.
La ARF está indicada como tratamiento de CPNM estadio i en pacientes inoperables, o como tratamiento para las recurrencias.
Recientemente, se ha objetivado mediante un análisis prospectivo realizado a pacientes con tumor primario pulmonar o metástasis pulmonares de otros orígenes que, en caso de lesiones menores o iguales a 3,5cm, la ARF consigue la destrucción total en el 80% de las ocasiones (control por imagen), con 70% de supervivencia al año y 48% a los 2 años, para CPNM37, y del 27% a los 5 años. Los resultados de la ARF pueden sufrir modificaciones según el tamaño del tumor, empeorando en lesiones de más de 3cm de diámetro.
También se ha publicado la experiencia con 64 pacientes que no toleraban lobectomía y fueron sometidos de forma no aleatorizada a resección sublobar, crioterapia o ARF. Los resultados de supervivencia general y cáncer-específica fueron semejantes en los 3 grupos38.
Algunos autores defienden la aplicación de la ARF por encima de la RCE, ya que la primera puede realizarse de manera ambulatoria y en una sola sesión. Con la idea de determinar qué técnica es más adecuada, Renaud ha realizado recientemente un metaanálisis. Tras estudiar 90 artículos referentes a la ARF y 112 referentes a RCE, determina que actualmente existe evidencia de que la RCE, en caso de disponer de ella, es la primera elección para el tratamiento de pacientes con CPNM inoperables. No obstante, hasta la fecha no existe ningún estudio prospectivo aleatorizado que compare ambas técnicas39.
Braquiterapia intraoperatoria con 125IYa se ha comentado el beneficio de la braquiterapia intraoperatoria como adyuvante de la cirugía sublobar20 o de la criocirugía40. No solo por la capacidad de ampliar los márgenes de resección, sino porque elimina el problema que supone la coordinación con los movimientos respiratorios de otros tipos de RT y minimiza la toxicidad pulmonar.
El American College of Surgeons Oncology Group (ACOSOG Z4032) está realizando un gran ensayo clínico aleatorizado comparando la segmentectomía o resección en cuña sola o junto con braquiterapia con 125I aplicada a través de un implante de malla de vicryl, en pacientes con CPNM en estadio i (3cm o menos) y mala reserva cardiorrespiratoria41. Durante este estudio se ha objetivado que la exposición a la radiación de médicos y personal durante una segmentectomía y la implantación de la malla de vicryl-125I es muy baja, siendo un método seguro para profesionales sanitarios42. Por otro lado, en este estudio se ha determinado que la braquiterapia intraoperatoria no supone un mayor empeoramiento de la función respiratoria ni un incremento de la estancia hospitalaria, en comparación con la cirugía sola43. Los resultados oncológicos a medio y largo plazo de este estudio están por publicar.
QuimioterapiaLa principal causa de muerte en pacientes con CPNM operados mediante resección pulmonar son las recaídas, debido a micrometástasis no detectadas previamente.
Diferentes ensayos clínicos han determinado la pertinencia de tratamiento quimioterápico adyuvante tras la cirugía:
Estadio IAUn número relativamente pequeño de pacientes con CPNM en estadio IA han sido incluidos en ensayos clínicos aleatorizados de quimioterapia adyuvante. El metaanálisis LACE ha demostrado que el beneficio de la quimioterapia adyuvante varía considerablemente en función del estadio, con un potencial detrimento en el estadio IA44.
Actualmente, la quimioterapia adyuvante no está recomendada en pacientes con CPNM en estadio IA
Estadio IBEl beneficio de la quimioterapia adyuvante en pacientes con CPNM en estadio IB es poco aparente.
No existen pruebas sólidas en ninguno de los ensayos clínicos aleatorizados que defiendan la quimioterapia adyuvante en estos casos.
Existe controversia en el subgrupo de pacientes en estadio IB definidos por el tamaño tumoral. Un análisis no planificado de subgrupo de los datos del CALGB 9633 reveló que en pacientes con tumores de más de 4cm de diámetro sí existía beneficio45. En la reunión anual de ASCO 2009, se informaron los resultados actualizados del ensayo JBR.10, en el que se revisaron los datos del mismo subconjunto. También se concluyó que los pacientes con tumores de más de 4cm mostraban una tendencia no significativa a favor de la quimioterapia adyuvante46. Sin embargo, se debe tener cautela con enfatizar estos resultados, dado que el análisis por subgrupos no estaba planificado. Lo que se ha recomendado es considerar a los pacientes de este subgrupo de forma individualizada para quimioterapia adyuvante, después de una minuciosa discusión de los riesgos y beneficios.
Estadio IISe ha establecido de forma consistente un beneficio de la quimioterapia en pacientes con CPNM en estadio ii. Hasta la fecha, el estudio JBR.10 ha demostrado el mayor beneficio en supervivencia en estos pacientes, con un incremento absoluto de la supervivencia a los 5 años del 20%47. De igual manera, el estudio ANITA ha demostrado un incremento del 13%, y el estudio LACE, del 10%44,48.
Estadio IIIAPara pacientes con CPNM estadio IIIA con resección completa, la quimioterapia adyuvante es claramente beneficiosa. Un incremento absoluto del 16% a los 5 años se ha objetivado en el estudio ANITA48. En el estudio IALT, se ha observado el mayor beneficio en estadios IIIA49. Finalmente, el estudio LACE ha mostrado un incremento del 13% en la supervivencia a los 5 años44.
DiscusiónEl tratamiento del CPNM es multidisciplinar, y varía según la estadificación a la hora del diagnóstico y la situación del paciente.
No cabe duda de que el tratamiento de elección en pacientes con CPNM estadios i y ii es la lobectomía con linfadenectomía hiliar y mediastínica. En pacientes de edad avanzada o con otras comorbilidades, la cirugía VATS puede ayudar a tolerar la lobectomía.
En los pacientes que no toleren la lobectomía, la resección sublobar debe realizarse con márgenes amplios, de al menos el diámetro máximo del tumor. Los pacientes con nódulos en vidrio deslustrado puros menores de 2cm pueden ser operados mediante resección en cuña.
Puede plantearse segmentectomía anatómica en pacientes con CPNM estadio I y T menor o igual a 2cm, sin olvidar la linfadenectomía hiliar y mediastínica. En estos pacientes, conseguir buenos márgenes de resección es crucial para evitar la recurrencia local. Es más, en los casos de márgenes menores de 1cm en el estudio intraoperatorio, se recomienda bisegmentectomía o lobectomía. Sin embargo, actualmente no existen ensayos clínicos aleatorizados que permitan tomar la decisión de ofrecer a pacientes que toleren la cirugía una resección sublobar, por lo que habrá que esperar a los resultados del ensayo clínico aleatorizado en fase iii, del Cancer and Leukemia Group B.
En aquellos pacientes con CPNM en estadio inicial y alto riesgo (EPOC, edad avanzada, etc.) la RCE es la mejor opción. Más aún en pacientes operables borderline que no aceptan el riesgo de la morbimortalidad asociada a la cirugía. En los casos de recidiva tras el tratamiento, estos pacientes pueden ser operados mediante cirugía con intención curativa.
Por otro lado, la quimioterapia es fundamental como tratamiento complementario a la cirugía en pacientes con CPNM en estadios II y IIIA. El tratamiento estándar para los pacientes con CPNM en estadios II y IIIA es la doble quimioterapia adyuvante basada en cisplatino tras la cirugía, para mejorar la supervivencia. Este tratamiento debe iniciarse en los primeros 2-3 meses tras la cirugía, de manera que solo es aplicable a pacientes con buen estado general y sin complicaciones posquirúrgicas. El beneficio para los pacientes con CPNM en estadio IB es menos evidente, probablemente debido a la heterogeneidad de esta población. La última revisión de los criterios de estadificación TNM debería ayudar en la estratificación del riesgo. Si bien la quimioterapia estándar consiste en 4 ciclos, tras la resección pulmonar la toxicidad se ve incrementada, de tal forma que solo el 60-70% de los pacientes consiguen completarla. Entre los efectos adversos destacan neutropenia, anemia, náuseas, vómitos, fatiga y neuropatía40.
Aunque la introducción de la terapia adyuvante representa uno de los avances más significativos en el manejo del CPNM de la última década, los mayores beneficios están por llegar. El futuro para el tratamiento de pacientes con CPNM está cambiando, con nuevas estrategias que emplean el perfil de expresión génica y farmacogenómica para un tratamiento personalizado y para obtener el beneficio terapéutico máximo. Además, como los esfuerzos de investigación continúan para desentrañar los mecanismos moleculares detrás de la tumorigénesis de pulmón, nuevos objetivos se exponen, formando el fundamento para los modernos ensayos clínicos de terapia adyuvante que integran agentes biológicos tales como bevacizumab y erlotinib y la vacuna para MAGE-A3. Si estos enfoques, sustancialmente, mejoran el tratamiento estándar actual de doble quimioterapia adyuvante basada en cisplatino, queda por ver.
Descargo de responsabilidadesParte de este documento se ha obtenido de modificaciones de las siguientes publicaciones:
- 1.
Gadgeel SM, Ramalingam SS, Kalemkerian GP. Treatment of lung cancer. Radiol Clin N Am. 2012;50;961-974.
- 2.
Yagui-Beltrán A, Jablons DM. Optimal surgical management of stage inon-small cell lung cancer in an increasingly aging population: Challenges and recent progress. Expert Rev Respir Med. 2007;1(3):343-353.
Los autores declaran no tener ningún conflicto de intereses.