El carcinoma diferenciado de tiroides incluye 2 tipos tumorales diferentes: el carcinoma papilar (CP) y el folicular (CF) y, aunque similares, su pronóstico es diferente. La infrecuencia del CF ha hecho que habitualmente se analice conjuntamente con el CP, lo cual dificulta conocer su verdadera realidad. En esta revisión se analiza la situación de los diferentes aspectos terapéuticos de esta dolencia. Se revisa cuál es la mejor técnica quirúrgica y la utilidad de realizar vaciamiento ganglionar asociado. Respecto a la ablación posquirúrgica con 131I se evalúan las indicaciones, las dosis y su utilidad. En el resto de terapias se analizan las pocas indicaciones que tiene la radioterapia y la quimioterapia, y la aparición de nuevos fármacos como los inhibidores de la tirosin-cinasa.
Differentiated thyroid carcinoma includes 2 different tumor types, papillary (PC) and follicular carcinoma (FC), and although similar, their prognosis is different. FC is uncommon, and this has led to it often being analyzed together with PC, and therefore the true reality of this tumor is difficult to know. As a result, the diagnostic and therapeutic management and the prognostic factors in differentiated carcinoma are more predictive of PC than FC. In this review we analyze the current state of many of the therapeutic aspects of this pathology. The best surgical technique and the usefulness of associated lymphadenectomy is also analyzed. Regarding post-surgical ablation with 131I, the indications, doses and usefulness are discussed. For the remaining therapies we analyze the few indications for radiotherapy and chemotherapy, and of new drugs such as tyrosine kinase inhibitors.
El carcinoma diferenciado es el tumor tiroideo más frecuente y en la mayoría de casos se asocia a un pronóstico favorable1. Con la denominación de carcinoma diferenciado de tiroides se han incluido dos tipos tumorales con patogenia, biología y clínica bien distintas. La tendencia actual es a considerarlas entidades diferentes. Estos dos tumores son el carcinoma papilar (CP) y el folicular (CF), que aunque similares, tienen pronóstico diferente. Así, el CF está más vascularizado y suele presentar una mayor tasa de invasión vascular y agresividad clínica1.
La incidencia del CF está muy relacionada con el déficit de yodo, por lo que está disminuyendo con la suplementación de yodo1,2. Aunque existen variaciones poblacionales importantes, se estima que su incidencia se sitúa sobre 1-2 casos por cada 100.000 mujeres/año, y sobre 0,4-0,5 casos por cada 100.000 hombres/año. Esta infrecuencia ha hecho que habitualmente se analice conjuntamente con el CP, lo cual dificulta conocer la verdadera realidad de este tumor1. Así, la mayoría de estudios que analizan la utilidad de determinadas pruebas diagnósticas, la efectividad terapéutica de diferentes tratamientos y los factores pronósticos más significativos del carcinoma diferenciado, al incluir en sus series más CP que CF, presentan unos resultados que son más predictivos y útiles para el CP que para el CF3. Pocos estudios tienen el número suficiente de CF para afrontar su estudio independientemente, y entre ellos los resultados discrepan3–5.
En la actualidad el tratamiento del CF se establece en función de la extensión tumoral. Así, los pacientes con mayor extensión o riesgo más elevado de recurrencia son tratados de manera más agresiva y con un seguimiento más estrecho. Sin embargo, en tumores localizados y con bajo riesgo, un tratamiento más conservador es igualmente efectivo1. Además, hay que tener en cuenta los diferentes subtipos de CF existentes, que tienen influencia directa en el pronóstico del paciente (tabla 1).
Tipos histológicos de carcinoma folicular de tiroides
| Variantes | Incidencia % |
|---|---|
| Carcinoma folicular clásico | 83-90 |
| Mínimamente invasivo no angioinvasivo Mínimamente invasivo angioinvasivo Ampliamente invasivo | |
| Carcinoma de células de Hürthle | 2-6 |
| Carcinoma insular o pobremente diferenciado | 10 |
| Carcinoma variante de células claras | <1 |
Existen múltiples controversias en torno al diagnóstico, tratamiento y evolución del CF. El propósito de esta revisión es analizar el estado actual de las diferentes opciones terapéuticas en el CF y determinar cuál es el mejor tratamiento médico y quirúrgico para este grupo de pacientes a partir de la evidencia científica.
Para ello se realizó una doble búsqueda bibliográfica. Por un lado, publicaciones científicas indexadas en las diferentes bases de datos (Pubmed, Embase y Conchrane Library) y, por otro, las guías y documentos de consenso de las diferentes sociedades científicas españolas, europeas y americanas, sobre el tratamiento del CF.
Controversias en el tratamiento quirúrgico del carcinoma folicularUtilidad de los marcadores citológicos moleculares para el diagnóstico preoperatorio y la planificación quirúrgicaLa punción aspiración con aguja fina (PAAF) es en la actualidad el gold standard para el diagnóstico diferencial entre el nódulo benigno y el cáncer tiroideo, dependiendo su sensibilidad en gran parte de la experiencia del citólogo1,6. Sin embargo, el principal problema de esta técnica es la falta de sensibilidad en la evaluación de la neoplasia folicular por su incapacidad para distinguir entre lesiones benignas (adenoma folicular) y malignas (carcinoma folicular de tiroides y la variante folicular del carcinoma papilar)1,7, ya que no puede diagnosticar la invasión vascular ni la capsular1,8. Para mejorar la sensibilidad diagnóstica de la PAAF en la neoplasia folicular, se están analizando técnicas de inmunohistoquímica y de diagnóstico molecular. En este sentido, varias moléculas han sido involucradas en el proceso carcinogénico y propuestas como marcadores de malignidad tiroidea para aumentar la seguridad diagnóstica de la PAAF, como son la telomerasa, la tiroperoxidasa, el queratán-sulfato, el grupo de proteínas de alta mobilidad I (Y) (HMGI[Y]), el antígeno mesotelial de superficie celular HBME-1, las tiroperóxidas, la citoqueratina 19 y la galectina 3 (GAL3)9,10. También se está analizando la expresión de varios genes, habiéndose detectado la expresión de más de 100 genes11. Cabe destacar que la fusión del oncogén PAX8/proliferador de peroxidasa–receptor gamma (PPARγ) se ha identificado en aproximadamente el 25-50% de los CF, produciéndose una traslocación entre las regiones 3p25 y 2q13.
Aunque los avances se van produciendo de manera vertiginosa, con frecuencia los resultados son discrepantes respecto a la utilidad de varios marcadores propuestos como de malignidad12–15. Algunos estudios han mostrado que, en comparación con la utilización de los marcadores de forma aislada, la combinación secuencial de dos marcadores es más útil. En este sentido, la combinacion de GAL3 y HBME-1, o de GAL3 y citoqueratina 19 en el caso de lesiones oncocíticas, mejora la sensibilidad diagnóstica de la PAAF12,14. Actualmente, el uso de marcadores citológicos no es generalizable.
Por último, cabe indicar que el análisis de la mutación BRAF (V600E), aunque ha mostrado su utilidad para la selección de nódulos con citología indeterminada (AUS/FLUS), es muy específico del CP y no del CF, por lo que no es útil para el diagnóstico del CF16–19. Sin embargo, la mutación RAS podría ser importante en la identificación de la variante folicular del CP e incluso en el CF, aunque son precisos más estudios para confirmar estos resultados preliminares20,21.
¿Cuál es la mejor cirugía inicial para el carcinoma folicular?El principial problema que suele presentarse al plantear la cirugía en el CF es que habitualmente se indica la operación con el diagnóstico de neoplasia folicular sin saber que es un carcinoma. Esto condiciona que el diagnóstico definitivo de CF suele tenerse una vez que el paciente ya está operado. Por ello, nos encontramos con un paciente diagnosticado de CF y al que, por lo general, ya se le ha realizado una hemitiroidectomía. En la actualidad, existe consenso y se acepta que la hemitiroidectomía es una cirugía adecuada solo en 2 casos: 1) microcarcinoma (tumor<1cm) unifocal sin invasión vascular ni exposición previa a radiación y 2) CF mínimamente invasivo inferior a 3-4cm sin invasión vascular2,22.
En el resto de los casos, la mayoría de los estudios indican que la lobectomía es un factor independiente que afecta a la recurrencia tumoral y, por ello, aconsejan completar la tiroidectomía, si en la primera cirugía no se realizó una tiroidectomía total23. Sin embargo, dependiendo del tamaño del remanente tiroideo, cuando el riesgo de persistencia de la enfermedad es bajo, una alternativa efectiva frente a la opción de completar la tiroidectomía es la ablación con radioyodo24. En casos en los que se dejó un lóbulo entero, la ablación con 131I no es recomendada, dada su baja efectividad en estos casos. Además, completar la tiroidectomía tiene bajos índices de complicaciones cuando es realizada por cirujanos experimentados, facilita la ablación posquirúrgica con 131I y permite un seguimiento más adecuado25. Algunos autores aceptan la tiroidectomía casi total o técnica de Dunhill, si bien presenta el problema de que el remanente tiroideo va a dificultar la valoración de posibles recidivas a nivel cervical y la ablación con 131I1,2.
Un tema controvertido es cuánto tiempo debe pasar desde la primera cirugía para completar la tiroidectomía. Aunque no hay consenso, Glockzin et al. 26, en una serie de 128 carcinomas tiroideos reintervenidos para completar la tiroidectomía, indican que la morbilidad es menor cuando han pasado al menos 3 meses de la primera cirugía.
Utilidad de la biopsia intraoperatoriaDado que la mayoría de los pacientes con CF se intervienen con el diagnóstico de neoplasia folicular2,27, la biopsia intraoperatoria (BIO) intenta que el procedimiento quirúrgico definitivo pueda decidirse en la primera intervención, evitando una segunda cirugía o una cirugía agresiva innecesaria4. Sin embargo, aunque algunos autores han indicado su utilidad28, la mayoría muestran que no es una técnica coste-eficiente en el diagnóstico del CF29,30. En este sentido, Hamburger y Hamburger31 indican que solo 3 de 359 BIO (0,8%) contribuyeron a la decisión del tratamiento quirúrgico, y Shaha et al.32 muestran limitaciones similares. Además, hay que indicar que existen problemas de reproducibilidad de resultados por diferencias de interpretación interobservador e intraobservador en el diagnóstico histopatológico33. Aunque no es aceptado por la mayoría de patólogos, entre las desventajas de la BIO se ha indicado el deterioro que se produce en la pieza operatoria por el corte para congelación, lo cual puede afectar al estudio posterior en parafina.
A falta de estudios prospectivos aleatorizados (el único que hay indica su escasa utilidad29), la tendencia es a abandonar el uso rutinario de la BIO en las neoplasias foliculares (Bethesda III y IV)34. Algunos autores indican que la BIO debería reservarse para casos donde la exploración quirúrgica hiciera sospechar un carcinoma29,30,34. Por último, cabe indicar que hay grupos que, al no encontrar falsos positivos, aunque sí un alto porcentaje de falsos negativos, la siguen recomendando pues a un grupo de pacientes les evitan una reintervención.
La falta de sensibilidad de la BIO en las neoplasias foliculares de tiroides podría teóricamente mejorarse utilizando técnicas moleculares (ver apartado 1), sin embargo, son precisos estudios que confirmen dicha utilidad.
Tipo de vaciamiento ganglionar a realizarA diferencia del CP, el CF suele tener una menor tendencia a la extensión linfática. Por ello, el vaciamiento ganglionar se indica si se sospecha afectación linfática, bien sea pre- o intraoperatoriamente35. Los beneficios del vaciamiento central profiláctico están discutidos, ya que no hay evidencia de que mejore los índices de recurrencia o mortalidad, y aumenta la morbilidad postoperatoria1,2. Si bien permite una mayor seguridad en la estadificación de la enfermedad.
Cirugía más adecuada para carcinomas mínimamente invasivosAunque la cirugía recomendada en el CF es la tiroidectomía total, el carcinoma mínimante invasivo es el menos agresivo de los CF y su tratamiento puede ser la hemitiroidectomía5,36. Aunque no existe consenso en el tamaño, en los casos en los que se alcanza un tamaño superior a 3-4cm se aconseja completar la tiroidectomía del lado contralateral (tabla 2).
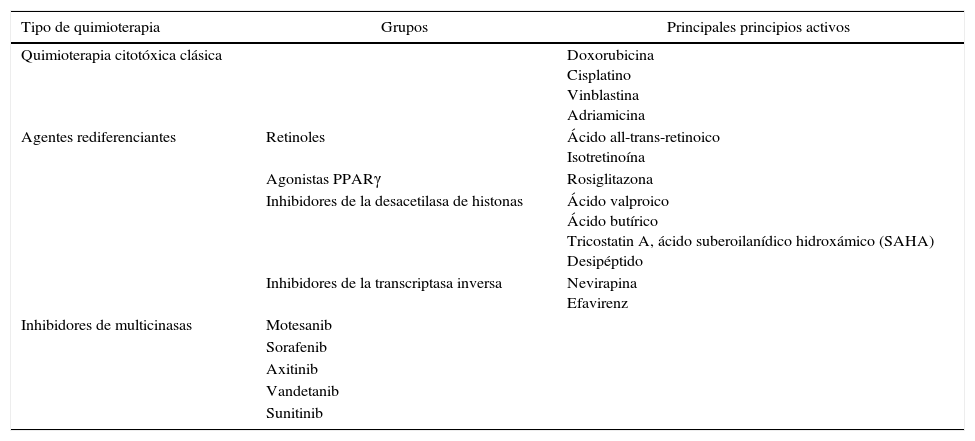
Clasificación de los fármacos potencialmente utilizables en el carcinoma folicular
| Tipo de quimioterapia | Grupos | Principales principios activos |
|---|---|---|
| Quimioterapia citotóxica clásica | Doxorubicina Cisplatino Vinblastina Adriamicina | |
| Agentes rediferenciantes | Retinoles | Ácido all-trans-retinoico Isotretinoína |
| Agonistas PPARγ | Rosiglitazona | |
| Inhibidores de la desacetilasa de histonas | Ácido valproico Ácido butírico Tricostatin A, ácido suberoilanídico hidroxámico (SAHA) Desipéptido | |
| Inhibidores de la transcriptasa inversa | Nevirapina Efavirenz | |
| Inhibidores de multicinasas | Motesanib | |
| Sorafenib | ||
| Axitinib | ||
| Vandetanib | ||
| Sunitinib |
Las últimas clasificaciones tienen en cuenta no solo que los CF sean mínima o ampliamente invasivos, sino también la angioinvasión. Así, se distingue el CF mínimamente invasivo con y sin angioinvasión (tabla 1). Esto es importante, pues los angioinvasivos tienen peor pronóstico y requieren un tratamiento más agresivo37.
Variantes más agresivas del carcinoma folicularEl carcinoma de células de Hürthle u oncocíticas presenta mayor tasa de multicentricidad y diseminación metastásica, sobre todo ganglionar cervical (25% de los casos), aunque también se disemina hacia otros órganos. Dada esta mayor presencia de afectación ganglionar y que suelen ser tumores poco captantes de yodo (la ablación con radioyodo es menos efectiva), clásicamente se ha recomendado una cirugía linfática tal y como se realiza en el CP, aconsejándose vaciamiento central ipsilateral.
Sin embargo, no existe consenso y, a pesar de haberse descrito este mayor riesgo, algunas instituciones, como el College of American Pathologists indican que el comportamiento biológico del carcinoma de Hürthle depende más del tamaño del tumor y extensión que de la propia histología. Por ello lo consideran una variante del CF con un pronóstico similar y consideran que se debe tratar de la misma forma que el estadio equivalente del CF de células no de Hürhtle38,39.
La variante insular o pobremente diferenciada se localiza en la mayoría de los casos en el seno de un bocio multinodular. Se caracteriza por presentar una morfología y un comportamiento intermedios entre los carcinomas diferenciados y el carcinoma anaplásico. El perfil clínico corresponde a una mujer mayor de 50 años, que presenta un crecimiento rápido de una lesión tiroidea preexistente. Se caracteriza por su elevado potencial metastásico y por una alta tasa de recidivas, siendo frecuentes las metástasis ganglionares, pulmonares y óseas al diagnóstico. La mayoría de los pacientes muere en los 3 primeros años después del diagnóstico. El pronóstico depende de la clasificación inicial de TNM, si la cirugía fue completa y si responde al tratamiento con yodo radioactivo40.
Por último, la variante de células claras es una variante más agresiva, pero poco frecuente. Las células claras son células foliculares con cambios metaplásicos con formación mitocondrial de vesículas intracitoplasmáticas, acumulación de glucógeno, de grasa y depósitos de tiroglobulina. La mayoría de los tumores primitivos de células claras se presentan como microfoliculares o trabeculares histológicamente.
En todas estas variantes más agresivas, el tratamiento quirúrgico debe ser más agresivo.
Cirugía más adecuada para el carcinoma localmente avanzadoLa invasión de estructuras cervicales es infrecuente pero incrementa la posibilidad de complicaciones que comprometen la vida del paciente y limita la utilidad de las terapias no quirúrgicas. Por ello, en ausencia de enfermedad diseminada no controlada, la posibilidad de la resección quirúrgica debe ser valorada41. La indicación de la cirugía depende no solo de la resecabilidad local sino también de la condición individual del paciente. Dependiendo de la extensión de la invasión, la técnica puede ser desde una resección traqueal simple hasta una resección compleja laringotraqueal o esofágica4.
Si bien no hay consenso sobre la cirugía óptima para el carcinoma con invasión laringotraqueal, la resección agresiva es generalmente recomendada para reducir la morbilidad y mantener la integridad de la vía aérea41. La enfermedad macroscópica residual tiene un efecto desfavorable en la evolución, sobre todo en los pacientes jóvenes.
Cuál es la mejor opción quirúrgica en las metástasis a distanciaLa mejor opción terapéutica para las metástasis a distancia del CF es la resección, siempre que esta sea accesible42,43. Dicho tratamiento debe completarse, o a veces como único tratamiento, con 131I, siempre que sean lesiones captantes de yodo. En el resto de casos y en casos refractarios al tratamiento con 131I, la mejor opción terapéutica es la radioterapia local42,43. Como norma general estos pacientes precisan un abordaje terapéutico multidisciplinario, pues suelen requerir resección quirúrgica, ablación con 131I, radioterapia y, ocasionalmente, quimioterapia para el control o alivio de los síntomas42,44.
Controversias en la ablación del tejido tiroideo residual posquirúrgico con yodo radiactivo¿Cuándo debe indicarse la ablación con yodo radiactivo?La ablación con 131I permite destruir los restos tiroideos que pudieran quedar en el lecho tiroideo, disminuye las recidivas y facilita el seguimiento con controles de tiroglobulina24,45,46.
En el CF se acepta el uso sistemático del 131I en los casos con enfermedad persistente, invasión vascular y factores de mal pronóstico, ya que reduce el índice de recurrencias. Sin embargo, en los microcarcinomas unifocales y en los carcinomas mínimamente invasivos no angioinvasivos no se ha demostrado ningún beneficio, por lo que no se aconseja la ablación en estos casos. En el resto de casos, que no son de mal pronóstico, pero tampoco son microcarcinomas unifocales ni mínimamente invasivos, no hay consenso sobre su utilidad pues los beneficios son controvertidos.
¿Cuál es la dosis de 131I más efectiva?La dosis de 131I a utilizar puede ser muy variada en función de varios factores. Para utilizar bajas dosis de 131I, entre 30 y 50 mCi, es fundamental que el remanente sea pequeño o inexistente, valorado por una gammagrafía total body usando 2-3 mCi 131I47. La dosis de 30 mCi se hizo bastante popular pues representaba una vía para evitar la hospitalización. Aunque no en todos los países, actualmente se puede realizar la ablación con 131I de forma ambulatoria con dosis de hasta 60 mCi pues la radiación de exposición a las personas cercanas al paciente es mínima.
Es importante la selección adecuada de la dosis pues varios autores muestran que las tasas de éxito de la ablación aumentan con la dosis de 131I, si bien en algunos de ellos las diferencias son mínimas24,47. Así, Johansen K et al.48, en un estudio aleatorizado, muestran que el índice de ablación con 30 mCi es del 81 frente al 84% con 100 mCi. Sin embargo, otro estudio aleatorizado49 muestra que con 30 mCi el índice de ablación completa es del 63%, con 50 mCi del 78%, con 90 mCi del 74% y con 155 mCi del 77%. Recientemente, Schlumberger et al.50 en un estudio aleatorizado fase 3 muestran que, en los pacientes con bajo riesgo, el tratamiento con 131I a basas dosis (30 mCi) es efectivo. En este mismo sentido, el ensayo clínico de Mallick et al.51 muestra que la dosis de 30 mCi puede ser igual de efectiva que la de 100 mCi (85 versus 88,9% de ablación completa, respectivamente).
¿Cuál es el impacto terapéutico de la ablación con 131I?Hay mucha discrepancia de resultados con la ablación con 131I, aunque la mayoría de los autores indican menores índices de recidiva y mortalidad tras la ablación. Posiblemente un factor que justifique estas diferencias sea la extensión de la tiroidectomía realizada, que no es homogénea en todos ellos1,2.
Hay suficiente evidencia científica para indicar que, en tumores de alto riesgo, la recurrencia del carcinoma, la recurrencia a distancia y las muertes por cáncer son significativamente menores tras la ablación con radioyodo 131I que con L-T4 o tratamiento médico solo1,2.
Utilidad de otros tratamientos¿Es útil el tratamiento con hormona tiroidea para obtener la supresión de la TSH?El objetivo teórico de la terapia supresiva de la TSH con L-T4 es inhibir el crecimiento, dependiente de la TSH, del tejido tiroideo que pueda quedar tras el tratamiento inicial. Algunos autores indican que los índices de recurrencia se reducen con el tratamiento con L-tiroxina52, pero el nivel óptimo de TSH requerido es aún incierto. Inicialmente la dosis de L-T4 debería ser suficiente para disminuir las cifras de TSH a ≤ 0,1 mU/l, pues no hay evidencia de que la supresión de la TSH por debajo de este nivel mejore los resultados.
El estudio retrospectivo realizado por Pujol et al.53 muestra que la supervivencia libre de enfermedad se incrementa cuando la TSH está constantemente suprimida (TSH < 0,05 U/ml), siendo el grado de supresión de la TSH un predictor independiente de recurrencia. Sin embargo, un estudio prospectivo con 617 pacientes en el National thyroid cancer treatment cooperative study encontró que el estadio de la enfermedad, la edad del paciente y el tratamiento con 131I eran factores independientes predictores de progresión de la enfermedad, pero no el grado de supresión de la TSH54.
Todo esto es importante pues la supresión de la TSH a niveles indetectables (tirotoxicosis subclínica) no es inocua, y a largo plazo tiene efectos secundarios sobre todo a nivel cardíaco y óseo55. Así, las concentraciones séricas bajas de TSH en individuos de 60 años o más se asocia con un incremento de la mortalidad de cualquier causa, y en particular, de la debida a enfermedades circulatorias y cardiovasculares. Por ello, en estos pacientes se debería evitar la supresión de la TSH. Durante la tirotoxicosis subclínica, un aspecto a tener en cuenta es que la mayoría de los pacientes tienen un perfil protrombótico. Por ello, en pacientes considerados en remisión completa y con un tiempo de seguimiento adecuado, no es necesaria la supresión de la TSH y, por tanto, la terapia puede ser cambiada de supresiva a de sustitución. La terapia supresiva de TSH sí que debe indicarse en pacientes con evidencia de enfermedad persistente. Además, en pacientes de alto riesgo que han presentado remisión, la terapia supresiva se aconseja durante 3-5 años56.
¿Radioterapia en el carcinoma folicular?La radioterapia externa del cuello es utilizada infrecuentemente, y suele indicarse en tumores o recurrencias irresecables, sobre todo si no captan 131I. La radioterapia externa también está indicada en las metástasis óseas y cerebrales57. En casos de CF invasivo microscópicamente se ha descrito una mayor tasa libre de enfermedad cuando se aplica radioterapia que cuando no (53 versus 38%)58.
Hay que tener en cuenta que la radioterapia debe ser planificada cuidadosamente, con precauciones para la prevención de la mielopatía posradiación4. Para la enfermedad microscópica residual debería darse una dosis total de 50-60Gy para el cuello y el mediastino superior, en 25-30 sesiones con 5 sesiones por semana. Un aumento de 5-10Gy puede ser dado si existe un foco neoplásico residual grande.
¿Tiene alguna utilidad actualmente la quimioterapia?Quimioterapia citotóxica clásicaLa quimioterapia citotóxica no tiene ninguna utilidad en el tratamiento del CF. Su uso esta restringido a pacientes con una enfermedad que progresa a pesar de la cirugía, 131I u otras modalidades de tratamiento4,59. La respuesta es pobre, de tal manera que la mejor respuesta es solo del 10-20% con la utilización de doxorrubicina o con la combinación doxorrubicina–cisplatino. Aunque, recientemente, la vinblastina con o sin adriamicina parece mejorar los resultados59. En cualquier caso, las respuestas son parciales y transitorias sin prolongación clara de la supervivencia.
La respuesta a la quimioterapia parece ser mejor en carcinomas pobremente diferenciados, pero necesita ser confirmada con más estudios60. En ocasiones, en casos avanzados la quimioterapia antes de la cirugía puede ser efectiva para reducir el tamaño tumoral y favorecer la cirugía59.
Agentes rediferenciantesEl objetivo de estos agentes es rediferenciar aquellos casos que se han desdiferenciado para que sean captantes de 131I y poder volver a utilizar el 131I como terapia. Se han utilizado varias sustancias, con resultados dispares. Los retinoides son el grupo más estudiado, y los estudios clínicos existentes indican que el tratamiento es bien tolerado y la captación de 131I aumenta entre un 20 y un 50%61,62. En estos casos se suele incrementar la tiroglobulina como signo de rediferenciación tumoral. Se están planteando estudios para valorar qué subgrupos de pacientes con cáncer avanzado de tiroides podrían beneficiarse de su uso. Otro grupo son los agonistas del PPARγ, sobre los que hay pocos estudios que muestren que se incrementa levemente la captación de radioyodo y que es bien tolerado. Los inhibidores de la desacetilasa de histonas inhiben la proliferación celular, permitiendo la desdiferenciación, si bien en clínica faltan estudios que confirmen su utilidad. Por último, recientemente, se ha descrito el uso de dos inhibidores de la transcriptasa reversa (nevirapina y efavirenz) en cáncer, tratamientos habitualmente usados para el HIV. Sin embargo, dada su toxicidad, no se recomienda su uso hasta que no se demuestre su efectividad.
Fármacos que inhiben la cascada de la proliferación intracelularOtras terapias moleculares, con agentes antiangiogénicos, están siendo analizadas y pueden representar una ayuda para algunos pacientes63, pero aún son solo estudios preliminares. En este sentido varios ensayos clínicos están evaluando inhibidores de la tirosin-cinasa y de la angiogénesis para el tratamiento de pacientes con enfermedad metastásica o carcinomas diferenciados refractarios al resto de los tratamientos, con resultados esperanzadores, pero pendientes de confirmarse en series amplias de pacientes63. Su principal problema es el alto porcentaje de efectos secundarios, que aunque no graves sí son muy molestos (síntomas gastrointestinales, etc.).
Consideraciones finales- 1.
Los marcadores citológicos moleculares no son aún útiles para su aplicación clínica para el diagnóstico preoperatorio del CF.
- 2.
La mejor técnica quirúrgica para el CF es la tiroidectomía total, excepto en casos muy seleccionados donde podría ser suficiente con la hemitiroidectomía.
- 3.
La BIO tiene una utilidad limitada para descartar un CF, por lo que su utilización no se recomienda.
- 4.
El vaciamiento ganglionar en el CF solo se recomienda si se sospecha afectación linfática. No debe realizarse de forma profiláctica.
- 5.
En el CF mínimamente invasivo es importante la diferenciación entre angioinvasivo y no angioinvasivo, pues tiene implicaciones terapéuticas y pronósticas.
- 6.
Las variantes no clásicas del CF (Hürthle, insular y células claras) tienen peor pronósico y precisan de un tratamiento inicial más agresivo.
- 7.
En el CF localmente avanzado, por lo general, se recomienda una resección más agresiva para reducir la morbilidad y mantener la integridad de la vía aérea.
- 8.
La ablación del tejido tiroideo en el CF disminuye las recidivas y facilita los controles con tiroglobulina, si bien algunos grupos de CF no precisan dicha ablación para tener un buen pronóstico.
- 9.
Los últimos ensayos clínicos muestran la utilidad del radioyo a baja dosis, lo que facilita el tratamiento de estos pacientes de forma ambulatoria. Por ello, algunos grupos europeos, sobre todo italianos, están empezando a utilizarlo de forma ambulatoria.
- 10.
La terapia supresiva de TSH mejora la supervivencia libre de enfermedad, pero en pacientes añosos y de riesgo cardiovascular aumenta la mortalidad por motivos cardiovasculares.
- 11.
La radioterapia externa se indica en recidivas irresecables que no captan 131I y en lesiones metastásicas óseas y cerebrales.
- 12.
Muchos agentes terapéuticos se están ensayando en cáncer de tiroides avanzado, donde la terapia génica farmacológica, principalmente los agentes bloqueantes de la vía de señalización y los agentes de rediferenciación, se muestra en el horizonte como una alternativa terapéutica.
Los autores declaran no tener ningún conflicto de intereses.