El tumor fibroso solitario (TFS) es una neoplasia de origen mesenquimal poco frecuente. La mayoría de los TFS suelen ser torácicos y pleurales1, pero se han descrito casos en prácticamente cualquier localización, como en médula espinal2,3, órbita4, tracto respiratorio superior5, piel6, próstata7, meninges8, tiroides9, etc. En la literatura han sido descritos menos de 40 casos en adultos con origen en el parénquima hepático10–15.
Aproximadamente un 10% de los TFS presentan rasgos histológicos de malignidad16,17, como alta celularidad, actividad mitótica (> 4 mitosis/GA), pleomorfismo nuclear, hemorragia y necrosis17–19, que se asocian a una mayor tasa tanto de recidiva local como de metástasis. Éstas son excepcionales cuando presentan una localización extratorácica, aproximadamente un 6%12,20. Los hallazgos clínicos o radiológicos son inespecíficos y la citología preoperatoria puede ser no concluyente. Para el diagnóstico preciso es conveniente usar marcadores como CD34, vimentina y desmina. En la mayoría de los casos hay baja celularidad con mínima atipia o necrosis, lo que lo convierte en una entidad benigna. El tratamiento de elección es quirúrgico con amplios márgenes de resección, y en ocasiones se ha propuesto administrar quimioterapia o radioterapia adyuvante, aunque no hay suficiente evidencia científica para afirmar que reduzca la tasa de recidivas, dada la escasa experiencia con este tipo de tumores17,21. En este artículo presentamos en forma de caso clínico un TFS hepático con comportamiento maligno asociado a producción clínicamente relevante de IGF II. Además, es el de mayor tamaño y peso descrito en la literatura.
Varón de 71 años de edad que refería empeoramiento del estado general y distensión abdominal desde hacía 4 meses. Aportaba una RMN donde se evidenciaba una masa dependiente de lóbulo hepático derecho con crecimiento exofítico hacia peritoneo, predominantemente hiperintensa en T1 e hipointensa en T2. Previamente se había realizado una laparotomía exploradora no pudiendo resecarse el tumor por compromiso vascular y mediante biopsia fue diagnosticado de tumor fibroso solitario de estirpe mesenquimal con alto índice de proliferación. El tumor expresaba CD34, Bcl-2 y CD99 con ausencia de expresión para CD31, c-Kit, S-100, desmina, CD-21, AE1-AE3, actina, CK9, CK7, EM y FXIIIa. Durante este proceso diagnóstico el paciente tuvo que ser ingresado por cuadros de confusión y pérdida de conocimiento asociados a episodios repetidos de hipoglucemia. En la exploración física presentaba regular estado general, sin adenopatías, con ingurgitación yugular a 45°, hipoventilación bilateral en la auscultación pulmonar, fibrilación auricular, ligera ascitis y una masa pétrea que ocupaba la totalidad del abdomen.
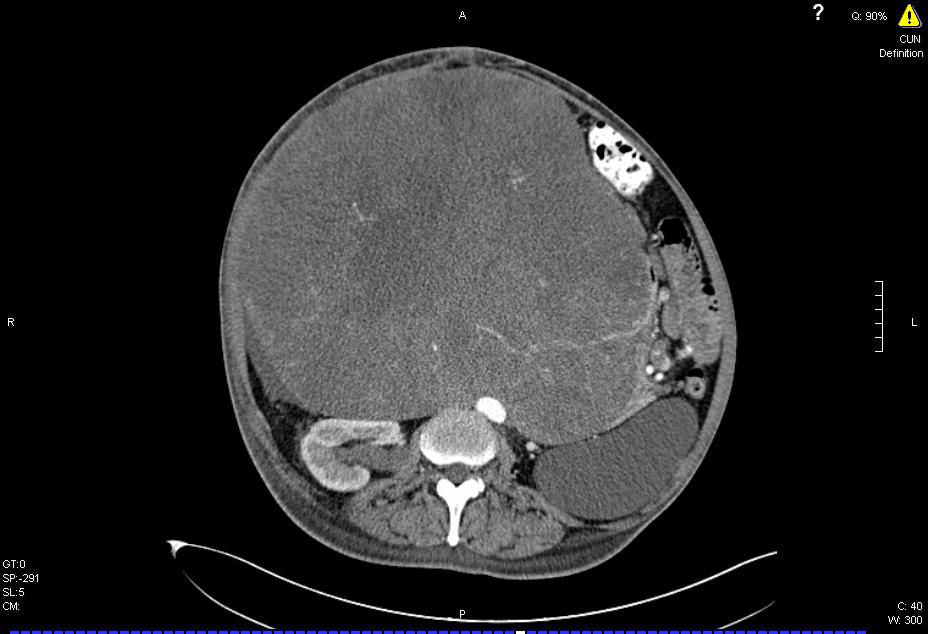
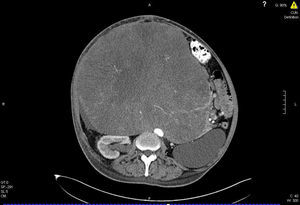
En el TAC abdominal con contraste se objetivó una gran masa abdominal de 27 × 25cm de diámetro, con una continuación de 13cm que afectaba a los segmentos VII y V desplazando al hígado en sentido craneal y que se extendía caudalmente ocupando todo el hipocondrio y el vacío derecho, atravesando la línea media, desplazando todas las estructuras abdominales hacia la izquierda. Se apreciaba dilatación de la vía biliar intrahepática por compresión tumoral (fig. 1). Se decidió realizar angiografía para valorar su resecabilidad, objetivándose un desplazamiento hacia la izquierda de la línea media de las arterias y venas mesentérica superior e inferior. La porta principal y sus ramas intrahepáticas se encontraban permeables y con flujo hepatópeto.
Se intervino resecando en bloque la tumoración abdominal y el hígado derecho, con extirpación parcial de la pared duodenal. Fue necesario efectuar una resección de la vena porta con anastomosis posterior y una hepático-yeyunostomía por compromiso de la vía biliar principal. Se reparó la pared duodenal y se realizó una gastroenteroanastomosis. Se requirió la colocación de una prótesis no cubierta en arteria hepática izquierda por presentar estenosis con disección de la íntima, en posible relación a una elongación durante la cirugía.
En el postoperatorio permaneció ingresado en la UCI, siendo posteriormente trasladado a la planta de hospitalización, reinstaurándose alimentación oral al cuarto día. El décimo día presentó un cuadro de fiebre con distensión abdominal, ascitis y derrame pleural bilateral que precisó de paracentesis y de toracocentesis, con reingreso en UCI. Requirió reparación quirúrgica de la anastomosis biliar, que presentaba una fuga. Al noveno día de la reintervención se le colocó una prótesis portal mediante radiología intervencionista por persistencia de ascitis y estenosis en la anastomosis portal. El decimonoveno día fue dado de alta con buen estado general y portando drenaje de Pig-tail ambiente. A los tres meses de la intervención el paciente se encontraba bien, sin evidencia de enfermedad en TAC. A los cuatro meses y medio ingresa en su hospital de referencia por dolor abdominal cólico, presentando en el TAC realizado una gran masa de 17 × 10cm que afectaba al remanente hepático, hilio hepático, páncreas y estómago. Tras desestimar reintervención quirúrgica, el paciente fallecía al cabo de 5 meses desde la primera intervención.
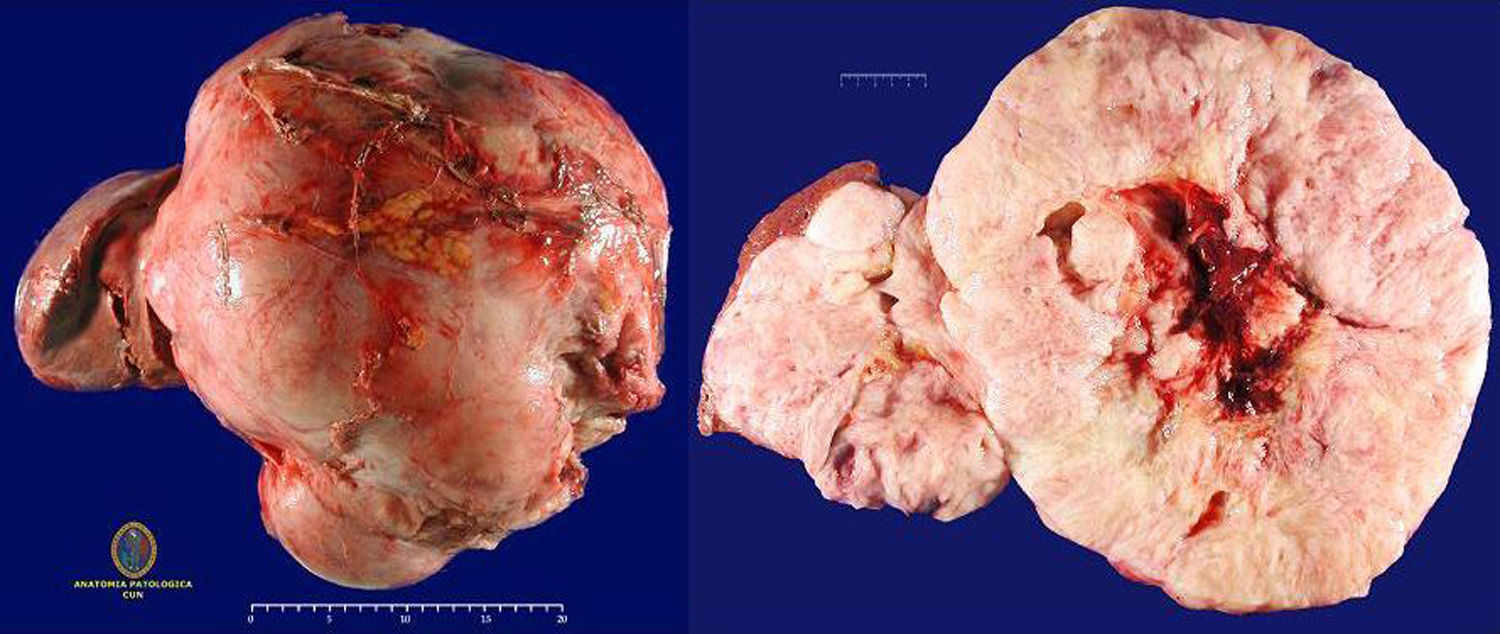
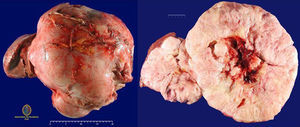
La pieza de resección quirúrgica constaba de un fragmento de tejido polilobulado, que medía 40 × 32 × 18cm y pesaba 11,5kg. Estaba constituida por múltiples nódulos de coloración blanquecina amarillenta separados por tractos fibrosos. En la zona central, el tejido era hemorrágico y se apreciaban áreas de necrosis. Los márgenes de resección estaban libres de tumor (fig. 2).
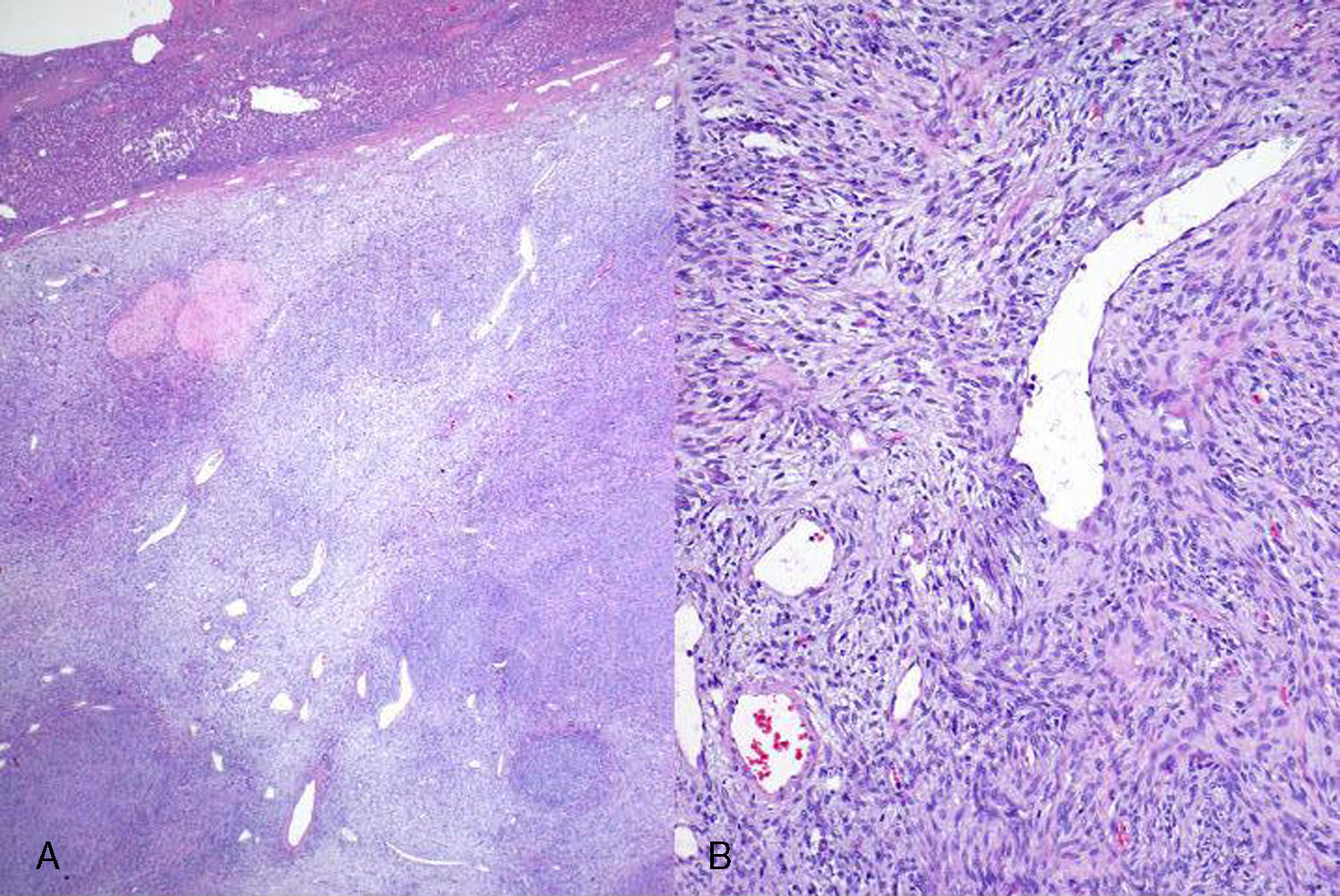
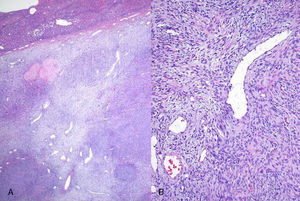
Microscópicamente correspondía a una neoformación de estirpe mesenquimal. En la zona central el tumor crecía formando nódulos de tamaño variable separados por áreas en las que alternaban zonas de fibrosis con zonas de degeneración mixoide y pequeños focos de necrosis. Se distinguían dos zonas de diferente densidad celular. En las áreas más celulares las células neoplásicas fusiformes tenían límites citoplasmáticos imprecisos, núcleo ovoide hipercromático −a veces con un pequeño nucléolo− y frecuentes figuras de mitosis. Se disponían formando nidos o capas alrededor de vasos. Había también una rica red de vasos ramificados, con luz amplia y pared fina. El tumor crecía con un patrón expansivo, comprimiendo el parénquima hepático adyacente, del que se encontraba separado por una banda de tejido conectivo fibroso, y en el que se observaban cambios en relación con la compresión tumoral con abundantes fenómenos de dilatación sinusoidal y un infiltrado inflamatorio crónico reactivo de localización portal (fig. 3).
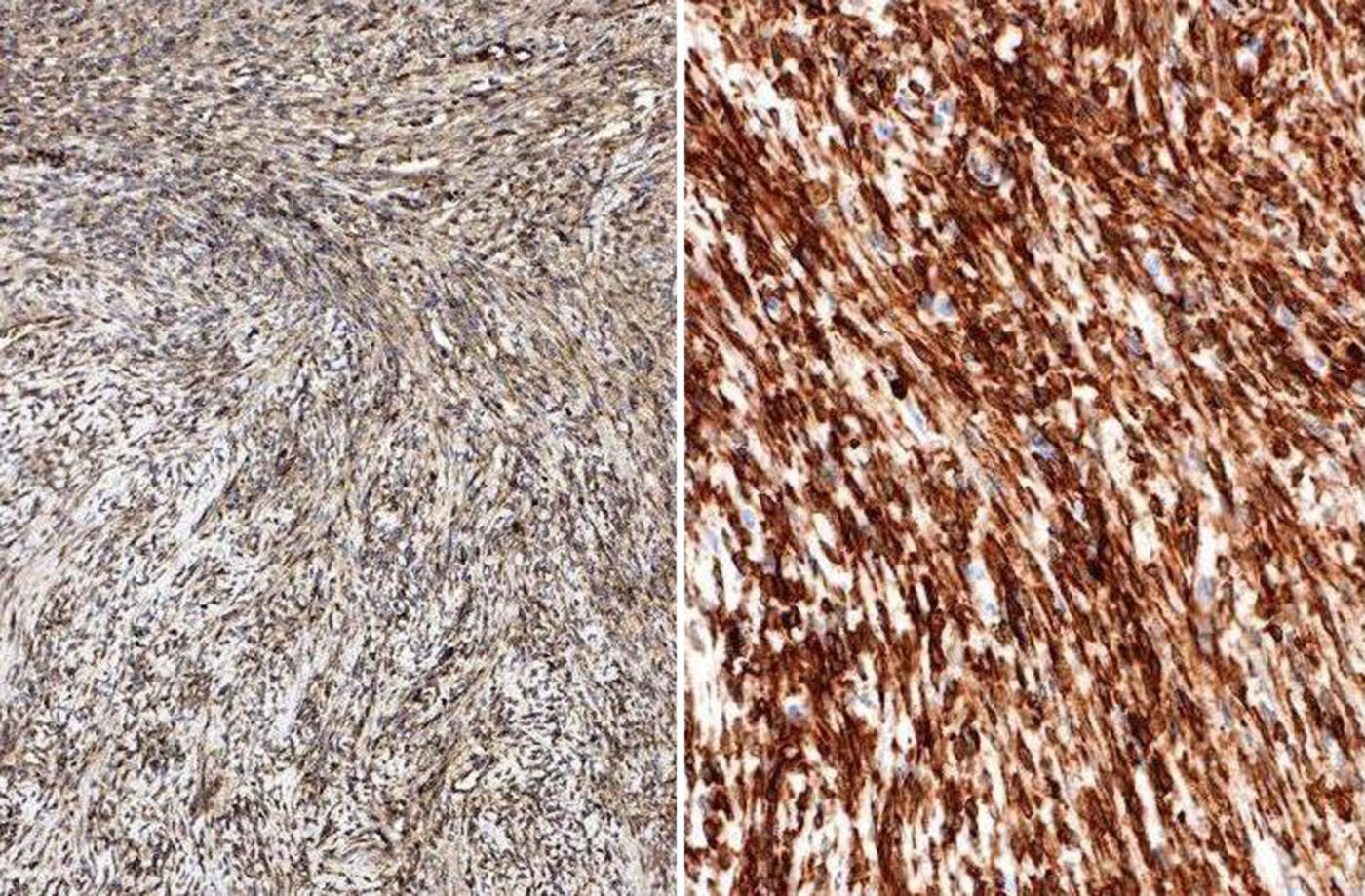
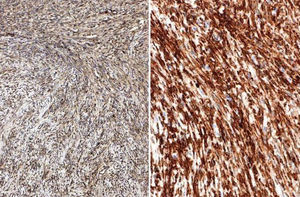
El perfil inmunohistoquímico era Bcl-2,CD-99, CD-34 e IGF II positivos al 100%; proteína S-100, pancitoqueratina, EMA y c-kit negativos. Presentaba desmina y actina específica de músculo liso con positividad focal < 1% (fig. 4).
El tumor fibroso maligno del hígado es una enfermedad muy infrecuente con aspectos no completamente aclarados. La edad media del diagnóstico es de 55 años, con preponderancia femenina (2:1)11,13,15. En ocasiones se ha asociado a una transformación fibrótica tras radiación hepática20. La localización se da tanto en lóbulo hepático derecho como izquierdo, sobre hígado no cirrótico. La clínica suele debutar con síntomas inespecíficos de plenitud, obstrucción gastrointestinal, dolor abdominal en hipocondrio derecho, alteración de la función hepática, pérdida de peso o hipoglucemia, estando esta última asociada más frecuentemente a los TFS localizados en pleura17,18,22. La difícil interpretación histológica y el gran tamaño de la lesión provocan dificultades en cuanto al diagnóstico preoperatorio y al manejo clínico.
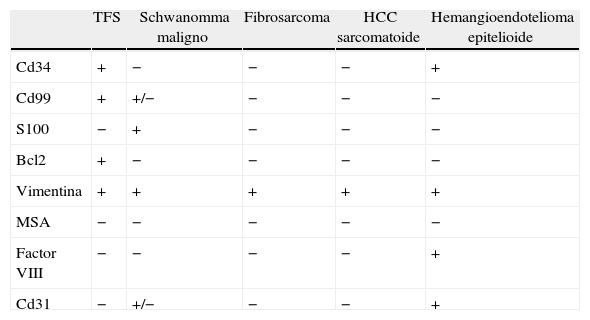
El diagnóstico histológico del TFS se apoya tanto en sus rasgos morfológicos con las técnicas convencionales como en su perfil inmunohistoquímico. Aun así, en ocasiones se plantean múltiples diagnósticos diferenciales, dependiendo en gran medida de su localización. En este caso estos diagnósticos diferenciales incluyen todos los tumores de origen o apariencia mesenquimal de localización hepática como son el HCC sarcomatoide, hemangioendotelioma epitelioide, leiomiosarcoma, pseudotumor inflamatorio, fibrosarcoma, schwanomma celular, MPSNT, histiocitoma fibroso maligno y hemangioma esclerosante. Proponemos una tabla de diagnóstico diferencial (tabla 1).
Diagnóstico diferencial
| TFS | Schwanomma maligno | Fibrosarcoma | HCC sarcomatoide | Hemangioendotelioma epitelioide | |
| Cd34 | + | − | − | − | + |
| Cd99 | + | +/− | − | − | − |
| S100 | − | + | − | − | − |
| Bcl2 | + | − | − | − | − |
| Vimentina | + | + | + | + | + |
| MSA | − | − | − | − | − |
| Factor VIII | − | − | − | − | + |
| Cd31 | − | +/− | − | − | + |
HCC: hepatocarcinoma; MSA: actina muscular específica; TFS: tumor fibroso solitario.
Este es un caso de tumor fibroso solitario con rasgos histológicos de malignidad, que se vieron reflejados en la evolución clínica del paciente. La resección quirúrgica con márgenes libres se convierte en el pilar fundamental del tratamiento de esta entidad. Dado su gran tamaño, que ya de por sí es un factor de riesgo de malignidad y de recidiva17, generalmente la anatomía está modificada de manera importante y suele requerir hepatectomías mayores. Incluso en las situaciones en que presenta un carácter benigno es fundamental el resecar la totalidad de la lesión para disminuir la tasa de recidivas, lo que lo convierte en un importante reto quirúrgico y que puede obligar a la reintervención para ampliar los márgenes. Se puede dar la indicación extrema de trasplante en caso de irresecabilidad10.
No hay evidencia sólida sobre la necesidad de tratamiento complementario con quimio-radioterapia tras la cirugía, salvo en las situaciones en las que no se ha podido resecar el 100% del tumor. En cualquier caso, dada la escasez de experiencia, la eficacia de la adyuvancia no está bien definida, si bien se han descrito pocos casos con buena respuesta a quimioterapia si existe enfermedad a distancia10,13,16.
En conclusión, los TFM del hígado son neoplasias extremadamente raras en adultos y su incidencia real es desconocida. El diagnóstico exacto se basa en los hallazgos patológicos e inmunohistoquímicos y el tratamiento de elección es la cirugía con márgenes de seguridad. El pronóstico depende de la resecabilidad, más que del tamaño o del grado patológico, aunque se deben realizar más estudios para valorar la respuesta a terapias adyuvantes en los casos más agresivos.