Paciente mujer de 42 años, fumadora, sin otros antecedentes de interés, que presenta dolor torácico coincidente con los períodos menstruales. La paciente está en estudio por digestivo desde 2007 por molestias epigástricas, siendo diagnosticada de tumoración subcarinal sospechosa de quiste de duplicación esofágico. Entre las pruebas cabe destacar:
- -
TC torácica: lesión hipodensa, redondeada y bien delimitada a partir de la carina traqueal. Posible quiste de duplicación esofágico.
- -
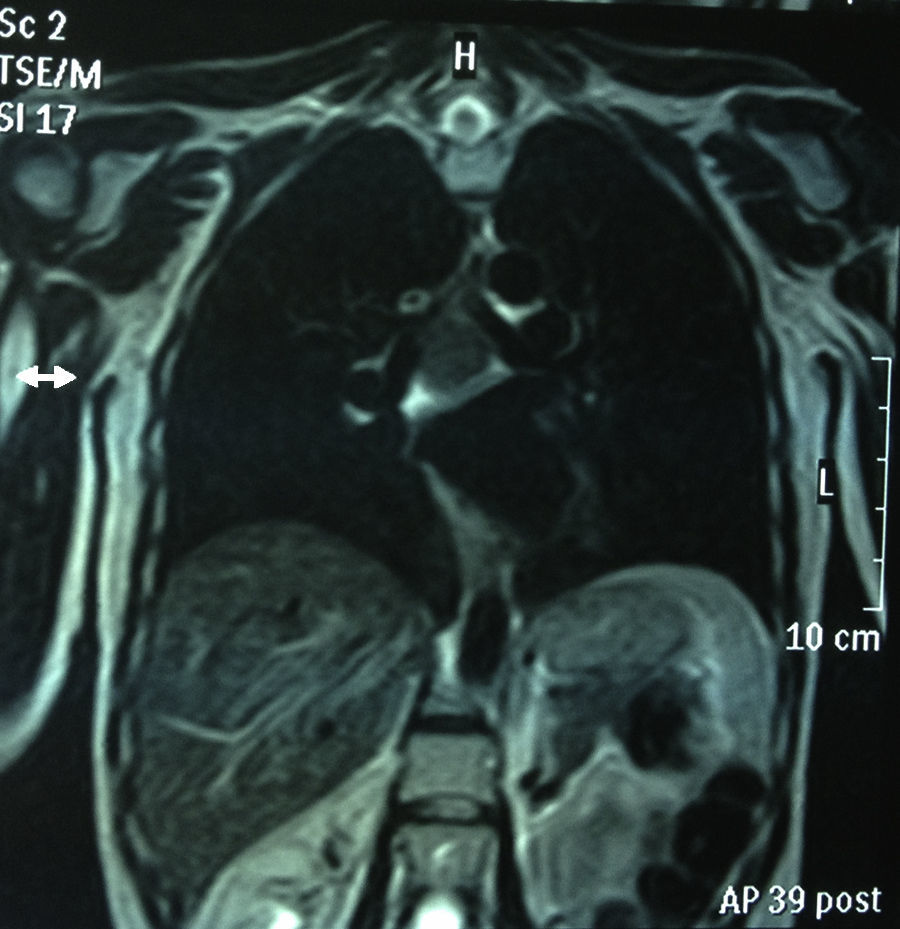
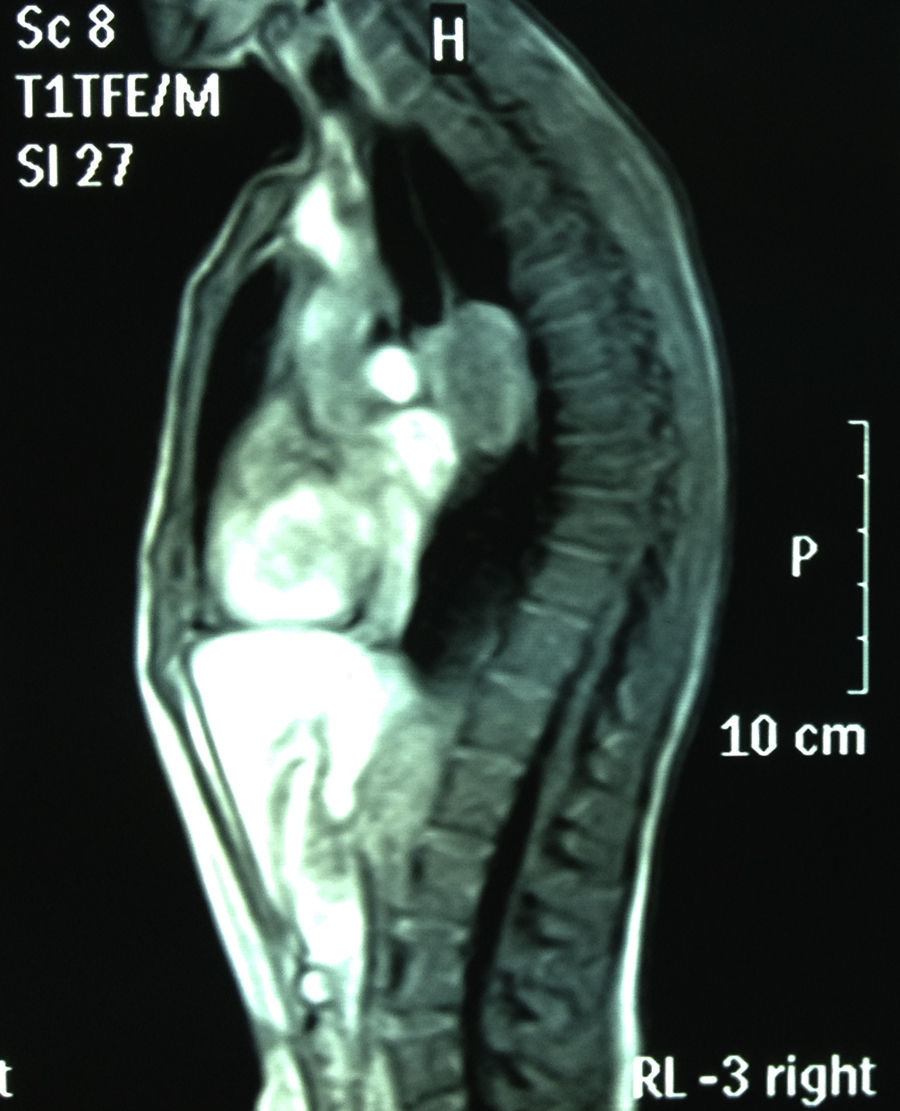
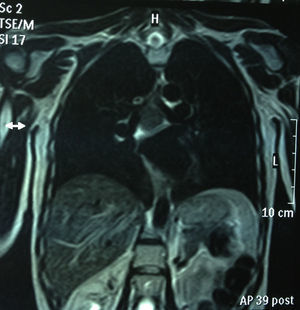
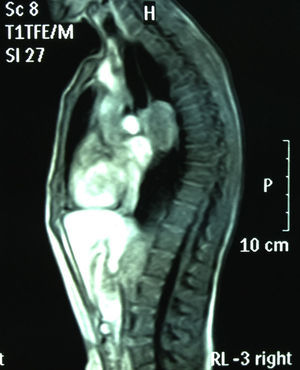
RMN torácica: masa mediastínica de 45mm subcarinal hiperintensa en T1 (figs. 1 y 2).
- -
Ecoendoscopia: lesión de naturaleza quística dependiente de la mucosa esofágica.
- -
Espirometría: FVC: 4.010ml (108%), FEV1: 3.280ml/s (113%).
Ante la sospecha diagnóstica de quiste de duplicación esofágico, se recomienda tratamiento quirúrgico mediante resección.
Se realiza bajo anestesia general e intubación orotraqueal una toracotomía derecha. Se evidencia una tumoración mediastínica subcarinal de consistencia dura y en relación con el tercio medio del esófago. Se realiza una resección de la misma con parte de la musculatura esofágica, reforzando el esófago mediante puntos sueltos en la capa muscular no resecada. No se evidencia afectación de la mucosa esofágica.
Tras remitir el informe a anatomía patológica, el estudio muestra un tumor del estroma intestinal (GIST) mediastínico de 6 × 3,5 × 3,3cm, con diferenciación difusa muscular, bien delimitado, sin necrosis, ni mitosis, ni atipia (mitosis < 5). Se realiza tinción de Giemsa y se observan mastocitos intersticiales (+). El inmunofenotipo del tumor fue: actina músculo liso (+++), S-100: negativo, Ki-67: (bajo índice de proliferación < 5%), CD-34 (+) en vasos, c-kit: +. Riesgo moderado (Fletcher 2002).
En 1983, el concepto de un tumor del estroma gástrico fue introducido por Mazur y Clack1, hasta entonces los GIST fueron tumores catalogados originalmente como leiomioma, leiomioblastoma, o leiomiosarcoma. Gracias a los avances en biología molecular e inmunohistoquímica se han definido como tumores mesenquimáticos raros, de origen en las células intersticiales de Cajal. Estas células expresan un receptor de membrana mutante con actividad tirosinquinasa anómala (c-kit o CD117) que provoca una proliferación celular no regulada. Suelen ser asintomáticos, descubriéndose incidentalmente durante endoscopias o pruebas radiográficas2. Los GIST son predominantes en el estómago y el intestino, y rara vez se presentan en el esófago. Un tumor de GIST en el mediastino posterior generalmente tiene su origen en el esófago, como ocurrió en nuestro caso. Aunque se han publicado 2 casos de GIST gástricos en el mediastino posterior3,4, en esta localización también hay que incluir los diagnósticos diferenciales de tumores neurogénicos, quiste de duplicación gastroesofágica y leiomioma esofágico. La localización mediastínica es rara y la presentación subcarinal no ha sido comunicada hasta el momento. Un crecimiento amplio del tumor con esta localización puede provocar síntomas compresivos como la disnea, aunque nuestra paciente inició su sintomatología con epigastralgia y dolor torácico. El lugar de presentación de estos tumores es un factor pronóstico. Así, los GIST derivados del estómago son más indolentes, mientras que los GIST que surgen en el intestino delgado, colon y esófago son más agresivos. La mayoría de los GIST tienen buen pronóstico tras resección quirúrgica, pero en estadios avanzados (definidos por tamaño y mitosis) se asocian a baja supervivencia y pobre respuesta quimioterápica. En cuanto al tratamiento médico, el imatinib, inhibidor de la tirosinquinasa, ha demostrado ser eficaz en su control, aumentando la supervivencia incluso en GIST no metastásicos2. Sin embargo, hay que tener presentes los efectos adversos de este fármaco, como la necrosis5 y el sangrado tumoral, que, aunque poco frecuentes, son típicos del imatinib, en especial al tratar GIST de alta malignidad, como los GIST gigantes del duodeno (que son raros y de mayor riesgo hemorrágico), en los que el imatinib debe administrarse durante la hospitalización.
Los GIST han demostrado mutaciones genéticas KIT, comúnmente en el exón 11 y con menos frecuencia en el exón 9. Las mutaciones KIT sirven de «guardianes» en el desarrollo de GIST. El inmunofenotipo es importante a la hora de catalogar estos tumores, de manera que existen estudios que afirman que el índice proliferativo Ki-676 podría ser un excelente marcador pronóstico de supervivencia en pacientes con c-kit+, pudiendo ser útil para seleccionar candidatos al tratamiento con imatinib.
La resección quirúrgica agresiva con márgenes negativos ha sido siempre el tratamiento de elección para los GIST, debido a la radiorresistencia y la insensibilidad a los agentes quimioterápicos. Pero los avances descritos con el imatinib hacen plantear nuevas técnicas quirúrgicas7 menos agresivas que ofrecen similar supervivencia, desechando la resección frente a la enucleación y cuestionando así la cirugía agresiva gastroesofágica por sus elevados riesgos.
Existen estudios sobre la resección laparoscópica8 de GIST gástricos, apoyándola para resecciones en cuña. Ninguna localización contraindica estrictamente la videocirugía. Los principales inconvenientes descritos han sido las estenosis postoperatorias, especialmente en unión esofagogástrica o píloro. Para tumores voluminosos o con una ubicación desfavorable se sugiere la utilización previa de imatinib con objeto de reducir la masa, permitiendo una cirugía conservadora del órgano.