Una de las complicaciones más graves tras la cirugía de resección esofagogástrica es la dehiscencia de la anastomosis. El uso de apósitos adhesivos podría constituir una ayuda eficaz para resolver esta complicación. Nuestro objetivo ha sido realizar un estudio experimental encaminado a estudiar dichos mecanismos en un modelo de anastomosis esofágica en rata.
MétodosSe han utilizado un total de 50 ratas Sprague-Dawley divididas en 2 grupos, grupo Tachosil® (n=25) y grupo control (n=25). Tras la sección del esófago abdominal se realizó una anastomosis esófago-gástrica monoplano, reforzando con una tira de 1cm de Tachosil® envolviendo la anastomosis en el primer grupo.
Se realizó un estudio funcional mediante manometría, así como un estudio histopatológico e inmunohistoquímico para factores angiogénicos, fibrogénicos y proliferativos.
ResultadosLa mortalidad en nuestra serie alcanzó un 8% en el grupo en el que fue aplicado apósito de colágeno, frente a un 36% del grupo control. Al realizar la manometría esofágica, la presión de dehiscencia fue mayor en las anastomosis reforzadas. En el estudio microscópico, en el grupo en el que se aplicó apósito de colágeno se apreció una profusa reacción inflamatoria con abundantes PMN y macrófagos rodeados por una matriz conectiva con fibroblastos y vasos sanguíneos. La expresión de VEGF y FGF1 y FGF2 fue sensiblemente mayor en las anastomosis con apósito de colágeno.
ConclusionesEstos resultados indican que la aplicación de apósito de colágeno facilita los fenómenos de reparación tisular, por lo que podría ser de gran utilidad como refuerzo de las anastomosis esofagogástricas para la prevención de dehiscencias.
One of the most severe complications after esophaguectomy is anastomotic dehiscence. The use of collagen sponges could be an effective way to resolve this complication. Our objective was to perform an experimental model of esophageal anastomosis in rats to study these mechanisms.
MethodsA total of 50 Sprague-Dawley rats were used divided into 2 groups, Tachosil® group (n=25) and control group (n=25). After the section of the abdominal esophagus a single-layer esophago-gastric anastomosis was performed reinforced with 1cm of Tachosil® wrapping the anastomosis in group 1.
A functional study was performed using manometry as well as histopathological and immunohistochemical studies for angiogenic, fibrogenic and growth factors.
ResultsThe mortality in our series was 8% in the collagen dressing group, compared to 36% in the control group. When esophageal manometry was performed, the dehiscence pressure was higher in the reinforced anastomosis, On microscopical analysis, in the collagen dressing group a profuse inflammatory reaction with abundant neutrophils and macrophages surrounded by a connective matrix with fibroblasts and blood vessels was observed, The expression of VEGF, FGF1 and FGF2 was noticeably higher in the collagen dressing group.
ConclusionsThese results show that the application of collagen dressing facilitates tissue reparation phenomena, and therefore could be very useful as a reinforcement of esophago-gastric anastomosis to prevent dehiscence.
Una de las complicaciones más graves tras la cirugía de resección esofagogástrica es la dehiscencia de la anastomosis, con una prevalencia que varía entre el 3% y el 12% en las principales series publicadas1. El uso de apósitos adhesivos podría constituir una ayuda eficaz y fiable para resolver esta complicación2. apósito de colágeno (Nycomed, Takeda, Zurich, Suiza) es una esponja de colágeno que contiene fibrina y trombina humanas que en contacto con los fluidos fisiológicos se transforma en una red firme y mecánicamente estable de fibrina que posee buenas propiedades3. Existen algunos estudios experimentales relativos al uso de apósito de colágeno en cirugía gastrointestinal4 con buenos resultados resultados para reducir la tasa de dehiscencias5. Aunque se ha comprobado la utilidad de apósito de colágeno en cirugía esofágica experimental6, no se han estudiado en detalle los mecanismos fisiológicos de reparación tisular que acontecen tras la aplicación de la esponja en esta zona.
Nuestro objetivo ha sido realizar un estudio clínico, funcional e histopatológico encaminado a estudiar dichos mecanismos en un modelo experimental de anastomosis esofágica en rata.
MétodosPara la consecución del objetivo propuesto se han utilizado un total de 50 ratas Sprague-Dawley (SD) macho de 210-240g de peso y 4 semanas de edad.
Los animales se dividieron en 2 grupos, grupo Tachosil® (n=25) y grupo control (n=25), según la aplicación o no de Tachosil® una vez completada la sutura.
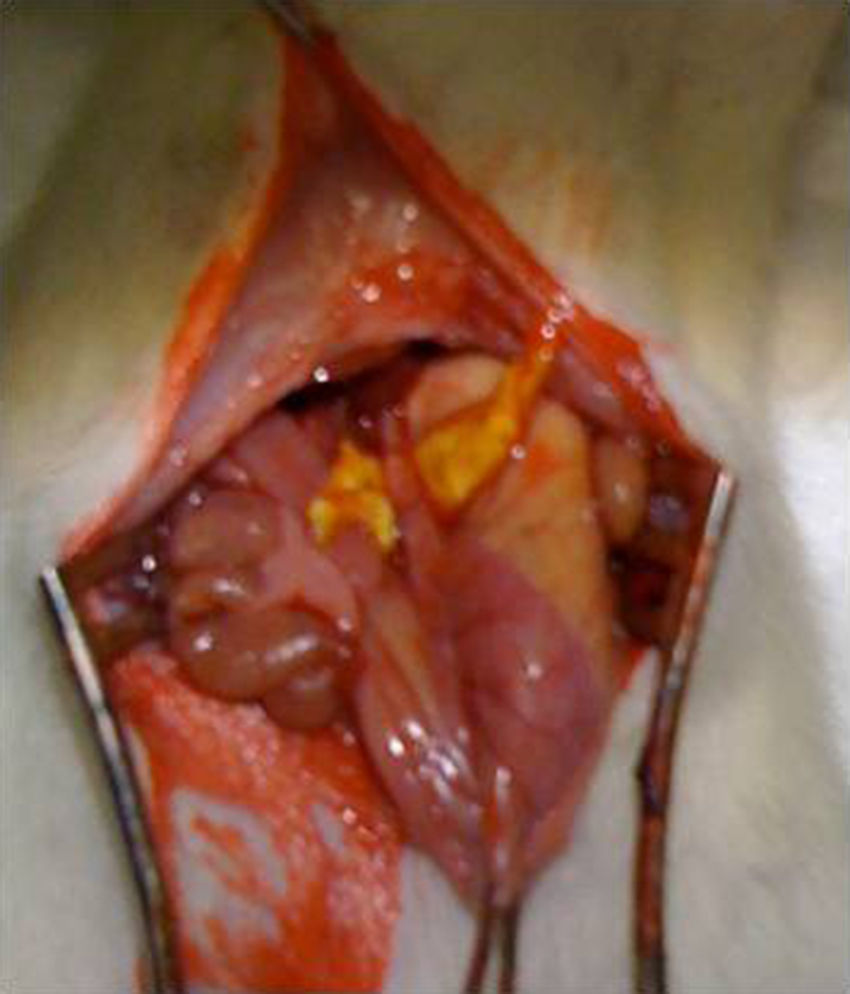
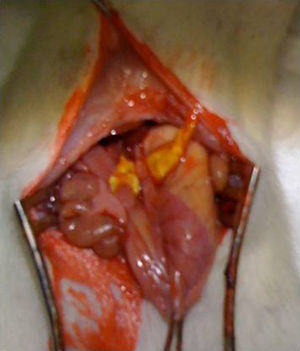
Intervención quirúrgica: tras la anestesia del animal con una combinación de ketamina-xilacina (50mg/kg y 10mg/kg respectivamente, vía IP), se practicó una laparotomía media de 3cm de longitud y se procedió a la disección del esófago abdominal y sección del mismo al nivel del cardias. La anastomosis esófago-gástrica se realizó manual monoplano con 3 puntos de PDS 6/0. En el grupo Tachosil® la anastomosis se refuerza con una tira de 1cm de Tachosil® (fig. 1), mientras que en el grupo control no se realizó ningún tipo de refuerzo. Los animales fueron mantenidos en observación diaria con una solución de agua y buprenorfina (0,1mg/kg) y comida ad libitum durante todo el tiempo que duró el experimento. Este estudio se realizó con la aprobación del Comité Ético de Experimentación Animal del Instituto Murciano de Investigación Biosanitaria.
Sacrificio y toma de muestras: con el fin de analizar el proceso de cicatrización a corto y medio plazo de los animales supervivientes más de 7 días, se sacrificaron la mitad a los 8 días y la otra mitad a los 30 postintervención mediante inducción anestésica inhalatoria con isofluorano a saturación.
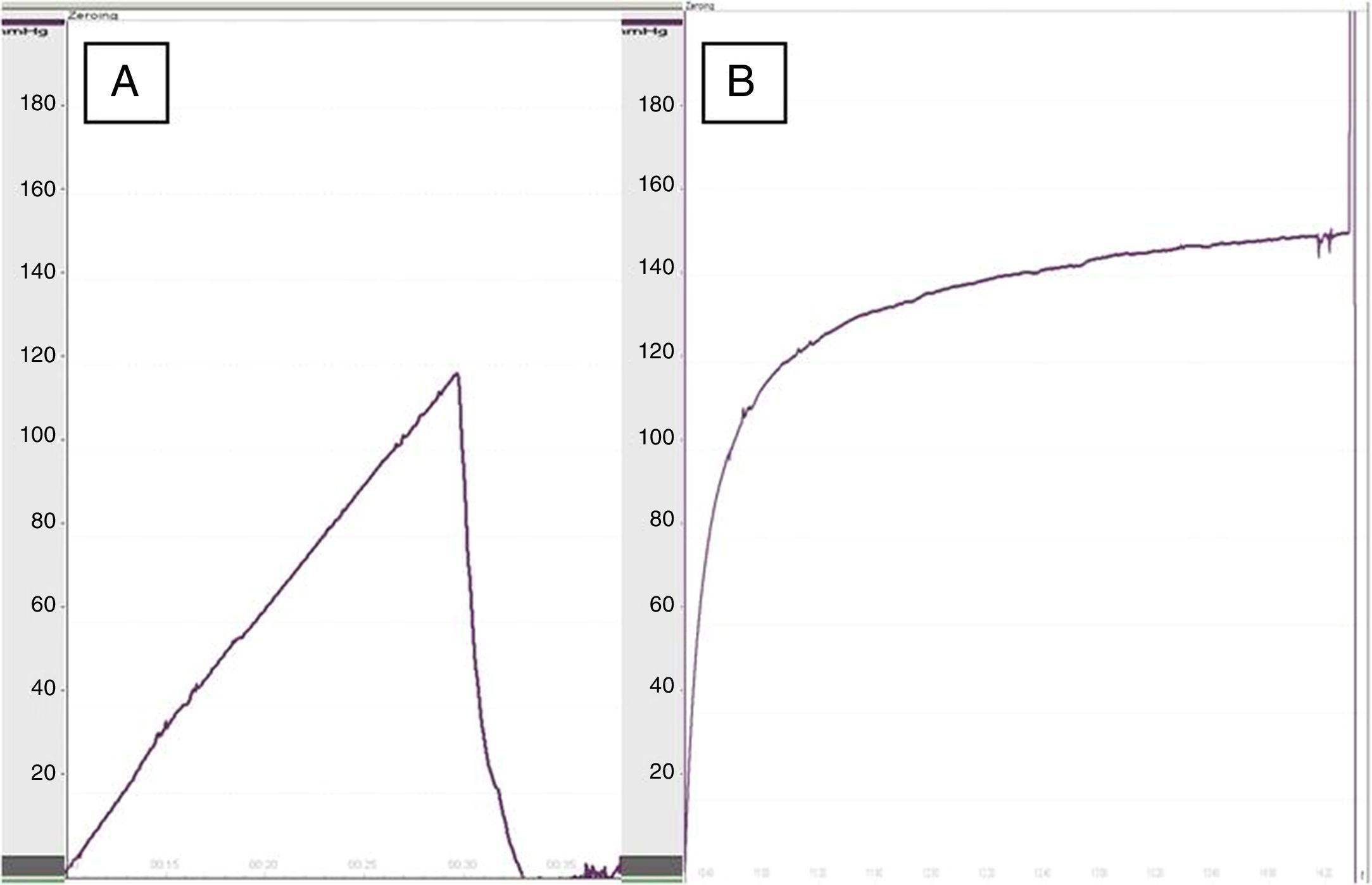
Estudio funcional: para el estudio manométrico se utilizó el segmento anatómico comprendido entre el esófago y el duodeno de la rata. El esófago se cortó transversalmente a 1,5cm por encima del nivel del diafragma y fue resecado en bloque junto con el estómago y el duodeno proximal, lavando con suero fisiológico el contenido gástrico. Posteriormente el duodeno se cerró con hilo de seda de 3/0 y se rellenó el estómago con azul de metileno al 1%. La manometría se realizó mediante una sonda de polivinilo introducida en la luz esofágica y un polígrafo de 4 canales (Synectics medical, Estocolmo, Suecia)7. La presión de dehiscencia se definió como la presión máxima intraluminal a partir de la cual se produce la salida de azul de metileno a través de la sutura anastomótica.
Los datos obtenidos fueron analizados utilizando un paquete estadístico SPSS 20 (Chicago, Illinois).
Estudio inmunohistopatológico: el estudio histopatológico se realizó en secciones de 3μm de espesor que fueron teñidas con hematoxilina-eosina y tricrómico de Masson. El estudio inmunohistoquímico se realizó mediante la técnica ABC, utilizando anticuerpos frente a factores angiogénicos (factor de crecimiento de células endoteliales [VEGF], Abcam, Cambridge, Reino Unido), fibrogénicos (factor de crecimiento de fibroblastos 1 y 2 (FGF-1 y FGF-2, Santa Cruz Biotechnology, Heidelberg, Alemania) y proliferativo (cuantificación de la expresión de la proteína Ki-67, Master Diagnostica, Granada, España). Tras desparafinado y rehidratación, se procedió al desenmascaramiento antigénico con tampón citrato, pH 6.0 (Dako Diagnostics, Sant Just Desvern, España) e inhibición de la peroxidasa endógena. Se procedió a la incubación overnight con el anticuerpo primario a 4°C, y a la incubación con el complejo polímero biotinilado (EnVision, Dako Diagnostics, Sant Just Desvern, España), y revelado de la reacción con 3-3¿ diaminobencidina. La inmunorreacción positiva se identificó mediante un halo de color marrón citoplasmático (VEGF, FGF-1 y FGF-2) y nuclear (Ki-67).
ResultadosLa mortalidad objetivada en nuestra serie alcanzó un 8% (n=2) en el grupo en el que fue aplicada la esponja apósito de colágeno, frente a un 36% (n=9) del grupo control. La principal causa de mortalidad en el grupo control fue la dehiscencia de la anastomosis (n=7), seguida de hemoperitoneo (n=2). En el grupo de apósito de colágeno se evidenciaron 2 casos de hemoperitoneo en las primeras 24horas poscirugía. Excluyendo estos casos de sangrado precoz fueron estudiadas 23 ratas del grupo control y 23 del grupo apósito de colágeno.
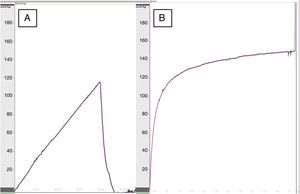
Al realizar la manometría esofágica, la presión de dehiscencia en el grupo tratado con apósito de colágeno fue de 119,5±22mmHg frente a 93,5±30mmHg del grupo control (p<0,05) (fig. 2), lo que demostró una mayor resistencia en las anastomosis reforzadas. No se apreciaron diferencias significativas en la presión de dehiscencia entre las ratas del mismo grupo comparando los registros a los 8 y los 30 días.
En el estudio macroscópico de las piezas la regeneración epitelial de la mucosa tuvo lugar en el 87% (n=20) de los animales tratados con recubrimiento anastomótico con apósito de colágeno, frente al 44% (n=10) de los no recubiertos. Se objetivaron abscesos perianastomósticos en un 26% (n=6) del grupo control y en el 13% (n=3) en las ratas con apósito de colágeno, no evidenciando peritonitis difusa en ninguno de los casos. En un 30% (n=7) del grupo sin apósito de colágeno apareció una dehiscencia completa, no objetivándose ningún caso en el grupo apósito de colágeno.
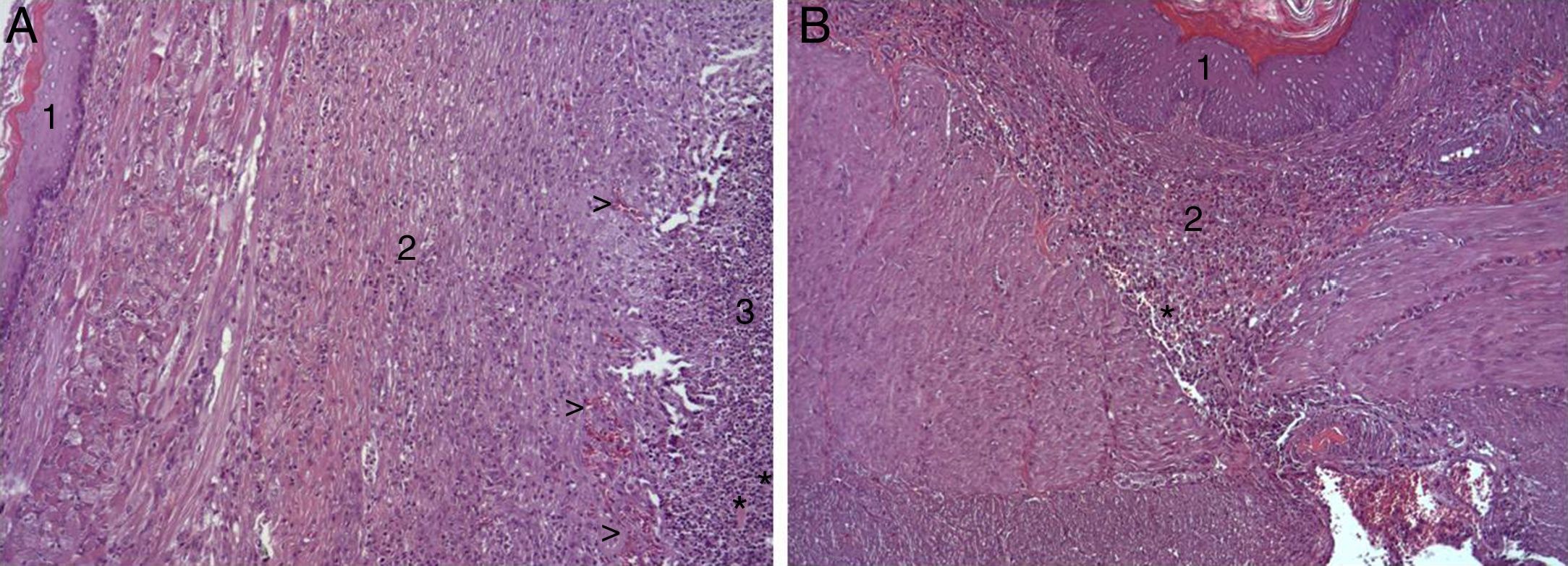
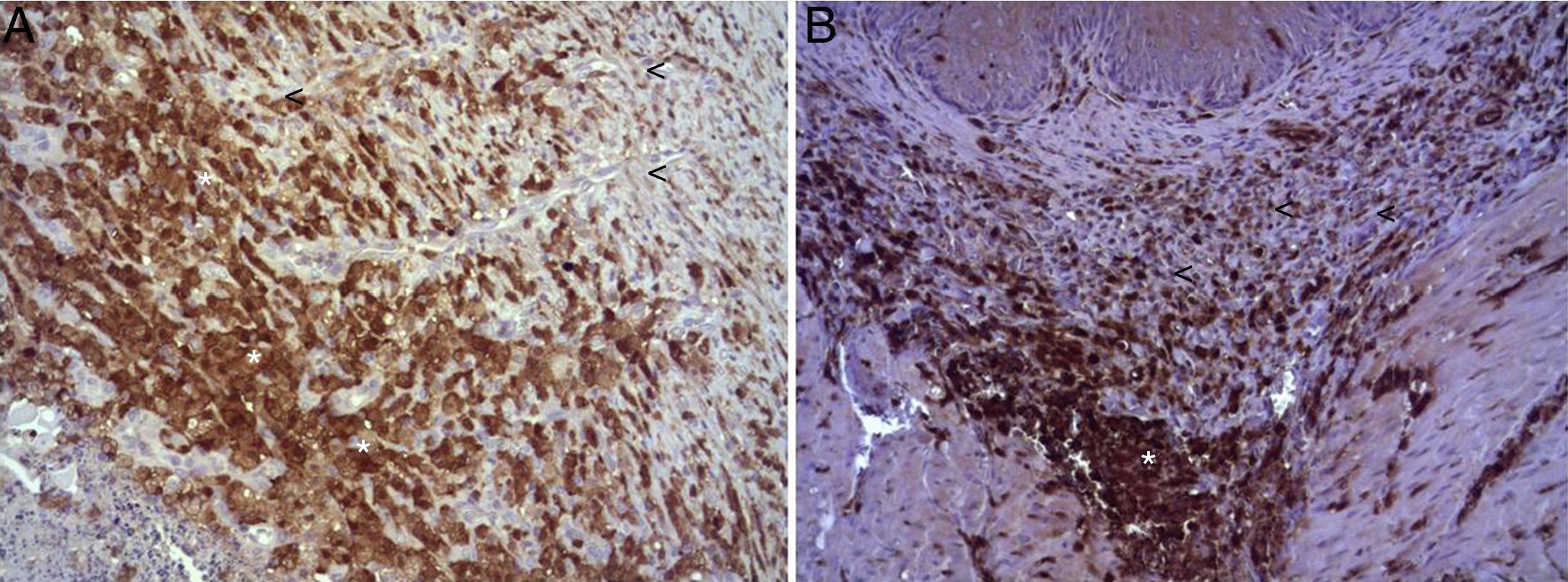
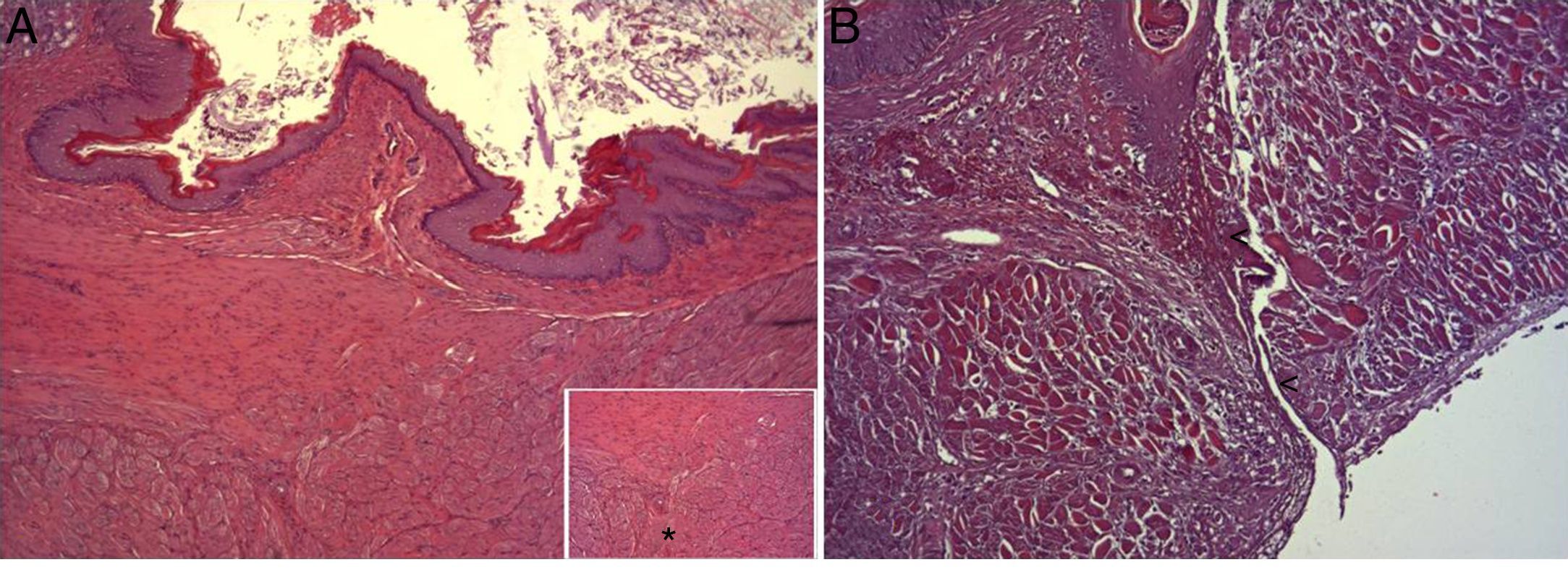
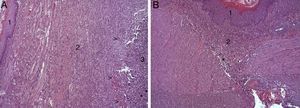
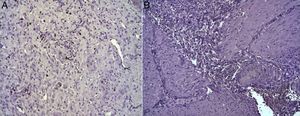
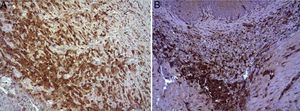
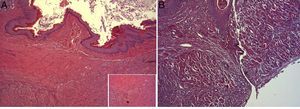
En el estudio microscópico, en el grupo en el que se aplicó apósito de colágeno como sellante se apreció, en la zona de sección, una profusa reacción inflamatoria a cuerpo extraño que afectaba a la pared esofágica, con un centro de restos de material fibrilar con abundantes polimorfonucleares neutrófilos y macrófagos rodeados por una matriz conectiva con numerosos fibroblastos y vasos sanguíneos (fig. 3A). El análisis de expresión de Ki-67 reveló la proliferación de fibroblastos y, ocasionalmente, células endoteliales (fig. 4A), y se identificaron abundantes macrófagos positivos al VEGF (fig. 5A) y una fuerte expresión de FGF1 y FGF2 asociado a fibroblastos y células del infiltrado inflamatorio. La reacción inflamatoria en el grupo control se limitó exclusivamente al área de intervención, con la presencia de un infiltrado difuso rico en polimorfonucleares neutrófilos y macrófagos, con poca o nula proliferación conectiva, sin signos evidentes de neovascularización (fig. 3B). El análisis inmunohistoquímico reveló poca o nula proliferación celular (fig. 4B), mientras que la expresión de VEGF, FGF1 y FGF2 fue sensiblemente menos acusada en comparación con el grupo de apósito de colágeno (fig. 5B). El análisis inmunohistopatológico al día 30 reveló en los animales en los que se utilizó apósito de colágeno una completa regeneración epitelial, conectiva y muscular de la pared esofágica sin signos de fibrosis (fig. 6A), mientras que en el grupo control se observaron signos de cicatrización asociada al área de sección (fig. 6B). En ninguno de los 2 grupos se observó expresión de Ki-67, VEGF, FGF1 y FGF2.
(A) Imagen representativa de los cambios histopatológicos más relevantes observados tras la aplicación del parche de apósito de colágeno a los 8 días tras la intervención. Tras la regeneración epitelial completa (1), se observa en la zona de sección la presencia de una profusa reacción inflamatoria, caracterizada por una abundante proliferación conectiva (2) y vascular (cabezas de flecha), con una zona central rica en PMN y macrófagos (3), junto con restos de material proteináceo fibrilar y debris celular (asteriscos). Hematoxilina-eosina ×100 aumentos. (B) Imagen representativa de los cambios histopatológicos más relevantes observados en los animales control a los 8 días tras la intervención. Tras la regeneración epitelial completa (1) se observa en la zona de sección la presencia de un infiltrado inflamatorio difuso rico en macrófagos y PMN (2), con una zona de debris celular (asterisco). Hematoxilina-eosina ×100 aumentos.
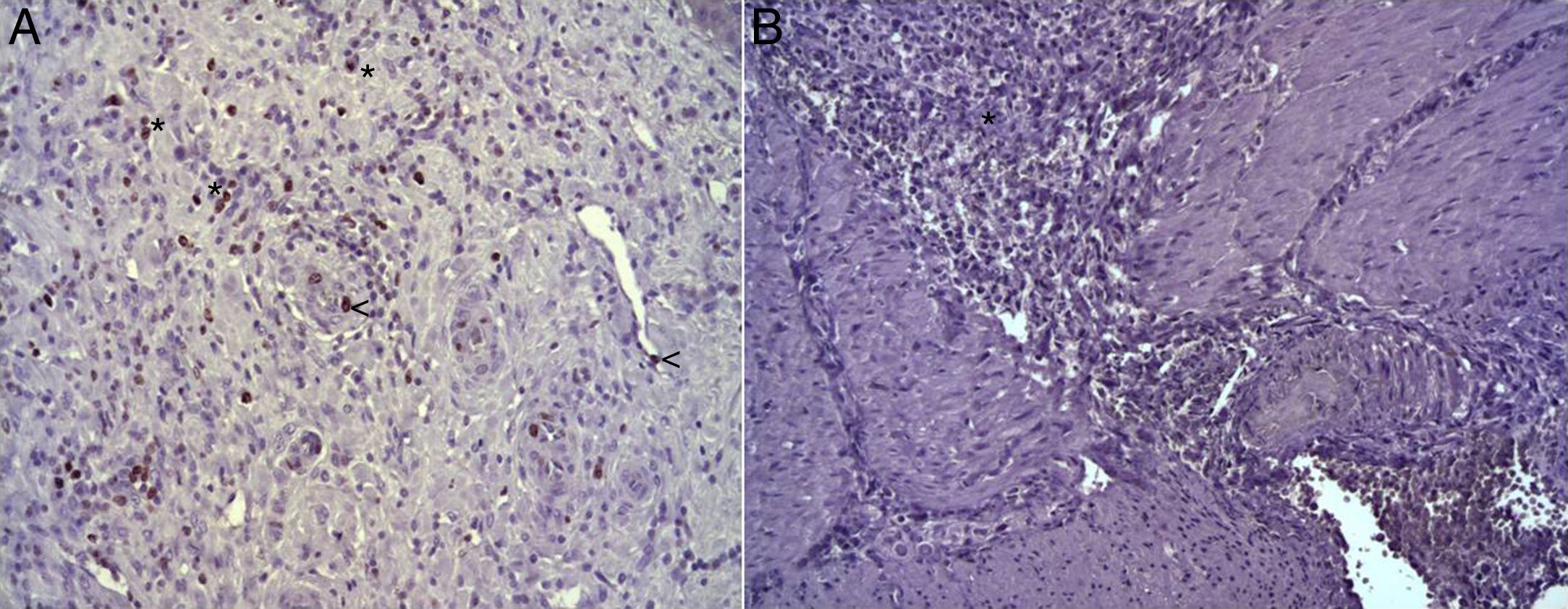
(A) Expresión de la proteína Ki-67 en el esófago de animales en los que se aplicó el parche apósito de colágeno a los 8 días tras la intervención. Se observan abundantes fibroblastos positivos (asteriscos) y, ocasionalmente, células endoteliales (cabezas de flecha). Inmunohistoquímica ABC anti-Ki67 ×200 aumentos. (B) Expresión de la proteína Ki-67 en el esófago de los animales control a los 8 días tras la intervención. No se observan células positivas en el área de infiltrado inflamatorio (asterisco). Inmunohistoquímica ABC anti-Ki67 ×200 aumentos.
(A) Expresión del VEGF en el esófago de animales en los que se aplicó el parche apósito de colágeno a los 8 días tras la intervención. Se observan abundantes macrófagos positivos (asteriscos), junto a numerosos vasos sanguíneos (cabezas de flecha). Inmunohistoquímica ABC anti-VEGF ×200 aumentos. (B) Expresión del VEGF en el esófago de los animales control a los 8 días tras la intervención. Se observa un bajo número de células positivas (cabezas de flecha) en el infiltrado inflamatorio, próximo al área de debris celular (asterisco). Inmunohistoquímica ABC anti-VEGF ×200 aumentos.
(A) Imagen representativa de los cambios histopatológicos más relevantes observados tras la aplicación del parche de apósito de colágeno a los 30 días tras la intervención. Se observa una reconstitución completa de toda la pared esofágica, incluyendo la lámina muscular (asterisco). Hematoxilina-eosina ×100 aumentos. (B) Imagen representativa de los cambios histopatológicos más relevantes observados en el grupo de animales control a los 30 días tras la intervención. Obsérvese la línea de tejido conectivo que atraviesa todas las capas de la pared esofágica (cabezas de flecha). Hematoxilina-eosina ×100 aumentos.
El presente trabajo ha tenido como finalidad el estudio de los mecanismos fisiopatológicos e histológicos que acontecen en la anastomosis esofagogástrica tras aplicación de la esponja de apósito de colágeno en un modelo experimental de rata. En nuestro estudio la presión de dehiscencia medida por manometría fue significativamente más alta en aquellos casos en los que se aplicó el parche de fibrina frente al grupo control, resultados que concuerdan con estudios previos6.
Hemos observado a los 8 días tras la cirugía una profusa reacción inflamatoria a cuerpo extraño asociada a apósito de colágeno con signos de proliferación celular y expresión VEGF, FGF1 y FGF2, citoquinas implicadas en los fenómenos de regeneración tisular8 y signos de restitutio ad integrum de la pared esofágica al día 30. Estudios previos6 han demostrado la presencia al 7.° día poscirugía de un incremento acusado de la proliferación fibroblástica y aumento de la cantidad de tejido conectivo asociado a la aplicación de apósito de colágeno sobre las anastomosis5,6. Nuestros resultados avalan esos estudios, mostrando además la presencia de signos de proliferación vascular asociada al fenómeno inflamatorio, en comparación con el grupo al que no le fue aplicada la esponja de apósito de colágeno. Así mismo, hemos observado la mayor expresión de VEFG en macrófagos del infiltrado inflamatorio del grupo al que se le aplicó apósito de colágeno. Existen estudios previos9,10 que sugieren un papel importante del VEGF en los fenómenos de reparación y regeneración tisular, así pues esta abundante expresión de VEGF por parte de esta subpoblación celular en los animales en los que se le ha aplicado apósito de colágeno podría colaborar en el incremento de la matriz conectiva observada. Por otra parte, también hemos observado una abundante expresión de FGF-1 y FGF-2 en estos animales en relación con el grupo control. El FGF es una citoquina secretada por un abundante número de subpoblaciones celulares, directamente implicada en fenómenos de cicatrización11, por lo que nuevamente la secreción de estas citoquinas colaboraría en los fenómenos de regeneración tisular, la cual globalmente se demuestra muy eficaz tras observar la restitución completa de la arquitectura tisular del órgano al día 30 poscirugía. En cambio, en los animales del grupo control se observó la presencia de cicatriz conectiva, con la posibilidad de pérdida de funcionalidad. No existen estudios previos que analicen los mecanismos fisiológicos que acontecen tras la realización de anastomosis esofagogástrica reforzada con apósito de colágeno.
Podría existir la duda sobre si la mayor resistencia de las anastomosis en el grupo experimental se debe tanto o más al proceso inflamatorio que se desarrolla, al efecto reparador del dispositivo aplicado o a ambos. En cualquier caso, estos resultados indican que la aplicación de la esponja apósito de colágeno facilita los fenómenos de reparación tisular, por lo que podría ser de gran utilidad como refuerzo de las anastomosis esofagogástricas para la prevención de dehiscencias.
AutoríaRocío García Pérez: diseño del estudio, adquisición y recogida de datos, análisis e interpretación de los resultados y redacción del artículo.
Vicente Munitiz: diseño del estudio, adquisición y recogida de datos, análisis e interpretación de los resultados, redacción del artículo, revisión crítica y aprobación de la versión final.
Carlos Manuel Martínez Cáceres: adquisición y recogida de datos, análisis e interpretación de los resultados y redacción del artículo.
David Ruiz de Angulo: adquisición y recogida de datos y redacción del artículo.
Angeles Ortiz: diseño del estudio, revisión crítica y aprobación de la versión final.
Luisa F. Martínez de Haro: diseño del estudio, revisión crítica y aprobación de la versión final.
Diana Navas: adquisición y recogida de datos y análisis e interpretación de los resultados.
Pascual Parrilla: diseño del estudio, revisión crítica y aprobación de la versión final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentado como poster en el XXIX Congreso Nacional de Cirugía de la AEC (Madrid 2012).