El objetivo de este estudio observacional, prospectivo, multicéntrico y multinivel ha sido evaluar los resultados oncológicos (recidiva local, metástasis y supervivencia global) del Proyecto del Cáncer de Recto de la Asociación Española de Cirujanos (AEC) 10 años después de su inicio, comparando los resultados con los registros escandinavos.
MétodosLa base de datos del proyecto docente de la AEC incluye hasta la fecha a 17.620 pacientes, de los cuales 4.508 fueron operados con una resección potencialmente curativa entre marzo de 2006 y diciembre de 2010. Todos ellos son provenientes de los primeros 59 hospitales incluidos en el proyecto, y por tanto seguidos al menos durante 5 años, y constituyen el objeto del presente estudio.
ResultadosLa incidencia acumulada de recidiva local fue 7,3 (IC 95%: 8,2-6,5), la de metástasis fue 21,0 (IC 95%: 22,4-19,7) y la de supervivencia global, 72,3 (IC 95%: 80,3-77,6). El análisis de regresión multinivel, con la variable hospital como un efecto aleatorio, mostró una variación significativa entre los hospitales para las variables de resultado oncológico: supervivencia general, recidiva local y metástasis (δ2=0,053).
ConclusionesEste estudio indica que los resultados observados en el Proyecto del Cáncer de Recto de la AEC son inferiores a los observados en los registros de Escandinavia a los que tratamos de emular y que ello es atribuible a la variabilidad de la práctica en algunos centros.
The objective of this observational, prospective, multicenter and multilevel study was to evaluate the oncological outcomes (local recurrence, metastasis and overall survival) of the Rectal Cancer Project of the Spanish Association of Surgeons (AEC) 10 years after its initiation, comparing the results with Scandinavian registries.
MethodsThe AEC teaching project database includes 17,620 patients to date, of which 4,508 were operated on with a potentially curative resection between March 2006 and December 2010. All of them come from the first 59 hospitals included in the project, and therefore followed for at least 5 years, and are the subject of the present study.
ResultsThe cumulative incidence of local recurrence was 7.3 (95% CI: 8.2-6.5), metastasis 21.0 (CI 95%: 22.4-19.7) and overall survival 72.3 (CI 95%: 80.3-77.6). The multilevel regression analysis with the hospital variable as a random effect, showed a significant variation among the hospitals for the cancer outcome variables: general survival, local recurrence and metastasis (δ2=0.053).
ConclusionsThis study indicates that the results observed in the AEC’ Rectal Cancer Project are inferior than those observed in the Scandinavian registries that we tried to emulate and that this is attributable to the variability of practice in some centers.
Para conocer, y si era posible mejorar, los resultados oncológicos del tratamiento del cáncer de recto en España, la Asociación Española de Cirujanos (AEC) introdujo en el año 2006 un proyecto1 inspirado en el Norwegian Colon and Rectal Cancer Project2. Esta iniciativa docente tuvo por objetivo difundir y sistematizar, inicialmente, la cirugía de escisión del mesorrecto y, posteriormente, la amputación abdominoperineal extendida3 a los grupos multidisciplinares de los 105 hospitales del Sistema Nacional de Salud que lo solicitaron y que cumplían las condiciones requeridas entre los años 2006 y 2012 (anexo).
El objetivo de este estudio ha sido evaluar los resultados oncológicos conseguidos por esta iniciativa docente 10 años después de su inicio y determinar si estos resultados han permitido conseguir los estándares de calidad observados en los registros de los países escandinavos, a los que este proyecto intenta imitar.
MétodosEste estudio observacional multicéntrico se ha realizado con la base de datos prospectiva del Proyecto del Cáncer de Recto de la AEC.
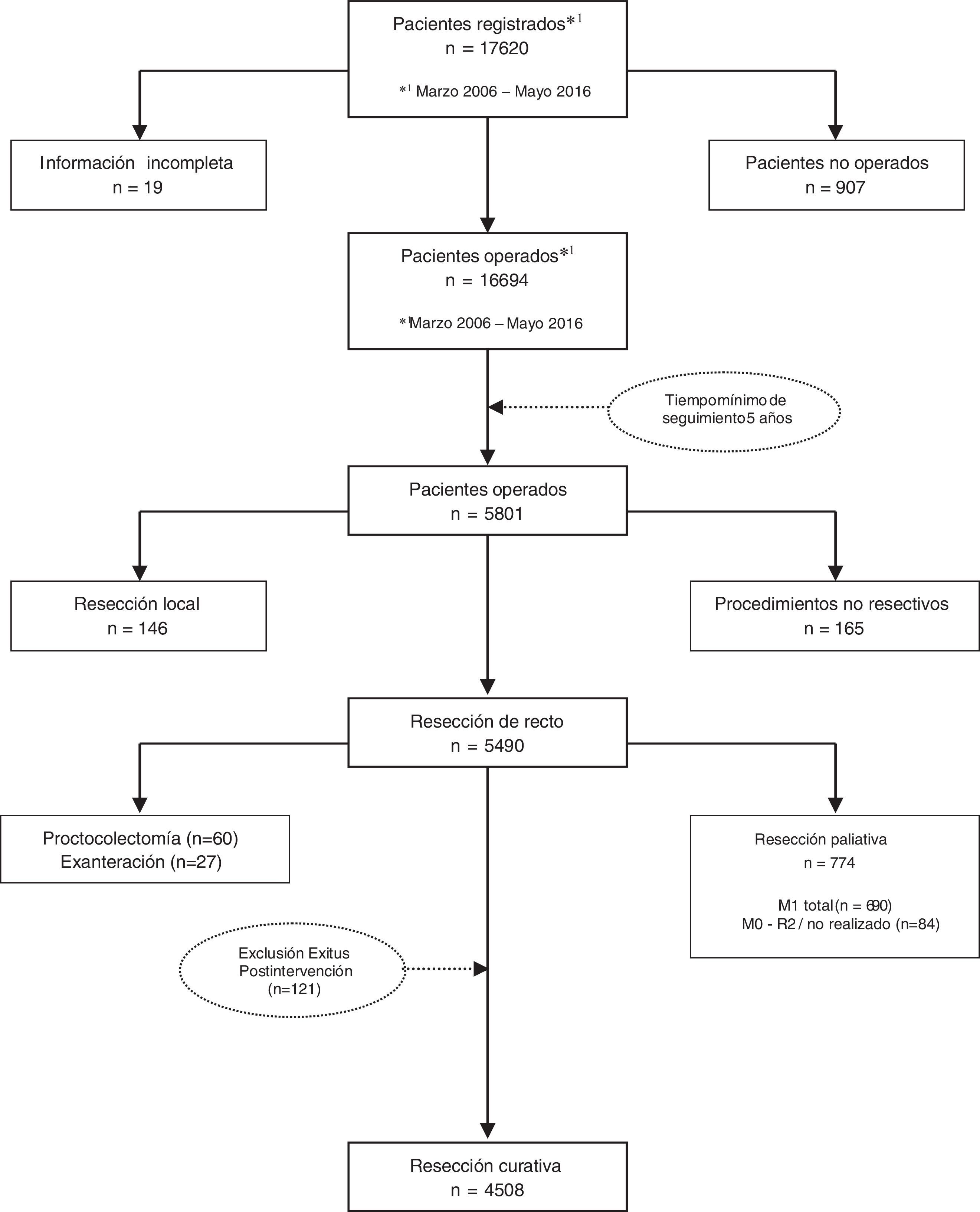
Selección de pacientes. Se incluyeron los pacientes intervenidos de forma electiva, en los primeros 59 hospitales incluidos en el proyecto, entre el 1 de marzo de 2006 y el 1 de diciembre de 2010, con resecciones curativas de recto con o sin restablecimiento de la continuidad intestinal: resección anterior (RA); resección abdominoperineal (APER) e intervención de Hartmann.
Se excluyeron los pacientes no operados, los tratados con operaciones no resectivas: laparotomía o laparoscopia exploradoras, estoma como único gesto y derivaciones; los intervenidos con las técnicas siguientes: resección local, proctocolectomía y exenteración pélvica; aquellos en los que las operaciones no se consideraron curativas, así como los pacientes con afectación del margen distal histopatológico y los pacientes operados de urgencia.
Variables de estudio. Las variables de resultado del estudio fueron: la recidiva local, las metástasis aparecidas en el seguimiento y la supervivencia global. Las variables de confusión fueron las siguientes: sexo, edad categorizada en 3 grupos (<65, 65-80, >80años), la gravedad del riesgo quirúrgico (medida mediante el grado del riesgo anestésico ASA), la localización del tumor categorizada en 3 grupos desde el margen anal (0-6, 7-12, 13-15cm), el tipo de escisión del mesorrecto (parcial o total), el tipo de operación practicado (RA, APER, y operación de Hartmann), la perforación intraoperatoria del tumor o del recto, el estado del margen rectal circunferencial (MRC) (libre o invadido), la utilización de tratamiento neoadyuvante y adyuvante, y el estadio patológico del tumor.
Definiciones y estándares. Se consideraron tumores de recto, según la Clasificación Internacional de Enfermedades (CIE10-C20), los situados en los últimos 15cm medidos desde el margen anal mediante rectoscopia rígida o mediante resonancia magnética (RM)4.
Una resección se consideró potencialmente curativa en aquellos casos en los que se practicó un procedimiento localmente radical con márgenes distal y circunferencial libres o con invasión microscópica de los mismos (R0 y R1) y en ausencia de metástasis.
El estadio tumoral patológico se clasificó con la quinta versión de la clasificación TNM (American Joint Committee on Cancer stagesI-IV; fifth edition)5. La perforación intraoperatoria se definió como cualquier defecto de la pared del recto producido por la operación que pusiera en contacto la luz del recto con la superficie. El MRC se consideró invadido si se encontraban células neoplásicas a 1mm o menos del mismo.
La recidiva local fue definida como la reaparición de la enfermedad en la pelvis, incluyendo: la anastomosis y la herida perineal, independientemente de que el paciente tuviera metástasis a distancia. La recidiva aislada en los ovarios se consideró como metástasis.
Dado el anonimato de hospitales y pacientes, no se consideró necesaria la aprobación por los comités de ética de los centros incluidos, aunque el proyecto había sido avalado por estos comités.
Análisis estadísticoPrevio a la realización de los análisis se llevó a cabo un análisis exploratorio de los datos para detectar casos extremos, no respuesta y casos perdidos. Se efectuó un análisis descriptivo univariante, donde las variables cuantitativas se resumieron mediante media y desviación estándar y las variables categóricas mediante frecuencias y porcentajes. Los resultados relacionados con la incidencia de recidiva, metástasis y supervivencia global se presentaron como el número total de eventos y el intervalo de confianza al 95% (IC 95%); se consideró que los pacientes estaban en riesgo de experimentar los eventos indicados hasta el fallecimiento, la pérdida de seguimiento por cambio de ciudad de residencia o finalización del seguimiento a los 5 años. La incidencia de estos eventos se estimó mediante el método de Kaplan-Meier.
La identificación de las variables de confusión que tienen un impacto significativo en la supervivencia global, recidiva local y metástasis en el seguimiento se llevó a cabo a través de los modelos de riesgos proporcionales de Cox. Se consideró que el ajuste era necesario para corregir el sesgo de confusión si el cambio entre el efecto ajustado y sin ajustar era superior al 10%. Se evaluó el supuesto de riesgos proporcionales mediante el contraste de Therneau-Grambsch. Los resultados se expresaron como la hazard ratio (HR) y su IC 95%.
Como los pacientes de un mismo hospital tienen una probabilidad mayor de tener unos resultados oncológicos similares, dependientes de las características de los pacientes y de los tumores, que los observados en otros hospitales, la regresión logística se amplió con la variable hospital como un efecto aleatorio para corregir por la no independencia de los datos.
Los análisis se realizaron con los paquetes estadísticos IBM SPSS (versión 24), R (versión 3.3.2) y STATA IC13, con un nivel de significación de 0,05.
ResultadosEntre los años 2006 y 2012 se formaron en 10 cursos los grupos multidisciplinarios (GMD) de 105 hospitales. De ellos, 23 abandonaron el proyecto y 6 hospitales se han fusionado quedando 3 en su lugar. En total, y hasta hoy, los 79 centros participantes han incluido 17.620 pacientes en la base de datos.
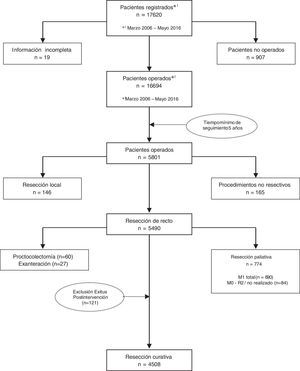
Los resultados que se presentan en este estudio son los observados en los pacientes tratados de forma electiva con una resección curativa de recto en los 59 centros participantes entre el 1 de marzo de 2006 y el 31 de diciembre de 2010, contando por tanto con un mínimo de 5 años de seguimiento. En este periodo, una vez aplicados los criterios de exclusión indicados en el diagrama de flujo (fig. 1), 4.716 pacientes consecutivos fueron tratados con una resección rectal curativa; de ellos, 4.508 pacientes sobrevivieron a la operación y fueron incluidos en el análisis de los resultados oncológicos.
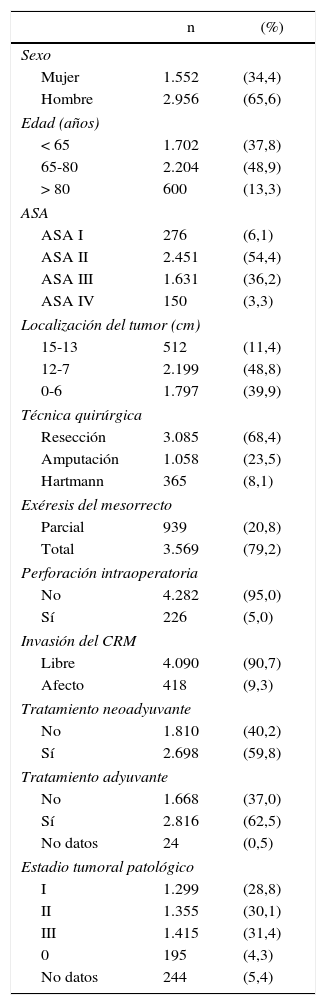
Las características de esta cohorte de pacientes se muestran en la tabla 1. En 3.085 (68,4%) pacientes se realizó una RA, 1.058 (23,5%) fueron tratados con una APER, y 365 (8,1%) con una operación de Hartmann.
Descripción de la muestra de pacientes (n=4.508)
| n | (%) | |
|---|---|---|
| Sexo | ||
| Mujer | 1.552 | (34,4) |
| Hombre | 2.956 | (65,6) |
| Edad (años) | ||
| < 65 | 1.702 | (37,8) |
| 65-80 | 2.204 | (48,9) |
| > 80 | 600 | (13,3) |
| ASA | ||
| ASA I | 276 | (6,1) |
| ASA II | 2.451 | (54,4) |
| ASA III | 1.631 | (36,2) |
| ASA IV | 150 | (3,3) |
| Localización del tumor (cm) | ||
| 15-13 | 512 | (11,4) |
| 12-7 | 2.199 | (48,8) |
| 0-6 | 1.797 | (39,9) |
| Técnica quirúrgica | ||
| Resección | 3.085 | (68,4) |
| Amputación | 1.058 | (23,5) |
| Hartmann | 365 | (8,1) |
| Exéresis del mesorrecto | ||
| Parcial | 939 | (20,8) |
| Total | 3.569 | (79,2) |
| Perforación intraoperatoria | ||
| No | 4.282 | (95,0) |
| Sí | 226 | (5,0) |
| Invasión del CRM | ||
| Libre | 4.090 | (90,7) |
| Afecto | 418 | (9,3) |
| Tratamiento neoadyuvante | ||
| No | 1.810 | (40,2) |
| Sí | 2.698 | (59,8) |
| Tratamiento adyuvante | ||
| No | 1.668 | (37,0) |
| Sí | 2.816 | (62,5) |
| No datos | 24 | (0,5) |
| Estadio tumoral patológico | ||
| I | 1.299 | (28,8) |
| II | 1.355 | (30,1) |
| III | 1.415 | (31,4) |
| 0 | 195 | (4,3) |
| No datos | 244 | (5,4) |
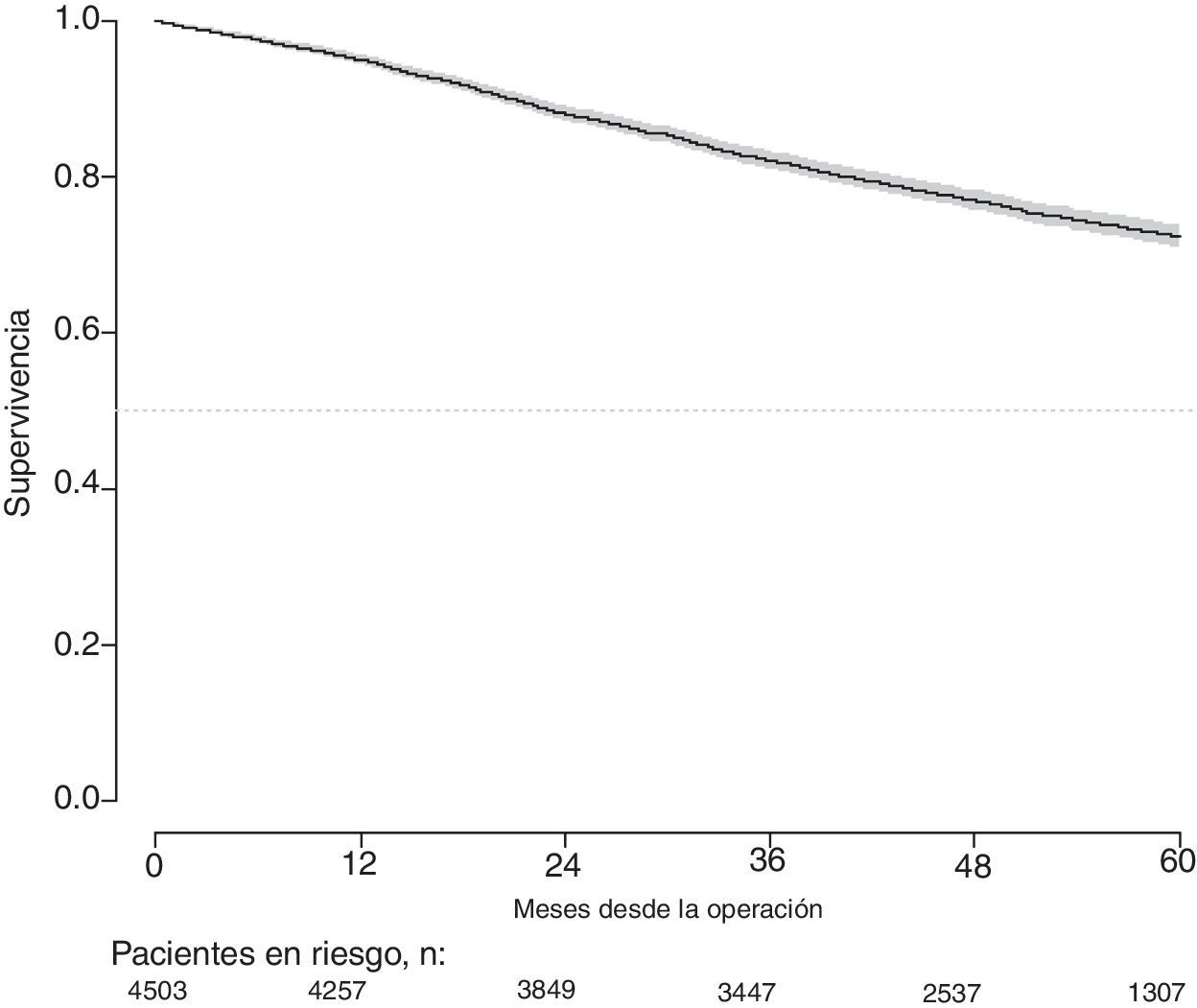
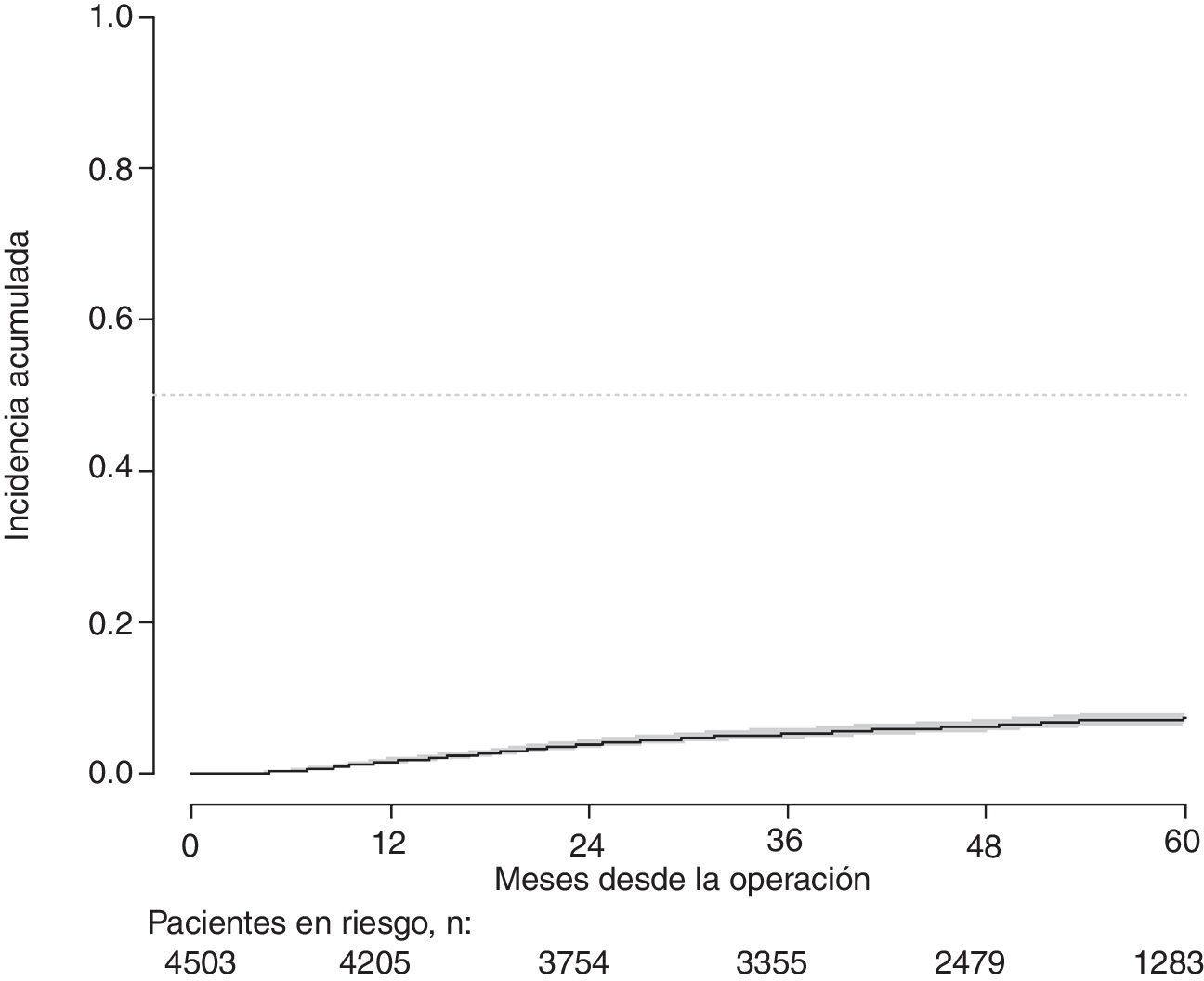
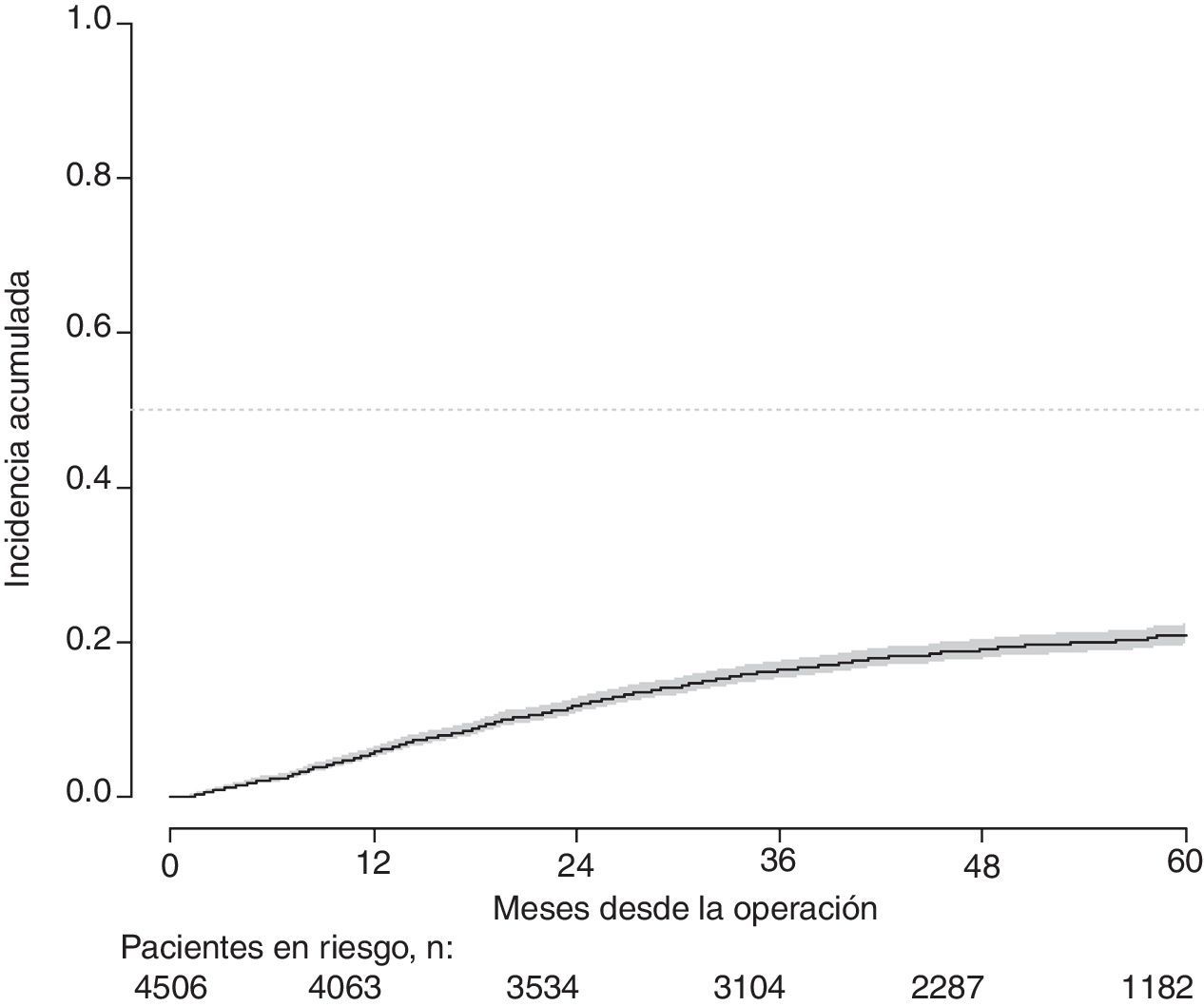
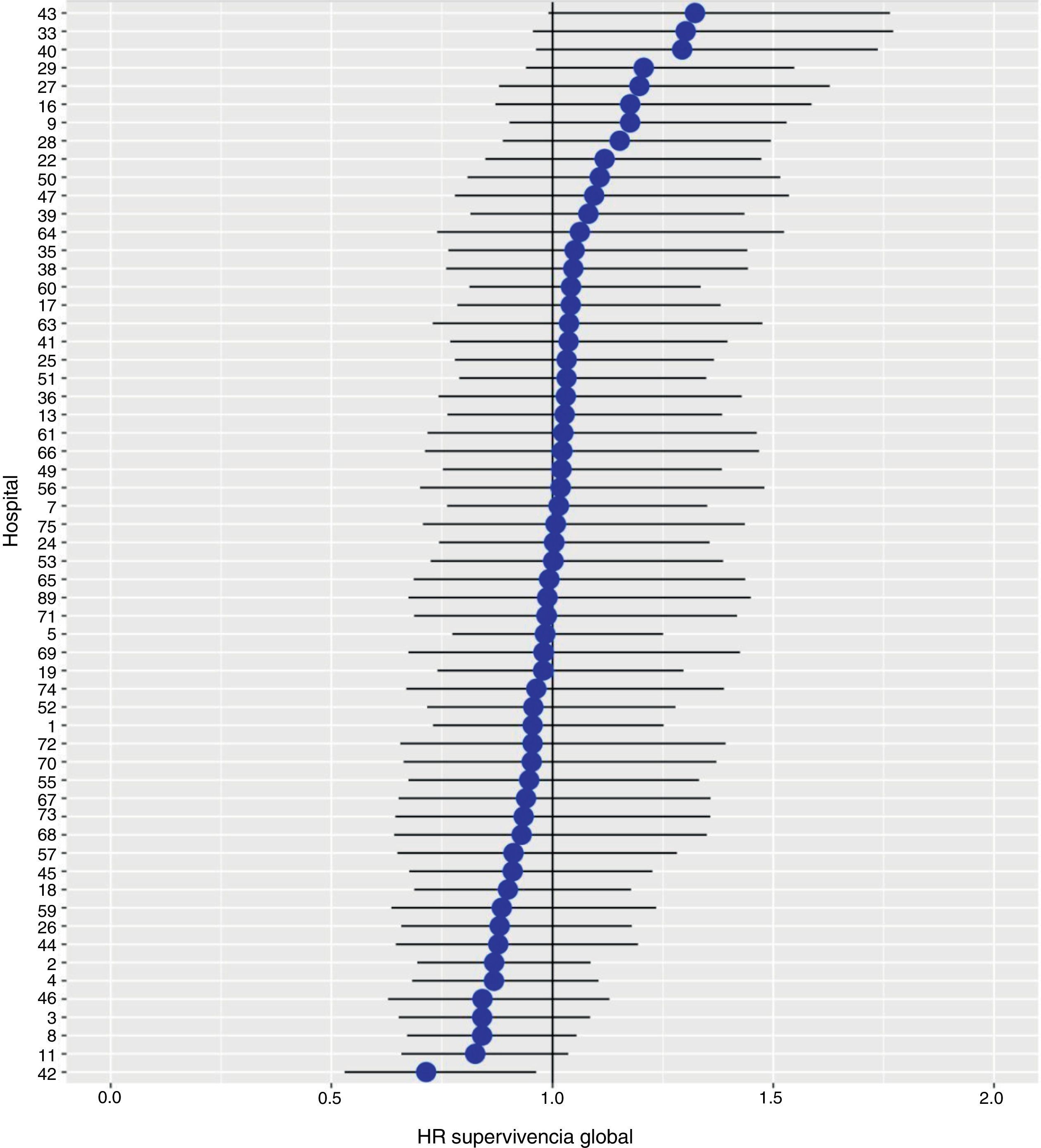
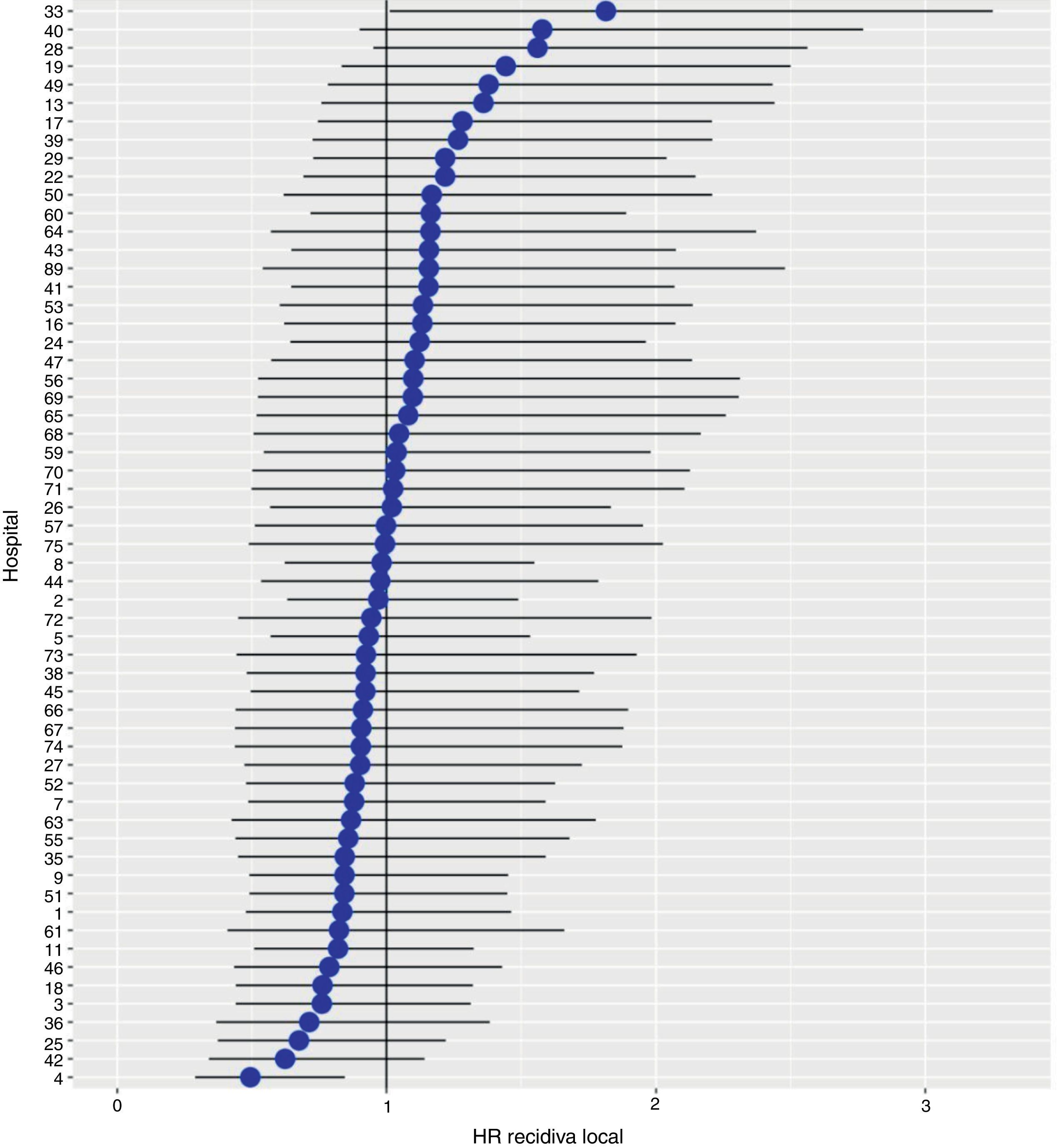
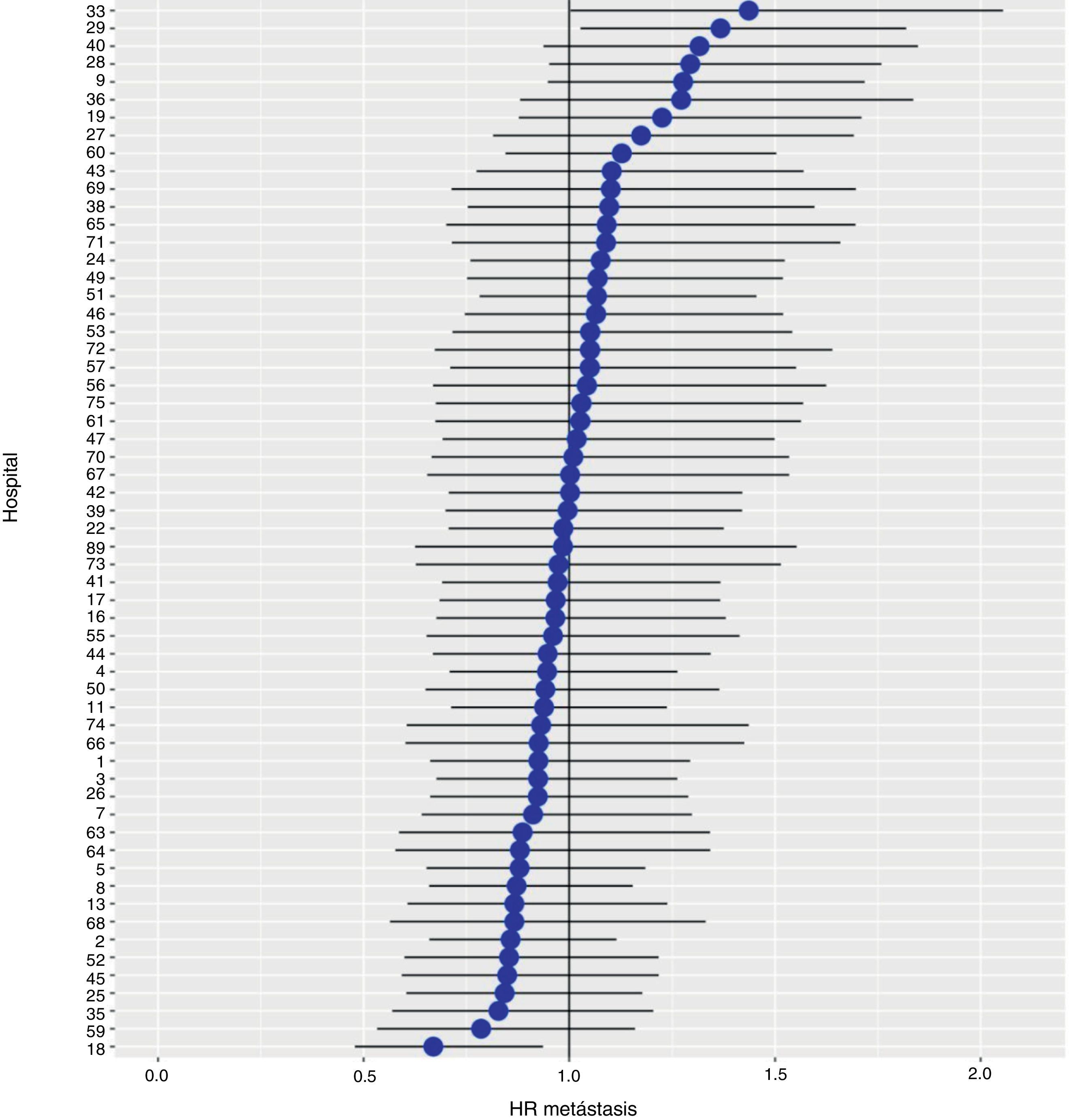
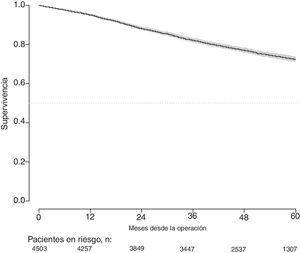
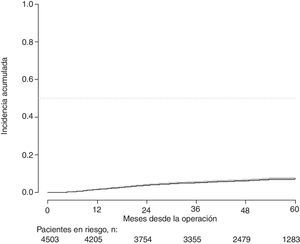
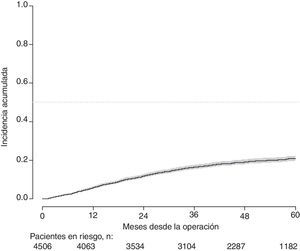
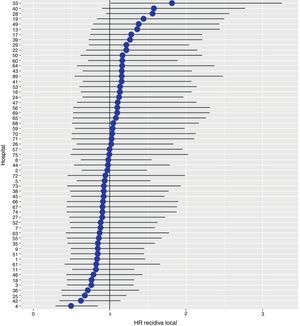
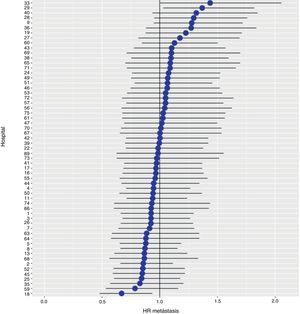
Con un seguimiento de al menos 5 años, la incidencia acumulada de recidiva local fue del 7,3% (IC 95%: 6,5-8,2) (fig. 2), la de metástasis en el seguimiento fue del 21% (IC 95%: 19,7-22,4) (fig. 3) y la de supervivencia global, del 72,3% (IC 95%: 70,9-73,8) (fig. 4).
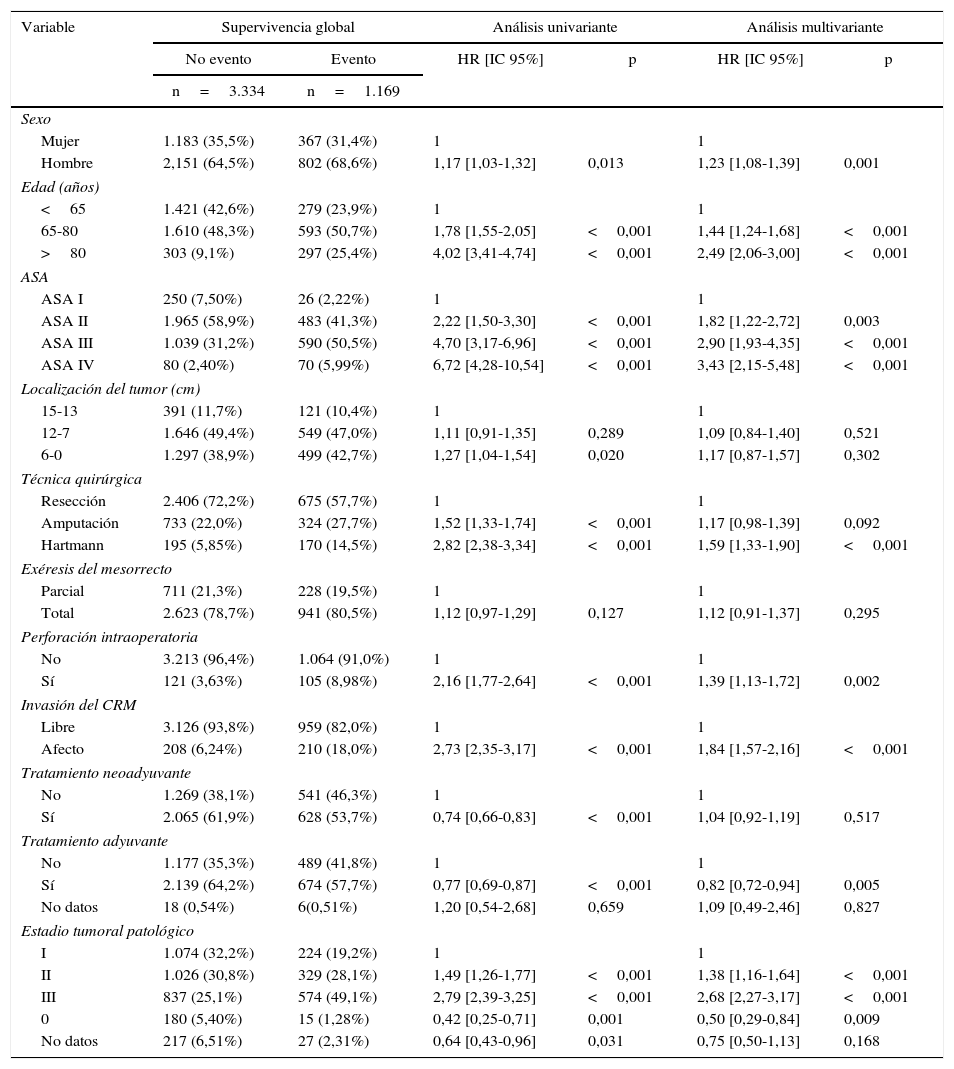
Los resultados de los análisis univariante y multivariante realizados para determinar la influencia de las variables de confusión en los resultados oncológicos se muestran en las tablas 2-4. La perforación intraoperatoria, la invasión del MRC, los estadios tumorales avanzados, y la intervención de Hartmann influyeron negativamente en las 3 variables de resultado: recidiva local, metástasis en el seguimiento y supervivencia global. El sexo masculino influyó negativamente en la recidiva local y supervivencia global. Además, la edad avanzada de los pacientes y los mayores riesgos ASA influyeron negativamente en la supervivencia global.
Influencia de las variables de confusión en la supervivencia global
| Variable | Supervivencia global | Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|---|---|
| No evento | Evento | HR [IC 95%] | p | HR [IC 95%] | p | |
| n=3.334 | n=1.169 | |||||
| Sexo | ||||||
| Mujer | 1.183 (35,5%) | 367 (31,4%) | 1 | 1 | ||
| Hombre | 2,151 (64,5%) | 802 (68,6%) | 1,17 [1,03-1,32] | 0,013 | 1,23 [1,08-1,39] | 0,001 |
| Edad (años) | ||||||
| <65 | 1.421 (42,6%) | 279 (23,9%) | 1 | 1 | ||
| 65-80 | 1.610 (48,3%) | 593 (50,7%) | 1,78 [1,55-2,05] | <0,001 | 1,44 [1,24-1,68] | <0,001 |
| >80 | 303 (9,1%) | 297 (25,4%) | 4,02 [3,41-4,74] | <0,001 | 2,49 [2,06-3,00] | <0,001 |
| ASA | ||||||
| ASA I | 250 (7,50%) | 26 (2,22%) | 1 | 1 | ||
| ASA II | 1.965 (58,9%) | 483 (41,3%) | 2,22 [1,50-3,30] | <0,001 | 1,82 [1,22-2,72] | 0,003 |
| ASA III | 1.039 (31,2%) | 590 (50,5%) | 4,70 [3,17-6,96] | <0,001 | 2,90 [1,93-4,35] | <0,001 |
| ASA IV | 80 (2,40%) | 70 (5,99%) | 6,72 [4,28-10,54] | <0,001 | 3,43 [2,15-5,48] | <0,001 |
| Localización del tumor (cm) | ||||||
| 15-13 | 391 (11,7%) | 121 (10,4%) | 1 | 1 | ||
| 12-7 | 1.646 (49,4%) | 549 (47,0%) | 1,11 [0,91-1,35] | 0,289 | 1,09 [0,84-1,40] | 0,521 |
| 6-0 | 1.297 (38,9%) | 499 (42,7%) | 1,27 [1,04-1,54] | 0,020 | 1,17 [0,87-1,57] | 0,302 |
| Técnica quirúrgica | ||||||
| Resección | 2.406 (72,2%) | 675 (57,7%) | 1 | 1 | ||
| Amputación | 733 (22,0%) | 324 (27,7%) | 1,52 [1,33-1,74] | <0,001 | 1,17 [0,98-1,39] | 0,092 |
| Hartmann | 195 (5,85%) | 170 (14,5%) | 2,82 [2,38-3,34] | <0,001 | 1,59 [1,33-1,90] | <0,001 |
| Exéresis del mesorrecto | ||||||
| Parcial | 711 (21,3%) | 228 (19,5%) | 1 | 1 | ||
| Total | 2.623 (78,7%) | 941 (80,5%) | 1,12 [0,97-1,29] | 0,127 | 1,12 [0,91-1,37] | 0,295 |
| Perforación intraoperatoria | ||||||
| No | 3.213 (96,4%) | 1.064 (91,0%) | 1 | 1 | ||
| Sí | 121 (3,63%) | 105 (8,98%) | 2,16 [1,77-2,64] | <0,001 | 1,39 [1,13-1,72] | 0,002 |
| Invasión del CRM | ||||||
| Libre | 3.126 (93,8%) | 959 (82,0%) | 1 | 1 | ||
| Afecto | 208 (6,24%) | 210 (18,0%) | 2,73 [2,35-3,17] | <0,001 | 1,84 [1,57-2,16] | <0,001 |
| Tratamiento neoadyuvante | ||||||
| No | 1.269 (38,1%) | 541 (46,3%) | 1 | 1 | ||
| Sí | 2.065 (61,9%) | 628 (53,7%) | 0,74 [0,66-0,83] | <0,001 | 1,04 [0,92-1,19] | 0,517 |
| Tratamiento adyuvante | ||||||
| No | 1.177 (35,3%) | 489 (41,8%) | 1 | 1 | ||
| Sí | 2.139 (64,2%) | 674 (57,7%) | 0,77 [0,69-0,87] | <0,001 | 0,82 [0,72-0,94] | 0,005 |
| No datos | 18 (0,54%) | 6(0,51%) | 1,20 [0,54-2,68] | 0,659 | 1,09 [0,49-2,46] | 0,827 |
| Estadio tumoral patológico | ||||||
| I | 1.074 (32,2%) | 224 (19,2%) | 1 | 1 | ||
| II | 1.026 (30,8%) | 329 (28,1%) | 1,49 [1,26-1,77] | <0,001 | 1,38 [1,16-1,64] | <0,001 |
| III | 837 (25,1%) | 574 (49,1%) | 2,79 [2,39-3,25] | <0,001 | 2,68 [2,27-3,17] | <0,001 |
| 0 | 180 (5,40%) | 15 (1,28%) | 0,42 [0,25-0,71] | 0,001 | 0,50 [0,29-0,84] | 0,009 |
| No datos | 217 (6,51%) | 27 (2,31%) | 0,64 [0,43-0,96] | 0,031 | 0,75 [0,50-1,13] | 0,168 |
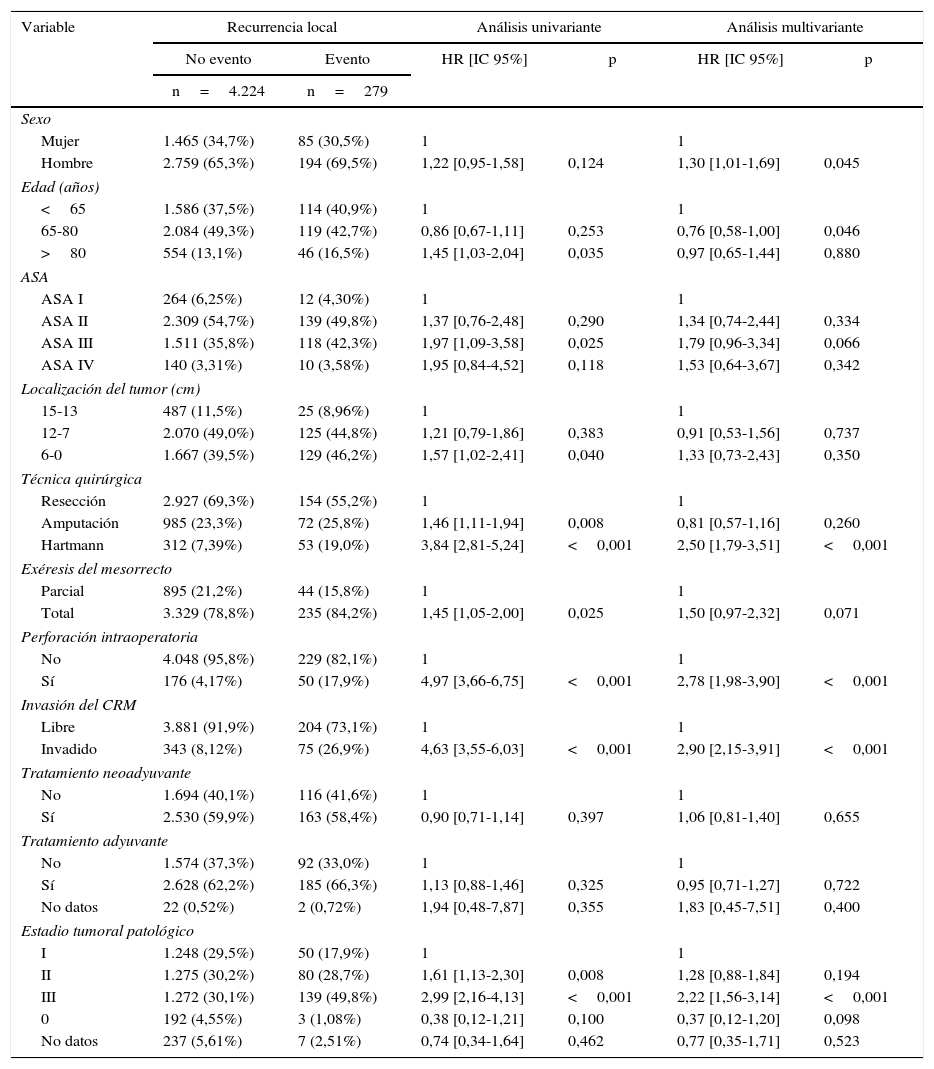
Influencia de las variables de confusión en la recidiva local
| Variable | Recurrencia local | Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|---|---|
| No evento | Evento | HR [IC 95%] | p | HR [IC 95%] | p | |
| n=4.224 | n=279 | |||||
| Sexo | ||||||
| Mujer | 1.465 (34,7%) | 85 (30,5%) | 1 | 1 | ||
| Hombre | 2.759 (65,3%) | 194 (69,5%) | 1,22 [0,95-1,58] | 0,124 | 1,30 [1,01-1,69] | 0,045 |
| Edad (años) | ||||||
| <65 | 1.586 (37,5%) | 114 (40,9%) | 1 | 1 | ||
| 65-80 | 2.084 (49,3%) | 119 (42,7%) | 0,86 [0,67-1,11] | 0,253 | 0,76 [0,58-1,00] | 0,046 |
| >80 | 554 (13,1%) | 46 (16,5%) | 1,45 [1,03-2,04] | 0,035 | 0,97 [0,65-1,44] | 0,880 |
| ASA | ||||||
| ASA I | 264 (6,25%) | 12 (4,30%) | 1 | 1 | ||
| ASA II | 2.309 (54,7%) | 139 (49,8%) | 1,37 [0,76-2,48] | 0,290 | 1,34 [0,74-2,44] | 0,334 |
| ASA III | 1.511 (35,8%) | 118 (42,3%) | 1,97 [1,09-3,58] | 0,025 | 1,79 [0,96-3,34] | 0,066 |
| ASA IV | 140 (3,31%) | 10 (3,58%) | 1,95 [0,84-4,52] | 0,118 | 1,53 [0,64-3,67] | 0,342 |
| Localización del tumor (cm) | ||||||
| 15-13 | 487 (11,5%) | 25 (8,96%) | 1 | 1 | ||
| 12-7 | 2.070 (49,0%) | 125 (44,8%) | 1,21 [0,79-1,86] | 0,383 | 0,91 [0,53-1,56] | 0,737 |
| 6-0 | 1.667 (39,5%) | 129 (46,2%) | 1,57 [1,02-2,41] | 0,040 | 1,33 [0,73-2,43] | 0,350 |
| Técnica quirúrgica | ||||||
| Resección | 2.927 (69,3%) | 154 (55,2%) | 1 | 1 | ||
| Amputación | 985 (23,3%) | 72 (25,8%) | 1,46 [1,11-1,94] | 0,008 | 0,81 [0,57-1,16] | 0,260 |
| Hartmann | 312 (7,39%) | 53 (19,0%) | 3,84 [2,81-5,24] | <0,001 | 2,50 [1,79-3,51] | <0,001 |
| Exéresis del mesorrecto | ||||||
| Parcial | 895 (21,2%) | 44 (15,8%) | 1 | 1 | ||
| Total | 3.329 (78,8%) | 235 (84,2%) | 1,45 [1,05-2,00] | 0,025 | 1,50 [0,97-2,32] | 0,071 |
| Perforación intraoperatoria | ||||||
| No | 4.048 (95,8%) | 229 (82,1%) | 1 | 1 | ||
| Sí | 176 (4,17%) | 50 (17,9%) | 4,97 [3,66-6,75] | <0,001 | 2,78 [1,98-3,90] | <0,001 |
| Invasión del CRM | ||||||
| Libre | 3.881 (91,9%) | 204 (73,1%) | 1 | 1 | ||
| Invadido | 343 (8,12%) | 75 (26,9%) | 4,63 [3,55-6,03] | <0,001 | 2,90 [2,15-3,91] | <0,001 |
| Tratamiento neoadyuvante | ||||||
| No | 1.694 (40,1%) | 116 (41,6%) | 1 | 1 | ||
| Sí | 2.530 (59,9%) | 163 (58,4%) | 0,90 [0,71-1,14] | 0,397 | 1,06 [0,81-1,40] | 0,655 |
| Tratamiento adyuvante | ||||||
| No | 1.574 (37,3%) | 92 (33,0%) | 1 | 1 | ||
| Sí | 2.628 (62,2%) | 185 (66,3%) | 1,13 [0,88-1,46] | 0,325 | 0,95 [0,71-1,27] | 0,722 |
| No datos | 22 (0,52%) | 2 (0,72%) | 1,94 [0,48-7,87] | 0,355 | 1,83 [0,45-7,51] | 0,400 |
| Estadio tumoral patológico | ||||||
| I | 1.248 (29,5%) | 50 (17,9%) | 1 | 1 | ||
| II | 1.275 (30,2%) | 80 (28,7%) | 1,61 [1,13-2,30] | 0,008 | 1,28 [0,88-1,84] | 0,194 |
| III | 1.272 (30,1%) | 139 (49,8%) | 2,99 [2,16-4,13] | <0,001 | 2,22 [1,56-3,14] | <0,001 |
| 0 | 192 (4,55%) | 3 (1,08%) | 0,38 [0,12-1,21] | 0,100 | 0,37 [0,12-1,20] | 0,098 |
| No datos | 237 (5,61%) | 7 (2,51%) | 0,74 [0,34-1,64] | 0,462 | 0,77 [0,35-1,71] | 0,523 |
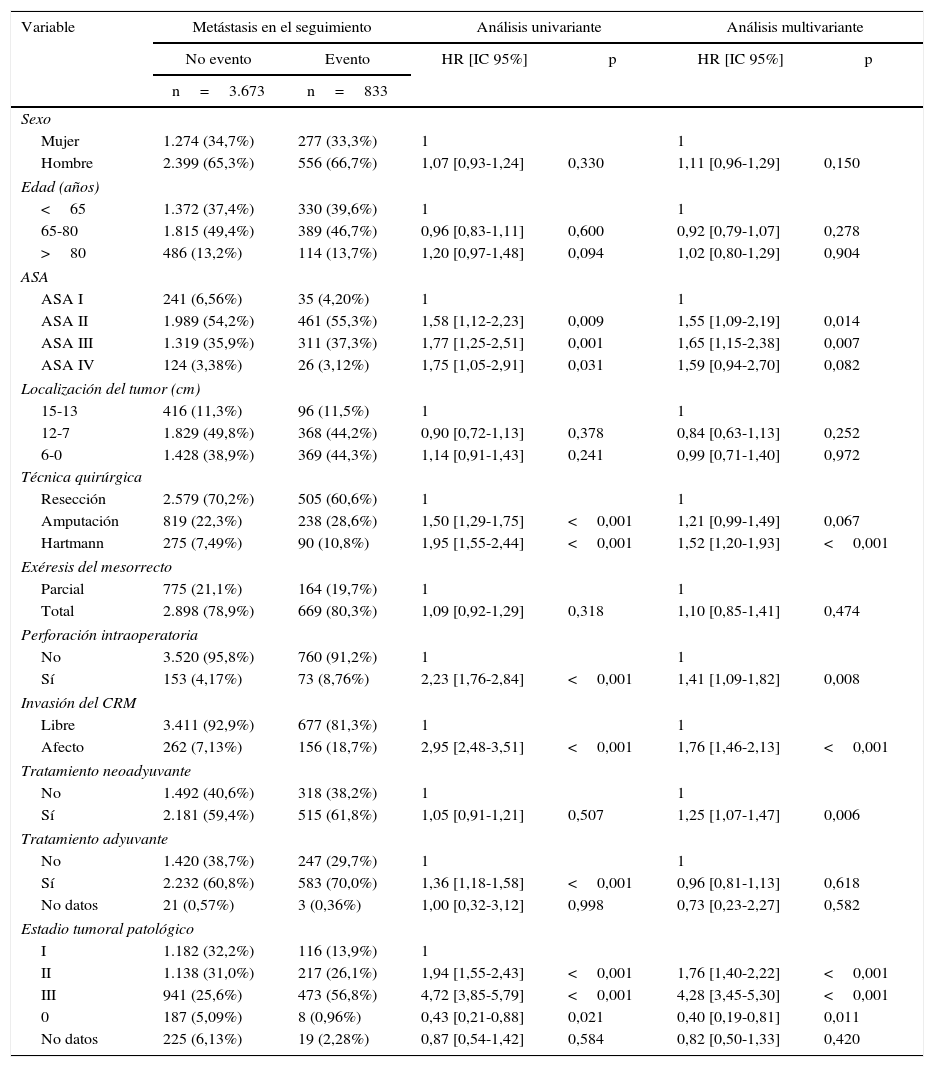
Influencia de las variables de confusión en las metástasis
| Variable | Metástasis en el seguimiento | Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|---|---|
| No evento | Evento | HR [IC 95%] | p | HR [IC 95%] | p | |
| n=3.673 | n=833 | |||||
| Sexo | ||||||
| Mujer | 1.274 (34,7%) | 277 (33,3%) | 1 | 1 | ||
| Hombre | 2.399 (65,3%) | 556 (66,7%) | 1,07 [0,93-1,24] | 0,330 | 1,11 [0,96-1,29] | 0,150 |
| Edad (años) | ||||||
| <65 | 1.372 (37,4%) | 330 (39,6%) | 1 | 1 | ||
| 65-80 | 1.815 (49,4%) | 389 (46,7%) | 0,96 [0,83-1,11] | 0,600 | 0,92 [0,79-1,07] | 0,278 |
| >80 | 486 (13,2%) | 114 (13,7%) | 1,20 [0,97-1,48] | 0,094 | 1,02 [0,80-1,29] | 0,904 |
| ASA | ||||||
| ASA I | 241 (6,56%) | 35 (4,20%) | 1 | 1 | ||
| ASA II | 1.989 (54,2%) | 461 (55,3%) | 1,58 [1,12-2,23] | 0,009 | 1,55 [1,09-2,19] | 0,014 |
| ASA III | 1.319 (35,9%) | 311 (37,3%) | 1,77 [1,25-2,51] | 0,001 | 1,65 [1,15-2,38] | 0,007 |
| ASA IV | 124 (3,38%) | 26 (3,12%) | 1,75 [1,05-2,91] | 0,031 | 1,59 [0,94-2,70] | 0,082 |
| Localización del tumor (cm) | ||||||
| 15-13 | 416 (11,3%) | 96 (11,5%) | 1 | 1 | ||
| 12-7 | 1.829 (49,8%) | 368 (44,2%) | 0,90 [0,72-1,13] | 0,378 | 0,84 [0,63-1,13] | 0,252 |
| 6-0 | 1.428 (38,9%) | 369 (44,3%) | 1,14 [0,91-1,43] | 0,241 | 0,99 [0,71-1,40] | 0,972 |
| Técnica quirúrgica | ||||||
| Resección | 2.579 (70,2%) | 505 (60,6%) | 1 | 1 | ||
| Amputación | 819 (22,3%) | 238 (28,6%) | 1,50 [1,29-1,75] | <0,001 | 1,21 [0,99-1,49] | 0,067 |
| Hartmann | 275 (7,49%) | 90 (10,8%) | 1,95 [1,55-2,44] | <0,001 | 1,52 [1,20-1,93] | <0,001 |
| Exéresis del mesorrecto | ||||||
| Parcial | 775 (21,1%) | 164 (19,7%) | 1 | 1 | ||
| Total | 2.898 (78,9%) | 669 (80,3%) | 1,09 [0,92-1,29] | 0,318 | 1,10 [0,85-1,41] | 0,474 |
| Perforación intraoperatoria | ||||||
| No | 3.520 (95,8%) | 760 (91,2%) | 1 | 1 | ||
| Sí | 153 (4,17%) | 73 (8,76%) | 2,23 [1,76-2,84] | <0,001 | 1,41 [1,09-1,82] | 0,008 |
| Invasión del CRM | ||||||
| Libre | 3.411 (92,9%) | 677 (81,3%) | 1 | 1 | ||
| Afecto | 262 (7,13%) | 156 (18,7%) | 2,95 [2,48-3,51] | <0,001 | 1,76 [1,46-2,13] | <0,001 |
| Tratamiento neoadyuvante | ||||||
| No | 1.492 (40,6%) | 318 (38,2%) | 1 | 1 | ||
| Sí | 2.181 (59,4%) | 515 (61,8%) | 1,05 [0,91-1,21] | 0,507 | 1,25 [1,07-1,47] | 0,006 |
| Tratamiento adyuvante | ||||||
| No | 1.420 (38,7%) | 247 (29,7%) | 1 | 1 | ||
| Sí | 2.232 (60,8%) | 583 (70,0%) | 1,36 [1,18-1,58] | <0,001 | 0,96 [0,81-1,13] | 0,618 |
| No datos | 21 (0,57%) | 3 (0,36%) | 1,00 [0,32-3,12] | 0,998 | 0,73 [0,23-2,27] | 0,582 |
| Estadio tumoral patológico | ||||||
| I | 1.182 (32,2%) | 116 (13,9%) | 1 | |||
| II | 1.138 (31,0%) | 217 (26,1%) | 1,94 [1,55-2,43] | <0,001 | 1,76 [1,40-2,22] | <0,001 |
| III | 941 (25,6%) | 473 (56,8%) | 4,72 [3,85-5,79] | <0,001 | 4,28 [3,45-5,30] | <0,001 |
| 0 | 187 (5,09%) | 8 (0,96%) | 0,43 [0,21-0,88] | 0,021 | 0,40 [0,19-0,81] | 0,011 |
| No datos | 225 (6,13%) | 19 (2,28%) | 0,87 [0,54-1,42] | 0,584 | 0,82 [0,50-1,33] | 0,420 |
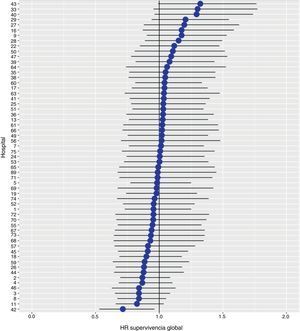
Los resultados del modelo de regresión logística, con la variable hospital como un efecto aleatorio, mostraron una variación significativa entre los hospitales para todas las variables de resultado (figs. 5-7).
Este estudio muestra las tasas de recidiva local del 7,3% (IC 95%: 6,5-8,2), metástasis en el seguimiento del 21% (IC 95%: 19,7-22,4), y supervivencia global del 72,3% (IC 95%: 70,9-73,8), observadas en el Proyecto del Cáncer de Recto de la AEC en una cohorte de 4.508 pacientes consecutivos seguidos durante 5 años.
La mayor debilidad de este estudio tiene que ver con la naturaleza voluntaria de inclusión de los datos en el Proyecto del Cáncer de Recto de la AEC, sobre todo cuando se compara con los registros de los países escandinavos6-8, en los que la inclusión de datos en el registro es obligatoria. Sin embargo, como ya se indicó con más detalle9, se han tomado diversas iniciativas para evitar sesgos voluntarios o involuntarios de inclusión y de información. Desgraciadamente, debido al carácter anónimo de los datos y a la carencia de otras fuentes para contrastar la información en nuestro país, los datos de este estudio indican las tasas registradas de recidiva local, metástasis y supervivencia general.
Los factores de riesgo de recurrencia tumoral, y por tanto peores resultados oncológicos, coinciden con los descritos previamente10: perforación tumoral, invasión MRC, estadios tumorales avanzados e intervención de Hartmann, sin encontrar asociaciones significativas.
Los resultados observados en el Proyecto del Cáncer de Recto de la AEC son inferiores a los observados en los registros de Escandinavia a los que tratamos de emular. La tasa de recidiva local (7,3%) es superior a las observadas en Noruega (5,0%)6 y Suecia (4,0%)7; este indicador de resultado no se evalúa en el registro danés8. La tasa de supervivencia global en este proyecto (72,3%) se sitúa entre las publicadas por los registros de Noruega y Suecia7 (81%)7 y la observada en Dinamarca (68%)8.
Además, la tasa de recidiva local observada en este estudio, en el que se han empleado los resultados de 59 hospitales, ha sido ligeramente más elevada que la observada en un análisis previo, realizado con los datos aportados por los primeros 36 hospitales integrados en el proyecto (6,6%)10. No obstante, esta variación negativa de los resultados también se ha observado en los registros noruego y sueco, en los que las cifras de recidiva local han aumentado del 3 al 5 y 4%, respectivamente7. Por lo que, tal vez, la explicación de este hecho, probablemente, se puede atribuir a la pérdida de atención de los equipos multidisciplinares de algunos hospitales y a las diferencias interhospitalarias.
En conclusión, los resultados de este estudio indican que los resultados observados en el Proyecto del Cáncer de Recto de la AEC son inferiores a los observados en los registros de Escandinavia a los que tratamos de emular y que ello es atribuible a la variabilidad de la práctica en algunos centros.
AutoríaTodos los autores han participado en el diseño del estudio, en la redacción del artículo, revisión crítica y aprobación de la versión final. Maria Buxó ha realizado la recogida de datos, análisis de datos y estadística del mismo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Hector Ortiz por la coordinación del proyecto Vikingo y por la coordinación de este trabajo.
Hospital Virgen de la Arrixaca (J.A. Lujan Mompean).
Hospital Universitari de Bellvitge (S. Biondo, D. Fracalvieri).
Hospital Virgen del Camino-Complejo Hospitalario de Navarra (M. de Miguel Velasco, M.A. Ciga Lozano).
Hospital Clínico Universitario de Valencia (A. Espí Macias).
Hospital Universitari de Girona Dr. Josep Trueta (A. Codina Cazador, F. Olivet Pujol).
Hospital de Sagunto (M.D. Ruiz Carmona).
Hospital Universitari Vall d’Hebron de Barcelona (E. Espin Basany, Fancesc Vallribera).
Hospital Universitario La Fe de Valencia (E. Garcia-Granero, R. Palasí Gimenez).
Complejo Hospitalario de Ourense (A. Parajo Calvo).
Hospital Universitari Germans Trias i Pujol de Badalona (I. Camps Ausas, M. Piñol Pascual).
Hospital Lluis Alcanyis de Xàtiva (V. Viciano Pascual).
Complejo Asistencial de Burgos (E. Alonso Alonso).
Hospital del Mar de Barcelona (M. Pera Roman).
Complejo Asistencial de Salamanca (J. Garcia Garcia).
Hospital Gregorio Marañón de Madrid (M. Rodriguez Martin).
Hospital Torrecárdenas de Almería (A. Reina Duarte).
Hospital General Universitario de Valencia (M.J. Garcia Coret, M. Garcia Botella).
Hospital Txagorritxu de Vitoria (J. Errasti Alustiza).
Hospital Donostia (J.A. Múgica Martinera).
Hospital Universitario Reina Sofía de Córdoba (J. Gomez Barbadillo).
Hospital General Juan Ramón Jimenez de Huelva (M. Orelogio Orozco, R. Rada Morgades).
Hospital Arnau de Vilanova de Valencia (N. Uribe Quintana).
Hospital General de Jerez (J. de Dios Franco Osorio).
Hospital General Universitario de Elche (A. Arroyo Sebastian).
Hospital Universitario Arnau de Vilanova de Lleida (J.E. Sierra Grañon).
Hospital Universitari de la Santa Creu i Sant Pau de Barcelona (P. Hernandez Casanovas, M. Martinez, J. Bollo).
Hospital Clínico Universitario de Santiago de Compostela (J. Paredes Cotore).
Complejo Hospitalario de Jaén (G. Martinez Gallego, J. Gutierrez).
Hospital Clínico San Carlos de Madrid (M. Garcia Alonso).
Hospital de Cabueñes de Gijón (G. Carreño Villarreal).
Hospital General de Albacete (J. Cifuentes Tebar).
Hospital Miguel Servet de Zaragoza (J. Monzón Abad).
Hospital Xeral de Lugo (O. Maseda Díaz).
Hospital Universitario de Fuenlabrada (D. Huerga Alvarez).
Hospital Clínico y Provincial de Barcelona (L. Flores).
Hospital Universitari Joan XXIII de Tarragona (M. Millan Schediling).
Hospital Universitario Virgen de las Nieves (I. Segura Jimenez, P. Palma Carazo).
Hospital Nuestra Señora de la Candelaria de Tenerife (J.G. Díaz Mejías).
Complejo Hospitalario de Badajoz (J. Salas Martínez).
Hospital Clínico Universitario San Cecilio de Granada (F. Pérez Benítez).
Hospital de Requena (J.C. Bernal Sprekelsen).
Hospital General Universitario de Alicante (F. Lluis Casajuana).
Hospital Virgen Macarena de Sevilla (L. Capitán Morales, J. Valdés Hernández).
Complejo Hospitalario de Vigo (Xeral + Meixoeiro) (E. Casal Nuñez, N. Cáceres Alvarado).
Hospital Infanta Sofía de Madrid (J. Martinez Alegre, R. Cantero Cid).
Hospital Policlínico Povisa de Vigo (A.M. Estevez Diz).
Hospital Virgen del Rocío de Sevilla (M. Victoria Maestre, J.M. Díaz Pavón).
Hospital San Juan de Dios del Aljarafe de Sevilla (M. Reig Pérez, A. Amaya Cortijo).
Hospital Nuestra Señora de Sonsoles de Ávila (J.A. Carmona Saez).
Hospital Universitario de Getafe (F.J. Jimenez Miramón).
Hospital General de Granollers (D. Ribé Serrat).
Hospital Universitario La Paz de Madrid (I. Prieto Nieto).
Hospital Dr. Peset de Valencia (T. Torres Sanchez, E.Martí Martínez).
Hospital General Rafael Mendez de Murcia (S. Rodrigo del Valle, G.S anchez de la Villa).
Hospital General Reina Sofía de Murcia (P. Barra Baños).
Hospital San Pedro de Alcántara de Cáceres (F. Romero Aceituno).
Hospital Torrevieja Salud (UTE) (A. Garcea).
Hospital de Santa María de Lleida (R. Batlle Solé).
Hospital Virgen del Puerto de Plasencia (J.A. Pérez García).
Hospital de Segovia (G. Ais Conde).
Hospital de Reus (S. Blanco).
Instituto Valenciano de Oncología (IVO) (A. García Fadrique, R. Estevan Estevan).
Hospital de Viladecans (A. Sueiras Gil).
Hospital de Cruces (J.M. García García, A. Lamiquiz Vallejo).
Hospital Universitario Ramón y Cajal de Madrid (J. Die Trill).
Hospital de Manises (A. Solana Bueno).
Hospital La Ribera, Alzira (F.J. Blanco Gonzalez).
Hospital Nuestra Señora del Rosell (A. Lage Laredo).
Hospital de Mérida (J.L. Dominguez Tristancho).
Hospital Universitario Fundación Alcorcón (P. Dujovne Lindenbaum).
Hospital de Henares, Coslada (N. Palencia García).
Hospital de Vinaroz (R. Adell Carceller).
Onkologika de San Sebastian (R. Martinez Pardavila).
Consorci Sanitari Integral (Hospital General de L’Hospitalet y Hospital Moisés Broggi) (L. Ortiz de Zarate).
Complejo Hospitalario de Palencia (A.M. Huidobro Piriz).
Fundación Jimenez Díaz (C. Pastor Idoate).
Hospital de Torrejón (J.A. Garijo Alvarez).
Hospital Puerto Real de Cádiz (M. de la Vega Olías).
Hospital Espíritu Santo de Santa Coloma de Gramanet (M. López Lara).