En 2007 se consensuó un protocolo asistencial entre los tres centros de trasplante hepático (TH) de Cataluña, que contemplaba el trasplante hepático (TH) asociado a quimiorradioterapia neoadyuvante como tratamiento del colangiocarcinoma perihiliar (CCAp) irresecable.
ObjetivoAnalizar la aplicabilidad del TH en los pacientes con CCAp incluidos en el protocolo y la supervivencia por intención de tratamiento.
MétodosEstudio observacional multicéntrico que incluye a pacientes de edad ≤ 68 años, diagnosticados de CCAp ≤3 cm (diámetro radial), irresecable, sin afectación ganglionar o metástasis a distancia. Los pacientes recibieron tratamiento neoadyuvante basado en radioterapia externa en una dosis total de 45 Gy, asociado con bolos de 5-fluoracilo durante los tres primeros días de irradiación y posteriormente capecitabina oral. Aquellos en los que no se objetivó signos de progresión se incluyeron en la lista de espera para TH.
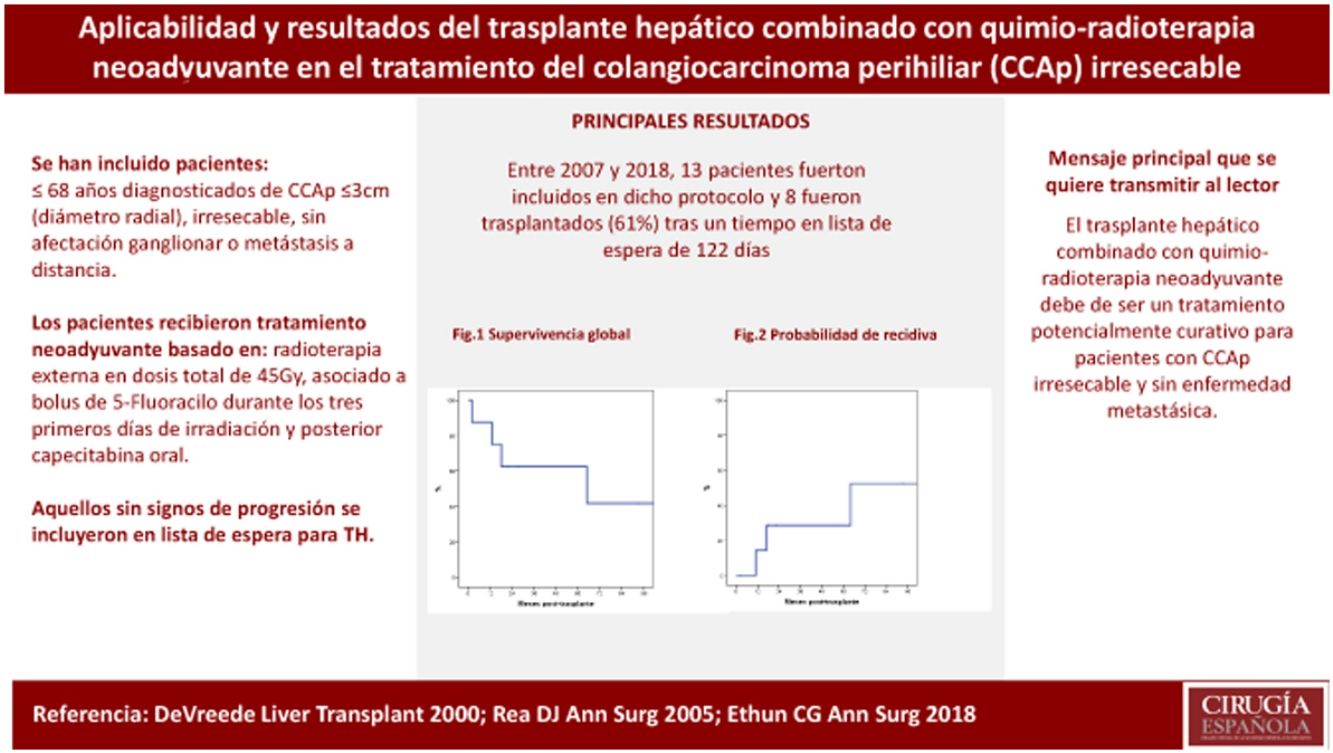
ResultadosEntre 2007 y 2018, 13 pacientes fueron incluidos en dicho protocolo. Ocho de los 13 pacientes (61%) fueron trasplantados tras un tiempo en lista de espera de 122 días (rango 5-192). La supervivencia por intención de tratamiento a 1 y 5 años fue del 69 y 39%. La supervivencia global post-TH a 1 y 5 años fue del 87 y 62%, con una probabilidad de recidiva del 29% a los cinco años post-TH.
ConclusiónLa aplicabilidad del trasplante hepático combinado con quimiorradioterapia neoadyuvante ha sido del 61% en nuestra serie y debe ser considerado como un tratamiento potencialmente curativo para pacientes seleccionados con CCAp irresecable y sin enfermedad metastásica.
In 2007, a multicenter protocol was developed in Catalonia, Spain, combining neoadjuvant chemoradiotherapy and liver transplantation (LT) for those patients with unresectable hilar cholangiocarcinoma (hCCA).
AimTo analyse the effectiveness of the neoadjuvant chemoradiotherapy and LT for those patients enrolled in the protocol based on intention-to-treat.
MethodsObservational multicenter study which includes patients ≤ 68 years-old diagnosed with unresectable, solitary tumors ≤ 3 cm in radial diameter, without evidence of lymph node metastases. The protocol was based on a strategy of neoadjuvant therapy with high-dose radiation (45 Gy in total) plus intravenous fluorouracil (5-FU) given as a daily bolus for the first 3 days of radiation follow by oral capecitabine until transplantation. The patient was included in waiting list for LT if no evidence of disseminated disease was found.
ResultsBetween 2007 and 2018, 13 patients were enrolled in the transplant protocol. Of those, 61% (8/13) of the patients were transplanted. The average time spent on the waiting list was 122 days (range 5-192). Intent-to-treat survival was 69% and 39% at one and 5 years. Post-transplantation overall survival was 87% and 62% and 29% recurrence rate at 5 years.
ConclusionThe suitability of the neoadjuvant chemoradiotherapy and LT protocol was 61% in our series with long-term overall survival and should be considered as an alternative to resection for patients with localized node-negative hCCA.
Ebata et al.1, definieron el colangiocarcinoma perihiliar (CCAp) como toda masa envolvente de la vía biliar a nivel hiliar, localizada entre el borde derecho de la porción umbilical de la vena porta y el borde izquierdo del segmento portal posterior derecho. Es un tumor poco frecuente y un desafío desde el punto de vista quirúrgico, dada la cercanía a las estructuras del hilio hepático, que en muchas ocasiones acaban siendo infiltradas al igual que los ganglios linfáticos regionales. La cirugía es la única opción terapéutica potencialmente curativa en ausencia de metástasis a distancia con el principal objetivo de alcanzar una resección R0. No obstante solo entre el 40-80% se alcanzan márgenes negativos, con una supervivencia de 20-67% a los cinco años2-9, siendo casi del 0% en aquellos pacientes con una resección R110-12. Actualmente, la única alternativa, en los casos de tumores irresecables es el tratamiento sistémico paliativo con una supervivencia mediana de 12 meses13.
En el año 200014-16 la Clínica Mayo presentó los resultados preliminares de un protocolo multimodal para CCAp basado en una estrategia de quimioterapia neoadyuvante, radioterapia y braquiterapia, seguida de una laparotomía exploradora y del trasplante hepático (TH). Aquellos pacientes incluidos en el protocolo con una lesión perihiliar irresecable ≤ 3 cm, en su tamaño radial, y sin evidencia de metástasis ganglionar, o aquellos con CCAp resecable en el contexto de colangitis esclerosante primaria (CEP), alcanzaron una supervivencia del 82% a los cinco años postrasplante hepático14-18. Esta estrategia se extendió a otros centros norteamericanos19,20 con resultados similares.
Según lo publicado, en Cataluña se redactó un protocolo asistencial en 2007 basado en el TH con quimioterapia (QT) y radioterapia (RT) neoadyuvantes para tratar pacientes con CCAp ≤ 3 cm, irresecable, sin metástasis ganglionares ni a distancia. Dicho protocolo fue liderado por el Hospital Clínic (Dr. García Valdecasas) y consensuado juntamente con los otros dos centros de TH en Cataluña (Hospital Universitario de Bellvitge y Hospital Universitario Vall d’Hebron). El objetivo de nuestro estudio fue analizar la aplicabilidad del TH y la supervivencia por intención de tratamiento de aquellos pacientes con CCAp incluidos en dicho protocolo.
MétodosSe trata de un estudio observacional, multicéntrico, que analiza retrospectivamente aquellos pacientes diagnosticados de CCAp irresecable incluidos en el protocolo asistencial de trasplante hepático y QT-RT neoadyuvantes, que se inició en 2007.
Todos los pacientes firmaron el consentimiento para participar en el estudio aprobado por el Comité ético de cada centro.
Criterios diagnósticos de CCApAquella estenosis o tumoración radiológica, a nivel del hilio hepático, con confirmación histológica de adenocarcinoma (por citología o biopsia endoluminal) y/o valor de CA 19-9 superior a 100 U/mL con un nivel de bilirrubina total inferior a 3 mg/dL.
Criterios de irresecabilidadLa colangiorresonancia magnética (CRNM) es la prueba de imagen prínceps para valorar la extensión de la afectación biliar. Se definió CCAp irresecable como aquella lesión Bismuth IV21 con extensión bilateral del tumor a radicales biliares secundarios y aquellos con afectación ductal unilateral a radicales biliares secundarios y afectación portal +/- atrofia lobar hepática contralateral o con afectación de la vena porta principal o de forma bilateral22 o con un volumen del remanente hepático insuficiente incluso después de la embolización portal.
EstadificaciónCon el objetivo de descartar la metástasis a distancia, la afectación ganglionar (o ambas) se realizó a todos los pacientes una tomografía axial computarizada (TC). La tomografía por emisión de positrones (PET-TC) se indicó en los pacientes con sospecha de enfermedad a distancia. La biopsia dirigida por ecoendoscopia se realizó en pacientes con adenopatías regionales sospechosas de afectación neoplásica.
Protocolo trasplante hepático combinado con QT + RT neoadyuvantesCriterios de inclusión- -
Pacientes con edad ≤ 68 años.
- -
CCAp irresecable ≤ 3 cm diámetro radial (ni el englobamiento vascular ni la longitud de la afectación biliar ni la pobre definición de los límites de la tumoración fueron contraindicaciones).
- -
Ausencia de enfermedad a distancia.
- -
Pacientes que hubiesen recibido quimioterapia o radioterapia previa para CCAp.
- -
Intervención quirúrgica previa sobre el CCAp, biopsia percutánea o intención de resección.
- -
Antecedentes patológicos o enfermedad asociada que contraindiquen el trasplante hepático.
- -
Infección no controlada o mal estado general.
El tratamiento neoadyuvante se basó en el esquema de la Clínica Mayo13. Dicho esquema incluía la RT externa a dosis total de 45 Gy (pautada en 30 fracciones de 15 Gy, dos veces al día, durante tres semanas). De manera concomitante se administró fluoracilo (5-FU) en dosis de 500 mg/m2 en forma de bolo diario durante los tres primeros días de la irradiación. La braquiterapia no se contempló en este protocolo. Posteriormente, los pacientes recibieron capecitabina a dosis de 2.000 mg/m2 al día, dos de cada tres semanas hasta el momento del trasplante.
Aquellos casos con valores de bilirrubina superiores a 3 mg/dL siguieron un procedimiento de drenaje biliar mediante colangiografía transhepática percutánea (CTPH) para alcanzar valores de bilirrubina inferiores a 3 mg/dL antes de iniciar la QT-RT neoadyuvante.
Criterios de inclusión en lista de espera para trasplante hepático- 1.
Cumplir los criterios de inclusión anteriormente especificados.
- 2.
Haber recibido la QT-RT neoadyuvantes.
- 3.
Confirmación de la ausencia de afectación ganglionar metastásica, o enfermedad a distancia, mediante una laparotomía exploradora, tomando muestras ganglionares de adenopatías sospechosas a nivel del hilio hepático, región del tronco celíaco, retropancreáticas o de cualquier lesión sospechosa de la cavidad abdominal.
Con el objetivo de ser trasplantados en menos de tres meses, y en consenso con el resto de los grupos y la oficina de coordinación autonómica (OCATT), los pacientes se incluyeron en una lista común de priorización con una puntuación en el Model for End-stage Liver Disease (MELD) de 19, igual a la que reciben los pacientes con hepatocarcinoma de alto riesgo de progresión en la lista de espera.
El protocolo de seguimiento de estos pacientes durante su estancia en lista de espera consistió en la realización de una TC tóracoabdominal y CA 19-9 cada tres meses.
Trasplante hepáticoEn el momento del TH se exploró la cavidad abdominal y se realizó una biopsia intraoperatoria de las lesiones sospechosas de metástasis hepáticas o de enfermedad extrahepática, en caso de que las hubiera. Si se confirmó histológicamente la progresión de enfermedad, se descartó seguir con el procedimiento del TH, por lo que era recomendable disponer de un segundo receptor.
En caso de resultado negativo, se continuó con el trasplante según la técnica habitual del centro, teniendo en cuenta dos consideraciones:
- 1.
Resecar toda la vía biliar principal como tratamiento oncológico del tumor biliar, lo que conlleva una reconstrucción biliar con un asa en Y de Roux así como una linfadenectomía hiliar.
- 2.
Dada la frecuente afectación de la arteria hepática propia por la RT se recomienda no utilizar dicha arteria del receptor para la reconstrucción arterial en el trasplante.
Los pacientes recibieron la inmunosupresión convencional según la estipulada en cada centro, basada en anticalcineurínico, mofetil micofenolato y/o esteroides.
Seguimiento postrasplante hepáticoEl seguimiento post-TH fue el habitual con la realización de controles analíticos periódicos y de una TC toracoabdominopélvica y marcador tumoral CA 19-9 cada tres meses durante los dos primeros años y posteriormente cada seis meses. Solo se indicó tratamiento sistémico post-TH en aquellos casos con evidencia de recidiva de la enfermedad.
Estudio estadísticoSe registraron de forma retrospectiva los datos demográficos, el esquema neoadyuvante, los datos intraoperatorios y anatomo-patológicos y el seguimiento de los pacientes. Se realizó un análisis descriptivo presentando las variables categóricas en número total y porcentaje, y las variables cuantitativas en medianas y rango. Se analizó la supervivencia por intención de tratamiento, la supervivencia global post-trasplante y la supervivencia libre de enfermedad de la serie mediante un análisis de Kaplan-Meier. Se calculó el tiempo de supervivencia por intención de tratamiento desde la fecha de inicio del tratamiento sistémico neoadyuvante hasta la fecha de la muerte o último seguimiento. Se calculó la supervivencia global desde la fecha del TH hasta la muerte o último seguimiento y el tiempo libre de enfermedad hasta la aparición de la recidiva o último seguimiento. El análisis estadístico se realizó utilizando SPSS® Statistics Version 22.
ResultadosEntre enero 2007 y agosto 2018, trece pacientes de los tres centros que realizan trasplante en Cataluña (Hospital Vall d’Hebron, Hospital Bellvitge, Hospital Clínic) fueron diagnosticados de CCAp irresecable y evaluados para su inclusión en el protocolo de QT-RT y TH. Se recogió el seguimiento de estos pacientes hasta diciembre 2019.
Las características del grupo de estudio aparecen reflejadas en la tabla 1.
Características del paciente y pre-trasplante
| Paciente | Año de diagnóstico | Edad (años) | Sexo | BiT al diagnóstico (mg/dL) | Drenaje biliar previo al tratamiento | Prótesis biliar previo al tratamiento | Infiltración vena porta por TC | Infiltración arteria hepática por TC | Ca 19-9 al diagnóstico (U/mL) | Ca 19-9 a la inclusión en lista de espera (U/mL) | Tiempo en lista de espera (meses) | Exclusión de la lista de espera y causa | Hallazgos en la laparotomía del trasplante | Trasplante hepático |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2007 | 62 | M | 10 | Sí | Sí | Sí | No | 120 | 11 | 0,5 | No | No | Sí |
| 2 | 2009 | 64 | M | 1 | Sí | Sí | No | No | 122 | 55 | 6,4 | No | No | Sí |
| 3 | 2010 | 60 | M | 7 | Sí | Sí | No | No | 232 | 304 | 2,3 | Progresión sistémica | NA | No |
| 4 | 2010 | 55 | F | 6 | Sí | Sí | No | No | 115 | 45 | 5 | No | No | Sí |
| 5 | 2011 | 59 | M | 14 | Sí | Sí | Sí | Sí | 12.026 | 3 | 0,5 | No | No | Sí |
| 6 | 2011 | 49 | F | 1 | No | No | No | No | 4 | 6 | 1,5 | No | No | Sí |
| 7 | 2012 | 66 | F | 3 | Sí | Sí | No | No | 463 | 861 | 2,5 | Progresión sistémica | NA | No |
| 8 | 2013 | 44 | M | 6 | Sí | Sí | No | No | 204 | 33 | 5 | Exitus por colangitis | NA | No |
| 9 | 2014 | 52 | M | 15 | Sí | Sí | Sí | Sí | 635 | 4 | 6,7 | No | Carcinomatosis | No |
| 10 | 2016 | 66 | F | 6 | Sí | Sí | No | No | 4 | 4 | 3 | No | No | Sí |
| 11 | 2017 | 47 | M | 19 | Sí | Sí | Sí | No | 92 | 1 | 6,4 | No | No | Sí |
| 12 | 2017 | 67 | M | 5 | Sí | Sí | No | No | 828 | 46 | 6 | No | Adenopatía hiliar positiva | No |
| 13 | 2017 | 64 | M | 14 | Sí | Sí | Sí | Sí | 43 | 128 | 4 | No | No | Sí |
M: masculino; F: femenino; BiT: Bilirrubina total; NA: no aplicable.
Todos los casos de nuestra serie fueron CCAp de novo, sin antecedentes de CEP. Fue necesario el drenaje de la vía biliar con colocación de prótesis bilateral por CTPH en 12 pacientes. Cuatro pacientes (número 6, 10, 11 y 13) requirieron la realización de citología endoluminal para el diagnóstico definitivo por presentar una imagen radiológica de masa hiliar pero sin elevación de marcador tumoral.
El tratamiento de QT-RT se completó en 12 pacientes. La capecitabina oral se suspendió en el paciente número 11 por morbilidad asociada. Tras la realización de la laparotomía exploradora, todos los pacientes fueron incluidos en lista de espera para TH. Los niveles de CA 19-9 preTH fueron superiores a 500 U/mL solamente en un caso, como se refleja en la tabla 1. La mediana de tiempo entre el diagnóstico y la inclusión en lista fue de cinco meses (r: 3-11 meses). El paciente número 12 presentó varios episodios de colangitis de repetición a pesar del drenaje biliar retrasando el inicio del tratamiento neoadyuvante y por tanto su inclusión en lista (11 meses desde el diagnóstico).
Salida de la lista de esperaDurante el periodo en la lista de espera, dos pacientes tuvieron que ser excluidos por progresión tumoral en forma de letálides cutáneas a los dos meses (paciente número 3) y aparición de metástasis hepáticas a los tres meses (paciente número 7). Un tercer paciente murió a los cuatro meses debido a un shock séptico por colangitis sin signos de progresión (tabla 1).
En el momento del trasplante se suspendió el procedimiento en dos pacientes por hallazgo de carcinomatosis en la laparotomía, en un caso y afectación adenopática en el segundo. El tiempo en lista de espera de estos dos pacientes fue de 6,7 y 6 meses (tabla 1).
Finalmente, ocho de los trece pacientes fueron trasplantados, lo que significa una aplicabilidad del 61%. La mediana en lista de espera de estos pacientes fue de 122 días (r: 5-192 días).
Trasplante hepáticoEn la tabla 2 se reflejan las principales características de la cirugía y el seguimiento. Todos los pacientes recibieron un injerto procedente de un donante en muerte encefálica con una mediana de edad de 53 años (r: 33-78 años). El tiempo de isquemia fría fue de 382 min (r: 300-480 min). En tres de los ocho pacientes trasplantados se utilizó la arteria hepática común para la reconstrucción arterial (tabla 2).
Características de la cirugía y postrasplante
| Paciente | Tiempo isquemia fría (min) | Tiempo de isquemia caliente (min) | Transfusión de concentrados de hematíes (unidades) | Reconstrucción arterial | Estancia post-operatoria (días) | Morbilidad postoperatoria | Recidiva | Exitus | Seguimiento post-TH (meses) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 360 | 25 | 0 | Arteria hepática común | 12 | Pseudoaneurisma de la arteria hepática | No | Sí | 18 |
| 2 | 300 | 50 | 0 | Aorta supracelíaca sin injerto | 8 | Toxicodermia con sepsis secundaria | No | Sí | 2 |
| 4 | 300 | 60 | 0 | Injerto ilíaco | 13 | No | No | No | 103 |
| 5 | 390 | 60 | 2 | Arteria hepática común | 22 | Estenosis de la arteria hepática | Sí | Sí | 65 |
| 6 | 375 | 105 | 1 | Injerto ilíaco | 31 | Trombosis de las venas suprahepáticas | No | No | 92 |
| 10 | 405 | 60 | 4 | Arteria hepática común | 23 | Infección de orinaRechazo agudo moderado | Sí | No | 26 |
| 11 | 477 | 70 | 0 | Aorta supracelíaca sin injerto | 9 | Pseudoaneurisma micótico | No | No | 22 |
| 13 | 480 | 43 | 7 | Tronco celíaco | 10 | No | Sí | Sí | 13 |
Dos pacientes en los que se utilizó la arteria hepática común (2/3) para la anastomosis presentaron un pseudoaneurisma a nivel de la anastomosis que se reparó quirúrgicamente a los 34 días post-TH y una estenosis de la anastomosis que requirió la colocación de una endoprótesis a los seis meses post-TH. Un paciente con anastomosis supracelíaca presentó un pseudoaneurisma micótico a los 41 días post-TH colocándose una endoprótesis aórtica y posterior reconstrucción quirúrgica vascular. Ningún caso supuso la pérdida del injerto (tabla 2).
El paciente número 6 desarrolló una trombosis de la anastomosis de las tres venas suprahepáticas secundario a torsión de la misma durante el postoperatorio inmediato. Requirió reparación quirúrgica sin complicaciones a largo plazo (tabla 2).
Cuatro de los ocho pacientes trasplantados fallecieron en el seguimiento. Dos pacientes por recidiva de la enfermedad a los 13 meses y 65 meses post-TH. Un tercer paciente presentó un cuadro de insuficiencia hepática por hipertensión portal secundaria a una estenosis de la anastomosis portal tardía, siendo la causa de la muerte a los 18 meses post-TH, sin evidencia de recidiva. Un cuarto paciente desarrolló una toxicodermia con dermatosis ampulosa y posterior sepsis por Klebsiella, sin evidencia de recidiva, a los dos meses post-TH (tabla 2).
Examen histológico del hígado explantadoEn cuanto al estudio anátomo-patológico, se utilizó la clasificación pTNM del American Joint Committe on Cancer, 8 ª edición23.
Los hallazgos histológicos se presentan en la tabla 3. Hay que destacar la presencia de tumor en todas las piezas excepto en un caso de regresión tumoral y la ausencia de infiltración de los márgenes. No hubo signos de hepatopatía en la pieza de explante en ningún caso.
Características histológicas del tumor en la pieza de explante
| Paciente | Estadio | Invasión margen | Invasión linfática | Invasión vascular | Invasión perineural | Tamaño |
|---|---|---|---|---|---|---|
| 1 | ypT3 G2 | No | No | Sí | Sí | 36 mm |
| 2 | Regresión tumoral | No | No | No | No | - |
| 4 | ypT2a G2 | No | No | No | Sí | Nidos tumorales residuales |
| 5 | ypT4 G2 | No | No | No | Sí | 40 mm |
| 6 | ypT1 G2 | No | No | Sí | Sí | 20 mm |
| 10 | ypT2a G3 | No | No | No | Sí | 25 mm |
| 11 | ypT2 G2 | No | Sí | Sí | Sí | 20 mm |
| 13 | ypT4 G1 | No | No | No | Sí | 33 mm |
La supervivencia por intención de tratamiento fue del 69 y 39% a uno y cinco años, respectivamente (fig. 1). Tras una mediana de seguimiento post-TH de 24 meses (r: 2-103 meses), la supervivencia global fue del 87 y 62% a uno y cinco años, respectivamente (fig. 2).
La probabilidad de recidiva a los cinco años fue del 29% (fig. 3). Un paciente presentó una recidiva sistémica a los 64 meses post-TH, siendo la causa de la muerte poco después. Un segundo paciente murió a los 13 meses post-TH por hemorragia digestiva alta secundaria a recidiva local con infiltración del tronco celíaco diagnosticada a los 11 meses post-TH. Y, finalmente, un tercer paciente presentó una recidiva en forma de implante focal anterior gástrico a los 17 meses post-TH que se resecó. Actualmente está vivo y con tratamiento sistémico.
DiscusiónEl CCAp sigue siendo uno de los principales retos dentro del ámbito de la cirugía hepatobiliopancreática. Debido a la naturaleza infiltrativa de este tipo de tumores, es difícil determinar el margen preoperatoriamente por pruebas de imagen con la intención de alcanzar un R0, a lo que se añade la elevada morbimortalidad asociada con la complejidad quirúrgica. El grupo de Ebata et al., que presenta la mayor experiencia a nivel internacional en este tipo de patología, describieron una supervivencia global del 67% y libre de enfermedad del 58% a cinco años en aquellos CCAp resecables R0 sin afectación linfática ni vascular9. Sin embargo, para un grupo seleccionado de pacientes con CCAp irresecable, el TH asociado a QT-RT neoadyuvantes se ha convertido en una alternativa terapéutica prometedora, como demostramos en el presente estudio, alcanzando una supervivencia global y libre de enfermedad similar a aquellos resecables. Este abordaje no deja de ser una entidad más dentro del concepto, que está comenzando a gestarse, denominado Transplant Oncology, resultado de la combinación de los principios de cirugía oncológica, trasplante hepático y quimioterapia neoadyuvante24,25.
En el año 2000, De Vreede et al., de la Clínica Mayo, publicaron su serie de 25 pacientes con CCAp incluidos dentro del protocolo de QT-RT combinado con braquiterapia, de los cuales 12 (63%) se trasplantaron con una supervivencia del 91% tras una mediana de seguimiento de 44 meses14. En 2005, Rea et al.18 compararon los resultados de los pacientes trasplantados con aquellos casos que fueron resecados y los autores demostraron una mejoría de la supervivencia global a uno, tres y cinco años en el grupo que recibió un TH (92, 82 y 82%, respectivamente) en comparación con aquellos a los que se le realizó una resección con intención curativa (82, 48 y 21%, respectivamente).
En una actualización de la serie de la Clínica Mayo, publicada por Croome et al.26, se compararon 54 pacientes resecados con 99 pacientes incluidos en el protocolo neoadyuvancia y TH. Se observó una ganancia de la supervivencia global en el grupo de trasplante a uno, tres y cinco años (90, 71 y 59% vs. 81, 53 y 36% en el grupo resecado). Hay que destacar que un 30% de los pacientes trasplantados no presentaron cáncer residual en la pieza de explante, lo que justifican como resultado de la terapia neoadyuvante. Posteriormente, Lehrke et al.27 describieron que en el 56% de los casos había una respuesta completa/casi completa tras la neoadyuvancia. Así los pacientes con CEP (56% de la serie) tenían un porcentaje de respuesta completa superior a aquellos pacientes sin CEP (71 vs. 31%), lo cual podría poner en duda la existencia de un tumor previo al inicio del tratamiento, confundiendo lesiones estenóticas benignas típicas en el CEP con lesiones malignas. Esta es la principal crítica del protocolo de la Clínica Mayo, dado que no es necesario la confirmación histológica para la inclusión en el protocolo; no obstante, está justificado por el elevado riesgo de diseminación de la biopsia transperitoneal.
Los resultados de nuestra serie son similares a los publicados en la literatura, a lo que hay que añadir dos hechos diferenciales con respecto a las series americanas: que todos los casos son CCAp de novo sin antecedentes de CEP y que se excluyó la braquiterapia del tratamiento neoadyuvante, asumiendo un tiempo en lista de espera inferior a lo descrito por la United Network of Organ Sharing (UNOS) (< 6 meses).
Con respecto a los criterios diagnósticos del CCAp de novo, se han seguido los mismos criterios de la Clínica Mayo, basados en una estenosis radiológica a nivel hiliar con confirmación histológica de adenocarcinoma (por citología o biopsia endoluminal) y/o valor de CA 19-9 superior a 100 U/mL. Es importante la discusión de estos casos en un comité multidisciplinario con radiólogos expertos en patología hepatobiliopancreática, para realizar una descripción precisa de la extensión del tumor, confirmar su irresecabilidad, y definir el tamaño radial de la lesión que debe de ser ≤ 3 cm, siendo uno de los principales factores pronóstico publicados en la literatura18,28. La dificultad reside en los casos en los que no es posible una confirmación histológica, cuando el valor del marcador tumoral está por debajo de 100 U/mL. En esta línea, en la última reunión de consenso de la International Liver Transplantation Society (ILTS), en febrero 2019, se aceptó como criterio de inclusión la presencia de «masa» hiliar en el contexto de una estenosis radiológica.
Aunque en las series publicadas no se especifica el tiempo medio en lista de espera para TH, sí se estima un riesgo de drop-out por progresión de la enfermedad del 12% por cada tres meses en lista, siendo del 46% tras 12 meses desde su inclusión. De forma que, en 2009, la UNOS recomendó un ajuste del MELD score con adjudicación de puntos extra para la priorización de estos pacientes y minimizar el riesgo de progresión28. Entre los tres centros catalanes se consensuó priorizar a estos pacientes con una puntuación MELD de 19. Tres pacientes fueron excluidos estando en lista: dos pacientes por progresión tumoral (15%) similar a lo publicado y una muerte por sepsis en el contexto de colangitis grave. Dos pacientes fueron excluidos en el momento del trasplante por presencia de carcinomatosis y afectación linfática regional, sin haber objetivado hallazgos en la laparotomía exploradora previa a la inclusión, aunque el tiempo en lista fue superior a la media. Finalmente, el 61% de los pacientes se trasplantaron tras una mediana de tiempo en lista de espera de cuatro meses, resultados similares a la serie más reciente publicada por Ethun et al.20, sin superar en ningún caso los 6,7 meses en lista. Darwish et al.28, describieron las concentraciones de CA 19-9 ≥ 500 U/mL como uno de los principales factores de riesgo de drop-out. De hecho, de los 13 pacientes de nuestra serie, los valores de CA 19-9 aumentaron discretamente con respecto al diagnóstico en los dos casos que progresaron estando en lista y uno de ellos tenía valores de CA 19-9 superiores a 500 U/mL en el momento de su inclusión. No obstante, la evidencia en la literatura para definir el real valor de este marcador y su impacto es insuficiente.
Histológicamente, hay que destacar que se confirmó la presencia de tumor en la pieza de explante en todos los casos excepto en uno (12%) probablemente por regresión tumoral. Aunque radiológicamente era compatible con CCAp no tenemos confirmación histológica pretrasplante. Este porcentaje es bastante inferior a lo publicado en la literatura y se podría atribuir tanto a una estricta selección de los casos como a la ausencia de antecedentes de CEP, a diferencia de otras series. La resección fue R0 en el 100% de los casos frente al 90% reportado por Ethun et al.20, y muy superior a lo publicado en el CCAp resecable, en torno al 70-80%9,20,26.
Si bien la probabilidad de alcanzar R0 con el TH respecto a la cirugía es indiscutible, otro punto a considerar es la morbimortalidad perioperatoria. Habitualmente la cirugía del CCAp resecable incluye procedimientos complejos asociando una hepatectomía ampliada a las reconstrucciones biliares y/o vasculares. La morbilidad postoperatoria tras la cirugía supera el 60%, de las cuales en torno al 45% son complicaciones mayores4,20,29,30. La mortalidad postoperatoria es del 2-15% en las series occidentales4,20-30, no obstante, Nagino et al.5 describieron una mortalidad del 11% antes de 1990 y del 1,4% después de 2005. Con respecto al TH, la principal desventaja es la trombosis arterial precoz post-TH asociada al daño intimal por la radioterapia, por lo que De Vreede et al.14 ya aconsejaban la interposición de un injerto ilíaco entre la arteria del donante y la aorta infrarrenal. Nuestra serie presentó un 50% de complicaciones mayores, todas ellas vasculares: tres problemas arteriales resueltos con cirugía o endoprótesis y un problema de drenaje de las venas suprahepáticas reparado quirúrgicamente. Aunque no se utilizó de forma reglada el injerto arterial para realizar la anastomosis, en ningún caso se utilizó la arteria propia del paciente. De forma que la elevada incidencia de problemas arteriales de nuestra serie nos debería hacer reconsiderar el injerto arterial en todos los casos. Aunque la mortalidad durante el postoperatorio inmediato fue nula, la mortalidad a 90 días post-TH fue del 12,5%. Estos resultados, en consonancia con lo publicado en la literatura, demuestran que por el momento el TH sigue presentando una tasa de morbimortalidad similar a la cirugía del CCAp resecable.
Tras una mediana de seguimiento de 24 meses, la supervivencia global de nuestra serie fue del 62%, con una probabilidad de recidiva del 29% a cinco años. La serie más reciente, publicada por Ethun et al.20, demostró una supervivencia global del 54% en el grupo trasplantado sin CEP y mejor que aquellos pacientes resecados de las mismas características (32%) (p = 0,049). La tasa de recidiva fue del 31% en los pacientes trasplantados frente al 29% de los CCAp intervenidos (p = 0,1) tras una mediana de seguimiento de 23 meses de la cohorte trasplantada vs. 15 meses de la resecada.
Probablemente el análisis de supervivencia por intención de tratamiento nos da una idea más real de la efectividad del tratamiento neoadyuvante combinado con TH, dado que el TH se retrasa hasta completar el estudio y tras un intenso tratamiento sistémico. En esta línea, Ethun et al.20 también realizó un subanálisis por intención de tratamiento entre todos los pacientes diagnosticados de CCAp irresecable que fueron incluidos en el protocolo de neoadyuvancia y TH y fueron comparados con todos aquellos pacientes con CCAp resecable < 3 cm/N0, y aun así los pacientes trasplantados tenían mejor supervivencia incluso si excluimos los pacientes con CEP (supervivencia a cinco años del 41 vs. 27%; p = 0,049). Nuestros resultados demostraron una supervivencia por intención de tratamiento a cinco años del 39%, similar a la reportada por Ethun et al.20.
El otro punto por considerar es el papel de la inmunosupresión. Sin ser el objetivo de nuestro estudio, la tendencia fue utilizar pautas de minimización del anticalcineurínico como se realiza en los pacientes que se trasplantan por hepatocarcinoma de alto riesgo de recidiva. No obstante, serían necesarios más estudios para poder analizar su impacto en la evolución de la enfermedad.
Nuestra serie es una de las pocas publicadas, a nivel europeo, del abordaje del CCAp irresecable dentro de un protocolo de tratamiento combinado de QT-RT neoadyuvantes y TH. La escasa experiencia europea se limita a series muy antiguas31-34 con una pobre supervivencia a tres años, del 30-38%, y una elevada ratio de recidiva de la enfermedad. Ello está justificado probablemente por una falta de selección de los pacientes y la ausencia de tratamiento neoadyuvante que permite no solo un control del crecimiento del tumor sino también contemporizar su comportamiento. Recientemente, un grupo irlandés35 publicó su experiencia de TH con el protocolo de la Clínica Mayo. Incluyeron a 37 pacientes, de los cuales 26 fueron finalmente trasplantados. Solo el 8% de los casos eran Bismuth tipo IV, el 88% presentaban CEP y el 62% de los casos alcanzaron una respuesta patológica completa. La supervivencia global fue del 55% a cinco años, similar a la nuestra, pero la recidiva de la enfermedad fue del 23%. Ello se puede justificar por la elevada respuesta patológica completa y nuevamente pone en duda si realmente había tumor al diagnóstico en todos los casos.
Actualmente está en marcha un estudio francés prospectivo, aleatorizado, TRANSPHIL (ClinicalTrials.Gov NCT02232932), que compara TH y quimiorradioterapia neoadyuvante vs. cirugía convencional. Los criterios de inclusión son similares a los definidos por el grupo de la Clínica Mayo (la regla de los 3 cm) incluyendo a pacientes potencialmente resecables y excluyendo a pacientes con CEP. El objetivo principal es la supervivencia por intención de tratamiento a cinco años y probablemente aporte respuestas más definitivas.
Con respecto a las limitaciones de nuestro estudio, hay que destacar la estricta selección de los pacientes, como lo demuestra el escaso número de pacientes reclutados a lo largo del período de seguimiento. Ello también ha permitido que el impacto en la lista de espera por otras indicaciones sea mínimo. Según datos facilitados por la OCATT, en Cataluña se realizaron, de media, 169 trasplantes al año entre 2007-2019, de forma que el TH por CCAp supone un 0,36% sobre el total de pacientes trasplantados desde 200736. Hay que puntualizar también, que las complicaciones arteriales siguen siendo el talón de Aquiles de este procedimiento que deberían minimizarse evitando la arteria hepática para la realización de la anastomosis arterial.
Podemos concluir, por tanto, que la aplicabilidad del TH, combinado con QT-RT neoadyuvantes, ha sido del 61% en nuestra serie y debe ser considerado como una estrategia más dentro del algoritmo terapéutico para un grupo de pacientes seleccionados con CCAp irresecable y sin enfermedad metastásica. Estos datos deberían confirmarse con futuros estudios prospectivos multicéntricos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a la Dra. Hessheimer por la ayuda en la colección de los datos y a Abiguei Torrents, técnico de la OCATT, por la información facilitada.