La cirugía endoscópica transanal puede ser la técnica de elección para el tratamiento de las lesiones rectales, tanto benignas como malignas seleccionadas, con cifras de supervivencia equiparables a la cirugía convencional y tasas de morbilidad más bajas.
MétodosPresentamos una serie de 70 pacientes intervenidos por operación endoscópica transanal (TEO); las indicaciones fueron lesiones rectales benignas o malignas en estadio precoz (T1) 86%. La cirugía se instrumentó con un sistema TEO (Karl Storz, Tüttlingen, Alemania) y bisturí armónico (Harmonic scalpel, Ethicon Endo-Surgery).
ResultadosEn 43 pacientes la indicación fue lesión adenomatosa; en los 27 restantes el diagnóstico preoperatorio fue de adenocarcinoma. Sin embargo, tras la resección, 47% mostraron lesión maligna en el resultado anatomopatológico, incluyendo 13 de los 43 considerados inicialmente como benignos. La morbilidad postoperatoria global fue del 36%, Clavien III (5,7%), precisando reintervención inmediata 3 (4%).
Todas las lesiones benignas se resecaron de forma completa y 7 malignas presentaron afectación del margen de resección. Con un seguimiento medio de 26,4 meses (1-71), la recidiva para tumores benignos ha sido del 9% para pT1 del 8% y, para pT2, del 12,5%. Precisaron nueva cirugía 8 pacientes.
ConclusionesLa TEO permite extirpar tumores benignos de recto no resecables mediante resección endoscópica o transanal con un bajo índice de morbilidad. También está indicada en el tratamiento curativo de las neoplasias malignas de recto que se confirman histológicamente como carcinomas pT1 de buen pronóstico.
Transanal endoscopic operation (TEO) may be the technique of choice for the treatment of rectal lesions, both benign and selected malignant lesions, with similar survival rates to conventional surgery but with lower morbidity.
MethodsIn this article we present a series of 70 patients operated on with this procedure (TEO) in our center. The indications were benign rectal lesions and malignant lesions at early stages (T1) 86%. The surgical procedure was performed with the the transanal endoscopic operation platform (TEO; Karl Storz, Tüttlingen, Germany) and ultrasonic scalpel (Harmonic scalpel, Ethicon Endo-surgery,…).
ResultsThe indication in 43 patients was a benign lesion (adenoma), in the other 27 the diagnosis was adenocarcinoma. After the resection, 61% of the series had a malignant lesion in the pathology report: 13 patients of the 43 with a benign lesion initially had a malignant lesion in the pathology report. Postoperative morbidity was 36%, Clavien III (5,7%). 3 patients (4%) needed emergency surgery.
All of the benign lesions were completely excised, but 7 malignant lesions had resection margin involvement The median follow-up time was 26,4 months (range, 1-71 months), the overall recurrence for benign tumors was 9%, 8% for malignant pT1 and 12,5% for malignant pT2. Early salvage surgery was performed on 8 patients.
ConclusionsTEO allows us to excise benign rectal lesions that could not be excised with a conventional approach (endoscopic or transanal resection) with a low morbidity rate. TEO can be used for malignant rectal tumors in early stages (pT1) with pathological confirmation.
La operación endoscópica transanal (TEO) se inicia por Buess1 en los años ochenta, como respuesta a las dificultades generadas en la resección local de las neoplasias rectales bajas.
Múltiples indicaciones se han propuesto con la instrumentación de la TEO; dentro de ellas, la más frecuente es la resección de adenomas rectales2,3. Hoy se aceptan también como indicaciones: la exéresis de carcinomas con afectación de la mucosa rectal (T1), en los que podemos conseguir resecciones oncológicas con índices de morbimortalidad menores que la escisión mesorrectal total e iguales resultados a largo plazo4–6; y en los cánceres con afectación hasta la muscular rectal (T2), en el contexto de ensayos clínicos en los que se incluyera tratamiento adicional con quimio- o radioterapia7,8. Si la invasión tumoral sobrepasara la muscular o se sospechara la posibilidad de adenopatías infiltradas T3 o N (+), solo existiría indicación paliativa por altas comorbilidades del paciente, o si este rechazara la realización de una amputación de recto.
En estudio y bajo investigación, existen otras aplicaciones para la TEO como pueden ser: la regresión completa clinicopatológica en cáncer de recto T2-T3 después de neoadyuvancia y resección de la cicatriz residual9–11 y la escisión mesorrectal completa en tumores T2N0 de recto inferior o medio con posterior anastomosis coloanal12.
Otras indicaciones tumorales menos frecuentes aplicando la TEO serían los tumores carcinoides y los tumores del estroma gastrointestinal13,14.
Pacientes y métodosPara llevar a cabo esta técnica quirúrgica necesitamos un instrumental específico. En nuestro caso se trata de un equipo TEO de Storz y un bisturí ultrasónico (Ultracision Harmonic Ethicon Endo-Surgery, Karl Storz, Tüttlingen, Alemania) que ha facilitado mucho el control de la hemostasia.
Todos los casos fueron valorados preoperatoriamente mediante endoscopia y biopsia. Se realizó ecografía endorrectal (ERUS) o resonancia nuclear magnética (RMN) preoperatoria o tomografía axial computarizada (TAC) en tumores mayores de 3cm o con biopsia de adenocarcinoma. Realizamos nueva toma de biopsias ante la sospecha de invasión de la segunda capa en alguna de las pruebas anteriores y cuando la biopsia previa había sido de adenoma velloso. Se llevó a cabo una limpieza mecánica del colon mediante preparados vía oral de fosfato mono- y disódico (Fosfosoda Casen-Fleet, Zaragoza, España).
Posicionamos al paciente en la mesa de quirófano de tal forma que la lesión se situara en la parte inferior del rectoscopio. Realizamos la exéresis a espesor completo de pared en todos los casos. El defecto de la pared rectal lo suturamos.
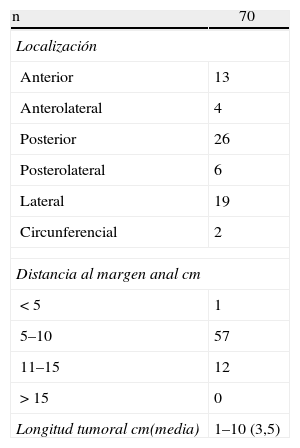
Seguimos la clasificación preoperatoria con intención terapéutica para la TEO, considerando curativos los grupos i y ii (adenomas y T1 buen pronóstico), con intención consensuada grupo iii (T2) y paliativa grupo iv (T3)15. La distancia al margen anal para realizar la TEO fue entre 4 y 15cm.
En el seguimiento de estos pacientes se realizó una rectoscopia rígida en consulta cada 3 meses durante los 2 primeros años, tanto en el caso de lesiones benignas como malignas. Adicionalmente, en estas últimas se realizó CEA cada 3 meses y ecografía abdominal/TAC cada 6 meses.
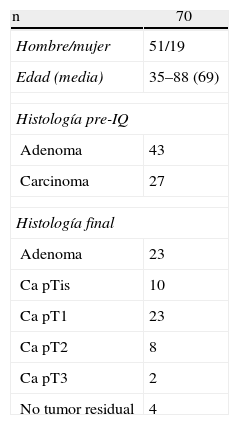
ResultadosNuestra experiencia en cuanto a datos epidemiológicos incluye 70 pacientes intervenidos consecutivamente mediante TEO desde julio de 2006 hasta marzo de 2012. Incluye 51 varones y 19 mujeres con edad media de 69 años. Se clasificaron según la escala anestésica de la American Society of Anesthesiologists (ASA): 8 pacientes en grado i, 31 pacientes en ASA II, 25 en ASA III y 5 en ASA IV.
La localización y altura a la que se encontraba la lesión se muestra en la tabla 1. En las piezas para anatomía patológica, el tamaño medio de las lesiones benignas era 4,1cm (rango: 1,5-10cm) y en malignas de 3,2cm (rango: 1-6cm). La histología final se muestra en la tabla 2.
Entre las lesiones malignas, 7 correspondían a tumores T2-T3N0; de ellas 4 se estadiaron con RMN y ERUS como T2N0; en 3 se realizó la técnica de TEO por importantes comorbilidades y otra por metástasis hepáticas por tumor de origen no digestivo. Los 3 casos diagnosticados preoperatoriamente de T3N0M0 en los que se realizó una técnica de TEO lo fueron por cirrosis estadio B-C de Child, por neo de páncreas estadio iv y al último se le aplicó neoadyuvancia con quimioterapia más radioterapia y, después de la misma, clínicamente presentaba regresión completa.
Como complicación operatoria, una perforación de cara anterior rectal no pudimos cerrarla por vía transanal, realizándose conversión a laparotomía.
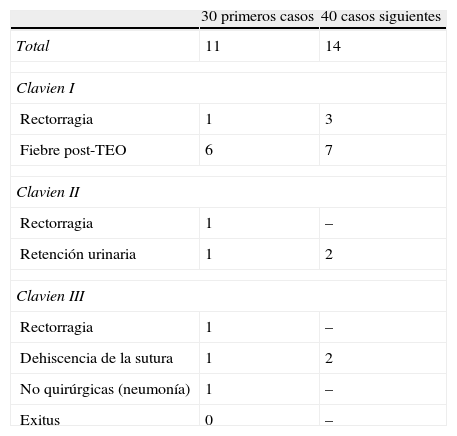
La morbilidad postoperatoria global fue del 35,7% (25 de 70). Siguiendo la clasificación de Clavien16 fueron grado i 17 de ellas, grado ii 4 más y grado iii otras 4. De los 30 primeros casos operados, 11 tuvieron algún tipo de morbilidad y, de los 40 siguientes, 14 pacientes. Toda la morbilidad se desarrolló en los pacientes con intención curativa o consensuada (tabla 3). De los 4 pacientes Clavien III, 3 presentaron una dehiscencia de sutura rectal y otro rectorragia, manifestándose las dehiscencias como rectorragia, absceso presacro y pelviperitonitis. La rectorragia obligó a una resección rectal laparotómica. Un paciente con dehiscencia se sometió a un nuevo TEO para hemostasia. En otro paciente con pelviperitonitis se practicó lavado de la cavidad pélvica, sutura rectal e ileostomía de protección y, por último, en el tercer paciente con dehiscencia de la mitad de circunferencia rectal y absceso presacro, se realizaron múltiples lavados de la cavidad residual con ileostomía de protección.
Las complicaciones a medio/largo plazo fueron: 3 casos de incontinencia transitoria, 2 para gases y uno para heces líquidas, que se resolvieron al cabo de 2 y 3 meses, respectivamente.
La anatomía patológica preoperatoria informó de 27 lesiones malignas y 43 benignas. El resultado anatomopatológico de la pieza final fue: 33 lesiones malignas, 33 benignas y en 4 casos no se encontró tumor residual (tabla 4). En 13 casos de lesiones benignas previas, tras la resección y estudio patológico, fueron pT1 (10 casos) y pT2 (3 casos).
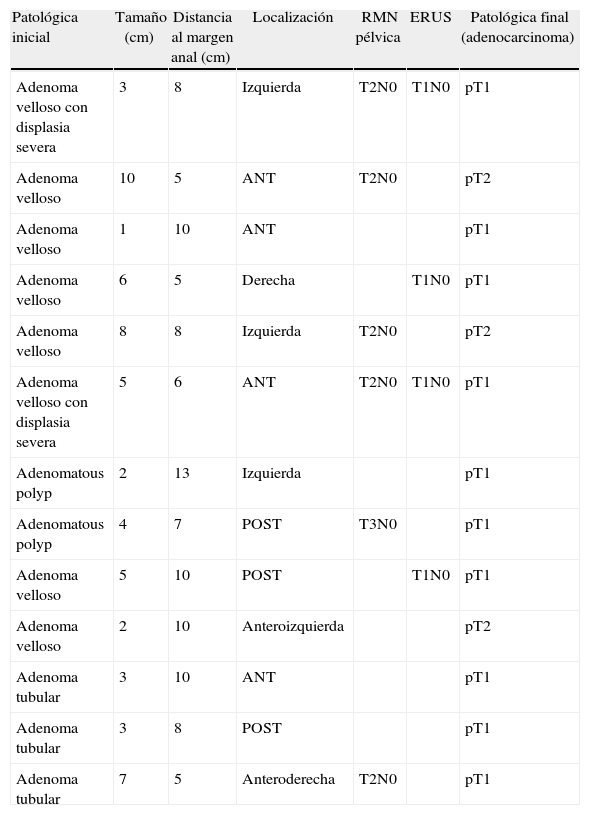
Lesiones con diagnóstico inicial de benignidad y anatomía patológica de la pieza quirúrgica de malignidad (adenocarcinoma)
| Patológica inicial | Tamaño (cm) | Distancia al margen anal (cm) | Localización | RMN pélvica | ERUS | Patológica final (adenocarcinoma) |
| Adenoma velloso con displasia severa | 3 | 8 | Izquierda | T2N0 | T1N0 | pT1 |
| Adenoma velloso | 10 | 5 | ANT | T2N0 | pT2 | |
| Adenoma velloso | 1 | 10 | ANT | pT1 | ||
| Adenoma velloso | 6 | 5 | Derecha | T1N0 | pT1 | |
| Adenoma velloso | 8 | 8 | Izquierda | T2N0 | pT2 | |
| Adenoma velloso con displasia severa | 5 | 6 | ANT | T2N0 | T1N0 | pT1 |
| Adenomatous polyp | 2 | 13 | Izquierda | pT1 | ||
| Adenomatous polyp | 4 | 7 | POST | T3N0 | pT1 | |
| Adenoma velloso | 5 | 10 | POST | T1N0 | pT1 | |
| Adenoma velloso | 2 | 10 | Anteroizquierda | pT2 | ||
| Adenoma tubular | 3 | 10 | ANT | pT1 | ||
| Adenoma tubular | 3 | 8 | POST | pT1 | ||
| Adenoma tubular | 7 | 5 | Anteroderecha | T2N0 | pT1 |
ANT: anterior; ERUS: ultrasonido endorectal; polyp: pólipo adenomatoso; POST: posterior; RMN: resonancia nuclear magnética.
Dentro de las lesiones benignas, la mayoría fueron pólipos adenovellosos con mayor o menor grado de displasia, lográndose una resección R0 en el 100% de los pacientes.
Con respecto a las lesiones finalmente malignas, hubo 23 carcinomas T1, de los cuales 4 presentaban margen afecto; 8 lesiones T2, 2 con margen afecto; y 2 lesiones T3, una de ellas con afectación del margen profundo de resección.
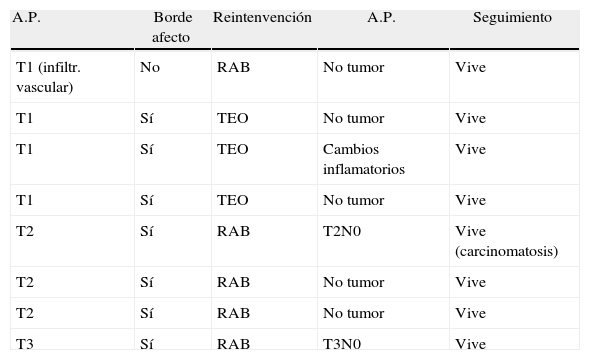
El rescate quirúrgico inmediato se realizó en los pacientes pT1 con márgenes afectos, en 3 de ellos mediante nueva TEO, no reinterviniéndose un cuarto por graves comorbilidades. En un paciente pT1 por criterios de mal pronóstico (adenocarcinoma pobremente diferenciado con invasión vascular), realizamos una escisión mesorrectal total laparoscópica. En las lesiones pT2 y pT3 no se resecaron 4 por sus comorbilidades muy elevadas, y otra T2 por negativa del paciente. Al resto se le realizó cirugía radical con resección rectal y escisión mesorrectal, como se refleja en la tabla 5.
Reintervenciones precoces
| A.P. | Borde afecto | Reintenvención | A.P. | Seguimiento |
| T1 (infiltr. vascular) | No | RAB | No tumor | Vive |
| T1 | Sí | TEO | No tumor | Vive |
| T1 | Sí | TEO | Cambios inflamatorios | Vive |
| T1 | Sí | TEO | No tumor | Vive |
| T2 | Sí | RAB | T2N0 | Vive (carcinomatosis) |
| T2 | Sí | RAB | No tumor | Vive |
| T2 | Sí | RAB | No tumor | Vive |
| T3 | Sí | RAB | T3N0 | Vive |
A.P.: anatomía patológica; RAB: resección anterior baja recto.
Durante el seguimiento, todos los pacientes T2-T3 no rescatados, excepto uno, han fallecido de sus comorbilidades o de otros tumores. Un T1 ha desarrollado una neoplasia en sigma.
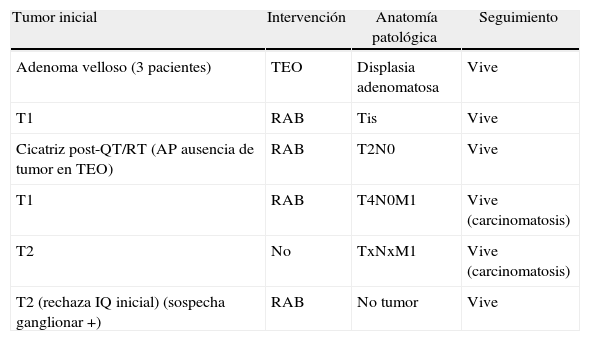
Recidivaron 7 pacientes, 3 adenomas vellosos, 2 tumores T1 y otros 2 T2, cuya intervención, anatomía patológica y evolución se reflejan en la tabla 6.
Recidivas y seguimiento
| Tumor inicial | Intervención | Anatomía patológica | Seguimiento |
| Adenoma velloso (3 pacientes) | TEO | Displasia adenomatosa | Vive |
| T1 | RAB | Tis | Vive |
| Cicatriz post-QT/RT (AP ausencia de tumor en TEO) | RAB | T2N0 | Vive |
| T1 | RAB | T4N0M1 | Vive (carcinomatosis) |
| T2 | No | TxNxM1 | Vive (carcinomatosis) |
| T2 (rechaza IQ inicial) (sospecha ganglionar +) | RAB | No tumor | Vive |
AP: anatomía patológica; IQ: intervención quirúrgica; QT/RT: quimioterapia+radioterapia; RAB: resección anterior baja del recto.
Un 40% de la población va a desarrollar pólipos benignos o adenomas en el recto; la mayoría van a poder ser resecados mediante polipectomía endoscópica17, pero esta no es capaz de eliminar lesiones grandes y pólipos extensos planos. La resección rectal vía transabdominal o transacra es un procedimiento quirúrgico asociado a significativa morbilidad (7-68%) y mortalidad (0-6,5%). La realización de una técnica TEO es una alternativa válida a estos accesos.
Una proporción de tumores diagnosticados como adenomas preoperatoriamente resultarán ser carcinomas en el análisis anatomopatológico definitivo. Si la resección parietal realizada ha sido de espesor completo y la patológica definitiva estadia la lesión en pT1 de buen pronóstico, los márgenes de seguridad parietal que obtenemos mediante resección vía TEO son adecuados y para ellos esta resección representa un procedimiento radical y un tratamiento que es definitivo, dado que la afectación ganglionar posible se acerca a 0-8% (T1)4–6,17. Respecto a los carcinomas T2, las opciones terapéuticas asociadas a la cirugía local dan resultados diversos en cuanto a recidiva y supervivencia, y su tratamiento mediante TEO, con la que solo resecamos la pared rectal, no está aceptado en el momento actual debido a la posibilidad de afectación ganglionar de hasta un 20%, por lo que deben ser tratados con cirugía de resección mesorrectal entre 4 y 6 semanas. La quimioterapia y la radioterapia concomitantes han conseguido un mejor control local de las neoplasias rectales y está permitiendo, en casos de respuesta histológica y clínica completa, la resección de la cicatriz residual mediante TEO con la finalidad de confirmar esta respuesta completa, pero siempre dentro de ensayos clínicos9, porque se ha visto que en estos pacientes no empeora la supervivencia frente a la resección anterior rectal baja y porque siempre nos queda un margen de rescate ante la recidiva con cirugía radical abdominal y sin alterar la supervivencia global9,10.
En nuestros pacientes, realizado el estudio patológico de la pieza, obtuvimos el diagnóstico de adenoma en 33 de ellos, mostrando 10 displasia intensa/carcinoma in situ. Otros 23 pacientes fueron etiquetados de pT1, 8 pacientes de pT2, 2 pacientes eran pT3 y en 4 el estudio patológico no encontró tumor (en 3 de ellos se resecó mediante TEO la cicatriz previa de una resección endoscópica de un adenoma con infiltración del tallo por adenocarcinoma. En el cuarto se resecó la cicatriz resultante de un tumor T3N0M0, el cual había recibido quimioterapia y radioterapia neoadyuvante y el paciente, junto con su cirujano, por sus comorbilidades, se planteó una resección endoscópica transanal).
Las complicaciones relacionadas con TEO oscilan entre el 20 y el 30%18, siendo Clavien I-II rectorragias escasas, retenciones urinarias y fiebre cuyo tratamiento es sencillo. Pero un 5% serán complicaciones graves (Clavien III) como infección de espacio, sangrado severo, y perforación en la cavidad peritoneal19. En nuestro estudio, a pesar de haber realizado la TEO en pacientes con adenomas mayores de 3cm en un porcentaje del 80%, de que un 18,3% se situaban a más de 10cm del margen anal y de que, de estos últimos, el 50% fueran anteriores o laterales, las complicaciones Clavien I-II han sido del 30% y las Clavien III del 5,7%, comportando una morbilidad similar los 30 primeros casos a los 40 siguientes pues, a medida que la experiencia avanzó, incorporamos casos más complejos. Esta morbilidad se ve incrementada, si la TEO ha sido realizada para extraer una cicatriz residual en tumores T2-T3 que han recibido radioquimioterapia neoadyuvante, hasta cifras del 53%9,10. Si la complicación en un tumor alto es la perforación a cavidad abdominal, varios autores11,18,19 informan de que la misma no requiere conversión a otra vía de abordaje ya que puede ser reparada con seguridad endoscópicamente. En nuestra experiencia, una conversión a cirugía abdominal fue necesaria por presentarse una perforación intraperitoneal.
Otra complicación con esta técnica es la dehiscencia de la sutura. Puede ocurrir en más del 50% de los casos y no tener consecuencias clínicas ya que el defecto parietal es pequeño e infraperitoneal, por lo que algunos autores preconizan no cerrar estos defectos20,21. Distinto es si la dehiscencia se produce después de un cierre parietal amplio, que creemos, al igual que otros autores, que se debe cerrar15 ya que de lo contrario puede ocasionar hemorragia y estenosis, e incluso abscesos presacros que obligan a drenajes y limpiezas sucesivas. En nuestra serie, se presentaron dehiscencias en el 50% de los pacientes, pero solo en 3 (4%) casos la dehiscencia generó complicaciones mayores con repercusión clínica y obligó a reintervenir quirúrgicamente a los pacientes.
Se ha estudiado mediante manometría y ecografía rectal la continencia y se ha visto que no hay alteraciones esfinterianas a largo plazo22–25. En nuestros pacientes hubo 2 incontinencias a gases y una a heces líquidas resueltas a los 2 y 3 meses de forma satisfactoria.
Los índices de recurrencia para lesiones benignas se sitúan en torno a un 5%, siendo los principales factores relacionados con la misma el tamaño tumoral, un margen libre insuficiente o la presencia de displasia en los bordes de la pieza26,27. En nuestra serie de 33 pacientes con adenomas, 3 (9,1%) recidivaron y, en todos ellos, en el primer estudio anatomopatológico de la pieza existía displasia en alguno de los bordes de resección.
Con respecto a las lesiones pT1 y pT2, los índices medios de recidiva a un año oscilan entre el 10 y el 25% respectivamente28–30 y están directamente relacionados con los márgenes de resección inferiores a 1cm y con factores tumorales de mal pronóstico. El tratamiento de esta recidiva en pacientes con graves morbilidades puede ser en ocasiones una nueva escisión y quimiorradioterapia adyuvante. En los pacientes sin o con comorbilidades aceptables, la recurrencia endoluminal o pélvica debe ser tratada con cirugía radical de rescate inmediata. En nuestra serie, 4 pacientes con tumores infiltrantes (10,8%) presentaron recidiva local. Dos eran pT1 (8,7%), uno era pT2 (12,5%) y otro era pT3 (50%) al que previamente se le había resecado la cicatriz rectal mediante TEO, después de neoadyuvancia con diagnóstico anatomopatológico de ausencia de tumor en la pieza quirúrgica.
Creemos que este trabajo presenta un porcentaje alto de lesiones benignas que con el diagnóstico patológico definitivo resultaron ser malignas. Ello se debe a la no utilización de macrobiopsias durante la colonoscopia. Además, con el diagnóstico inicial de adenoma velloso, en muchos casos y a pesar del tamaño tumoral superior a 2-3cm, hemos planteado la cirugía al paciente como una escisión-biopsia de espesor completo, siendo conscientes de la dificultad de diferenciar mediante las pruebas diagnósticas habituales (eco endorrectal y RMN pélvica) las lesiones benignas de las displasias graves y de estadios iniciales de malignidad (T1), principalmente en lesiones polipoideas de gran tamaño. De esta forma, excepto en 3 pacientes en los que la afectación tumoral llegaba hasta la muscular, en el resto la TEO ha sido la cirugía correcta y suficiente, al ser lesiones con displasia severa/carcinoma in situ o tumores que afectaban a la mucosa o submucosa (pT1) sin criterios de mal pronóstico.
En cuanto a la amplitud de la resección, hemos tenido un 9,3% de márgenes de resección insuficientes en las lesiones consideradas benignas o T1 y, en todas, con existencia de borde con displasia adenomatosa, lo que nos ha obligado a reintervenir a estos pacientes mediante nueva TEO.
En conclusión, la técnica TEO permite resecar tumores benignos rectales no extirpables mediante resección endoscópica, con bajo índice de morbilidad. Permite tratamiento curativo de las neoplasias malignas rectales que se confirman histológicamente como carcinomas pT1. En línea con estas observaciones, el diagnóstico histológico y la estadificación preoperatoria son esenciales para una cuidadosa selección de los pacientes. Puede proporcionar el beneficio potencial de un abordaje mínimamente invasivo, pero sin los riesgos asociados a la cirugía abdominal rectal. Además, el análisis de esta serie consecutiva de pacientes intervenidos con TEO sugiere que la técnica es segura y eficaz en el tratamiento de los adenomas y carcinomas pT1, con una recurrencia comparable a la de la cirugía convencional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.