El colangiocarcinoma intrahepático es una neoplasia primaria hepática de mal pronóstico, cuyo único tratamiento curativo es la cirugía. El objetivo de este trabajo ha sido determinar los factores pronósticos de supervivencia del colangiocarcinoma intrahepático tratado quirúrgicamente con intención curativa.
MétodosSe ha recogido una serie de 67 pacientes intervenidos quirúrgicamente de esta neoplasia en el Hospital Universitario de Bellvitge entre 1996 y 2017. Se han analizado los datos epidemiológicos, clínicos, quirúrgicos, anatomopatológicos, de morbilidad, de mortalidad y de supervivencia.
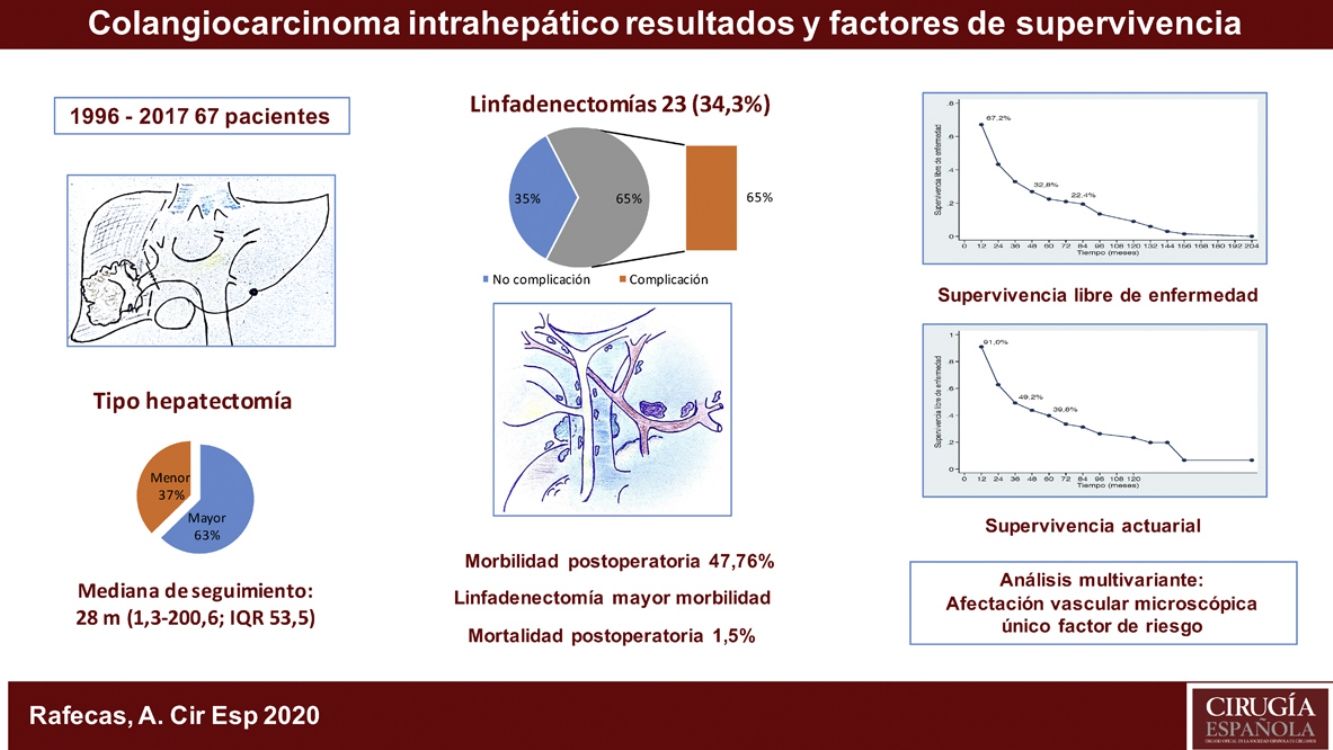
ResultadosLa morbilidad postoperatoria ha sido del 47,76% y la mortalidad postoperatoria de 1,5%. La linfadenectomía se ha asociado a mayor morbilidad. La supervivencia global ha sido de 91%; 49,2% y 39,8% a los 12, 36 y 60 meses, respectivamente, y la supervivencia libre de enfermedad de 67,2%; 32,8% y 22,4%. La morbilidad postoperatoria en forma de reintervención quirúrgica, la invasión vascular y la quimioterapia adyuvante han demostrado ser factores de mal pronóstico. La invasión vascular en el estudio anatomopatológico fue el factor de riesgo de mayor importancia en la supervivencia.
ConclusionesEste estudio recoge la experiencia de nuestro centro en el tratamiento quirúrgico del colangiocarcinoma intrahepático durante un periodo de 21 años. La linfadenectomía se ha asociado a mayor morbilidad y la afectación vascular en el estudio anatomopatológico ha sido el factor de riesgo más importante en cuanto a la supervivencia.
Intrahepatic cholangiocarcinoma is a primary liver neoplasm whose only curative treatment is surgery. The objective of this study was to determine the prognostic factors for survival of intrahepatic cholangiocarcinoma treated surgically with curative intent.
MethodsSixty-seven patients who had been treated surgically for this neoplasm were collected at Bellvitge University Hospital between 1996 and 2017. Epidemiological, clinical, surgical, anatomopathological, morbidity, mortality and survival data have been analysed.
ResultsPostoperative morbidity was 47.76%, and postoperative mortality was 1.5%. Lymphadenectomy was associated with increased morbidity. Overall survival was 91%, 49.2% and 39.8% after 12, 36 and 60 months, respectively, and disease-free survival was 67.2%, 32.8% and 22.4%. Postoperative morbidity (reoperation, vascular invasion, adjuvant chemotherapy) were shown to be factors for a poor prognosis. Vascular invasion in the pathological study was the most important risk factor in the survival analysis.
ConclusionsThis study reflects our centre's experience in the surgical treatment of intrahepatic cholangiocarcinoma over a period of 21 years. Lymphadenectomy was associated with increased morbidity, and vascular invasion in the pathological study was the most important risk factor in the survival analysis.
El colangiocarcinoma intrahepático es una neoplasia que se desarrolla a partir de las células epiteliales de los conductos biliares intrahepáticos. Representa menos de un 3% de los tumores gastrointestinales y el 15% de los casos de neoplasia primaria hepática. Es la segunda neoplasia en frecuencia, por detrás del hepatocarcinoma1. La infección crónica por el VHB y el VHC, la cirrosis hepática de cualquier causa y otras alteraciones, como la esteatohepatitis no alcohólica, se han implicado como factores de riesgo de desarrollo de esta neoplasia1,2.
La sintomatología es inespecífica y en la mayoría de casos es diagnosticado como hallazgo casual en el contexto del seguimiento de una hepatopatía crónica. El diagnóstico se basa en los estudios de imagen. En la ecografía aparece como una lesión focal hipoecoica. En la tomografía computarizada (TC) se observa como una lesión hipodensa irregular con infiltración marginal y con un grado variable de retraso de captación en la fase portal. En la resonancia magnética (RM) se muestra como una imagen hipointensa en T1 e hiperintensa en T23,4.
La biopsia de la lesión está indicada en los casos en los que existe duda diagnóstica o en pacientes no resecables para tratamiento quimioterápico paliativo. En cuanto a marcadores tumorales, el antígeno carcinoembrionario (CEA) solamente se encuentra elevado en un tercio de los pacientes y el antígeno carbohidratado 19.9 (CA19.9) es más sensible pero poco específico, ya que se encuentra elevado también en otros tipos de neoplasias gastrointestinales3,4.
El colangiocarcinoma intrahepático tiene mal pronóstico y tan solo el tratamiento quirúrgico con intención curativa es capaz de ofrecer una supervivencia aceptable4,5. Sin embargo, varios estudios han demostrado que la ablación por radiofrecuencia de tumores menores de 3cm puede ser útil en pacientes cirróticos o en casos de recidiva6,7. Los pacientes tratados con resección quirúrgica tienen una media de supervivencia a los 5 años de entre el 25 y el 40%, con una mediana de supervivencia de 20-22 meses. En cambio, los pacientes no resecados tienen una mediana de supervivencia de 6 a 9 meses1,5,8. Los factores descritos de mal pronóstico incluyen: la multifocalidad, la afectación ganglionar, la invasión vascular y los márgenes quirúrgicos positivos1,3,5.
El estudio actual se basa en el análisis de los pacientes con colangiocarcinoma intrahepático tratados quirúrgicamente en nuestro centro con intención curativa analizando los aspectos quirúrgicos y patológicos, en valorar la influencia de la linfadenectomía en las complicaciones postoperatorias y en analizar los factores pronósticos de recidiva y de supervivencia.
MétodosSe recogieron datos de los pacientes afectos de colangiocarcinoma intrahepático, tratados quirúrgicamente con intención curativa, entre enero de 1996 y octubre de 2017.
Para el análisis solamente se han utilizado las variables clínicas, cuya información está disponible en más del 30% de los pacientes, por lo que variables como la diabetes mellitus, el índice de masa corporal o la hipertensión arterial no han podido ser valorados. Se indicó la resección hepática en los pacientes diagnosticados de colangiocarcinoma intrahepático por técnicas de imagen (TC o RM) o por biopsia si existían dudas diagnósticas. Se consideraron irresecables los pacientes con enfermedad metastásica parenquimatosa o ganglionar celíaca o retroperitoneal, los que precisaran una resección hepática con remanente insuficiente a pesar de embolización portal preoperatoria y los pacientes con hepatopatía crónica avanzada o descompensada con Child-Pugh B o C. Respecto al tratamiento quirúrgico, se consideró resección hepática mayor la resección de 3o más segmentos y resección menor las resecciones limitadas o hasta de 2 segmentos. Se realizó linfadenectomía del hilio hepático en caso de sospecha de afectación neoplásica ganglionar por el estudio de imagen y en el caso de resecciones hepáticas extendidas para mejorar la estadificación. Se analizó la morbilidad con base en la clasificación de Clavien-Dindo9, la estancia hospitalaria y la mortalidad perioperatoria (en 30 días o durante la hospitalización inicial). Todos los pacientes han tenido un mínimo de seguimiento de 12 meses, con marcadores tumorales y estudio de imagen (TC o RM) cada 6 meses. Se analizaron los márgenes de resección en milímetros. Revisados todos los dictámenes anatomopatológicos, se utilizó para clasificarlos la 8.ª edición del sistema TNM10. La quimioterapia adyuvante, si no existía contraindicación, se indicó a criterio del oncólogo responsable en estadios II y III.
Análisis estadísticoEn el análisis descriptivo de los datos, las variables cualitativas fueron expresadas en números absolutos y porcentajes, y las variables cuantitativas en mediana y rango intercuartílico. Para la descripción de la supervivencia global y libre de enfermedad se ha utilizado el método actuarial, tomando períodos de 12 meses, expresando la mediana y los pacientes en riesgo a 1, 3 y 5 años. Para la comparación de supervivencias entre estadios tumorales se ha utilizado el método de Kaplan-Meier mediante la técnica de log-rank. El análisis de factores de riesgo asociados a mortalidad y recidiva se ha hecho mediante modelos de regresión de Cox; para el análisis multivariante se escogieron variables con relevancia clínica o bien las que mostraron significación p < 0,2 en el análisis univariante. Se ha considerado significativo un valor de p < 0.05. Para el análisis estadístico se utilizó el programa Stata 12.0 (StataCorp, CollegeStation, Texas, EE. UU., 2011).
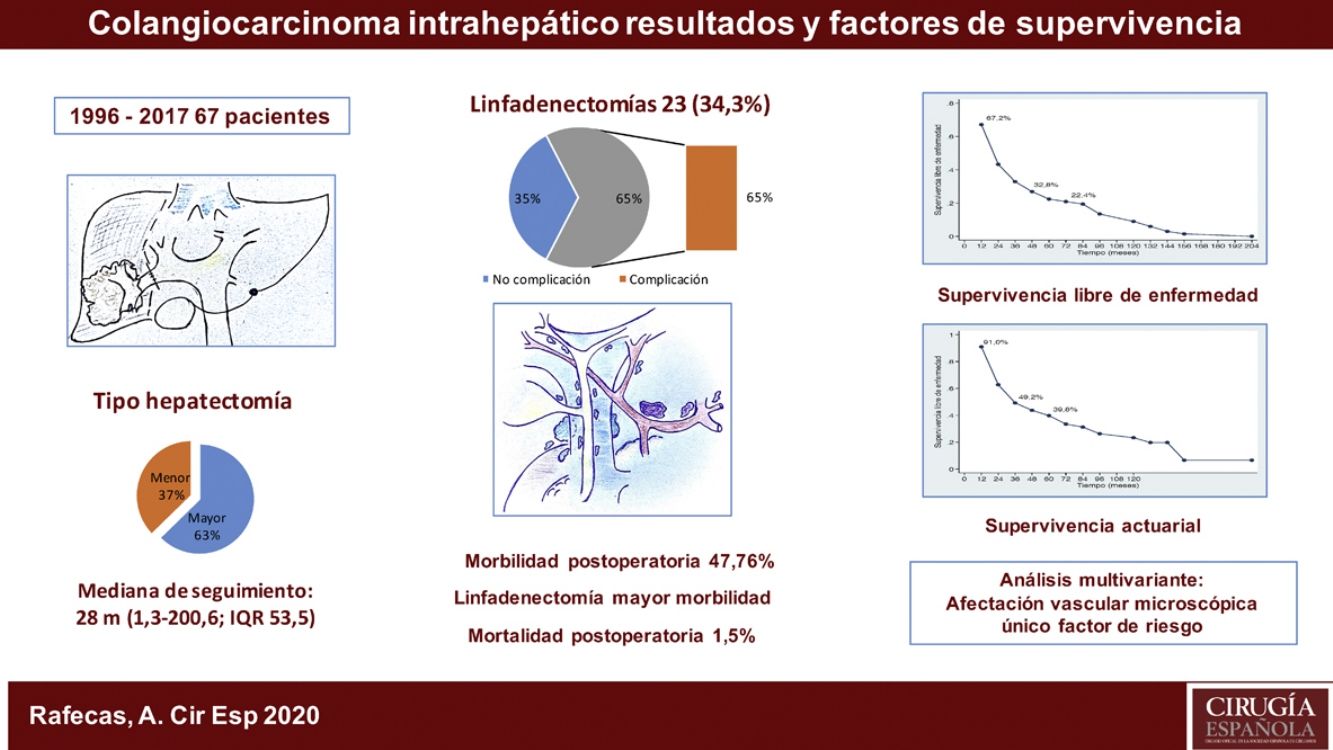
ResultadosFueron intervenidos 67 pacientes, 45 hombres (67,2%) y 22 mujeres (32,8%), con una mediana de 66 años (rango: 33-86 años). Veintiuno de estos pacientes (31,3%) tenían una hepatopatía previa: enólica en 15 casos, 2de ellos asociada a VHB, 4 a VHC, un caso de esteatohepatitis no alcohólica y otro de colangitis esclerosante. La anatomía patológica demostró cirrosis hepática en 9 casos, fibrosis portal en 8, hepatitis crónica en 2, esteatohepatitis en uno y sin alteraciones parenquimatosas en otro caso. En el momento del diagnóstico, 10 pacientes presentaban adenopatías en el hilio hepático. Como marcador tumoral se disponía de los valores del CA19.9 de 60 pacientes (89,6%), en 36 de los cuales (60,0%) estaba por encima de la normalidad (tabla 1).
Datos clínicos
| Sexo, n(%) | |
| Hombres | 45 (67,2%) |
| Mujeres | 22 (32,8%) |
| Edad (años), mediana (rango) | 66 (33 a 86) |
| >70, n(%) | 24 (35,8%) |
| Hepatopatía previa, n(%) | 21 (31,3%) |
| CA 19.91 (U/mL), mediana (rango)1 | 47 (1 a 5324) |
| > 37 U/mL, n(%) | 43 (64,2%) |
| Estudios de imagen (TC / RM) | 87 |
| TC abdominal | 65 |
| RM hepática | 22 (20 complementarias a la TC) |
| TIPO DE RESECCIÓN HEPÁTICA | |
| Hepatectomía mayor, n (%) | 42 (62,7%) |
| H. Izquierda | 12 (17,9%) |
| H. Derecha | 11 (16,4%) |
| H. Izquierda extendida a S.I | 8 (11,9%) |
| Trisectorectomía derecha | 4 (6%) |
| Trisectorectomía izquierda | 4 (6%) |
| H. Medial | 1 (1,5%) |
| H. Mayor asociando resección limitada contralateral | 2 (3%) |
| Hepatectomía menor, n(%) | 25 (37,1%) |
| Segmentectomía / Bisegmentectomía | 17 (25,4%) |
| Resección limitada | 7 (10,5%) |
| Bisegmentectomía lateral izquierda | 1 (1,5%) |
| LINFADENECTOMÍA | |
| SÍ | 23 (34,3%) |
| NO | 44 (65,7%) |
| DATOS POSTOPERATORIOS | |
| Complicaciones postoperatorias, n(%) | 32 (47,8%) |
| Clavien =< IIIA, n(%)2 | 27 (40,3%) |
| Clavien > IIIA, n(%)2 | 5 (15,6%) |
| Pacientes complicados con linfadenectomias | 15 (65,2%)3 |
| Pacientes complicados sin linfadenectomías | 17 (38,6%)3 |
| Reintervención, n(%) | 4 (6%) |
| Mortalidad postoperatoria (90 días), n %) | 1 (1,5%) |
| Estancia (días), mediana (rango) | 10 (5 a 100) |
| DATOS ANATOMOPATOLÓGICOS | |
| Tamaño tumoral (cm), mediana (rango) | 5,5 (1,4,a 15) |
| > 5cm, n(%) | 44 (65,7%) |
| Estadio tumoral, n(%) | |
| IA | 3 (4,5%) |
| IB | 37 (55,2%) |
| II | 12 (17,9%) |
| IIIA | 3 (4,5%) |
| IIIB | 12 (17,9%) |
| Grado de diferenciación tumoral, n(%) | |
| Bien diferenciado | 6 (9%) |
| Moderadamente diferenciado | 50 (74,6%) |
| Mal diferenciado | 11 (16,4%) |
| Multifocalidad, n(%) | 6 (9%) |
| Invasión vascular, n(%) | 17 (25,4%) |
| Invasión perineural, n(%) | 14 (20,9%) |
| Afectación adenopática, n(%) | 10 (14,9%) |
| Quimioterapia adyuvante, n(%) | 8 (11,9%) |
1 Sólo se dispone de datos en 60 pacientes (89,6%)
2 Porcentajes sobre los 32 pacientes que se complican
3 Pearson chi2 = 4.2774 p= 0.039
En 23 pacientes se realizaron 22 linfadenectomías hilioportales, 2 peripancreáticas, 5 del tronco celíaco y 3 del territorio interaortocava. En 4 pacientes se asoció resección de la vía biliar izquierda por infiltración neoplásica. Se indicó embolización portal previa a la intervención quirúrgica en 4 pacientes, a los que se les realizó una hepatectomía derecha (2 casos), una hepatectomía izquierda y una trisectorectomía derecha en un caso cada uno.
La estancia postoperatoria mediana fue de 10 días (rango; 5-100). Presentaron algún tipo de complicación postoperatoria 32 pacientes (47,8%). La mayoría de los casos (84,4%) fueron grados del I al IIIa de la escala de Clavien-Dindo9, predominantemente infección de localización quirúrgica, tratados con antibióticos, desbridamiento en la propia cama del paciente o drenaje percutáneo por técnicas de imagen bajo anestesia local. Presentaron una complicación postoperatoria 5 pacientes (3 Clavien IVa, 1 IVb y 1V) con insuficiencia respiratoria, renal, o cardíaca, que requirió tratamiento quirúrgico e ingreso en la Unidad de Medicina Intensiva. Hubo un caso de mortalidad perioperatoria (Clavien V) a causa de una sepsis y fallo multiorgánico. De los 23 pacientes a los que se realizó linfadenectomía, 15 (65,2%) presentaron complicaciones, mientras que tan solo 17 de los 44 pacientes (38,6%) a los que no se les realizó las presentaron, resultado estadísticamente significativo (p = 0,039) (tabla 1).
En el 80,6% de pacientes se consiguió una resección con márgenes libres (R0). La mayoría de los pacientes (91,9%) presentaban una lesión única. La mediana del tamaño tumoral fue de 5,5cm (1,4-15cm): en 44 pacientes igual o superior a 5cm (65,7%). Presentaban invasión vascular 17 pacientes y 14 invasión perineural. Respecto a la diferenciación tumoral, la mayoría de los tumores, 50 casos, eran adenocarcinomas moderadamente diferenciados, 6 eran muy diferenciados y 11 poco diferenciados (tabla 1).
De los 23 pacientes a los que se les realizó una linfadenectomía, en 10 casos fueron positivas, 9de las 22 linfadenectomías hilioportales (40,9%), una de las 2peripancreáticas y una de las 3interaortocava. Las 5linfadenectomías del tronco celíaco fueron negativas.
Respecto a la estadificación, la mayoría de los pacientes (59,7%) presentaban un estadio IA o IB, 18% estadio II, 4,5% estadio IIIA y 18% estadio IIIB.
Dos pacientes (4,5%), considerados potencialmente resecables, recibieron quimioterapia neoadyuvante con carboplatino-gemcitabina. De los 67 pacientes, 8 (11,9%) fueron tratados con quimioterapia adyuvante, 5recibieron gemcitabina, sola o asociada a 5-fluorouracilo, 2oxaliplatino-5 fluorouracilo y uno cisplatino-5-fluorouracilo.
Presentaron algún tipo de recidiva en el seguimiento 39pacientes (58,2%). La mayoría (32 pacientes, 82,1%), en forma de recidiva hepática. De los 7 pacientes restantes, en un caso la recidiva fue pulmonar, en 2en forma de adenopatías, en 3óseas y uno la presentó en diversas localizaciones. Presentaron recidiva en más de una localización 17 pacientes. Tan solo un caso de las 32 recidivas hepáticas (3,1%) fue tratado quirúrgicamente con intención curativa.
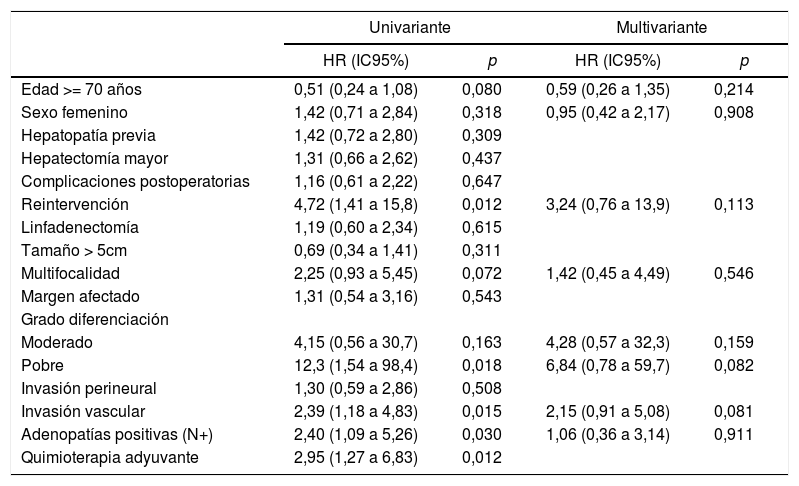
En el análisis univariante la reintervención quirúrgica, los tumores pobremente diferenciados, las adenopatías positivas, la invasión vascular y la quimioterapia adyuvante resultaron estadísticamente significativos. En el análisis multivariante ninguna variable evidenció significación estadística (tabla 2).
Factores de riesgo de recidiva
| Univariante | Multivariante | |||
|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |
| Edad >= 70 años | 0,51 (0,24 a 1,08) | 0,080 | 0,59 (0,26 a 1,35) | 0,214 |
| Sexo femenino | 1,42 (0,71 a 2,84) | 0,318 | 0,95 (0,42 a 2,17) | 0,908 |
| Hepatopatía previa | 1,42 (0,72 a 2,80) | 0,309 | ||
| Hepatectomía mayor | 1,31 (0,66 a 2,62) | 0,437 | ||
| Complicaciones postoperatorias | 1,16 (0,61 a 2,22) | 0,647 | ||
| Reintervención | 4,72 (1,41 a 15,8) | 0,012 | 3,24 (0,76 a 13,9) | 0,113 |
| Linfadenectomía | 1,19 (0,60 a 2,34) | 0,615 | ||
| Tamaño > 5cm | 0,69 (0,34 a 1,41) | 0,311 | ||
| Multifocalidad | 2,25 (0,93 a 5,45) | 0,072 | 1,42 (0,45 a 4,49) | 0,546 |
| Margen afectado | 1,31 (0,54 a 3,16) | 0,543 | ||
| Grado diferenciación | ||||
| Moderado | 4,15 (0,56 a 30,7) | 0,163 | 4,28 (0,57 a 32,3) | 0,159 |
| Pobre | 12,3 (1,54 a 98,4) | 0,018 | 6,84 (0,78 a 59,7) | 0,082 |
| Invasión perineural | 1,30 (0,59 a 2,86) | 0,508 | ||
| Invasión vascular | 2,39 (1,18 a 4,83) | 0,015 | 2,15 (0,91 a 5,08) | 0,081 |
| Adenopatías positivas (N+) | 2,40 (1,09 a 5,26) | 0,030 | 1,06 (0,36 a 3,14) | 0,911 |
| Quimioterapia adyuvante | 2,95 (1,27 a 6,83) | 0,012 | ||
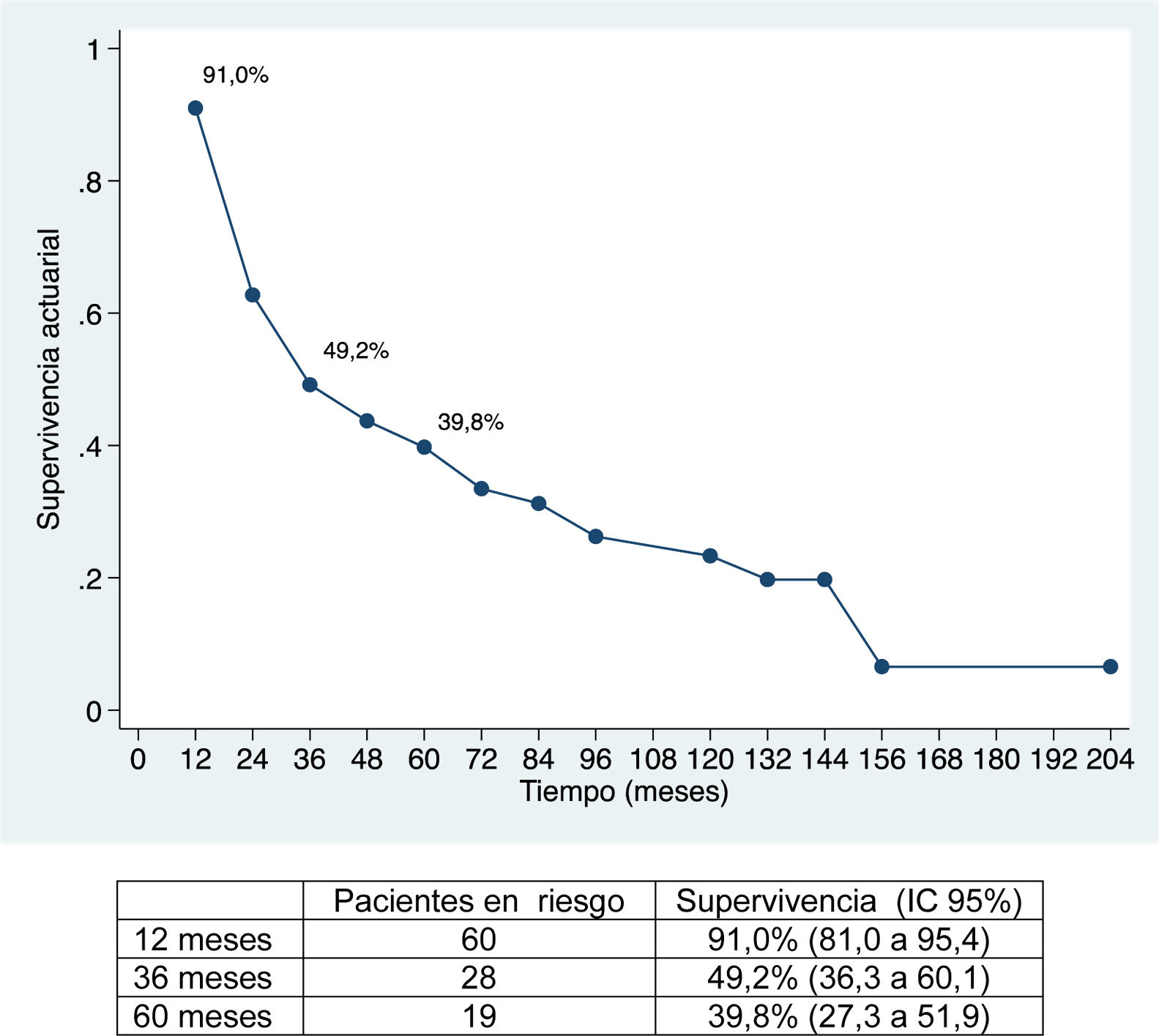
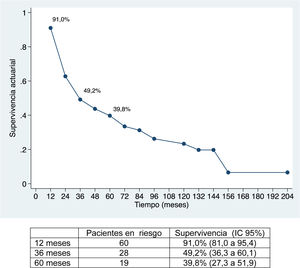
La mediana de seguimiento ha sido de 28 meses (rango: 1,3-200,6) y la mediana de supervivencia de 31,2 meses (IC 95%: 22,2-65,1 meses), del 91,0%; 49,2% y 39,8% a los 12, 36 y 60 meses, respectivamente.
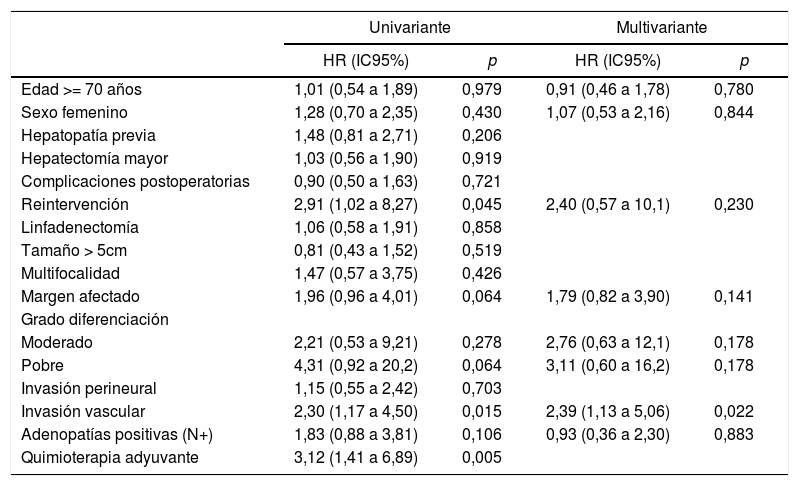
El análisis univariante de los factores de riesgo respecto a la supervivencia demostró que la reintervención quirúrgica, la invasión vascular y la quimioterapia adyuvante son variables significativas. En el análisis multivariante solo la invasión vascular obtuvo significación estadística (tabla 3).
Factores de riesgo de supervivencia
| Univariante | Multivariante | |||
|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |
| Edad >= 70 años | 1,01 (0,54 a 1,89) | 0,979 | 0,91 (0,46 a 1,78) | 0,780 |
| Sexo femenino | 1,28 (0,70 a 2,35) | 0,430 | 1,07 (0,53 a 2,16) | 0,844 |
| Hepatopatía previa | 1,48 (0,81 a 2,71) | 0,206 | ||
| Hepatectomía mayor | 1,03 (0,56 a 1,90) | 0,919 | ||
| Complicaciones postoperatorias | 0,90 (0,50 a 1,63) | 0,721 | ||
| Reintervención | 2,91 (1,02 a 8,27) | 0,045 | 2,40 (0,57 a 10,1) | 0,230 |
| Linfadenectomía | 1,06 (0,58 a 1,91) | 0,858 | ||
| Tamaño > 5cm | 0,81 (0,43 a 1,52) | 0,519 | ||
| Multifocalidad | 1,47 (0,57 a 3,75) | 0,426 | ||
| Margen afectado | 1,96 (0,96 a 4,01) | 0,064 | 1,79 (0,82 a 3,90) | 0,141 |
| Grado diferenciación | ||||
| Moderado | 2,21 (0,53 a 9,21) | 0,278 | 2,76 (0,63 a 12,1) | 0,178 |
| Pobre | 4,31 (0,92 a 20,2) | 0,064 | 3,11 (0,60 a 16,2) | 0,178 |
| Invasión perineural | 1,15 (0,55 a 2,42) | 0,703 | ||
| Invasión vascular | 2,30 (1,17 a 4,50) | 0,015 | 2,39 (1,13 a 5,06) | 0,022 |
| Adenopatías positivas (N+) | 1,83 (0,88 a 3,81) | 0,106 | 0,93 (0,36 a 2,30) | 0,883 |
| Quimioterapia adyuvante | 3,12 (1,41 a 6,89) | 0,005 | ||
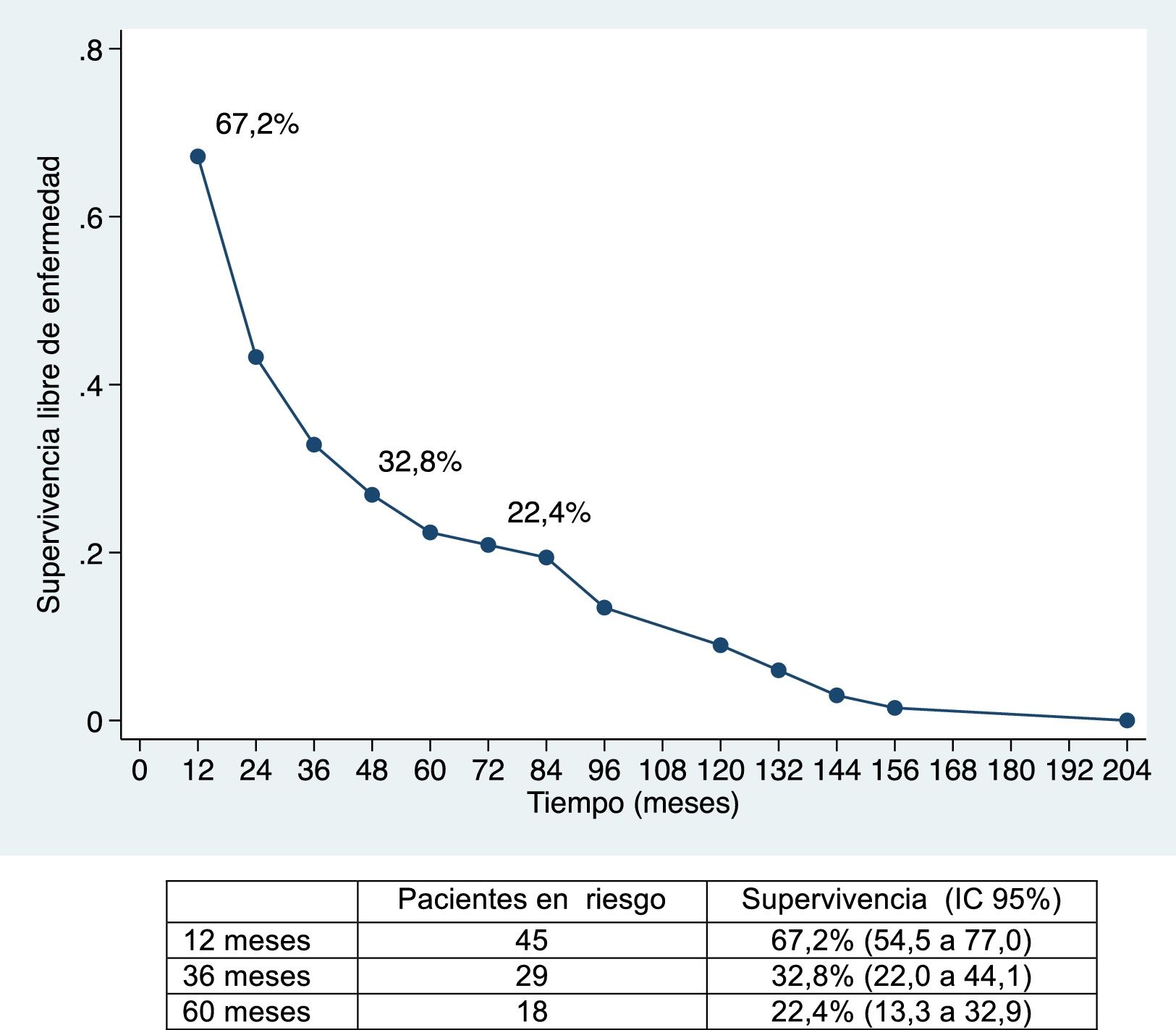
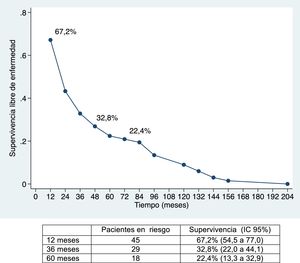
La mediana de supervivencia libre de enfermedad ha sido de 24,7 meses (IC 95%: 15,6-88,9 meses), del 67,2%; 32,8% y 22,4% a 12, 36 y 60 meses, respectivamente (figs. 1 y 2).
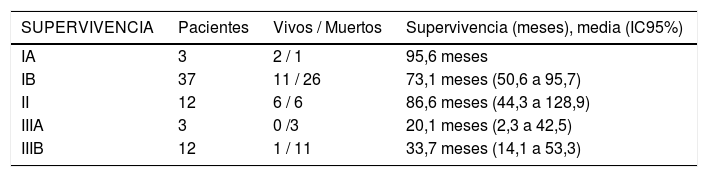
En cuanto al estadio tumoral se aprecia una mayor supervivencia global en los estadios IA, IB y II (95,6, 73,1 y 86,6 meses), diferencias estas estadísticamente significativas (p = 0,046). Del mismo modo, se aprecia una mayor supervivencia libre de enfermedad en los estadios IA y IB (72,5 y 111 meses), con diferencias también significativas (p = 0,024) (tabla 4).
factores de riesgo de supervivencia y recidiva según estadio
| SUPERVIVENCIA | Pacientes | Vivos / Muertos | Supervivencia (meses), media (IC95%) |
|---|---|---|---|
| IA | 3 | 2 / 1 | 95,6 meses |
| IB | 37 | 11 / 26 | 73,1 meses (50,6 a 95,7) |
| II | 12 | 6 / 6 | 86,6 meses (44,3 a 128,9) |
| IIIA | 3 | 0 /3 | 20,1 meses (2,3 a 42,5) |
| IIIB | 12 | 1 / 11 | 33,7 meses (14,1 a 53,3) |
| RECIDIVA | Pacientes | Recidivas / No recidivas | Supervivencia (meses), media (IC95%) |
|---|---|---|---|
| IA | 3 | 1 / 2 | 72,5 meses (40,5 a 104,5) |
| IB | 37 | 17 / 20 | 111,1 meses (79,8 a 142,3) |
| II | 12 | 8 / 4 | 42,4 meses (20,4 a 64,4) |
| IIIA | 3 | 3 /0 | 17,9 meses (4,0 a 39,7) |
| IIIB | 12 | 10 / 2 | 24,8 meses (3,8 a 45,9) |
De los 20pacientes vivos en el momento del análisis, 18 están libres de enfermedad. Han muerto en el seguimiento 47, 37 por recidiva del colangiocarcinoma y otros 10 por otras causas, sin evidencia de recidiva.
DiscusiónEl colangiocarcinoma intrahepático es una neoplasia primaria hepática de mal pronóstico. El único tratamiento potencialmente curativo es la resección quirúrgica completa. La mejoría de las técnicas quirúrgicas y el manejo postoperatorio han ayudado a disminuir la morbimortalidad de la intervención.
El objetivo principal de este estudio ha sido observar la influencia de diferentes factores, considerados de mal pronóstico en anteriores publicaciones, en la recidiva y en la supervivencia de los pacientes.
La supervivencia global ha sido del 91%; 49,2% y 39,8% a los 12, 36 y 60 meses, respectivamente, y la supervivencia libre de enfermedad del 67,2%; 32,8% y 22,4%, y es comparable e incluso ligeramente superior, a largo plazo, a la obtenida en otras publicaciones11-14. La mediana de supervivencia libre de enfermedad ha sido de 26,5 meses, similar a la del estudio de Endo et al.13.
La morbilidad postoperatoria, en forma de reintervención quirúrgica, ha demostrado influir en la supervivencia y en la recidiva como variable independiente. En cuanto a las variables anatomopatológicas, el tamaño tumoral, el número de tumores (multifocalidad), la diferenciación tumoral, la invasión vascular y la invasión perineural son los aspectos condicionantes del pronóstico de los pacientes. El tamaño tumoral > 5cm, que había resultado determinante en otras publicaciones13,15, no ha mostrado significación estadística en este estudio, como tampoco lo ha hecho la invasión perineural. La multifocalidad, en nuestra serie tan solo en un 8,95% de los caso, tampoco ha demostrado diferencias significativas, a diferencia del trabajo de Endo et al.13. En cambio, la invasión vascular ha resultado ser el factor de riesgo de mayor importancia por lo que respecta a la supervivencia, puesto que ha sido el único que, en el análisis multivariante, ha logrado un valor estadísticamente significativo.
La quimioterapia adyuvante se indica en pacientes que presentan factores de mal pronóstico, como son las adenopatías positivas, la invasión de los márgenes quirúrgicos o la multifocalidad. En este estudio la quimioterapia se ha mostrado como variable que influye negativamente en la supervivencia y en la recidiva, hecho que se explicaría debido a la presentación de otros factores que confieren un mal pronóstico, si bien los pocos casos de esta serie y la heterogeneidad del tratamiento no permiten sacar conclusiones. Aun así, cabe esperar que en el futuro la quimioterapia adyuvante aumente la supervivencia del colangiocarcinoma intrahepático resecado, indicándola en los tumores que presentan factores de alto riesgo de recurrencia16. Por otro lado, estudios recientes han relacionado el colangiocarcinoma intrahepático con varias mutaciones genéticas y cambios moleculares que hacen pensar que en un futuro próximo la inmunoterapia y los tratamientos dirigidos contra estas mutaciones adquirirán relevancia de cara al abordaje terapéutico de esta neoplasia17,18.
En cuanto al diagnóstico preoperatorio y la necesidad de biopsia diagnóstica, es aconsejable seguir las últimas guías clínicas de la National Comprehensive Cancer Network (NCCN)19. Respecto a la necesidad de linfadenectomía sistemática en la cirugía del colangiocarcinoma intrahepático, su indicación ha evolucionado a lo largo del tiempo. Algunos autores, hace una década, recomendaban la necesidad de linfadenectomía sistemática para estadificar adecuadamente a los pacientes20. Otros autores no han podido demostrar su beneficio, ya que la supervivencia era similar con o sin linfadenectomía21,22. En nuestra serie se aplicó a un tercio de los pacientes y ello se acompañó de una mayor morbilidad, lo que puede influir en la determinación de efectuar la linfadenectomía sistemáticamente, pero las guías de la NCCN aconsejan considerar la linfadenectomía del hilio hepático para mejor estadificación19.
Entre las limitaciones de este estudio destaca que la recogida de datos ha sido dificultosa, sobre todo en el periodo inicial. Por otra parte, hay que ser cautos en la interpretación de ciertos resultados, teniendo en cuenta que en algunos apartados como en los estadios IA y IIIA hay tan solo 3 casos. Se ha llevado a cabo una revisión exhaustiva de los datos quirúrgicos y de todas las piezas de resección y se ha actualizado la clasificación. Por otro lado, no se han recogido los pacientes diagnosticados de colangiocarcinoma intrahepático considerados irresecables o con comorbilidades que contraindicaban la intervención quirúrgica. Esta información habría permitido conocer la evolución de la incidencia del colangiocarcinoma intrahepático, así como también el índice de resecabilidad de esta enfermedad en nuestro medio, como muestran otros autores en sus publicaciones23,24.
En cuanto a perspectivas de futuro, aparte de la inmunoterapia y la terapia dirigida contra las mutaciones, hay diversos aspectos que tener en cuenta: la posibilidad de trasplante hepático en casos seleccionados de tumores pequeños y bien diferenciados y la mejoría de los resultados de la quimioterapia neoadyuvante con los ensayos en marcha25.
Como conclusiones, en relación con el tratamiento quirúrgico del colangiocarcinoma intrahepático, la linfadenectomía ha comportado mayor morbilidad y la afectación vascular en el estudio anatomopatológico ha sido el factor de riesgo más importante en cuanto a la supervivencia.
Conflicto de interesesLos autores declaran no tener conflicto de intereses
Los autores agradecen al señor Antoni Molera Espelt su colaboración en la recogida y actualización de datos.