La quimioembolización transarterial (QETA) es considerada una opción terapéutica utilizada en el tratamiento del carcinoma hepatocelular y de las metástasis hepáticas secundarias del carcinoma colorrectal, tumores neuroendocrinos y melanoma ocular. Aunque es un procedimiento seguro, no está exento de complicaciones, siendo la más frecuente la colecistitis aguda. Otras complicaciones descritas son el tromboembolismo pulmonar, el absceso hepático, lesiones de la mucosa gastrointestinal, lesiones de la vía biliar, etc. El objetivo principal del estudio es revisar y describir las complicaciones derivadas de la QETA en el tratamiento de los tumores hepáticos.
MétodosSe ha realizado un análisis retrospectivo de todas las QETA practicadas en nuestro centro entre enero de 2013 y diciembre de 2016. En dicho periodo se realizaron 322 QETA en 196 pacientes.
ResultadosDel total de procedimientos, 258 (80%) fueron realizados en hombres y 64 (20%) en mujeres. Además, la edad media de los pacientes fue de 66,5años. Las complicaciones mayores derivadas de la QETA fueron descompensación edemo-ascítica (6casos), colecistitis aguda (4), pancreatitis aguda (3), rotura hepática (1), absceso hepático (1) y deterioro de la función renal (1). Además, el síndrome postembolización se objetivó en 71 (22%) casos. En el análisis multivariante se observó que el antecedente cardiovascular (OR: 4,5; IC95%: 1,2-17; p=0,025) es un factor de riesgo para el desarrollo de complicaciones post-QETA.
ConclusionesLas complicaciones derivadas de la QETA son poco frecuentes y con una baja incidencia de mortalidad.
Transarterial chemoembolization (TACE) is considered a therapeutic option. It is mostly used in hepatocellular carcinoma or liver colorectal, neuroendocrine or melanoma metastases. Although it is considered a safe procedure, TACE presents complications, such as acute cholecystitis, which is the most common. Other procedure-related complications include pulmonary embolism, hepatic abscess, bile duct injury, gastric mucosa injury and, less frequently, acute pancreatitis. The aim of this study is to review the complications following TACE for liver tumors.
MethodsWe performed a retrospective study including all the TACE procedures performed in a single center during the period between January 2013 and December 2016.
ResultsOut of the 196 patients with liver tumors who had undergone 322 TACE, 258 (80%) were male and 64 (20%) were female. Mean patient age was 66.5years. Major complications after chemoembolization included: decompensation with edema/ascites (6patients), acute cholecystitis (4), acute pancreatitis (3), liver rupture (1), liver abscess (1) and renal failure (1). Postembolization syndrome appeared in 71 (20%) patients. On multivariate analysis, it was observed that concomitant cardiovascular disease (OR: 4.5; 95%CI: 1.2-17; P=.025) is a risk factor for the development of complications.
ConclusionsTACE is a safe and effective procedure for liver tumor treatment. The majority of the complications are rare and present a low incidence of mortality.
La quimioembolización transarterial (QETA) es considerada una opción terapéutica utilizada comúnmente en el tratamiento del carcinoma hepatocelular (CHC) primario y de las metástasis hepáticas secundarias del carcinoma colorrectal, tumores neuroendocrinos y melanoma ocular1-3. Asimismo, se puede utilizar como tratamiento adyuvante antes o después de una resección quirúrgica o como terapia puente antes de un trasplante hepático.
Las diversas técnicas de QETA comprenden una cateterización selectiva o supraselectiva y el uso de diferentes agentes quimioterapéuticos y de embolización que pueden influir en el resultado4. En los últimos años se han desarrollado microesferas sintéticas calibradas que se cargan con el agente quimioterápico. Estas permiten liberar el fármaco de una manera más uniforme y prolongada en el tiempo, consiguiendo elevadas concentraciones del agente quimioterápico en la célula tumoral, reduciendo su paso a la circulación sistémica y por tanto minimizando los efectos secundarios4,5. Esta técnica se conoce con el nombre de DEB QETA (del inglés Drug Eluting Beads) para diferenciarla de la QETA convencional (QETAc), en la que se administra el agente quimioterápico junto con el lipiodol y posteriormente el material de oclusión. Por otro lado, se ha evaluado la seguridad de ambos tratamientos y se ha visto que no hay diferencias en su perfil de seguridad. Además, no aumenta la supervivencia ni disminuye la recurrencia local6, y la incidencia de efectos adversos dentro de los primeros 30días es similar7, aunque parece que la DEB se tolera mejor.
Aunque la QETA es considerada un procedimiento seguro, no está exenta de complicaciones, siendo las más frecuentes la colecistitis aguda y la leucopenia8. Otras complicaciones descritas son el tromboembolismo pulmonar, la isquemia hepática, el absceso hepático, lesiones de la vía biliar y, con menor frecuencia, la pancreatitis aguda9-11.
El objetivo principal del estudio es revisar y describir las complicaciones derivadas de la realización de una QETA en el tratamiento de los tumores hepáticos (primarios o metastásicos). Asimismo, los objetivos secundarios son describir las características epidemiológicas, clínicas y analíticas de los pacientes que recibieron dicho procedimiento.
MétodosPresentamos un análisis retrospectivo de todas las QETA realizadas en nuestro centro entre enero de 2013 y diciembre de 2016. En dicho periodo se realizaron 322 QETA en 196 pacientes.
Los datos demográficos, clínicos, analíticos, radiológicos y el tratamiento fueron extraídos de la historia clínica electrónica del hospital. Asimismo, registramos la comorbilidad asociada de cada paciente: cardiovascular (hipertensión arterial, cardiopatía, valvulopatía o arteriopatía periférica), pulmonar y renal. Las pruebas de laboratorio incluyeron hemograma, coagulación, pruebas de función hepática y renal, alfa-fetoproteína (AFP) sérica y marcadores virales para la hepatitisB yC. Además, se analizaron los hallazgos de la tomografía computarizada (TAC) y la resonancia magnética (RMN).
Todos los casos fueron presentados en un comité multidisciplinario (oncólogo, radiólogo diagnóstico e intervencionista, cirujano y hepatólogo), donde se discutió la indicación de QETA en cada paciente siguiendo las guías clínicas de Barcelona (BCLC) para los casos de CHC12,13. Además, el diagnóstico de CHC primario se basó en los criterios de la Asociación Europea para el Estudio del Hígado (EASL)14. En los pacientes con colangiocarcinoma intrahepático (CCi) y metástasis hepática se planteó una QETA paliativa. Las contraindicaciones absolutas para la realización del procedimiento fueron: cirrosis descompensada (Child-Pugh B>8), ictericia, encefalopatía y ascitis refractaria o síndrome hepatorrenal; obstrucción severa del flujo portal; tumor que invade ambos lóbulos; trombosis tumoral de la vena porta; shunt arteriovenoso evidente y deterioro de la función renal (creatinina ≥2mg/dl o aclaramiento <30ml/min).
Todos los procedimientos fueron realizados por radiólogos intervencionistas con experiencia similar, utilizando como soporte de imagen el Dyna-CT. Mediante la técnica de Seldinger se puncionó la arteria femoral y posteriormente se realizó una angiografía de la arteria mesentérica superior y de la arteria hepática derecha e izquierda para determinar la arteria principal que irriga y nutre al tumor. Después de la cateterización selectiva o supraselectiva, se realizó la quimioembolización con una mezcla de doxorubicina hidrocloruro (Laboratorio Accord Healthcare) y lipiodol (Laboratorio Guerbet) para los casos con CHC y CCi, e irinotecán para los casos de metástasis. Además, en algunos casos se utilizaron partículas liberadoras de fármaco (DEB: Drug Eluting Beads) (HepaSphere®), prefiriéndose su uso en tumores multilobares, aunque la decisión de usar o no las microesferas fue realizada por los radiólogos intervencionistas.
En todos los pacientes se realizó una TAC abdominal de control a las 4-6semanas después del procedimiento para valorar la respuesta, basándose en los criterios modificados de Response Evaluation Criteria In Solid Tumors (RECIST)15,16. Asimismo, la decisión de repetir el procedimiento o realizar otra prueba de imagen a los 3meses se realizó a demanda, en función de los resultados de la TAC, con un intervalo mínimo de 2-3meses entre las QETA. Además, se registraron todos los efectos adversos que se produjeron dentro de las primeras 6semanas tras el procedimiento. Los efectos adversos fueron agrupados según la clasificación de The National Cancer Institute Common Terminology Criteria for Adverse Events (CTCAE): grado1 o leve (asintomáticos o síntomas leves), grado2 o moderado, grado3 o severo (no ponen en riesgo la vida pero prolongan la hospitalización), grado4 (ponen en peligro la vida) y grado5 (muerte)17.
Por otro lado, para facilitar el análisis de las complicaciones, las hemos dividido en menores y mayores, considerando que las menores merman la calidad de recuperación y prolongan la estancia hospitalaria, y las mayores, además, amenazan la vida del paciente.
Análisis estadísticoLas variables categóricas se han expresado según frecuencias, mientras que las cuantitativas se han expresado por la media y la desviación estándar. Se realizó análisis multivariante mediante regresión logística binaria para evaluar el riesgo de desarrollar complicaciones. El modelo final fue descrito a través del odds ratio, aportando su intervalo de confianza al 95% junto al valor de p. Una p≤0,05 fue considerada estadísticamente significativa. El análisis de datos se llevó a cabo mediante el programa estadístico SPSS versión 20.0.
ResultadosDel total de procedimientos, 258 (80%) fueron realizados en hombres y 64 (20%) en mujeres. La edad media de los pacientes fue de 66,5años y el tamaño medio de los tumores hepáticos fue de 31,6mm.
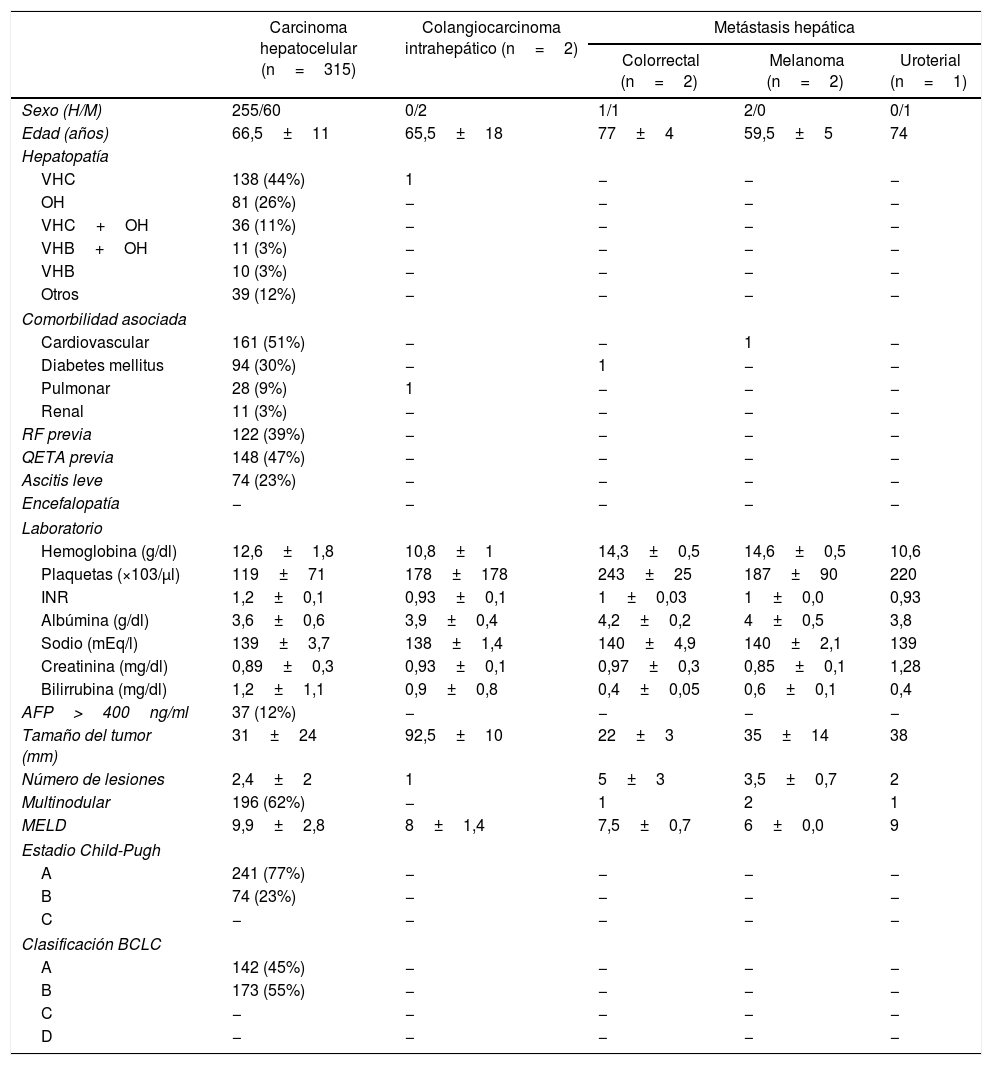
El diagnóstico principal para la realización de una QETA fue el CHC primario, representando el 97,8% (315casos); otras causas fueron las metástasis hepáticas y el CCi. Todos los pacientes con CHC tenían una hepatopatía crónica, siendo la principal etiología el virus de la hepatitisC (44%) y el alcohol (26%). Los principales antecedentes de comorbilidad asociada fueron los cardiovasculares (50%) y la diabetes (30%) (tabla 1).
Características epidemiológicas, clínicas, analíticas y radiológicas de los pacientes tratados con quimioembolización transarterial
| Carcinoma hepatocelular (n=315) | Colangiocarcinoma intrahepático (n=2) | Metástasis hepática | |||
|---|---|---|---|---|---|
| Colorrectal (n=2) | Melanoma (n=2) | Uroterial (n=1) | |||
| Sexo (H/M) | 255/60 | 0/2 | 1/1 | 2/0 | 0/1 |
| Edad (años) | 66,5±11 | 65,5±18 | 77±4 | 59,5±5 | 74 |
| Hepatopatía | |||||
| VHC | 138 (44%) | 1 | − | − | − |
| OH | 81 (26%) | − | − | − | − |
| VHC+OH | 36 (11%) | − | − | − | − |
| VHB+OH | 11 (3%) | − | − | − | − |
| VHB | 10 (3%) | − | − | − | − |
| Otros | 39 (12%) | − | − | − | − |
| Comorbilidad asociada | |||||
| Cardiovascular | 161 (51%) | − | − | 1 | − |
| Diabetes mellitus | 94 (30%) | − | 1 | − | − |
| Pulmonar | 28 (9%) | 1 | − | − | − |
| Renal | 11 (3%) | − | − | − | − |
| RF previa | 122 (39%) | − | − | − | − |
| QETA previa | 148 (47%) | − | − | − | − |
| Ascitis leve | 74 (23%) | − | − | − | − |
| Encefalopatía | − | − | − | − | − |
| Laboratorio | |||||
| Hemoglobina (g/dl) | 12,6±1,8 | 10,8±1 | 14,3±0,5 | 14,6±0,5 | 10,6 |
| Plaquetas (×103/μl) | 119±71 | 178±178 | 243±25 | 187±90 | 220 |
| INR | 1,2±0,1 | 0,93±0,1 | 1±0,03 | 1±0,0 | 0,93 |
| Albúmina (g/dl) | 3,6±0,6 | 3,9±0,4 | 4,2±0,2 | 4±0,5 | 3,8 |
| Sodio (mEq/l) | 139±3,7 | 138±1,4 | 140±4,9 | 140±2,1 | 139 |
| Creatinina (mg/dl) | 0,89±0,3 | 0,93±0,1 | 0,97±0,3 | 0,85±0,1 | 1,28 |
| Bilirrubina (mg/dl) | 1,2±1,1 | 0,9±0,8 | 0,4±0,05 | 0,6±0,1 | 0,4 |
| AFP>400ng/ml | 37 (12%) | − | − | − | − |
| Tamaño del tumor (mm) | 31±24 | 92,5±10 | 22±3 | 35±14 | 38 |
| Número de lesiones | 2,4±2 | 1 | 5±3 | 3,5±0,7 | 2 |
| Multinodular | 196 (62%) | − | 1 | 2 | 1 |
| MELD | 9,9±2,8 | 8±1,4 | 7,5±0,7 | 6±0,0 | 9 |
| Estadio Child-Pugh | |||||
| A | 241 (77%) | − | − | − | − |
| B | 74 (23%) | − | − | − | − |
| C | − | − | − | − | − |
| Clasificación BCLC | |||||
| A | 142 (45%) | − | − | − | − |
| B | 173 (55%) | − | − | − | − |
| C | − | − | − | − | − |
| D | − | − | − | − | − |
AFP: alfa-fetoproteína; BCLC: Barcelona Clinic Liver Cancer; H: hombre; M: mujer; MELD: Model for End-stage Liver Disease; OH: alcohol; RF: radiofrecuencia; VHB: virus de la hepatitisB; VHC: virus de la hepatitisC.
En 148 (46%) casos se realizó una quimioembolización anterior. Además, 201 (62%) casos presentaron más de una lesión hepática. La AFP media fue de 795ng/ml y solo en 37 (11%) casos se objetivó una AFP ≥400ng/ml. Asimismo, en los paciente con estadioA (BCLC) la indicación de la QETA fue una terapia puente al trasplante hepático.
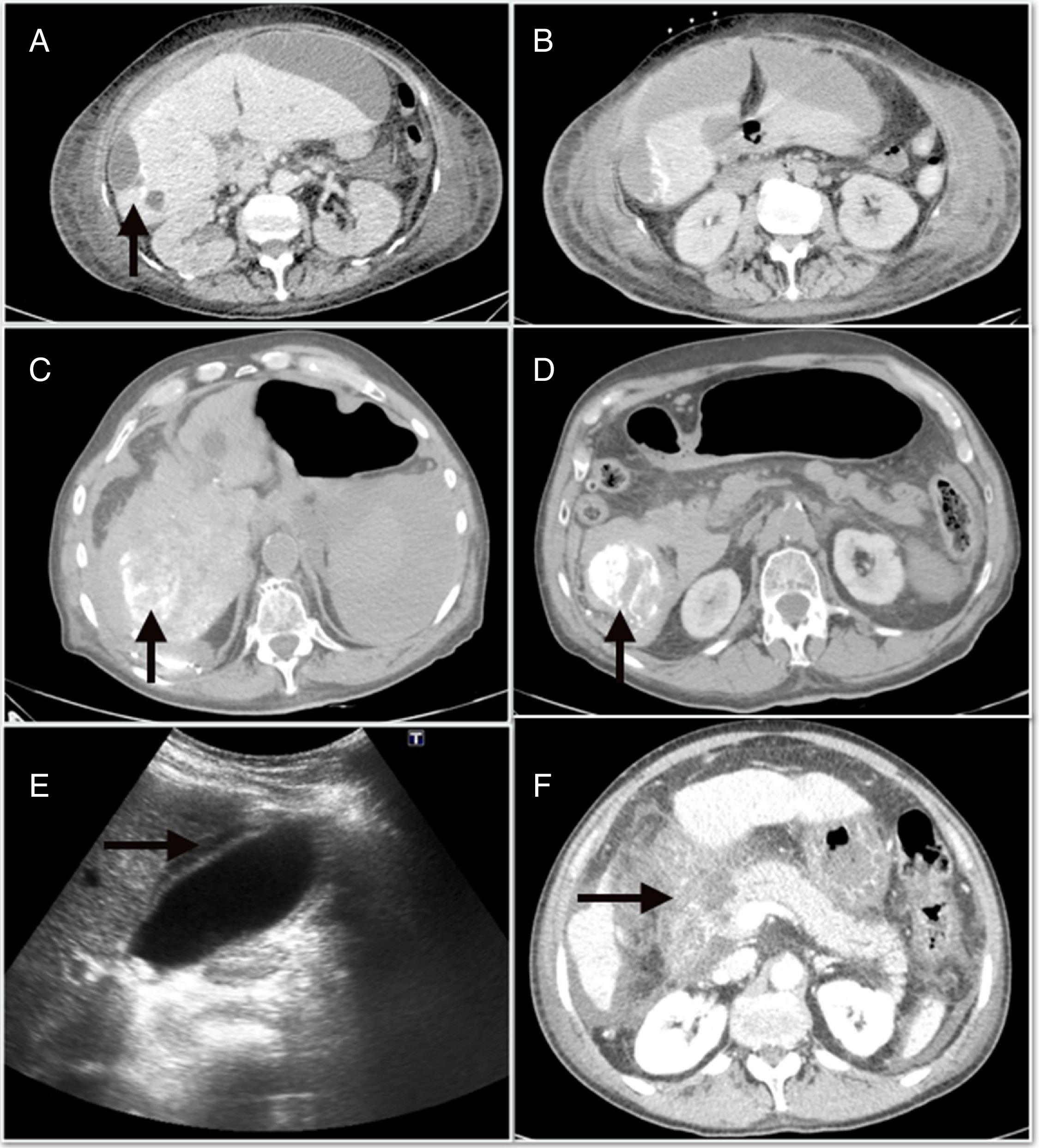
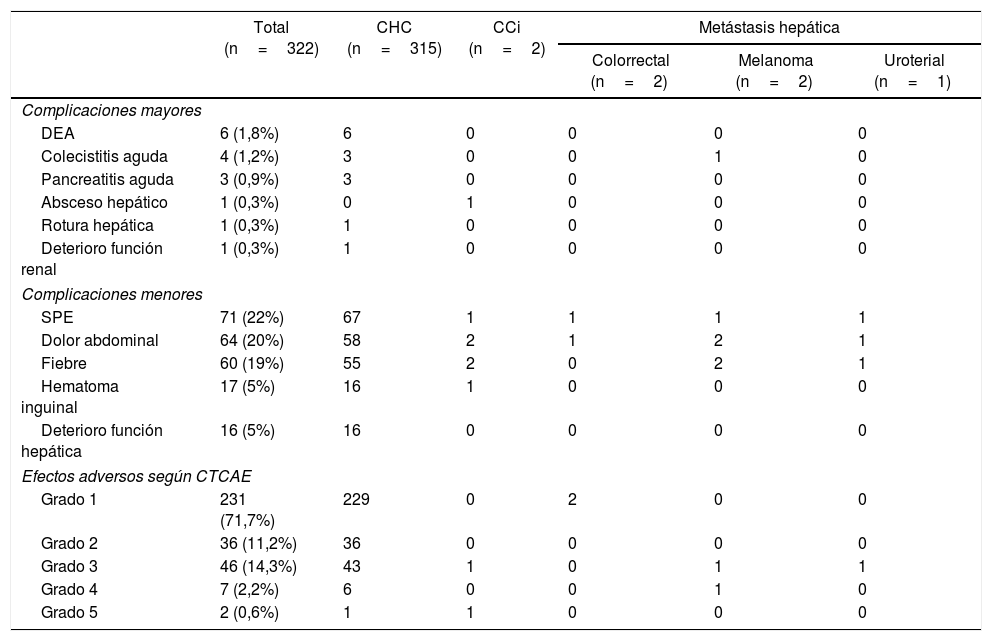
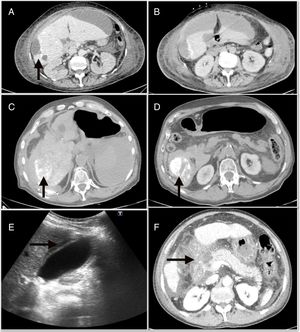
Las complicaciones mayores derivadas de la QETA tuvieron una incidencia del 4,9%, y fueron principalmente la descompensación edemo-ascítica6, la colecistitis aguda4 y la pancreatitis aguda3. En la figura 1 se muestran algunas de las complicaciones mayores, como el absceso hepático, el hemoperitoneo y la pancreatitis. Además, dentro de las complicaciones menores, el síndrome postembolización (SPE) se objetivó en 71 (22%) casos. Por otro lado, al analizar los efectos adversos, el 71,7% de los pacientes estaban asintomáticos o tenían síntomas leves (tabla 2)
A)absceso hepático posquimioembolización. B)Colección perihepática subcapsular que se continúa con la lesión periférica del segmento 6. C)Hemoperitoneo que ocupa predominantemente el flanco derecho. D)Focos de lipiodol extravasado hacia la cavidad abdominal. E)Ecografía abdominal con signos de colecistitis aguda. F)Necrosis extensa de la cabeza pancreática asociada a necrosis de la grasa peripancreática y de la raíz del mesenterio.
Incidencia de complicaciones y efectos adversos asociados a la quimioembolización transarterial
| Total (n=322) | CHC (n=315) | CCi (n=2) | Metástasis hepática | |||
|---|---|---|---|---|---|---|
| Colorrectal (n=2) | Melanoma (n=2) | Uroterial (n=1) | ||||
| Complicaciones mayores | ||||||
| DEA | 6 (1,8%) | 6 | 0 | 0 | 0 | 0 |
| Colecistitis aguda | 4 (1,2%) | 3 | 0 | 0 | 1 | 0 |
| Pancreatitis aguda | 3 (0,9%) | 3 | 0 | 0 | 0 | 0 |
| Absceso hepático | 1 (0,3%) | 0 | 1 | 0 | 0 | 0 |
| Rotura hepática | 1 (0,3%) | 1 | 0 | 0 | 0 | 0 |
| Deterioro función renal | 1 (0,3%) | 1 | 0 | 0 | 0 | 0 |
| Complicaciones menores | ||||||
| SPE | 71 (22%) | 67 | 1 | 1 | 1 | 1 |
| Dolor abdominal | 64 (20%) | 58 | 2 | 1 | 2 | 1 |
| Fiebre | 60 (19%) | 55 | 2 | 0 | 2 | 1 |
| Hematoma inguinal | 17 (5%) | 16 | 1 | 0 | 0 | 0 |
| Deterioro función hepática | 16 (5%) | 16 | 0 | 0 | 0 | 0 |
| Efectos adversos según CTCAE | ||||||
| Grado 1 | 231 (71,7%) | 229 | 0 | 2 | 0 | 0 |
| Grado 2 | 36 (11,2%) | 36 | 0 | 0 | 0 | 0 |
| Grado 3 | 46 (14,3%) | 43 | 1 | 0 | 1 | 1 |
| Grado 4 | 7 (2,2%) | 6 | 0 | 0 | 1 | 0 |
| Grado 5 | 2 (0,6%) | 1 | 1 | 0 | 0 | 0 |
CCi: colangiocarcinoma intrahepático; CHC: carcinoma hepatocelular; CTCAE: The National Cancer Institute Common Terminology Criteria for Adverse Events; DEA: descompensación edemo-ascítica; SPE: síndrome postembolización,
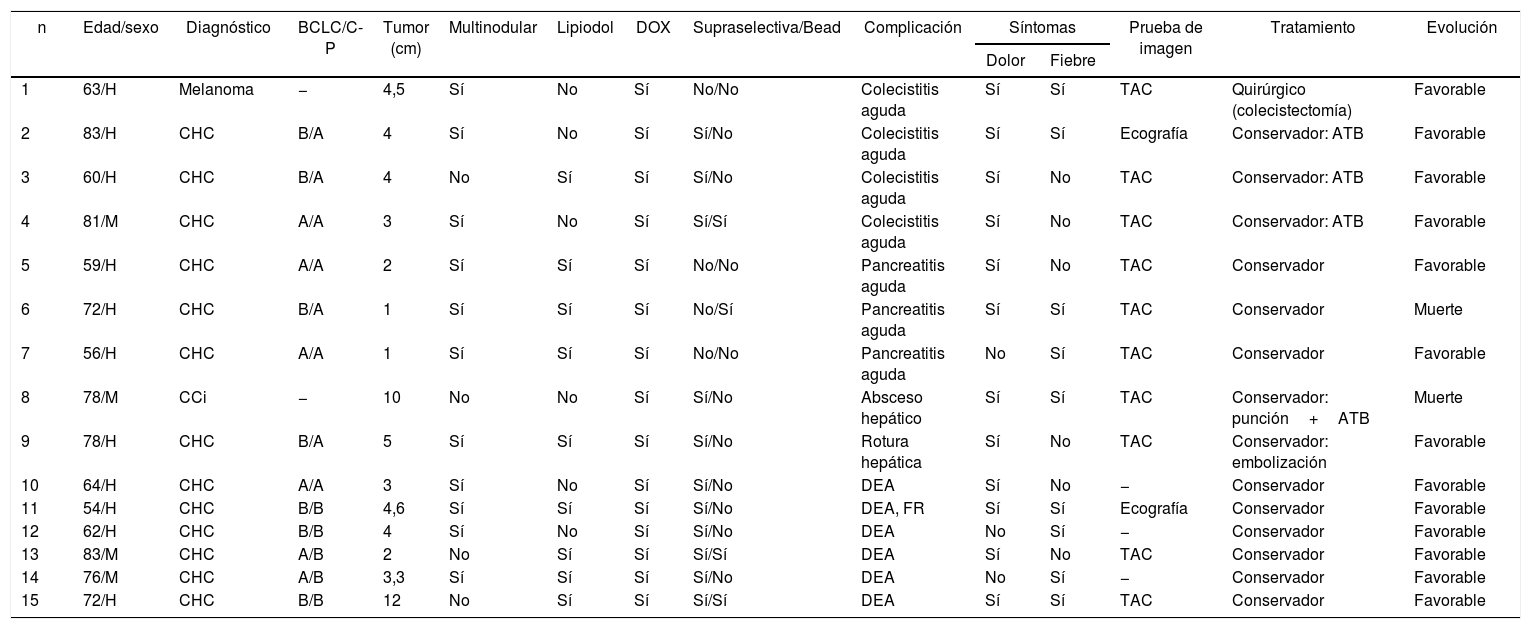
En la tabla 3 se describen los 15 pacientes que presentaron alguna complicación mayor derivada del procedimiento, realizándose en 14 (93%) pacientes un manejo conservador. Solo en un paciente con diagnóstico de colecistitis se realizó un tratamiento quirúrgico (colecistectomía). Por otro lado, la mortalidad relacionada con el procedimiento se objetivó en 2 (0,6%) casos. Asimismo, al realizar el análisis multivariante se observó que el antecedente cardiovascular (OR: 4,5; IC95%: 1,2-17; p=0,025) es un factor de riesgo para el desarrollo de complicaciones post-QETA.
Características de los pacientes que desarrollaron complicaciones mayores posquimioembolización transarterial
| n | Edad/sexo | Diagnóstico | BCLC/C-P | Tumor (cm) | Multinodular | Lipiodol | DOX | Supraselectiva/Bead | Complicación | Síntomas | Prueba de imagen | Tratamiento | Evolución | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dolor | Fiebre | |||||||||||||
| 1 | 63/H | Melanoma | − | 4,5 | Sí | No | Sí | No/No | Colecistitis aguda | Sí | Sí | TAC | Quirúrgico (colecistectomía) | Favorable |
| 2 | 83/H | CHC | B/A | 4 | Sí | No | Sí | Sí/No | Colecistitis aguda | Sí | Sí | Ecografía | Conservador: ATB | Favorable |
| 3 | 60/H | CHC | B/A | 4 | No | Sí | Sí | Sí/No | Colecistitis aguda | Sí | No | TAC | Conservador: ATB | Favorable |
| 4 | 81/M | CHC | A/A | 3 | Sí | No | Sí | Sí/Sí | Colecistitis aguda | Sí | No | TAC | Conservador: ATB | Favorable |
| 5 | 59/H | CHC | A/A | 2 | Sí | Sí | Sí | No/No | Pancreatitis aguda | Sí | No | TAC | Conservador | Favorable |
| 6 | 72/H | CHC | B/A | 1 | Sí | Sí | Sí | No/Sí | Pancreatitis aguda | Sí | Sí | TAC | Conservador | Muerte |
| 7 | 56/H | CHC | A/A | 1 | Sí | Sí | Sí | No/No | Pancreatitis aguda | No | Sí | TAC | Conservador | Favorable |
| 8 | 78/M | CCi | − | 10 | No | No | Sí | Sí/No | Absceso hepático | Sí | Sí | TAC | Conservador: punción+ATB | Muerte |
| 9 | 78/H | CHC | B/A | 5 | Sí | Sí | Sí | Sí/No | Rotura hepática | Sí | No | TAC | Conservador: embolización | Favorable |
| 10 | 64/H | CHC | A/A | 3 | Sí | No | Sí | Sí/No | DEA | Sí | No | − | Conservador | Favorable |
| 11 | 54/H | CHC | B/B | 4,6 | Sí | Sí | Sí | Sí/No | DEA, FR | Sí | Sí | Ecografía | Conservador | Favorable |
| 12 | 62/H | CHC | B/B | 4 | Sí | No | Sí | Sí/No | DEA | No | Sí | − | Conservador | Favorable |
| 13 | 83/M | CHC | A/B | 2 | No | Sí | Sí | Sí/Sí | DEA | Sí | No | TAC | Conservador | Favorable |
| 14 | 76/M | CHC | A/B | 3,3 | Sí | Sí | Sí | Sí/No | DEA | No | Sí | − | Conservador | Favorable |
| 15 | 72/H | CHC | B/B | 12 | No | Sí | Sí | Sí/Sí | DEA | Sí | Sí | TAC | Conservador | Favorable |
ATB: antibiótico; BCLC: Barcelona Clinic Liver Cancer; CCi: colangiocarcinoma intrahepático; CHC: carcinoma hepatocelular; C-P: Child-Pugh; DEA: descompensación edemo-ascítica; DOX: doxorubicina; FR: fracaso renal; H: hombre; M: mujer; TAC: tomografía abdominal.
La primera embolización fue descrita por Doyon et al.18 en 1974. Posteriormente, en 1983, Yamada et al.19 añadieron el uso de una esponja de gelatina y un agente quimioterapéutico, surgiendo de esta forma el concepto de quimioembolización transarterial. Los tumores hepáticos reciben el 90% de su aporte sanguíneo a través de la arteria hepática. Por tanto, la embolización provoca una necrosis isquémica del tumor causando un daño en los receptores de membrana de la célula tumoral, aumentando de esta forma la absorción del agente quimioterápico20.
Las indicaciones de la QETA, a nivel hepático, son en tumores hipervasculares, siendo su aplicación más frecuente en los CHC, CCi y metástasis hepáticas. Asimismo, tiene relevancia en casos de recurrencia de CHC posresección quirúrgica, como terapia puente hacia un trasplante hepático o como terapia neoadyuvante en pacientes con tumores potencialmente resecables, aunque en estos casos no se ha demostrado que aumente la supervivencia21,22.
En cuanto a otros tipos de tumores, también está descrito su uso en las metástasis colorrectales y de tumores neuroendocrinos3,5. Sin embargo, la naturaleza no hipervascular de las metástasis colorrectales limita la difusión de los agentes de quimioembolización. Por lo tanto, este tipo de tratamiento es usado como segunda línea después de la ausencia de respuesta a la quimioterapia, con una tasa de respuesta del 25%. En nuestro estudio se ha usado en 5 metástasis hepáticas: 2 de origen colorrectal, 2 de melanoma uveal y una de origen urotelial.
Las complicaciones de la QETA son raras, con una frecuencia inferior al 5%, cifra similar objetivada en nuestro estudio. Los principales factores de riesgo para su aparición son la obstrucción de la vena porta, el compromiso de la reserva funcional del hígado, la obstrucción biliar, la cirugía biliar previa, el exceso de inyección de lipiodol y la embolización no selectiva23.
El SPE es un tipo de complicación menor y patognomónico de la QETA. Puede aparecer inmediatamente después o en los 10días siguientes del procedimiento, prolongando el tiempo de hospitalización y limitando la aplicación de tratamientos adicionales24,25. Se presenta en forma de fiebre, dolor abdominal, náuseas y/o vómitos y elevación de los niveles de transaminasas. Los mecanismos subyacentes no están muy bien establecidos, y algunas de las hipótesis propuestas son la isquemia del parénquima hepático, la distensión de la cápsula de Glisson o la isquemia de la vesícula biliar por embolización de la arteria cística26.
Dentro de las complicaciones mayores, la más grave es el fallo hepático. Los factores predisponentes son la hiperbilirrubinemia, una cirrosis avanzada o la administración de elevadas dosis del agente quimioterápico27. En nuestra serie, dentro de las complicaciones mayores, destacan la descompensación edemo-ascítica (2,8%), seguida de la colecistitis aguda (1,5%), la pancreatitis aguda (0,9%) y el deterioro de la función renal (0,6%).
Dhamija et al.28 describieron una incidencia de complicaciones biliares del 1,9%, debido a la exclusiva vascularización de la vía biliar por parte de ramas de la arteria hepática. Ello puede ocasionar necrosis de la vía biliar, ectasia, formación de biliomas o estenosis. Entre los factores predisponentes se han descrito el tamaño tumoral, la existencia de dilatación de la vía biliar previa al procedimiento, la embolización proximal, el intervalo entre dos procedimientos menor de 3meses y la inyección de lipiodol con el agente quimioterápico. Por otro lado, Monier et al.29 observaron un aumento del daño de la vía biliar con el uso la QETA-DEB comparado con la QETAc. Este hallazgo es bastante controvertido teniendo en cuenta la existencia de varios estudios controlados aleatorizados donde se demuestra la seguridad con el uso de QETA-DEB comparado con la QETAc en pacientes con función hepática más comprometida. Sin embargo, dichos estudios no habían evaluado de forma objetiva la toxicidad locorregional. Además, los pacientes con cirrosis avanzada tienen menos riesgo de desarrollar toxicidad locorregional con la QETA-DEB debido a una hipertrofia gradual del plexo vascular peribiliar por hipertensión portal y vascularización colateral.
Otra complicación infrecuente y grave es la pancreatitis aguda, habiéndose postulado que la patogénesis reside en la regurgitación del material de quimioembolización a la arteria gastroduodenal provocando una isquemia pancreática30. La incidencia descrita en la literatura es de alrededor 1,5-2%31, y en nuestro estudio es del 0,9%.
Con relación al deterioro de la función renal —definido en nuestro estudio como un incremento repentino de la cifra de creatinina mayor del 50% respecto al nivel basal o una cifra mayor de 1,5mg/dl dentro de los primeros 7días después del procedimiento—, el mecanismo subyacente es la nefrotoxicidad por contraste, si bien es cierto que la tasa de deterioro renal es mayor en los pacientes con CHC que se someten a una QETA que otros sujetos a los que se les realiza otro procedimiento angiográfico32. El riesgo de fallo renal está relacionado con la dosis y el número de sesiones de QETA, pudiendo tener un efecto acumulativo sobre dicho riesgo.
Otras de las complicaciones descritas en nuestra serie son el absceso (0,6%) y la rotura hepática (0,6%). La incidencia del absceso hepático es similar a los casos descritos en la literatura. Los factores de riesgo asociados a esta complicación son las derivaciones biliodigestivas, la edad avanzada, la diabetes mellitus, el tamaño tumoral y la oclusión de la vena porta33. En la mayoría de los pacientes los abscesos se presentan como lesiones únicas (66,7%), y la prueba de imagen de elección es la TAC. En cuanto al tratamiento, en un metaanálisis se objetivó que los abscesos que miden menos de 5cm pueden ser subsidiarios de tratamiento antibiótico, siendo de elección el drenaje percutáneo o quirúrgico en los casos mayores de 5cm34.
Por otro lado, en nuestra serie solo hemos tenido un caso de rotura hepática (0,6%), similar a la serie de Tu et al.25. Los factores de riesgo para una rotura hepática son los tumores gigantes (>10cm), o tumores localizados en la superficie hepática. Se puede realizar un manejo conservador, complementando en ocasiones con otra embolización.
Otra complicación grave descrita, aunque no presente en nuestra serie, es el daño pulmonar agudo o el síndrome de distrés respiratorio causado por el material embolígeno que alcanza la vascularización pulmonar debido a un shunt arteriovenoso. Esta complicación es rara (0,05% de los casos)35.
Asimismo, en el análisis multivariante observamos que los antecedentes cardiovasculares son un factor de riesgo para el desarrollo de complicaciones. Este dato no aparece reflejado en otras publicaciones, por lo cual creemos que podría ser novedoso y punto de partida para futuros estudios. No obstante, los antecedentes cardiovasculares agrupan a un conjunto de patologías, por lo que sería interesante que en futuros estudios se analicen por separado. Otra limitación de este estudio es su naturaleza retrospectiva, lo cual puede afectar los resultados, debido a que no todas las complicaciones estén registradas o no fueron identificadas por parte de los médicos.
En conclusión, las complicaciones derivadas de la QETA son poco frecuentes, con una baja incidencia de mortalidad y resueltas mayoritariamente con tratamiento conservador. Además, la presencia de comorbilidad cardiovascular está asociada a un mayor riesgo de desarrollar complicaciones tras el procedimiento.
Conflicto de interesesLos autores declaran no tener conflicto de intereses económicos, personales o profesionales.