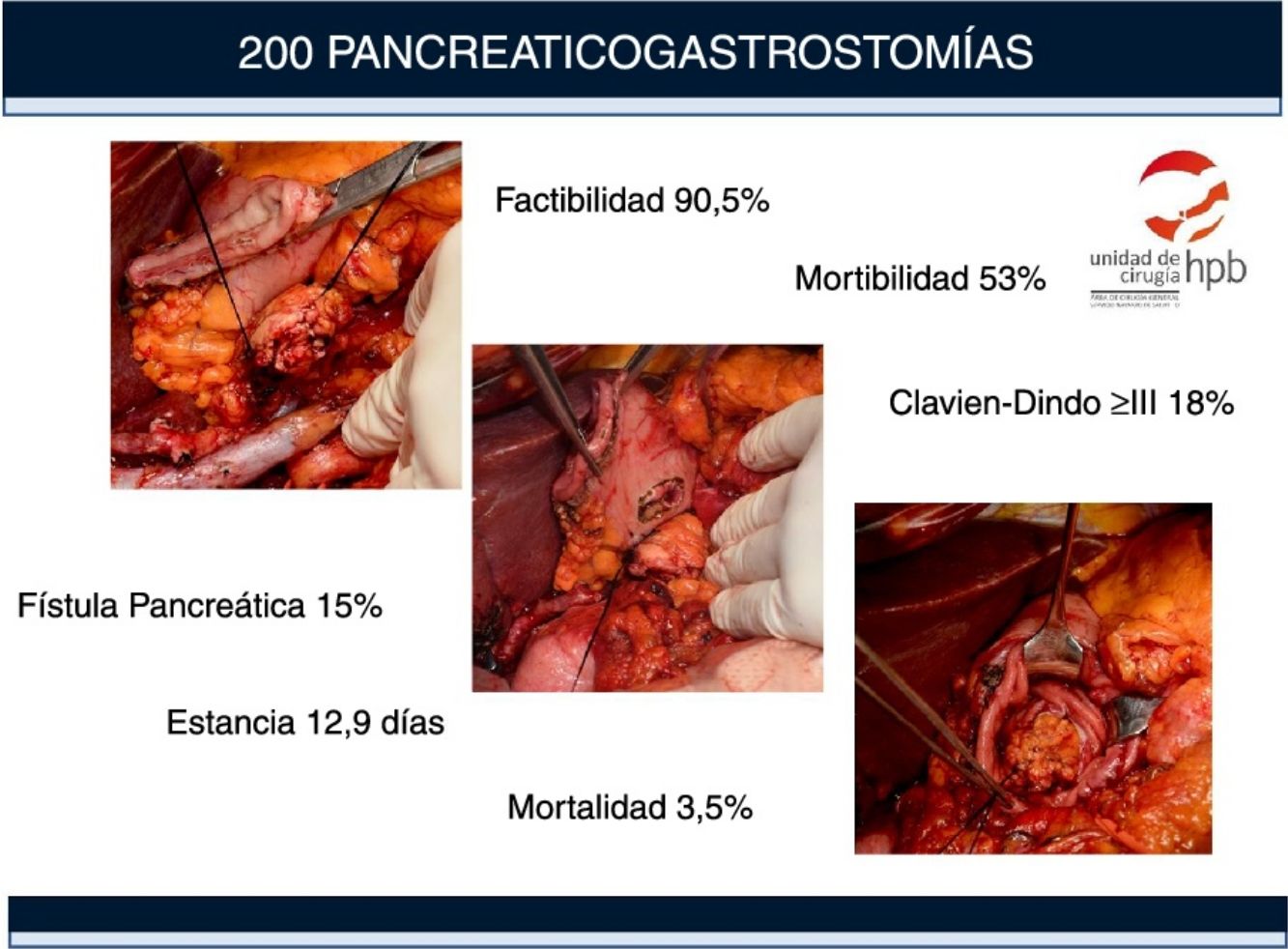
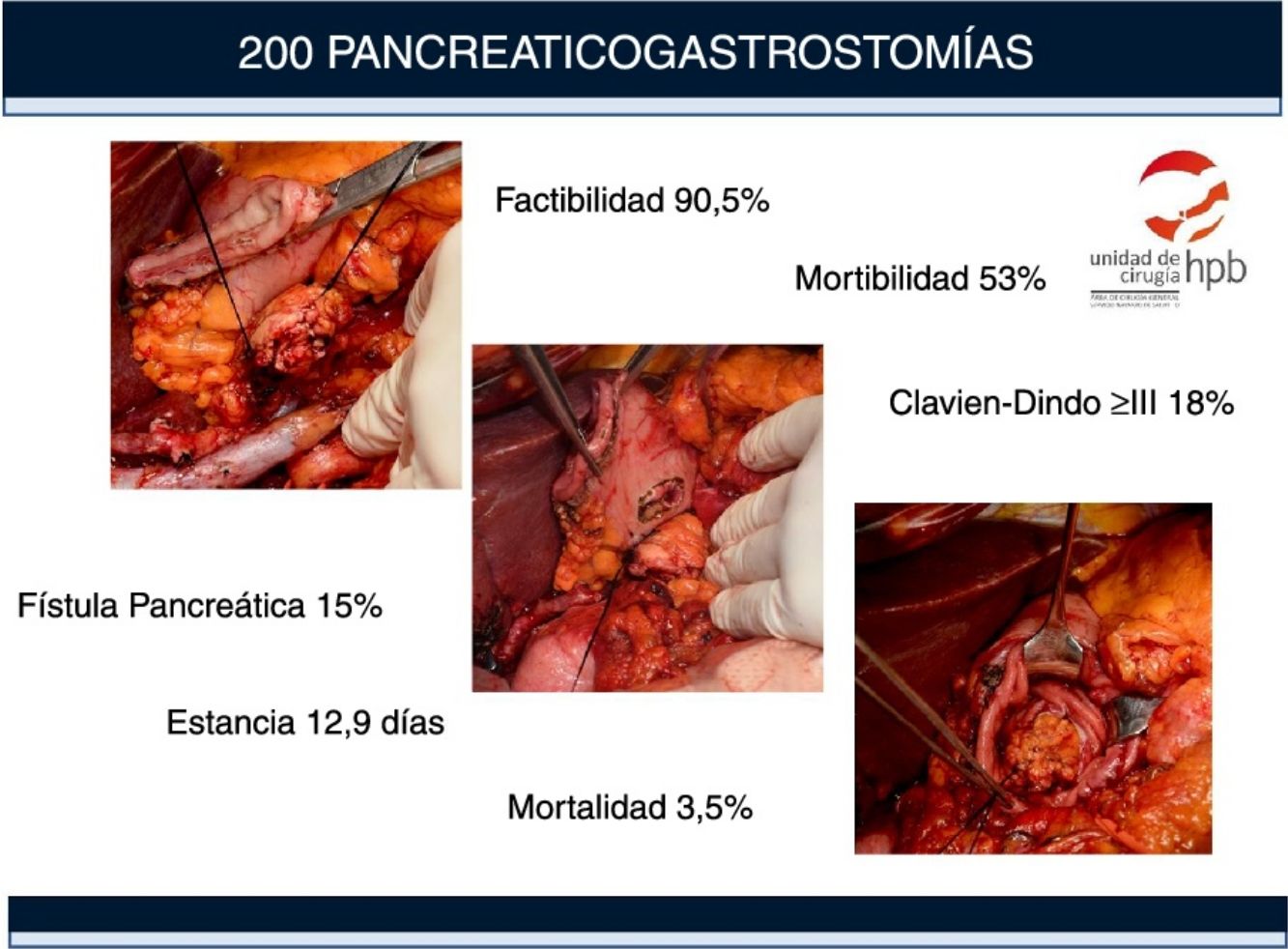
La mortalidad postoperatoria asociada a la duodenopancreatectomía (DP) en centros de alto volumen es inferior al 5%, sin embargo, las tasas de morbilidad oscilan entre el 45% y el 60%. Estudios recientes muestran una menor incidencia de complicaciones y fístula pancreática postoperatoria (POPF) con el uso de la pancreaticogastrostomía (PG). El objetivo de nuestro estudio es evaluar la incidencia y los factores predictivos de las complicaciones: POPF, hemorragia pospancreatectomía y retraso del vaciamiento gástrico según los criterios de las clasificaciones ISGPS y Clavien-Dindo.
Material y métodosEstudio prospectivo observacional en el que se incluyeron todos los pacientes sometidos a DP entre 2008 y 2016. La PG fue la técnica de elección en la reconstrucción de la DP.
ResultadosDoscientos cuarenta y nueve pacientes se sometieron a cirugía con la intención de realizar una DP. La viabilidad de PG fue del 90,5%. Ciento seis (53%) pacientes tuvieron complicaciones, 36 (18%) fueron graves (grado Clavien-Dindo ≥ III). La mortalidad a 90 días fue del 4%. El retraso del vaciamiento gástrico fue la complicación más frecuente (22,5%), seguida de la hemorragia pospancreatectomía (21%). La tasa clínica de POPF fue del 15% (6% grado Clavien-Dindo ≥ III). Los principales factores de riesgo asociados a las complicaciones fueron la edad > 70 años (1,9 [1-3,55]), el sexo masculino (1,89 [1; 3,6]) y la textura blanda del páncreas (3,38 [1,5; 7,37]).
ConclusionesEn nuestra experiencia la factibilidad de la PG fue del 90,5%. Los principales factores de riesgo asociados a las complicaciones fueron la edad > 70 años, el sexo masculino y la textura blanda del páncreas. La textura blanda del páncreas también está asociada al desarrollo y la gravedad de la POPF.
Postoperative mortality associated with pancreaticoduodenectomy (PD) in high-volume hospitals is below 5%, yet morbidity rates range between 45% and 60%. Recent studies show a lower incidence of complications and postoperative pancreatic fistula (POPF) in pancreaticogastrostomy (PG). The primary objective was to assess the incidence and predictive factors for complications: POPF, post-pancreatectomy hemorrhage (PPH) and delayed gastric emptying (DGE) following the criteria of the ISGPS and Clavien-Dindo classifications.
MethodsA prospective observational study that included all patients who underwent PD between 2008 and 2016. PG was the surgical procedure of choice for PD reconstruction.
ResultsTwo hundred forty-nine patients underwent surgery with intention of performing a PD. The feasibility of PG was 90.5%. One hundred and six (53%) patients had complications, 36 (18%) were severe (Clavien-Dindo grade ≥III). Death within 90 postoperative days was 4%. DGE was the most frequent complication (22.5%), followed by PPH (21%). The clinical POPF rate was 15% (6% Clavien-Dindo grade ≥III). The primary risk factors associated with complications were age >70 years (1.9 [1-3.55]), being male (1.89 [1; 3.6]) and soft pancreatic texture (3.38 [1.5; 7.37]).
ConclusionsIn this paper, we report a feasibility study for PG (90.5%). The primary risk factors associated with complications were age >70 years, being male and soft pancreatic texture. Soft pancreatic texture is also associated with the development and severity of POPF.
La duodenopancreatectomía (DP) es un procedimiento habitual en los hospitales de tercer nivel. En las últimas dos décadas, varios estudios se han centrado en los cambios técnicos en la reconstrucción pancreática con el objetivo de disminuir la incidencia de la fístula pancreática postoperatoria (POPF)1–3, el principal factor asociado con la morbimortalidad postoperatoria.
Las dos técnicas más utilizadas para la reconstrucción pancreática son la pancreaticoyeyunostomía (PJ) y la pancreaticogastrostomía (PG). Hasta la fecha existe controversia sobre las ventajas o inconvenientes de estas dos técnicas y cuál debería ser la técnica de elección en la DP. Esto se debe en parte al uso de diferentes variantes dentro de una misma técnica, así como diferentes modos de definir y registrar las complicaciones por los distintos grupos.
El uso de las clasificaciones propuestas por el Grupo de estudio internacional sobre cirugía pancreática (ISGPS) en relación a las anastomosis, las complicaciones postoperatorias, el retraso del vaciamiento gástrico (RVG), la hemorragia postoperatoria (HPP) y la POPF, permite una comparación más objetiva de los resultados4–7.
El objetivo de nuestro estudio es analizar la incidencia y los factores de riesgo de complicaciones (POPF, HPP y RVG) utilizando los criterios de las clasificaciones internacionales de la ISGPS y Clavien-Dindo8 en 200 pacientes consecutivos con PG. Como objetivo secundario nos planteamos analizar la factibilidad técnica de la PG en una serie prospectiva de pacientes intervenidos en el mismo centro con una técnica y cuidados postoperatorios estandarizados.
Material y métodosDiseño del estudioEn abril de 2008 se seleccionó y se realizó la primera PG como técnica de reconstrucción estándar para todos los pacientes intervenidos de DP. Realizamos un estudio observacional prospectivo que incluye a todos los pacientes sometidos a DP entre abril de 2008 y abril de 2016 en nuestro centro. La técnica de elección del estudio incluye el abordaje inicial de la arteria mesentérica superior9–11, para facilitar la valoración de la resecabilidad y la extirpación del mesopáncreas en los pacientes con tumores malignos. La reconstrucción pancreática se realizó mediante PG (tipo I-B S0)7 según la técnica descrita por Delcore12. La reconstrucción con PG se realizó por el mismo equipo quirúrgico formado por 3 cirujanos. La indicación quirúrgica fue realizada por un comité multidisciplinar.
Los pacientes firmaron el consentimiento informado antes de la cirugía de acuerdo con el protocolo del hospital, según lo aprobado por el comité de ética.
Cuidados postoperatoriosSe implementó una vía clínica estandarizada para los cuidados postoperatorios13. Siguiendo los criterios del ISGPS4, analizamos la concentración de amilasa en el líquido de drenaje abdominal en el postoperatorio al tercer día (PDO3); los drenajes se retiraron cuando los niveles de amilasa alcanzaron ≤ 400 U/L. Para valores más altos, el procedimiento se repitió cada 48h.
Recogida de datos y definicionesDiseñamos una base de datos con FileMaker® e introdujimos los datos prospectivamente. La base de datos incluyó datos demográficos, grado de la Sociedad Americana de Anestesiólogía (ASA)14, índice de masa corporal (IMC), diagnóstico, procedimientos quirúrgicos, fecha, cirujano y complicaciones quirúrgicas según las clasificaciones de Clavien-Dindo e ISGPS para la POPF, el RVG y la HPP, en los 30 días posteriores a la cirugía. La mortalidad incluyó todos los eventos dentro de los primeros 90 días postoperatorios.
El diámetro del conducto pancreático se midió utilizando un tubo de silicona de 10 French (3,3mm) durante el procedimiento. Se consideró que el conducto tenía > 3mm cuando el tubo se introdujo fácilmente y ≤ 3mm cuando se requería dilatación o que no era posible introducir el dispositivo de medición. La textura del páncreas se clasificó como dura o blanda, según la resistencia del tejido a la sutura.
Análisis estadísticoUtilizamos la biblioteca epiR y el paquete R (versión 2.13.1) para el cálculo del tamaño de la muestra para determinar los factores de riesgo de POPF en función de nuestros resultados previos13 de porcentaje de fístula pancreática y páncreas de consistencia blanda. Para nuestro estudio, con una serie de 200 pacientes permite obtener una diferencia de riesgo relativo (RR) estadísticamente significativa de 1,5 con una potencia del 80% en una prueba a dos colas y un intervalo de confianza (IC) del 95%.
Se utilizaron test estadísticos descriptivos para presentar las variables sociodemográficas y las complicaciones posteriores a la DP. Se aplicaron modelos logísticos binarios para describir la relación entre las variables y la aparición de complicaciones de POPF y RVG, proporcionando el odds ratio (OR) como la medición del riesgo y el IC correspondiente del 95%. Además, realizamos una regresión logística multivariante, incluyendo las variables estadísticamente significativas según el análisis bivariante. Consideramos estadísticamente significativo un valor p < 0,05.
ResultadosSelección de pacientes y factibilidad de la PGDoscientos cuarenta y nueve (249) pacientes fueron intervenidos en nuestro centro entre abril de 2008 y abril de 2016 con intención de realizar una DP, de los cuales 155 han sido incluidos en un trabajo anterior13. Ciento ochenta y uno (181) tenían tumores malignos, que en 26 casos no pudieron resecarse debido a la infiltración local o metástasis, lo que supone una resecabilidad del 85,6%.
En los 223 pacientes en los que pudo realizarse la resección, en 221 casos pudo realizarse una DP y en 2 casos se realizó una pancreatectomía total por afectación tumoral del borde en la biopsia preoperatoria. La PG fue factible en 200 (90,5%) de las 221 DP y en los restantes 21 (9,5%) se eligió la reconstrucción con PJ. La PG no fue posible en estos 21 pacientes por la resección extensa del páncreas (42,8%), debido a una cirugía previa (33,4%) o debido a pancreatitis crónica (23,8%).
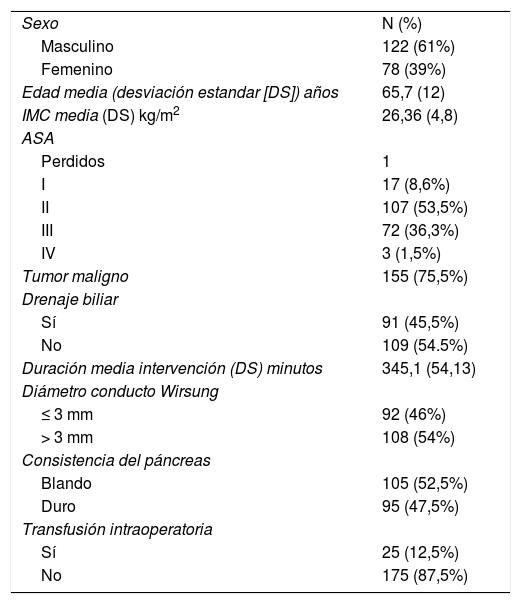
Datos demográficos y quirúrgicosLa tabla 1 presenta las principales variables demográficas de nuestra serie y resume las variables relacionadas con la cirugía.
Datos demográficos
| Sexo | N (%) |
| Masculino | 122 (61%) |
| Femenino | 78 (39%) |
| Edad media (desviación estandar [DS]) años | 65,7 (12) |
| IMC media (DS) kg/m2 | 26,36 (4,8) |
| ASA | |
| Perdidos | 1 |
| I | 17 (8,6%) |
| II | 107 (53,5%) |
| III | 72 (36,3%) |
| IV | 3 (1,5%) |
| Tumor maligno | 155 (75,5%) |
| Drenaje biliar | |
| Sí | 91 (45,5%) |
| No | 109 (54.5%) |
| Duración media intervención (DS) minutos | 345,1 (54,13) |
| Diámetro conducto Wirsung | |
| ≤ 3 mm | 92 (46%) |
| > 3 mm | 108 (54%) |
| Consistencia del páncreas | |
| Blando | 105 (52,5%) |
| Duro | 95 (47,5%) |
| Transfusión intraoperatoria | |
| Sí | 25 (12,5%) |
| No | 175 (87,5%) |
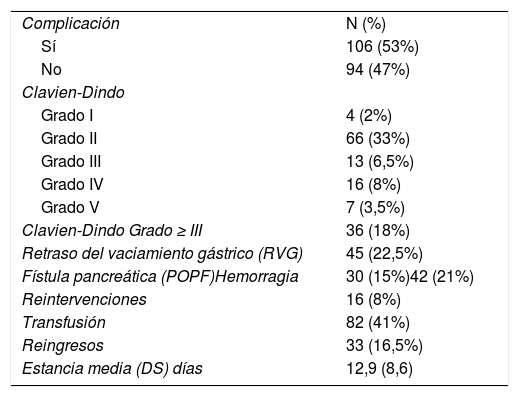
En la tabla 2 se presentan las complicaciones. Hubo 106 (53%) complicaciones dentro de los 30 días postoperatorios, incluidos los reingresos hospitalarios. La media de complicaciones por paciente fue de 1,5.
Morbimortalidad de la serie de pancreaticogastrostomía
| Complicación | N (%) |
| Sí | 106 (53%) |
| No | 94 (47%) |
| Clavien-Dindo | |
| Grado I | 4 (2%) |
| Grado II | 66 (33%) |
| Grado III | 13 (6,5%) |
| Grado IV | 16 (8%) |
| Grado V | 7 (3,5%) |
| Clavien-Dindo Grado ≥ III | 36 (18%) |
| Retraso del vaciamiento gástrico (RVG) | 45 (22,5%) |
| Fístula pancreática (POPF)Hemorragia | 30 (15%)42 (21%) |
| Reintervenciones | 16 (8%) |
| Transfusión | 82 (41%) |
| Reingresos | 33 (16,5%) |
| Estancia media (DS) días | 12,9 (8,6) |
| Clavien-Dindo | I | II | III | IV | V | TOTAL |
|---|---|---|---|---|---|---|
| RVG | 35 (17,5%) | 5 (2,5%) | 4 (2%) | 1 (0,5%) | 45 (22,5%) | |
| Hemorragia | 15 (7,5%) | 11 (5,5%) | 11 (5,5%) | 5 (2,5%) | 42 (21%) | |
| POPF | 1 (0,5%) | 17 (8,5%) | 3 (1,5%) | 6 (3%) | 3 (1,5%) | 30 (15%) |
| ISGPS | A | B | C | |
|---|---|---|---|---|
| RVG | 17 (8,5%) | 19 (9,5%) | 9 (4,5%) | 45 (22,5%) |
| Hemorragia | 7 (3,5%) | 17 (8,5%) | 18 (9%) | 42 (21%) |
| POPF | 5 (2,5%) | 16 (8%) | 9 (4,5%) | 30 (15%) |
Las complicaciones en 70 pacientes (35%) se consideraron leves (Clavien-Dindo grados I-II) y en 36 (18%) graves (Clavien-Dindo grado ≥ III). Siete (3,5%) pacientes murieron dentro de los 30 días y ocho (4%) dentro de los 90 días.
ReintervencionesDieciséis (8%) pacientes fueron reoperados, la causa principal fue la hemorragia (56%); 7 debido a hemorragia del muñón pancreático, un caso de hemoperitoneo y un hematoma asociado a una POPF. La sepsis fue la segunda causa (3%): una debida a POPF, una fístula biliar (FB), una POPF con FB asociada, una dehiscencia de la sutura gastroyeyunal y dos casos con peritonitis sin objetivar origen en la reintervención.
Reingresos hospitalariosTreinta y tres (16,5%) pacientes reingresaron en los primeros 30 días postoperatorios, principalmente debido a infección (6,5%), hemorragia (4%) y RVG (2,5%). Hubo tres reingresos no justificados (1,5%). Los reingresos aumentan el porcentaje de complicaciones al alta (43,5%) un 9,5% hasta el 53%.
Estancia en el hospitalLa duración media de la estancia hospitalaria fue de 12,9 días (8,6). La media en los pacientes con alguna complicación fue de 17,3 días frente a 8 días en los pacientes sin complicaciones.
Retraso del vaciamiento gástricoEl RVG fue la complicación más frecuente; 45 pacientes (22,5%) cumplieron con los criterios de la ISGPS. En 35 (77,8%) pacientes, el RVG se clasificó como grado II de Clavien-Dindo. En nueve pacientes se clasificó como Clavien-Dindo grados III y IV. Un paciente falleció debido a una broncoaspiración secundaria al RVG. La estancia hospitalaria media de los pacientes con RVG fue de 19,67 días.
De los 45 pacientes que desarrollaron RVG, 21 (46,6%) no tuvieron otras complicaciones intraabdominales asociadas y se clasificaron como RVG primarios. Los 24 pacientes restantes (53,3%) fueron clasificados como RVG secundarios.
Complicaciones hemorrágicasCuarenta y dos (42; 21%) pacientes tuvieron complicaciones hemorrágicas (tabla 2), 27 (13,5%) se clasificaron como graves (Clavien ≥ III).
Se observó hemorragia intraluminal (ISGPS) en 30 (15%) casos, extraluminal en 10 (5%) e intra/extraluminal en dos (1%). En cuanto al momento de inicio de la hemorragia, en 32 (16%) casos fue tardía (> 24h) y 10 (5%) temprana (< 24h).
Fístula pancreática (POPF)Treinta (15%) pacientes desarrollaron POPF clínica: dieciocho (9%) de las POPF se clasificaron como Clavien-Dindo grados I-II (tabla 2) y los otros 12 (6%) se clasificaron como graves (grado Clavien-Dindo ≥ III).
Observamos una mayor incidencia de POPF en pacientes con páncreas blandos en comparación con aquellos con páncreas duro: 25% frente a 4,2% (P < 0,001).
Otras complicacionesCuarenta (20%) pacientes tuvieron otras complicaciones, que en general fueron leves: siete (3,5%) desarrollaron bacteriemia primaria y fueron tratados con antibióticos; seis (3%) pacientes desarrollaron FB, seis (3%) desarrollaron infección de herida quirúrgica y tres (1,5%) un absceso intraabdominal.
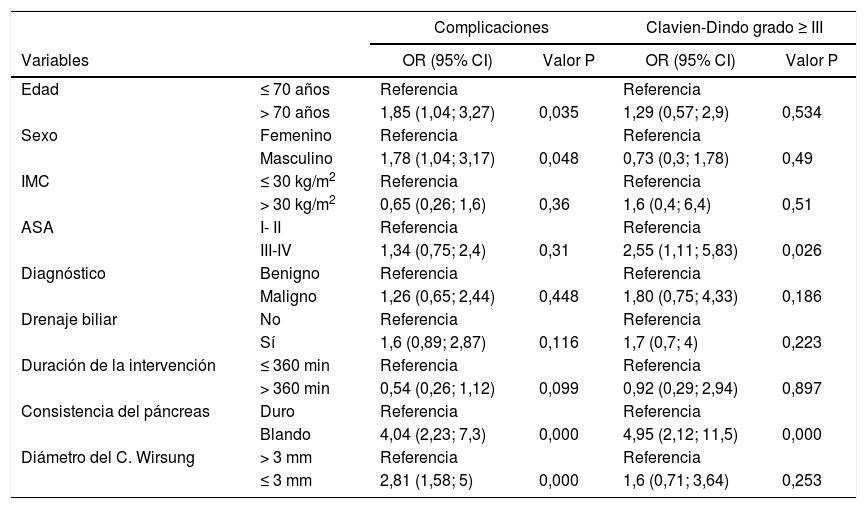
Factores de riesgo de morbimortalidad de la PGComplicaciones generales y gravedadSe analizaron los factores de riesgo asociados al desarrollo de complicaciones (tabla 3) en las 200 PG. En primer lugar, se evaluó la relación con la incidencia de complicaciones y posteriormente con la gravedad de las mismas, considerando graves las complicaciones Clavien-Dindo grado ≥ III.
Regresión logística univariante para las complicaciones totales y Clavien-Dindo ≥ III
| Complicaciones | Clavien-Dindo grado ≥ III | ||||
|---|---|---|---|---|---|
| Variables | OR (95% CI) | Valor P | OR (95% CI) | Valor P | |
| Edad | ≤ 70 años | Referencia | Referencia | ||
| > 70 años | 1,85 (1,04; 3,27) | 0,035 | 1,29 (0,57; 2,9) | 0,534 | |
| Sexo | Femenino | Referencia | Referencia | ||
| Masculino | 1,78 (1,04; 3,17) | 0,048 | 0,73 (0,3; 1,78) | 0,49 | |
| IMC | ≤ 30 kg/m2 | Referencia | Referencia | ||
| > 30 kg/m2 | 0,65 (0,26; 1,6) | 0,36 | 1,6 (0,4; 6,4) | 0,51 | |
| ASA | I- II | Referencia | Referencia | ||
| III-IV | 1,34 (0,75; 2,4) | 0,31 | 2,55 (1,11; 5,83) | 0,026 | |
| Diagnóstico | Benigno | Referencia | Referencia | ||
| Maligno | 1,26 (0,65; 2,44) | 0,448 | 1,80 (0,75; 4,33) | 0,186 | |
| Drenaje biliar | No | Referencia | Referencia | ||
| Sí | 1,6 (0,89; 2,87) | 0,116 | 1,7 (0,7; 4) | 0,223 | |
| Duración de la intervención | ≤ 360 min | Referencia | Referencia | ||
| > 360 min | 0,54 (0,26; 1,12) | 0,099 | 0,92 (0,29; 2,94) | 0,897 | |
| Consistencia del páncreas | Duro | Referencia | Referencia | ||
| Blando | 4,04 (2,23; 7,3) | 0,000 | 4,95 (2,12; 11,5) | 0,000 | |
| Diámetro del C. Wirsung | > 3 mm | Referencia | Referencia | ||
| ≤ 3 mm | 2,81 (1,58; 5) | 0,000 | 1,6 (0,71; 3,64) | 0,253 | |
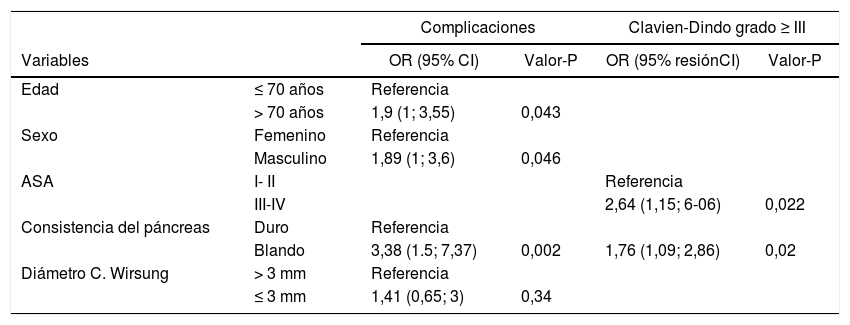
Reg logística multivariante para complicaciones globales y Clavien-Dindo ≥ III
| Complicaciones | Clavien-Dindo grado ≥ III | ||||
|---|---|---|---|---|---|
| Variables | OR (95% CI) | Valor-P | OR (95% resiónCI) | Valor-P | |
| Edad | ≤ 70 años | Referencia | |||
| > 70 años | 1,9 (1; 3,55) | 0,043 | |||
| Sexo | Femenino | Referencia | |||
| Masculino | 1,89 (1; 3,6) | 0,046 | |||
| ASA | I- II | Referencia | |||
| III-IV | 2,64 (1,15; 6-06) | 0,022 | |||
| Consistencia del páncreas | Duro | Referencia | |||
| Blando | 3,38 (1.5; 7,37) | 0,002 | 1,76 (1,09; 2,86) | 0,02 | |
| Diámetro C. Wirsung | > 3 mm | Referencia | |||
| ≤ 3 mm | 1,41 (0,65; 3) | 0,34 | |||
Con respecto a las características clínicas y demográficas preoperatorias, la edad mayor de 70 años (OR = 1,85 [IC 95%: 1,04-3,27]) y el género masculino (OR = 1,78 IC 95%: [1,04-3,17]) se identificaron como factores de riesgo para complicaciones.
Los factores de riesgo quirúrgico asociados con las complicaciones fueron la consistencia blanda del páncreas (OR = 4,04 [IC del 95%: 2,23-7,3]) y el diámetro del conducto pancreático ≤ 3mm (OR = 2,81 [IC del 95%: 1,5-8,5]). Un ASA ≥ III (OR = 2,55 [IC 95%; 1,11-5,83]) y la consistencia blanda (OR = 4,95 [IC 95%; 2,12-11,5]) se relacionaron con la gravedad de las complicaciones.
La edad > 70 años, el género masculino y la consistencia blanda del páncreas (P = 0,002) se mantuvieron como variables predictivas en el modelo multivariante. Los pacientes con ASA ≥ III y la consistencia blanda del páncreas también se asocian con la gravedad de las complicaciones (P = 0,02).
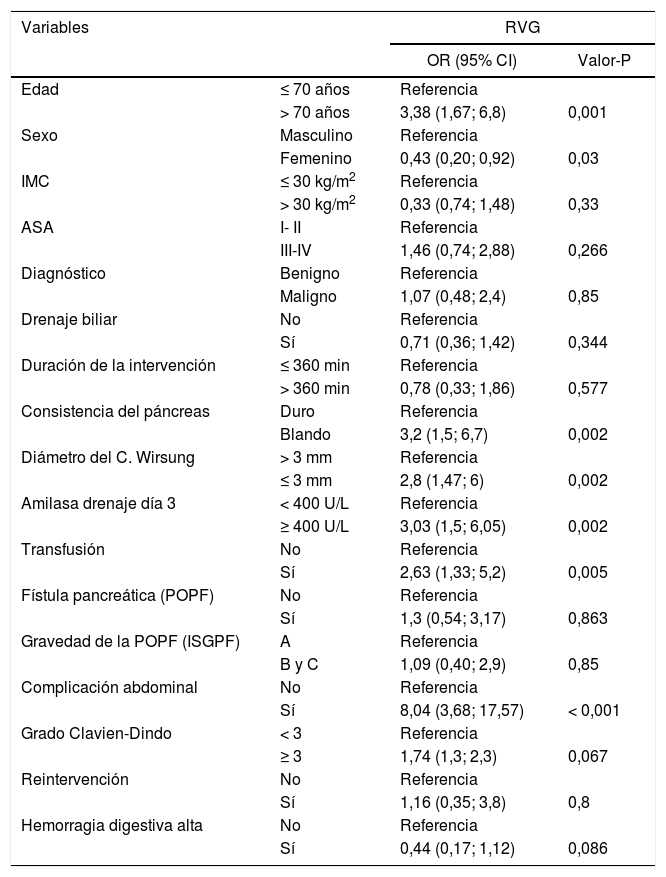
Retraso del vaciamiento gástricoEl análisis univariante (tabla 4) reveló que la edad > 70 años (P = 0,001) y el género masculino (P = 0,03) eran factores de riesgo para el RVG. La consistencia blanda del páncreas (OR = 3,2 [IC 95% 1,5-6,7]), el diámetro del conducto pancreático ≤ 3mm (OR = 2,8 [IC 95% 1,47-6]), la concentración de amilasa en PDO3 ≥ 400 UI / L (OR = 1,83 [IC 95% 0,8-4,13]), la transfusión de sangre (OR = 2,63 [IC 95% 1,33-5,2]) y la POPF (OR = 8,04 [IC 95% 3,68-17,57]) se relacionaron con RVG. La presencia de complicaciones abdominales fue la variable con mayor asociación con el RVG.
Regresión logística univariante para el retraso del vaciamiento gástrico (RVG)
| Variables | RVG | ||
|---|---|---|---|
| OR (95% CI) | Valor-P | ||
| Edad | ≤ 70 años | Referencia | |
| > 70 años | 3,38 (1,67; 6,8) | 0,001 | |
| Sexo | Masculino | Referencia | |
| Femenino | 0,43 (0,20; 0,92) | 0,03 | |
| IMC | ≤ 30 kg/m2 | Referencia | |
| > 30 kg/m2 | 0,33 (0,74; 1,48) | 0,33 | |
| ASA | I- II | Referencia | |
| III-IV | 1,46 (0,74; 2,88) | 0,266 | |
| Diagnóstico | Benigno | Referencia | |
| Maligno | 1,07 (0,48; 2,4) | 0,85 | |
| Drenaje biliar | No | Referencia | |
| Sí | 0,71 (0,36; 1,42) | 0,344 | |
| Duración de la intervención | ≤ 360 min | Referencia | |
| > 360 min | 0,78 (0,33; 1,86) | 0,577 | |
| Consistencia del páncreas | Duro | Referencia | |
| Blando | 3,2 (1,5; 6,7) | 0,002 | |
| Diámetro del C. Wirsung | > 3 mm | Referencia | |
| ≤ 3 mm | 2,8 (1,47; 6) | 0,002 | |
| Amilasa drenaje día 3 | < 400 U/L | Referencia | |
| ≥ 400 U/L | 3,03 (1,5; 6,05) | 0,002 | |
| Transfusión | No | Referencia | |
| Sí | 2,63 (1,33; 5,2) | 0,005 | |
| Fístula pancreática (POPF) | No | Referencia | |
| Sí | 1,3 (0,54; 3,17) | 0,863 | |
| Gravedad de la POPF (ISGPF) | A | Referencia | |
| B y C | 1,09 (0,40; 2,9) | 0,85 | |
| Complicación abdominal | No | Referencia | |
| Sí | 8,04 (3,68; 17,57) | < 0,001 | |
| Grado Clavien-Dindo | < 3 | Referencia | |
| ≥ 3 | 1,74 (1,3; 2,3) | 0,067 | |
| Reintervención | No | Referencia | |
| Sí | 1,16 (0,35; 3,8) | 0,8 | |
| Hemorragia digestiva alta | No | Referencia | |
| Sí | 0,44 (0,17; 1,12) | 0,086 | |
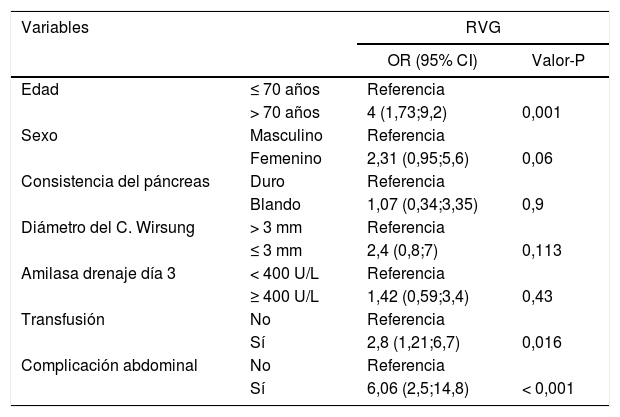
Regresión logística multivariante para el retraso del vaciamiento gástrico
| Variables | RVG | ||
|---|---|---|---|
| OR (95% CI) | Valor-P | ||
| Edad | ≤ 70 años | Referencia | |
| > 70 años | 4 (1,73;9,2) | 0,001 | |
| Sexo | Masculino | Referencia | |
| Femenino | 2,31 (0,95;5,6) | 0,06 | |
| Consistencia del páncreas | Duro | Referencia | |
| Blando | 1,07 (0,34;3,35) | 0,9 | |
| Diámetro del C. Wirsung | > 3 mm | Referencia | |
| ≤ 3 mm | 2,4 (0,8;7) | 0,113 | |
| Amilasa drenaje día 3 | < 400 U/L | Referencia | |
| ≥ 400 U/L | 1,42 (0,59;3,4) | 0,43 | |
| Transfusión | No | Referencia | |
| Sí | 2,8 (1,21;6,7) | 0,016 | |
| Complicación abdominal | No | Referencia | |
| Sí | 6,06 (2,5;14,8) | < 0,001 | |
En el modelo multivariante, los factores asociados con el RVG fueron la edad > 70 años (P = 0,001), la presencia de complicaciones abdominales (P < 0,001) y la transfusión (P = 0,016).
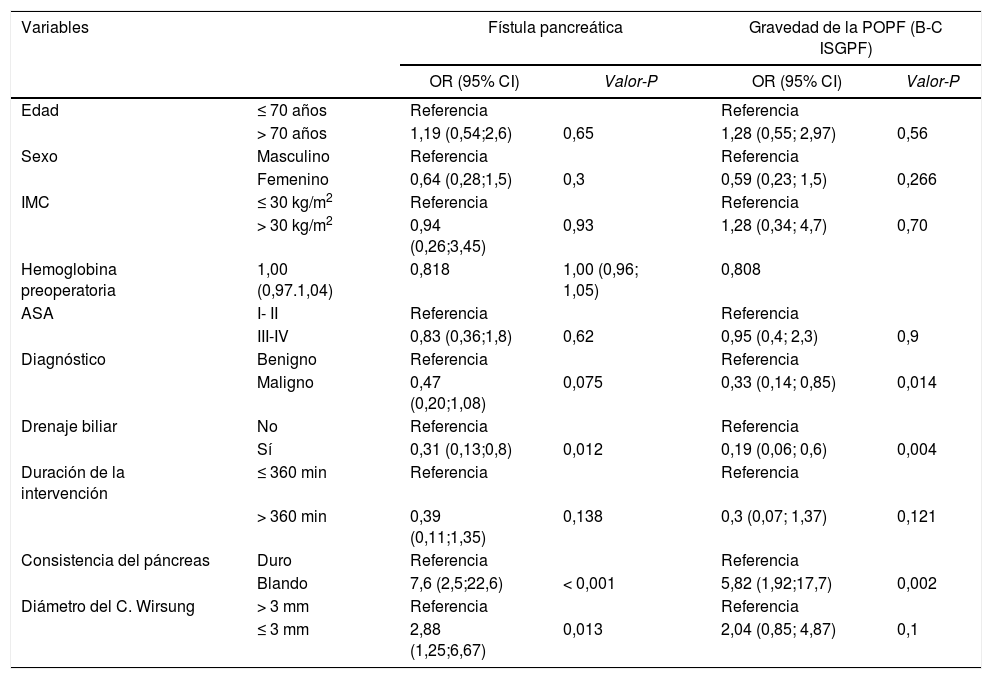
Fístula pancreáticaAnalizamos los factores de riesgo asociados a la POPF (tabla 5) y su gravedad (Grados B y C). El modelo univariante reveló que los factores de riesgo para la POPF eran la consistencia del páncreas, blanda frente a dura (OR = 7,6 [IC 95% 2,5-22,6], P < 0,001) y el diámetro del conducto ≤ 3mm (OR = 2,88 [IC 95% 1,25-6,67]). Por el contrario, el análisis identificó el drenaje biliar preoperatorio como factor protector (OR = 0,31 [IC 95% 0,13-0,8], P = 0,012).
Regresión logística univariante para la fístula pancreática (POPF) y gravedad de la POPF según la ISGPS
| Variables | Fístula pancreática | Gravedad de la POPF (B-C ISGPF) | |||
|---|---|---|---|---|---|
| OR (95% CI) | Valor-P | OR (95% CI) | Valor-P | ||
| Edad | ≤ 70 años | Referencia | Referencia | ||
| > 70 años | 1,19 (0,54;2,6) | 0,65 | 1,28 (0,55; 2,97) | 0,56 | |
| Sexo | Masculino | Referencia | Referencia | ||
| Femenino | 0,64 (0,28;1,5) | 0,3 | 0,59 (0,23; 1,5) | 0,266 | |
| IMC | ≤ 30 kg/m2 | Referencia | Referencia | ||
| > 30 kg/m2 | 0,94 (0,26;3,45) | 0,93 | 1,28 (0,34; 4,7) | 0,70 | |
| Hemoglobina preoperatoria | 1,00 (0,97.1,04) | 0,818 | 1,00 (0,96; 1,05) | 0,808 | |
| ASA | I- II | Referencia | Referencia | ||
| III-IV | 0,83 (0,36;1,8) | 0,62 | 0,95 (0,4; 2,3) | 0,9 | |
| Diagnóstico | Benigno | Referencia | Referencia | ||
| Maligno | 0,47 (0,20;1,08) | 0,075 | 0,33 (0,14; 0,85) | 0,014 | |
| Drenaje biliar | No | Referencia | Referencia | ||
| Sí | 0,31 (0,13;0,8) | 0,012 | 0,19 (0,06; 0,6) | 0,004 | |
| Duración de la intervención | ≤ 360 min | Referencia | Referencia | ||
| > 360 min | 0,39 (0,11;1,35) | 0,138 | 0,3 (0,07; 1,37) | 0,121 | |
| Consistencia del páncreas | Duro | Referencia | Referencia | ||
| Blando | 7,6 (2,5;22,6) | < 0,001 | 5,82 (1,92;17,7) | 0,002 | |
| Diámetro del C. Wirsung | > 3 mm | Referencia | Referencia | ||
| ≤ 3 mm | 2,88 (1,25;6,67) | 0,013 | 2,04 (0,85; 4,87) | 0,1 | |
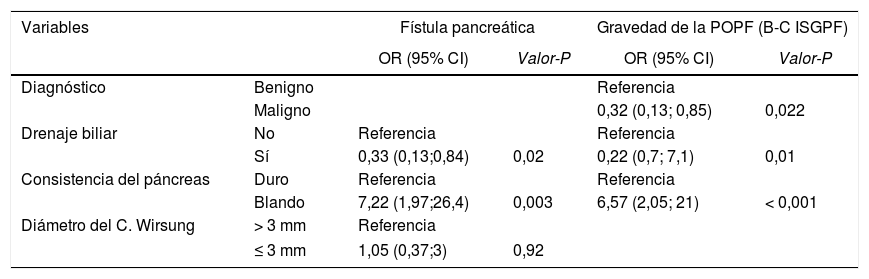
Regresión logística multivariante para la fístula pancreática (POPF) y gravedad de la POPF según la ISGPS
| Variables | Fístula pancreática | Gravedad de la POPF (B-C ISGPF) | |||
|---|---|---|---|---|---|
| OR (95% CI) | Valor-P | OR (95% CI) | Valor-P | ||
| Diagnóstico | Benigno | Referencia | |||
| Maligno | 0,32 (0,13; 0,85) | 0,022 | |||
| Drenaje biliar | No | Referencia | Referencia | ||
| Sí | 0,33 (0,13;0,84) | 0,02 | 0,22 (0,7; 7,1) | 0,01 | |
| Consistencia del páncreas | Duro | Referencia | Referencia | ||
| Blando | 7,22 (1,97;26,4) | 0,003 | 6,57 (2,05; 21) | < 0,001 | |
| Diámetro del C. Wirsung | > 3 mm | Referencia | |||
| ≤ 3 mm | 1,05 (0,37;3) | 0,92 | |||
Respecto a la gravedad de la POPF, el único factor de riesgo fue la consistencia blanda del páncreas, mientras que el diagnóstico de adenocarcinoma y drenaje biliar preoperatorio fueron factores protectores.
En el modelo multivariante, la consistencia blanda del páncreas se mantuvo como factor de riesgo significativo (OR = 7,22 IC 95%: [1,97-26,4]) y el drenaje biliar preoperatorio como factor protector (OR = 0,33 [IC 95% 0,13 -0,84]). Con respecto a la gravedad de la POPF, el drenaje biliar preoperatorio (OR = 0,33; IC del 95% [0,13-0,84]) y el diagnóstico de adenocarcinoma (OR = 0,32; [IC 95% 0,13-0,85]) fueron factores protectores y la consistencia blanda del páncreas fue un factor de riesgo (OR = 7,2 [IC 95% 1,97- 26,4]).
Finalmente, en la tabla 6 se comparan nuestros resultados de morbimortalidad con los de las principales series publicadas.
Comparación de morbimortalidad con otras series de pancreaticogastrostomía (PG)
| Herrera et al.(200 PG) | Figueras et al.(66 PG) | Topal et al.(162 PG) | Keck et al.(171 PG) | |
|---|---|---|---|---|
| Consistencia blanda del páncreas | 52% | 52% | 46,8% | 59% |
| Complicaciones | 53% | 63% | 61,7% | |
| Clavien-Dindo | ||||
| I-II | 35% | 26% | ||
| ≥ IIIa | 18% | 39% | 35% | 36% |
| Mortalidad | 3,5% | 5% | 3% | 6% |
| Retraso del vaciamiento gástrico (B/C) | 14% | 14% | 15% | 12% |
| Fístula pancreática (B/C) | 12,5% | 11% | 8% | 20% |
| Complicaciones hemorrágicas (%) | 21.5% | 20% | 13% | 21% |
| A | 3,5% | 3% | 5% | |
| B | 8,5% | 3% | 9% | |
| C | 9% | 14% | 6% | |
| Reintervenciones | 8% | 9% | 12% | |
| Abscesos intraabdominales | 1,5% | 8% | 6% | 11% |
Un trabajo previo de nuestro grupo13 con 332 DP (177 PJ y 155 PG), indicaba que la reconstrucción con PG presentaba una menor morbilidad e incidencia de POPF. Aunque la técnica quirúrgica de elección sigue siendo un tema de debate, los datos de nueve ensayos clínicos (RTCs)15–22 que comparan PJ frente a PG revelaron unos resultados heterogéneos con tasas de morbimortalidad similares. Ninguno de los RTCs anteriores fue diseñado para evaluar la influencia del tipo de anastomosis en la incidencia de POPF de grado C y además no se ha realizado un análisis por intención de tratar para analizar la factibilidad técnica de la PG.
En algunos centros de alto volumen, la PG es la técnica de reconstrucción de elección en casos con mayor riesgo de desarrollar POPF17. En el debate actual sobre la mejor técnica para la reconstrucción después de la DP, probablemente no se obtendrá información adicional para proporcionar una recomendación de Nivel 1. Sin embargo, podemos centrarnos en ciertos factores para mejorar los resultados, como la estandarización de la técnica y de los cuidados postoperatorios, los recursos técnicos del equipo quirúrgico para adaptarse a las circunstancias de cada paciente y considerar no solo la morbilidad y la mortalidad, sino también la calidad de vida de los pacientes o el estado nutricional y el control glucémico a largo plazo.
A continuación, analizamos tres estudios que han utilizado la clasificación ISGPS y en los que la incidencia de la POPF se evalúa por separado considerando la consistencia pancreática y el diámetro del conducto pancreático17,21,22. Para el análisis de las complicaciones y sus factores de riesgo, se realizó una búsqueda en la literatura y se encontró que solo en las series más recientes se reportan las complicaciones siguiendo las clasificaciones ISGPS y Clavien-Dindo8. La consistencia del páncreas es un factor de riesgo de gran relevancia para las complicaciones, por lo que cuando falta esta información es difícil realizar comparaciones entre series. Es cierto que la consistencia del páncreas es un dato subjetivo que depende de la impresión del cirujano, mientras que el diámetro del conducto pancreático es más objetivo, pero en nuestra experiencia la consistencia tiene un mayor valor predictivo de POPF.
En general, en nuestra serie hubo 105 páncreas blandos (52,5%) y 95 duros (48,5%). Estos datos están en línea con las series recientemente publicadas por Keck17, 59% y 41%, respectivamente (58% con un diámetro ≤ 3mm). En el estudio de Figueras22, se notificó que el 52% de los pacientes tenía páncreas blando, en Topal21 el 46,8% era blando y el 60% tenía un diámetro del conducto pancreático ≤ 3mm. En nuestra serie, el 75% de los casos con páncreas blandos tenían diámetros del conducto pancreático ≤ 3mm y en la serie de Topal21 era del 78%.
En nuestra serie, el 43,5% de los pacientes hospitalizados tuvo complicaciones al alta y aumenta un 9,5% al incluir los reingresos a 30 días (53% en total): 18% Clavien-Dindo ≥ IIIA, 8% IV y 3,5% de mortalidad. La tabla 6 resume las complicaciones de tres RTC según las clasificaciones ISGPS1–3 y Clavien-Dindo8. Además, la incidencia total de complicaciones en nuestra serie es de alrededor del 53% en comparación con el 63% reportado por Figueras22; Keck17 no evaluó las complicaciones totales. No está claro si se incluyen en estos dos estudios las complicaciones durante las readmisiones dentro de los 30 días, como se hizo en nuestra serie.
El dieciocho por ciento (18%) de las complicaciones reportadas en nuestro estudio fueron graves (Clavien-Dindo ≥ III A), un porcentaje inferior al que presentan otras series con PG (tabla 6). La mortalidad en los primeros 30 días osciló entre el 3 y el 6% en las diferentes series. La mortalidad dentro de los 90 días en nuestra serie aumentó un 0,5% hasta el 4%, un porcentaje inferior al 10% comunicado por Keck17. El resto de los estudios no contenían dicha información. Estos resultados de morbimortalidad cumplen los estándares de calidad de la cirugía oncológica pancreática23,24.
Los porcentajes de POPF grado B/C fueron del 8% en el estudio de Topal21, del 11,5% en Figueras22, del 12,5% en el presente estudio y del 20% en Keck17. Es relevante señalar la asociación entre el porcentaje de páncreas blandos (46,8% Topal21 a 59% Keck17) y el grado de POPF B/C.
La incidencia de HPP oscila entre el 13%22 y el 21%13,17,21. Excepto por la serie de Topal21, la hemorragia intraluminal temprana del muñón pancreático fue significativamente mayor en el grupo de PG frente a la PJ3,17,25,26. En nuestra serie, los pacientes con hemorragia de arteria visceral fueron tratados mediante embolización percutánea y los siete (3,5%) pacientes con hemorragia del borde de sección del páncreas, fueron reintervenidos por esta causa realizando una gastrotomía y hemostasia sobre el borde de sección pancreático. A la vista de los resultados, la HPP puede considerarse la complicación postoperatoria de mayor gravedad, por encima de la FPP, y deberíamos haber realizado un análisis de los factores pronósticos asociados a la HPP al igual que la realizada con el RVG y la FPP. Consideramos que los factores asociados a la HPP no pueden analizarse globalmente ya que la hemorragia incluye dos escenarios distintos, la hemorragia de arteria visceral y la hemorragia del borde de sección del páncreas por lo que estamos realizando un estudio específico más amplio sobre esta complicación.
El porcentaje de transfusión de la serie (41%) es superior al de complicaciones hemorrágicas, y se debe principalmente a que en la primera parte de la serie se intervenían pacientes con peor estado preoperatorio (desnutrición y anemia) que requerían transfusión intraoperatoriamente o en las primeras horas postoperatorias sin que se objetivase hemorragia y otra complicación. Actualmente se está realizando un proceso de optimización del estado preoperatorio de los pacientes desde la consulta de anestesia para disminuir el porcentaje de transfusión o la necesidad de NPT postoperatoria.
A pesar de que la incidencia global de RVG en las cuatro series varía entre el 15 y 37% de la de Keck17, el porcentaje de RVG grado B / C fue similar entre ellas (12 a 15%). Esta diferencia de resultados puede deberse al porcentaje de RVG grado A que no está recogido en todas ellas y a la variabilidad de los protocolos de manejo de la sonda nasogástrica y de alimentación.
En nuestro estudio, la edad > 70 años, el sexo masculino y la consistencia blanda del páncreas (OR 3,38) son factores de riesgo asociados a complicaciones. Los factores asociados a la gravedad de las complicaciones son el grado ASA ≥ III y la consistencia blanda del páncreas (OR 1,76). En la serie de Figueras22 los factores asociados son el diámetro del conducto pancreático y la POPF. En el análisis multivariante sobre la incidencia y gravedad de la POPF, Figueras22 informa una Hazard Ratio (HR) de 17,76 para la consistencia blanda del páncreas, seguida del IMC > 25 kg/m2 con una HR de 11,21. El HR de la consistencia blanda del páncreas en la serie presentada por Keck17 es de 2,09. Por el contrario, el drenaje biliar preoperatorio aparece como factor protector, algo que no concuerda con los resultados de estudios previos. Un estudio de Fujii27 con 122 pacientes intervenidos mediante DPC, 72 (59%) de ellos con drenaje biliar preoperatorio, concluye que existe un aumento del porcentaje de FP en pacientes con drenaje biliar preoperatorio si la intervención se demora más de un mes tras la colocación del drenaje. Una posible explicación de nuestro resultado puede ser la asociación de la ictericia obstructiva con los páncreas de consistencia dura, por lo que los pacientes con drenaje biliar tendrían un páncreas de consistencia más dura que los pacientes sin drenaje.
Como objetivo secundario, evaluamos las limitaciones de la reconstrucción con PG en una serie consecutiva, no seleccionada, de pacientes de un solo centro en el que tres cirujanos realizan 30 DP por año. La factibilidad de la PG en nuestro centro fue del 90,1%, en la serie de Keck17, la factibilidad fue del 93% y 97% en el grupo de Figueras22. En nuestra experiencia, estos valores de factibilidad nos permiten utilizar a la PG como técnica estándar y reservar la PJ, más compleja técnicamente, para pacientes con cirugías gástricas previas o con páncreas que no pueden movilizarse debido a la fibrosis de las pancreatis crónicas o por resecciones extensas.
Este trabajo es un estudio observacional, con una sola técnica y con un número limitado de pacientes por lo que no permite extraer una conclusión definitiva sobre qué reconstrucción es mejor (PG o PJ), al igual que ocurre con el análisis de los RTC y de las series comparadas en este estudio. Sin embargo, parece que, independientemente de la técnica de reconstrucción, la consistencia del páncreas y el diámetro del conducto pancreático son variables asociadas con las complicaciones, con la gravedad de las mismas y con el desarrollo de la POPF. En la serie de Keck17, un volumen de más de 10 DP por año reduce la incidencia de POPF, aunque no significativamente. El estudio RECOPANC realizado por Keck17 es metodológicamente el RTC más sólido hasta la fecha, aunque la técnica de reconstrucción no fue la misma para todas las PJ o PG. En nuestro estudio, utilizamos la misma técnica de reconstrucción y el mismo protocolo de cuidados postoperatorios en todos los pacientes y presentamos unos resultados similares. En nuestra experiencia, la PG es una técnica segura que cumple con los criterios de morbimortalidad exigidos por la DP y presenta una factibilidad del 90,5%.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.