La mayor supervivencia del paciente trasplantado viene acompañada del aumento en la tasa de tumores de novo (TN) que representan la complicación tardía más frecuente. Podemos distinguir entre tumores de piel no melanoma (TPNM), síndrome linfoproliferativo postrasplante (SLPT) y tumores de órgano sólido (TOS). Nuestro objetivo es determinar la incidencia de los distintos TN, el tiempo trascurrido hasta su diagnóstico y su supervivencia en nuestro medio.
Material y métodoRealizamos un estudio retrospectivo de 1.071 trasplantados hepáticos desde 1990 hasta 2015 en nuestro centro. Analizamos las variables demográficas, la incidencia de TN y la supervivencia.
ResultadosSe desarrollaron 184 TN en 1.071 pacientes trasplantados (17%), en el 19% de los varones y en el 13% de las mujeres (p=0,004). Los TN más frecuentes fueron los TPNM (29%), pulmón (18%), cabeza y cuello (16%), SLPT (10%) y gastrointestinales (8%). La mediana del tiempo de diagnóstico fue de 7,9 años en los TPNM, 3,9 años en SLPT y de 9,8 años en TOS. Los pacientes con TPNM tuvieron significativamente mejor supervivencia que aquellos con SLPT o TOS. La incidencia de los tumores de novo (excluidos TPNM) fue 1.889/100.000 trasplantados/año. Por género, el cáncer de pulmón fue el TOS más común en varones y el cáncer de mama en mujeres.
ConclusiónEn nuestro medio, excluidos los TPNM, la incidencia es 8,8 veces la estimada para la población general, con una alta tasa de cáncer de pulmón por lo que deberíamos implementar estrategias preventivas y diagnósticas.
The greater survival of transplanted patients is accompanied by an increase in the rate of de novo malignancies (NM), which are the most frequent late-onset complication. We can distinguish between non-melanoma skin cancers (NMSC), post-transplant lymphoproliferative disorders (PTLD) and solid organ cancers (SOC). Our objective is to determine the incidence of the different types of NM, the time elapsed until diagnosis and survival rates in our setting.
MethodsWe conducted a retrospective study of 1071 liver transplant patients from 1990 to 2015 at our center. We analyzed the demographic variables, incidence of NM and survival.
Results184 NM developed in 1071 transplant patients (17%), specifically 19% of the males and 13% of the females (P=.004). The most frequent NM were NMSC (29%), lung (18%), head and neck (16%), PTLD (10%) and gastrointestinal (8%). The median time of diagnosis was 7.9 years in NMSC, 3.9 years in PTLD and 9.8 years in SOC. Patients with NMSC had significantly better survival than those with PTLD or SOC. The incidence of de novo tumors (excluding NMSC) was 1889/100,000 transplants/year. By gender, lung cancer was the most common TOS in men and breast cancer in women.
ConclusionIn our setting, excluding NMSC, the incidence is 8.8 times greater than estimations for the general population, with a high rate of lung cancer, so we should implement preventive and diagnostic strategies.
El trasplante hepático (TOH) se ha establecido como tratamiento estándar para la insuficiencia hepática, con más de 120.000 procedimientos realizados y tasas de supervivencia que han mejorado significativamente en los últimos 25 años y que se sitúan en el 83%, el 71% y el 61% a 1, 5 y 10 años1, respectivamente.
La incidencia de tumores malignos postrasplante de novo en pacientes trasplantados fue descrita por primera vez por Penn y Starzl en 19722. En los últimos años su incidencia varía del 2,2 al 26%3,4. Estudios de grandes registros5-8 indican que los receptores de un trasplante tienen 2 a 7 veces más probabilidades de desarrollar tumores malignos de novo que la población general y suponen una causa frecuente de mortalidad9,10. Diferentes factores han sido involucrados en el desarrollo de estos tumores: la inmunosupresión utilizada, el tiempo transcurrido desde que se realizó el trasplante y factores de riesgo asociados de forma general con la carcinogénesis (infecciones virales, tabaquismo, abuso de alcohol, etc.).
En España, según la Sociedad Española de Oncología Médica (SEOM)11, en los últimos 20 años, el número de tumores diagnosticados en la población general ha experimentado un crecimiento constante, debido no solo al aumento poblacional, sino también a las técnicas de detección precoz y al aumento de la esperanza de vida. En 2015, los tumores más frecuentemente diagnosticados en varones fueron los de próstata, zona colorrectal y pulmón, y en mujeres los de mama, zona colorrectal y útero.
En la actualidad, existe un número importante de estudios realizados en pacientes tratados mediante diferentes trasplantes de órgano sólido. El objetivo del presente estudio ha sido analizar las tasas de incidencia acumulada y las características de los tumores aparecidos de novo en pacientes que han recibido un TOH en nuestro medio y determinar su supervivencia tras el diagnóstico para valorar la necesidad de estrategias preventivas y diagnósticas tempranas específicas para esta población.
MétodosRealizamos un análisis retrospectivo de 1.071 pacientes adultos trasplantados hepáticos en nuestra institución, entre 1990 y 2015. Las variables analizadas incluyeron: edad, sexo del receptor, indicación primaria, fecha del trasplante, tipo de tumor, fecha de diagnóstico y fecha de último seguimiento obtenidas de la revisión de las historias clínicas de los receptores.
El protocolo de cribado de tumores previo al trasplante incluye en los candidatos: radiografía de tórax y ecografía abdominal (tomografía computarizada toracoabdominal si se encuentran alteraciones en las pruebas anteriores), endoscopia oral y colonoscopia en mayores de 50 años o pertenecientes a grupos de riesgo de carcinoma colorrectal, en mujeres se realiza mamografía y citología cervical.
En el seguimiento postrasplante el diagnóstico de tumor de novo se establece mediante el examen histológico de biopsias o muestras quirúrgicas del tumor, las lesiones precancerosas no se han incluido en el análisis. La fecha de la biopsia se designó como la fecha del diagnóstico del tumor de novo.
El tratamiento inmunosupresor en nuestro centro ha variado con los años, actualmente los pacientes siguen protocolo de inducción con tacrolimús, micofenolato mofetilo y corticoides, con retirada precoz de estos últimos. En aquellos pacientes con alto riesgo de disfunción renal se utiliza basiliximab con introducción retardada del anticalcineurínico, en trasplantados por hepatocarcinoma con criterios de mal pronóstico en el explante se realiza sustitución del anticalcineurínico por un inhibidor de mTOR.
Análisis estadísticosEl análisis estadístico se realizó utilizando el paquete de software SPSS, versión 15.0 (SPSS, Chicago, IL, EE. UU.) y R v.3.1.3 (R Development Core Team 2015). Los resultados de las variables categóricas se presentan como porcentajes, en las variables continuas como media (desviación estándar) si siguen una distribución normal y mediana (rango) según asimetría de la distribución .Las variables categóricas fueron analizadas con el test de la chi al cuadrado o F de Fisher, y la diferencia entre variables continuas mediante «t» de Student.
Las estimaciones de incidencia de tumores de novo se han calculado con el software R usando las librerías «survival» y «cmprsk», teniendo en cuenta como riesgo competitivo la muerte del paciente. Analizamos la supervivencia de los pacientes según la edad en el momento del trasplante, utilizando la mediana de edad de nuestra serie (54 años) como punto de corte entre ambos grupos. Las estimaciones de supervivencia se han calculado utilizando el método de Kaplan-Meier y la comparación entre los grupos con la prueba log-rank. Consideramos estadísticamente significativo un valor de p<0,05.
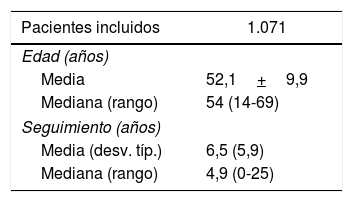
ResultadosSe diagnosticaron tumores de novo en 184 pacientes. La tabla 1 muestra las características clínicas y demográficas de los pacientes y en la tabla 2 se expone la distribución de los 189 tumores de novo desarrollados en 184 pacientes.
Características clínicas y demográficas de los pacientes trasplantados hepáticos
| Pacientes incluidos | 1.071 |
|---|---|
| Edad (años) | |
| Media | 52,1+9,9 |
| Mediana (rango) | 54 (14-69) |
| Seguimiento (años) | |
| Media (desv. típ.) | 6,5 (5,9) |
| Mediana (rango) | 4,9 (0-25) |
| Pacientes (%) | Tumores de novo (%) | |
|---|---|---|
| Sexo | ||
| Hombre | 811 (75,7) | 150 (18,5) |
| Mujer | 260 (24,3) | 34 (13,1) |
| Edad | ||
| <54 años | 524 (49) | 71 (13,5) |
| > 54 años | 547 (51) | 113 (20,6) |
| Indicación de trasplante | ||
| Cirrosis alcohólica | 434 (40,5) | 87 (20) |
| Cirrosis viral | 428 (39,9) | 65 (15,1) |
| VHC | 318 (29,7) | 40 (12,5) |
| VHB | 110 (10,2) | 25 (22,7) |
| Enfermedades colestásicas | 56 (5,2) | 10 (17,8) |
| EHNA | 15 (1,4) | 2 (13,3) |
| FHA | 22 (2) | 2 (9) |
| Otras | 117 (10,9) | 18 (15,4) |
| CHC | 237(22,1) | 14 (6,4) |
CHC: carcinoma hepatocelular; EHNA: esteatohepatitis no alcohólica; FHA: fallo hepático agudo; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
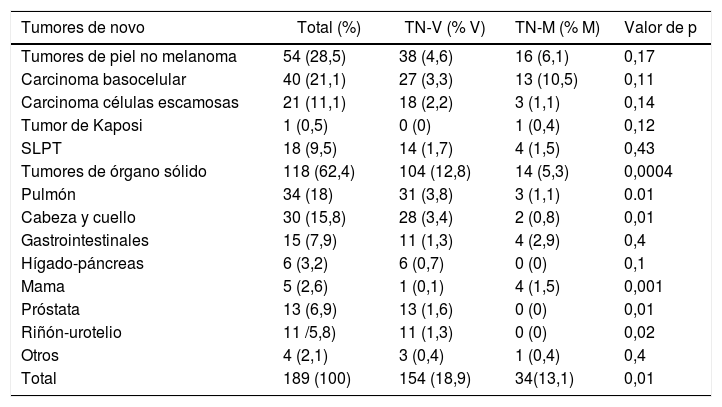
Distribución de los tumores de novo en el trasplante hepático
| Tumores de novo | Total (%) | TN-V (% V) | TN-M (% M) | Valor de p |
|---|---|---|---|---|
| Tumores de piel no melanoma | 54 (28,5) | 38 (4,6) | 16 (6,1) | 0,17 |
| Carcinoma basocelular | 40 (21,1) | 27 (3,3) | 13 (10,5) | 0,11 |
| Carcinoma células escamosas | 21 (11,1) | 18 (2,2) | 3 (1,1) | 0,14 |
| Tumor de Kaposi | 1 (0,5) | 0 (0) | 1 (0,4) | 0,12 |
| SLPT | 18 (9,5) | 14 (1,7) | 4 (1,5) | 0,43 |
| Tumores de órgano sólido | 118 (62,4) | 104 (12,8) | 14 (5,3) | 0,0004 |
| Pulmón | 34 (18) | 31 (3,8) | 3 (1,1) | 0.01 |
| Cabeza y cuello | 30 (15,8) | 28 (3,4) | 2 (0,8) | 0,01 |
| Gastrointestinales | 15 (7,9) | 11 (1,3) | 4 (2,9) | 0,4 |
| Hígado-páncreas | 6 (3,2) | 6 (0,7) | 0 (0) | 0,1 |
| Mama | 5 (2,6) | 1 (0,1) | 4 (1,5) | 0,001 |
| Próstata | 13 (6,9) | 13 (1,6) | 0 (0) | 0,01 |
| Riñón-urotelio | 11 /5,8) | 11 (1,3) | 0 (0) | 0,02 |
| Otros | 4 (2,1) | 3 (0,4) | 1 (0,4) | 0,4 |
| Total | 189 (100) | 154 (18,9) | 34(13,1) | 0,01 |
M: mujeres; SLPT: síndrome linfoproliferativo postrasplante; V: varones.
De forma general, los tumores de novo en el paciente trasplantado son más frecuentes en varones 18,5% vs. 13,1% en mujeres (p=0,004) y en los pacientes mayores de 54 años 20,6% vs. 13,5% (p=0,002). Con una mediana de seguimiento de 4,9 años, el análisis detallado de los distintos tumores muestra que los TPNM son la neoplasia más frecuente y que tanto en este tipo de tumor como en el SLPT no se encuentran diferencias con respecto al género, que sí se aprecian en los TOS.
La cirrosis alcohólica fue la indicación primaria de trasplante más frecuente en 434 pacientes (40,5%), identificándose en este grupo 87 pacientes con tumores de novo (20%): 61 (14%) con TOS (20 tumores de cabeza-cuello, 19 de pulmón y 6 de próstata), 20 con TPNM y 6 con SLPT.
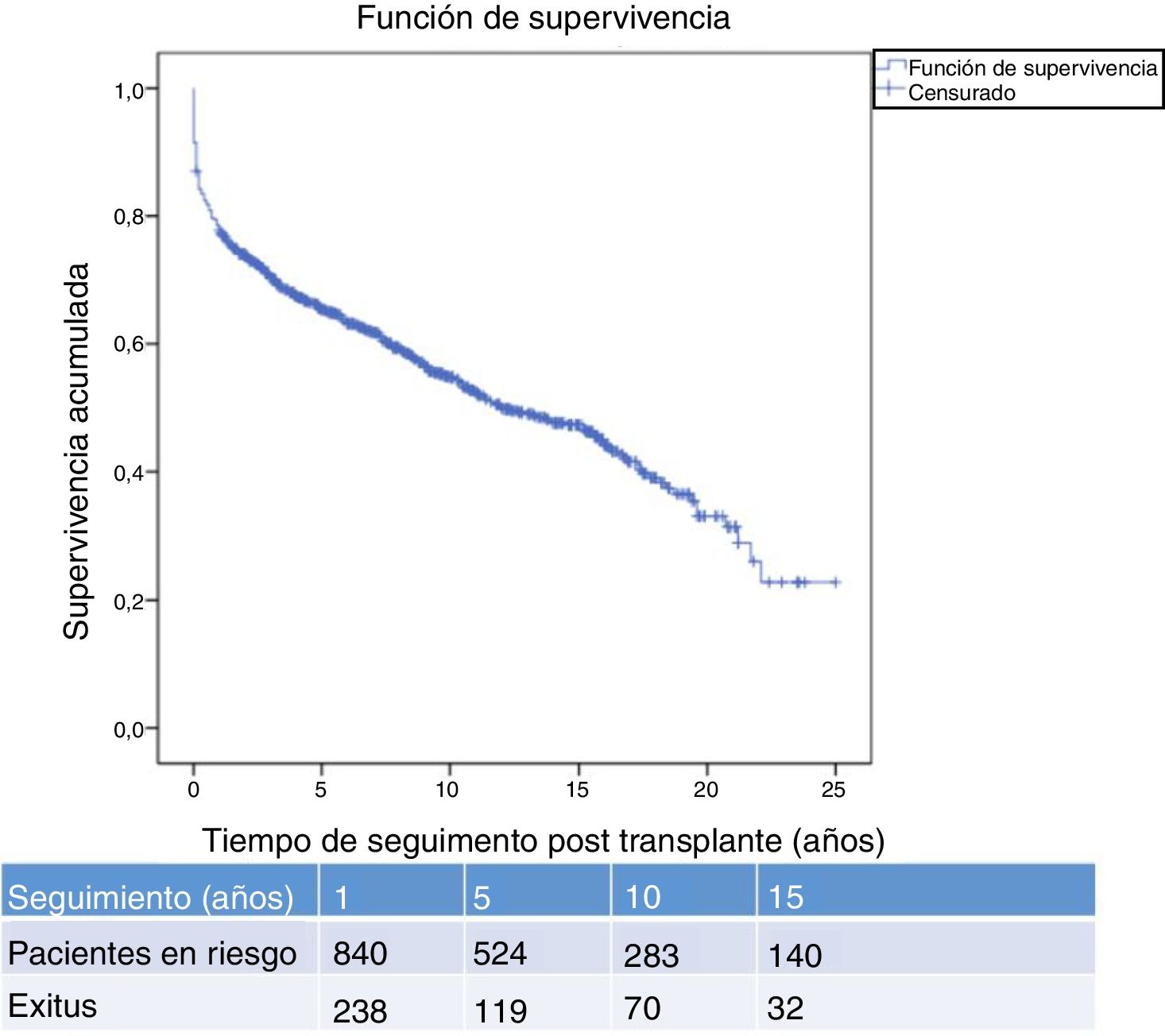
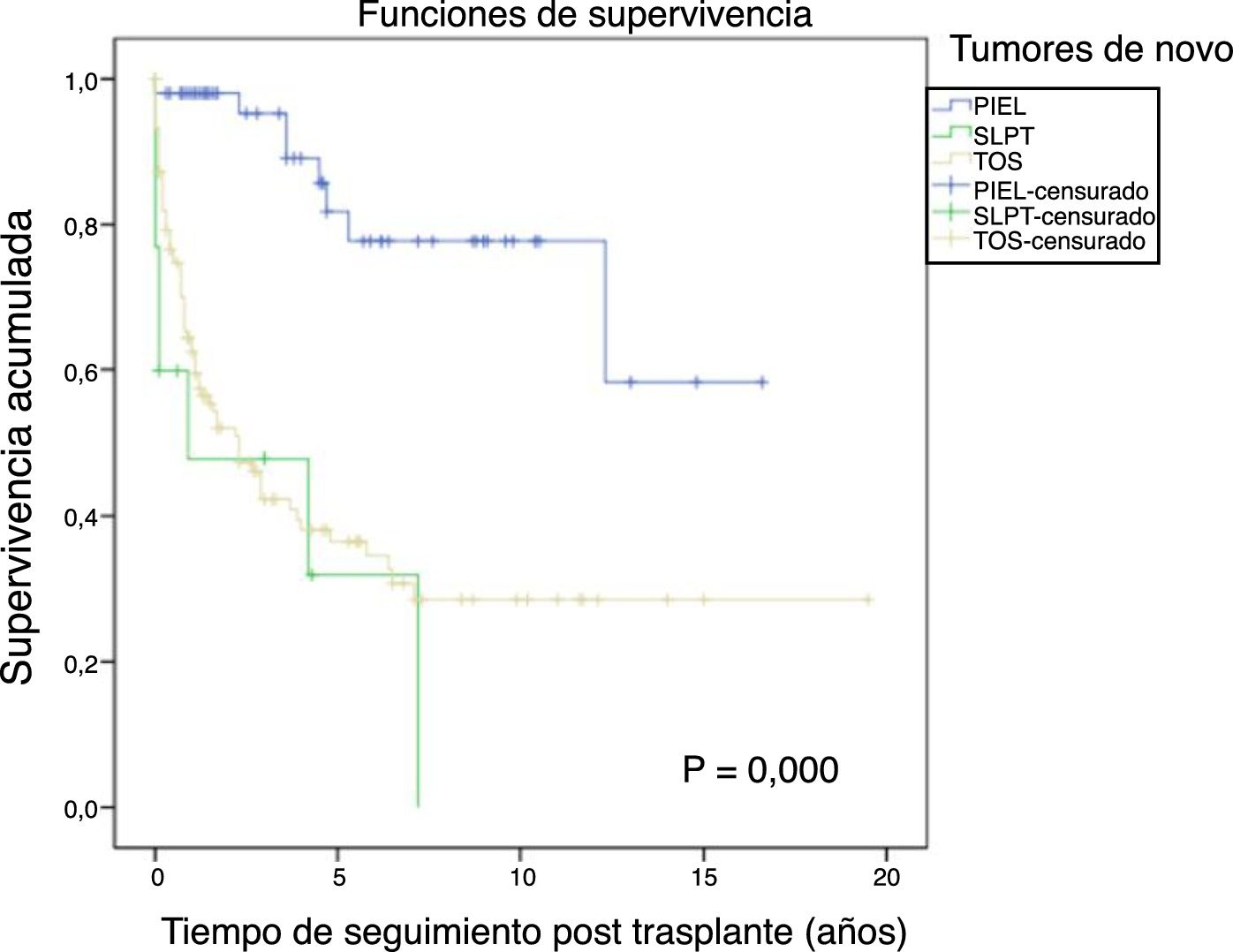
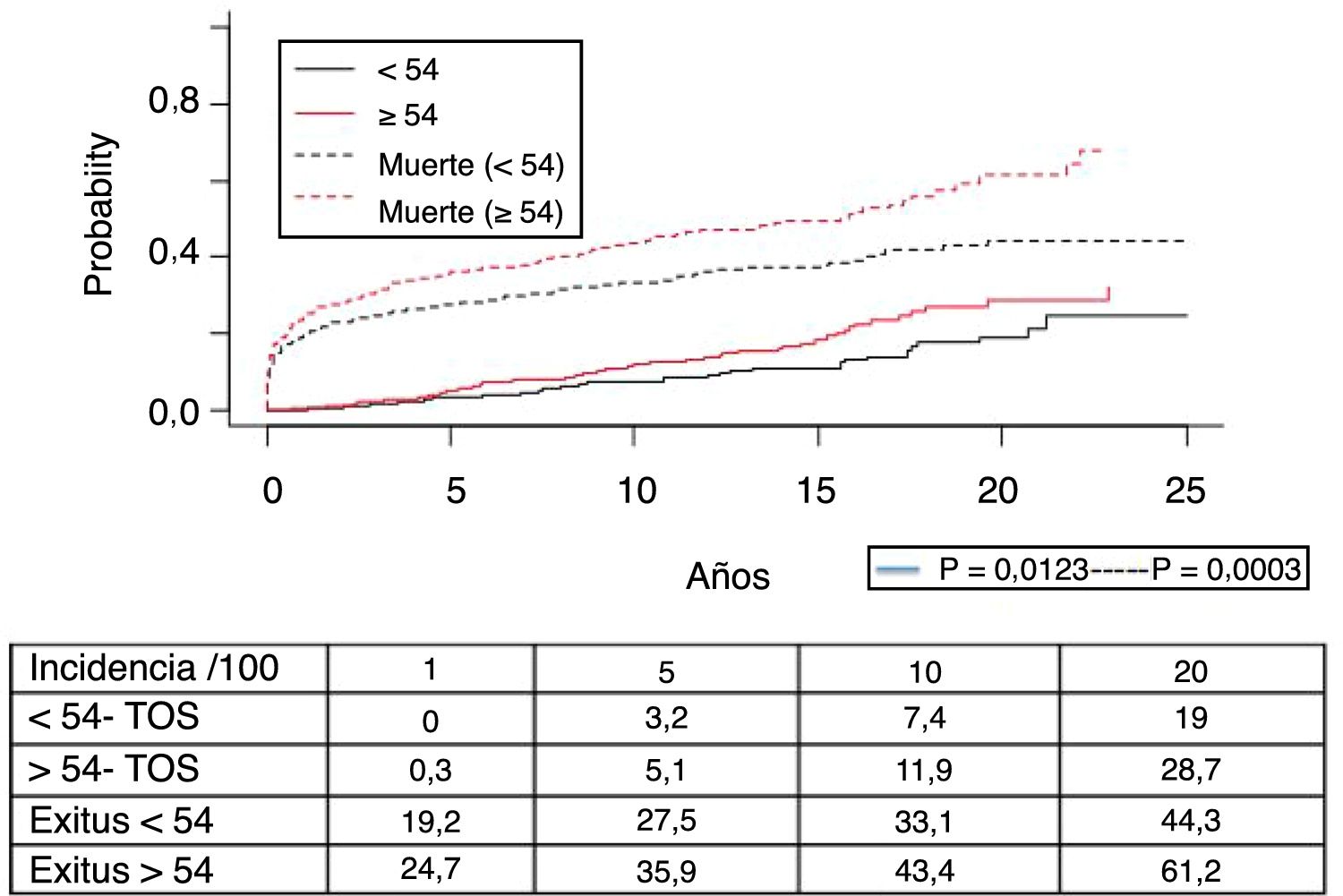
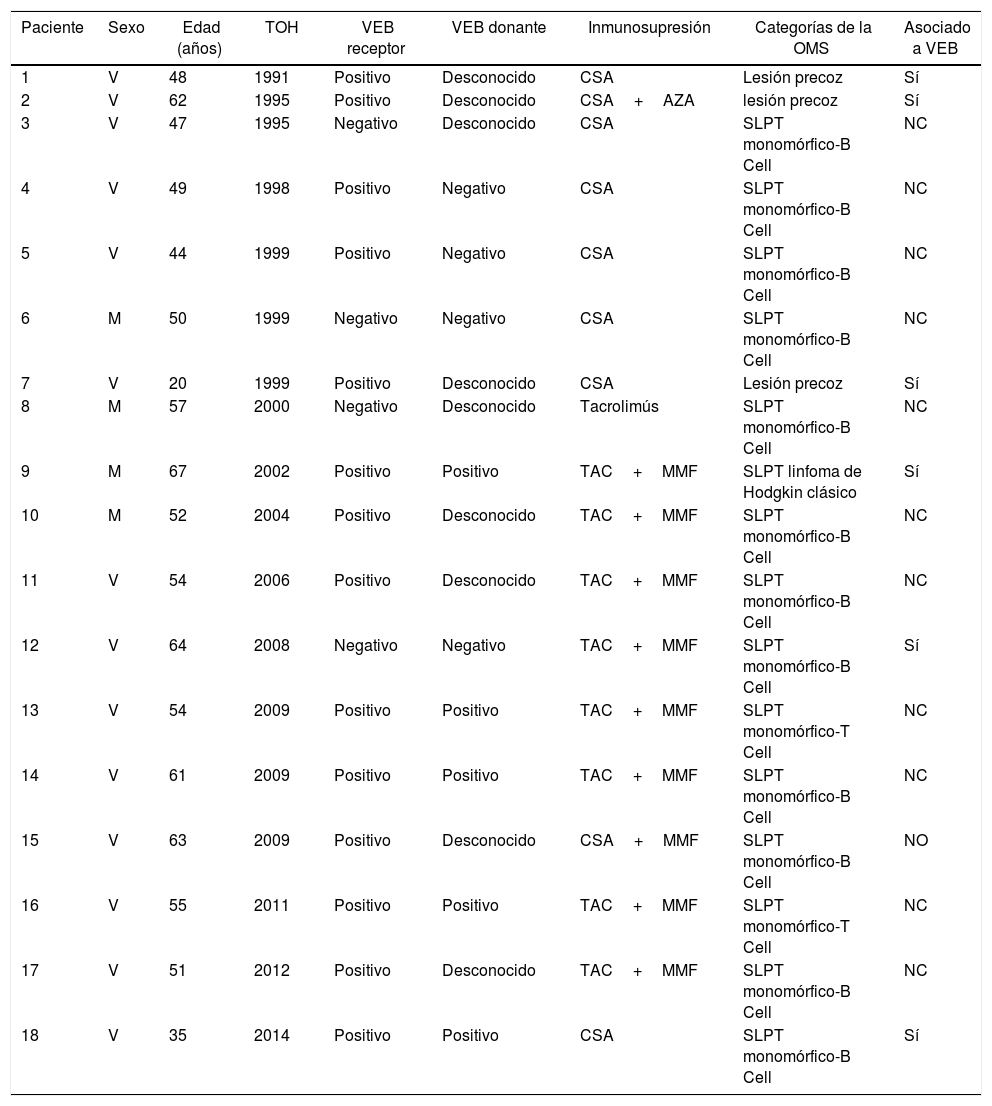
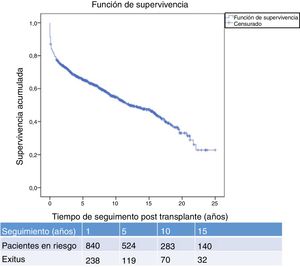
La figura 1 muestra la supervivencia de nuestra serie que se sitúa en el 77,8%, el 65,4% y el 54,8% a 1, 5 y 10 años postrasplante, respectivamente. La supervivencia fue menor en el grupo de pacientes mayores de 54 años (el 75%, el 61%, el 48% a 1, 5 y 10 años, respectivamente) sin encontrar diferencias estadísticamente significativas con respecto al grupo de pacientes menores de 54 años (el 81%, el 71%, el 62% a 1, 5 y 10 años, respectivamente). La supervivencia desde el diagnóstico varía según el tipo de tumor (TPNM, SLPT y TOS) (p=0,000). Como se aprecia en la figura 2, los pacientes con TPNM tuvieron significativamente mejor supervivencia que aquellos con SLPT o TOS.
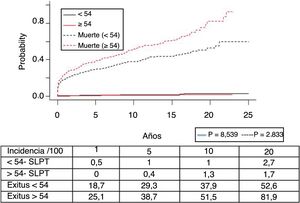
En la figura 3 se muestra que la incidencia de TPNM aumenta con los años de seguimiento y que existen diferencias entre los grupos de edad (p=0,0001). El cáncer de piel no melanoma se desarrolló en 54 pacientes (5%). En 31 pacientes el tipo fue el carcinoma basocelular, en 12 el carcinoma de células escamosas, en 9 pacientes se desarrollaron ambos tipos de tumores y en una paciente se identificó un tumor de Kaposi. La mediana del tiempo de diagnóstico fue de 7,9 años (0,3-15,4). La supervivencia desde el diagnóstico a 1, 5 y 10 años fue del 100%, el 83,1% y el 79%.
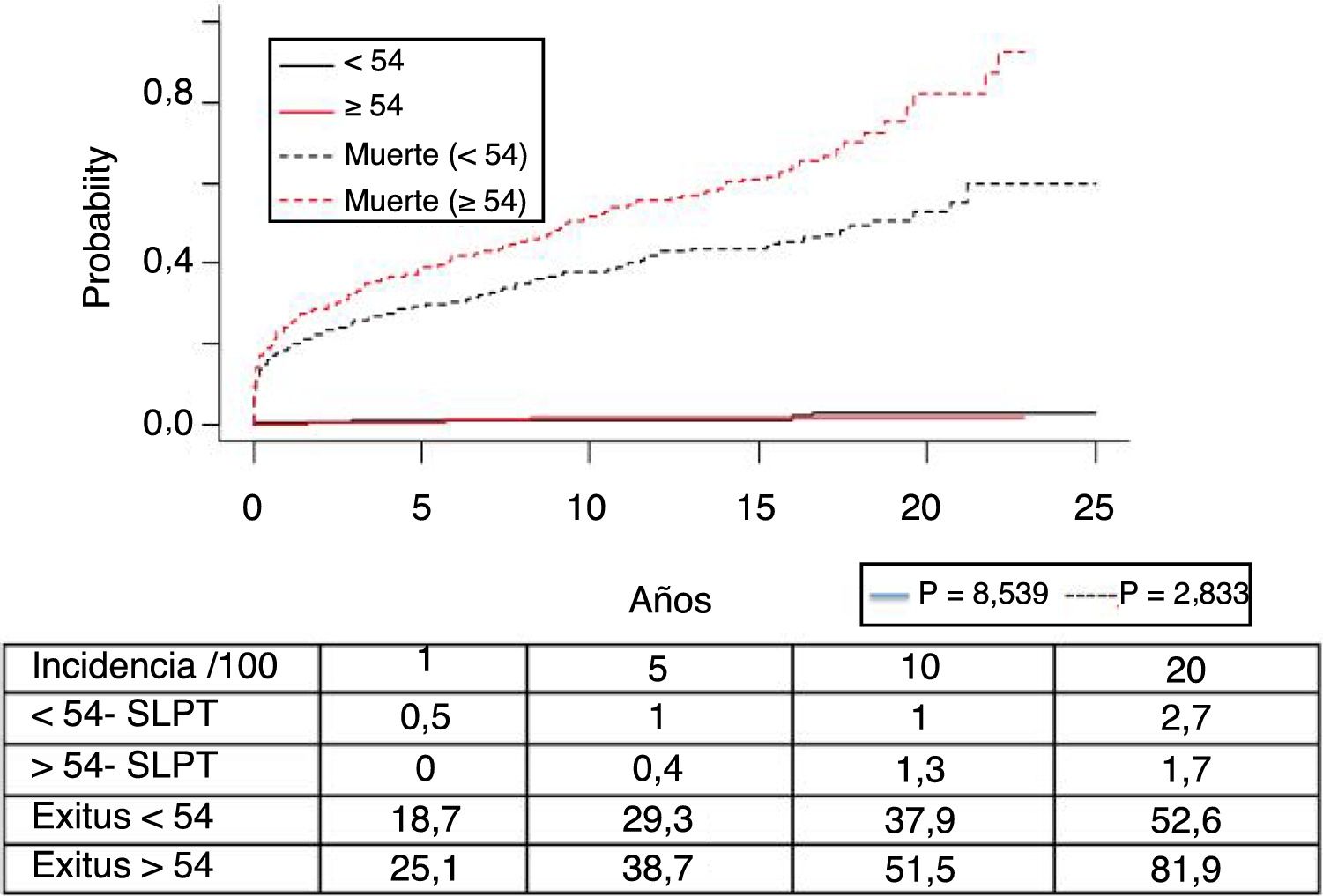
El síndrome linfoproliferativo postrasplante se diagnosticó en 18 pacientes con una edad media de los receptores de 52 años. Como muestra la figura 4, su incidencia aumenta con el tiempo de seguimiento, sobre todo en los pacientes más jóvenes pero sin alcanzar diferencias estadísticamente significativas. La mediana del tiempo de diagnóstico fue de 3,9 años (0,1-12,3). En la tabla 3 se exponen las características de los pacientes diagnosticados de SLPT, en 6 pacientes encontramos una asociación con el virus de Epstein-Barr (VEB), en 4 pacientes el SLPT se desarrolló en el primer año postrasplante. La supervivencia desde el diagnóstico a 1, 5 y 10 años fue del 63,8%, el 33% y el 16,8%, respectivamente.
Características de los pacientes con SLPT
| Paciente | Sexo | Edad (años) | TOH | VEB receptor | VEB donante | Inmunosupresión | Categorías de la OMS | Asociado a VEB |
|---|---|---|---|---|---|---|---|---|
| 1 | V | 48 | 1991 | Positivo | Desconocido | CSA | Lesión precoz | Sí |
| 2 | V | 62 | 1995 | Positivo | Desconocido | CSA+AZA | lesión precoz | Sí |
| 3 | V | 47 | 1995 | Negativo | Desconocido | CSA | SLPT monomórfico-B Cell | NC |
| 4 | V | 49 | 1998 | Positivo | Negativo | CSA | SLPT monomórfico-B Cell | NC |
| 5 | V | 44 | 1999 | Positivo | Negativo | CSA | SLPT monomórfico-B Cell | NC |
| 6 | M | 50 | 1999 | Negativo | Negativo | CSA | SLPT monomórfico-B Cell | NC |
| 7 | V | 20 | 1999 | Positivo | Desconocido | CSA | Lesión precoz | Sí |
| 8 | M | 57 | 2000 | Negativo | Desconocido | Tacrolimús | SLPT monomórfico-B Cell | NC |
| 9 | M | 67 | 2002 | Positivo | Positivo | TAC+MMF | SLPT linfoma de Hodgkin clásico | Sí |
| 10 | M | 52 | 2004 | Positivo | Desconocido | TAC+MMF | SLPT monomórfico-B Cell | NC |
| 11 | V | 54 | 2006 | Positivo | Desconocido | TAC+MMF | SLPT monomórfico-B Cell | NC |
| 12 | V | 64 | 2008 | Negativo | Negativo | TAC+MMF | SLPT monomórfico-B Cell | Sí |
| 13 | V | 54 | 2009 | Positivo | Positivo | TAC+MMF | SLPT monomórfico-T Cell | NC |
| 14 | V | 61 | 2009 | Positivo | Positivo | TAC+MMF | SLPT monomórfico-B Cell | NC |
| 15 | V | 63 | 2009 | Positivo | Desconocido | CSA+MMF | SLPT monomórfico-B Cell | NO |
| 16 | V | 55 | 2011 | Positivo | Positivo | TAC+MMF | SLPT monomórfico-T Cell | NC |
| 17 | V | 51 | 2012 | Positivo | Desconocido | TAC+MMF | SLPT monomórfico-B Cell | NC |
| 18 | V | 35 | 2014 | Positivo | Positivo | CSA | SLPT monomórfico-B Cell | Sí |
AZA: azatioprina; CSA: ciclosporina; M: mujer; MMF: micofenolato mofetilo; OMS: Organización Mundial de la Salud; SLPT: síndrome linfoproliferativo postrasplante; TAC: tacrólimus; TOH: trasplante hepático; V: varón; VEB: virus de Epstein-Barr.
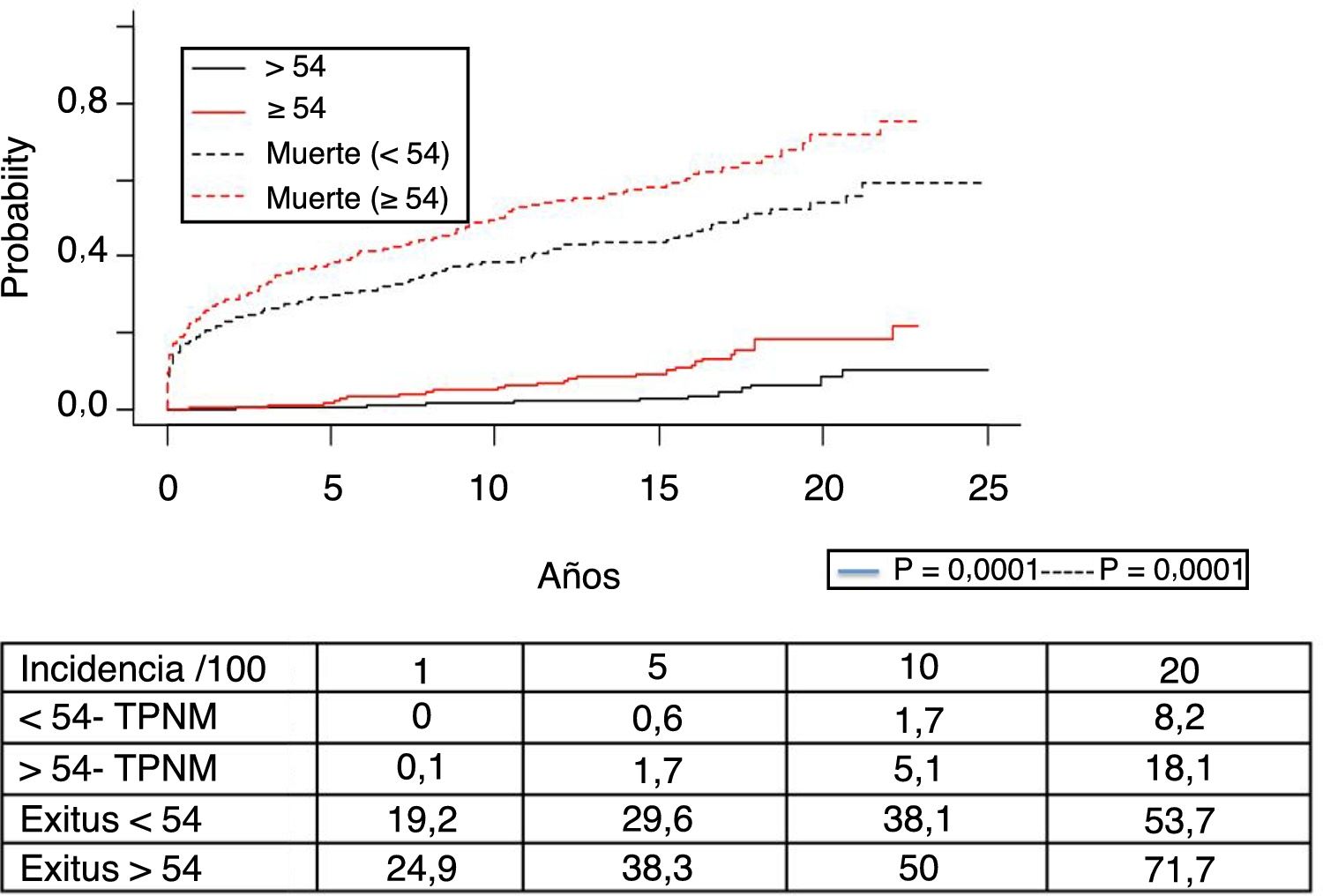
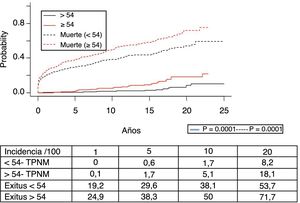
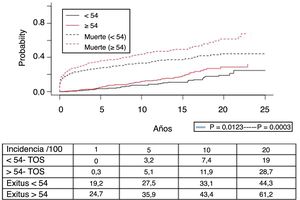
Los 118 tumores de novo de órgano sólido se desarrollaron en 115 pacientes (12%): 97 varones (13,3%) y 18 mujeres (7,7%) (p=0,0086). La mediana de tiempo de diagnóstico fue de 9,8 años (0,1-21). En la figura 5 se aprecia cómo la incidencia aumenta con el tiempo de seguimiento y es mayor en el grupo de pacientes mayores de 54 años (p=0,0001), alcanzando al 28% de los pacientes> 54 años con 20 años de seguimiento. La supervivencia desde el diagnóstico fue del 64,7%, el 34,9% y el 25,4% a 1, 5 y 10 años, respectivamente, encontrando diferencias en los distintos tipos de tumores diagnosticados (p=0,000).
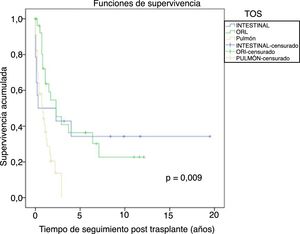
De los tumores de órgano sólido (TOS), los tumores de pulmón fueron los más frecuentes (29%), seguidos de los tumores de cabeza y cuello (25,6%), y los gastrointestinales (12%). La figura 6 muestra la supervivencia desde el diagnóstico tumoral de los TOS más frecuentes:
- Tumores de pulmón: la incidencia global fue del 3,1%, siendo mayor en varones que en mujeres, 3,8% vs. 1,1% (p=0,01), con una mediana de tiempo de diagnóstico de 6,3 años (0,7-21). La supervivencia a 5 años desde el trasplante fue del 64,7%. La supervivencia desde el diagnóstico a 1, 3 y 5 años fue del 44%, el 13,5% y el 0%, respectivamente.
- Tumores de cabeza y cuello: la incidencia de estos tumores fue mayor en varones que en mujeres, 3,4% vs. 0,8% (p=0,01), con una mediana de tiempo de diagnóstico 3,6 años (0,7-12,7). La supervivencia a 5 años desde el trasplante fue del 56,6%. La supervivencia desde el diagnóstico a 1, 3 y 5 años fue del 73,2, el 43,4% y el 34,7%, respectivamente.
- Tumores gastrointestinales: fueron diagnosticados en 15 pacientes sin encontrar diferencias respecto al sexo. El tipo histológico más frecuente fue el adenocarcinoma de colon en 5 pacientes (en ninguno la indicación primaria de TOH fue enfermedad CEP), seguido de 4 tumores gástricos, 3 esofágicos y un adenocarcinoma duodenal, con una mediana de tiempo de diagnóstico de 5,3 años (1,3-19,6). La supervivencia de estos pacientes a los 5 años del trasplante fue del 80%. La supervivencia tras el diagnóstico tumoral a 1, 3 y 5 años fue del 53,3%, el 40% y el 32%, respectivamente.
Otros tumores como el adenocarcinoma de próstata o el cáncer de mama tuvieron supervivencias a los 5 años tras el diagnóstico del 85,5% y el 60%, respectivamente.
DiscusiónLos datos de cáncer en España en 2015 publicados por la SEOM11 excluyen el cáncer de piel no melanoma y presentan una incidencia de 215,5 tumores por cada 100.000 habitantes. En nuestra serie se identificó a 132 pacientes con estos tumores de novo (12,3%) (excluidos los de piel no melanoma), lo que representa una incidencia de 1.889,1/100.000 trasplantados/año y la sitúa en 8,8 veces la de la población general.
Esta tasa de incidencia está entre las más altas reportadas en la literatura (2,2-26%)3,4. Las explicación de las discrepancias incluyen diferencias de tamaño de los estudios poblacionales y duración del seguimiento, ya que la probabilidad de desarrollar estos tumores malignos aumenta después de 5 años de seguimiento; por tanto, cualquier estudio con menos de 5 años de seguimiento subestima su incidencia12. La mediana de la duración del seguimiento en nuestra cohorte es comparable con otros informes, por lo que es probable que en nuestros resultados influyan otros factores implicados (la variación geográfica, el régimen inmunosupresor utilizado y los distintos métodos de identificación y notificación de tumores malignos de novo)13,14.
Aunque los factores de riesgo para el desarrollo de neoplasias malignas después del TOH no han sido totalmente elucidados, como en otros estudios15,16, en nuestro medio el género varón se asocia significativamente con un mayor riesgo de cáncer.
Coincidimos con la mayoría de los autores en que el cáncer de piel no melanoma constituye el tumor de novo más frecuente y que la supervivencia tras el diagnóstico no difiere de los pacientes trasplantados sin neoplasias4,17,18. Se incluyen en este grupo el cáncer de células escamosas (CCE), el cáncer de células basales (CCB) y el sarcoma de Kaposi. Aunque se ha comunicado que en los pacientes trasplantados parece invertirse la relación 4/1 del CCB/CCE de la población general19, en nuestro estudio predominan los CCB con una relación 2/1, igual que la encontrada en otras series nacionales4; no obstante, encontramos una mediana en el tiempo de diagnóstico desde el trasplante mayor (4,1 vs. 7,9 años). Esta diferencia puede deberse a la disminución de la incidencia de tumores de piel, sobre todo el CCE en trasplantados en las últimas décadas20. En nuestro medio, estos tumores siguen siendo los más frecuentes y no están exentos de un comportamiento agresivo, sus principales factores de riesgo conocidos (radiación UV, la inmunosupresión crónica y la edad avanzada) son comunes en la mayoría de los pacientes, por lo que las estrategias para evitar su aparición van encaminadas a transmitir una adecuada sensibilización y utilización de protección solar, así como una revisión periódica por dermatología de aquellos pacientes con sospecha de lesión o antecedente personal de cáncer cutáneo epitelial.
Los tumores de novo, excluidos los de piel no melanoma, constituyen la mayor causa de mortalidad de los pacientes trasplantados por hepatopatía alcohólica21. En nuestro medio esta fue la indicación primaria más frecuente y los tumores de novo, excluidos los de piel, se desarrollaron en el 15% de estos pacientes, correspondiéndose más del 50% con tumores aerodigestivos. El alcohol y su relación con los antecedentes de consumo tabáquico han sido descrito previamente como los principales factores de riesgo22-24.
La seronegatividad del VEB del receptor y la incompatibilidad con la serología del donante es el principal factor de riesgo para el SLPT, que incluye un amplio espectro de trastornos linfoproliferativos. En nuestro medio, Govantes et al.25 identificaron 60 SLPT en 5.775 trasplantados renales del registro andaluz SICATA (1990-2009), con una mediana de tiempo de diagnóstico de 5,9 años. En nuestro estudio, se han identificado 18 SLPT en 1.071 pacientes, con una mediana de tiempo de diagnóstico inferior, lo que contrasta con series donde la tasa de SLPT en el trasplantado hepático es inferior a la de otros receptores de órganos sólidos26, aunque acorde con datos recientes que indican que los pacientes trasplantados hepáticos tienen un mayor riesgo de SLPT en comparación con los receptores de trasplante renal6,27. Hipotéticamente, la presencia de tejidos linfoides en el injerto hepático podría ser el factor contribuyente28. Tuvimos pocos casos de SLPT asociado a VEB pero la sensibilidad del diagnóstico de VEB ha cambiado durante el tiempo del estudio, por lo que podríamos haber subestimado la incidencia real.
Dentro de los TOS, la incidencia de cáncer de pulmón varía según las series (0-19%)3,4. En nuestra serie, el cáncer de pulmón se identificó en 34 pacientes, siendo el TOS más frecuente (29%). Esta incidencia es superior a la encontrada en recientes publicaciones8 de registros multicéntricos en los que establecen el incremento de este tipo de tumor en los últimos años y diferencias según los países incluidos (cabe mencionar que identifican 30 tumores de pulmón en 4.246 trasplantes hepáticos). La importancia de este dato viene dada por que la supervivencia de los pacientes trasplantados diagnosticados con tumores de pulmón es escasa, por lo que las estrategias para reducir el riesgo de estas neoplasias y facilitar su detección temprana son de suma importancia.
Para finalizar, no hemos encontrado una mayor incidencia de tumores de colon en trasplantados por CEP, tal y como ha sido descrito8,17. Nuestra política de detección pretrasplante no ha cambiado durante el período de estudio e incluye una colonoscopia para aquellos sujetos mayores de 50 años de edad o con antecedentes de riesgo de cáncer colorrectal. Nuestros datos no apoyan la consideración de un cribado de cáncer de colon más frecuente tras el trasplante que el recomendado para la población general.
En conclusión, este estudio confirma que los pacientes con tumores de novo de órgano sólido postrasplante presentan una menor supervivencia tras el diagnóstico que los pacientes con tumores de piel no melanomas o sin tumores postrasplante. Nuestros resultados difieren de otros informes publicados, encontrando una alta incidencia de neoplasias de pulmón, con mal pronóstico y supervivencia escasa, por lo que creemos están justificadas las estrategias preventivas y protocolos de detección precoz, especialmente en poblaciones con mayor riesgo, para detectar tumores de novo en una etapa temprana y potencialmente curativa.
Las limitaciones de este estudio incluyen: el diseño retrospectivo, unicéntrico, donde los datos sobre los factores de riesgo y la incidencia de cáncer en nuestra población general no han podido ser validados, como referencia hemos utilizado los datos nacionales aportados por la SEOM11.
AutoríaCarmen Bernal Bellido: disen¿o del estudio, adquisicio¿n y recogida de datos, análisis e interpretacio¿n de los resultados, redaccio¿n del arti¿culo y aprobacio¿n de la versio¿n final.
José María Álamo Martínez: adquisición y recogida de datos y análisis e interpretación de los resultados, revisión crítica.
Gonzalo Suárez Artacho, Luis Miguel Marín Gómez, Carmen Cepeda Franco y Lydia Barrera Pulido: adquisicio¿n y recogida de datos, revisión crítica.
Javier Padillo Ruiz y Miguel Ángel Gómez Bravo: revisio¿n cri¿tica y aprobacio¿n de la versio¿n final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.