El melanoma asienta mayoritariamente en piel y ojo, seguido de la región anorrectal. En el recto, los melanocitos se localizan en la zona de transición y en la región escamosa1. El melanoma primario anorrectal es altamente maligno, con gran capacidad metastásica; sus síntomas son silentes y a veces no visibles, puesto que pueden ser amelanocíticos2. Representa el 0,3-3% de los melanomas1 y el 1-3% de los tumores anorrectales1,2.
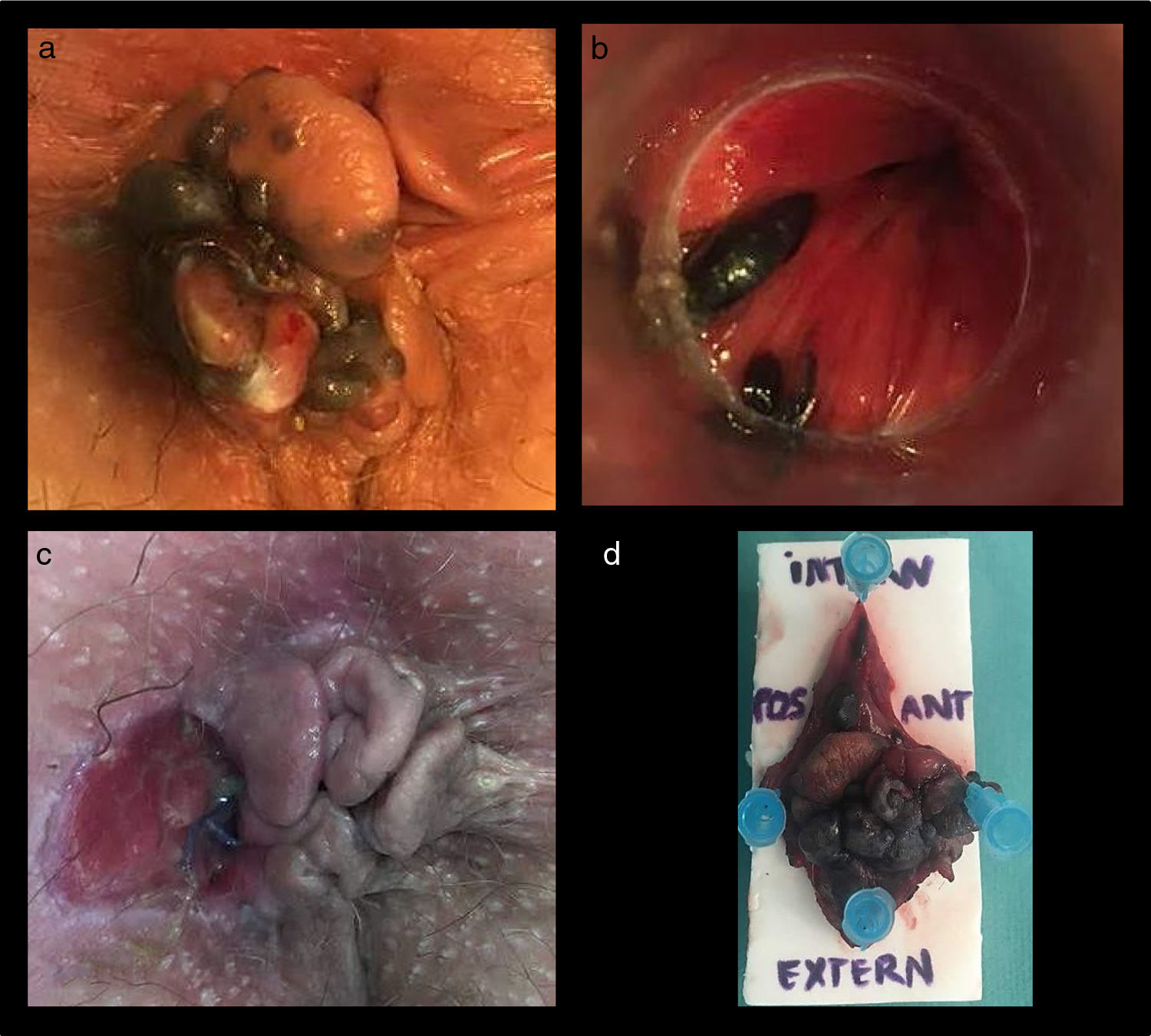
Presentamos el caso de una paciente de 69años con antecedentes de neoplasia vaginal intraepitelial tipo VINIII intervenida mediante resección local en 2015 y libre de enfermedad dos años después. En el último control aparecen tags cutáneos perianales con un área de coloración negruzca en su interior sospechosa de melanoma anal (fig. 1a). En la anuscopia se aprecian dos lesiones mucosas pigmentadas en el canal anal, predominantemente en el cuadrante anterior izquierdo (fig. 1b). La biopsia informa de melanoma maligno. Se realiza estudio de extensión con resonancia magnética (RM) rectal, tomografía computarizada (TC) toracoabdominopélvica y colonoscopia completa, objetivándose neoformación pseudonodular perianal izquierda, de 30×16×13mm, sin evidencia de diseminación a distancia ni de afectación esfinteriana.
Se realiza escisión local (fig. 1c,d) en bloque de la zona afectada.
El informe anatomopatológico concluye melanoma maligno de canal anal infiltrante de tejido perirrectal con márgenes libres pT3NxMx, siendo los márgenes quirúrgicos de resección adecuados superiores a 1cm.
Tras la intervención la paciente comienza un protocolo clínico de seguimiento de alto riesgo con visita en consultas cada 3meses; en el primer PET-TC se objetiva una adenopatía inguinal izquierda que es biopsiada y resulta metástasis de melanoma anal. Entra en ensayo clínico para tratamiento mediante inmunoterapia, nivolumab combinado con BMS-986016 (anti-LAG-3).
La evolución inicial es favorable, con regresión casi completa de la adenopatía en las dos primeras TC de seguimiento realizadas. Tras 17meses de control presenta paraplejia de miembros inferiores, por lo que se realiza RM medular, con hallazgo de carcinomatosis leptomeníngea, una forma excepcional de recidiva a distancia de esta enfermedad. Se inician cuidados paliativos, falleciendo a los 18meses tras la intervención.
El 1,2% de los melanomas asientan en mucosas, y de estos, menos del 25% son anorrectales3. El melanoma anal es una enfermedad muy agresiva dado su mal pronóstico, considerándose una enfermedad sistémica.
Sus síntomas son inespecíficos, la mayoría en forma de rectorragia, tenesmo y cambios en el ritmo deposicional1. Afecta igual a hombres y mujeres y se presenta más frecuentemente en torno la quinta-sexta década de la vida, mayoritariamente en población caucásica1,4. Hasta el 60% de los pacientes presentan metástasis al diagnóstico, habitualmente limitadas a los ganglios linfáticos regionales. Pueden metastatizar a hígado, pulmones2 y sistema nervioso central, siendo la tercera causa más frecuente de carcinomatosis meníngea, por detrás del cáncer de mama y de pulmón.
Se considera una patología distinta al melanoma cutáneo4, con una clasificación específica y un tratamiento controvertido. Así como el melanoma cutáneo sobreviene por una transformación maligna de los melanocitos expuestos a radiación ultravioleta, que actúa como estímulo carcinogénico, la etiopatogenia del melanoma anal no está bien establecida1. Se sugiere que los pacientes con VPH y VIH tienen mayor riesgo de padecer esta enfermedad debido al papel de la inmunología en el desarrollo del melanoma anal1,4.
Existen dos métodos de estadificación específicos para el melanoma anorrectal3,5: el de la American Joint Commission on Cancer Staging for Anorrectal Melanoma1,6, que tiene en cuenta tanto la extensión de la lesión como la profundidad (tabla 1), y el basado solo en la extensión (estadio 1: localizado; estadio 2: afectación de nódulos linfáticos regionales; estadio 3: enfermedad metastásica)1,3.
Estadificación de la American Joint Commission on Cancer Staging System for Anorectal Melanoma1,8
| Estadio | Extensión | Profundidad (mm) |
|---|---|---|
| IA | Localizado | 0,75 |
| IB | Localizado | 0,76-1,5 |
| IIA | Localizado | 1,5-4,0 |
| IIB | Localizado | > 4,0 |
| III | Nódulos linfáticos regionales | − |
| IV | Metástasis a distancia | − |
Su tratamiento se basa en la cirugía, y está en discusión cuál es la forma de tratamiento ideal: la amputación abdominoperineal (AAP) vs la escisión local con márgenes de seguridad (1cm se considera suficiente cuando el espesor de la lesión no supera 1mm; en caso contrario se plantea la ampliación de márgenes hasta 2cm)4.
Desafortunadamente, no existen estudios aleatorizados controlados para evaluar las diferencias entre la AAP y la escisión local. No obstante, muchos estudios afirman que, a pesar de su radicalidad y del mejor control local de la enfermedad, la AAP no ha demostrado aumentar la supervivencia de los pacientes7 y, por el contrario, aumenta la comorbilidad asociada a la cirugía, empeorando la calidad de vida de estos2. La AAP será el tratamiento de elección cuando exista afectación esfinteriana.
La adyuvancia con radioterapia (incluyendo ambas cadenas ganglionares iliacas e inguinales), quimioterapia e inmunoterapia sigue siendo controvertida, ya que puede aumentar el tiempo libre de enfermedad, pero no la supervivencia global7,8. Sin embargo, según un trabajo reciente, parece que lo más efectivo es la combinación de cirugía y radioterapia en caso de enfermedad no diseminada9,10.
Lamentablemente, cuando la enfermedad disemina el pronóstico es muy pobre, con supervivencias del 0% a los 5años5 y medianas de supervivencia de 5-7meses a 18meses sin metástasis al diagnóstico2. El campo de la inmunoterapia parece prometedor pero está todavía en el terreno de la investigación. Los fármacos en ensayo son en su mayoría inhibidores de c-kit.