La fuga anastomótica (FA) es una complicación seria en cirugía colorrectal, dado que conlleva un aumento de la morbimortalidad. El objetivo de este estudio prospectivo no aleatorizado es determinar si la proteína C reactiva (PCR) es útil como predictor de FA en pacientes intervenidos por vía laparoscópica versus cirugía abierta.
MétodosSe incluyeron 168 pacientes intervenidos de manera electiva por enfermedad colorrectal. La PCR fue medida diariamente en los 5 primeros días del postoperatorio. Se analizaron las complicaciones y, especialmente, la FA.
ResultadosPresentaron complicaciones 32 (45,7%) pacientes del abordaje abierto, 15 (18,7%) del laparoscópico y 12 (29,4%) en el grupo de convertidos a cirugía abierta (p = 0,002). Desarrollaron FA 9 pacientes del abordaje abierto, 5 de los del laparoscópico y ninguno del grupo que hubo que convertir (p = 0,15). Hubo diferencias estadísticamente significativas de los valores de PCR entre los 3 grupos (p = 0,03).
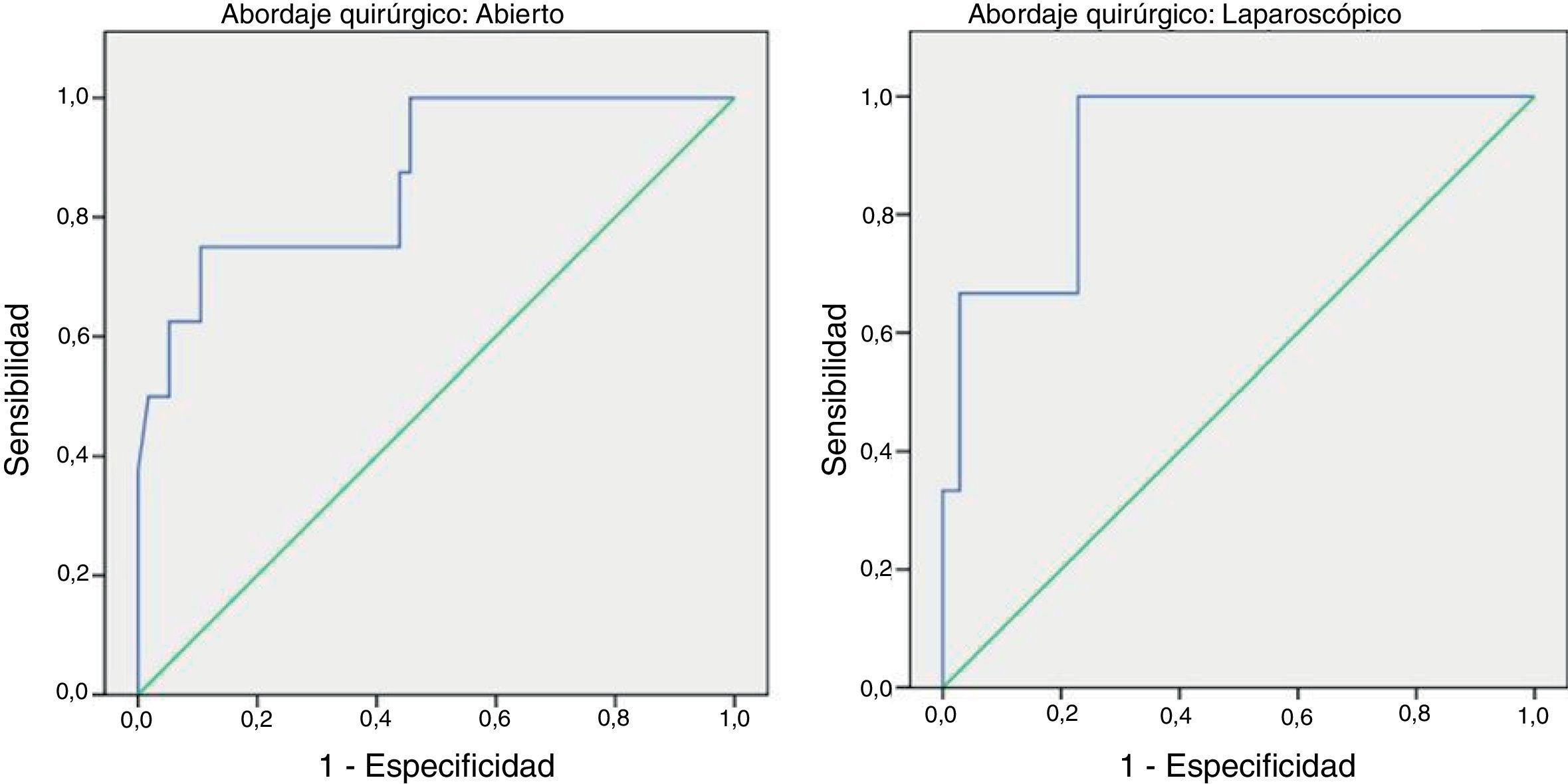
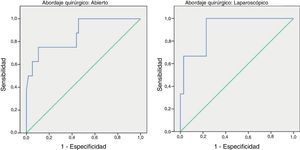
Las curvas ROC mostraron un área bajo la curva (ABC) en el día 3 para el abordaje abierto y laparoscópico de 0,731 y 0,760, respectivamente. En el día 4 obtuvimos un ABC de 0,867 en el abierto y de 0,914 en el laparoscópico.
Los puntos de corte en el día 4 fueron: en abierto 159,2mg/L; sensibilidad 75%, especificidad 89% y valor predictivo negativo (VPN) de 96% (p < 0,001). En el laparoscópico fue de 67,3mg/L; sensibilidad 100%, especificidad 89,5% y VPN de 100% (p = 0,016).
ConclusionesLa PCR en el cuarto día postoperatorio es útil para diagnosticar FA; se deben tener en cuenta los diferentes puntos de corte en función del abordaje quirúrgico utilizado.
Anastomotic leak (AL) is a serious complication in colorectal surgery due to its increase in morbidity and mortality. The aim of this prospective non-randomised study is to determine whether C-reactive Protein (CRP) is useful as a predictor of AL in patients undergoing open versus laparoscopic surgery.
MethodsA total of 168 patients undergoing elective colorectal surgery were included. CRP was measured daily during the first 5postoperative days. Complications, specially AL, were analysed.
ResultsFollowing an open approach 32 patients (45.7%) presented complications, 15 (18.7%) in the laparoscopic group and 12 (29.4%) in the converted group (P=0.153). Following open surgery 9 patients experienced AL, 5 were detected in the laparoscopic group and none in those converted (P=0.153). There were significant differences in CRP values between the 3 groups (P=0.03). ROC Curves showed AUC for the open and laparoscopic approach of 0.731 and 0.760 respectively. On day 4 the AUC was 0.867 for the open group and 0.914 for the laparoscopic group.
Cut-off points on day 4 were: Open: 159.2mg/L; sensitivity 75%, specificity 89% and NPP 96% (P<0.001). Following laparoscopic surgery the cut-off point was 67.3%; sensitivity 100%, specificity 89.5% and NPP 100% (P=0.016).
ConclusionCRP on day 4 is useful to diagnose AL. Different cut-off values should be taken into account depending on the approach used.
La incidencia de fuga anastomótica (FA) en cirugía colorrectal es muy variable: se describe en diferentes estudios entre un 1 y un 28%1,2. No cabe la menor duda de que se trata de una complicación muy grave que conlleva una no despreciable mortalidad, morbilidad, aumento de la estancia hospitalaria y que frecuentemente requiere de un estoma con consecuencias funcionales relevantes3,4. Además, tiene importantes implicaciones en pacientes oncológicos, dado que se ha objetivado un aumento en la recidiva local en estos enfermos5.
Un diagnóstico temprano es muy importante para poder iniciar precozmente un tratamiento. Se ha observado que el retraso en su inicio aumenta de manera importante las complicaciones sépticas6.
En algunas ocasiones la clínica y pruebas complementarias no nos orientan de forma adecuada hacia su diagnóstico, o lo hacen de manera tardía. Aunque la tomografía computarizada sigue siendo la prueba diagnóstica más utilizada cuando se sospecha una FA, una revisión sistemática reciente concluye que al analizar su utilidad en cirugía de colon y recto tiene una sensibilidad de tan solo un 68%7. La proteína C reactiva (PCR) es una proteína de fase aguda sintetizada en el hígado y que es liberada a la sangre como respuesta de la estimulación de citocinas inflamatorias. Cuando el estímulo para su producción cesa, se produce un descenso rápido de sus niveles. Su vida media es de 19 h8. La PCR ha sido estudiada como un marcador biológico para diagnóstico precoz de FA en cirugía colorrectal y es útil para descartarla9-12. Este hecho parece que es claro en los pacientes a los que se les realiza una cirugía abierta, sin embargo, en los pacientes intervenidos mediante un abordaje laparoscópico y, a priori, con una menor respuesta inmunitaria13 cabría esperar unos valores de PCR menores que en cirugía abierta: existe controversia a este respecto en los diferentes trabajos publicados14.
Por todo lo anterior, planteamos un estudio cuyo objetivo es ver si la PCR predice la FA de igual manera en cirugía abierta y en cirugía laparoscópica.
MétodosEstudio prospectivo unicéntrico no aletorizado en el que hemos incluido a 168 pacientes intervenidos de manera electiva por enfermedad colorrectal, con anastomosis primaria y a los que se les realiza tanto un abordaje abierto como laparoscópico. El estudio fue aprobado por el Comité Ético del hospital y todos los pacientes firmaron un consentimiento informado.
Los criterios de exclusión fueron: edad menor de 18 años, cirugía urgente, existencia de una infección activa en el momento de la cirugía, la realización de un estoma de protección o que el paciente no firmase el consentimiento informado. Los pacientes con estoma se excluyeron para evitar un sesgo de selección, debido a que, aunque el estoma de protección no evita la FA, sí disminuye la sintomatología.
Los pacientes se dividieron en 3 grupos: cirugía abierta, cirugía laparoscópica y laparoscopia convertida a cirugía abierta. La laparoscopia convertida no se incluyó en el grupo de cirugía abierta para evitar un posible sesgo de selección.
Además de los datos demográficos, fueron recogidos otros factores de riesgo como la edad, sexo, índice de masa corporal (IMC), existencia de comorbilidades: hipertensión arterial, diabetes mellitus, insuficiencia renal crónica, enfermedad pulmonar obstructiva crónica, infarto agudo de miocardio o cardiopatía y cirrosis, hábitos tóxicos (alcohol y tabaco), la escala de la Asociación Americana de Anestesia (ASA), el uso de corticoides, inmunosupresores o anticoagulantes, la necesidad de transfusión perioperatoria, neoadyuvancia, la indicación de la cirugía, el procedimiento quirúrgico realizado, intención de la cirugía, existencia de metástasis al diagnóstico, técnica quirúrgica, abordaje quirúrgico, tipo de anastomosis, complicaciones durante la cirugía, tiempo operatorio, uso de drenajes, distancia al margen anal y estadio tumoral.
Definimos la FA como la existencia de una peritonitis en una reintervención, salida de contenido fecaloideo a través de algún drenaje o de la herida quirúrgica, extravasación de contraste cuando se realiza un enema o la presencia de aire o colección en una zona próxima a la anastomosis evidenciada en una tomografía computarizada. La FA menor (Clavien-Dindo I-II) se definió como aquella que no requiere ninguna intervención terapéutica y como mayor (Clavien-Dindo III-V) aquella que precisó de un drenaje percutáneo o de una reintervención10.
Los pacientes se evaluaron diariamente tras la cirugía recogiendo la temperatura, la exploración abdominal, la existencia de movimientos intestinales y el aspecto del drenaje en caso de que el paciente lo tuviese. Se realizó una analítica a las 8:00 a. m. que incluía leucocitos, neutrófilos, PCR, hemoglobina y hematocrito. La PCR fue medida los primeros 5 días del postoperatorio inmediato mediante inmunoanálisis colorimétrico. (Dimenson RXL, Siemens).
A todos los pacientes se les realizó un seguimiento hasta los 30 días del postoperatorio.
Análisis estadísticoLos datos obtenidos fueron analizados mediante el programa SPSS versión 20.0.0 (IBM corporation, Chicago, IL, EE. UU.). Se realizó un análisis descriptivo de las características de los pacientes usando medidas de tendencia central y de dispersión (media y desviación estándar [DE]) para las variables continuas y de distribución de frecuencias para las cualitativas. La incidencia se calculó con su respectivo intervalo de confianza del 95% (IC 95%). Se realizó un análisis bivariado para ver las diferencias entre pacientes usando la Chi cuadrado o el test de Fisher para variables independientes. Se usó el test de U de Mann-Whitney para variables cuantitativas independientes con comparación de 2grupos y la prueba de Kruskal-Wallis para comparación de 3grupos.
Para determinar la capacidad pronóstica de la PCR en la detección de FA se realizaron curvas ROC, describiendo el área bajo la curva (ABC) con su correspondiente IC 95%. Se determinaron los mejores puntos de corte mediante el índice de Youden, presentando los indicadores clásicos de pruebas diagnósticas: sensibilidad, especificidad y valor predictivo negativo (VPN). Se consideró estadísticamente significativo un valor de p < 0,05.
ResultadosSe intervinieron 168 pacientes con una edad media de 63 ± 17 años (73 mujeres). En 71 se practicó un abordaje abierto y en 97 laparoscópico, de los cuales hubo que convertir a cirugía abierta a 17 pacientes.
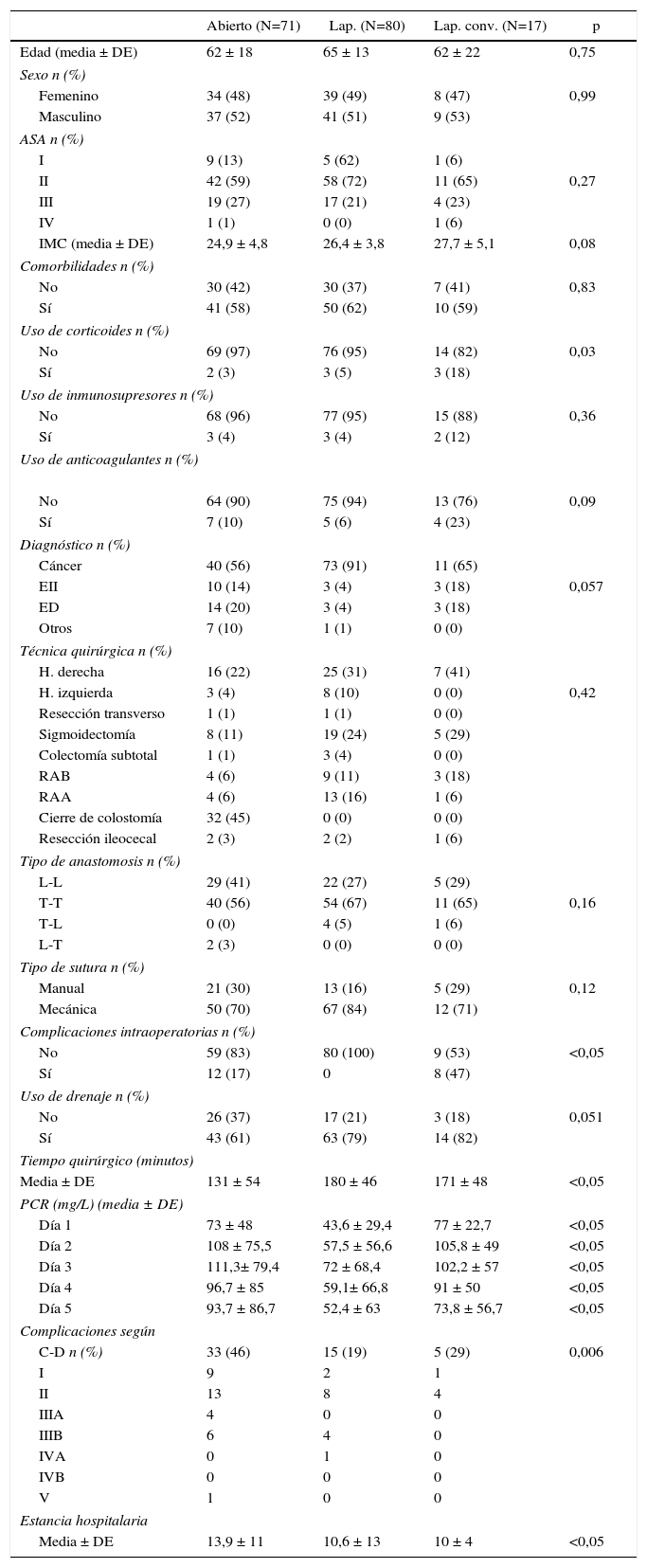
Se realizó un análisis bivariado para contrastar diferencias de variables entre los 3 abordajes quirúrgicos. Respecto a los datos demográficos (edad, sexo, ASA, IMC, comorbilidades, uso de corticoides, inmunosupresores, anticoagulantes y dolencia intervenida) no hubo diferencias estadísticamente significativas entre los 3 grupos. Las únicas diferencias encontradas entre los 3 grupos fueron un tiempo quirúrgico superior en el grupo laparoscópico (p = 0,032), una mayor estancia hospitalaria (p = 0,021) y mayor número de complicaciones en el grupo abierto, mayor índice de complicaciones intraoperatorias en el grupo de laparoscopia convertida (p = 0,006) y diferencias en los valores de PCR durante los 5 días del postoperatorio (tabla 1).
Características demográficas, de la intervención quirúrgica y postoperatoria de los pacientes intervenidos
| Abierto (N=71) | Lap. (N=80) | Lap. conv. (N=17) | p | |
|---|---|---|---|---|
| Edad (media ± DE) | 62 ± 18 | 65 ± 13 | 62 ± 22 | 0,75 |
| Sexo n (%) | ||||
| Femenino | 34 (48) | 39 (49) | 8 (47) | 0,99 |
| Masculino | 37 (52) | 41 (51) | 9 (53) | |
| ASA n (%) | ||||
| I | 9 (13) | 5 (62) | 1 (6) | |
| II | 42 (59) | 58 (72) | 11 (65) | 0,27 |
| III | 19 (27) | 17 (21) | 4 (23) | |
| IV | 1 (1) | 0 (0) | 1 (6) | |
| IMC (media ± DE) | 24,9 ± 4,8 | 26,4 ± 3,8 | 27,7 ± 5,1 | 0,08 |
| Comorbilidades n (%) | ||||
| No | 30 (42) | 30 (37) | 7 (41) | 0,83 |
| Sí | 41 (58) | 50 (62) | 10 (59) | |
| Uso de corticoides n (%) | ||||
| No | 69 (97) | 76 (95) | 14 (82) | 0,03 |
| Sí | 2 (3) | 3 (5) | 3 (18) | |
| Uso de inmunosupresores n (%) | ||||
| No | 68 (96) | 77 (95) | 15 (88) | 0,36 |
| Sí | 3 (4) | 3 (4) | 2 (12) | |
| Uso de anticoagulantes n (%) | ||||
| No | 64 (90) | 75 (94) | 13 (76) | 0,09 |
| Sí | 7 (10) | 5 (6) | 4 (23) | |
| Diagnóstico n (%) | ||||
| Cáncer | 40 (56) | 73 (91) | 11 (65) | |
| EII | 10 (14) | 3 (4) | 3 (18) | 0,057 |
| ED | 14 (20) | 3 (4) | 3 (18) | |
| Otros | 7 (10) | 1 (1) | 0 (0) | |
| Técnica quirúrgica n (%) | ||||
| H. derecha | 16 (22) | 25 (31) | 7 (41) | |
| H. izquierda | 3 (4) | 8 (10) | 0 (0) | 0,42 |
| Resección transverso | 1 (1) | 1 (1) | 0 (0) | |
| Sigmoidectomía | 8 (11) | 19 (24) | 5 (29) | |
| Colectomía subtotal | 1 (1) | 3 (4) | 0 (0) | |
| RAB | 4 (6) | 9 (11) | 3 (18) | |
| RAA | 4 (6) | 13 (16) | 1 (6) | |
| Cierre de colostomía | 32 (45) | 0 (0) | 0 (0) | |
| Resección ileocecal | 2 (3) | 2 (2) | 1 (6) | |
| Tipo de anastomosis n (%) | ||||
| L-L | 29 (41) | 22 (27) | 5 (29) | |
| T-T | 40 (56) | 54 (67) | 11 (65) | 0,16 |
| T-L | 0 (0) | 4 (5) | 1 (6) | |
| L-T | 2 (3) | 0 (0) | 0 (0) | |
| Tipo de sutura n (%) | ||||
| Manual | 21 (30) | 13 (16) | 5 (29) | 0,12 |
| Mecánica | 50 (70) | 67 (84) | 12 (71) | |
| Complicaciones intraoperatorias n (%) | ||||
| No | 59 (83) | 80 (100) | 9 (53) | <0,05 |
| Sí | 12 (17) | 0 | 8 (47) | |
| Uso de drenaje n (%) | ||||
| No | 26 (37) | 17 (21) | 3 (18) | 0,051 |
| Sí | 43 (61) | 63 (79) | 14 (82) | |
| Tiempo quirúrgico (minutos) | ||||
| Media ± DE | 131 ± 54 | 180 ± 46 | 171 ± 48 | <0,05 |
| PCR (mg/L) (media ± DE) | ||||
| Día 1 | 73 ± 48 | 43,6 ± 29,4 | 77 ± 22,7 | <0,05 |
| Día 2 | 108 ± 75,5 | 57,5 ± 56,6 | 105,8 ± 49 | <0,05 |
| Día 3 | 111,3± 79,4 | 72 ± 68,4 | 102,2 ± 57 | <0,05 |
| Día 4 | 96,7 ± 85 | 59,1± 66,8 | 91 ± 50 | <0,05 |
| Día 5 | 93,7 ± 86,7 | 52,4 ± 63 | 73,8 ± 56,7 | <0,05 |
| Complicaciones según | ||||
| C-D n (%) | 33 (46) | 15 (19) | 5 (29) | 0,006 |
| I | 9 | 2 | 1 | |
| II | 13 | 8 | 4 | |
| IIIA | 4 | 0 | 0 | |
| IIIB | 6 | 4 | 0 | |
| IVA | 0 | 1 | 0 | |
| IVB | 0 | 0 | 0 | |
| V | 1 | 0 | 0 | |
| Estancia hospitalaria | ||||
| Media ± DE | 13,9 ± 11 | 10,6 ± 13 | 10 ± 4 | <0,05 |
C-D: Clavien-Dindo; ED: enfermedad diverticular; EII: enfermedad inflamatoria intestinal; H: hemicoléctomía; Lap. conv: laparoscopia convertida; RAA: resección anterior alta; RAB: resección anterior baja.
Durante el seguimiento, presentaron complicaciones 32 (45,7%) de los pacientes a los que se les realizó un abordaje abierto, 15 (18,7%) de los pacientes con abordaje laparoscópico y 12 (29,4%) de los pacientes a los que hubo que reconvertir, diferencias estas estadísticamente significativas (p = 0,002). Desarrollaron FA 9 enfermos en el grupo de abordaje abierto, 5 a los que se les realizó un abordaje laparoscópico y no hubo fugas en el grupo que se convirtió. Estos datos no fueron estadísticamente significativos (p = 0,15). En el grupo de cirugía abierta hubo más fugas mayores que en el grupo laparoscópico, 7 frente a 4, respectivamente, aunque esa diferencia no fue significativa (p = 0,13) (tabla 2). Un paciente falleció en el grupo de cirugía abierta.
Morbilidad en función del abordaje
| Complicaciones | Abierta (N = 71) | Laparoscopia (N = 80) | Lap. conv. (N = 17) | p |
|---|---|---|---|---|
| Sin complicaciones | 39 (56) | 65 (81) | 12 (71) | 0,002 |
| Con complicaciones | 32 (45) | 15 (19) | 5 (29) | |
| No infecciosas | 11 (16) | 5 (6) | 3 (18) | 0,018 |
| Infecciosas | 21 (26) | 10 (12) | 2 (12) | 0,13 |
| Infección de herida | 11 (16) | 3 (4) | 1 (6) | 0,037 |
| Infección urinaria | 0 (0) | 1 (1) | 0 (0) | 0,58 |
| Infección respiratoria | 1 (1) | 1 (1) | 1 (6) | 0,40 |
| FA | 9 (13) | 5 (6) | 0 (0) | 0,15 |
FA: fuga anastomótica; Lap. conv.: laparoscopia convertida.
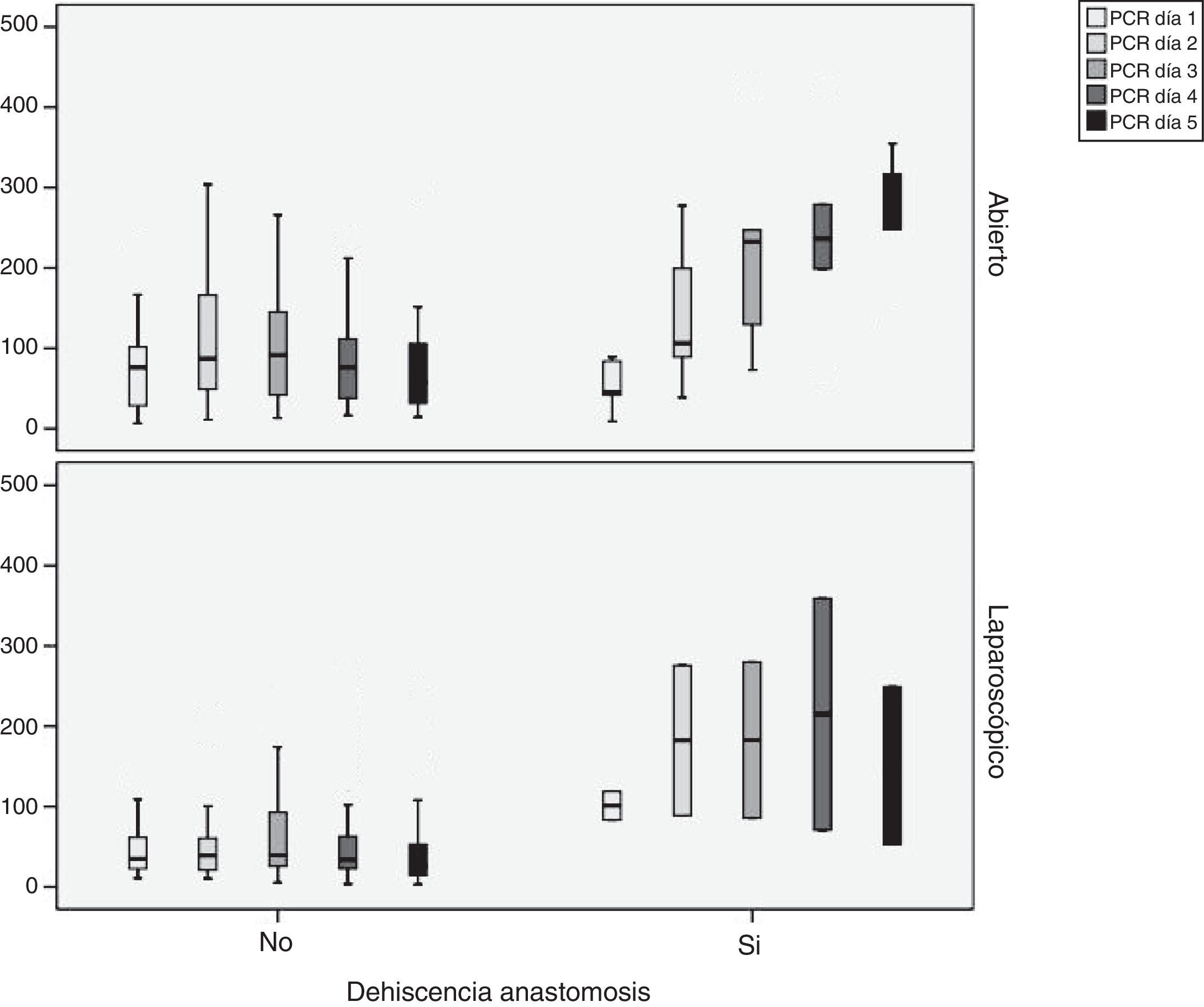
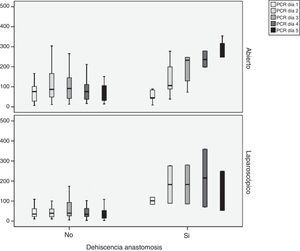
Observamos que existen diferencias estadísticamente significativas entre los 3 grupos (cirugía abierta, laparoscopia y laparoscopia convertida) en los valores de la PCR en los 5 días analizados. Estas diferencias son menores cuando el abordaje es laparoscópico en todos los días del postoperatorio (p < 0,05) (tabla 1). Existen diferencias significativas entre los pacientes con y sin fuga en el tercer, cuarto y quinto día cuando el abordaje es abierto y en el cuarto y quinto día cuando es laparoscópico. Además, observamos que en los pacientes que no presentan FA los valores de PCR descienden en el cuarto día del postoperatorio (fig. 1).
Para poder establecer una relación entre los valores de PCR y el desarrollo de FA, calculamos curvas ROC. Así, obtuvimos un ABC en el día 3 para el abordaje abierto y laparoscópico de 0,731 y de 0,760, respectivamente. En el día 4 obtuvimos un ABC de 0,867 cuando se realizó un abordaje abierto y de 0,914 cuando fue laparoscópico, por tanto, superior al obtenido en el día 3 (fig. 2).
Dado que el ABC de las curvas ROC es mejor en el día 4, calculamos puntos de corte para cada uno de los abordajes en este día del postoperatorio. En caso de abordaje abierto obtuvimos para un punto de corte de 159,2mg/L una sensibilidad del 75% (IC 95%: 38,7-100%), una especificidad del 89% (IC 95%: 80,6-98,3%) y un VPN de 96% (IC 95%: 90,1-100%) (p < 0,001). En caso de abordaje laparoscópico obtuvimos para un punto de corte de 67,3mg/L una sensibilidad del 100% (IC 95%: 83,3-100%), una especificidad del 89,5% (IC 95%: 66,6-100%) y un VPN de 100% (IC 95%: 99,1-100%).
DiscusiónNuestros resultados confirman que la PCR es útil en el diagnóstico de FA en el tercer y el cuarto día postoperatorio y, además, evidencian, que estos varían en función del abordaje realizado.
Varios estudios se han llevado a cabo con el fin de determinar el valor de la PCR a la hora de diagnosticar infecciones en pacientes intervenidos de cirugía colorrectal. En 2012, Warchkow et al.15 publicaron un metaanálisis con 1.832 pacientes de 6 estudios, en el que valoraron el alta precoz en función del valor de PCR. El punto de corte que establecieron en el cuarto día del postoperatorio es de 135mg/L, con un VPN de 89%, una sensibilidad del 68% y una especificidad del 83%, con un ABC de 0,810. Solo 2 de los 6 estudios eran prospectivos y uno de ellos tenía 35 pacientes, mientras que el otro tenía 133. En ninguno de los artículos se hace referencia a la diferencia de valor de PCR con relación al tipo de abordaje empleado.
Respecto a FA y PCR, son varios los estudios publicados en los que se identifican diferentes puntos de corte. Platt et al.16 observan que el día 3 y con un punto de corte de 190mg/L, la sensibilidad es del 77% y la especifidad del 80%, con un ABC de 0,84 y que el día 4, para un punto de corte de 125mg/L, la sensibilidad es del 77% y la especificidad del 76% con un ABC de 0,83, por lo que concluyen que el mejor marcador analítico para detectar/descartar FA es la PCR en el día 3 del postoperatorio. Ortega-Deballon et al.12 en 2010 publicaron un artículo en el que consideraban que la PCR en el día 4 es un predictor útil para detectar FA, dado que el ABC es de 0,80, la sensibilidad es de 81,8%, la especificidad de 64,4% y el VPN de 95,8% para un punto de corte de PCR de 125mg/L. García-Granero et al.10, en su estudio prospectivo que compara PCR y procalcitonina para la detección precoz de FA, observan que el mejor marcador es la procalcitonina del día 5. Así, para este marcador en el quinto día del postoperatorio obtienen un 100% de sensibilidad y de VPN junto con un 72% de especificidad y un 17% de VPP para un punto de corte de 0,31 ng/mL. También observan que la PCR en los días 3, 4 y 5 del postoperatorio resulta útil, dado que el ABC en estos días es superior a 0,80 y el VPN es de 99, 99 y 98%, respectivamente. Singh et al.9 publicaron un metaánalisis basado en 7 estudios, con 2.743 pacientes, para ver si la PCR resultaba útil como predictor precoz de FA en cirugía colorrectal y concluyeron que el mejor día es el cuarto: con un punto de corte de 124mg/L obtienen un VPN de 97%, un VPP de 21% y un ABC de 0,80.
En nuestro trabajo el mejor día para diagnosticar FA valorando PCR según el ABC obtenido es el cuarto, similar al descrito en el metaanálisis. Igual ocurre con la sensibilidad y el VPN (en torno al 96%); sin embargo, nuestro punto de corte de la PCR difiere de lo encontrado en el metaanálisis: 124mg/L. En nuestro trabajo es mayor en el caso de cirugía abierta (159,2mg/L) y bastante menor en el caso de abordaje laparoscópico (67,3mg/L), en el día 4 del postoperatorio.
Aunque la PCR parece un buen marcador que nos permite dar de alta de manera precoz a los enfermos debido a que es improbable que ocurra una FA, no está claro si lo sigue siendo cuando el abordaje es laparoscópico, dado que la mayoría de los estudios que han sido publicados se basan en pacientes a los que se les ha realizado una cirugía abierta9. Cuando se realiza un abordaje laparoscópico, la inmunidad celular parece que se preserva mejor debido a que existe un menor daño tisular y además, es menos invasivo. Existen pocos estudios que comparen la respuesta inmunitaria de la cirugía abierta frente a la laparoscópica. Los trabajos que existen son contradictorios y, además, con un tamaño muestral pequeño17.
En 2013, Karanika et al.18 publicaron un revisión de pacientes intervenidos de colectomía laparoscópica y encontraron que la respuesta inmunitaria (expresada como secreción de PCR, interleucina 6 y otras citocinas) fue menor. Postularon que probablemente fuera consecuencia del menor estrés quirúrgico que se produce con este tipo de abordaje.
Existen, además, trabajos recientes que valoran la utilidad de PCR para diagnosticar complicaciones infecciosas comparando ambas vías de abordaje. Así, Nason et al.19 analizaron una cohorte de 169 pacientes a los que se les realizó colectomía laparoscópica, e indicaron que una PCR > 148mg/L en el tercer día del postoperatorio es sugerente de complicaciones infecciosas. Ramanathan et al.14 publicaron un estudio con 344 pacientes en el que concluyen que, aunque la respuesta sistémica es mayor cuando se realiza una cirugía abierta, la PCR tiene un valor similar para predecir complicaciones infecciosas en el tercer y cuarto día del postoperatorio. Así, en el cuarto día del postoperatorio y para un punto de corte de 140mg/L, obtienen una sensibilidad y especificidad semejantes en ambos abordajes que se encuentra en torno al 70% con un ABC de 0,780 para cirugía abierta y de 0,720 para cirugía laparoscópica. Estos resultados difieren de los encontrados en nuestro trabajo a la hora de evaluar FA, ya que nosotros sí hemos encontrado diferencias en los valores de PCR en función del abordaje utilizado, como también ocurre en el trabajo publicado por Shibata et al.20, en el que además incluyen pacientes intervenidos por vía robótica; o el de Adamina et al.21 para detectar complicaciones infecciosas, con un punto de corte establecido para PCR en este último trabajo de 56mg/L, muy parecido al de nuestro trabajo. Recientemente, Waterland et al.22 publican un trabajo en el que comparan valores de PCR en cirugía abierta y laparoscópica y observan, al igual que nosotros, valores de PCR inferiores en el grupo laparoscópico y con puntos de corte de 91mg/L en cirugía laparoscópica y de 123,5mg/L en cirugía abierta con VPN superiores al 97%, como en nuestro estudio.
A pesar de que existen limitaciones en nuestro trabajo, como puede ser la potencia estadística debido al tamaño muestral, la relevancia clínica práctica de nuestros hallazgos no es despreciable.
Debemos concluir que la PCR en el cuarto día del postoperatorio es útil a la hora de detectar FA, pero sus valores difieren según el abordaje empleado; de manera que en la vía laparoscópica el nivel de corte es muy inferior al de la cirugía abierta. Esto, sin duda, deberá ser confirmado en futuros estudios multicéntricos y con mayor número de pacientes, ya que la implicación en la práctica clínica es importante.
Autoría/colaboraciones- •
M. Ramos Fernández fue responsable de la concepción y diseño del presente estudio, así como de la recogida de datos, interpretación y diseño del artículo.
- •
Fernández López fue responsable de la recogida de datos.
- •
F. Rivas Ruiz contribuyó en el análisis e interpretación de datos.
- •
F. de la Portilla de Juan contribuyó en la interpretación y redacción del artículo.
- •
Loinaz Segurola y J. M. Fernández Cebrián han contribuido de forma imprescindible en el desarrollo del estudio.
Los autores declaran no tener ningún conflicto de intereses.