El tratamiento quirúrgico de los adenocarcinomas de la unión esofagogástrica se basa en gastrectomías totales o esofaguectomías oncológicas, procedimientos de alta complejidad y considerable morbimortalidad. Los datos obtenidos del análisis de registros quirúrgicos poblacionales muestran una elevada variabilidad en el enfoque terapéutico y los resultados entre diferentes centros hospitalarios y zonas geográficas. Una de las principales medidas destinadas a reducir esta variabilidad, mejorando los resultados globales, es la centralización de la enfermedad en centros de referencia, proceso que debe basarse en el cumplimiento de unos estándares de calidad e ir acompañada de la armonización de protocolos terapéuticos. La cirugía mínimamente invasiva puede disminuir la morbilidad postoperatoria sin comprometer la supervivencia, pero es técnicamente más demandante que la cirugía abierta. Los programas de formación quirúrgica tutelada permiten incorporar la cirugía mínimamente invasiva a la práctica de los equipos quirúrgicos sin que la curva de aprendizaje condicione la morbimortalidad ni la radicalidad oncológica.
Surgical treatment of oesophagogastric junction adenocarcinomas is based on total gastrectomies or oesophagectomies, which are complex procedures with potentially high morbidity and mortality. Population-based registers show a considerable variability of protocols and outcomes among different hospitals and regions. One of the main strategies to improve global results is centralization at high-volume hospitals, a process that should take into account the benchmarking of processes and outcomes at referral hospitals. Minimally invasive surgery can improve postoperative morbidity while maintaining oncological guaranties, but is technically more demanding than open surgery. This fact underlines the need for structured training and mentorship programs that minimize the impact of surgical teams’ training curves without affecting morbidity, mortality or oncologic radicality.
Los adenocarcinomas de la unión esofagogástrica (UEG) son tumores de incidencia creciente en los países occidentales, cuyo tratamiento se basa en un enfoque multimodal con quimioterapia, radioterapia y cirugía1,2. El tratamiento quirúrgico sigue siendo el único con intención curativa, basado en gastrectomías totales ampliadas o esofaguectomías oncológicas, que son procedimientos de alta complejidad y considerable morbimortalidad. Los datos actuales muestran una elevada variabilidad en el enfoque y los resultados del tratamiento neoadyuvante, quirúrgico y adyuvante de los tumores de la UEG entre diferentes centros hospitalarios y zonas geográficas3. Para minimizar esta variabilidad y mejorar los resultados globales, diversos países han impulsado procesos de centralización de la enfermedad a hospitales de referencia en las últimas décadas, con resultados globalmente positivos4,5. Además, con la introducción de los procedimientos quirúrgicos mínimamente invasivos, técnicamente más demandantes, se ha hecho patente la necesidad de una formación regulada de los cirujanos que integran las unidades de cirugía esofagogástrica para que su curva de aprendizaje no vaya en detrimento de la radicalidad oncológica y la seguridad de los pacientes6.
En el presente artículo se revisa la heterogeneidad en el enfoque terapéutico y los resultados del tratamiento de los tumores de la UEG según datos de los registros poblacionales, así como las iniciativas de estandarización mediante la centralización de la enfermedad y la formación quirúrgica.
CentralizaciónLa cirugía de los tumores del esófago y la UEG se asocia a una considerable morbimortalidad postoperatoria y a una baja supervivencia3,7. Diversos estudios han mostrado que estos resultados son mejores en hospitales de alto volumen8–15, aunque no existe unanimidad16. En un metaanálisis de 2012, Wouters et al.9 analizaron 32 artículos que demostraban la relación inversa entre volumen hospitalario y mortalidad postoperatoria tras una esofaguectomía (OR 2,30, IC 95% 1,89-2,80) y 7 que establecían una asociación entre volumen hospitalario y supervivencia (OR 1,17, IC 95% 1,05-1,31). Sin embargo, muchos de esos estudios eran observacionales y basados en datos administrativos y ha sido subrayado que los efectos positivos del mayor volumen hospitalario son menos pronunciados en los estudios prospectivos que en los retrospectivos17. En cualquier caso, ningún estudio ha mostrado peores resultados en los centros de alto volumen. En consecuencia, se han planteado diversas propuestas de un volumen anual mínimo recomendable por centro: Henneman et al.13 demostraron que los equipos quirúrgicos holandeses que realizaban más de 40 esofaguectomías al año tenían una menor mortalidad a los 6 meses (HR 0,73, IC 95% 0,65-0,83) y a los 2 años (HR 0,88, IC 95% 0,83-0,93), por lo que consideraron que ese debía ser el número mínimo exigible para un equipo quirúrgico especializado. Siguiendo un método similar, otros autores han establecido puntos de corte en un mínimo de 13 o 20 esofaguectomías al año18,19.
Estos hallazgos han justificado la puesta en marcha de diferentes procesos de centralización de las neoplasias de esófago y la UEG. Vonlanthen et al.17 analizaron las políticas de centralización de la cirugía oncológica de 20 países europeos, EE. UU. y Canadá, hallando que la mayoría (15 de los 22) habían definido un volumen mínimo de esofaguectomías anuales por centro, con un rango muy amplio que iba de 7 en Canadá a 80 en Dinamarca. En 2 países (Reino Unido y EE. UU.) se había propuesto, además, un volumen mínimo por cirujano. Sin embargo, solo en 6 países esas medidas habían sido impuestas legalmente. Esos procesos de centralización han demostrado su eficacia en países como Holanda, donde se redujo la mortalidad postoperatoria de 12 a 5% (p=0,003) y la estancia hospitalaria de 21 a 17 días (p=0,002), aumentando la supervivencia a los 2 años de 38 a 54% (p=0,001)5.
La mayoría de esas iniciativas no contemplan los tumores de la UEG como un caso aparte y se basan en la definición del tipo de resección quirúrgica. En las gastrectomías oncológicas la relación del volumen hospitalario con la mortalidad postoperatoria, la extensión de la linfadenectomía y la supervivencia a largo plazo también ha sido descrita, aunque con menos contundencia que con las esofaguectomías14,17. Algunos países también han impulsado procesos de centralización de las gastrectomías con buenos resultados, como Dinamarca, donde disminuyó la tasa de dehiscencia anastomótica de 6,1 a 5% (HR 5,2, IC 95% 3,2-7,7), la mortalidad a los 30 días de 8,2 a 2,4% (HR 2,8, IC 95% 1,2-4,4) y el porcentaje de pacientes con al menos 15 ganglios resecados de 19 a 76% (p<0,001)20.
En España, varias comunidades autónomas han realizado procesos de centralización de las neoplasias esofagogástricas en los últimos años de manera más o menos espontánea o dirigida. En Cataluña, en la primera década del presente siglo se produjo un descenso de 69 a 17 hospitales autorizados a realizar esta cirugía, con el consiguiente incremento de las esofaguectomías y gastrectomías por centro y año (de 3,4 a 7,4 y de 7,2 a 17, respectivamente). Se observó una disminución de la morbimortalidad postoperatoria, junto con un aumento de los accesos transtorácicos y las linfadenectomías amplias, así como una mayor uniformidad de los tratamientos multimodales21,22. Recientemente, el gobierno autonómico catalán ha establecido un mínimo de 11 gastrectomías y 11 esofaguectomías por año para autorizar a un centro el tratamiento con intención radical de las neoplasias epiteliales esofagogástricas.
Pero las políticas de centralización basadas exclusivamente en el volumen hospitalario pueden no traducirse en un beneficio óptimo, puesto que existen otros factores que juegan un papel importante17,20. Así lo demostraron Simunovic et al.23 comparando los resultados de la regionalización del cáncer de páncreas en 2 provincias de Canadá donde llevaron a cabo una diferente implementación de medidas de calidad asistencial con resultados muy dispares. Además, la elección de los centros de referencia no debería basarse solo en el número de procedimientos anuales que realiza cada centro en el momento de iniciar el proceso de centralización, sino sobre todo en el cumplimiento de los requisitos de estructura, procesos y resultados17,24. Low et al.25 definieron los resultados postoperatorios de referencia (benchmarking) que sería razonable exigir a una unidad quirúrgica especializada, con base en las tasas de complicaciones, mortalidad y reingresos de 2.704 esofaguectomías del registro promovido por el Esophageal Complication Consensus Group. Recientemente, se han descrito nuevos conceptos como el Failure to Rescue (porcentaje de pacientes con alguna complicación postoperatoria que mueren a consecuencia de ella) y el Textbook Outcome (porcentaje de pacientes que cumplen con una serie de resultados ideales de curso perioperatorio), que son también criterios de calidad asistencial hospitalaria26,27. Algunos autores e instituciones, como la European CanCer Organization, han elaborado listas de los recursos estructurales y los parámetros de calidad exigibles para realizar esofaguectomías y gastrectomías oncológicas según la evidencia publicada: el número de pacientes atendidos por año es solo uno de esos factores, junto con otros muchos como la estructura hospitalaria, la formación del personal, la radicalidad quirúrgica, las tasas de morbimortalidad postoperatoria, el cumplimiento de protocolos multimodales y la participación en registros multicéntricos auditados28–30.
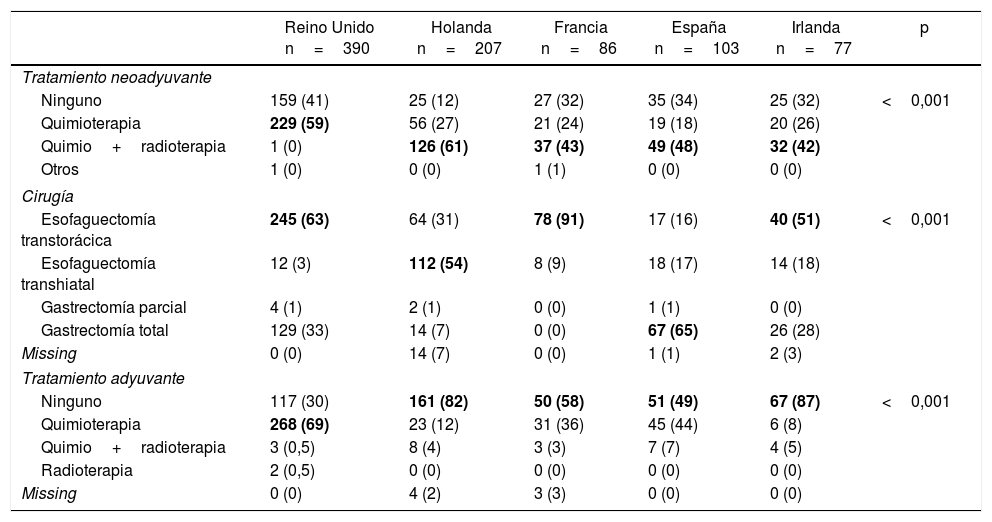
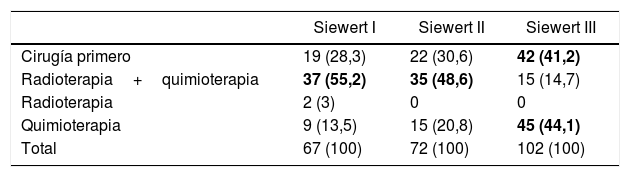
RegistrosLos registros oncológicos son útiles para identificar diferencias en la presentación de la enfermedad y comparar abordajes terapéuticos y resultados entre diferentes áreas geográficas y centros hospitalarios3,31,32. Un estudio comparativo de 5 registros clínicos poblacionales dentro del proyecto EURECCA identificó grandes variaciones en el enfoque terapéutico de los pacientes con tumores de la UEG: en el Reino Unido la mayoría recibían quimioterapia neoadyuvante (59%), mientras que en Holanda la quimiorradioterapia era el esquema más frecuente (54%); la resección quirúrgica más habitual era la esofaguectomía transtorácica en Francia (91%) e Inglaterra (63%), mientras que en España se recogían más gastrectomías totales ampliadas (65%) (tabla 1). Estas diferencias pueden explicarse en parte por la localización tumoral y el grado de preparación de los equipos en cirugía del tórax. El registro EURECCA español analizó recientemente 2.024 pacientes operados entre 2014 y 2017, de los cuales 241 (12%) eran de la UEG. En ellos se indicaron más gastrectomías totales ampliadas en los tumores tipo Siewert III (94%), mientras que en los Siewert I y II se realizaron más esofaguectomías tipo Ivor-Lewis (52%) y transhiatales (28%) (tabla 2). En cuanto al tratamiento neoadyuvante, la mayoría de los pacientes con tumores tipo Siewert III recibieron quimioterapia (44%) o cirugía de entrada (41%), mientras que en los Siewert I y II se indicó sobre todo quimiorradioterapia (52%) (tabla 3). El registro holandés analizó 266 tumores resecables de la UEG, de los cuales el 86% fueron tratados mediante esofaguectomía y el 14% mediante gastrectomía. En los pacientes con tumores Siewert II (n=176), las gastrectomías se asociaron a un mayor riesgo de afectación del margen circunferencial esofágico (29 vs. 11%, p=0,025) y a linfadenectomías más limitadas (5 vs. 34%, p<0,001)33.
Variabilidad en el abordaje terapéutico de los tumores de la unión esofagogástrica en diferentes registros nacionales
| Reino Unido n=390 | Holanda n=207 | Francia n=86 | España n=103 | Irlanda n=77 | p | |
|---|---|---|---|---|---|---|
| Tratamiento neoadyuvante | ||||||
| Ninguno | 159 (41) | 25 (12) | 27 (32) | 35 (34) | 25 (32) | <0,001 |
| Quimioterapia | 229 (59) | 56 (27) | 21 (24) | 19 (18) | 20 (26) | |
| Quimio+radioterapia | 1 (0) | 126 (61) | 37 (43) | 49 (48) | 32 (42) | |
| Otros | 1 (0) | 0 (0) | 1 (1) | 0 (0) | 0 (0) | |
| Cirugía | ||||||
| Esofaguectomía transtorácica | 245 (63) | 64 (31) | 78 (91) | 17 (16) | 40 (51) | <0,001 |
| Esofaguectomía transhiatal | 12 (3) | 112 (54) | 8 (9) | 18 (17) | 14 (18) | |
| Gastrectomía parcial | 4 (1) | 2 (1) | 0 (0) | 1 (1) | 0 (0) | |
| Gastrectomía total | 129 (33) | 14 (7) | 0 (0) | 67 (65) | 26 (28) | |
| Missing | 0 (0) | 14 (7) | 0 (0) | 1 (1) | 2 (3) | |
| Tratamiento adyuvante | ||||||
| Ninguno | 117 (30) | 161 (82) | 50 (58) | 51 (49) | 67 (87) | <0,001 |
| Quimioterapia | 268 (69) | 23 (12) | 31 (36) | 45 (44) | 6 (8) | |
| Quimio+radioterapia | 3 (0,5) | 8 (4) | 3 (3) | 7 (7) | 4 (5) | |
| Radioterapia | 2 (0,5) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | |
| Missing | 0 (0) | 4 (2) | 3 (3) | 0 (0) | 0 (0) | |
Valores expresados como n (%). En negrita se destacan las variables más frecuentes para cada caso.
Adaptada de Messager et al.3, con permiso.
Resultados del registro EURECCA español 2014-2017: técnica quirúrgica indicada para los tumores de la unión esofagogástrica según localización (n=241), datos no publicados
| Siewert I | Siewert II | Siewert III | |
|---|---|---|---|
| Gastrectomía total/total ampliada | 2 (3) | 19 (26,4) | 96 (94,1) |
| Esofaguectomía transhiatal | 21 (31,3) | 19 (26,4) | 4 (3,9) |
| Esofaguectomía Ivor-Lewis | 39 (58,2) | 33 (45,8) | 2 (2) |
| Esofaguectomía McKeown | 5 (7,5) | 1 (1,4) | 0 |
| Total | 67 (100) | 72 (100) | 102 (100) |
Valores expresados como n (%). En negrita se destacan las variables más frecuentes para cada caso.
Resultados del registro EURECCA español 2014-2017: tratamiento neoadyuvante indicado para los tumores de la unión esofagogástrica según localización (n=241), datos no publicados
| Siewert I | Siewert II | Siewert III | |
|---|---|---|---|
| Cirugía primero | 19 (28,3) | 22 (30,6) | 42 (41,2) |
| Radioterapia+quimioterapia | 37 (55,2) | 35 (48,6) | 15 (14,7) |
| Radioterapia | 2 (3) | 0 | 0 |
| Quimioterapia | 9 (13,5) | 15 (20,8) | 45 (44,1) |
| Total | 67 (100) | 72 (100) | 102 (100) |
Valores expresados como n (%).En negrita se destacan las variables más frecuentes para cada caso.
Sin embargo, existen diferencias en la naturaleza de los registros que pueden limitar la interpretación y comparación de los datos. Así, solo en algunos países los registros son obligatorios y financiados con recursos públicos: el DUCA (Holanda), el FREGAT (Francia) y el NOGCA (Inglaterra e Irlanda); en el resto de los países son ocasionales y voluntarios o inexistentes34–36. Los ítems recogidos no siempre están bien definidos ni estandarizados para facilitar su comparación37. Además, solo 2 de ellos (el DUCA y el NREV en Suecia) han sido auditados para validar la fiabilidad de los datos34,38.
En España, el registro EURECCA de cáncer gastroesofágico se inició en 2013 en Cataluña y Navarra, aprovechando la centralización de la enfermedad. Se trata de un registro poblacional y clínico, no administrativo como los publicados previamente22,39. En 2015 se incorporó el País Vasco y posteriormente La Rioja, coincidiendo con el paso del registro a prospectivo on-line y la definición más precisa y estandarizada de los ítems siguiendo las recomendaciones por consenso de grupos internacionales7,40–43. Hoy en día forman parte del registro EURECCA español 30 hospitales de 4 comunidades y está en marcha una auditoría, siguiendo el modelo del NREV sueco, para asegurar la veracidad y coherencia de los datos38.
FormaciónEs imposible contemplar el proceso de centralización de la patología oncológica sin afrontar los nuevos desafíos de los centros de referencia. El tratamiento quirúrgico y multimodal de los tumores de la UEG es complejo, lo que hace precisa la formación específica de los equipos responsables17. La Union Européene des Médicins Spécialistes (www.uems.eu) recomienda que la formación especializada de posgrado sea acreditada, incluyendo estancias en centros cualificados (fellowships) y exámenes. Tanto el American College of Surgeons (http://www.facs.org/education/resources/medical-students/postres) como la European Society of Surgical Oncology (https://www.essoweb.org/fellowships/training-fellowships/) promueven programas formativos que incluyen fellowships de uno o 2 años y buscan asegurar la competencia en indicación, técnica quirúrgica, manejo de las complicaciones e investigación.
Pero la formación de los equipos quirúrgicos no debe ser puntual, sino continua y adaptarse a los avances tecnológicos. La cirugía mínimamente invasiva (CMI) ha ido ganando espacio durante los últimos años en el tratamiento del cáncer esofágico y de la UEG44-47. Sin embargo, es técnicamente más compleja que la cirugía abierta y se asocia a una curva de aprendizaje durante la que puede verse comprometida la radicalidad oncológica y aumentar la morbilidad postoperatoria y la tasa de reintervenciones48–51. Los programas formativos denominados de mentorship o proctorship pretenden minimizar el impacto sobre el paciente de estas curvas de aprendizaje en CMI mediante un proceso de implicación progresiva y tutorizada de los cirujanos antes de su ejercicio autónomo, sin olvidar que la radicalidad oncológica y la seguridad del paciente deben primar sobre el tipo de abordaje.
En Holanda se inició en 2003 un programa formativo nacional para las esofaguectomías mínimamente invasivas asistidas por robot (RAMIE). Primero se estudió prospectivamente el tiempo quirúrgico, la pérdida sanguínea y la tasa de conversión de los «mentores» y se valoró cuántas intervenciones se precisaban para que dichos parámetros alcanzasen valores iguales o por encima de la media. La curva de aprendizaje de los mentores se completó tras 70 procedimientos en 5 años. En una segunda fase se incorporaron los «alumnos», sucesivamente espectadores y ayudantes de los mentores, pasando después a ser ayudados por ellos y, por último, autónomos con supervisión. La curva de aprendizaje de los alumnos precisó 24 procedimientos durante un año, un 70% menos que sus mentores, al ser ayudados y supervisados por ellos6.
En España, el registro EURECCA ha mostrado que solo el 37% de las gastrectomías y el 41% de las esofaguectomías se realizan por CMI (datos no publicados). El grupo EURECCA español creó un comité de formación que ha diseñado un programa basado en el formato de «inmersiones clínicas», que combina la cirugía en directo con sesiones clínicas interactivas, dirigido a cirujanos experimentados en cirugía abierta de los tumores de estómago, esófago y UEG, con la voluntad de iniciarse o mejorar su práctica en CMI. Dicha iniciativa parte del supuesto de que el equipo iniciado realizará un mínimo de procedimientos anuales que garanticen su continuidad. El objetivo de este y otros programas formativos debe ser que los pacientes puedan acabar beneficiándose de las ventajas de la CMI sin que la curva de aprendizaje del equipo quirúrgico comprometa su seguridad ni la supervivencia de los pacientes.
En conclusión, los registros quirúrgicos multicéntricos permiten conocer la variabilidad existente en los procesos y resultados del tratamiento de los tumores de la UEG. Una de las principales medidas destinadas a reducir esta variabilidad mejorando los resultados globales es la centralización de la enfermedad en centros de referencia, proceso que debe basarse en el cumplimiento de unos estándares de calidad por parte de las unidades especializadas e ir acompañada de la armonización de protocolos terapéuticos. La CMI en manos de cirujanos experimentados puede disminuir la morbilidad postoperatoria sin comprometer la supervivencia, pero es técnicamente más demandante. Los programas de formación quirúrgica tutelada (mentorship) permiten incorporar la CMI a la práctica de los equipos de referencia sin que la curva de aprendizaje condicione la morbimortalidad ni la radicalidad oncológica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Grupo EURECCA español de cáncer esofagogástrico.