Este artículo resume la guía clínica de diagnóstico y tratamiento del derrame pleural maligno (DPM) auspiciada por la Sociedad Española de Cirugía Torácica (SECT). Se elaboraron 10 controversias clínicas bajo la metodología de preguntas PICO (Patient, Intervention, Comparison, Outcome) y la calidad de la evidencia y graduación de la fuerza de las recomendaciones se basó en el sistema Grading of Recommendations, Assessment, Development and Evaluations (GRADE). El análisis inmunocitoquímico y molecular del líquido pleural puede evitar procedimientos invasivos ulteriores con finalidad diagnóstica. Actualmente, el control definitivo del DPM se puede realizar indistintamente a través de una pleurodesis (talco poudrage o slurry) o de la inserción de un catéter pleural tunelizado (CPT). Es probable que la combinación de ambas técnicas (p.ej. toracoscopia con talco poudrage e inserción de un CPT, o instilación de talco slurry a través de un CPT) ocupe un lugar predominante en el manejo terapéutico futuro.
This article summarizes the clinical guidelines for the diagnosis and treatment of malignant pleural effusion (MPE) sponsored by the Spanish Society of Thoracic Surgery (SECT). Ten clinical controversies were elaborated under the methodology of PICO (Patient, Intervention, Comparison, Outcome) questions and the quality of the evidence and grading of the strength of the recommendations was based on the GRADE system. Immunocytochemical and molecular analyses of pleural fluid may avoid further invasive diagnostic procedures. Currently, the definitive control of MPE can be achieved either by pleurodesis (talc poudrage or slurry) or the insertion of a indwelling pleural catheter (IPC). It is likely that the combination of both techniques (i.e., thoracoscopy with talc poudrage and insertion of a IPC, or instillation of talc slurry through a IPC) will have a predominant role in the future therapeutic management.
El derrame pleural maligno (DPM) supone en torno a un 25% de todos los derrames pleurales que se someten a una toracocentesis, siendo la primera causa de exudado1,2. La mayoría de DPM son metastásicos y provienen mayoritariamente de un tumor primario pulmonar o mamario. La presencia de un DPM en el contexto de una neoplasia implica una enfermedad avanzada o diseminada, con un pronóstico de vida de 3 a 12 meses, variable en función del tumor primario3.
La orientación terapéutica del DPM viene determinada, en gran medida, por el pronóstico del paciente. Han sido múltiples los estudios publicados en busca de factores pronósticos de supervivencia del DPM. Se han propuesto distintos sistemas de puntuación pronóstica del DPM. Sin embargo, solo uno ha sido validado de forma externa: el sistema de puntuación LENT4. Las variables que lo componen son el valor de lactato deshidrogenasa (LDH) en líquido pleural, el Eastern Cooperative Oncology Group Performance Status (ECOG PS) del paciente, el cociente entre los neutrófilos y los linfocitos en sangre (NLR) y la estirpe tumoral. Según la puntuación obtenida, se establecen tres grupos de riesgo: bajo (0-1 punto), moderado (2-4 puntos) y alto (5-7 puntos) (tabla 1). El modelo LENT se ha establecido como una herramienta útil, sencilla y precisa en la toma de decisiones sobre el DPM.
Cálculo del Score LENT y categorías de riesgo para el derrame pleural maligno
| CÁLCULO DEL SCORE LENT | |
|---|---|
| Variable | Puntuación |
| LDH en líquido pleural (UI/L) | |
| < 1500 | 0 |
| > 1500 | 1 |
| ECOG | |
| 0 | 0 |
| 1 | 1 |
| 2 | 2 |
| 3-4 | 3 |
| NLR | |
| < 9 | 0 |
| > 9 | 1 |
| Estirpe tumoral | |
| Tumores de bajo riesgo | 0 |
| Mesotelioma | |
| Neoplasias hematológicas | |
| Tumores de riesgo moderado | 1 |
| Cáncer de mama | |
| Cáncer ginecológico | |
| Carcinoma de células renales | |
| Tumores de alto riesgo | 2 |
| Cáncer de pulmón | |
| Otros tipos de cánceres | |
| Categoría | Puntuación total |
|---|---|
| Bajo riesgo | 0-1 |
| Riesgo moderado | 2-4 |
| Riesgo elevado | 5-7 |
ECOG: Eastern Cooperative Oncology Group; LDH: Lactato deshidrogenasa; NLR: Ratio neutrófilos/linfocitos.
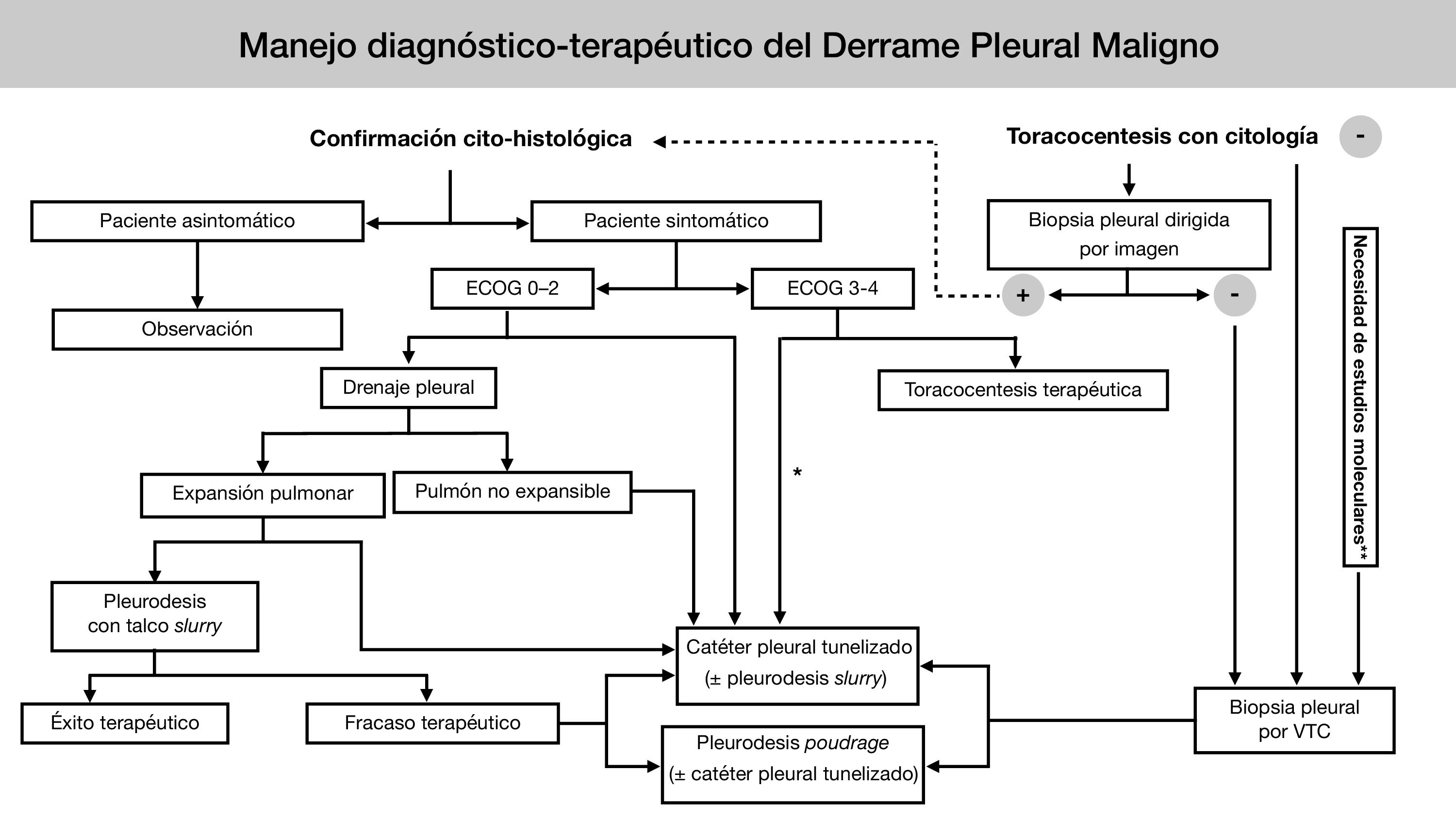
En 2018 se publicaron las guías europea5 y americana6 sobre el manejo del DPM. En los últimos años, la creciente evidencia clínica basada en ensayos clínicos aleatorizados (ECA) ha supuesto un cambio en el enfoque diagnóstico y terapéutico de esta entidad. Desde la Sociedad Española de Cirugía Torácica (SECT) se ha considerado necesaria la elaboración de una guía clínica que refleje los numerosos avances y controversias aún existentes en el manejo del DPM (tabla 2) (fig. 1)7.
Resumen de recomendaciones de la Guía de la SECT para el derrame pleural maligno
| Resumen de recomendaciones |
|---|
| CONTROVERSIA CLÍNICA 1 |
| ¿Cómo se debe procesar el líquido pleural para maximizar la rentabilidad diagnóstica de los estudios citológicos? |
| Recomendaciones |
| - Ante la sospecha de DPM metastásico, solicitar un frotis y un bloque celular del líquido pleural, ya que ambas pruebas ofrecen información complementaria (Calidad de la evidencia MODERADA). |
| - Si un primer estudio citológico es negativo, se debe realizar una segunda toracocentesis para nuevo análisis del líquido pleural, pero análisis ulteriores son innecesarios (Calidad de la evidencia MODERADA). |
| - El bloque celular obtenido tras centrifugar el líquido pleural permite identificar el origen primario del tumor (estudios inmunohistoquímicos) y detectar mutaciones oncogénicas (Calidad de la evidencia MODERADA). |
| CONTROVERSIA CLÍNICA 2 |
| En pacientes con DPM, ¿qué tipo de biopsia pleural es más rentable? |
| Recomendaciones |
| - La biopsia pleural guiada por imagen (ecografía, TC) es la prueba diagnóstica de elección ante un derrame sospechoso de malignidad cuando los estudios citológicos del liquido pleural obtenido mediante toracocentesis han sido negativos y existen áreas de engrosamiento pleural, nodularidad o masas pleurales (Calidad de la Evidencia MODERADA). |
| - La biopsia por VTC es la prueba diagnóstica de elección cuando la biopsia pleural ciega o guiada por imagen no es diagnóstica o se prevé que ofrecerá poca rentabilidad (pleura parietal normal en la ecografía) (Calidad de la Evidencia MODERADA). |
| - La VTC permite, además de tomar biopsias pleurales bajo visión directa, la realización de una pleurodesis durante el mismo procedimiento, así como la inserción de CPT (Calidad de la Evidencia BAJA). |
| CONTROVERSIA CLÍNICA 3 |
| En pacientes con DPM, ¿es necesaria la evacuación del derrame o es la observación una opción? |
| Recomendaciones |
| - No se recomienda la evacuación del DPM en pacientes asintomáticos, ya que implica un riesgo asociado al procedimiento invasivo, sin beneficio clínico alguno (Calidad de la Evidencia BAJA). |
| CONTROVERSIA CLÍNICA 4 |
| En los pacientes con DPM a los que se realiza una toracocentesis terapéutica, ¿es útil la manometría pleural para predecir la presencia de un pulmón no-expansible o complicaciones del procedimiento? |
| Recomendaciones |
| - Se debe suspender la toracentesis terapéutica cuando el paciente desarrolla síntomas (molestias torácicas, dolor, disnea) (Calidad de la Evidencia MODERADA). |
| - La manometría pleural durante la toracocentesis terapéutica es potencialmente útil para predecir un pulmón atrapado, lo que contraindicaría un intento de pleurodesis (Calidad de la Evidencia BAJA). |
| CONTROVERSIA CLÍNICA 5 |
| ¿Cuál es la actitud a seguir ante un pulmón no expansible diagnosticado tras la colocación de un drenaje pleural? |
| Recomendaciones |
| - En pacientes con DPM sintomático y pulmón no expansible o fracaso en la pleurodesis se recomienda el empleo de CPT (Calidad de la Evidencia BAJA). |
| - El empleo de agentes fibrinolíticos en DPM multiseptados no presenta efectos beneficiosos sobre la disnea o el éxito en la pleurodesis, pero sí se relaciona con una disminución radiológica del DPM y de la estancia hospitalaria (Calidad de la Evidencia BAJA). |
| CONTROVERSIA CLÍNICA 6 |
| ¿Es más eficaz la pleurodesis con talco slurry o con talco poudrage? |
| Recomendaciones |
| - No se han demostrado diferencias en la eficacia de la pleurodesis con talco poudrage respecto a la pleurodesis con talco slurry, ni tampoco en la mortalidad (Calidad de la Evidencia ALTA). |
| - La decisión de utilizar talco slurry o poudrage dependerá de factores relacionados con el paciente (drenaje pleural ya colocado, VTC en curso), de la disponibilidad y experiencia con la VTC y de la necesidad de obtener biopsias para estudios moleculares cuando otras muestras han sido insuficientes (Calidad de la Evidencia MUY BAJA). |
| CONTROVERSIA CLÍNICA 7 |
| ¿Qué actitud hay que seguir ante un fallo de la pleurodesis? |
| Recomendaciones |
| - Ante un fracaso de la pleurodesis se recomienda el uso de un CPT en lugar de una nueva pleurodesis, siempre que sea técnicamente factible (Calidad de la Evidencia BAJA). |
| - La pleurodesis con talco poudrage es una alternativa ante el fracaso de una pleurodesis previa y la imposibilidad técnica de colocar un CPT (Calidad de la Evidencia MUY BAJA). |
| CONTROVERSIA CLÍNICA 8 |
| En pacientes con DPM, ¿puede la colocación de un CPT aportar un éxito terapéutico similar a la pleurodesis? |
| Recomendaciones |
| - En el DPM, la colocación de un CPT puede aportar un beneficio terapéutico similar a la pleurodesis química (Calidad de la Evidencia ALTA). |
| - Las principales ventajas de los CPT frente a la pleurodesis química son una menor estancia hospitalaria y menor necesidad de intervenciones adicionales sobre la cavidad pleural. En cambio, la tasa de complicaciones (aunque no graves) es mayor (Calidad de la Evidencia ALTA). |
| - El tratamiento sistémico antitumoral no aumenta el riesgo de complicaciones infecciosas relacionadas con los CPTs y, por consiguiente, no supone una contraindicación para la utilización de los mismos. (Calidad de la Evidencia MUY BAJA). |
| - La realización de VTC con talco poudrage e instauración de un CPT en el mismo acto mejora la tasa de éxito y el tiempo en que se alcanza una pleurodesis respecto al CPT aislado. En caso de recidiva del DPM, la presencia del CPT evita tratamientos posteriores (Calidad de la Evidencia BAJA). |
| CONTROVERSIA CLÍNICA 9 |
| ¿Cuál debe ser la frecuencia de drenaje de un CPT en pacientes con DPM? |
| Recomendaciones |
| - Los regímenes de drenaje intensivo (diario) del CPT y/o la instilación de talco a través del mismo aceleran el proceso de pleurodesis y, por consiguiente, la retirada del catéter. Este objetivo, además del alivio de la disnea, puede considerarse por parte del paciente como prioritario (Calidad de la Evidencia MODERADA). |
| CONTROVERSIA CLÍNICA 10 |
| - En pacientes con expectativas de respuesta al tratamiento sistémico antitumoral y DPM sintomático, ¿deben realizarse procedimientos definitivos (pleurodesis o CPT) inicialmente o bien una toracocentesis terapéutica y esperar al efecto del tratamiento sistémico? |
| Recomendaciones |
| - En pacientes con DPM sintomático secundario a una neoplasia con expectativas de respuesta al tratamiento sistémico antitumoral (quimioterapia, inmunoterapia, terapias diana), las terapias pleurales definitivas (pleurodesis, CPT) pueden disminuir la necesidad de procedimientos posteriores sobre el espacio pleural (Calidad de la Evidencia BAJA). |
CPT: catéter pleural tunelizado; DPM: derrame pleural maligno; TC: tomografía computarizada; VTC: videotoracoscopia.
Algoritmo de manejo diagnóstico-terapéutico del DPM de la Sociedad Española de Cirugía Torácica.
* Si se prevé más de dos toracocentesis evacuadoras.
**Solo si dichos estudios no pueden realizarse en líquido pleural (bloque celular / sobrenadante), o bien en una biopsia obtenida de otro modo (dirigida por imagen / ciega).
Ante un paciente con sospecha de DPM si tras una toracocentesis no se obtiene diagnóstico, se procederá a la realización de una VTC diagnóstica para biopsia pleural, valorándose tras ésta, según los hallazgos, la realización de una pleurodesis química con talco y/o la colocación de un CPT.
En caso de confirmación histológica tras la toracocentesis, la sintomatología marcará la actitud a seguir, manteniendo una actitud conservadora si el paciente se encuentra asintomático. En caso de pacientes sintomáticos, será la situación clínica basal la que orientará la actitud a seguir. En pacientes con buen ECOG, se colocará un DT. Si se consigue una correcta expansión pulmonar, se recomienda realizar una pleurodesis a través del DT mediante técnica “slurry”. En casos de ausencia de expansión pulmonar o fracaso de la pleurodesis anterior, se recomienda valorar una pleurodesis por VTC o la colocación de un CPT. En paciente con mal ECOG, se valorará según su situación basal la realización de toracocentesis evacuadora o colocación de un CPT.
DPM: derrame pleural maligno; VTC: videotoracoscopia; CPT: catéter pleural tunelizado; DT: drenaje torácico.
Este documento se ha elaborado para intentar homogeneizar la asistencia de los pacientes con DPM metastásico; es decir, de aquellos con un tumor primario que se extiende a la pleura y desarrollan un derrame pleural (DP) uni o bilateral secundario. Se ha excluido el mesotelioma pleural, tanto por sus características particulares como por su baja prevalencia en nuestro medio.
A partir de un guion inicial, se consensuaron unas «Controversias Clínicas» sobre aspectos diagnósticos o terapéuticos del DPM, bajo el planteamiento metodológico de una pregunta PICO (Patient, Intervention, Comparison and Outcome). Se realizó una búsqueda preliminar («scoping search») seleccionando los estudios potencialmente relevantes. Fue llevada a cabo en mayo del 2019 en las siguientes bases de datos electrónicas: PubMed, Trip Database, Cochrane Database of Systematic Reviews y Cochrane Central Register of Controlled Trials (CCRCT). En una segunda etapa entre agosto y octubre del 2019 se realizaron búsquedas específicas para aquellas controversias en las que no se identificaron suficientes estudios durante la primera etapa. Se consultaron Embase, Pubmed y CCRCT, sin límite lingüístico ni temporal, con actualizaciones durante el año 2020. Otros detalles sobre la estrategia de búsqueda se describen en el Material Suplementario.
Cada autor llevó a cabo una revisión y lectura crítica de la bibliografía dando respuesta a dichas controversias clínicas. Se siguieron los criterios GRADE (Grading of Recommendations, Assessment, Development and Evaluation)8 para cuantificar la fuerza de las recomendaciones en cada una de las controversias planteadas (tablas 3 y 4). Después de tres procesos de revisión se aprobó del documento final por parte del grupo de trabajo, siendo posteriormente revisado y aprobado por el Comité Científico y la Junta Directiva de la SECT.
Sistema GRADE: significado de los 4 niveles de evidencia
| Niveles de calidad | Definición actual | Concepto anterior |
|---|---|---|
| Alto | Alta confianza en la coincidencia entre el efecto real y el estimado | La confianza en la estimación del efecto no variará en posteriores estudios |
| Moderado | Moderada confianza en la estimación del efecto. Hay posibilidad de que el efecto real esté alejado del efectoestimado | Posteriores estudios pueden tener un importante impacto en nuestra confianza en la estimación del efecto |
| Bajo | Confianza limitada en la estimación del efecto. El efecto real puede estar lejos del estimado | Es muy probable que posteriores estudios cambien nuestra confianza en la estimación del efecto |
| Muy bajo | Poca confianza en el efecto estimado. El efecto verdadero muy probablemente sea diferente del estimado | Cualquier estimación es muy incierta |
GRADE: Grading of Recommendations, Assessment, Development and Evaluations
Clasificación del nivel de evidencia según el sistema GRADE
| Tipo de estudio | Nivel de calidada priori | Desciende si | Sube si | Nivel de calidada posteriori |
|---|---|---|---|---|
| Estudios aleatorizados | Alta | Riesgo de sesgo-1 importante-2 muy importanteInconsistencia-1 importante-2 muy importante | Efecto + 1 grande + 2 muy grandeDosis-respuesta + 1 gradiente evidente | AltaModerada |
| Estudios observacionales | Baja | No evidencia directa-1 importante-2 muy importanteImprecisión-1 importante-2 muy importanteSesgo de publicación-1 probable-2 muy probable | Todos los factores de confusión + 1 reducirían el efecto observado + 1 sugerirían un efecto espurio si no hay efecto observado | BajaMuy baja |
GRADE: Grading of Recommendations, Assessment, Development and Evaluations
El análisis citológico del líquido pleural es diagnóstico en alrededor del 55% de los DPM, si bien este porcentaje se ve influenciado por una serie de factores como el tipo de tumor primario, la experiencia del citólogo, el número de especímenes remitidos para análisis, la forma en que se examinan y el volumen de líquido pleural procesado9. Las recomendaciones más aceptadas serían: 1) enviar al menos 20 a 40 mL de líquido pleural para análisis citológico; 2) generar tanto un frotis teñido con Papanicolaou o May-Grunwald Giemsa, como un bloque celular fijado en formalina, parafinado y teñido con hematoxilina-eosina, ya que ofrecen información complementaria. Así, en un estudio de 414 DPM, el 11% de los líquidos pleurales con frotis negativos mostraron un bloque positivo para malignidad, mientras que ocurrió lo contrario en el 15% de ocasiones10; 3) solicitar un segundo estudio citológico mediante nueva toracocentesis si el primero ha resultado negativo y existe sospecha fundada de malignidad. En un estudio de 214 pacientes con DPM cuyo primer estudio citológico resultó negativo, el examen de una nueva muestra fue diagnóstico en 55 casos (26%)2. No se recomiendan estudios citológicos ulteriores; y 4) hacer uso de las tinciones inmunocitoquímicas sobre el bloque celular para definir el origen de las metástasis pleurales, así como de técnicas de biología molecular sobre el sobrenadante, frotis o bloque celular del líquido pleural para la toma de decisiones terapéuticas9.
La biopsia pleural se recomienda cuando el estudio citológico del líquido pleural es negativo, se sospecha malignidad y se quiere confirmar dicho diagnóstico porque el paciente sería candidato a un tratamiento oncológico activo. Existen tres modalidades de biopsia pleural: la biopsia cerrada o «a ciegas», la guiada por imagen (ecografía o tomografía computarizada [TC]) y la obtenida a través de una videotoracoscopia (VTC). La biopsia cerrada tiene una rentabilidad inferior a la citología del líquido debido a que la invasión tumoral de la pleura es mayoritariamente parcheada o focal. No obstante, la biopsia cerrada puede llegar a diagnosticar hasta un 20% de DPM con citologías de líquido pleural falsamente negativas11.
La biopsia pleural guiada por técnicas de imagen tiene una rentabilidad muy superior, siempre que exista suficiente engrosamiento pleural (>1 cm) o lesiones nodulares focales. En dos estudios randomizados la biopsia pleural con aguja Tru-cut dirigida por TC tuvo una sensibilidad diagnóstica del 87% vs. 40-47% de la biopsia pleural cerrada con aguja de Abrams12,13. Un estudio randomizado encontró que la biopsia pleural asistida (no en tiempo real) por ecografía con aguja Tru-cut fue menos sensible que la dirigida por TC con aguja de Abrams (61% vs. 77%)14. Es plausible pensar que el uso de ecografía en tiempo real probablemente hubiera incrementado dicha sensibilidad. Además de la presencia de engrosamiento pleural, un mayor tamaño de la aguja de biopsia se relaciona significativamente con un mayor rendimiento diagnóstico15.
La VTC tiene una sensibilidad del 93-95% para confirmar la naturaleza maligna de un DP11. Puede realizarse bajo sedación intravenosa y anestesia local o mediante anestesia general, prefiriéndose la primera por los menores costes y estancia hospitalaria16. Sus únicas contraindicaciones son la obliteración del espacio pleural por adherencias extensas y una hipercapnia basal. Además de la toma de biopsias pleurales bajo visión directa, la VTC permite realizar una pleurodesis con talco en pulverizado (poudrage) y la colocación de un catéter pleural tunelizado (CPT). En un estudio randomizado de 90 pacientes el rendimiento diagnóstico de la VTC rígida fue superior al de la variante semirrígida (97,8% vs. 73,3%)17. Esta diferencia se atribuyó al menor tamaño de las biopsias pleurales obtenidas mediante el toracoscopio semirrígido; algo que se podría solventar teóricamente con el uso de criobiopsias. No obstante, un metaanálisis reciente que comparó 311 criobiopsias pleurales frente a 275 obtenidas mediante fórceps no encontró diferencias en el rendimiento diagnóstico (96,5% vs. 93,1%)18. En otro estudio donde se randomizaron 73 pacientes no se encontraron diferencias estadísticamente significativas entre la sensibilidad de la biopsia pleural obtenida por mini-toracoscopia o por VTC semirrígida (69,4% vs. 81,1%)19. Finalmente, la comparación entre VTC médica y biopsia pleural guiada por TC (aguja de Abrams) en un único estudio randomizado mostró superioridad numérica, pero no estadísticamente significativa, para el diagnóstico de malignidad con el primero de estos procedimientos (95,2% vs. 86,8%)20.
La prevalencia de DPM asintomáticos oscila entre el 14 y el 41%, aunque no está establecido cuántos de estos pacientes terminan desarrollando síntomas21. En un estudio retrospectivo multicéntrico, 46 de 113 pacientes (41%) con un DPM asintomático asociado a cáncer de pulmón desarrollaron síntomas que requirieron la intervención sobre el espacio pleural durante un año de seguimiento, a pesar de la instauración de un tratamiento oncológico apropiado22. En un estudio multicéntrico internacional de 540 pacientes con DPM, el 53,6% requirió tratamiento definitivo con pleurodesis o CPT23. En otro estudio retrospectivo de 556 pacientes con cáncer de pulmón, el 40% desarrolló DP en algún momento de la evolución de la enfermedad. En la mitad de estos casos el DP era demasiado pequeño para poder realizar una toracocentesis diagnóstica. Este tipo de DP mínimos no progresaron a DP sintomáticos, pero se asociaron a una peor supervivencia24. De los DPM demostrados por toracocentesis, el 84% necesitó de alguna intervención paliativa sobre el espacio pleural. El consenso general es el de no actuar sobre el DP cuando este es asintomático6,10,25–27.
Predecir un pulmón atrapado es crucial cuando se prevé realizar una pleurodesis, ya que su existencia la contraindicaría y dejaría al CPT como única opción terapéutica. El pulmón no se expande en aproximadamente el 30% de los pacientes con DPM6,28,29. Una rara complicación de la toracocentesis terapéutica (<0,1%) es el edema pulmonar post reexpansión (EPR)30. Para evitarlo se recomienda finalizar la evacuación cuando el paciente presente síntomas como molestias torácicas, dolor, tos persistente o disnea.
La manometría pleural permite el cálculo de la elastancia (cambio en la presión del espacio pleural en cm H20/L de líquido extraído) con la finalidad de predecir si el pulmón se expandirá31,32. Una elastancia > 14,5 cm H20/L sugiere un pulmón no expansible y valores > 19 cm H20/L se relacionan con fallo en la pleurodesis33,34.
En un estudio randomizado de 124 pacientes, el empleo de manometría pleural durante una toracocentesis terapéutica no redujo el riesgo de complicaciones en comparación con la suspensión del procedimiento cuando el paciente presenta síntomas o ya se ha extraído todo el líquido35. Cuando se utiliza manometría, la toracentesis se suspende si se alcanza una presión pleural de -20 cm H2033,36,37.
Un «pulmón atrapado o no expansible» es aquel incapaz de expandirse y ocupar > 50% de la cavidad torácica tras la evacuación del DP38. No existen estudios randomizados que investiguen específicamente el manejo terapéutico del pulmón atrapado en el DPM. Una revisión sistemática concluyó que ante un pulmón atrapado en el contexto de un DPM la mejor opción terapéutica es el CPT39. Este mejora la sintomatología40, reduce la estancia hospitalaria y tiene escasos efectos adversos en aquellos pacientes con DPM y pulmón no expansible41. En esta línea, varios estudios observacionales concluyen lo mismo, con mejorías sintomáticas en más del 94% de los casos42–44.
El DPM loculado es aquel que presenta diversas colecciones líquidas debido a la compartimentalización del espacio pleural. En estos casos el drenaje del DP no consigue la reexpansión completa del pulmón, por lo que la pleurodesis estaría contraindicada y el CPT tampoco conseguiría evacuar totalmente el espacio pleural, limitando así la mejoría sintomática del paciente45. Existen varios estudios randomizados que han investigado el papel de los fibrinolíticos en el tratamiento de los DPM loculados, observándose mejorías radiológicas y la posterior realización de pleurodesis con tasas de éxito entre 80-95%. El estudio más reciente, el TIME3, analizó la disnea y el resultado de la pleurodesis en 71 pacientes con DPM multiseptado a los que se les instilaba uroquinasa intrapleural frente a placebo. No se encontraron diferencias en el grado de mejoría de la disnea ni en el porcentaje de fracaso de la pleurodesis. No obstante, la uroquinasa se asoció a una disminución del volumen radiológico del DP y una reducción de la estancia hospitalaria46.
Más de la mitad de los DPM recidivan a las pocas semanas de una toracocentesis terapéutica inicial, por lo que se recomienda la realización de procedimientos pleurales definitivos en esos casos. El talco es el agente esclerosante más efectivo para realizar una pleurodesis, una vez se ha conseguido la evacuación completa del DPM y la reexpansión pulmonar1,28,47.
La administración de talco en suspensión (slurry) es tan efectiva como la administración de talco pulverizado (poudrage)28,47. Las tasas de éxito del talco slurry oscilan entre el 81 y el 100%48–50; unos porcentajes similares a los descritos para el talco poudrage. En casos de recurrencia del DPM tras un primer intento de pleurodesis, la realización de un segundo procedimiento con el empleo de talco poudrage a través de VTC o la inserción de un CPT son las técnicas más utilizadas.
Ninguno de los cuatro ECA publicados ha encontrado diferencias significativas en términos de éxito de la pleurodesis al comparar ambas técnicas51–54 (tabla 5). En el mayor estudio aleatorizado, no se observaron diferencias en la tasa de pleurodesis con talco poudrage o slurry a los 30 días en pacientes con reexpansión pulmonar inicial > 90% (78% vs. 71%)51. No obstante, el talco poudrage fue superior en el subgrupo de pacientes con cáncer de mama o pulmón (82% vs. 67%). Recientemente, Bhatnagar et al. no hallaron diferencias significativas al comparar ambas técnicas en la tasa de fallo de la pleurodesis a los 30 (10% vs. 14%), 90 (22% vs. 24%) o 180 días (29% vs. 28%)52. El estudio, sin embargo, no tuvo potencia estadística para encontrar diferencias inferiores al 15% entre los grupos de tratamiento, que algunos podrían considerar clínicamente relevantes.
Estudios aleatorizados comparando pleurodesis con talco en polvo y en suspensión en el DPM
| Autor | Año | N | Resultados |
|---|---|---|---|
| Yim et al.53 | 1996 | 57 (28 poudrage; 29 slurry) | Sin diferencias significativas en recurrencia (3,5% poudrage vs. 10,3% slurry; p = NS).Similar tasa de complicaciones (10,7% poudrage vs. 6,9% slurry; p = NS). |
| Dresler et al.51 | 2005 | 482 (240 poudrage; 242 slurry) | Similar tasa de pleurodesis a los 30 días (78% vs. 71%; p = 0,169).Mayor tasa de pleurodesis con el uso de poudrage en cáncer mama/pulmón (82% vs. 67%; p = 0,022). |
| Terra et al.54 | 2009 | 60 (30 poudrage; 30 slurry) | Sin diferencias significativas en recurrencia (16,6% poudrage vs. 13,3% slurry; p = 0,999).Similar tasa de complicaciones (23,3% poudrage vs. 30% slurry; p = 0,559). |
| Bhatnagar et al.52 | 2020 | 330 (166 poudrage; 164 slurry) | Similar tasa de fallo de pleurodesis a los 30 días (10% vs. 14%; p = 0,29).Similar tasa de fallo de pleurodesis a los 90 días (22% vs. 24%; p = 0,74).Similar tasa de fallo de pleurodesis a los 180 días (29% vs. 28%; p = 0,86). |
DPM: derrame pleural maligno; NS: no significativo.
La pleurodesis suele fracasar en alrededor del 25-30% de los casos55, particularmente en pacientes con cáncer de pulmón y mesotelioma56,57. Ante un fallo de la pleurodesis se puede optar por colocar un CPT o por intentar una nueva pleurodesis, bien mediante VTC o a través de un drenaje torácico. La experiencia publicada sobre re-pleurodesis es anecdótica y basada en la descripción de casos aislados56,58,59, por lo que la recomendación general es hacer uso del CPT, si técnicamente es posible colocarlo60.
Se han publicado cinco ECA comparando la pleurodesis química con el CPT61–65, siendo los más relevantes el TIME262 y el AMPLE64. El TIME2 estudió si el CPT es más efectivo que la inserción de un tubo de drenaje seguido de pleurodesis con talco slurry para aliviar la disnea de pacientes con DPM. Se randomizaron 106 pacientes; 52 al grupo de CPT y 54 al de pleurodesis con talco62. La disnea basal mejoró en ambos grupos por igual. No obstante, a los seis meses los resultados favorecieron al grupo CPT. El CPT se asoció con un menor número de días de estancia hospitalaria a lo largo de un año (1 vs. 4,5 días) y menor necesidad de procedimientos pleurales ulteriores (6% vs. 22%), pero un mayor riesgo de efectos secundarios, fundamentalmente infecciones. El estudio AMPLE randomizó 144 pacientes con DPM sintomático a un tratamiento con CPT o una pleurodesis con talco slurry para evaluar el número total de días que requería el paciente en el hospital desde el procedimiento hasta su muerte o los 12 meses de seguimiento, excluyendo el tiempo de quimioterapia en régimen de hospital de día64. Este número de días fue significativamente menor en el grupo CPT (10 vs. 12 días), aunque la magnitud de esta diferencia tiene una importancia clínica incierta. El estudio también demostró que ambos grupos mejoraron por igual la disnea y calidad de vida y que se requirieron menos procedimientos pleurales ulteriores en el grupo CPT (4% vs. 22%), si bien hubo mayores efectos adversos globales no graves (30% vs. 18%).
Un reciente metaanálisis en red concluyó que el CPT es una primera línea de tratamiento del DPM tan válida como la pleurodesis66. En comparación con el talco slurry, el CPT consigue con menor frecuencia una pleurodesis, pero controla la disnea de forma similar y se asocia con una menor necesidad de procedimientos pleurales posteriores. Las desventajas son la necesidad de llevar colocado un CPT y el riesgo de infecciones. Aproximadamente el 50% de los CPT pueden ser retirados debido a pleurodesis espontánea, después de una mediana de 50 días de su inserción67. Se producen infecciones, bien de la piel que rodea la entrada del CPT o del líquido pleural, en el 5-8% de los casos67,68. Cabe destacar que el porcentaje de infecciones es similar en pacientes que reciben quimioterapia o que están neutropénicos, por lo que dichas circunstancias no deben contraindicar la inserción de un CPT69. La infección del espacio pleural no implica la retirada del CPT. La obstrucción del CPT (5%), que puede resolverse con instilaciones de suero salino o fibrinolíticos, o el desarrollo de múltiples septos (<15%), que puede requerir de fibrinolíticos intrapleurales, son otras complicaciones menores67.
Varios estudios no randomizados con un número limitado de pacientes han mostrado que la colocación de un CPT durante una VTC con talcaje reduce la estancia hospitalaria, consigue la sínfisis pleural después de una mediana de una semana y, en caso de pulmón no expansible, evita nuevos procedimientos puesto que el CPT ya se ha colocado previamente70–72.
Para muchos pacientes con un CPT, no solo la mejoría de la disnea y de la calidad de vida son el objetivo terapéutico, sino también la retirada de aquél en el plazo más breve posible. Cuanto menos tiempo se lleve el CPT, menores serán los costes y las potenciales complicaciones derivadas del mismo.
Se desconoce cuál debe ser el esquema de drenaje idóneo del CPT. En la práctica existen dos opciones: 1) drenaje basado en los síntomas, lo cual suele comportar dos o tres drenajes semanales; y 2) drenaje intensivo o diario. Los ensayos ASAP73 y AMPLE274 demostraron que el drenaje intensivo consigue un mayor grado de autopleurodesis y, en consecuencia, de retirada del CPT (47% vs. 24% a las 12 semanas en ASAP, y 37,2% vs. 11,4% a los dos meses en AMPLE2). Otra aproximación que reduce el tiempo de pleurodesis es la instilación de talco slurry (4 g) a través del CPT (43% de autopleurodesis vs. 23% en el grupo placebo a las cinco semanas en el estudio IPC-plus)75.
Un escenario que se plantea con frecuencia es el de la necesidad o no de un tratamiento pleural definitivo inicial (pleurodesis o CPT) en pacientes con un DPM sintomático secundario a una neoplasia con expectativa de respuesta al tratamiento sistémico antitumoral. La guía europea establece que, debido a la falta de evidencia, no pueden extraerse conclusiones firmes sobre el valor del tratamiento sistémico para controlar el DPM4. Por ello, dado que el tratamiento definitivo sobre el DPM es seguro y efectivo, se recomienda aplicarlo también en estas situaciones.
En general, en las neoplasias hematológicas se recomienda iniciar la quimioterapia de forma precoz76,77, si bien algunos investigadores promueven la realización de procedimientos pleurales definitivos desde el inicio si el DPM es sintomático78.
En el cáncer de mama, una serie retrospectiva de 108 pacientes con DPM dividió a las pacientes en dos grupos según recibieran o no pleurodesis desde el inicio, además de la terapia sistémica correspondiente. La mediana de supervivencia libre de progresión pleural fue mayor en aquellas sometidas a pleurodesis inicialmente (8,5 vs. 4,1 meses)79.
En pacientes con carcinoma de pulmón de célula pequeña (CPCP) una actitud inicial podría ser esperar al efecto del tratamiento sistémico, pero no hay estudios sólidos que lo apoyen. Un estudio retrospectivo de 373 pacientes con CPCP evidenció una tasa de resolución del DPM tras la primera línea de tratamiento del 55%80. Por otro lado, drenar el DP antes de una quimioterapia podría evitar la toxicidad derivada potencialmente de su acumulación en un tercer espacio.
En el carcinoma de pulmón de célula no pequeña (CPCNP), no parece que esperar al efecto del tratamiento sistémico tenga algún beneficio sobre el control del DPM. En los pocos estudios disponibles, el uso de nuevas terapias (terapias diana, inmunoterapia, entre otras) no mejora el control del DPM en los pacientes con CPCNP38,81. En un estudio de cohortes de 233 pacientes con DPM secundario a cáncer de pulmón (mayoritariamente CPCNP) el control precoz del DPM con pleurodesis o CPT, además de las terapias diana, redujo significativamente la necesidad de reintervenciones sobre el espacio pleural en comparación con aquellos que recibieron solo terapias diana (23,5% vs. 53,8%)81.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Juan Ignacio Martín Sánchez
Responsable de Área de Medicina Basada en la Evidencia. Área de Transferencia del Conocimiento.
Instituto Aragonés de Ciencias de la Salud (IACS). Centro de Investigación Biomédica de Aragón (CIBA). Zaragoza.