La invasión macrovascular (IMV) en los pacientes con carcinoma hepatocelular (CHC) es un factor de muy mal pronóstico. El tratamiento de estos casos es todavía controvertido. El objetivo de este estudio es valorar los resultados a corto y a largo plazo de la resección hepática asociada a trombectomía en una serie de pacientes con CHC asociado a IMV.
MétodosEstudio retrospectivo de cohortes en los pacientes sometidos a resección hepática por CHC durante el período 2007-2015 (n=120). Del total, 108 pacientes no presentaban IMV, mientras 12 presentaban al diagnóstico IMV: 1paciente presentaba IMV en la porta común (Vp4), 8pacientes en ramas portales de primer orden (Vp3), 1paciente en ramas sectoriales (Vp2), 1paciente en ramas segmentarias (Vp1), y además 1paciente presentaba trombosis en una vena suprahepática principal hasta la entrada en vena cava (Vv2).
ResultadosLos pacientes con IMV necesitaron con mayor frecuencia una hepatectomía mayor frente a los sin IMV (83,3% vs 25,9%, p<0,0001), sin diferencias en cuanto a mortalidad y morbilidad grave postoperatoria. Los casos con IMV requirieron un tiempo operatorio más largo y desarrollaron con más frecuencia ascitis postoperatoria (33,3% vs 9,3%, p=0,034).
La supervivencia global a 1, 3 y 5años fue del 66,7, del 33,3 y del 22,2%, respectivamente, en los pacientes con IMV, y del 90,7, del 72,4 y del 52,2% en el grupo sin IMV (p=0,009).
ConclusiónLa hepatectomía asociada a trombectomía parece estar justificada en un grupo seleccionado de pacientes con CHC e IMV, pudiendo aportar un beneficio de supervivencia con una aceptable tasa de morbilidad.
Macrovascular invasion (MVI) in patients with hepatocellular carcinoma (HCC) is a very poor prognostic factor. Treatment in such cases is still a matter of debate. The goal of this study is to assess short- and long-term results of liver resection and thrombectomy in a series of patients with HCC and MVI.
MethodsRetrospective cohort study of patients who underwent liver resection for HCC in the period 2007-2015 (n=120). Of all the patients, 108 did not have MVI, while 12 presented with MVI: 1patient in the common portal vein (Vp4), 8patients in first-order portal branches (Vp3), 1patient in a sectorial branch (Vp2), 1patient in a segmental branch (Vp1); another patient presented with tumor thrombus in a main hepatic venous branch in the confluence with the vena cava (Vv2).
ResultsPatients with MVI needed major hepatic resection more frequently than patients without MVI (83.3% vs 25.9%, P<.0001), with no differences in postoperative mortality or severe morbidity. Patients with MVI required a longer operative time and developed more frequently postoperative ascites (33.3% vs 9.3%, P=.034).
Global survival at 1, 3 and 5years was 66.7%, 33.3% and 22.2% in patients with IMV, and 90.7%, 72.4% and 52.2% in patients without IMV (P=.009), respectively.
ConclusionsHepatectomy associated with thrombectomy might be justified in a selected group of patients with HCC and MVI, offering a potential benefit in survival with acceptable morbidity.
El carcinoma hepatocelular (CHC) tiene tendencia a diseminarse a través del sistema portal y venoso intrahepático, siendo la invasión macrovascular (IMV) un criterio de enfermedad avanzada y de muy mal pronóstico1. La IMV en el tronco portal puede contribuir al aumento de la presión portal, con el riesgo de sangrado por varices, ascitis y descompensación hepática; la trombosis tumoral en las venas hepáticas o su extensión a la vena cava puede causar embolismo pulmonar o diseminación intrapulmonar tras la embolización de trombos tumorales hacia la aurícula derecha. Sin tratamiento, el CHC con IMV está asociado a una supervivencia mediana de menos de 3meses2.
Las opciones de tratamiento en estos casos avanzados están parcialmente limitadas en los países occidentales por las actuales guías de la American Association for the Study of the Liver Diseases (AASLD)3 y de la European Association for the Study of the Liver (EASL)4, basadas en el algoritmo terapéutico de la Barcelona Clinic for Liver Cancer (BCLC)5, que en los casos de IMV (estadioC) recomienda terapia sistémica.
Sin embargo, un grupo seleccionado de pacientes con CHC y trombosis portal pueden beneficiarse también del tratamiento quirúrgico o de terapias intraarteriales, por lo que tanto la Asociación Americana Hepato-Pancreático-Biliar6 como la Sociedad Japonesa de Hepatología7 han llegado a incluir estos tratamientos como opciones terapéuticas.
En este estudio se han analizado la técnica quirúrgica, las complicaciones postoperatorias y la supervivencia a largo plazo de una serie de pacientes con CHC asociado a IMV comparándolos con aquellas de pacientes operados en el mismo periodo, sin IMV. Además, se han intentado detectar, con un estudio univariante y multivariante, los factores de riesgo asociados con un peor pronóstico.
MétodosEstudio retrospectivo de tipo cohortes en los pacientes sometidos a resección hepática por CHC con y sin trombosis macroscópica entre los años 2007 y 2015. El estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital General Universitario Gregorio Marañón.
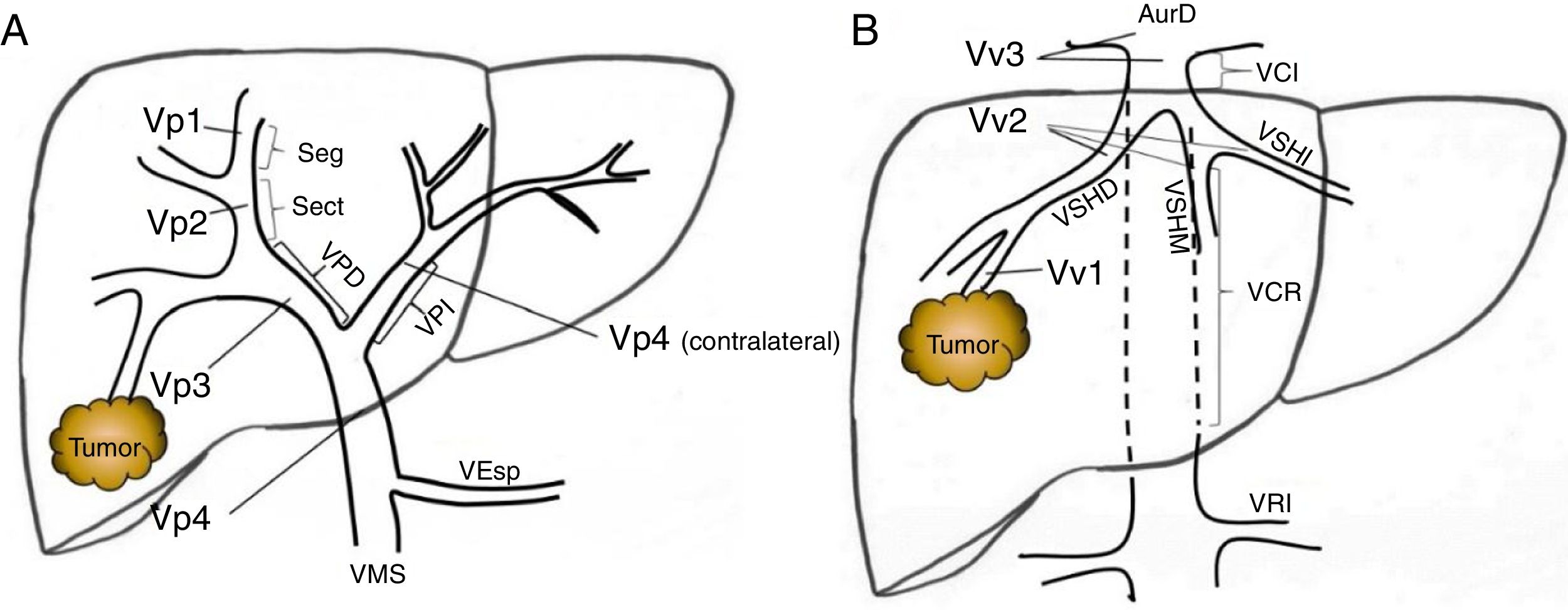
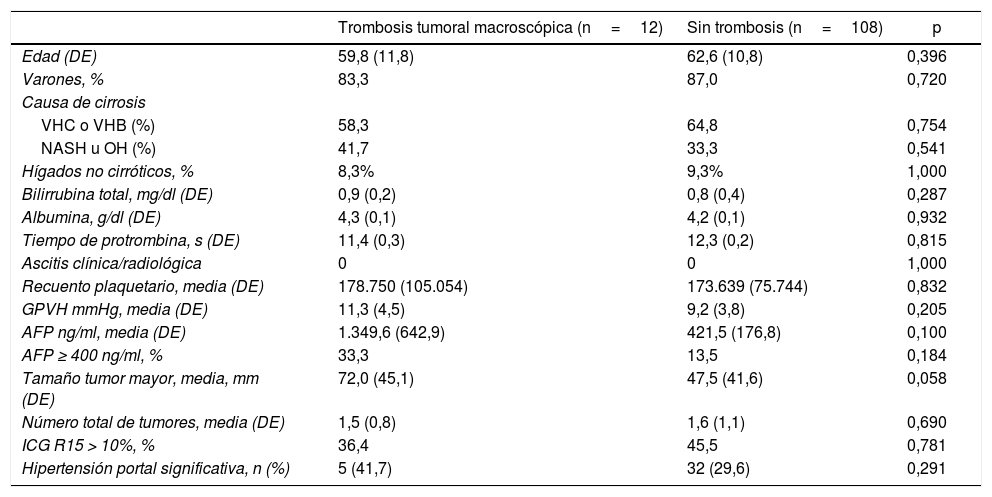
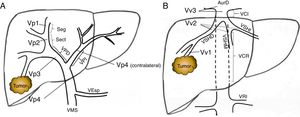
Estadificación preoperatoriaLa enfermedad extrahepática se descartó a través de una tomografía computarizada (TC) toraco-abdomino-pélvica y una gammagrafía ósea. La carga tumoral hepática fue estudiada al menos con TC y/o resonancia magnética (RM). El diagnóstico diferencial entre trombo benigno y trombo tumoral se realizó preoperatoriamente por criterios radiológicos (hipervascularización en fase arterial con lavado en fase portal), mediante TC o con ecografía con contraste (Sonovue®, Bracco, Italia). En caso de duda, se realizó punción percutánea ecoguiada (aguja 18G) para realizar un estudio histológico del trombo. Se ha clasificado el nivel de afectación tumoral portal y venoso siguiendo la nomenclatura del sistema de estadificación japonés8 (fig. 1).
Clasificación del nivel de trombosis tumoral portal (A) y del sistema venoso suprahepático/cava (B) según la nomenclatura japonesa.
A: Vp1, presencia de trombo tumoral en ramas segmentarias (Seg) o subsegmentarias; Vp2, trombo tumoral en las ramas portales de segundo orden (sectoriales, Sect); Vp3, trombo tumoral en las ramas de primer orden (vena porta derecha o vena porta izquierda); Vp4, trombo tumoral en el tronco portal principal y/o en el sistema portal contralateral al lóbulo afectado.
B: Vv1, presencia de trombo tumoral en ramas venosas hepáticas periféricas, incluyendo la invasión microvascular; Vv2, trombo tumoral en ramas venosas suprahepáticas principales; Vv3, trombo tumoral en vena cava inferior.
AurD: aurícula derecha; VCI: vena cava inferior; VCR: vena cava retrohepática; VEsp: vena esplénica; VMS: vena mesentérica superior; VPD: vena porta derecha; VPI: vena porta izquierda; VRI: vena renal izquierda; VSHD: vena suprahepática derecha; VSHI: vena suprahepática izquierda; VSHM: vena suprahepática media.
Para la planificación preoperatoria se realizó una volumetría hepática, una medición de gradiente de presión venosa hepática (GPVH) por vía transyugular para conocer el grado de hipertensión portal (considerado clínicamente significativo si ≥10mmHg)9 y un estudio del aclaramiento del verde de indocianina (ICG) para determinar la reserva funcional hepática10.
En 47 pacientes (39,2%), al no disponer de medición directa de GPVH, se consideró una cifra de plaquetas inferior a 100/nl asociada a un hiperesplenismo superior a 12cm como criterio de hipertensión portal clínicamente significativa11. De los pacientes clasificados con hipertensión portal significativa (en total 37 en toda la serie), solo para 3 (8,1%) se utilizó el criterio indirecto. Solo 1paciente (8,3%) de la cohorte con IMV (sin datos de hipertensión portal significativa) se clasificó en base a los criterios indirectos.
Criterios de resección quirúrgicaTodos los pacientes fueron evaluados en el Comité Multidisciplinar de Hepatocarcinoma, que, aunque utiliza el algoritmo del BCLC5, amplió los criterios de resección quirúrgica respaldado por los resultados de varios centros a nivel internacional12-14.
Se indicó la cirugía en los pacientes con trombosis macroscópica si cumplían los siguientes criterios: 1)función hepática preservada (Child-PughA) sin presencia de ascitis ni descompensaciones previas; 2)posibilidad de realizar una resección tumoral completa R0, incluyendo el trombo tumoral y dejando un volumen de remanente hepático superior al 40% del volumen total en caso de hígado cirrotico; 3)ausencia de invasión de porta contralateral y de vena cava, y 4)ausencia de enfermedad extrahepática.
La presencia de hipertensión portal significativa no se consideró como criterio estricto de exclusión de cara a la resección15,16.
Procedimiento quirúrgicoEn los casos con IMV se realizó: 1)una re-estadificación intraoperatoria con ecografía en modoB y con contraste para determinar el tamaño y la extensión de la IMV, además de comprobar posibles modificaciones secundarias en el flujo portal o venoso; 2)la resección portal primero y la parenquimatosa con mínima manipulación, por vía anterior, después, y 3)una resección hepática anatómica.
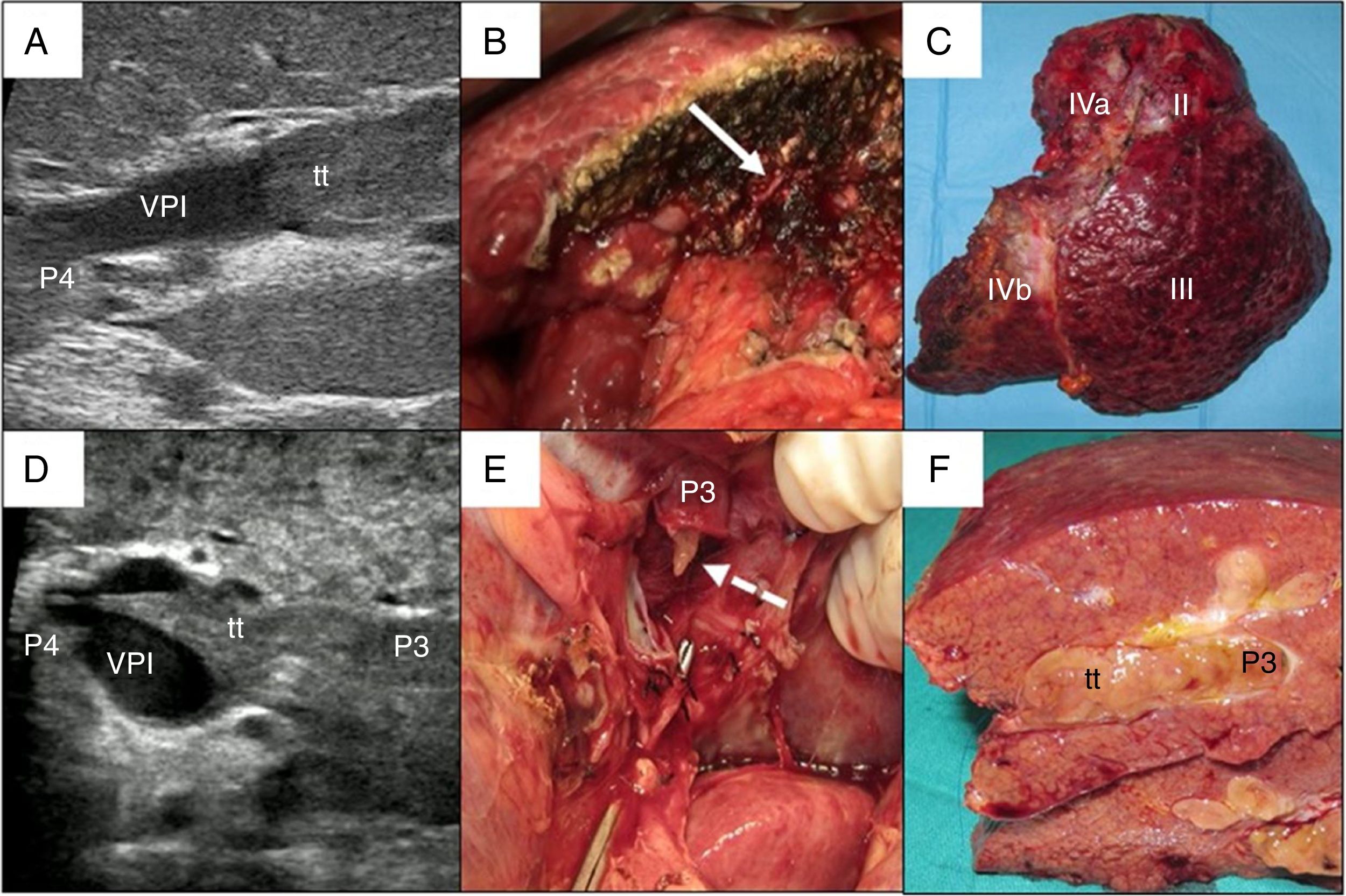
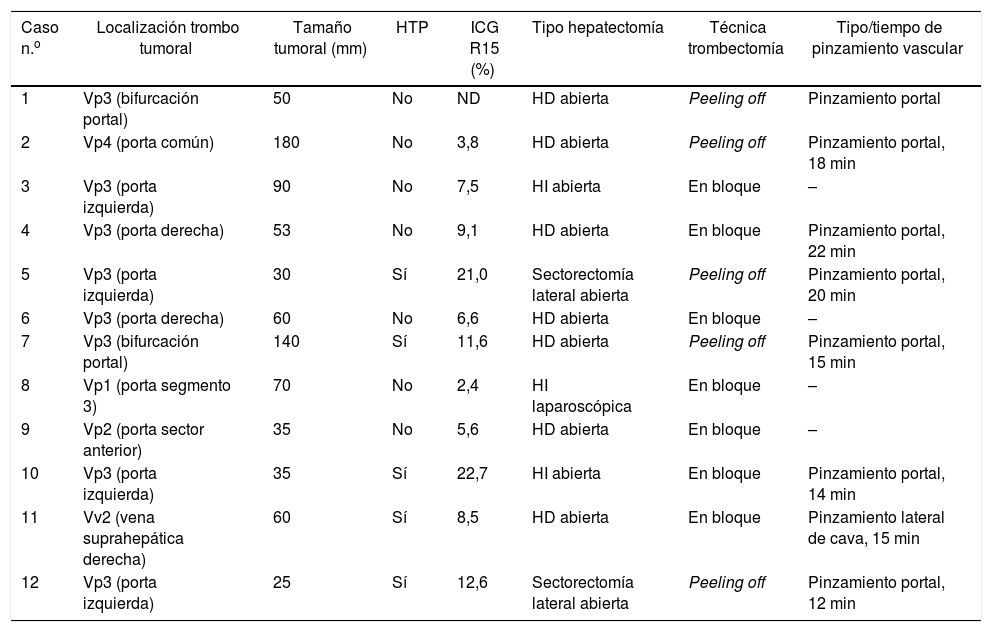
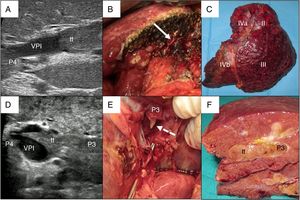
En los casos de trombo portal maligno se usaron dos modalidades de hepatectomía: 1)la resección en bloque17 (fig. 2A-C), cuando se disponía de un volumen remanente suficiente y de un manguito entre la rama portal a seccionar y el extremo proximal del trombo, y 2)la técnica del peeling off18 (fig. 2D-F) en los casos con un aclaramiento de ICG reducido y/o con volumen hepático remanente insuficiente en el caso de ejecutar una resección en bloque. El peeling off permite ahorrar parénquima mediante una trombectomía portal cuando el frente del trombo se extiende más allá de la rama portal a ligar. Esta técnica incluye: 1)control vascular y pinzamiento portal proximal y distal-contralateral al territorio de origen del trombo; 2)venotomía portal y extracción del trombo; 3)lavado de las ramas portales con suero heparinizado a presión y por arrastre, tras despinzamiento parcial proximal, y 4)sutura de la venotomía (hígado remanente). En el paciente con trombo tumoral localizado en la vena suprahepática se invirtió el procedimiento, realizando primero resección del parénquima por vía anterior y después un pinzamiento lateral de la vena cava retrohepática para verificar la completa extirpación del trombo.
Ejemplos de hepatectomía izquierda en bloque (caso 1, A-C) y sectorectomía lateral con técnica del peeling off (caso 2, D-F).
Caso 1. A: La ecografía intraoperatoria del sector lateral muestra el frente del trombo tumoral (tt) procedente de la rama portal del segmentoII, que penetra parcialmente hacia la luz de la vena porta izquierda (VPI), dejando libre las ramas portales del segmentoIV (P4). B: Con un remanente hepático adecuado, se ejecuta resección en bloque (muñón vena porta izquierda señalado con flecha). C: Hepatectomía izquierda (segmentosII-III-IV).
Caso 2. D: En este otro caso, la ecografía intraoperatoria del sector lateral muestra el trombo tumoral (tt) que, desde el segmentoIII, atraviesa completamente la luz de la vena porta izquierda (VPI) hasta introducirse en la rama portal del segmentoIV (P4). E: Dado el volumen remanente insuficiente para realizar una hepatectomía izquierda, la técnica del peeling off permite retranquear el frente del trombo tumoral a través de una venotomía en el sector umbilical de la VPI. La flecha discontinua señala el tt asomándose a través de P3 (vena porta del segmentoIII). F: Pieza de sectorectomía lateral tallada, con trombo tumoral (tt) ocupando completamente la luz portal.
Se incluyen en el estudio un total de 120 pacientes con CHC sometidos a resección quirúrgica. La cohorte de estudio (n=12) comprende los pacientes con CHC y trombosis maligna (11 pacientes con IMV en el sistema portal y 1paciente con IMV localizada en el sistema venoso hepático); la cohorte sin IMV incluye 108 pacientes, de los cuales 15 en estadio0 (13,9%), 69 en estadioA (63,9%) y 24 en estadioB (22,2%).
Se han analizado, de forma retrospectiva: variables demográficas, etiología de la hepatopatía, parámetros de función hepática preoperatoria, carga tumoral hepática (incluyendo valores de alfafetoproteína [AFP] preoperatorios), técnica quirúrgica (tipo de hepatectomía, tiempo de isquemia transitoria, procedimientos asociados como ablación con radiofrecuencia (RFA), alcoholización o resecciones hepáticas limitadas atípicas (tumorectomías), tiempo operatorio y necesidad de transfusión de concentrados de hematíes. Se han estudiado las complicaciones postoperatorias generales (clasificadas según la escala de Dindo-Clavien)19 y otras específicas de disfunción hepática postoperatoria (insuficiencia hepática según los criterios «50-50»20, desarrollo de ascitis). Los valores de AFP se han estudiado como variable continua y categórica, utilizando como punto de corte 400ng/ml, según en el sistema de estadificación CLIP21. Además, se han recogido los datos relativos a los tratamientos postoperatorios de las eventuales recidivas.
Seguimiento postoperatorioEl seguimiento de los pacientes operados se ha realizado de forma rutinaria con TC toraco-abdomino-pélvica y AFP al mes de la cirugía y sucesivamente (salvo hallazgos clínicos intercurrentes) con TC y AFP cada 3meses. En caso de duda de recidiva intrahepática se realizó RM en lugar de TC. Todas las decisiones diagnósticas y terapéuticas correspondientes se consensuaron en el Comité Multidisciplinar de CHC de nuestra institución.
Análisis estadísticoLas variables categóricas entre los grupos se han comparado usando el test de chi-cuadrado o el test exacto de Fisher, mientras que las variables continuas se han comparado con el test t de Student o el test de Mann-Whitney. El análisis de supervivencia se ha realizado con curvas de Kaplan-Meier. Las curvas de supervivencia se han comparado con el test log-rank. Un análisis multivariante de Cox se ha realizado para identificar las variables independientemente asociadas con una peor supervivencia entre las significativas en el análisis univariante. Los datos se han analizado utilizando el software estadístico SPSS®, IBM®, versión 20.
ResultadosLas dos cohortes no presentaban diferencias preoperatorias significativas, aunque hay que reseñar que había una tendencia en los pacientes con IMV a presentar un tamaño tumoral mediamente mayor (tabla 1).
Comparación de los datos demográficos y preoperatorios entre los dos grupos
| Trombosis tumoral macroscópica (n=12) | Sin trombosis (n=108) | p | |
|---|---|---|---|
| Edad (DE) | 59,8 (11,8) | 62,6 (10,8) | 0,396 |
| Varones, % | 83,3 | 87,0 | 0,720 |
| Causa de cirrosis | |||
| VHC o VHB (%) | 58,3 | 64,8 | 0,754 |
| NASH u OH (%) | 41,7 | 33,3 | 0,541 |
| Hígados no cirróticos, % | 8,3% | 9,3% | 1,000 |
| Bilirrubina total, mg/dl (DE) | 0,9 (0,2) | 0,8 (0,4) | 0,287 |
| Albumina, g/dl (DE) | 4,3 (0,1) | 4,2 (0,1) | 0,932 |
| Tiempo de protrombina, s (DE) | 11,4 (0,3) | 12,3 (0,2) | 0,815 |
| Ascitis clínica/radiológica | 0 | 0 | 1,000 |
| Recuento plaquetario, media (DE) | 178.750 (105.054) | 173.639 (75.744) | 0,832 |
| GPVH mmHg, media (DE) | 11,3 (4,5) | 9,2 (3,8) | 0,205 |
| AFP ng/ml, media (DE) | 1.349,6 (642,9) | 421,5 (176,8) | 0,100 |
| AFP ≥ 400 ng/ml, % | 33,3 | 13,5 | 0,184 |
| Tamaño tumor mayor, media, mm (DE) | 72,0 (45,1) | 47,5 (41,6) | 0,058 |
| Número total de tumores, media (DE) | 1,5 (0,8) | 1,6 (1,1) | 0,690 |
| ICG R15 > 10%, % | 36,4 | 45,5 | 0,781 |
| Hipertensión portal significativa, n (%) | 5 (41,7) | 32 (29,6) | 0,291 |
AFP: alfafetoproteína; ICG R15: retención de verde de indocianina a los 15 min; NASH: esteatohepatitis no alcohólica; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
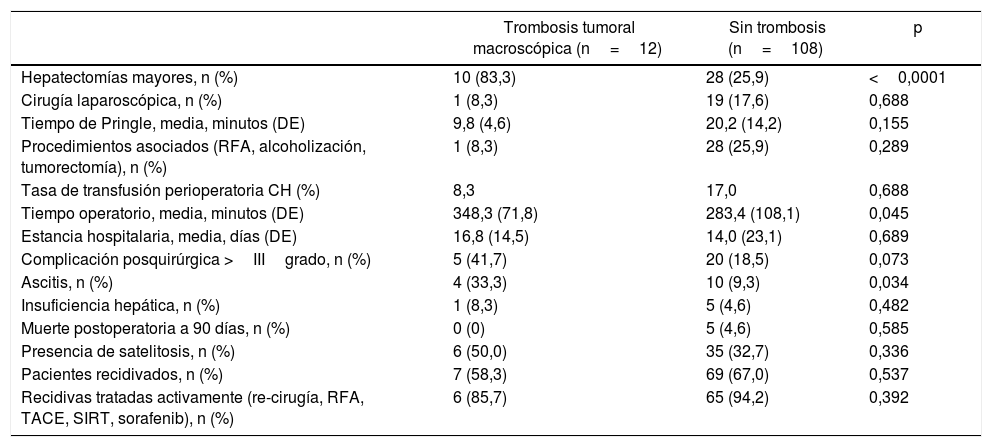
En los 12 pacientes con IMV los procedimientos consistieron en 10 resecciones mayores (3 o más segmentos hepáticos según la clasificación de Couinaud) y 2 menores (hasta 2 segmentos) (tabla 2). En proporción, en el grupo con IMV se realizaron resecciones mayores en el 83,3% de los casos frente al 25,9% del grupo sin IMV (p<0,0001). El tiempo operatorio fue en media más largo en los pacientes con IMV que en la cohorte sin IMV (348,3±71,8 vs. 283,4±108,1min, p=0,045).
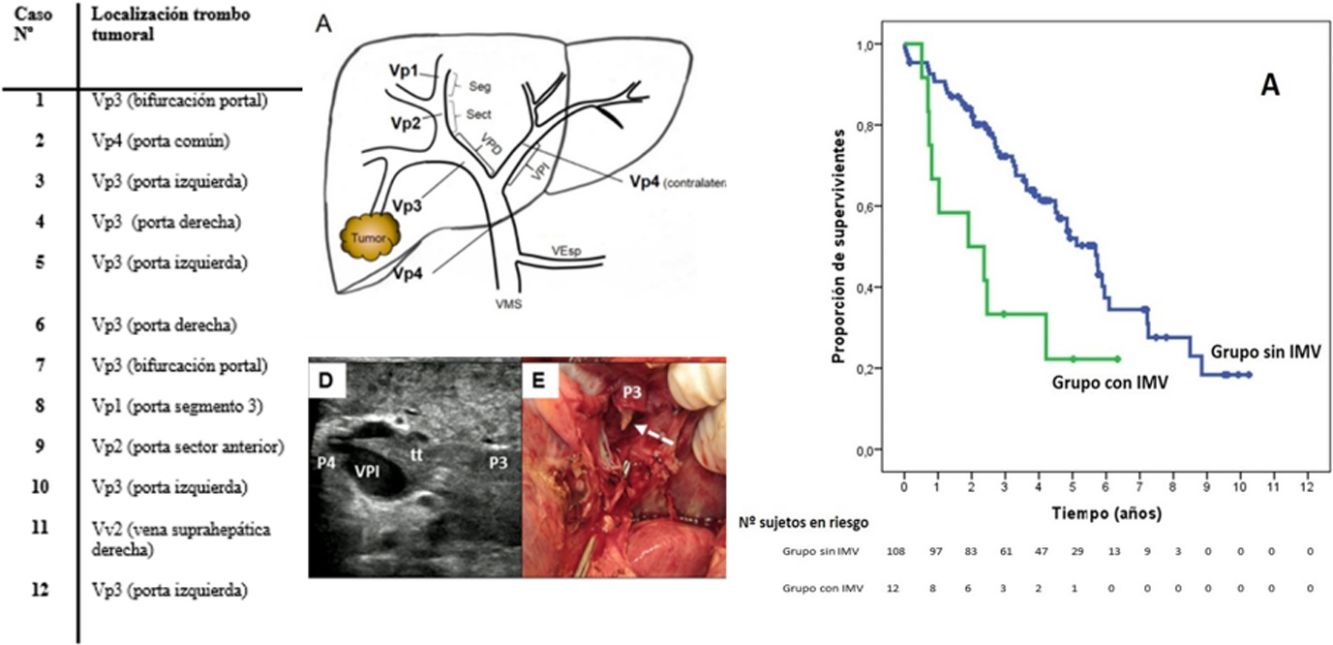
Extensión de la invasión macrovascular (IMV) en los 12 casos y técnica empleada
| Caso n.o | Localización trombo tumoral | Tamaño tumoral (mm) | HTP | ICG R15 (%) | Tipo hepatectomía | Técnica trombectomía | Tipo/tiempo de pinzamiento vascular |
|---|---|---|---|---|---|---|---|
| 1 | Vp3 (bifurcación portal) | 50 | No | ND | HD abierta | Peeling off | Pinzamiento portal |
| 2 | Vp4 (porta común) | 180 | No | 3,8 | HD abierta | Peeling off | Pinzamiento portal, 18 min |
| 3 | Vp3 (porta izquierda) | 90 | No | 7,5 | HI abierta | En bloque | – |
| 4 | Vp3 (porta derecha) | 53 | No | 9,1 | HD abierta | En bloque | Pinzamiento portal, 22 min |
| 5 | Vp3 (porta izquierda) | 30 | Sí | 21,0 | Sectorectomía lateral abierta | Peeling off | Pinzamiento portal, 20 min |
| 6 | Vp3 (porta derecha) | 60 | No | 6,6 | HD abierta | En bloque | – |
| 7 | Vp3 (bifurcación portal) | 140 | Sí | 11,6 | HD abierta | Peeling off | Pinzamiento portal, 15 min |
| 8 | Vp1 (porta segmento 3) | 70 | No | 2,4 | HI laparoscópica | En bloque | – |
| 9 | Vp2 (porta sector anterior) | 35 | No | 5,6 | HD abierta | En bloque | – |
| 10 | Vp3 (porta izquierda) | 35 | Sí | 22,7 | HI abierta | En bloque | Pinzamiento portal, 14 min |
| 11 | Vv2 (vena suprahepática derecha) | 60 | Sí | 8,5 | HD abierta | En bloque | Pinzamiento lateral de cava, 15 min |
| 12 | Vp3 (porta izquierda) | 25 | Sí | 12,6 | Sectorectomía lateral abierta | Peeling off | Pinzamiento portal, 12 min |
HD: hepatectomía derecha; HI: hepatectomía izquierda; HTP: hipertensión portal clínicamente significativa; ICG R15: porcentaje de aclaramiento de verde de indocianina a los 15 min; Vp1: trombo tumoral en rama portal segmentaria; Vp2: trombo tumoral en rama sectorial; Vp3: trombo tumoral en rama portal de primer orden; Vp4: trombo tumoral en porta común o en porta contralateral; Vv2: invasión tumoral de rama venosa hepática principal.
No hubo diferencia en los dos grupos en cuanto a necesidad de transfusión de concentrados de hematíes perioperatoria (tabla 3).
Comparación de las variables intraoperatorias y postoperatorias entre las dos cohortes
| Trombosis tumoral macroscópica (n=12) | Sin trombosis (n=108) | p | |
|---|---|---|---|
| Hepatectomías mayores, n (%) | 10 (83,3) | 28 (25,9) | <0,0001 |
| Cirugía laparoscópica, n (%) | 1 (8,3) | 19 (17,6) | 0,688 |
| Tiempo de Pringle, media, minutos (DE) | 9,8 (4,6) | 20,2 (14,2) | 0,155 |
| Procedimientos asociados (RFA, alcoholización, tumorectomía), n (%) | 1 (8,3) | 28 (25,9) | 0,289 |
| Tasa de transfusión perioperatoria CH (%) | 8,3 | 17,0 | 0,688 |
| Tiempo operatorio, media, minutos (DE) | 348,3 (71,8) | 283,4 (108,1) | 0,045 |
| Estancia hospitalaria, media, días (DE) | 16,8 (14,5) | 14,0 (23,1) | 0,689 |
| Complicación posquirúrgica >IIIgrado, n (%) | 5 (41,7) | 20 (18,5) | 0,073 |
| Ascitis, n (%) | 4 (33,3) | 10 (9,3) | 0,034 |
| Insuficiencia hepática, n (%) | 1 (8,3) | 5 (4,6) | 0,482 |
| Muerte postoperatoria a 90 días, n (%) | 0 (0) | 5 (4,6) | 0,585 |
| Presencia de satelitosis, n (%) | 6 (50,0) | 35 (32,7) | 0,336 |
| Pacientes recidivados, n (%) | 7 (58,3) | 69 (67,0) | 0,537 |
| Recidivas tratadas activamente (re-cirugía, RFA, TACE, SIRT, sorafenib), n (%) | 6 (85,7) | 65 (94,2) | 0,392 |
CH: concentrados de hematíes; RFA: ablación por radiofrecuencia.
Las tasas de morbilidad de gradoIII o superior en la escala de Dindo-Clavien19 fueron equiparables en las dos cohortes (tabla 3). Sin embargo, la incidencia de ascitis postoperatoria fue 3veces superior en los pacientes con IMV (33,3% vs. 9,3%, p=0,034). La incidencia de insuficiencia hepática postoperatoria y el tiempo de hospitalización fueron similares en ambos grupos. No hubo mortalidad a 90días en los pacientes con IMV, mientras 5pacientes (4,6%) del grupo sin IMV fallecieron en el postoperatorio (p=0,585) debido, en 3 casos, a insuficiencia hepática y, en los otros 2, a shock multiorgánico refractario tras politransfusión.
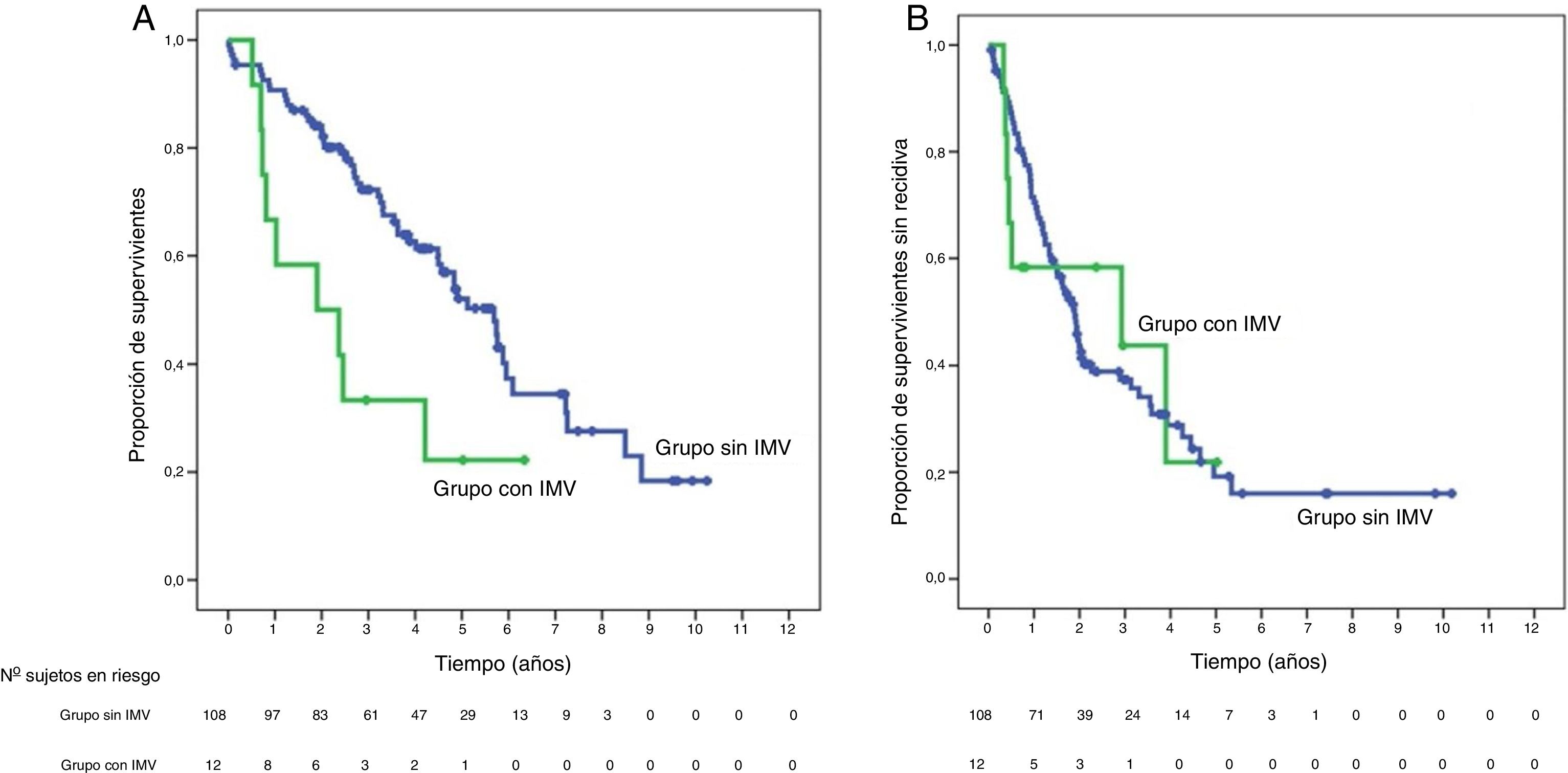
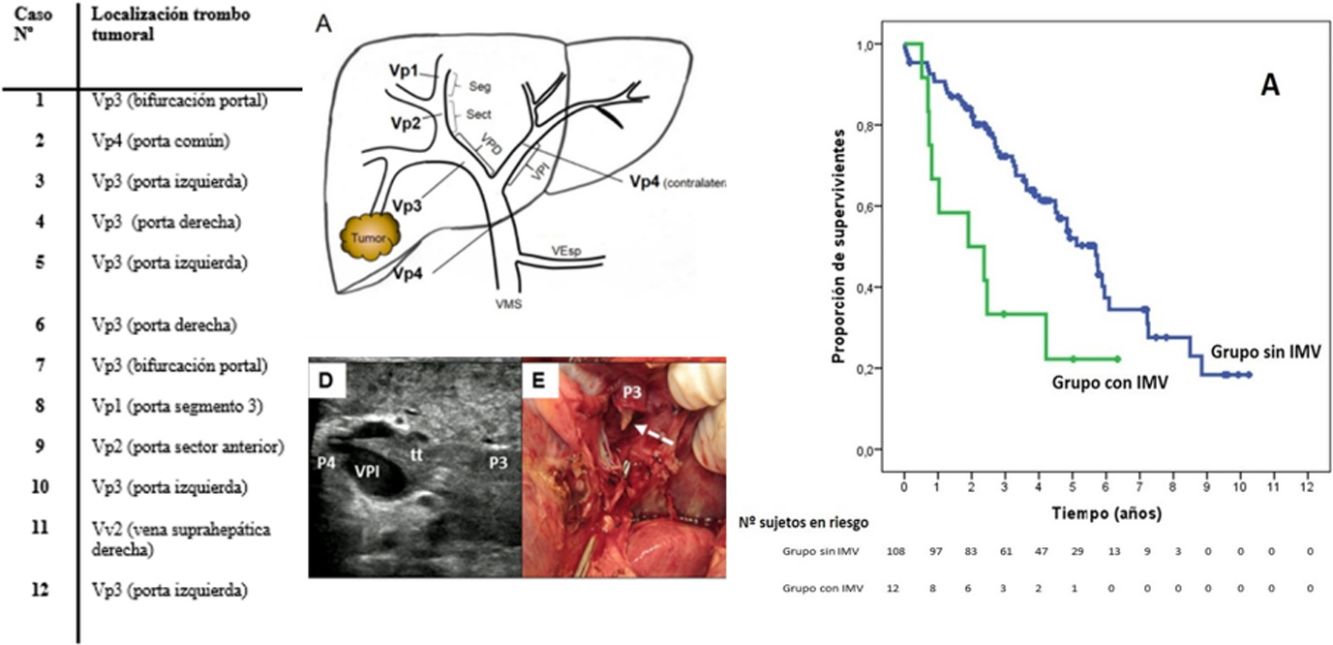
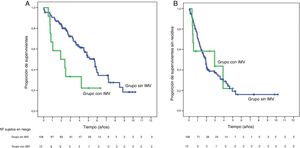
SupervivenciaCon un tiempo de seguimiento mediano de 81,3meses, la supervivencia global a 1, 3 y 5años en los pacientes con IMV fue del 66,7, del 33,3 y del 22,2%, respectivamente, con mediana de 22,8meses, y del 90,7, del 72,4 y del 52,2% en el grupo sin IMV (p=0,009), con mediana de 65,7meses (fig. 3A). No se encontraron en los dos grupos diferencias en la supervivencia libre de recidiva, que fue del 58,3, del 43,7 y del 21,9% en los casos con IMV, y del 70,5, del 37,4 y del 19,2% en el grupo sin IMV, a 1, 3 y 5años, respectivamente (p=0,988) (fig. 3B). Se trataron de manera activa, y según el criterio del Comité de Hepatocarcinoma, 6 de los 7pacientes (85,7%) que recidivaron en la cohorte con IMV (con sorafenib, quimioembolización transarterial (TACE), RFA) y 65 de los 69pacientes (el 94,2%) sin IMV que recidivaron (con re-cirugía, RFA, TACE, sorafenib) (p=0,392) (tabla 3).
Kaplan-Meier de la supervivencia global (A) y de la supervivencia libre de recidiva (B) tras la cirugía en los pacientes con IMV (en verde) frente a los sin IMV (en azul). En la tabla inferior se indican los pacientes en riesgo en cada grupo por intervalos de 1año.
IMV: invasión macrovascular.
En el análisis univariante se detectaron como variables de mal pronóstico la presencia de IMV, el tamaño tumoral superior a 10cm, la necesidad de transfusión de concentrados de hematíes y la presencia de satelitosis en la anatomía patológica. En el modelo multivariante se confirmaron como factores de mal pronóstico exclusivamente la presencia de IMV (hazard ratio [(HR]: 2,248; intervalo de confianza (IC) del 95%: 1,067-4,734, p=0,033) y de satelitosis (HR: 2,015; IC95%: 1,140-3,561, p=0,016).
DiscusiónEn las guías en vigor, tanto americanas (AASLD)3 como europeas (EASL)4, basadas en el algoritmo terapéutico del BCLC5, el tratamiento recomendado en presencia de IMV (estadioC) es la terapia sistémica con sorafenib, con una mediana de supervivencia reportada de 10,7meses22. Hay que remarcar que en la última edición de la guía europea se contempla la posibilidad de resección quirúrgica en casos seleccionados con invasión portal segmentaria o sectorial, pero no como estándar de tratamiento.
El Comité Multidisciplinar de CHC de nuestra institución tomó la decisión excepcional de indicar cirugía para estos pacientes basándose en la amplia experiencia de varios grupos orientales y occidentales, que, en la práctica clínica, superan las indicaciones del AASLD-EASL con aceptables beneficios de supervivencia para los pacientes12,17,23-25. Por lo tanto, nuestra serie es una de las pioneras en España que recoge los resultados de la resección hepática en el estadioC del BCLC en un grupo seleccionado de pacientes.
El trasplante hepático está contraindicado en presencia de trombosis tumoral macroscópica por ser un factor de recidiva tumoral precoz (antes de 1año) y por afectar la supervivencia global26-29.
Entre los tratamientos locorregionales la TACE, aunque históricamente contraindicada por el supuesto riesgo de desencadenar atrofia o una necrosis hepática en un territorio ya comprometido desde el punto de vista vascular30, ha demostrado presentar un buen perfil de seguridad hasta en pacientes con IMV en la porta común, gracias a técnicas de cateterización arteriales más selectivas31-33, y resultados similares a los obtenidos con sorafenib, aunque falten estudios comparativos prospectivos.
La radioterapia interna selectiva (SIRT) con microesferas de itrio90 no parece tener mejores resultados oncológicos para los estadios intermedios y avanzados en términos de supervivencia global que el tratamiento sistémico con sorafenib, como demostraron los recientes ensayos clínicos aleatorizados SARAH34 y SIRveNIB35.
Otra opción terapéutica prometedora es la radioterapia corporal estereotáctica (SBRT), que puede ofrecer control local de la enfermedad también en presencia de IMV36,37.
Accidentalmente, Kumada et al.38 utilizaron al principio de los años noventa la trombectomía como método de descompresión portal urgente para prevenir el riesgo de hemorragia por varices: los pacientes presentaban una supervivencia más larga de lo esperado, de hasta 16meses de media. A continuación, Minagawa et al.39 presentaron una primera serie (n=18) de pacientes sometidos a resección quirúrgica, tras haber respondido a TACE, como tratamiento de hepatocarcinoma con IMV portal y sin metástasis a distancia, demostrando una supervivencia del 42% a los 5años. Desde entonces, el registro nacional japonés ha ido inventariando los resultados a largo plazo de la indicación de resección quirúrgica en los casos de IMV portal (tanto ChildA comoB). Los datos presentados recientemente por Kokudo et al.25 indican que la supervivencia mediana en los pacientes sometidos a resección quirúrgica (n=2.093) fue 1,77años superior a la del grupo no quirúrgico (n=4.381), que había recibido tratamientos locorregionales (TACE, ablación), quimioterapia sistémica (excepto sorafenib) o tratamiento de soporte.
Esta experiencia, originaria de países asiáticos, también se ha ido extendiendo a otros centros terciarios occidentales. Un estudio multicéntrico publicado en 201323 que recoge datos de 10departamentos de cirugía hepatobiliopancreática (solamente 3 eran asiáticos, 4 eran europeos y 3 norteamericanos) pone de manifiesto que en la «vida real», y no solo en Oriente, muchos equipos buscan alternativas a las indicaciones rígidas del algoritmo del BCLC, ofertando cirugía con intención radical también a los pacientes con CHC en estadiosB yC del BCLC.
Existen algunas limitaciones en nuestro estudio: 1)su diseño retrospectivo; 2)un sesgo de selección, habiéndose incluido para resección quirúrgica solo los pacientes con función hepática relativamente conservada, sin invasión de porta contralateral ni de vena cava; 3)un tamaño muestral limitado (n=12) y perteneciente a un único centro, y 4)otros tratamientos postoperatorios (sorafenib, RFA, re-cirugía, TACE, SIRT) se han aplicado de forma dispersa e individualizada (dosis, momento de la indicación, tolerancia), por lo que son de difícil interpretación y reagrupación para su análisis estadístico en buena parte de los pacientes de una y otra cohorte, lo que pudo haber influido en la supervivencia global de toda la serie.
Cabe reseñar que, según las recomendaciones de la AASLD-EASL, los pacientes en estadioC solo recibirían tratamiento sistémico con finalidad puramente paliativa, mientras que en nuestra serie el tratamiento quirúrgico en casos seleccionados ha permitido lograr la posibilidad de supervivencias prolongadas (con una mediana de casi 2años), dejando la puerta abierta a los tratamientos de las posibles recidivas.
Podemos reseñar que no se han encontrado diferencias de supervivencia libre de recidiva en los dos grupos. Esto se puede explicar, a nuestro juicio, por dos reconocidos factores de riesgo de recidiva del CHC: por un lado, la alta prevalencia (>90%) en ambos grupos de hígados cirróticos, y por otro, la presencia de 24pacientes (22,2%) con estadioB en el grupo sin IMV.
A pesar de las limitaciones enumeradas más arriba, esta serie muestra que en los pacientes con CHC asociado a IMV sin diseminación extrahepática y que presenten una aceptable reserva funcional hepática, exceptuando los casos con afectación de porta contralateral y de vena cava, la resección hepática con trombectomía es una opción terapéutica válida, ofreciendo una supervivencia mediana de hasta 22,8meses a expensas de un mayor riesgo de ascitis postoperatoria y de un tiempo operatorio más largo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses para la publicación de este manuscrito.
Los autores desean agradecer a María del Carmen de la Cruz, del Instituto de Investigación Sanitaria del Gregorio Marañón (IiSGM), por su ayuda en la edición del protocolo para el Comité Ético, a José María Bellón, de la Unidad de Apoyo al Diseño de Proyectos y Análisis estadístico (IiSGM), por la ayuda en el análisis estadístico.