Se analizan las resecciones hepáticas mayores realizadas en 10 años, con el objetivo principal de evaluar los resultados perioperatorios. Como objetivos secundarios, se evalúan los factores relacionados con las complicaciones mayores y el análisis comparativo de 2periodos de 5 años.
MétodosAnálisis retrospectivo de pacientes intervenidos mediante una resección hepática mayor (3 o más segmentos) desde enero de 2005 hasta diciembre de 2014, de los datos pre-, intra- y postoperatorios. Se utiliza la clasificación de Clavien para el análisis de la morbilidad postoperatoria.
ResultadosSe realizaron 416 hepatectomías mayores, con necesidad de transfusión en 38 pacientes (9,1%) y maniobra de Pringle en el 47,7% de los casos. La mitad de los pacientes no presentaron ninguna complicación y únicamente 96 pacientes (23%) presentaron una complicación mayor. La fuga biliar fue la complicación más frecuente (n=72; 17,3% de los pacientes), sobre todo, por enfermedad maligna y derivación biliar, con ASA elevado (III-IV) y tiempo quirúrgico prolongado. Trece pacientes cumplían criterios de insuficiencia hepática, de los cuales 7 murieron (5 asociaban sobreinfección bacteriana). La estancia hospitalaria media fue de 12,5 días, con una tasa de reingreso del 11,8%. Al comparar 2periodos de 5 años, se operan pacientes más complejos, con menor incidencia de transfusiones y de complicaciones (ns).
ConclusionesLa cirugía hepática ha aumentado de forma significativa en los últimos años. El manejo quirúrgico del hígado permite en la actualidad ofrecer una cirugía segura y eficaz, con un índice de complicaciones muy bajo. El límite de la resecabilidad viene marcado por el volumen hepático residual.
We analyze major liver resections performed in 10 years, with the objective of evaluating perioperative results. As secondary objectives, factors related to major complications and comparative analyses of 25-year periods are evaluated.
MethodsRetrospective analysis of patients undergoing major hepatic resection (3 or more segments) from January 2005 to December 2014, from pre, intra and postoperative data. The Clavien classification is used for postoperative morbidity.
ResultsA total of 416 major hepatectomies were performed. Transfusions were performed in 38 patients (9.1%). A Pringle maneuver was used in 47.7% of the cases. Half of the patients had no complications, and only 96 patients (23%) had a major complication. Bile leakage was the most frequent complication (n=72, 17.3% of patients), especially due to malignant disease and biliary reconstruction, high risk ASA (III-IV) and prolonged surgical time. Thirteen patients met criteria for liver failure, of which 7died (5 associated a bacterial infection). The mean hospital stay was 12.5 days, with an 11,8% readmission rate. When comparing 25-year periods, at present more complex patients are operated on, with a lower incidence of transfusions and complications (ns).
ConclusionsLiver surgery has increased significantly in recent years. Surgical management of the liver now allows safe and effective surgery, with a very low complication rate. The limit of resectability depends on the residual hepatic volume.
La cirugía de resección hepática ha mostrado la capacidad de modificar de forma sustancial el pronóstico de pacientes que previamente se consideraban no tributarios de tratamiento con intención curativa, como los pacientes con metástasis hepáticas1 o tumores primarios hepáticos2, y ha experimentado una evolución notable desde su introducción. Como consecuencia de sus buenos resultados y de su difusión universal, ha comportado un incremento de las indicaciones, lo que conlleva, a su vez, una mayor complejidad de los procedimientos realizados. Como resultado, cada vez hay más pacientes con mayor volumen de enfermedad hepática que son valorados para resección y que últimamente son intervenidos mediante resecciones hepáticas más extensas3,4.
Por regla general, cuanta más cantidad de parénquima hepático es resecado, mayor número de complicaciones específicas hepáticas postoperatorias pueden aparecer. La morbimortalidad asociada a estas complicaciones marca los límites de la cirugía de resección hepática5,6. A diferencia de la cirugía hepática menor, que puede realizarse en la mayoría de los centros con una mínima infraestructura, la cirugía hepática mayor (resección de 3 segmentos o más) conlleva más complicaciones intraoperatorias y postoperatorias (hemorragia, insuficiencia hepática postoperatoria, fuga biliar…) y un manejo postoperatorio diferente, que precisa de una unidad de cuidados intensivos dedicada y de maniobras adicionales específicas. Todo ello conlleva que dicha cirugía se lleve a cabo normalmente en centros con una amplia experiencia en este tipo de procedimientos quirúrgicos. La experiencia obtenida tras dichas resecciones se ha constituido en un factor clave, que logra mejores resultados en términos de complicaciones y supervivencia en aquellos pacientes intervenidos en centros de referencia. Esto conduce a la agrupación de pacientes en centros de alto volumen, con políticas territoriales de derivación de cirugía hepática compleja7.
En el presente trabajo presentamos un estudio descriptivo de las resecciones hepáticas mayores consecutivas realizadas en nuestro centro en un periodo de los últimos 10 años. El objetivo fundamental es evaluar los resultados en el periodo intra- y postoperatorio inmediato en términos de morbimortalidad. Como objetivos secundarios, se analizará el factor de aprendizaje de la técnica en función de la evolución de los resultados a lo largo del tiempo y, finalmente, se evaluarán los factores que pueden determinar la aparición de las complicaciones mayores en el periodo postoperatorio.
MétodosEste es un estudio retrospectivo de datos recogidos de forma prospectiva. Se han incluido las resecciones hepáticas mayores realizadas en 10 años, desde el 1 de enero de 2005 hasta el 31 de diciembre de 2014. Durante este periodo se realizaron en nuestro centro un total de 827 resecciones hepáticas, de las que 416 fueron hepatectomías mayores, lo que constituye un 50,3% del total.
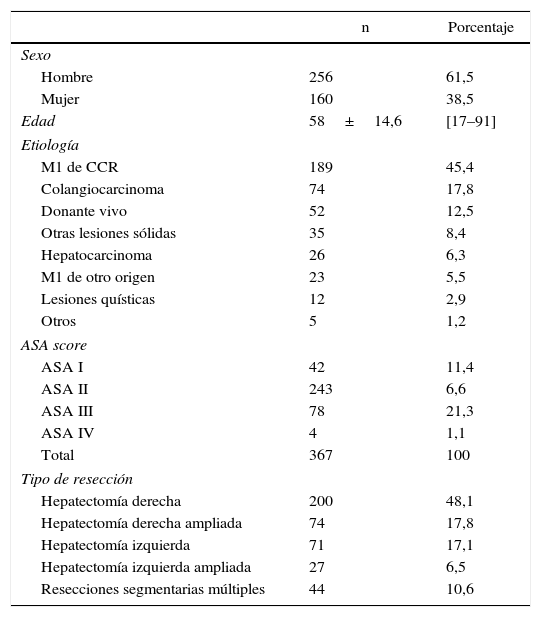
Los datos demográficos de los pacientes pueden consultarse en la tabla 1. La mayoría de los pacientes fueron de sexo masculino con una relación hombre:mujer 61,5%:38,5% y una edad media de 58±14,6 años (rango 17-91). En cuanto a la valoración del riesgo anestésico, la mayoría de los pacientes (66,2%) presentaban un riesgo anestésico (ASA score) de II.
Datos demográficos
| n | Porcentaje | |
|---|---|---|
| Sexo | ||
| Hombre | 256 | 61,5 |
| Mujer | 160 | 38,5 |
| Edad | 58±14,6 | [17–91] |
| Etiología | ||
| M1 de CCR | 189 | 45,4 |
| Colangiocarcinoma | 74 | 17,8 |
| Donante vivo | 52 | 12,5 |
| Otras lesiones sólidas | 35 | 8,4 |
| Hepatocarcinoma | 26 | 6,3 |
| M1 de otro origen | 23 | 5,5 |
| Lesiones quísticas | 12 | 2,9 |
| Otros | 5 | 1,2 |
| ASA score | ||
| ASA I | 42 | 11,4 |
| ASA II | 243 | 6,6 |
| ASA III | 78 | 21,3 |
| ASA IV | 4 | 1,1 |
| Total | 367 | 100 |
| Tipo de resección | ||
| Hepatectomía derecha | 200 | 48,1 |
| Hepatectomía derecha ampliada | 74 | 17,8 |
| Hepatectomía izquierda | 71 | 17,1 |
| Hepatectomía izquierda ampliada | 27 | 6,5 |
| Resecciones segmentarias múltiples | 44 | 10,6 |
De de los 416 procedimientos, 323 (77,3%) fueron realizados en enfermedades malignas y 95 (22,7%) en enfermedades benignas. Las causas para intervenir a los pacientes de una hepatectomía mayor se muestran en la tabla 1: la mayoría (189; 45,4%) corresponden a metástasis hepáticas de cáncer colorrectal (MHCCR). La segunda etiología más frecuente fue el colangiocarcinoma, con 74 casos (17,8%), y la tercera más frecuente fue la donación de hemihígado para trasplante hepático de donante vivo, con 52 casos (12,5%).
Datos preoperatoriosCasi un cuarto de todos los pacientes (24,5%) recibieron quimioterapia antes del procedimiento de resección hepática, que correspondían en todos los casos a MHCCR o a metástasis de otro origen.
A pesar de tratarse de resecciones hepáticas mayores, solamente en 88 pacientes (21,2%) se realizó un estudio volumétrico, especialmente en el 2.° periodo (2010-2014), coincidente también con un mayor número de casos de alta complejidad. En aquellos pacientes cuyo cálculo de volumen del remanente hepático estimado fue inferior al 20% del total en hígado normal o inferior al 30% del total en hígado patológico, o bien cuando existía un ratio sobre el peso corporal inferior al 0,6% en hígado normal o inferior al 0,8% en hígado patológico (sometido a quimioterapia o en hígado colestásico, típico de colangiocarcinoma), se practicó una embolización portal previa con el objeto de hacer una cirugía diferida para conseguir una hipertrofia del remanente hepático estimado. Este procedimiento fue llevado a cabo en 20 pacientes y lo realizó el Servicio de Angiorradiología8 en todos los casos con abordaje transparietohepático.
La mayoría de los pacientes fueron intervenidos por primera vez de cirugía hepática. No obstante, 37 (8,9%) ya presentaban una resección hepática previa.
Procedimiento quirúrgicoLas intervenciones fueron realizadas en todos los casos por un equipo quirúrgico compuesto de 4cirujanos.
En la mayoría de los pacientes (95%) se practicó el procedimiento quirúrgico mediante laparotomía. El tipo de laparotomía preferida fue la «J» de Makuuchi o una subcostal derecha con prolongación epigástrica, dependiendo de cada cirujano. Un total de 21 pacientes fueron intervenidos por vía laparoscópica. El abordaje laparoscópico en resecciones hepáticas mayores se inició en 2009, tras haber realizado esta técnica en resecciones menores (bisegmentectomías II-III y segmentos anteriores) durante los años previos.
En el caso de las hepatectomías mayores por vía laparoscópica, colocamos al paciente en hiperextensión dorsal, con las piernas abiertas y en ligero decúbito lateral izquierdo para una mejor exposición del hígado. Se realiza el neumoperitoneo a nivel de la línea media, 5-10cm por encima del ombligo, con aguja de Veress o trocar de Hasson si presentaba una laparotomía media previa. Se colocan el resto de los trocares dejando una separación de 7cm entre ellos, siguiendo la línea subcostal derecha (3 trocares adicionales más, de 12mm), y uno en flanco izquierdo que se utilizará al principio para la ecografía intraoperatoria y después para separar el hígado hacia la izquierda. Antes de realizar la transección se deja colocada una cinta alrededor del hilio para la maniobra de Pringle.
De los 21 pacientes en los que se optó por al abordaje laparoscópico, en 13 se realizaron hepatectomías derechas y en 8 hepatectomías izquierdas. La etiología fue MHCCR (n=14), hepatocarcinoma sobre hígado (n=3), colangiocarcinoma periférico (n=2) y adenomas hepáticos (n=2).
El abordaje fue con intención híbrido (inicio por laparoscopia y conversión para completar el procedimiento) en 3 casos y en un caso con asistencia. Hubo que realizar conversión a cirugía abierta en 7 casos (por presencia de adherencias, por dificultad técnica de correcta evaluación de las lesiones, por hallazgos intraoperatorios de un implante en diafragma, o por hemorragia). En 10 casos la resección hepática mayor fue completamente laparoscópica.
En todos los casos se realizó una exploración sistemática del hígado mediante ecografía intraoperatoria (Aloka© Ltd. Modelo SSD-α5). Tanto en cirugía abierta como en laparoscópica la metodología utilizada es la misma. Se inicia la exploración por reconocer la bifurcación portal y el final de trayecto de la vena hepática media. Seguimos la vena porta izquierda, su rama ascendente para el segmento IV y las ramas para los segmentos III y II. Ya en el segmento II seguimos la vena hepática izquierda y su unión con la vena hepática media para desembocar en la vena cava. Seguimos por la vena hepática derecha para terminar de explorar los segmentos del lóbulo hepático derecho. El objetivo principal de esta exploración intraoperatoria no es tanto la valoración de las lesiones ya conocidas como la identificación de nuevas lesiones no conocidas previamente.
El primer paso que realizamos es el control vascular de estructuras del hilio hepático, con disección de los vasos (arterial y portal) del territorio que resecar, sección de arterias y ligadura de porta. En la mayoría de los casos, el siguiente control vascular consiste en el drenaje de las venas hepáticas, con disección del espacio entre vena derecha y media, que nos servirá posteriormente para la hanging-maneuver. Tras realizar el piggy-back, o disección hepatocaval, colocamos una cinta que hacemos llegar hasta el hilio por encima de la vena cava y que utilizamos para exponer anteriormente el hígado. En este momento se realiza la transección hepática, utilizando periodos de oclusión vascular del pedículo portal9 (maniobra de Pringle) de 15 min, con espacios de 5 min de descanso.
Para la transección hepática se utilizó como material de disección en todos los casos el sistema compact ultrasonic surgical aspirator (CUSA®10). En cuanto al material empleado como sistema de coagulación, inicialmente se empleó una pinza bipolar o el sistema Tissuelink®11 desde 2005 hasta noviembre de 2011, y desde entonces se ha utilizado el sistema Aquamantys®12.
En 47 pacientes (11,3%) se instauró una perfusión de somatostatina a 21mL/h a concentración estándar por estimación de remanente pequeño para peso del paciente. Tras un bolo de 250μg, se continúa con una perfusión de 250μg/h durante 5 días, manteniendo al paciente en ayunas. La somatostatina tiene un efecto en la irrigación esplácnica con un resultado final de diminución del flujo portal. Iniciamos la perfusión intraoperatoria de somatostatina cuando macroscópicamente el remanente es considerado de muy pequeño tamaño, con el objetivo de disminuir el flujo portal. En estos remanentes, el factor desencadenante para el futuro del desarrollo del síndrome de small-for-size es el daño endotelial (shear-stress) provocado por el hiperaflujo portal en el sinusoide hepático13,14. En la mayoría de los casos (n=44) se inició la perfusión de somatostatina durante la cirugía, y en 3 casos en el postoperatorio inmediato.
Datos postoperatoriosInsuficiencia hepática postoperatoriaTras la intervención quirúrgica, se procedió a la retirada de la intubación orotraqueal en el quirófano con posterior traslado, bien a la sala de hospitalización convencional, bien a la Unidad de Cuidados intensivos (UCI). La necesidad de estancia postoperatoria en UCI viene dada en estos pacientes por el riesgo de desarrollar una insuficiencia hepática. Este riesgo, en el intraoperatorio, se valoró por 3 factores.
- -
Extensión de la resección hepática y del remanente hepático de pequeño tamaño:el 100% de los pacientes que precisaron de somatostatina intraoperatoria requirieron UCI.
- -
Calidad del parénquima hepático: hay fundamentalmente 2 grupos de pacientes: los pacientes con hígado colestásico, sobre todo colangiocarcinomas, y los pacientes que han recibido quimioterapia neoadyuvante potencialmente tóxica para la funcionalidad del remanente hepático (con desarrollo de un síndrome de obstrucción sinusoidal o «hígado azul» en el caso del oxaliplatino y de una esteatohepatitis o «hígado amarillo» en el caso del irinotecan)15.
- -
Hemorragia intraoperatoria: directamente relacionada con la morbimortalidad postoperatoria.
La aparición de insuficiencia hepática en el postoperatorio se ha valorado de forma clínica (encefalopatía hepática y ascitis) y analítica. Los parámetros analíticos se midieron antes de la intervención y en los días del postoperatorio 1, 3, 5, 7, 15 y 30, con especial énfasis en la bilirrubina y el tiempo de protrombina, utilizando los scores 50-50 de morbilidad (3.er a 8.° día), score 50-50 de mortalidad (5.° día)16, y el pico de bilirrubina sérica mayor de 7mg/dL durante el postoperatorio17. Además, se ha analizado la evolución de estos 2 parámetros durante la primera semana tras la cirugía. Cuando no ha existido una tendencia a la normalización, esta alteración analítica se ha correlacionado con la aparición de complicaciones postoperatorias.
DefinicionesLa resección hepática mayor se define como la resección de 3 segmentos hepáticos o más (hepatectomía derecha e izquierda regladas, hepatectomía derecha ampliada e izquierda ampliada, y resecciones hepáticas regladas de 3 o más segmentos). Como nomenclatura utilizamos la clasificación de Brisbane18 de 2000 sobre la terminología en los diferentes tipos de resección hepática.
Se definió la presencia de ascitis en el postoperatorio cuando se ha evidenciado la salida de líquido ascítico por los drenajes abdominales de al menos 500 cc/día durante al menos 3 días consecutivos.
La presencia o no de fuga biliar se confirma por el aspecto macroscópico del líquido en drenaje o tras punción percutánea. En caso de duda se ha realizado siempre un análisis bioquímico, y se ha obtenido una concentración de bilirrubina en líquido ascítico al menos 3 veces mayor que en suero19. Cuando el aspecto macroscópico de una colección puncionada de forma percutánea o recogida por un drenaje no era bilioso y, además, el análisis bioquímico no mostraba ninguna alteración de la bilirrubina, definimos el evento como colección intraabdominal.
Análisis estadísticoLas variables continuas son expresadas como media±desviación estándar. Las variables categóricas fueron analizadas con el test de Chi cuadrado o con el F de Fisher, y la diferencia entre variables continuas mediante la t de Student. Los resultados de p<0,05 se consideraron estadísticamente significativos. El análisis estadístico realizado para evaluar los factores predictivos fue un estudio univariado. Las variables que obtuvieron significación estadística (p≤0,05) en el análisis univariado se incluyeron en un modelo de regresión logística para identificar los factores de riesgo asociados. Todas las pruebas estadísticas se llevaron a cabo mediante el programa SPSS Statistics 20 para Windows (SPSS Inc., Chicago, Illinois, EE. UU.).
ResultadosDatos intraoperatoriosEn la tabla 1 se muestran los procedimientos realizados. Casi la mitad de ellos (48,1%) han sido hepatectomías derechas regladas.
En 19 casos (4,6%) se asoció un tratamiento ablativo intraoperatorio (radiofrecuencia, microondas o alcoholización), la mayoría de ellos en el segundo periodo (2010-2014).
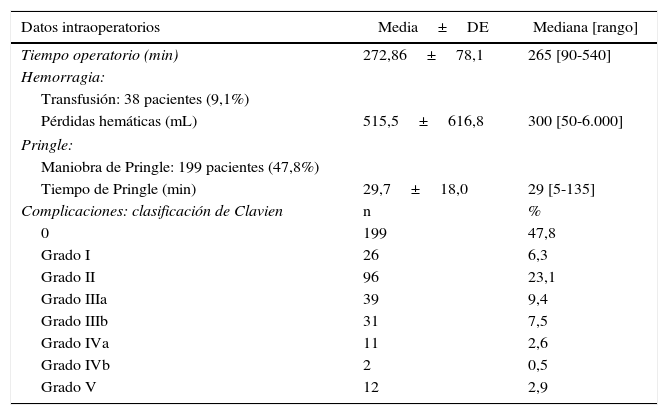
Los datos intraoperatorios se recogen en la tabla 2. El tiempo operatorio medio fue de 272,86 min. La maniobra de Pringle se realizó en 199 pacientes (47,8%). Cuando se realizó la maniobra de Pringle, el tiempo medio fue de 29,7 min. Se transfundieron un total de 38 pacientes (9,1%). En estos pacientes, la media de concentrados de hematíes transfundidos fue de 2,32 unidades (mediana: 2 unidades; rango: 1-8). Las pérdidas hemáticas medias por procedimiento fueron de 515,5mL. Se realizó una reconstrucción portal en 29 pacientes (7,0%), en el contexto de pacientes con tumores de Klatskin (n=28) con el fin de realizar una non-touch technique20 y un caso en un paciente con metástasis hepáticas de cáncer colorrectal.
Principales datos intraoperatorios y complicaciones postoperatorias según la clasificación de Clavien-Dindo
| Datos intraoperatorios | Media±DE | Mediana [rango] |
|---|---|---|
| Tiempo operatorio (min) | 272,86±78,1 | 265 [90-540] |
| Hemorragia: | ||
| Transfusión: 38 pacientes (9,1%) | ||
| Pérdidas hemáticas (mL) | 515,5±616,8 | 300 [50-6.000] |
| Pringle: | ||
| Maniobra de Pringle: 199 pacientes (47,8%) | ||
| Tiempo de Pringle (min) | 29,7±18,0 | 29 [5-135] |
| Complicaciones: clasificación de Clavien | n | % |
| 0 | 199 | 47,8 |
| Grado I | 26 | 6,3 |
| Grado II | 96 | 23,1 |
| Grado IIIa | 39 | 9,4 |
| Grado IIIb | 31 | 7,5 |
| Grado IVa | 11 | 2,6 |
| Grado IVb | 2 | 0,5 |
| Grado V | 12 | 2,9 |
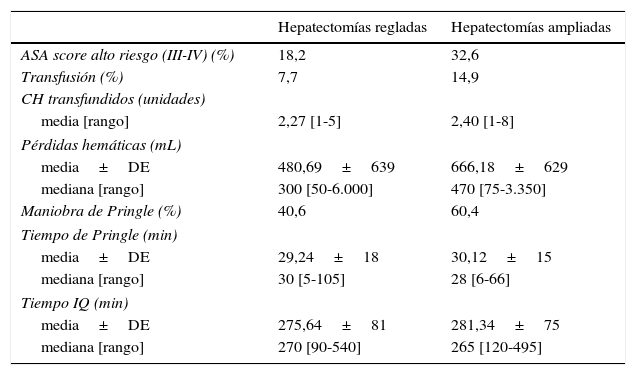
En la tabla 3 analizamos parámetros asociados a la complejidad quirúrgica, según el tipo de procedimiento realizado. Comparamos las hepatectomías regladas (derecha e izquierda) y las hepatectomías ampliadas (derecha ampliada e izquierda ampliada).
Comparación de los datos intraoperatorios entre hepatectomías regladas y ampliadas
| Hepatectomías regladas | Hepatectomías ampliadas | |
|---|---|---|
| ASA score alto riesgo (III-IV) (%) | 18,2 | 32,6 |
| Transfusión (%) | 7,7 | 14,9 |
| CH transfundidos (unidades) | ||
| media [rango] | 2,27 [1-5] | 2,40 [1-8] |
| Pérdidas hemáticas (mL) | ||
| media±DE | 480,69±639 | 666,18±629 |
| mediana [rango] | 300 [50-6.000] | 470 [75-3.350] |
| Maniobra de Pringle (%) | 40,6 | 60,4 |
| Tiempo de Pringle (min) | ||
| media±DE | 29,24±18 | 30,12±15 |
| mediana [rango] | 30 [5-105] | 28 [6-66] |
| Tiempo IQ (min) | ||
| media±DE | 275,64±81 | 281,34±75 |
| mediana [rango] | 270 [90-540] | 265 [120-495] |
En el grupo de resecciones mayores ampliadas los pacientes presentaron un mayor riesgo anestésico. Cuando comparamos las hepatectomías regladas con las hepatectomías mayores ampliadas, en estas últimas observamos mayores pérdidas hemáticas intraoperatorias, lo que conlleva una mayor tasa de transfusión sanguínea peroperatoria y una mayor utilización de la maniobra de Pringle. El tiempo de Pringle utilizado y el tiempo quirúrgico total es similar.
Datos postoperatoriosComplicaciones postoperatoriasSegún la clasificación de Clavien21, de las 416 resecciones mayores, 199 pacientes (47,8%) no presentaron ningún tipo de complicación. Hubo complicaciones menores (grado I y II de la clasificación de Clavien-Dindo) en 122 pacientes (29,3%) y complicaciones mayores (Clavien III-IV-V) en 95 pacientes (22,8%), la mayoría de tipo III. La mortalidad fue del 2,9% (12 pacientes).
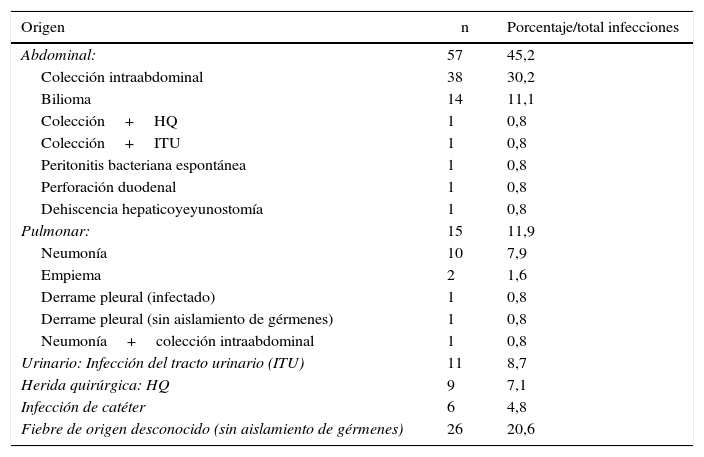
En la tabla 4 se muestran las complicaciones infecciosas, aparecidas en 126 pacientes (30,3%). Predominan las infecciones de origen abdominal (colección intraabdominal infectada y colección biliar), seguidas de infecciones del tracto urinario, infecciones de la herida quirúrgica y neumonías. En 26 pacientes no se logró identificar el origen de la fiebre.
Complicaciones infecciosas tras resecciones mayores
| Origen | n | Porcentaje/total infecciones |
|---|---|---|
| Abdominal: | 57 | 45,2 |
| Colección intraabdominal | 38 | 30,2 |
| Bilioma | 14 | 11,1 |
| Colección+HQ | 1 | 0,8 |
| Colección+ITU | 1 | 0,8 |
| Peritonitis bacteriana espontánea | 1 | 0,8 |
| Perforación duodenal | 1 | 0,8 |
| Dehiscencia hepaticoyeyunostomía | 1 | 0,8 |
| Pulmonar: | 15 | 11,9 |
| Neumonía | 10 | 7,9 |
| Empiema | 2 | 1,6 |
| Derrame pleural (infectado) | 1 | 0,8 |
| Derrame pleural (sin aislamiento de gérmenes) | 1 | 0,8 |
| Neumonía+colección intraabdominal | 1 | 0,8 |
| Urinario: Infección del tracto urinario (ITU) | 11 | 8,7 |
| Herida quirúrgica: HQ | 9 | 7,1 |
| Infección de catéter | 6 | 4,8 |
| Fiebre de origen desconocido (sin aislamiento de gérmenes) | 26 | 20,6 |
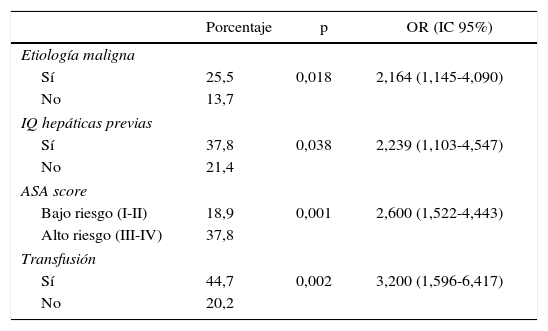
El estudio estadístico univariado de los diferentes factores que parecen influir en la aparición de complicaciones mayores en el postoperatorio (Clavien III-V) se muestran en la tabla 5.
Factores asociados a la aparición de complicaciones mayores (Clavien III-V) en el postoperatorio
| Porcentaje | p | OR (IC 95%) | |
|---|---|---|---|
| Etiología maligna | |||
| Sí | 25,5 | 0,018 | 2,164 (1,145-4,090) |
| No | 13,7 | ||
| IQ hepáticas previas | |||
| Sí | 37,8 | 0,038 | 2,239 (1,103-4,547) |
| No | 21,4 | ||
| ASA score | |||
| Bajo riesgo (I-II) | 18,9 | 0,001 | 2,600 (1,522-4,443) |
| Alto riesgo (III-IV) | 37,8 | ||
| Transfusión | |||
| Sí | 44,7 | 0,002 | 3,200 (1,596-6,417) |
| No | 20,2 | ||
Dentro de las complicaciones características de las hepatectomías mayores está la fuga biliar. Esta complicación apareció en 72 pacientes (17,3%).
De los 416 pacientes de toda la serie, en 69 de ellos (16,6%) se realizó una derivación biliar. De estos 69, hubo una fuga biliar en el postoperatorio en 36 casos (52,2%).
En los 72 pacientes que presentaron una fuga biliar, hemos analizado los resultados dividiendo los casos en 2 grupos: pacientes con reconstrucción biliar (n=36) y pacientes sin reconstrucción biliar (n=36).
Respecto a la localización de la fuga biliar, de los 36 pacientes que no presentaban una derivación biliar, en 33 casos (91,7%) la fuga se localizaba en el margen de transección. En cuanto a los 36 pacientes que sí presentaban una derivación biliar, en 14 de ellos (38,9%) esta se localizaba en la hepaticoyeyunostomía, y en 10 casos (27,8%) la fuga estaba presente en el borde de transección (en el resto de los casos de pacientes con derivación biliar no fue concluyente la localización de la fuga).
El tratamiento de las fugas biliares varió en función de la localización de la fuga, en el margen de resección o en una hepaticoyeyunostomía. La mayoría de los pacientes con fuga en el margen de resección fueron tratados de forma conservadora, o realizando un drenaje por ecografía. En cuanto a los pacientes con fuga biliar en la hepaticoyeyunostomía, en la mitad de los casos se decidió reintervenir al paciente, de entrada.
Las fugas biliares aparecieron en los diferentes tipos de hepatectomía realizados. Estas fueron más frecuentes en pacientes con etiología maligna (60 vs. 12) y fueron más prevalentes en pacientes con colangiocarcinoma (30 casos; 41,7%).
Al realizar un estudio univariante predictivo de fuga biliar, se encontraron diferencias estadísticamente significativas en cuanto a diagnóstico, score ASA y parámetros relacionados con la dificultad operatoria: transfusión peroperatoria, pérdidas hemáticas y tiempo quirúrgico.
En cuanto a la etiología, los pacientes con colangiocarcinoma presentaron una fuga biliar en el 40,5% de los casos, con una p<0,001 al compararlos con pacientes con otros diagnósticos. Los pacientes con ASA score de alto riesgo (III-IV) presentaron mayor riesgo de incidencia de fuga biliar (26,8%) que aquellos con un ASA score de bajo riesgo (I-II) (14%), con una p=0,004. También hubo diferencias estadísticamente significativas para la aparición de una fuga biliar en el postoperatorio entre los pacientes que se transfundieron en el peroperatorio, respecto a los que no se transfundieron (34,2 vs. 14,8%; p=0,015), en aquellos que tuvieron un tiempo quirúrgico prolongado (298 vs. 267min; p=0,003) y en aquellos con mayores pérdidas hemáticas (480 vs. 660mL; p=0,039).
Incidencia de insuficiencia hepáticaEn el postoperatorio, 27 pacientes tuvieron ascitis y 21 pacientes presentaron cierto grado de encefalopatía.
De los 416 pacientes operados, 13 pacientes presentaron un score 50-50 al 5.° día. De estos, 7 fallecieron (predicción de 53,8%). El segundo criterio que utilizamos es el pico de bilirrubina ≥ 7mg/dL en el postoperatorio (score de Mullen). Un total de 38 pacientes cumplían este criterio en el postoperatorio y 9 de ellos fallecieron (23,7%).
MortalidadLa mortalidad fue de 12 pacientes (2,88%).
Mortalidad inmediata: 2 pacientes fallecieron durante el postoperatorio inmediato. Uno a las 72 h por una hemorragia masiva, y el otro a las 48 h a consecuencia de una parada cardiorrespiratoria.
Insuficiencia hepática posresección: 7 pacientes fallecieron a consecuencia del desarrollo de una insuficiencia hepática posthepatectomía, aparecida en todos ellos durante los primeros 7 días. En 5 se asoció la presencia de encefalopatía hepática (grados 2 a 4), y en 3 casos presentaron ascitis. Todos excepto un paciente fallecieron como consecuencia de un fallo multiorgánico asociado a la aparición de una complicación infecciosa. El foco infeccioso fue abdominal en 5 pacientes y, en un caso, pulmonar. En el caso de la neumonía no se aisló ningún germen. En los demás casos, el germen causante de la infección implicaba un bacilo gramnegativo o un enterococo (que estaban asociados en la mayoría de las veces (3 de 5: 60%).
En los 3 pacientes restantes, la causa de la muerte fue un tromboembolismo pulmonar masivo en un caso, una trombosis de la arteria hepática en otro caso y una neumonía intrahospitalaria en el tercer caso.
Todos los pacientes fallecidos presentaban una enfermedad maligna de base, colangiocarcinoma en 8 pacientes (66,7%) y MHCCR en 4 (33,3%). La edad media era de 67,33 años (mediana: 69 años). En 2 pacientes existía una resección hepática previa. Los 8 pacientes con colangiocarcinoma que murieron representan el 10,8% de los pacientes operados con esta entidad.
Estancia hospitalaria postoperatoriaLa estancia postoperatoria media fue de 12,50 días (mediana: 9 días).
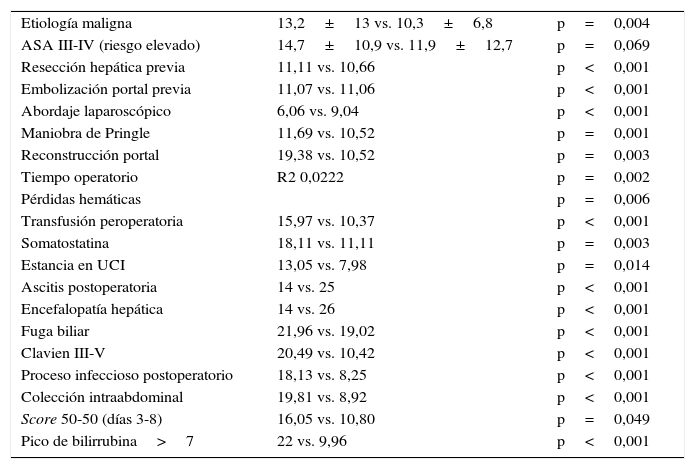
Se han analizado los factores predictivos de estancia postoperatoria realizando un análisis univariante. Las variables estadísticamente significativas (p<0,05) de estancia postoperatoria prolongada se muestran en la tabla 6. Los parámetros preoperatorios e intraoperatorios asociados a estancia postoperatoria prolongada están relacionados con una mayor dificultad quirúrgica. Los parámetros del postoperatorio asociados a mayor estancia hospitalaria son los derivados de la aparición de complicaciones posquirúrgicas.
Factores predictivos de estancia postoperatoria, en días
| Etiología maligna | 13,2±13 vs. 10,3±6,8 | p=0,004 |
| ASA III-IV (riesgo elevado) | 14,7±10,9 vs. 11,9±12,7 | p=0,069 |
| Resección hepática previa | 11,11 vs. 10,66 | p<0,001 |
| Embolización portal previa | 11,07 vs. 11,06 | p<0,001 |
| Abordaje laparoscópico | 6,06 vs. 9,04 | p<0,001 |
| Maniobra de Pringle | 11,69 vs. 10,52 | p=0,001 |
| Reconstrucción portal | 19,38 vs. 10,52 | p=0,003 |
| Tiempo operatorio | R2 0,0222 | p=0,002 |
| Pérdidas hemáticas | p=0,006 | |
| Transfusión peroperatoria | 15,97 vs. 10,37 | p<0,001 |
| Somatostatina | 18,11 vs. 11,11 | p=0,003 |
| Estancia en UCI | 13,05 vs. 7,98 | p=0,014 |
| Ascitis postoperatoria | 14 vs. 25 | p<0,001 |
| Encefalopatía hepática | 14 vs. 26 | p<0,001 |
| Fuga biliar | 21,96 vs. 19,02 | p<0,001 |
| Clavien III-V | 20,49 vs. 10,42 | p<0,001 |
| Proceso infeccioso postoperatorio | 18,13 vs. 8,25 | p<0,001 |
| Colección intraabdominal | 19,81 vs. 8,92 | p<0,001 |
| Score 50-50 (días 3-8) | 16,05 vs. 10,80 | p=0,049 |
| Pico de bilirrubina>7 | 22 vs. 9,96 | p<0,001 |
Hubo 47 pacientes (11,3%) que reingresaron en el periodo de 30 días tras ser dados de alta. Las causas más frecuentes fueron bilioma (12 casos), la mayoría ya conocidos, colección intraabdominal (9 casos) y fiebre de origen desconocido (9 casos). Se reintervino a 5 pacientes: uno por evisceración, otro por fístula intestinal, 2 en el contexto de un shock séptico por colección sobreinfectada y otro paciente por presentar un hemoperitoneo, al 3.er día del alta, secundario a una hemorragia desde la vena frénica izquierda (10 días después de la cirugía hepática). El resto de las causas de reingreso fueron casos aislados (n=1) de derrame pleural, infección de herida quirúrgica, malestar general, infección urinaria, trombosis venosa profunda, etc.
Análisis por periodosSe han dividido estos 10 años en 2 periodos de 5 años: 2005 a 2009 y 2010 a 2014. De las 416 resecciones hepáticas mayores, en el primer periodo (2005-2009) se realizaron 183 procedimientos (44%), y en el segundo periodo (2010-2014), 233 procedimientos (56%).
Al realizar un estudio comparativo entre los 2periodos, no se han visto diferencias estadísticamente significativas en las variables comparadas excepto en 4 apartados. Los 3 primeros apartados hacen referencia a la complejidad del paciente, mayor en el 2.° periodo. Así, tenemos en este 2.° periodo una mayor proporción de enfermedades malignas, una mayor utilización de volumetría y una edad mayor de los pacientes. A pesar de ser más complejos los casos, las pérdidas hemáticas son menores en el 2.° periodo: 618mL vs. 445mL (p=0,02).
Sin presentar diferencias estadísticamente significativas, en el 2.° periodo se transfundió al 8,7% de los pacientes, en comparación con el 14,5% en el primer periodo. Además, en el 2.° periodo hubo 52,8% de los pacientes que no presentaron ningún tipo de complicación, versus 41,5% en el 1.er periodo.
DiscusiónLa cirugía hepatobiliopancreática ha mostrado una evolución en progresión logarítmica en los últimos 20 años. La incorporación de la actividad en trasplante tanto hepático como pancreático ha dado lugar a un aumento en la actividad de la cirugía hepática de la resección muy relevante. Normalmente esta cirugía, considerada de alta complejidad, se asocia a una elevada morbilidad, con una incidencia de complicaciones mayores a los 30 días que puede llegar hasta el 50% y una mortalidad de hasta un 6%22–30.
A pesar de todo, no se tiene una imagen global de lo que representa esta cirugía en la actualidad. Por ello es por lo que nuestro grupo decidió revisar los últimos 10años, en el contexto de una actividad que tiene como aspecto reseñable que estábamos ya realizando trasplante hepático de donante vivo, es decir, que se asume una técnica quirúrgica depurada y muy bien estandarizada.
Recientemente, Clavien ha publicado lo que representaría la experiencia multinacional en la hepatectomía derecha en el donante vivo con más de 5.000 procedimientos, y que incluye 12 centros, entre los que se encontraba el nuestro. Se establecía así una imagen global de lo que tenía que ser de forma «ideal» el índice de complicaciones asociada a esta cirugía compleja, pero muy específica. Es lo que se conoce como benchmarking o una evaluación comparativa de los resultados.
En este estudio se establecía una incidencia de complicaciones que se encontraba en el 12% (3,8% de complicaciones mayores). Hay que entender que todo ello es en el contexto ideal de un sujeto sano y con todas las garantías a su favor. A pesar de todo, las complicaciones no son desdeñables.
Características del procedimientoLas características principales de la cirugía actual se asocian a una gran seguridad técnica. La evaluación preoperatoria mediante las pruebas de imagen asociada a la utilización sistemática de medios que permiten la transección hepática en un entorno exangüe ha permitido una reducción ostensible de la hemorragia durante y después de la intervención. En nuestra experiencia hemos analizado las pérdidas hemáticas y los requerimientos transfusionales que están relacionados con la magnitud del procedimiento (hepatectomías ampliadas). El 90,9% de los enfermos no requirieron ninguna transfusión, mientras que solo el 9,1% necesitaron ser trasfundidos, en comparación con el 49% de los pacientes transfundidos en una serie de finales de los 9031 o el 12,4% de los pacientes transfundidos en una publicación más reciente32. Cabe decir que estas series incluyen resecciones mayores y menores. En la serie multicéntrica de hepatectomías mayores de Vauthey de 200717 en pacientes no cirróticos, el 16,1% de los pacientes precisaron de transfusión perioperatoria. En los casos «ideales» de Rössler de resecciones mayores33, se transfundió a un 2% de los pacientes.
La maniobra de Pringle es un mecanismo de seguridad que se utiliza con mucha frecuencia. Tiene en principio 2vertientes, una buena en cuanto a que se señala que puede tener un cierto efecto de preconditioning9 y otra negativa que tiene que ver con la aparición posterior de lesiones isquémicas de la vía biliar. En esta serie se realizó la maniobra de Pringle en el 47,7% de los enfermos, normalmente en relación con la resección hepática ampliada. Los periodos utilizados por nuestro grupo están ampliamente contrastados en la literatura (15 min de oclusión vascular seguidos de 5 min sin pinzamiento). En la publicación de 2013 de Zimmitti32 se realizó la maniobra de Pringle en el 58,2% de las resecciones (tanto mayores como menores).
Hasta ahora, las series publicadas de resecciones hepáticas han englobado tanto las hepatectomías mayores como las menores31,32,34,35. Nadie se ha centrado en analizar las hepatectomías mayores, excepto en la publicación de Mullen de 2007 para definir el pico de bilirrubina sérica>7 como factor predictivo de insuficiencia hepática17, y el reciente estudio multicéntrico de Clavien33.
Curso postoperatorioComplicaciones globalesEn nuestra serie seleccionamos únicamente resecciones hepáticas mayores y descartamos las resecciones menores por el bajo impacto en la morbimortalidad postoperatoria.
Aparecieron complicaciones en el 52,3% de los pacientes; fueron complicaciones mayores el 23% de los casos. Estas complicaciones mayores fueron más frecuentes en etiologías malignas, pacientes con resecciones previas, ASA score de riesgo elevado y aquellos que precisaron de transfusión intraoperatoria.
Hasta que no se publicó en 2004 la clasificación de Clavien-Dindo21 y su posterior utilización, no se pueden realizar comparaciones fiables de complicaciones postoperatorias entre series. Así, existe en este periodo previo una gran variación en cuanto a la descripción de morbilidad postoperatoria, desde el 22% descrito en la serie de Belghiti de 200031 hasta el 74,9% de la serie de Jarnagin de 200234 y, posteriormente, el 39% de las complicaciones globales en la serie de Imamura de 200335. En la serie de 2007 de Vauthey de resecciones mayores17 ya se describen complicaciones según la clasificación de Clavien en el 42,8% de los pacientes, de las cuales el 16,8% fueron complicaciones mayores. Y en 2013 Zimmitti32 presentaba complicaciones en el 36,7% de los pacientes (14,1% de complicaciones mayores).
Las pérdidas hemáticas son un factor independiente de riesgo de complicaciones mayores en el postoperatorio y de mortalidad peroperatoria34,36. Se han analizado en la literatura, como factores independientes predictivos de hemorragia intraoperatoria mayor a 1.500 mL37: tiempo de Quick < 70%, tumor no periférico, afectación de venas hepáticas, IMC ≥ 23,0kg/m2, resecciones mayores, tiempo operatorio y tamaño tumoral38.
Fuga biliarHoy día, la hemorragia ha pasado a un segundo plano como problema en la cirugía hepática mayor, mientras que la fuga biliar sigue siendo el talón de Aquiles en este tipo de procedimientos, sobre todo, en las resecciones hepáticas ampliadas.
En nuestra serie existe una incidencia de fugas biliares del 17,3%. Los factores predictivos de fuga biliar se pueden dividir en 2 grupos diferentes. Por un lado, los procedimientos de mayor complejidad quirúrgica (pacientes con ASA de riesgo elevado, aquellos con mayores pérdidas hemáticas, que requirieron transfusiones sanguíneas en el peroperatorio, con un mayor tiempo quirúrgico y en aquellos en los que se instauró una perfusión de somatostatina por considerar el remanente hepático de muy pequeño tamaño). El otro grupo hace referencia a la etiología, con una mayor incidencia de fugas biliares en el colangiocarcinoma (p<0,001) debido a la realización de una derivación biliar. No encontramos diferencias en cuanto a fugas biliares al comparar los 2periodos. La presencia de esta complicación provoca una mayor estancia hospitalaria y, asimismo, una mayor tasa de complicaciones asociadas.
La incidencia de fuga biliar en la literatura permanece constante, con diferencias entre series del 4,8 al 7,6% (media: 5,5%)39–45. Incluso la incidencia de fuga biliar aumenta al comparar diferentes periodos, debido a una mayor complejidad de los procedimientos32: (5,9 vs. 3,7%; p=0,011).
Insuficiencia hepática y mortalidadEl principal riesgo tras realizar una resección hepática mayor es el desarrollo de una insuficiencia hepática y fallo hepático, lo cual está relacionado con el volumen y la calidad del remanente hepático.
En nuestra serie hemos encontrado una correlación entre los scores utilizados (score 50-5016 y pico de bilirrubina sérica>7mg/dL17) y la morbimortalidad asociada. Con 13 y 38 pacientes, respectivamente, y una predicción de mortalidad del 53,8 y del 23,7%. En el artículo de Belghiti, que incluye 775 resecciones hepáticas mayores (60%) y menores, los pacientes que presentaron un score 50-50 positivo al 5.° día tuvieron un factor predictivo de mortalidad del 59%. En la publicación de Mullen se incluyen 1.059 pacientes con una resección hepática mayor, con una mortalidad del 4,7% a los 90 días (del 3,2% a los 30 días) y una correlación potente con la morbimortalidad a partir de una bilirrubina sérica>7mg/dL. Estos scores siempre tienen que ver con el remanente hepático insuficiente, por lo que una primera evaluación intraoperatoria es obligada; se puede iniciar en el mismo acto una perfusión de somatostatina que se mantendrá durante 5días.
El fallo hepático tras una resección es la principal causa de muerte tras una resección hepática, con incidencias en la literatura que varían desde el 1,2 hasta el 32%.
En nuestra serie, la aparición de una sobreinfección en un paciente que había desarrollado una insuficiencia hepática posresección es un factor determinante en la mortalidad postoperatoria.
La incidencia de mortalidad es del 2,88%. Comparando con las series de hepatectomías, que incluyen tanto resecciones mayores como menores, se describen incidencias de mortalidad del 4,431; 3,134 y 2,3%32.
Análisis por periodosEn nuestro estudio comparativo entre los 2periodos observamos mayor proporción de enfermedades malignas, utilización de volumetría y pacientes de mayor edad. A pesar de tener un mayor número de pacientes en el 2.° periodo y de mayor complejidad quirúrgica, hubo una menor tasa de pérdidas hemáticas, de forma estadísticamente significativa, sin diferencias en cuanto a fugas biliares ni a morbimortalidad postoperatoria.
De forma similar, Nanashima et al. en 2014 publicaron un trabajo con un análisis en 3 periodos de 544 pacientes en los que se realizó una resección hepática46. Observaron un incremento en la edad de los pacientes operados, así como de esteatosis e hígados ictéricos. Los procedimientos quirúrgicos fueron más complejos en el último periodo, pero hubo menores pérdidas hemáticas y menor tasa de transfusiones sanguíneas. Esto se acompañó de una menor tasa de complicaciones postoperatorias, incluyendo las fugas biliares, lo que se tradujo en una menor estancia hospitalaria.
En la serie de Zimmitti de 2013 sobre 2.628 resecciones hepáticas realizadas entre 1997 y 2011, se dividieron 2 periodos con mismo número de casos32. Encontraron que en el 2.° periodo hubo una mayor incidencia de resecciones complejas (reintervenciones hepáticas previas, resecciones en 2 tiempos, hepatectomías ampliadas y embolización portal previa; p<0,05) y un aumento también de fugas biliares (5,9 vs. 3,7%; p=0,011).
En conclusión, la cirugía hepática mayor ofrece en la actualidad unos resultados extraordinariamente buenos, con una mortalidad y unos índices de complicaciones muy bajos. La sectorización de la enfermedad desde el punto de vista sanitario es un aspecto que puede haber influido, al conseguir así una mayor experiencia.
Autoría/colaboraciones- -
David Calatayud: diseño del estudio, adquisición y recogida de datos, análisis e interpretación de los resultados, redacción del artículo, revisión crítica y aprobación de la versión final.
- -
Santiago Sánchez Cabús: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
- -
Jaime Sampson: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
- -
Aridai Resendiz: adquisición y recogida de datos, revisión crítica y aprobación de la versión final.
- -
Víctor Molina: revisión crítica y aprobación de la versión final.
- -
Constantino Fondevila: revisión crítica y aprobación de la versión final
- -
josep fuster: revisión crítica y aprobación de la versión final.
- -
Juan Carlos García-Valdecasas: diseño del estudio, revisión crítica y aprobación de la versión final.
Los autores niegan la existencia de conflictos de intereses.