Tras 20 años de experiencia en cirugía hepática laparoscópica, aún no están bien definidos el mejor abordaje (totalmente laparoscópico [CTL] o asistido con la mano [CLA]), indicaciones quirúrgicas, posición, instrumentación, resultados postoperatorios inmediatos y a largo plazo, etc.
ObjetivoPresentar nuestra experiencia en resecciones hepáticas laparoscópicas (RHL).
Pacientes y métodoEn 10 años hemos realizado 132 RHL en 129 pacientes: 112 tumores malignos (90 metástasis hepáticas; 22 tumores malignos primarios) y 20 lesiones benignas (18 tumores benignos; 2 quistes hidatídicos). Veintiocho casos se realizaron por CTL y 104 por CLA. Técnica quirúrgica: 6 hepatectomías derechas (2 como segundo tiempo de una resección hepática en 2 tiempos); 6 hepatectomías izquierdas; 9 resecciones de 3 segmentos; 42 resecciones de 2 segmentos; 64 resecciones de un segmento y 5 casos de resecciones locales.
ResultadosNo existió mortalidad perioperatoria. Morbilidad: 3%. Con CTL se completó la resección en 23/28 casos, mientras que con CLA se completó en los 104 casos. Transfusión 4,5%; tiempo quirúrgico 150min y estancia media de 3,5 días. La supervivencia a 1, 3 y 5 años de los tumores malignos primarios fue del 100, 86 y 62%, mientras que la supervivencia de las metástasis colorrectales fue del 92, 82 y 52%, respectivamente.
ConclusiónLa RHL, tanto por CTL como por CLA, en casos seleccionados, reproduce los resultados de la cirugía abierta (morbimortalidad y supervivencia a 5 años similares), con las ventajas de la cirugía mínimamente invasiva.
After 20 years of experience in laparoscopic liver surgery there is still no clear definition of the best approach (totally laparoscopic [TLS] or hand-assisted [HAS]), the indications for surgery, position, instrumentation, immediate and long-term postoperative results, etc.
AimTo report our experience in laparoscopic liver resections (LLRs).
Patients and methodOver a period of 10 years we performed 132 LLRs in 129 patients: 112 malignant tumours (90 hepatic metastases; 22 primary malignant tumours) and 20 benign lesions (18 benign tumours; 2 hydatid cysts). Twenty-eight cases received TLS and 104 had HAS. Surgical technique: 6 right hepatectomies (2 as the second stage of a two-stage liver resection); 6 left hepatectomies; 9 resections of 3 segments; 42 resections of 2 segments; 64 resections of one segment; and 5 cases of local resections.
ResultsThere was no perioperative mortality, and morbidity was 3%. With TLS the resection was completed in 23/28 cases, whereas with HAS it was completed in all 104 cases. Transfusion: 4,5%; operating time: 150min; and mean length of stay: 3,5 days. The 1-, 3- and 5-year survival rates for the primary malignant tumours were 100, 86 and 62%, and for colorectal metastases 92, 82 and 52%, respectively.
ConclusionLLR via both TLS and HAS in selected cases are similar to the results of open surgery (similar 5-year morbidity, mortality and survival rates) but with the advantages of minimally invasive surgery.
Las indicaciones de cirugía hepática laparoscópica (CHL), definidas en el año 20001, continúan vigentes en el 2009, establecidas nuevamente en la reunión de Louisville2: tumores menores de 5cm localizados en el lóbulo izquierdo anatómico hepático o en segmentos anteriores. Las resecciones hepáticas laparoscópicas (RHL) más complejas (segmentos posterosuperiores, tumores centrales, próximos a grandes vasos, resecciones mayores, etc.) se deben realizar en centros con experiencia3–7. Las 2 formas fundamentales de abordaje son la cirugía totalmente laparoscópica (CTL)1,4,6 o la cirugía laparoscópica asistida (CLA)4,5,7,8, indicadas según el cirujano, la patología, el tamaño, la localización de las lesiones, etc.
El objetivo de este artículo es presentar nuestra experiencia en CHL, empleando 2 formas de abordaje laparoscópico: CTL y CLA, presentando las indicaciones, ventajas e inconvenientes de cada una de ellas. Por otra parte, presentamos los resultados postoperatorios de nuestra serie de RHL, que es la más numerosa de las publicadas de nuestro país.
Pacientes y métodoEntre enero de 2003-abril de 2012 hemos realizado 683 RH, de las cuales 132 (19,3%) fueron RHL en 129 pacientes (en un paciente se realizaron 2 RHL y en 2 se realizó una resección hepática en 2 tiempos). De un 5,5% en 2003 (3/54 casos), hemos pasado al 23,3% en 2011 (21/90 casos). Edad media: 62 años (rango 23-85), y 54 fueron mujeres (42%).
La indicación de RHL fue en 112 casos (85%) por tumores malignos (tabla 1): 90 por metástasis hepáticas y 22 por tumores malignos primarios. Las 20 resecciones restantes (15%) fueron lesiones benignas: 18 tumores benignos y 2 quistes hidatídicos.
Indicaciones y técnica quirúrgica (n=132)
| Indicaciones | |
| A. Tumores malignos | 112 (84,8%) |
| A.1. Metástasis hepáticas | 90 |
| MHCCR | 84 |
| GIST | 2 |
| TMNEP | 2 |
| Mama | 1 |
| ADC «tail gut» | 1 |
| A.2. Tumores malignos primarios | 22 |
| CHC cirrosis | 15 |
| CHC hígado sano | 5 |
| Leiomiosarcoma | 1 |
| CC periférico | 1 |
| B. Lesiones benignas | 20 (15,2%) |
| Hemangiomas | 9 |
| Adenomas | 4 |
| HNF | 3 |
| Quistes hidatídicos | 2 |
| TDCFN | 1 |
| Cistoadenoma | 1 |
| Indicaciones hemangiomas | |
| Crecimiento tumoral | 4 |
| Rotura tumoral | 3 |
| Duda diagnóstica | 1 |
| En S V asociado a colelitiasis | 1 |
| Indicaciones adenomas | |
| Todos con tamaño tumoral>5cm | |
| Indicaciones HNF | |
| Duda diagnóstica y todos>6cm | |
| Indicaciones en MHCCR | |
| En 45 casos metacrónicas | |
| En 35 casos sincrónicas (resección del colon y resección diferida de las MH en 34 casos; resección en un solo acto en un caso extirpando sigma R0 por laparoscopia y bisegmentectomía vi+ivb) | |
| Indicaciones en MHnoCCR | |
| La indicación se realizó en base a la extirpe tumoral | |
| Indicaciones en hepatocarcinoma | |
| Lesiones que requiriesen resección de 2 o menos segmentos, periféricas (quimioembolización de los segmentos a resecar) | |
| Técnica quirúrgica | |
| HD | 6 |
| HI | 6 |
| Resecciones 3 segmentos | 9 |
| 1 resección iii+vii+ivB | |
| 1 resección iii+v-vi | |
| 1 resección iii+vi+viii | |
| 2 resección ivb+v+vii | |
| 4 SLI+resección de otro segmento | |
| Resecciones de 2 segmentos | 42 |
| 21 SLI | |
| 11 SLD (vi-vii) | |
| 5 v-vi | |
| 2 ivb-v | |
| 1 vii+iii | |
| 1 viii+iii | |
| 1 iii+v | |
| Resecciones de un segmento | 64 |
| 27 segmentectomías | vi |
| 6 segmentectomías | iii |
| 7 segmentectomías | v |
| 6 segmentectomías | viii |
| 6 segmentectomías | vii |
| 6 segmentectomías | ii |
| 4 segmentectomías | ivB |
| 1 segmentectomías | iv |
| 1 segmentectomías | i |
| Resecciones locales | 5 |
| 2 hemangiomas | |
| 1 MH entre S iva y ivb | |
| 1 HNF | |
| 1 adenoma | |
| Gestos añadidos | |
| 1 resección de sigma | |
| 2 resecciones gástricas parciales | |
| 2 resecciones parciales de diafragma | |
| 2 pancreatectomías corporocaudales más esplenectomía (TMNEP) | |
| 1 resección de ovario | |
| 1 histerectomía | |
| 1 linfadenectomía hiliar en MHCCR | |
ADC: adenocarcinoma; CC: colangiocarcinoma; CHC: carcinoma hepatocelular; GIST: tumor del estroma gastrointestinal; HD: hepatectomía derecha; HI: hepatectomía izquierda; HNF: hiperplasia nodular focal; MHCCR: metástasis hepáticas de carcinoma colorrectal; TDCFN: tumor desmoplásico de células fusiformes en nidos; TMNEP: tumor neuroendocrino pancreático; SLD: seccionectomía lateral derecha; SLI: seccionectomía lateral izquierda.
Se resecaron 203 lesiones hepáticas, teniendo 42 casos 2 o más lesiones (32%), con un tamaño tumoral medio de 4,8cm (rango 1-20cm). En 34 casos (26%) las lesiones se localizaban en segmentos posterosuperiores derechos (vii y viii). En 4 casos la RHL se realizó como primer tiempo de MHCCR bilobares múltiples, realizando la embolización portal percutánea a la semana del primer tiempo, completándose la hepatectomía derecha del segundo tiempo por laparoscopia en 2 casos y por laparotomía en los otros 2.
Hemos empleado la CTL y la CLA con los siguientes criterios:
- -
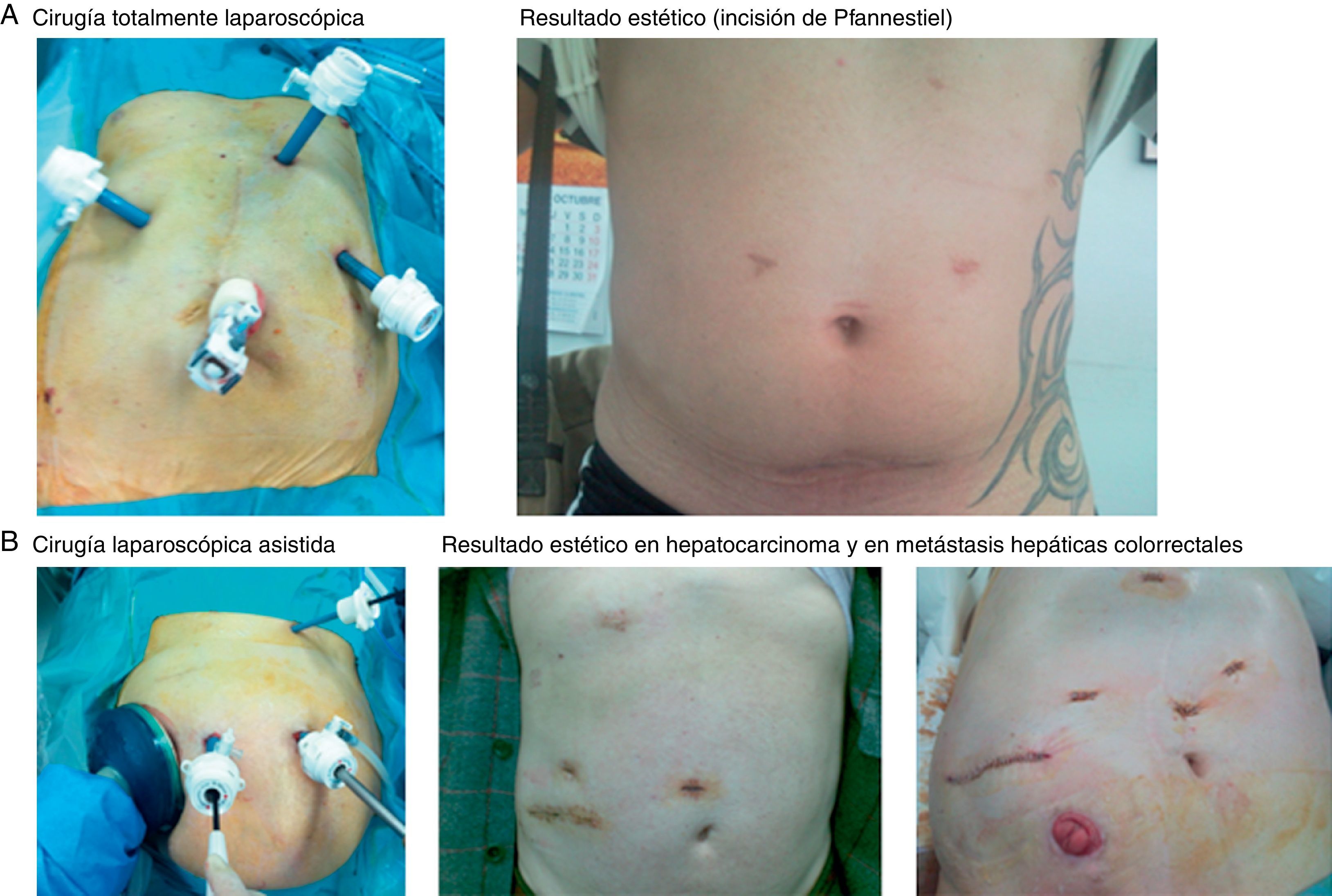
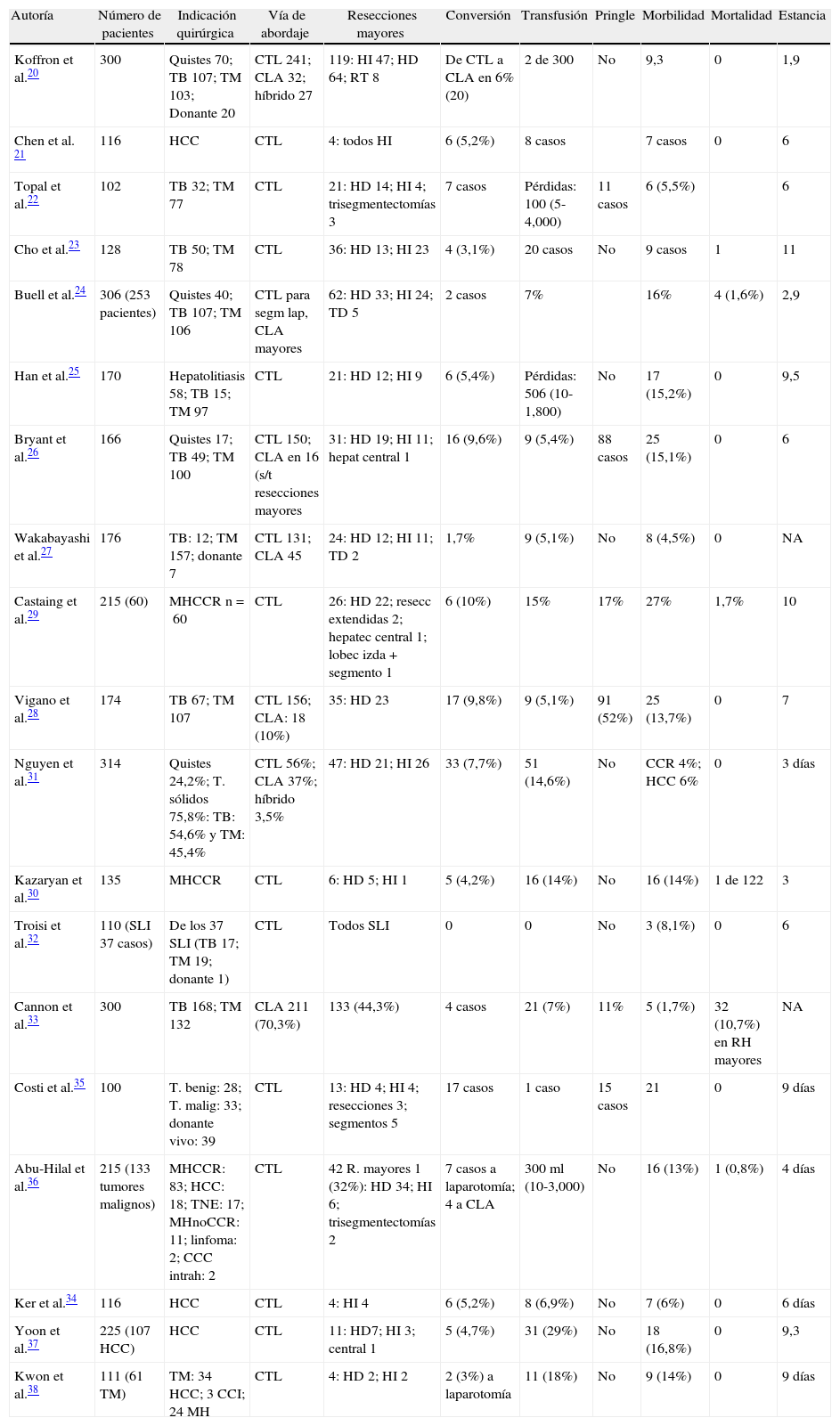
CTL (28 casos): se indicó en 13 tumores benignos, 11 hepatocarcinomas sobre cirrosis, 3 hepatocarcinomas sobre hígado sano y un colangiocarcinoma periférico. Con el paciente en decúbito supino, el cirujano se sitúa entre las piernas con 2 ayudantes. Se colocan 3 trocares (uno de ellos de 12mm cuando se utiliza endogía vascular) siguiendo una línea cóncava a la lesión (fig. 1A) y se genera un neumoperitoneo de 12mmHg. Si fuese necesario, se pueden colocar otros 3 trocares opcionales: en epigastrio para separar el hígado, subcostal derecho para movilizar el lóbulo derecho y en flanco izquierdo para introducir el clamp vascular con el que realizamos la maniobra de Pringle (descrito por nuestra Unidad)9,10. Se utiliza una óptica de 0° y ecografía laparoscópica flexible de 5,5-7,5MHz, Philips©. La sección del parénquima se realiza con bisturí harmónico (Ethicon©), disecando los vasos intrahepáticos que son seccionados entre clips o hemolock, y cuando ocluimos el hilio hepático utilizamos LigaSure Atlas® (Covidien©). En resecciones lobares derechas o izquierdas, realizamos disección de los pedículos portales seccionando la arteria hepática y la vena porta entre ligaduras o entre hemolock y seccionando la vía biliar con endogía. Las venas suprahepáticas son rodeadas y seccionadas con endogía. La hemostasia de la superficie hepática se realiza con Tissuelink® (Primm©) y se suturan las posibles fugas biliares. Si fuese necesario, se aplica una sustancia hemostática sobre la superficie hepática (TachoSil®-Nycomed©) y se coloca selectivamente un drenaje no aspirativo. La pieza, introducida en bolsa, se extrae a través de una incisión de Pfannestiel.
Figura 1.Posición de los trocares en cirugía totalmente laparoscópica (CTL) y en cirugía laparoscópica asistida (CLA), con el resultado estético. A) Cirugía CTL y resultado estético (incisión de Pfannestiel). B) CLA, resultado estético en hepatocarcinoma y en metástasis hepáticas colorrectales.
(0.42MB). - -
CLA (104 casos): se indicó en 90 casos por MH para una estadificación correcta; en 6 por tumores grandes (2 benignos y 4 malignos primarios entre 7 y 20cm); en 6 por tumores en segmentos posteriores derechos (5 benignos mayores de 5cm y un hepatocarcinoma); y en 2 como conversión desde CTL a CLA. Empleamos la técnica original de nuestra Unidad9,10 ya publicada (fig. 1B), por lo que se describe brevemente: se realiza una incisión transversa en flanco derecho desde la línea axilar media a la línea axilar anterior donde se coloca el handport (GelPort®; Applied Medical©) y se realiza exploración manual completa del hígado y de la cavidad abdominal y exploración con ecografía empleando la sonda abdominal (Entos®, CT8, Philips©) introducida por el handport. El resto de la técnica quirúrgica es similar a la descrita en la CTL. La pieza quirúrgica es introducida en bolsa y extraída a través del handport.
Se realizaron 21 resecciones mayores (16%): 6 hepatectomías derechas, 6 hepatectomías izquierdas y 9 resecciones de 3 segmentos (tabla 1). En 7 pacientes se asoció radiofrecuencia intraoperatoria (2 para tratar nódulos cirróticos, 2 para tratar MHCCR de 1cm y 3 para asegurar el margen quirúrgico tras la resección de MHCCR). Además de la RHL, en 10 pacientes se realizaron gestos añadidos (tabla 1). El manejo anestésico y la presión venosa central (PVC) son idénticos a los de la cirugía abierta (PVC por debajo de 4).
Calculamos las tasas de supervivencia global y libre de enfermedad a 1, 3 y 5 años mediante el método de Kaplan-Meier. Las comparaciones de las medias entre grupos se realizó con el test de la t-Student o el test de Behrens-Fisher, dependiendo de la homogeneidad de las varianzas entre las muestras, o con el test no paramétrico de Mann-Whitney. Comparamos los porcentajes entre grupos con el análisis de tablas de contingencia con el test de Chi-cuadrado o el test exacto de Fisher cuando las frecuencias de los casos fueron bajas.
ResultadosNo existió mortalidad intra ni postoperatoria. En 4 casos hubo complicaciones (3%) (2 casos con colección que precisó drenaje radiológico, un caso de fístula biliar y otro caso de sepsis por colección infectada, precisando ambos reintervención quirúrgica). Transfusión del 4,5% (6 pacientes), mediana del tiempo quirúrgico de 150min (rango 60-360) y estancia media de 3,5 días (rango 2-30). La maniobra de Pringle se empleó en 44 casos (33,3%), con una mediana de tiempo de 16min (rango 6-21); en 12 casos se realizó oclusión hemihepática; en 2 se realizó oclusión selectiva de arteria hepática y vena porta derechas; y las 74 resecciones restantes se realizaron sin oclusión vascular.
Desde CTL, se convirtió a laparotomía en 3 casos (2,3%), uno por hemorragia de un adenoma hepático de 8cm en segmento vii y 2 casos de MHCCR por bloqueo adherencial, perforándose inadvertidamente asas intestinales. Con CTL se completó la resección en 23/28 casos (82%) ya que, además de los 3 casos convertidos a laparotomía, se convirtió a CLA en 2 casos, mientras que con CLA se completó la resección laparoscópica en los 104 casos.
Las MHCCR, todas resecadas por CLA, fueron estadificadas primero con ecografía y visualización de la cavidad abdominal y a continuación se añadió la palpación, dentro de un estudio prospectivo comparativo entre ambas estadificaciones. De las 84 RH por MHCCR, se realizaron 77 estadificaciones (ya que en 2 pacientes se realizó una resección hepática en 2 tiempos y se considera una sola estadificación, y se excluyeron 2 conversiones a laparotomía desde CTL y 3 resecciones en hígados cirróticos). En 8 pacientes, al añadir la palpación, se detectó más enfermedad que la detectada con la exploración ecográfica (10%) y, además, en uno de estos casos se detectó un implante peritoneal.
En tumores benignos (tabla 2) (fig. 2A), la edad y la comorbilidad fueron inferiores que en las MH y en los tumores malignos primarios (fig. 2B, 1, 2 y 3), mientras que el tamaño tumoral y el porcentaje de mujeres fueron superiores (e.s.; p<0,05). En MH (fig. 2C, 1 2) las pérdidas hemáticas, el tiempo quirúrgico y el número de nódulos fueron superiores que en las otras indicaciones (presentando 16 pacientes 3 o más lesiones), estando además el margen quirúrgico invadido en 3 pacientes. La supervivencia global y libre de enfermedad a 1, 3 y 5 años de las MHCCR fueron del 92, 82, 52% y del 85, 60 y 32%, respectivamente. En los tumores malignos primarios, el número de cirróticos fue superior y se realizaron menos resecciones mayores que en los otros 2 grupos, siendo las pérdidas hemáticas, el empleo de la maniobra de Pringle, el tiempo quirúrgico, la estancia y la morbilidad inferiores que en los otros 2 grupos. La supervivencia total y libre de enfermedad a 1, 3 y 5 años fue del 100, 86 y 62%, y del 94, 80 y 50%, respectivamente.
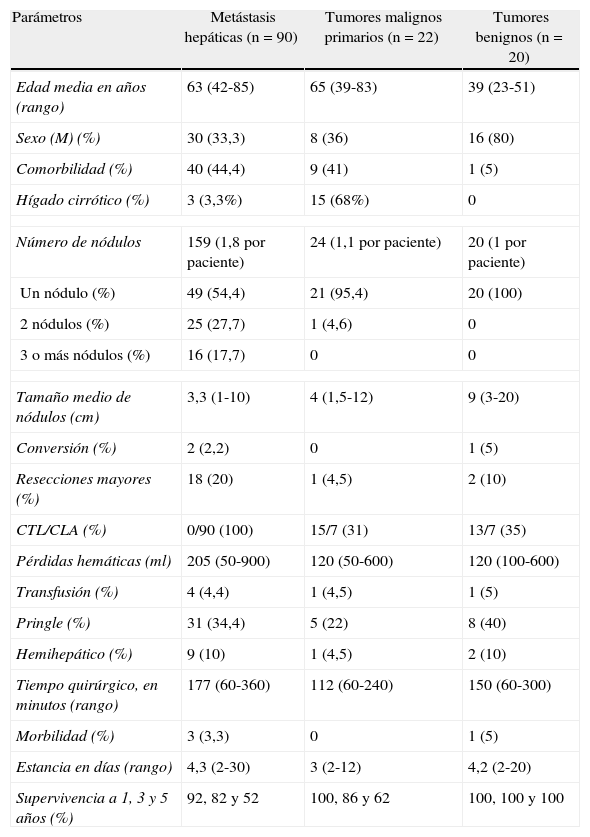
Resultados de la cirugía hepática laparoscópica según la indicación quirúrgica: metástasis hepáticas, tumores malignos primarios y tumores benignos
| Parámetros | Metástasis hepáticas (n=90) | Tumores malignos primarios (n=22) | Tumores benignos (n=20) |
| Edad media en años (rango) | 63 (42-85) | 65 (39-83) | 39 (23-51) |
| Sexo (M) (%) | 30 (33,3) | 8 (36) | 16 (80) |
| Comorbilidad (%) | 40 (44,4) | 9 (41) | 1 (5) |
| Hígado cirrótico (%) | 3 (3,3%) | 15 (68%) | 0 |
| Número de nódulos | 159 (1,8 por paciente) | 24 (1,1 por paciente) | 20 (1 por paciente) |
| Un nódulo (%) | 49 (54,4) | 21 (95,4) | 20 (100) |
| 2 nódulos (%) | 25 (27,7) | 1 (4,6) | 0 |
| 3 o más nódulos (%) | 16 (17,7) | 0 | 0 |
| Tamaño medio de nódulos (cm) | 3,3 (1-10) | 4 (1,5-12) | 9 (3-20) |
| Conversión (%) | 2 (2,2) | 0 | 1 (5) |
| Resecciones mayores (%) | 18 (20) | 1 (4,5) | 2 (10) |
| CTL/CLA (%) | 0/90 (100) | 15/7 (31) | 13/7 (35) |
| Pérdidas hemáticas (ml) | 205 (50-900) | 120 (50-600) | 120 (100-600) |
| Transfusión (%) | 4 (4,4) | 1 (4,5) | 1 (5) |
| Pringle (%) | 31 (34,4) | 5 (22) | 8 (40) |
| Hemihepático (%) | 9 (10) | 1 (4,5) | 2 (10) |
| Tiempo quirúrgico, en minutos (rango) | 177 (60-360) | 112 (60-240) | 150 (60-300) |
| Morbilidad (%) | 3 (3,3) | 0 | 1 (5) |
| Estancia en días (rango) | 4,3 (2-30) | 3 (2-12) | 4,2 (2-20) |
| Supervivencia a 1, 3 y 5 años (%) | 92, 82 y 52 | 100, 86 y 62 | 100, 100 y 100 |
CLA: cirugía laparoscópica asistida; CTL: cirugía totalmente laparoscópica; M: mujer.
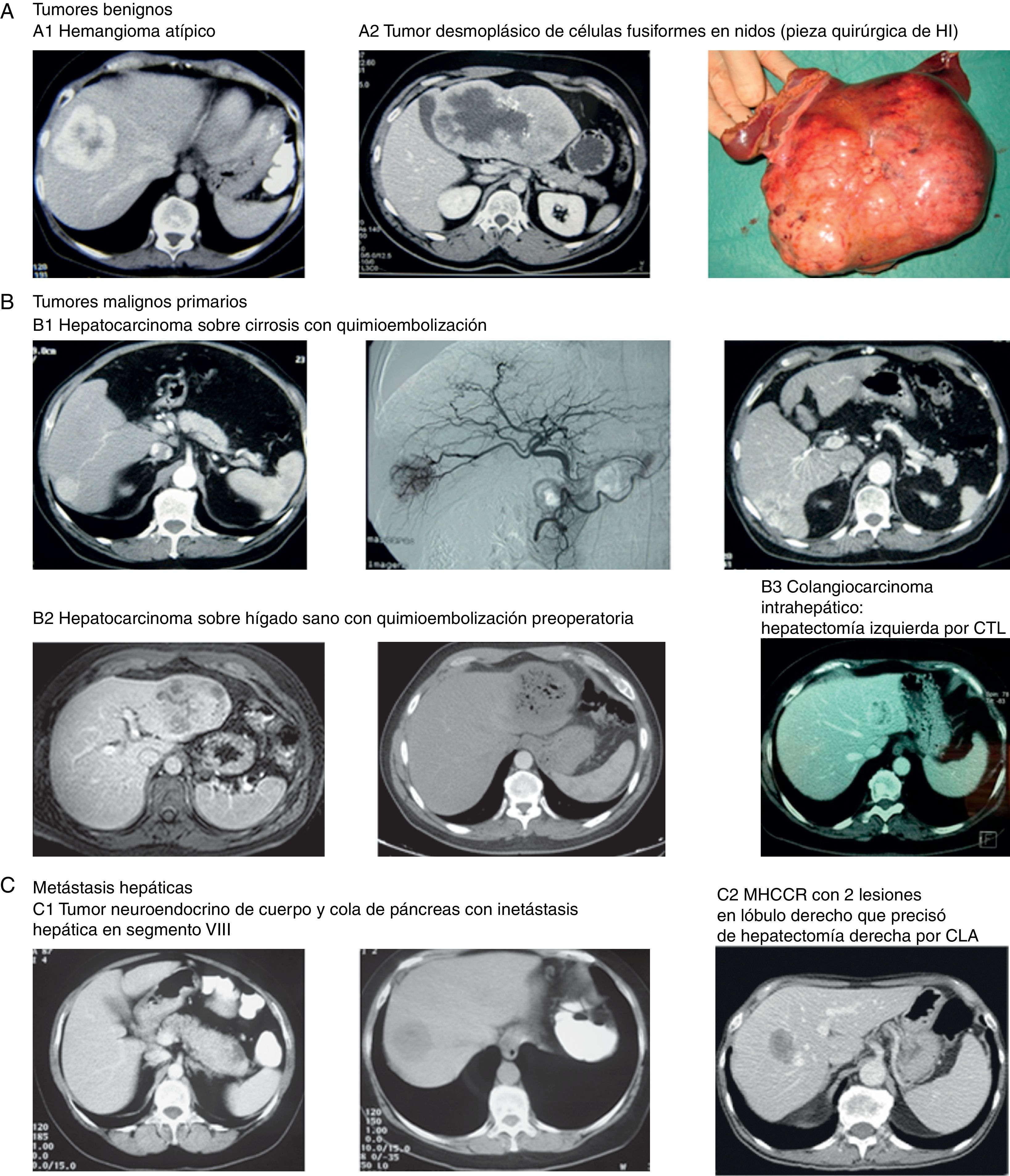
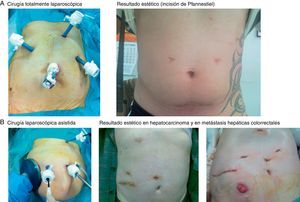
Imágenes de algunos tumores de nuestra casuística. A) Tumores benignos. 1) Hemangioma atípico. 2 y 3) Tumor desmoplásico de células fusiformes en nidos (pieza quirúrgica de HI). B) Tumores malignos primarios. 1) Hepatocarcinoma sobre cirrosis con QME. 2) Hepatocarcinoma sobre hígado sano con quimioembolización preoperatoria. 3) Colangiocarcinoma intrahepático que requirió hepatectomía izquierda por CTL. C) Metástasis hepáticas. 1) Tumor neuroendocrino de cuerpo y cola de páncreas con metástasis hepática en segmento viii. 2) MHCCR con 2 lesiones en lóbulo derecho que precisó de hepatectomía derecha por CLA.
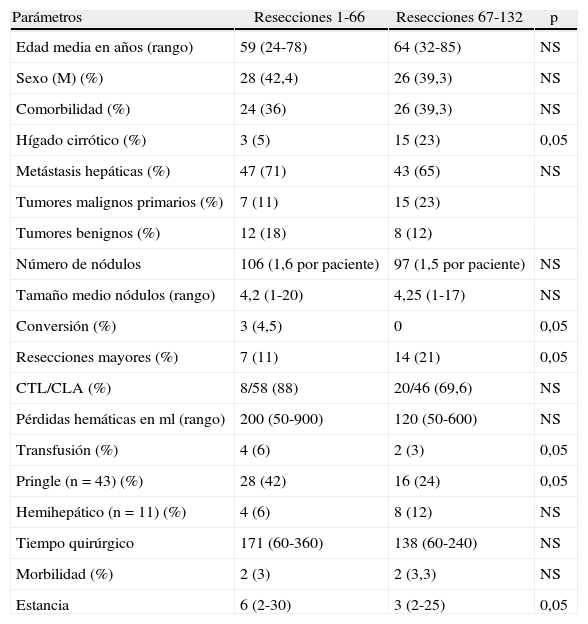
En las últimas 66 resecciones (tabla 3) hubo más cirróticos que en las primeras 66, y no hubo conversión a laparotomía. Con mayor experiencia hemos realizado más resecciones hepáticas mayores y las pérdidas hemáticas, las transfusiones, las maniobras de Pringle, el tiempo quirúrgico y la estancia hospitalaria han sido inferiores.
Resultados según experiencia comparando las primeras 61 resecciones con las segundas 62
| Parámetros | Resecciones 1-66 | Resecciones 67-132 | p |
| Edad media en años (rango) | 59 (24-78) | 64 (32-85) | NS |
| Sexo (M) (%) | 28 (42,4) | 26 (39,3) | NS |
| Comorbilidad (%) | 24 (36) | 26 (39,3) | NS |
| Hígado cirrótico (%) | 3 (5) | 15 (23) | 0,05 |
| Metástasis hepáticas (%) | 47 (71) | 43 (65) | NS |
| Tumores malignos primarios (%) | 7 (11) | 15 (23) | |
| Tumores benignos (%) | 12 (18) | 8 (12) | |
| Número de nódulos | 106 (1,6 por paciente) | 97 (1,5 por paciente) | NS |
| Tamaño medio nódulos (rango) | 4,2 (1-20) | 4,25 (1-17) | NS |
| Conversión (%) | 3 (4,5) | 0 | 0,05 |
| Resecciones mayores (%) | 7 (11) | 14 (21) | 0,05 |
| CTL/CLA (%) | 8/58 (88) | 20/46 (69,6) | NS |
| Pérdidas hemáticas en ml (rango) | 200 (50-900) | 120 (50-600) | NS |
| Transfusión (%) | 4 (6) | 2 (3) | 0,05 |
| Pringle (n=43) (%) | 28 (42) | 16 (24) | 0,05 |
| Hemihepático (n=11) (%) | 4 (6) | 8 (12) | NS |
| Tiempo quirúrgico | 171 (60-360) | 138 (60-240) | NS |
| Morbilidad (%) | 2 (3) | 2 (3,3) | NS |
| Estancia | 6 (2-30) | 3 (2-25) | 0,05 |
CLA: cirugía laparoscópica asistida; CTL: cirugía totalmente laparoscópica; M: mujer.
Iniciamos la CHL de lesiones quísticas hepáticas en 199311, dentro del contexto de nuestra experiencia en cirugía laparoscópica general12–15, y comenzamos la RHL en enero de 2003, cuando adquirimos experiencia en cirugía hepática abierta (177 resecciones). En España, existen 3 series publicadas de RHL, todas ellas con un número inferior a 100 casos16–18, y un estudio multicéntrico nacional con 104 RHL sobre lesiones sólidas en 15 centros19. Recientemente se aportan estudios institucionales con más de 100 RHL (tabla 4)20–38 y algunas revisiones de casi 3,000 pacientes39–50 que tratan de comprobar la seguridad (morbimortalidad) y eficacia curativa frente a cirugía abierta.
Series con más de 100 resecciones hepáticas por laparoscopia (se excluyen los metaanálisis, revisiones y multicéntricos)
| Autoría | Número de pacientes | Indicación quirúrgica | Vía de abordaje | Resecciones mayores | Conversión | Transfusión | Pringle | Morbilidad | Mortalidad | Estancia |
| Koffron et al.20 | 300 | Quistes 70; TB 107; TM 103; Donante 20 | CTL 241; CLA 32; híbrido 27 | 119: HI 47; HD 64; RT 8 | De CTL a CLA en 6% (20) | 2 de 300 | No | 9,3 | 0 | 1,9 |
| Chen et al. 21 | 116 | HCC | CTL | 4: todos HI | 6 (5,2%) | 8 casos | 7 casos | 0 | 6 | |
| Topal et al.22 | 102 | TB 32; TM 77 | CTL | 21: HD 14; HI 4; trisegmentectomías 3 | 7 casos | Pérdidas: 100 (5-4,000) | 11 casos | 6 (5,5%) | 6 | |
| Cho et al.23 | 128 | TB 50; TM 78 | CTL | 36: HD 13; HI 23 | 4 (3,1%) | 20 casos | No | 9 casos | 1 | 11 |
| Buell et al.24 | 306 (253 pacientes) | Quistes 40; TB 107; TM 106 | CTL para segm lap, CLA mayores | 62: HD 33; HI 24; TD 5 | 2 casos | 7% | 16% | 4 (1,6%) | 2,9 | |
| Han et al.25 | 170 | Hepatolitiasis 58; TB 15; TM 97 | CTL | 21: HD 12; HI 9 | 6 (5,4%) | Pérdidas: 506 (10-1,800) | No | 17 (15,2%) | 0 | 9,5 |
| Bryant et al.26 | 166 | Quistes 17; TB 49; TM 100 | CTL 150; CLA en 16 (s/t resecciones mayores | 31: HD 19; HI 11; hepat central 1 | 16 (9,6%) | 9 (5,4%) | 88 casos | 25 (15,1%) | 0 | 6 |
| Wakabayashi et al.27 | 176 | TB: 12; TM 157; donante 7 | CTL 131; CLA 45 | 24: HD 12; HI 11; TD 2 | 1,7% | 9 (5,1%) | No | 8 (4,5%) | 0 | NA |
| Castaing et al.29 | 215 (60) | MHCCR n=60 | CTL | 26: HD 22; resecc extendidas 2; hepatec central 1; lobec izda+segmento 1 | 6 (10%) | 15% | 17% | 27% | 1,7% | 10 |
| Vigano et al.28 | 174 | TB 67; TM 107 | CTL 156; CLA: 18 (10%) | 35: HD 23 | 17 (9,8%) | 9 (5,1%) | 91 (52%) | 25 (13,7%) | 0 | 7 |
| Nguyen et al.31 | 314 | Quistes 24,2%; T. sólidos 75,8%: TB: 54,6% y TM: 45,4% | CTL 56%; CLA 37%; híbrido 3,5% | 47: HD 21; HI 26 | 33 (7,7%) | 51 (14,6%) | No | CCR 4%; HCC 6% | 0 | 3 días |
| Kazaryan et al.30 | 135 | MHCCR | CTL | 6: HD 5; HI 1 | 5 (4,2%) | 16 (14%) | No | 16 (14%) | 1 de 122 | 3 |
| Troisi et al.32 | 110 (SLI 37 casos) | De los 37 SLI (TB 17; TM 19; donante 1) | CTL | Todos SLI | 0 | 0 | No | 3 (8,1%) | 0 | 6 |
| Cannon et al.33 | 300 | TB 168; TM 132 | CLA 211 (70,3%) | 133 (44,3%) | 4 casos | 21 (7%) | 11% | 5 (1,7%) | 32 (10,7%) en RH mayores | NA |
| Costi et al.35 | 100 | T. benig: 28; T. malig: 33; donante vivo: 39 | CTL | 13: HD 4; HI 4; resecciones 3; segmentos 5 | 17 casos | 1 caso | 15 casos | 21 | 0 | 9 días |
| Abu-Hilal et al.36 | 215 (133 tumores malignos) | MHCCR: 83; HCC: 18; TNE: 17; MHnoCCR: 11; linfoma: 2; CCC intrah: 2 | CTL | 42 R. mayores 1 (32%): HD 34; HI 6; trisegmentectomías 2 | 7 casos a laparotomía; 4 a CLA | 300ml (10-3,000) | No | 16 (13%) | 1 (0,8%) | 4 días |
| Ker et al.34 | 116 | HCC | CTL | 4: HI 4 | 6 (5,2%) | 8 (6,9%) | No | 7 (6%) | 0 | 6 días |
| Yoon et al.37 | 225 (107 HCC) | HCC | CTL | 11: HD7; HI 3; central 1 | 5 (4,7%) | 31 (29%) | No | 18 (16,8%) | 0 | 9,3 |
| Kwon et al.38 | 111 (61 TM) | TM: 34 HCC; 3 CCI; 24 MH | CTL | 4: HD 2; HI 2 | 2 (3%) a laparotomía | 11 (18%) | No | 9 (14%) | 0 | 9 días |
CCC: colangiocarcinoma; CLA: cirugía laparoscópica asistida; HCC: hepatocarcinoma; HD: hepatectomía derecha; HI: hepatectomía izquierda; MHCCR: metástasis hepáticas de carcinoma colorrectal; NO no obtenible; SLI: seccionectomía lateral izquierda; TB: tumores benignos; TD:trisectoriectomía derecha; TM: tumores malignos; TNE: tumores neuroendocrinos.
Autores, sobre todo europeos1,6,16,17,26–30,35,36, consideran de elección la CTL, reservando la CLA para la conversión. Sin embargo, en una revisión de RHL por MHCCR, 42 de las 103 resecciones (40,4%) se realizaron mediante CLA, empleándose más en centros americanos (85%) que europeos (15%)31,42. La reunión de Louisville concluye que la CLA es una vía rápida, segura y probablemente más eficaz que la CTL en MH, destacando el alto porcentaje de utilización en EE. UU.2,41 y Japón38. Un problema de la CTL en MHCCR es la posibilidad de no detectar lesiones ocultas con la exploración ecográfica laparoscópica, lo que se demuestra en varios estudios en los que, al convertir a laparotomía o CLA y añadir la palpación hepática, detectan enfermedad hepática y/o peritoneal inadvertida entre el 10-20%8,51–53. Nuestros resultados en MHCCR muestran una infraestadificación del 10%, lo que nos sugiere, como a otros autores53, que la palpación es fundamental para una correcta estadificación.
En los tumores malignos primarios, la CTL es el abordaje indicado ya que con frecuencia son únicos, y en el hepatocarcinoma sobre cirrosis se pierde la eficacia de la palpación, siendo exclusivamente estadificados con ecografía (en nuestra serie, se realizaron 15/22 casos por CTL). La CTL del hepatocarcinoma sobre cirrosis parece disminuir la ascitis postoperatoria debido a la conservación de la circulación colateral16,17,21,28,34,37. Nosotros utilizamos la quimioembolización preoperatoria de los segmentos a resecar54 para disminuir la hemorragia y el empleo de la maniobra de Pringle. También podría tener utilidad para asegurar el margen quirúrgico, ya que la mayoría de los nódulos quimioembolizados tenían una necrosis superior al 90%.
Los tumores benignos son una buena indicación para CHL ya que se trata de pacientes jóvenes con tumores únicos (tabla 2) y el resultado estético adquiere mayor importancia, siendo la CTL el abordaje ideal, extrayendo la pieza mediante una incisión de Pfannestiel, como realizamos en 13/20 de nuestros pacientes. En el caso de gran tamaño y/o localizados en segmentos posteriores del lóbulo derecho, la CLA puede ser una alternativa de inicio5,8,10,18,20,21,31 o tras la conversión desde CTL. La CTL no ha modificado las indicaciones de los tumores benignos en nuestra Unidad, constituyendo el 6% de todos los tumores sólidos resecados hasta Enero 2003 y el 7,5% a partir de esta fecha. Sin embargo, en algunas series se alcanzan porcentajes del 20-50% de las indicaciones19,20,26.
En la selección de los pacientes para CHL es importante el tamaño y la localización de las lesiones4,5,10,16–18,20,23,24,31. En nuestra serie, en 36 pacientes (25%) eran mayores de 5cm. Si además estas lesiones grandes se localizan en segmentos posterosuperiores (como ocurrió en 9 de los 34 pacientes con tumores en dicha localización), las dificultades son aún mayores, abogando algunos cirujanos por colocar al paciente en decúbito lateral1,16,17,28,33. Sin embargo, para algunos autores, sobre todo americanos y asiáticos, y para nosotros (con el paciente en decúbito supino), la CLA ha permitido ampliar las indicaciones recomendadas inicialmente5,10,18,20,24,31,33, pudiendo tratar con más facilidad lesiones posteriores del lóbulo derecho y realizar un porcentaje superior de resecciones hepáticas mayores y hemihepáticas, siendo en nuestra Unidad del 16%. Para algunos autores americanos20,24,31,33 y japoneses38,39, el uso de la mano reproduce las ventajas de la cirugía abierta: movilización hepática, control de pedículos vasculares, compresión, etc.
La conversión de CTL a laparotomía oscila entre el 0-20%10,16–18,20–38. Nuestra tasa de conversión es del 2,3% y se relaciona con el abordaje realizado. Así, con CTL se convirtieron a laparotomía 3 de los 28 casos, y no hubo conversión con CLA. Una alternativa a la conversión a laparotomía desde CTL es la conversión a CLA, como realizan algunos autores (conversión del 0,3%)20,41,42, maniobra que también nosotros hemos utilizado.
El margen invadido en tumores malignos es causa de conversión24,26,30,33,40. Con CTL, el margen se controla realizando ecografías repetidas1,6,16,17,26,28, mientras que con CLA el margen se controla con palpación y ecografía5,8,10,20,24,41. Algunos autores, cuando el margen está invadido, emplean radiofrecuencia sobre el lecho quirúrgico para evitar la conversión24,41,42, como nosotros empleamos en 3 de nuestros pacientes. Otra causa de conversión son las adherencias en pacientes con MHCCR30,41,42, como ocurrió en 2 de nuestros casos en los que se asoció además lesión intestinal. La causa de conversión más frecuente es la hemorragia1,10,16,17,19,30,36,47 que puede ocurrir durante la sección del parénquima o por desgarro de los vasos portales, VCI y VSH. Con CTL se pierde la compresión manual, por lo que el sangrado se controla sobre todo con la maniobra de Pringle y con CLA, la compresión directa disminuye las pérdidas hemáticas y ofrece mayor seguridad ante posibles lesiones vasculares. La lesión vascular es difícil de controlar y requiere con frecuencia conversión, aunque algunos cirujanos han suturado lesiones de VCI y VSH6. Nosotros controlamos con sutura laparoscópica una lesión de VCI, una lesión de arteria hepática derecha, una lesión de vena porta derecha y un desgarro de VSH media, todos ellos intervenidos por CLA. Consideramos que las segmentectomías anteriores y la SLI se pueden realizar de forma segura sin oclusión vascular, mientras que para los segmentos posteriores derechos, la maniobra de Pringle ofrece una mayor seguridad.
El control vascular de las VSH es una maniobra compleja. En la hepatectomía izquierda, la disección del pedículo vascular medio e izquierdo se realiza con mayor facilidad debido al espacio que existe con la VCI, lo que permite su sección con endogía vascular, maniobra que hemos realizado en 5 de los 6 pacientes. El control de VSH derecha, que es una maniobra aún más compleja6, nosotros la hemos realizado en 4 ocasiones.
En resumen, las RHL, bien por CTL, bien por CLA, comparten todas las ventajas propias de la cirugía mínimamente invasiva (mejor y más rápida recuperación postoperatoria, mejor resultado estético, menores necesidades de analgesia postoperatoria), con tasas de complicaciones y una supervivencia en tumores malignos similares a las publicadas para cirugía abierta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.