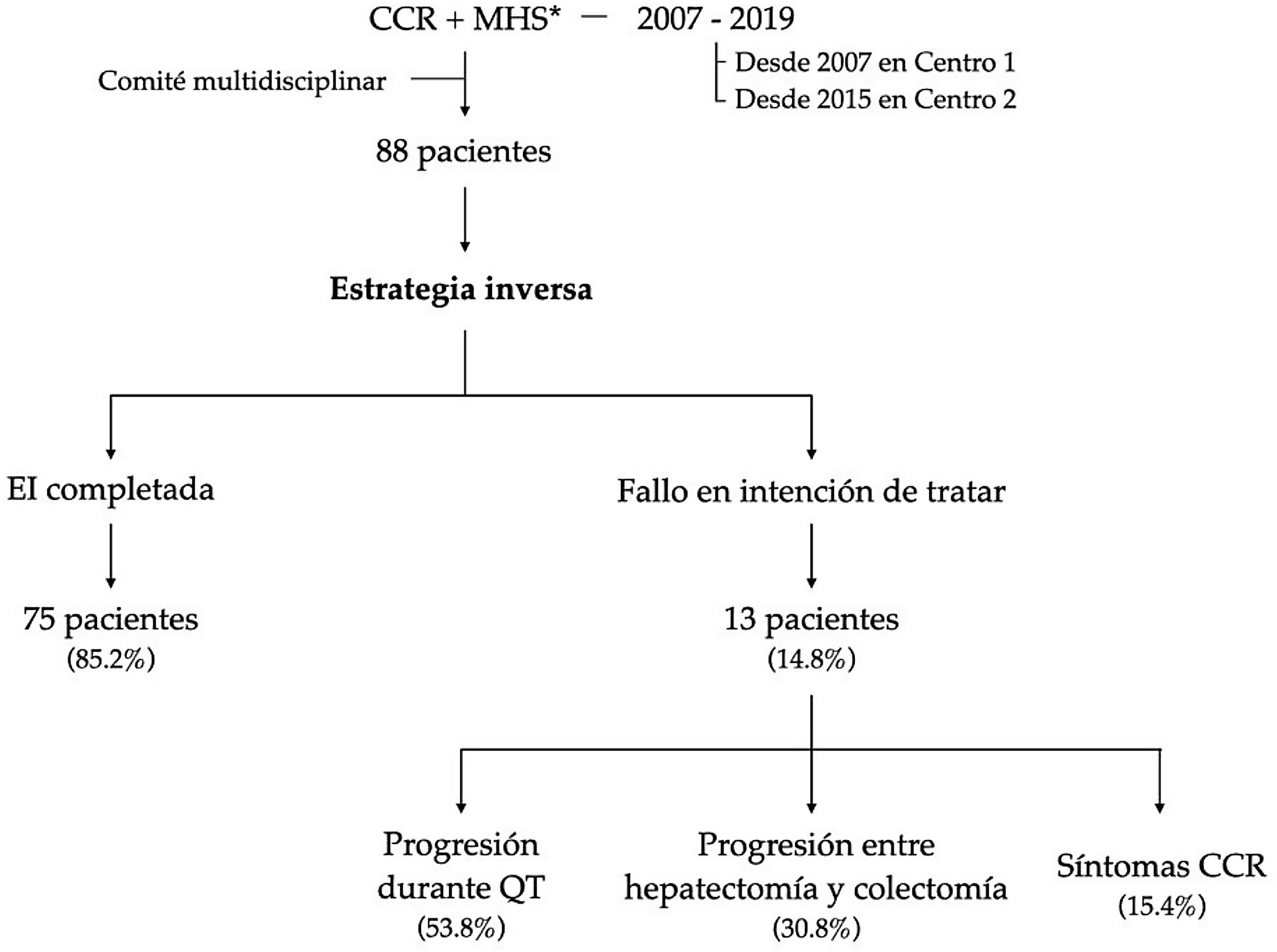
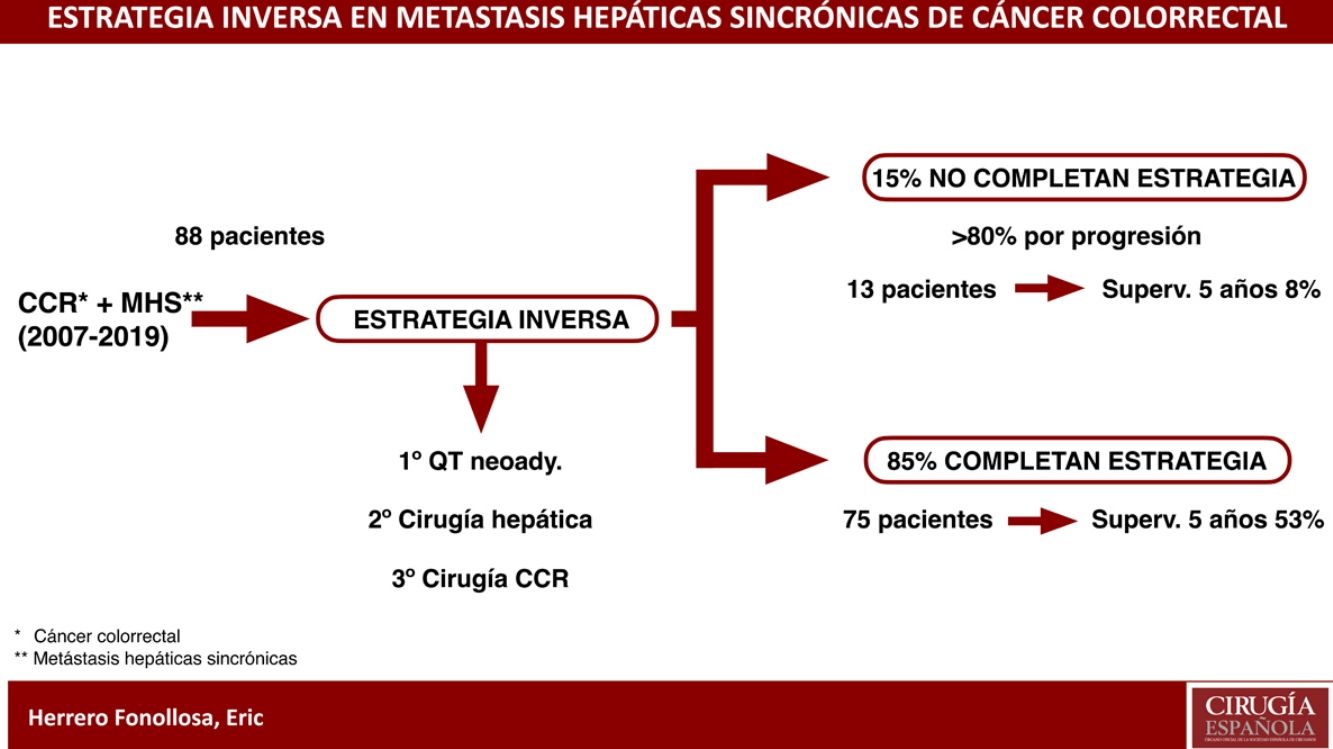
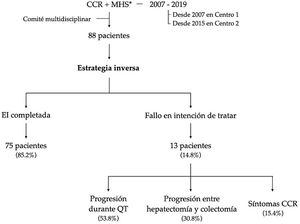
La estrategia inversa (EI) es un esquema indicado en pacientes con cáncer colorrectal (CCR) y metástasis hepáticas sincrónicas (MHS) avanzadas. Incluye quimioterapia neoadyuvante, seguido de resección hepática y, por último, resección del CCR.
MaterialEstudio descriptivo retrospectivo sobre una base de datos prospectiva de hepatectomías por metástasis hepáticas de CCR en 2 centros entre 2007 y 2019. Se incluyeron 88 pacientes con CCR y MHS. La enfermedad hepática fue bilobar en un 65,9%, el número y el tamaño medio de las lesiones fue de 5,5 y 42,7mm, respectivamente. La respuesta radiológica al tratamiento se evaluó mediante criterios RECIST. La supervivencia libre de progresión (SLP) y la supervivencia global (SG) media se estimaron mediante el método de Kaplan-Meier y regresión de Cox.
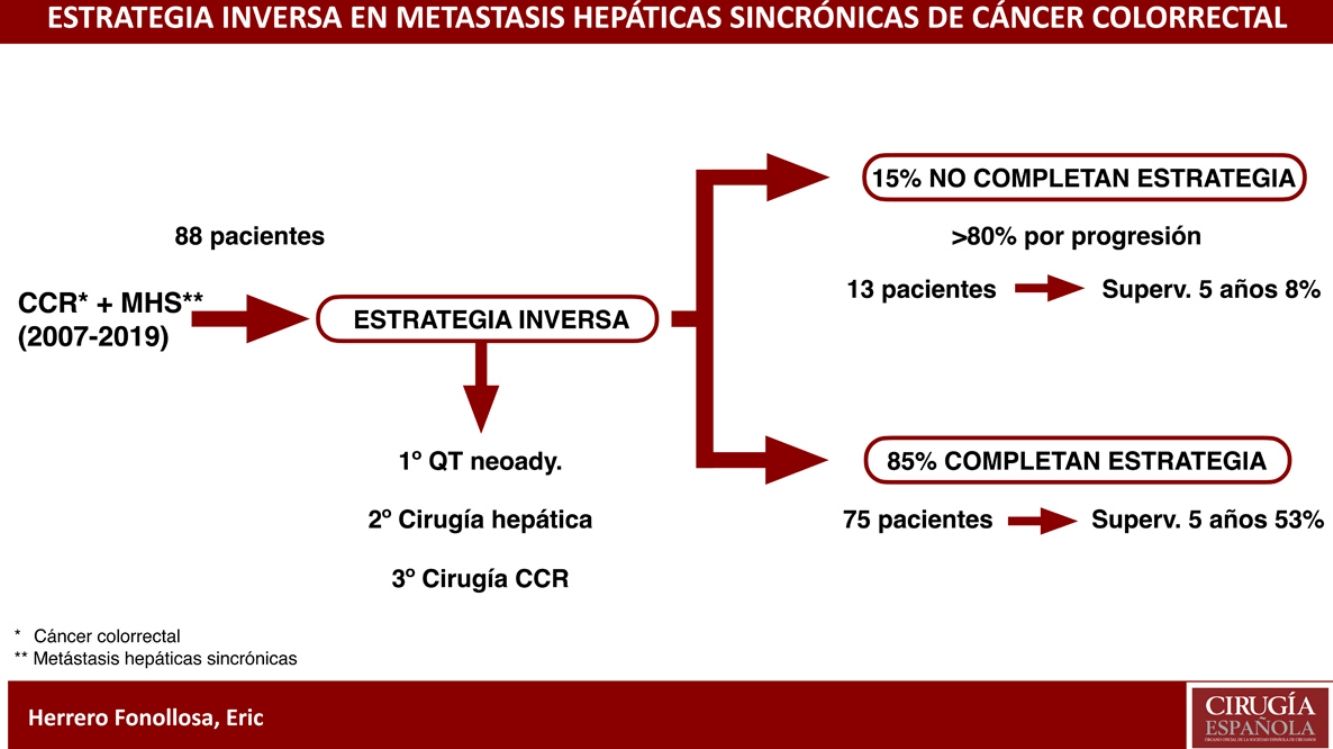
ResultadosDe los 88 pacientes, 75 completaron la EI (85,2%). La respuesta radiológica fue parcial en el 75,7% y la estabilización en el 22,8%. La tasa de morbilidad (Clavien-Dindo ≥IIIA) tras la cirugía hepática y colorrectal fue del 29,4 y 9,3%, respectivamente. No hubo mortalidad a los 90 días. La tasa de recurrencia fue del 76%. Se diagnosticaron 106 recurrencias en 56 pacientes. De estos, se realizó tratamiento quirúrgico asociado a quimioterapia en 34 (32,1%). La SLP fue de 8,5 meses y la SG a 5 años fue del 53%.
ConclusionesEn pacientes con CCR y MHS la EI permite el control inicial de la enfermedad metastásica, seleccionar pacientes respondedores a la neoadyuvancia y optimizar las posibilidades de resección completa, influyendo en la supervivencia a largo plazo.
The “liver-first” approach (LFA) is a strategy indicated for advanced synchronous liver metastases (ASLM) from colorectal cancer (CRC). Includes neoadjuvant chemotherapy, resection of the ASLM followed by CRC resection.
MethodsRetrospective descriptive analysis from a prospective database of hepatectomies from liver metastases (LM) from CRC in two centers. Between 2007-2019, 88 patients with CRC-ASLM were included in a LFA scheme. Bilobar (LM) was present in 65.9%, the mean number of lesions was 5.5 and mean size 42.7mm. Response to treatment was assessed by RECIST criteria. Progression-free survival (PFS) and overall survival (OS) were estimated using Kaplan-Meier survival curves.
ResultsSeventy-five of 88 patients (85.2%) completed the LFA. RECIST evaluation showed partial response in 75.7% and stable disease in 22.8%. Severe morbidity rate (Clavien–Dindo ≥ IIIA) after liver and colorectal surgery was present in 29.4% and 9.3%, respectively. There was no 90-day postoperative mortality in both liver and colorectal surgeries. Recurrence rate was 76%, being the liver the most frequent site, followed by the pulmonary. From the total number of recurrences (106) in 56 patients, surgical with chemotherapy rescue treatment was accomplished in 34 of them (32.1%). The mean PFS was 8.5 and 5-year OS was 53%.
ConclusionsIn patients with CRC-ASLM the LFA allows control of the liver disease beforehand and an assessment of the tumor response to neoadjuvant chemotherapy, optimising the chance of potentially curative liver resection, which influences long-term survival.
El cáncer colorrectal (CCR) es la tercera neoplasia maligna más frecuente1 y la segunda causa de muerte por cáncer2. El hígado es el órgano más comúnmente afectado por metástasis a distancia3. Hasta un 25% de los pacientes presentan metástasis hepáticas sincrónicas (MHS)4, confiriéndoles un peor pronóstico2.
La resección completa del CCR y de la enfermedad metastásica, asociada a quimioterapia, se considera el único tratamiento potencialmente curativo que alarga la supervivencia5.
La secuencia óptima en el tratamiento del CCR con MHS permanece en controversia2.
El abordaje clásico consiste en la resección del CCR, seguido de quimioterapia y, por último, la cirugía de las MHS. Menos del 30% de los pacientes completan el tratamiento. Su principal desventaja es la potencial progresión de la enfermedad hepática en caso de retraso del tratamiento quimioterápico adyuvante por complicaciones derivadas de la cirugía colorrectal6.
La resección simultánea del CCR y de las MHS presenta como principal desventaja el aumento de la morbimortalidad postoperatoria, aunque en casos seleccionados los resultados son equiparables a los de otros esquemas1,7,8.
Dado que el pronóstico a largo plazo de estos pacientes lo condicionan las MHS, Mentha et al. en 20069 describieron la estrategia inversa (EI) o «Liver-First Approach». Esta consiste en empezar el tratamiento con quimioterapia neoadyuvante, seguido de la cirugía hepática y, finalmente, la cirugía del CCR9. Está indicada en pacientes con CCR asintomático o sintomático tratable mediante endoprótesis o colostomía y MHS potencialmente resecables o inicialmente irresecables. Esta estrategia permite el control sistémico inicial de la enfermedad, la selección de pacientes respondedores a la quimioterapia y la optimización de las posibilidades de resección hepática completa1.
El objetivo del estudio fue evaluar los resultados a largo plazo (principalmente supervivencia global y libre de progresión, tasa de recidiva y tasa de pacientes que completaron el esquema terapéutico) en pacientes diagnosticados de CCR y MHS potencialmente resecables o inicialmente irresecables incluidos en un esquema de EI.
Material y métodoEstudio retrospectivo descriptivo sobre una base de datos prospectiva de 609 pacientes intervenidos de metástasis hepáticas de cáncer colorrectal (MHCCR) en 2 hospitales terciarios desde junio de 2007 en uno de ellos (Centro 1) y marzo de 2015 en el otro (Centro 2) (momento en el que se constituyó una unidad de cirugía hepática conjunta con los mismos protocolos terapéuticos en ambos hospitales), cerrándose la inclusión en ambos centros en diciembre de 2019 para obtener un seguimiento mínimo de 6 meses.
Se identificaron 88 pacientes diagnosticados de CCR y MHS de forma consecutiva que, tras evaluación en comité multidisciplinar, se incluyeron en un esquema de EI. Los criterios de inclusión fueron1: CCR asintomático o sintomático tratable mediante endoprótesis o derivación quirúrgica2, MHS potencialmente resecables o inicialmente irresecables (según las NCCN colon cáncer guidelines)3, ausencia de enfermedad extrahepática irresecable4, paciente apto para cirugía (ECOG≤2)5, consentimiento informado. Se consideró fallo en intención de tratar a1: persistencia de metástasis hepáticas irresecables o progresión de las mismas tras el tratamiento neoadyuvante2, progresión de la enfermedad entre la hepatectomía y la colectomía3, sintomatología del CCR no tratable mediante endoprótesis o derivación quirúrgica.
El esquema de la EI consistió en iniciar el tratamiento con quimioterapia neoadyuvante. La respuesta a la quimioterapia tras el tercer o cuarto ciclo se evaluó mediante los criterios radiológicos RECIST10, con una tomografía computarizada (TC) y resonancia magnética (RM) con contraste hepato-específico (gadoxetato disódico). En ausencia de progresión, se consideró para cirugía hepática y, finalmente, se realizó la cirugía del CCR. Los pacientes con neoplasia de recto recibieron quimioradioterapia preoperatoria y una re-estadificación de la enfermedad mediante TC y RM pélvica. Las complicaciones derivadas de ambas cirugías se registraron según la clasificación Clavien-Dindo11.
Quimioterapia neoadyuvanteSe basó en esquema Folfox (ácido folínico, fluorouracilo y oxaliplatino) en la mayoría de los casos, asociado a anticuerpo monoclonal según el estado mutacional RAS/BRAF. Se revaloró la resecabilidad de las MHS en comité multidisciplinar y los pacientes tributarios a cirugía fueron intervenidos tras un intervalo de unas 4 semanas. En los pacientes tratados con antiangiogénico el intervalo fue de 6 semanas.
CirugíaEl objetivo de la cirugía hepática fue la resección tumoral completa manteniendo un volumen hepático residual suficiente (FLR)>25% del volumen hepático total. Se realizaron estrategias de incremento del volumen (embolización portal [PVE] o bipartición hepática [ALPPS]) si el FLR era <25%. El abordaje fue laparoscópico en los casos considerados técnicamente factibles por el equipo quirúrgico.
Análisis estadísticoLos datos categóricos se presentan como números absolutos y porcentajes. Los datos contínuos se presentan como medias (con desviaciones estándar). Para el estudio de los factores que influyen en la tasa de resección R0/R1 y la tasa de recidiva se han analizado las variables mediante Chi-cuadrado para el estudio univariante y el método de regresión logística para el análisis multivariante. Considerando la significación estadística significativa una p<0,05. Para el estudio de los factores pronósticos de la supervivencia se realizó el método de Kaplan-Meier y regresión de Cox (univariante) y la regresión de Cox por pasos hacia delante (multivariante). El seguimiento medio se consideró el tiempo transcurrido desde la cirugía colorrectal hasta la fecha de la última visita. La supervivencia global (SG) se consideró el tiempo transcurrido desde el diagnóstico hasta la fecha de la última visita. La supervivencia libre de progresión (SLP) se consideró el tiempo desde la cirugía del CCR hasta la fecha de la primera recidiva (en caso de haberse realizado una cirugía R0 y que no exista enfermedad metastásica al diagnóstico) o progresión de la enfermedad (en resecciones R1 o enfermedad extrahepática no resecada, principalmente pulmonar). Los análisis se realizaron con el programa SPSS® (versión 26).
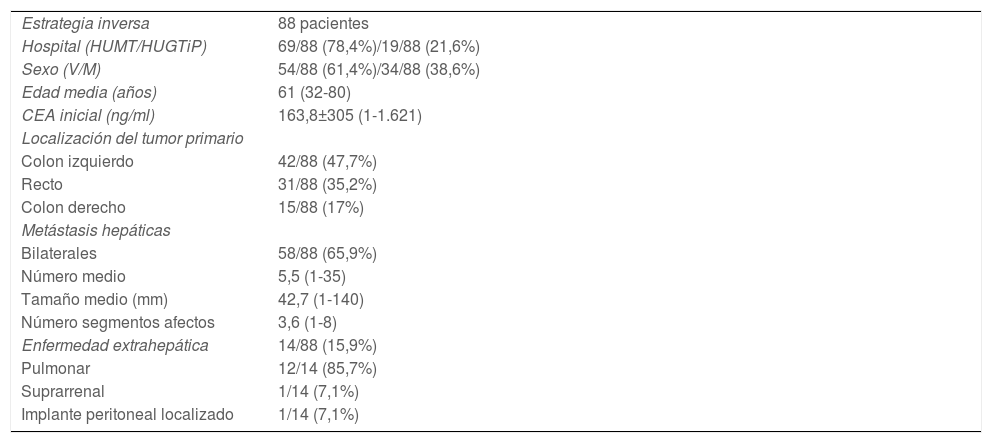
ResultadosDe los 88 pacientes incluidos en la EI, el 61,4% fueron varones, con una edad media de 61 años (32-80). La localización más frecuente del CCR fue el colon izquierdo (47,7%), seguido del recto (35,2%) y el colon derecho (17%).
La enfermedad hepática fue bilateral en el 65,9%, con una media de 3,6 segmentos afectos (1-8). El número y tamaño medio de las lesiones fue de 5,5 (1-35) y 42,7mm (1-140), respectivamente.
El 15,9% de pacientes presentaban enfermedad extrahepática inicialmente, siendo la pulmonar la más frecuente (85,7%). Un paciente presentaba metástasis suprarrenal y otro un implante peritoneal localizado (tabla 1).
Características preoperatorias de los pacientes con cáncer colorrectal y enfermedad hepática metastásica sincrónica avanzada seleccionados para estrategia inversa
| Estrategia inversa | 88 pacientes |
| Hospital (HUMT/HUGTiP) | 69/88 (78,4%)/19/88 (21,6%) |
| Sexo (V/M) | 54/88 (61,4%)/34/88 (38,6%) |
| Edad media (años) | 61 (32-80) |
| CEA inicial (ng/ml) | 163,8±305 (1-1.621) |
| Localización del tumor primario | |
| Colon izquierdo | 42/88 (47,7%) |
| Recto | 31/88 (35,2%) |
| Colon derecho | 15/88 (17%) |
| Metástasis hepáticas | |
| Bilaterales | 58/88 (65,9%) |
| Número medio | 5,5 (1-35) |
| Tamaño medio (mm) | 42,7 (1-140) |
| Número segmentos afectos | 3,6 (1-8) |
| Enfermedad extrahepática | 14/88 (15,9%) |
| Pulmonar | 12/14 (85,7%) |
| Suprarrenal | 1/14 (7,1%) |
| Implante peritoneal localizado | 1/14 (7,1%) |
CEA: antígeno carcinoembrionario; HUGTiP: Hospital Universitari Germans Trias i Pujol; HUMT: Hospital Universitari Mútua Terrassa; M: mujer; mm: milímetros; V: varón
Setenta y cinco pacientes (85,2%) completaron la EI. Nueve pacientes requirieron colocación de endoprótesis y 3 una colostomía por sintomatología del CCR, permitiendo completar el tratamiento (fig. 1).
Trece pacientes (14,8%) no completaron EI por fallo en intención de tratar. La causa más frecuente fue por progresión durante la quimioterapia neoadyuvante (53,8%), seguido de progresión entre la hepatectomía y colectomía (30,8%) y, finalmente, por sintomatología del CCR no tratable mediante endoprótesis o derivación (15,4%).
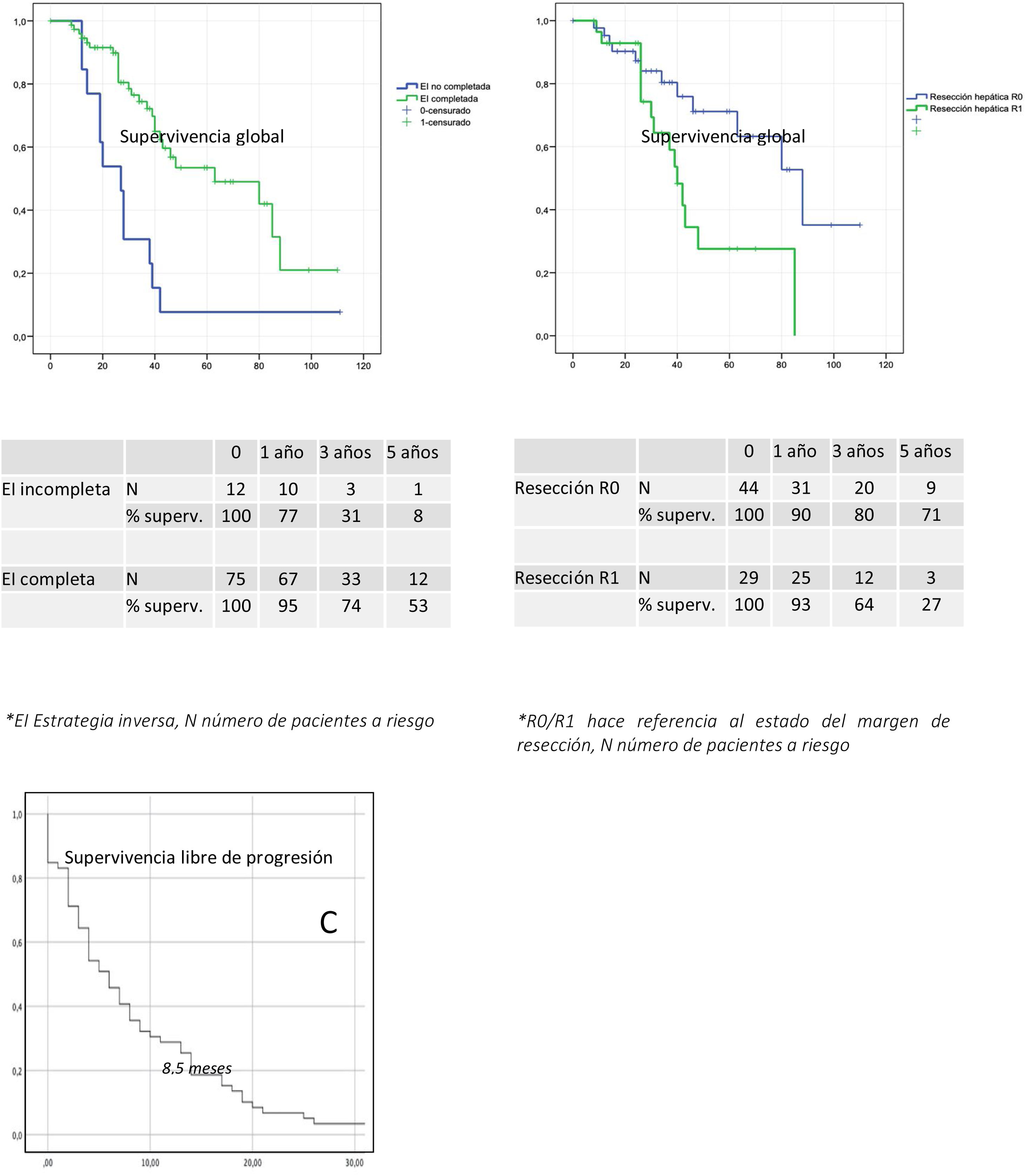
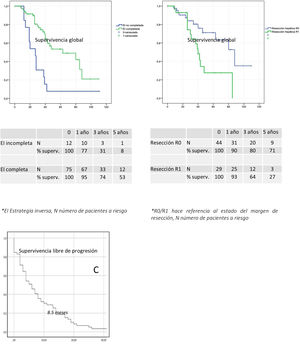
La SG a 5 años de este grupo de pacientes fue del 8% (fig. 2).
Curvas de supervivencia libre de progresión (SLP) y supervivencia global (SG) a los 5 años.
A) SG a los 5 años de los pacientes que completaron la EI (color verde) respecto a los que no la completaron (color azul).
B) SG a los 5 años de los pacientes con margen de resección hepático libre (color azul) respecto a los que presentaron margen afecto (color verde).
C) SLP de los pacientes que completaron la EI.
EI: estrategia inversa; N: número de pacientes a riesgo; R0/R1: hace referencia al estado del margen de resección.
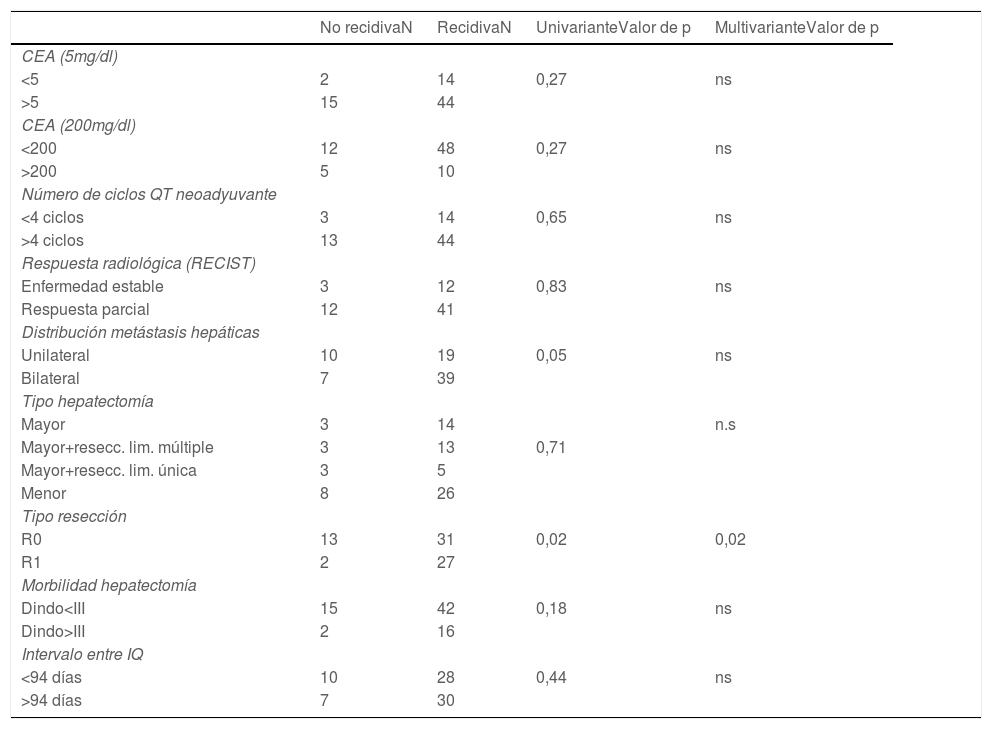
El 93,3% realizó quimioterapia neoadyuvante intravenosa. El esquema fue Folfox en el 84% de los casos, con una media de 8,5 ciclos ±6,5 (2-36). El 54,3% asoció un anticuerpo monoclonal (cetuximab [24,3%], bevacizumab [17,1%] y panitumumab [12,9%]). La respuesta radiológica fue parcial en el 75,7% de los pacientes y estabilización en el 22,8%. El número de ciclos de QT neoadyuvante (mayor o menor de 4 ciclos) y el tipo de respuesta radiológica no tuvieron influencia sobre la recidiva de la enfermedad (tabla 2).
Análisis de los factores relacionados con la recidiva en el grupo de pacientes que completaron la EI (test de Chi-cuadrado [univariante], regresión logística [multivariante])
| No recidivaN | RecidivaN | UnivarianteValor de p | MultivarianteValor de p | |
|---|---|---|---|---|
| CEA (5mg/dl) | ||||
| <5 | 2 | 14 | 0,27 | ns |
| >5 | 15 | 44 | ||
| CEA (200mg/dl) | ||||
| <200 | 12 | 48 | 0,27 | ns |
| >200 | 5 | 10 | ||
| Número de ciclos QT neoadyuvante | ||||
| <4 ciclos | 3 | 14 | 0,65 | ns |
| >4 ciclos | 13 | 44 | ||
| Respuesta radiológica (RECIST) | ||||
| Enfermedad estable | 3 | 12 | 0,83 | ns |
| Respuesta parcial | 12 | 41 | ||
| Distribución metástasis hepáticas | ||||
| Unilateral | 10 | 19 | 0,05 | ns |
| Bilateral | 7 | 39 | ||
| Tipo hepatectomía | ||||
| Mayor | 3 | 14 | n.s | |
| Mayor+resecc. lim. múltiple | 3 | 13 | 0,71 | |
| Mayor+resecc. lim. única | 3 | 5 | ||
| Menor | 8 | 26 | ||
| Tipo resección | ||||
| R0 | 13 | 31 | 0,02 | 0,02 |
| R1 | 2 | 27 | ||
| Morbilidad hepatectomía | ||||
| Dindo<III | 15 | 42 | 0,18 | ns |
| Dindo>III | 2 | 16 | ||
| Intervalo entre IQ | ||||
| <94 días | 10 | 28 | 0,44 | ns |
| >94 días | 7 | 30 |
CEA: antígeno carcinoembrionario; IQ: intervención quirúrgica; N:; ns: no significativo; QT: quimioterapia; RECIST: Response Evaluation Criteria in Solid Tumors; R0/R1: hace referencia al estado del margen de resección.
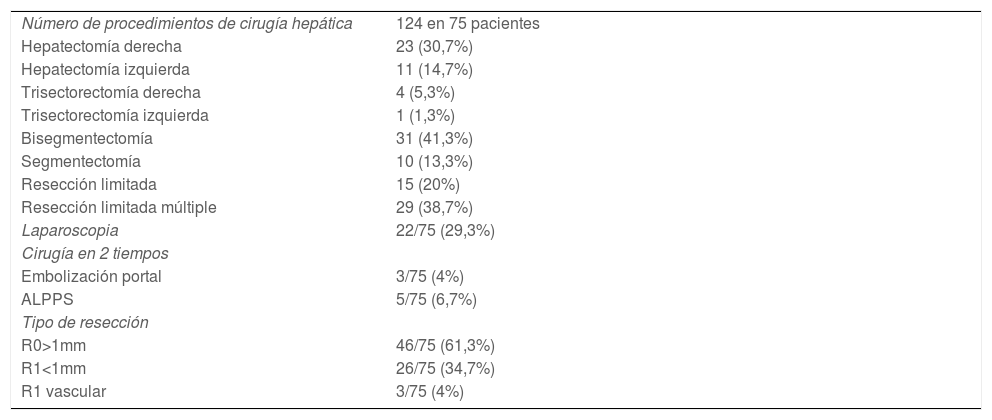
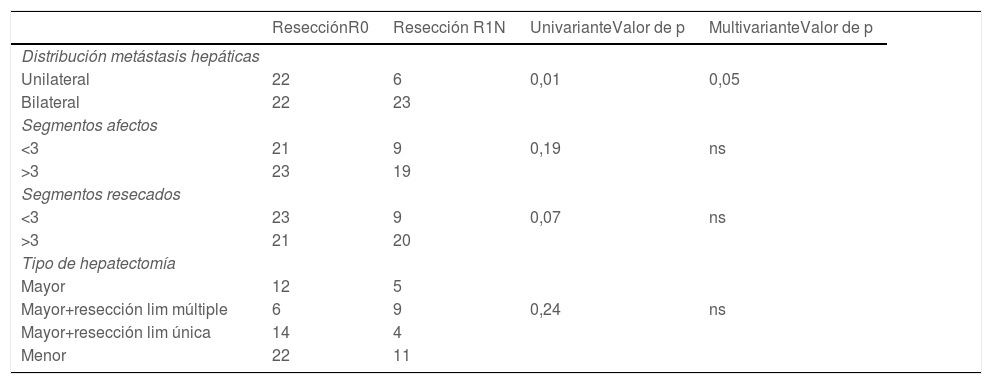
Respecto a la cirugía hepática, el número de procedimientos realizados, el tipo de resección hepática, la vía de abordaje, los procedimientos de incremento de volumen y el análisis del margen de resección se resumen en la tabla 3. En 2 pacientes se asoció otro procedimiento a la resección hepática (una suprarrenalectomía y una resección de un implante peritoneal diafragmático localizado). La distribución bilateral de las metástasis hepáticas fue identificado como un factor de riesgo de obtener una resección R1 tanto en el análisis univariante como en el multivariante. El número de segmentos hepáticos afectados, el número de segmentos resecados y el tipo de resección hepática realizada no tuvieron influencia en el estado del margen de resección (tabla 4). La morbilidad tras la cirugía hepática fue mayoritariamente grado IIIA en el 18,7% (14 pacientes requirieron un drenaje percutáneo por colección intraabdominal), seguido de grado I en el 16%. Cinco pacientes requirieron una reintervención quirúrgica (2 por hemoperitoneo y 3 para drenaje de colecciones no accesibles percutánemente). No hubo mortalidad peroperatoria a los 90 días (tabla 5).
Resultados de la cirugía hepática
| Número de procedimientos de cirugía hepática | 124 en 75 pacientes |
| Hepatectomía derecha | 23 (30,7%) |
| Hepatectomía izquierda | 11 (14,7%) |
| Trisectorectomía derecha | 4 (5,3%) |
| Trisectorectomía izquierda | 1 (1,3%) |
| Bisegmentectomía | 31 (41,3%) |
| Segmentectomía | 10 (13,3%) |
| Resección limitada | 15 (20%) |
| Resección limitada múltiple | 29 (38,7%) |
| Laparoscopia | 22/75 (29,3%) |
| Cirugía en 2 tiempos | |
| Embolización portal | 3/75 (4%) |
| ALPPS | 5/75 (6,7%) |
| Tipo de resección | |
| R0>1mm | 46/75 (61,3%) |
| R1<1mm | 26/75 (34,7%) |
| R1 vascular | 3/75 (4%) |
ALPPS: Associating Liver Partition and Portal vein Ligation for Staged hepatectomy; R0/R1: hace referencia al estado del margen de resección.
Influencia de las características de las metástasis hepáticas y el tipo de resección hepática en la obtención de una resección hepática completa (test de Chi-cuadrado [univariante], regresión logística [multivariante])
| ResecciónR0 | Resección R1N | UnivarianteValor de p | MultivarianteValor de p | |
|---|---|---|---|---|
| Distribución metástasis hepáticas | ||||
| Unilateral | 22 | 6 | 0,01 | 0,05 |
| Bilateral | 22 | 23 | ||
| Segmentos afectos | ||||
| <3 | 21 | 9 | 0,19 | ns |
| >3 | 23 | 19 | ||
| Segmentos resecados | ||||
| <3 | 23 | 9 | 0,07 | ns |
| >3 | 21 | 20 | ||
| Tipo de hepatectomía | ||||
| Mayor | 12 | 5 | ||
| Mayor+resección lim múltiple | 6 | 9 | 0,24 | ns |
| Mayor+resección lim única | 14 | 4 | ||
| Menor | 22 | 11 | ||
N: número de pacientes; R0/R1: hace referencia al estado del margen de resección; ns: no significativo.
Morbimortalidad tras la cirugía hepática y colorrectal según la clasificación de Clavien-Dindo
| Morbilidad (clasificación Clavien-Dindo) (30 días) | Hepatectomía | Colectomía |
|---|---|---|
| Grado I | 12 (16%) | 13 (17,3%) |
| Grado II | 8 (10,7%) | 8 (10,7%) |
| Grado IIIA (drenaje percutáneo) | 14 (18,7%) | 3 (4%) |
| Grado IIIB (re-intervención) | 5 (6,7%) | 3 (4%) |
| Grado IVA | 3 (4%) | 1 (1,3%) |
| Grado IVB | 0 | 0 |
| Mortalidad perioperatoria (90 días) | 0 | 0 |
En relación a la cirugía del CCR, las intervenciones más frecuentes fueron la hemicolectomía izquierda (45,6%), la cirugía de recto (31,7%) y la hemicolectomía derecha (21,1%). La intervención fue laparoscópica en el 41,3% de los casos. Todos los pacientes con neoplasia de recto recibieron radioterapia preoperatoria. La cirugía fue R0 en el 89,3% de pacientes, R1 en el 6,7% y R2 en el 2,7%.
La morbilidad tras la cirugía colorrectal fue grado III o superior en 7 pacientes (9,3%). No hubo mortalidad peroperatoria a los 90 días (tabla 4).
La mediana de días transcurridos entre la hepatectomía y la colectomía fue de 94 días (20-536). La presencia/ausencia de morbilidad grave tras hepatectomía (Dindo>III) no tuvo influencia sobre el intervalo de días transcurridos entre las 2 intervenciones siendo de 83 y 113 días, respectivamente (p=0,59). Un 57,3% de pacientes recibió quimioterapia adyuvante tras la cirugía colorrectal.
SeguimientoDurante el seguimiento, se diagnosticaron 106 recidivas en 57 pacientes (76%). La más frecuente fue hepática (53%), seguida de pulmonar (34%) y locorregional (13%). El tratamiento de la recidiva tumoral fue quirúrgico asociado a quimioterapia en 34 pacientes (32,1%), incluyendo 20 rehepatectomías, 10 resecciones atípicas pulmonares y 2 cirugías de la recidiva locorregional.
La presencia de enfermedad hepática bilateral y la obtención de un margen de resección hepático positivo fueron identificados como factores de riesgo para la recidiva de la enfermedad. En el análisis multivariante, únicamente la afectación del margen de resección mantuvo la significación estadística. Otros factores como el número de ciclos de quimioterapia neoadyuvante, la respuesta radiológica, el nivel de CEA, la morbilidad tras la cirugía hepática y el intervalo entre la cirugía hepática y colónica no tuvieron influencia sobre la tasa de recidiva (tabla 5).
Tras un seguimiento medio de 27,6 meses, el 64% de pacientes estaban vivos. La SLP fue de 8,5 meses, la SG a 5 años de los pacientes con EI completada fue del 53% respecto al 8% en los pacientes que no la completaron, siendo estas diferencias significativas en el análisis uni y multivariante.
El estado del margen de resección hepático (R0/R1) tuvo impacto sobre la SG a 5 años, siendo del 63,3 y 27,6%, respectivamente, con una significación de p de 0,02 en el análisis multivariante (fig. 2). La tasa de recidiva, las complicaciones graves tras cirugía hepática o el intervalo prolongado entre las 2 cirugías no tuvieron impacto sobre la supervivencia a largo plazo.
DiscusiónLa EI o «Liver-First Approach» fue introducida por Mentha et al. en 2006 para el tratamiento de las MHS de CCR9. Esta incluye la quimioterapia preoperatoria, seguida de resección de las MHS y, finalmente, resección del CCR. Esta estrategia permite obtener un control inicial de la enfermedad metastásica hepática mediante el tratamiento sistémico, por lo que podría optimizar las posibilidades de resección hepática curativa. A diferencia del abordaje clásico, podría minimizar el riesgo de progresión de las MHS, convirtiéndose estas en irresecables tras la resección intestinal, debido a complicaciones derivadas de la cirugía colorrectal, especialmente en casos de enfermedad hepática avanzada7,14,15.
Este estudio descriptivo evalúa los resultados a largo plazo de la EI en pacientes con CCR y MHS avanzadas en 2 hospitales terciarios durante un período de 12 años.
Se consideró enfermedad hepática avanzada aquella con alta carga tumoral, generalmente metástasis múltiples y bilobares, o bien lesiones que por su localización implicaran resecciones técnicamente complejas.
Mediante este abordaje terapéutico un 85,2% de los pacientes completó el esquema terapéutico, siendo este resultado ligeramente superior al de otras series publicadas previamente (65-84%)1,12–14. Esta diferencia podría deberse a que pacientes con MHS avanzadas diagnosticados en otros centros, únicamente fueron referidos a valoración del comité multidisciplinar en caso de respuesta al tratamiento neoadyuvante, perdiéndose aquellos que no tuvieron respuesta. Esto generaría un sesgo a favor de pacientes respondedores al tratamiento y con mayores posibilidades de completar la EI.
Entre las ventajas descritas de la EI se encuentran una duración menor de la quimioterapia previa a la resección hepática, una tasa de respuesta elevada a la quimioterapia y una mayor tasa de respuesta previa a la hepatectomía, así como maximizar la realización de radioterapia pélvica en los pacientes con neoplasia rectal14. El análisis de esta serie confirma estas ventajas, ya que la duración media de la quimioterapia neoadyuvante fue de 8 ciclos, optimizándose su efectividad y realizándose la cirugía hepática en fase de respuesta. Únicamente 7 pacientes (8%) progresaron durante la neoadyuvancia y fueron excluidos por fallo en intención de tratar. En el 92% de los pacientes se obtuvo estabilización o respuesta radiológica parcial según criterios RECIST, siendo similar a la descrita en la literatura13,16,17. En esta serie se evaluó la respuesta al tratamiento mediante TC abdominal con contraste intravenoso y RM con contraste hepato-específico (gadoxetato disódico). Esta última podría permitir la detección de lesiones hepáticas no diagnosticadas mediante otras técnicas y, por tanto, modificar la estrategia quirúrgica en algunos pacientes22–24.
La EI está indicada en pacientes con CCR asintomático o con síntomas tratables mediante colocación de endoprótesis o derivación quirúrgica, permitiendo así completar el tratamiento. Otras series reportan sintomatología derivada del CCR durante el tratamiento entre el 5 y el 7% de pacientes1,14. En la serie actual, el 16% de pacientes requirieron tratamiento por CCR sintomático completando el esquema terapéutico.
El 93,3% realizó quimioterapia neoadyuvante intravenosa, exceptuando dos casos por edad avanzada y comorbilidad que recibieron quimioterapia oral. Solo en el 54,3% de los casos se asoció un anticuerpo monoclonal, probablemente por el diferente criterio por parte de los oncólogos de los 2 centros participantes en cuanto a su indicación en régimen de neoadyuvancia.
En cuanto a la cirugía hepática, un 54-57% de los casos requirió una hepatectomía mayor para obtener una resección R0. En la literatura disponible se reporta entre un 36-89% de hepatectomías mayores13,16,17. Este elevado porcentaje de resecciones hepáticas mayores podría ser debido a que en la mayoría de las series publicadas, incluyendo la actual, los pacientes seleccionados para EI tienden a presentar mayor porcentaje de enfermedad hepática múltiple y bilobar. En esta serie, el 65,9% de los casos presentaban MHS bilaterales, con una media de >5 lesiones, >4cm de tamaño y >3 segmentos afectos.
En nuestra serie, el 29,3% de hepatectomías fueron por laparoscopia. La bibliografía disponible no muestra diferencias entre el abordaje abierto y el laparoscópico en enfermedad hepática maligna, por lo que la decisión de realizar un abordaje laparoscópico en estos casos debe fundamentarse en la experiencia del equipo quirúrgico17.
La resección hepática fue R0 en el 61,3% de los pacientes, siendo similar a lo reportado en otras series (50-80%)13,16 y R1 en el 34,7%. La tasa de resecciones R1 está relacionada con la carga tumoral hepática. En el presente estudio únicamente la distribución bilateral de las metástasis se relacionó con una mayor tasa de resecciones R1. El número de segmentos hepáticos afectados y resecados superior a 3 o el tipo de resección hepática realizada no influyeron en el estado del margen de resección. La obtención de un margen de resección positivo en la cirugía hepática se relacionó con una mayor tasa de recidiva de la enfermedad y una supervivencia a 5 años menor respecto a los pacientes con una resección hepática R0. Sin embargo, en nuestra opinión, la posibilidad de obtener una resección R1 tras cirugía hepática no debería constituir un criterio de irresecabilidad, ya que en este grupo de pacientes los resultados a largo plazo son superiores a los que no se les realiza ninguna resección18.
La morbilidad fue principalmente grado IIIA (18,7%) tras la cirugía hepática y grado I (17,3%) tras la cirugía colorrectal, equiparable a otras series descritas19. No hubo mortalidad perioperatoria a los 90 días. La presencia de complicaciones graves tras la hepatectomía (Dindo>IIIA) constituye una de las preocupaciones al plantear una EI, ya que podría retrasar la cirugía del primario y tener un impacto negativo en la evolución de estos pacientes. Sin embargo, en esta serie la morbilidad post-hepatectomía no se relacionó ni con una mayor tasa de recidivas ni incrementó el intervalo de días entre la cirugía hepática y colorrectal, así como tampoco impactó negativamente en la supervivencia a largo plazo.
No se han demostrado diferencias en la supervivencia de pacientes tratados mediante abordaje clásico o EI14,20,21,25, aunque no existen estudios aleatorizados comparando ambas estrategias. Podría existir una tendencia a incluir en la EI a pacientes con enfermedad hepática más avanzada, lo que impactaría negativamente en la supervivencia de este grupo.
La SLP fue de 8,5 meses. Dado que la mayoría de pacientes incluidos en la EI presentaban enfermedad hepática avanzada y hasta el 15,9% tenían enfermedad extrahepática en el momento del diagnóstico, se consideró más apropiado analizar la SLP y no la supervivencia libre de enfermedad. En el caso de las metástasis pulmonares (localización más frecuente), en muchas ocasiones se logran controlar e incluso cronificar con la quimioterapia sistémica.
La recurrencia en las series de EI no es infrecuente, pero su tasa es variable14. En nuestra serie, 57 pacientes (76%) presentaron al menos una recidiva. De estos, el 32,1% fueron tratados con cirugía y quimioterapia. Los autores consideran fundamental el manejo de estos pacientes en el marco de un comité multidisciplinar que facilite la detección precoz y el tratamiento de las recidivas.
La SG a los 5 años de los pacientes con la EI completada fue del 53%, similar al de la serie global de hepatectomías (30-72%)12,16,17.
Las limitaciones del presente estudio incluyen que se trata de un análisis retrospectivo con un número limitado de pacientes, únicamente forman parte dos hospitales y no hay grupo control con el que comparar. Algunos datos que podrían tener influencia en el pronóstico, como el estado mutacional (RAS/BRAF), no han sido analizados.
En conclusión, en los pacientes con CCR y MHS avanzadas, la EI permite el control inicial de la enfermedad metastásica, completándose el esquema terapéutico en el 85,2% de los pacientes, con una morbimortalidad aceptable y una supervivencia global similar a la serie global de hepatectomías.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.