El tratamiento del cáncer de esófago con pretensión curativa requiere un planteamiento multidisciplinar. La terapia neoadyuvante, la radicalidad de la resección y la extensión de la linfadenectomía pueden incrementar la morbimortalidad postoperatoria. El objetivo de este estudio es analizar los resultados del tratamiento quirúrgico del cáncer de esófago desde la creación del Comité de Tumores Esofagogástricos.
MétodosEstudio retrospectivo (de enero de 2005 a marzo de 2012) de todos los pacientes con cáncer de esófago o de la unión esofagogástrica a los que se les realizó una esofagectomía. Se analizaron el tipo de resección, las complicaciones postoperatorias, la mortalidad y la supervivencia.
Resultados: A 100 pacientes de un total de 392 diagnosticados se les realizó una esofagectomía. En 74 casos se administró tratamiento neoadyuvante. Se realizaron 82 esofagectomías transtorácicas en 2 o 3 campos, 10 esofagectomías transhiatales y 8 coloplastias. En 98 pacientes la resección fue R0. Se diagnosticaron 9 dehiscencias anastomóticas intratorácicas y 6 cervicales. La morbilidad global fue del 42% y la mortalidad hospitalaria y a los 90 días fue del 2%. La mediana de la estancia hospitalaria fue de 16 días. La supervivencia actuarial al año es del 82% y a los 5 años, del 56%.
ConclusionesEl tratamiento quirúrgico con intención curativa de la neoplasia de esófago solo es posible en una cuarta parte de los pacientes diagnosticados. La elevada morbilidad se debe, sobre todo, a complicaciones torácicas.
Treatment of oesophageal cancer with curative intent requires a multidisciplinary approach. Neoadjuvant therapy, the radicality of resection and extension of lymphadenectomy have been associated with increased operative morbidity and mortality. The aim of this study was to assess the results of surgical treatment of oesophageal cancer since the presence of an interdisciplinary esophagogastric tumour board.
MethodsPatients with cancer of the oesophagus and oesophagogastric junction who underwent oesophagectomy between January 2005 and March 2012 were included in this retrospective study. Data concerning type of resection, postoperative complications, mortality and survival were analysed.
ResultsOf the 392 patients with a diagnosis of oesophageal cancer over the study period, 100 underwent oesophagectomy. Seventy-four patients received neoadjuvant treatment. Eighty-two patients underwent transthoracic resection while a transhiatal was used in 10 patients. Colon interposition was required in 8 cases. An R0 resection was achieved in 98 patients. Anastomotic leaks developed in 15 patients, 9 were intrathoracic and 6 were cervical. Postoperative morbidity occurred in 42% of patients, and intra-hospital and 90-day mortality was 2%. Median length of hospital stay was 16 days. The respective actuarial survival at 1 and 5 years were 82% and 56%.
ConclusionsSurgical treatment with curative intention for oesophageal cancer is only possible in a quarter of patients diagnosed. The high morbidity rate was mainly due to intrathoracic complications.
El cáncer de esófago es una neoplasia de una gran agresividad cuyo pronóstico no ha mejorado significativamente en los últimos años1. En los países occidentales, el adenocarcinoma ha desplazado en frecuencia al carcinoma escamoso2, y el reflujo gastroesofágico y la obesidad son sus principales factores de riesgo3.
Aunque el planteamiento diagnóstico y terapéutico del cáncer de esófago debe ser multidisciplinar4, la esofagectomía es la mejor opción terapéutica en los tumores que infiltran hasta la submucosa5. La combinación de quimioterapia (QT) y radioterapia (RDT) con intención adyuvante6, neoadyuvante7,8 y radical9 completan el arsenal terapéutico.
La resección del cáncer de esófago es técnicamente compleja, precisa de un importante número de recursos materiales y humanos para su realización y se asocia a un elevado número de complicaciones10–12. Predomina la opinión de que los mejores resultados se obtienen, tanto en la morbimortalidad postoperatoria4,13,14 como en la supervivencia a largo plazo, en aquellos centros con un elevado número de pacientes15. La vía de abordaje más adecuada para la realización de la resección esofágica (transhiatal limitada [TH] o transtorácica con linfadenectomía en bloque [TT]) es controvertida16, aunque parece demostrado que la supervivencia libre de enfermedad a los 5 años es significativamente mejor con la esofagectomía TT en los pacientes cuyo número de adenopatías afectadas es limitado17.
En la actualidad, el tratamiento del cáncer de esófago es el mismo para los 2 tipos histológicos del tumor, si bien trabajos recientes1 parecen demostrar un mejor pronóstico a los 5 años de la resección esofágica en el adenocarcinoma que en el carcinoma escamoso.
El objetivo de este estudio ha sido analizar los resultados de una serie consecutiva de esofagectomías por neoplasia que fueron realizadas en la Unidad de Cirugía Esofagogástrica del Hospital Universitari de Bellvitge desde la creación del Comité de Tumores Esofagogástricos (UTEG).
Pacientes y métodosSe han analizado los resultados de las esofagectomías (morbilidad, mortalidad intrahospitalaria y a los 90 días y supervivencia) en pacientes con cáncer de esófago o de la unión esofagogástrica (UEG) Siewert I desde enero de 2005 (fecha de la creación del UTEG) hasta marzo de 2012. Los tumores de la UEG fueron clasificados topográficamente siguiendo la clasificación de Siewert18.
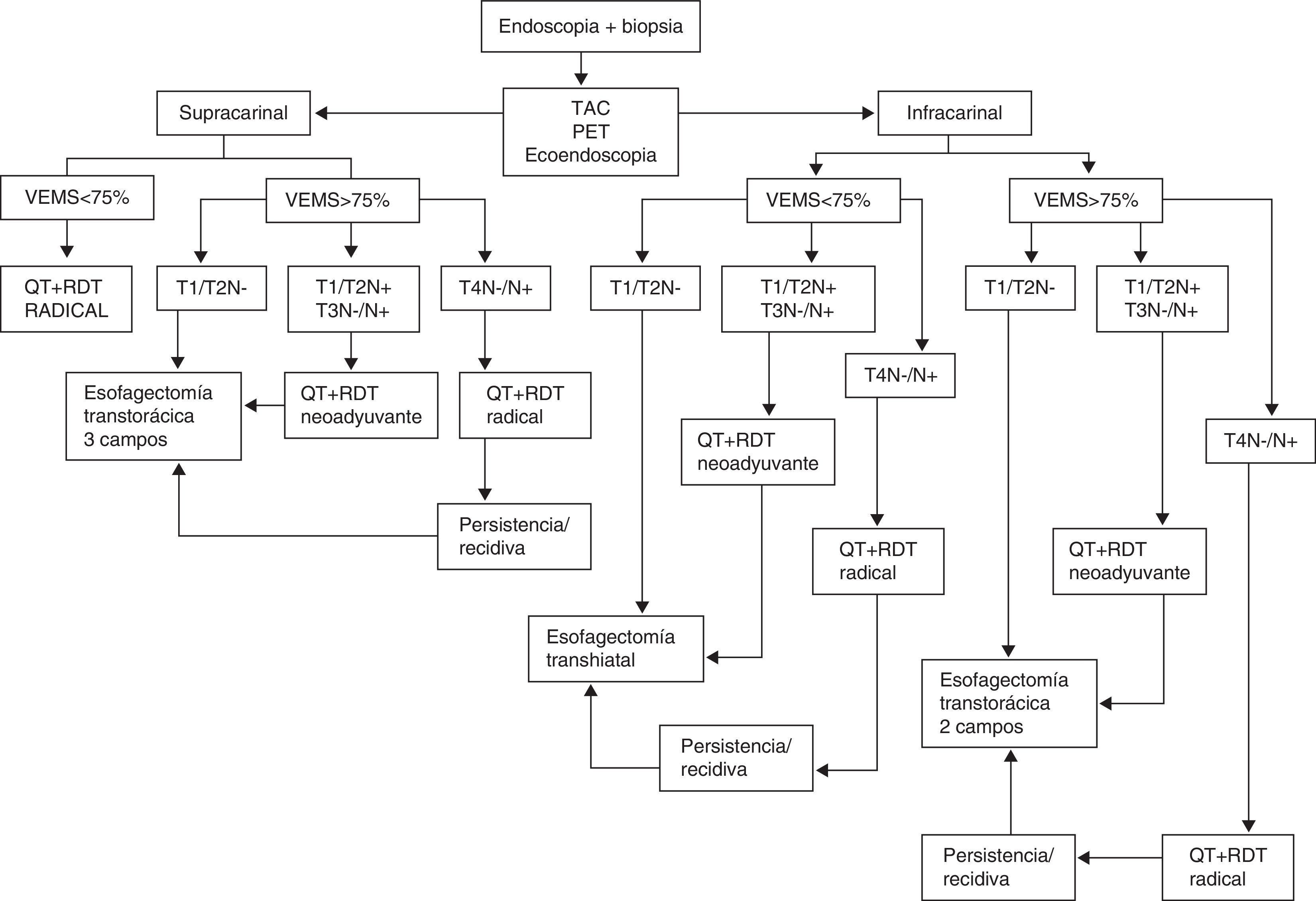
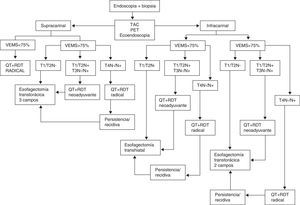
Protocolo de tratamientoEl protocolo de actuación de la UTEG en nuestro centro se muestra en la figura 1. El estudio de extensión se realiza con tomografía computarizada (TC), ecoendoscopia y tomografía por emisión de positrones (PET). La clasificación de los tumores se establece según la séptima edición del American Joint Comittee on Cancer (AJCC) Cancer Staging Manual19.
A todos los pacientes se les realiza una prueba de función respiratoria (PFR) durante el estudio de extensión de la enfermedad. Aquellos pacientes con un tumor supracarinal y un volumen espiratorio máximo por segundo (VEMS) < 75% no son candidatos al tratamiento quirúrgico. En el resto de los casos, nuestra conducta es la siguiente: T1/T2N0 son intervenidos quirúrgicamente; T1/T2N1 y T3N0/N1 reciben tratamiento neoadyuvante con QT y RDT según el esquema de cisplatino 75mg/m2/día intravenoso (día 1) y 5-fluoruracilo en infusión continua 1.000mg/m2/día (días 1-4 o 5) o carboplatino y 5-fluoruracilo a las mismas dosis en los pacientes con antecedentes de oto- o nefrotoxicidad. Se administran 2 ciclos de QT en la primera y la cuarta semanas de la RDT. La dosis total de RDT es de de 45Gy, 1,8Gy/fracción en el tumor y profilaxis en las áreas linfoides. A los pacientes T4N0/N1 se les ofrece tratamiento radical con 4 ciclos de QT (el segundo y tercero concomitantes con RDT), siendo la dosis total de RDT de 66 Gy, 2 Gy/fracción. En aquellos casos con respuesta incompleta al tratamiento radical o recidiva de la neoplasia durante el seguimiento de una respuesta completa, se valora la realización de cirugía de rescate.
Tratamiento quirúrgicoEn todos aquellos casos en los que se planifica una esofagogastrostomía cervical (esofagectomía TH o TT en 3 campos), se realiza un acondicionamiento gástrico mediante embolización arterial percutánea de la arteria gástrica izquierda, gástrica derecha y esplénica en las 2 o 3 semanas previas a la cirugía20,21.
En la inducción anestésica se administran 2 g de ceftriaxona y 1 g de metronidazol intravenoso como profilaxis antibiótica. Se les coloca a todos los pacientes un catéter peridural. El tratamiento quirúrgico dependerá de la localización de la neoplasia: en los pacientes con neoplasia infracarinal y VEMS > 75%, se realiza una TT a 2 campos según técnica de Ivor Lewis; con un VEMS < 75%, optamos por una TH. En aquellos pacientes en que la neoplasia se localiza proximal a la carina y con un VEMS > 75%, se realiza una esofagectomía TT en 3 campos según técnica de McKeown. Independientemente de la técnica utilizada, confeccionamos una plastia gástrica de unos 3 cm de amplitud y de la mayor longitud posible.
A nivel abdominal, realizamos una linfadenectomía D2, exceptuando el grupo 10 que solo se incluye cuando está afectado. En estos casos efectuamos una esplenectomía.
La linfadenectomía mediastínica incluye: grupo mediastínico inferior, periesofágicos, subcarinal, bronquiales, paratraqueales y el conducto torácico. Desde el año 2008, en todos los tumores supracarinales realizamos una linfadenectomía funcional cervical izquierda. En los tumores de la unión esofagogástrica con afectación de esófago distal y cúpula gástrica, realizamos esofagogastrectomía y reconstrucción con coloplastia, preferentemente derecha.
En todos los casos se realiza una yeyunostomía para alimentación enteral precoz y dejamos un drenaje aspirativo a nivel del hiato esofágico. En los abordajes transtorácicos, drenamos la cavidad pleural con 2 tubos torácicos Argyll 28 CH.
Seguimiento postoperatorioPosteriormente a la cirugía, el paciente es trasladado a una Unidad de Medicina Intensiva durante un mínimo de 72 h. Al tercer día se retira el catéter de analgesia peridural. Se inicia nutrición enteral (NE) precoz a las 24 h de la cirugía y se realiza una prueba de imagen con contraste hidrosoluble a los 7 días de la intervención, previa al inicio de dieta oral. El drenaje torácico anterior lo retiramos a las 72 h y el drenaje posterior una vez descartamos la dehiscencia anastomótica.
En ausencia de gastroparesia, la sonda nasogástrica se retira a los 3 días de la cirugía.
Complicaciones postoperatorias y mortalidadLas complicaciones posquirúrgicas se clasificaron según la escala propuesta por Dindo-Clavien22 y se registró la mortalidad intrahospitalaria y a 90 días.
Análisis estadísticoPara la descripción de la población de variables cualitativas se realizaron tablas de frecuencia y porcentajes. Las variables cuantitativas se expresaron como media y desviación estándar (DE) o como mediana y rango intercuartil (percentil 25-75). Se realizó un estudio de supervivencia por las características de la población y tamaño de la muestra mediante el método actuarial.
El paquete estadístico utilizado fue el programa SPSS v. 13 (SSPS, Inc., Chicago, IL, EE. UU.).
ResultadosDesde enero de 2005 a marzo de 2012 se han tratado en la UTEG 392 pacientes diagnosticados de cáncer de esófago o de la UEG, de los que 100 (90 varones) con una edad media de 58 años (DE 6) fueron intervenidos quirúrgicamente.
Cincuenta y un pacientes presentaban clínica de enfermedad por reflujo gastroesofágico (ERGE) y 17 se diagnosticaron histológicamente de esófago de Barrett; 3 pacientes habían sido intervenidos previamente con una técnica antirreflujo.
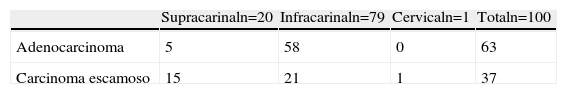
El tumor más frecuente fue el adenocarcinoma (63) y la localización predominante la infracarinal (79) (tabla 1). Después del estudio de extensión, 62 pacientes recibieron tratamiento neoadyuvante y 26 se intervinieron directamente. Durante este período, 88 pacientes fueron tratados con QT+RDT radical, de los que 12 fueron rescatados por presentar persistencia o recidiva de la enfermedad.
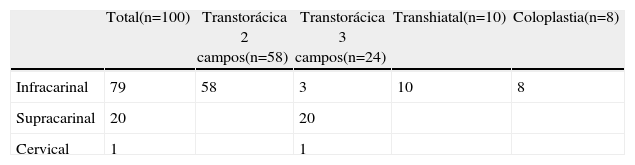
Se realizaron 58 esofagectomías transtorácicas en 2 campos (Ivor Lewis), 24 esofagectomías transtorácicas en 3 campos (McKeown), 10 esofagectomías transhiatales y 8 esofagogastrectomías y reconstrucción con coloplastia derecha (tabla 2). Se realizó un abordaje mínimamente invasivo del tiempo abdominal en 10 de los 27 pacientes sin tratamiento neoadyuvante, completándose la técnica en 8 de ellos (8/27; 29,6%).
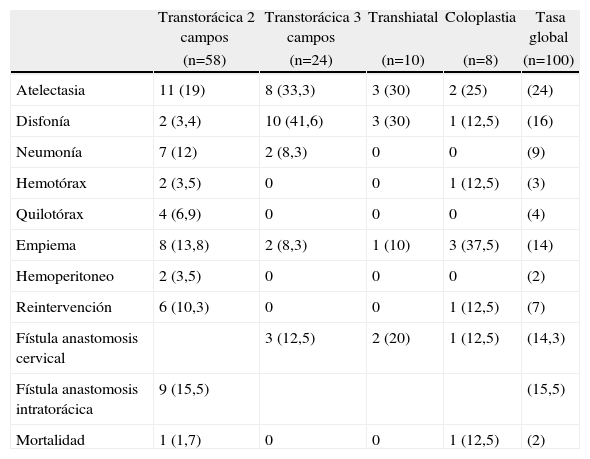
La morbilidad global fue del 42%, con predominio de las complicaciones torácicas (tabla 3). Según la clasificación de Dindo-Clavien22, 23 pacientes presentaron una complicación grado ii, 13 grado iii y 6 grado iv.
Complicaciones de la esofaguectomía según la técnica de reconstrucción
| Transtorácica 2 campos | Transtorácica 3 campos | Transhiatal | Coloplastia | Tasa global | |
| (n=58) | (n=24) | (n=10) | (n=8) | (n=100) | |
| Atelectasia | 11 (19) | 8 (33,3) | 3 (30) | 2 (25) | (24) |
| Disfonía | 2 (3,4) | 10 (41,6) | 3 (30) | 1 (12,5) | (16) |
| Neumonía | 7 (12) | 2 (8,3) | 0 | 0 | (9) |
| Hemotórax | 2 (3,5) | 0 | 0 | 1 (12,5) | (3) |
| Quilotórax | 4 (6,9) | 0 | 0 | 0 | (4) |
| Empiema | 8 (13,8) | 2 (8,3) | 1 (10) | 3 (37,5) | (14) |
| Hemoperitoneo | 2 (3,5) | 0 | 0 | 0 | (2) |
| Reintervención | 6 (10,3) | 0 | 0 | 1 (12,5) | (7) |
| Fístula anastomosis cervical | 3 (12,5) | 2 (20) | 1 (12,5) | (14,3) | |
| Fístula anastomosis intratorácica | 9 (15,5) | (15,5) | |||
| Mortalidad | 1 (1,7) | 0 | 0 | 1 (12,5) | (2) |
Los resultados se expresan como n (%).
Se diagnosticaron 15 dehiscencias anastomóticas. Con relación al tipo de intervención: 9 (15,5%) fueron en anastomosis intratorácicas y 6 (14,3%) en anastomosis cervicales. De los 9 pacientes con fístula intratorácica, 4 fueron reintervenidos y 5 se trataron de manera conservadora con antibioticoterapia de amplio espectro, dieta absoluta y nutrición enteral; en 3 de ellos utilizamos una prótesis endoscópica semicubierta (Wallflex® Esophageal. Fully covered 18 × 153, Galway, Irlanda) para cubrir el defecto.
Siete enfermos fueron reintervenidos: 6 Ivor Lewis (4 dehiscencias, un hemotórax, un hemoperitoneo) y una coloplastia (coleperitoneo).
Dos pacientes fallecieron: uno tras reintervención por hemotórax y otro por broncoaspiración secundaria a oclusión intestinal precoz; la mortalidad a los 90 días fue también del 2%.
Según la NCCN Guidelines versión 2.2011 de la AJCC19, los pacientes intervenidos se clasificaron en: estadio 0: 8; estadio ia: 13; estadioib: 8; estadioiia: 7; estadio iib; 30; estadio iiia: 17; estadioiiib: 4 y estadio iiic: 13. Todos los enfermos que fueron estadio 0 (T0N0M0) habían recibido tratamiento neoadyuvante o radical.
La mediana de adenopatías extirpadas fue de 231,5,17–29. En 13 pacientes con neoplasia supracarinal, se añadió una linfadenectomía funcional cervical; en estos casos, la mediana de adenopatías cervicales extirpadas fue de 109–12, y 3 pacientes presentaron afectación ganglionar.
En 98 casos la resección fue R0 y en 2, R1 por afectación del margen quirúrgico.
No se encontraron diferencias significativas en la morbimortalidad de los pacientes a los que se les administró QT+RDT radical respecto a los que recibieron QT+RDT neoadyuvante; en el análisis de supervivencia a los 5 años, la mortalidad fue más elevada en el grupo con QT+RDT radical (54,5 vs. 34%), si bien no fue estadísticamente significativa.
De los 8 pacientes con respuesta patológica completa (estadio 0), 2 fallecieron a los 27 y a los 7 meses de la cirugía. El resto están vivos a 56, 47 (recidiva), 30, 20, 13 y 7 meses.
La mediana de la estancia en Unidades de Medicina Intensiva fue de 43–6 días y la de la estancia hospitalaria de 161,5,12–17,19-21,23,24-27 días.
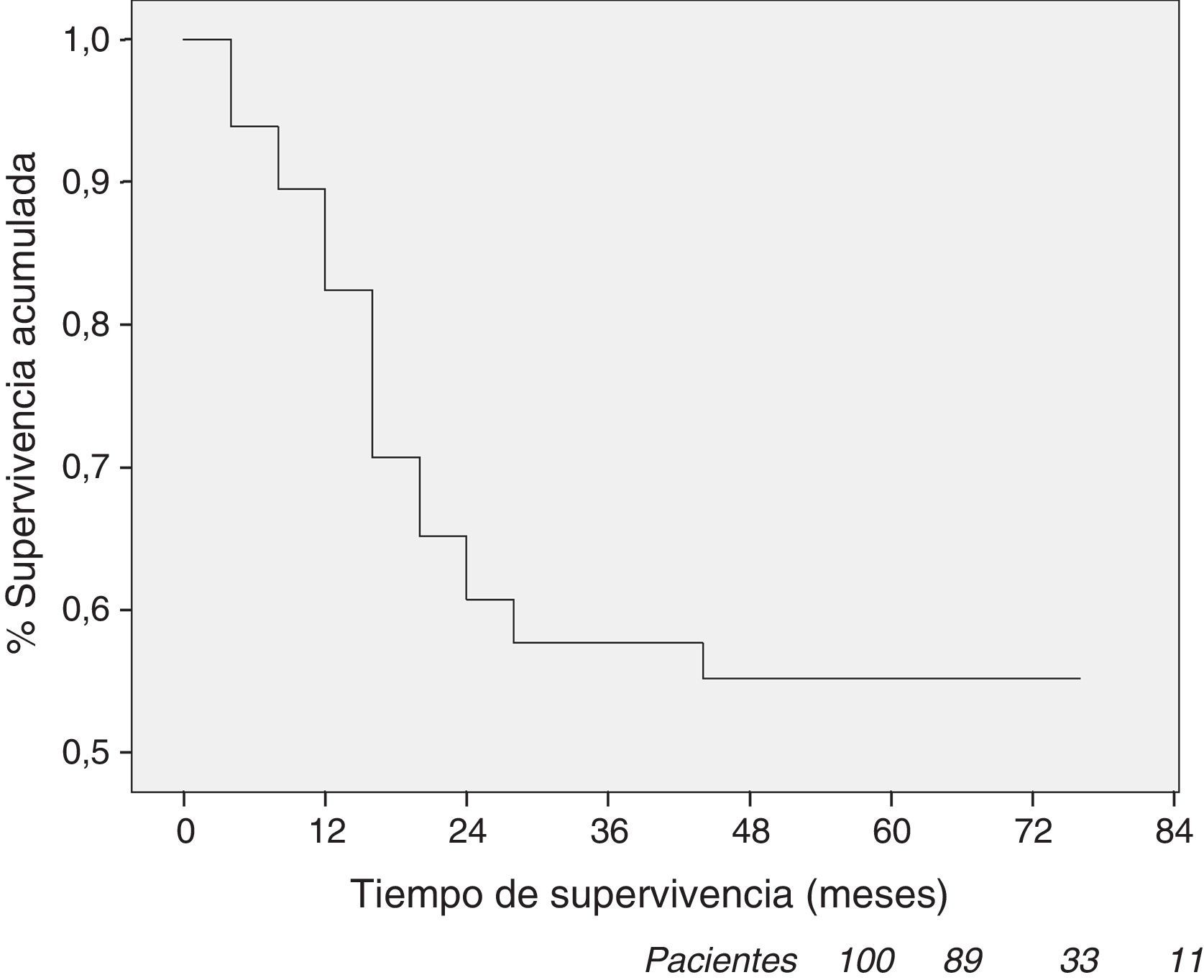
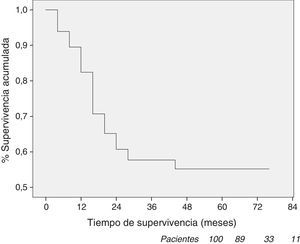
La supervivencia actuarial global es del 85% al año, 59% a los 3 años y 56% a los 5 años, siendo la mediana de seguimiento de 19 meses (9–37).
DiscusiónEn las 2 últimas décadas, el adenocarcinoma ha sobrepasado al carcinoma escamoso como la neoplasia más frecuente de esófago en los países occidentales, preferentemente de localización infracarinal2. En nuestra serie se confirman estos datos, ya que de los tumores esofágicos resecados, el 63% fueron adenocarcinomas y el 79% infracarinales. Estos cambios epidemiológicos se atribuyen, principalmente, al reflujo gastroesofágico y a la obesidad3.
La agresividad de esta neoplasia conlleva una pobre supervivencia a medio/largo plazo1. La resección quirúrgica continúa siendo la principal opción terapéutica5, pero diversos trabajos han demostrado mejoría en la supervivencia con la combinación de cirugía, QT y RDT6–9. Esta complejidad en el tratamiento conlleva que sea imprescindible un planteamiento multidisciplinar4. En nuestro hospital, desde enero de 2005, todos los pacientes con neoplasia gastroesofágica son tratados en una unidad específica formada por facultativos de 8 servicios.
De los 100 pacientes operados en este período, 62 recibieron tratamiento neoadyuvante y 12 radical previamente a la cirugía. El tipo de abordaje quirúrgico ha sido y es causa de controversias entre la esofagectomía TH o la TT. La esofagectomía TH tiene una morbilidad menor que la TT, sin afectar a la mortalidad16, pero Omloo et al.17 demuestran un beneficio en la supervivencia a 5 años en los pacientes con un número limitado de adenopatías afectadas y a los que se les ha realizado una esofagectomía TT. Nuestro grupo es partidario de la esofagectomía TT con linfadenectomía en 2 o 3 campos como tratamiento quirúrgico radical del cáncer de esófago frente a la esofagectomía TH (82 pacientes TT y 10 pacientes TH). La mayor morbilidad postoperatoria no se ha asociado con un incremento de la mortalidad (1,2% TT y 0% TH). La esofagectomía TH solo la indicamos en los pacientes con una neoplasia infracarinal que presenten una VEMS < 75% (ya que su condición respiratoria de base contraindica una toracotomía), o con un estadio clínico T1aN0M0. Los tumores con estadio T1bN0M0 pueden presentar metástasis linfáticas entre un 20-25% en los adenocarcinomas y hasta el 40% en los carcinomas escamosos5, por lo que creemos necesario realizar una linfadenectomía mediastínica reglada.
Rizk et al.23 postulan que una linfadenectomía óptima debe contener un mínimo de 18 adenopatías, mientras la AJCC recomienda la exéresis de al menos 10 adenopatías para los T1, 20 para los T2 y 30 para los T3/T419. En nuestra serie, la mediana de adenopatías extirpadas fue de 231,5,17–29; mientras que en los pacientes con neoplasias supracarinales a los que se les realizó una linfadenectomía cervical izquierda, la mediana de adenopatías extirpadas fue de 109–12 y en 3 de estos 13 casos (23%) existía afectación ganglionar. Este dato nos obliga a plantearnos si, en los tumores supracarinales, la no realización de una linfadenectomía cervical izquierda (¿y derecha?) disminuye la eficacia del tratamiento oncológico.
Nuestro grupo se plantea el abordaje laparoscópico en los tumores esofágicos localizados y que no precisan tratamiento neoadyuvante, ya que este (sobre todo la RDT) aumenta la dificultad de la disección y puede influir en la radicalidad de la linfadenectomía. Pensamos que una sistematización de la técnica ha de llevar al abordaje mínimamente invasivo completo (laparoscopia y toracoscopia) en este tipo de pacientes30.
La morbilidad global fue del 42% (tabla 3), siendo las complicaciones torácicas las más frecuentes9,12. Dentro de ellas, cabe destacar la prevalencia del empiema pleural (14%). La coloplastia fue la técnica de reconstrucción que dio lugar a un mayor número de esta complicación.
La disfonía afectó a 16 pacientes, siendo mucho más frecuente en la esofagectomía TT a 3 campos (41,6%). Aunque en 13 casos la función fonatoria se recuperó, 2 pacientes presentaron una lesión definitiva del nervio recurrente laríngeo izquierdo. Probablemente la linfadenectomía cervical pudo facilitar esta complicación. La paresia o parálisis de una cuerda vocal dificulta la eficacia del trabajo respiratorio y puede favorecer el aumento de complicaciones neumológicas en el postoperatorio inmediato5.
Se diagnosticaron 15 dehiscencias anastomóticas: 9/58 (15,5%) en anastomosis intratorácicas y 6/42 (14,3%) en anastomosis cervicales (tabla 3). De los 9 pacientes con dehiscencias intratorácicas, 4 (6,9%) presentaron una repercusión clínica grave que obligó a la reintervención y exéresis de la plastia; el diagnóstico de los 5 restantes fue radiológico y su tratamiento, conservador. La actitud de nuestro grupo ante una dehiscencia intratorácica siempre está subordinada a la situación clínica del paciente. Frente a la sospecha de mediastinitis secundaria a una fístula, nuestra opción es la reintervención urgente con exéresis de la plastia y esofagostomía cervical terminal. En los casos de nula repercusión clínica, dehiscencias tardías y bien drenadas, intentamos un tratamiento endoscópico. La colocación de prótesis endoscópicas es una solución eficaz y poco agresiva, siempre que el estado clínico del paciente lo permita26.
La incidencia de dehiscencia anastomótica cervical fue del 14,3%. Desde el año 2002, nuestro grupo realiza sistemáticamente un acondicionamiento previo de la plastia gástrica según la técnica descrita por Akiyama20,21 en todos los pacientes candidatos a una gastroplastia con anastomosis cervical. Creemos que el aumento de la vascularización a través de la arteria gastroepiploica derecha que se produce tras la realización de esta técnica es uno de los factores que disminuye el riesgo de isquemia de la plastia y favorece una menor incidencia de dehiscencias. A tenor de estos resultados, nuestro objetivo es implementar el acondicionamiento gástrico en todos los pacientes candidatos a esofagectomía y reconstrucción con gastroplastia.
Dos pacientes fallecieron en el periodo postoperatorio (fig. 2). La mortalidad se corresponde con las recomendaciones internacionales respecto a la cirugía del cáncer de esófago19 y con lo publicado por diversos autores17,24. El tratamiento neoadyuvante y una cirugía técnicamente compleja en un enfermo con afectación importante del estado nutricional obliga a una exquisita selección de los pacientes que solo puede realizarse en una unidad multidisciplinar. Esta selección, la experiencia quirúrgica y el número de casos tratados son los principales factores involucrados en la disminución de la mortalidad4.
Matthews et al.25 demostraron en 1986 la relación inversa entre el número de neoplasias resecadas y la mortalidad hospitalaria. Numerosos trabajos posteriores han confirmado esta relación4,13–15 y en la actualidad parece claro que el tratamiento quirúrgico de estos pacientes debe realizarse en unas pocas unidades altamente especializadas, con un número importante de casos y con protocolos de actuación conjuntos con los hospitales de su área de influencia. Un primer paso en este sentido ha sido la Instrucción publicada este año por el Departament de Salut de la Generalitat de Catalunya, limitando a 7 el número de hospitales autorizados a realizar cirugía oncológica esofágica27.
La supervivencia actuarial fue del 85% el primer año, 59% a los 3 años y 56% a los 5 años (fig. 2), superponible a otras series publicadas28,29. Más del 40% de los pacientes intervenidos fallecieron durante los 2 primeros años, mientras que la supervivencia se mantuvo relativamente estable a partir del tercer año. En 21 de los 26 pacientes que se intervinieron sin tratamiento neoadyuvante, la estadificación final fue de ia en 13 y ib en 8, lo que probablemente ha influido en la supervivencia.
En conclusión, solo un 25% de los pacientes diagnosticados de cáncer de esófago pueden ser intervenidos con intención curativa. La morbilidad quirúrgica es elevada, de modo especial, la derivada de complicaciones torácicas y dehiscencias anastomóticas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.