El leiomiosarcoma hepático primario (LHP) es un tumor mesenquimal maligno de estirpe muscular lisa bastante infrecuente y de difícil diagnóstico preoperatorio. Su mal pronóstico precisa de una resección R0 que nos permita conseguir largas supervivencias. Presentamos aquí el caso de un LHP resecado completamente por vía laparoscópica asistida (CLAM)1.
Mujer de 63 años sin antecedentes de interés que consultó por dolor abdominal. A la exploración presentaba una masa en epigastrio. La ecografía abdominal y la TC con contraste detectaron una masa de 7cm en el lóbulo hepático izquierdo, sin evidencia de enfermedad metastásica. La PAAF informó de tumor mesenquimal sugestivo de leiomiosarcoma. En la PET-TC presentaba características metabólicas malignas con SUV máximo de 4,5. Se intervino mediante CLAM y se halló una masa de 7cm en s. III del lóbulo hepático izquierdo, el s. IV y el resto del parénquima hepático eran normales en la ecografía intraoperatoria. Se realizó seccionectomía lateral izquierda laparoscópica sin oclusión portal. El tiempo quirúrgico fue de 120 min y no precisó transfusión sanguínea. Fue dada de alta a los 3días postoperatorios. Microscópicamente (fig. 1) se observó un parénquima hepático infiltrado por una neoplasia mesenquimal maligna de estirpe muscular lisa constituida por bandas entrecruzadas en distintas direcciones de células de morfología fusiforme u ovoideas atípicas, con ocasionales células multinucleadas. Además, se observaron áreas de necrosis y hasta 12 figuras de mitosis. En la pared de un vaso intrahepático se observó presencia de estas células malignas «emergiendo» de la pared. Las células neoplásicas mostraron positividad intensa citoplasmática para vimentina, actina de músculo liso y desmina, y negatividad para citoqueratina AE1/AE3, CD-117 (C-Kit), DOG-1 y S-100. El índice de proliferación celular Ki-67 fue del 20-30%. No recibió tratamiento adyuvante y se encuentra libre de enfermedad 132 meses después de la intervención.
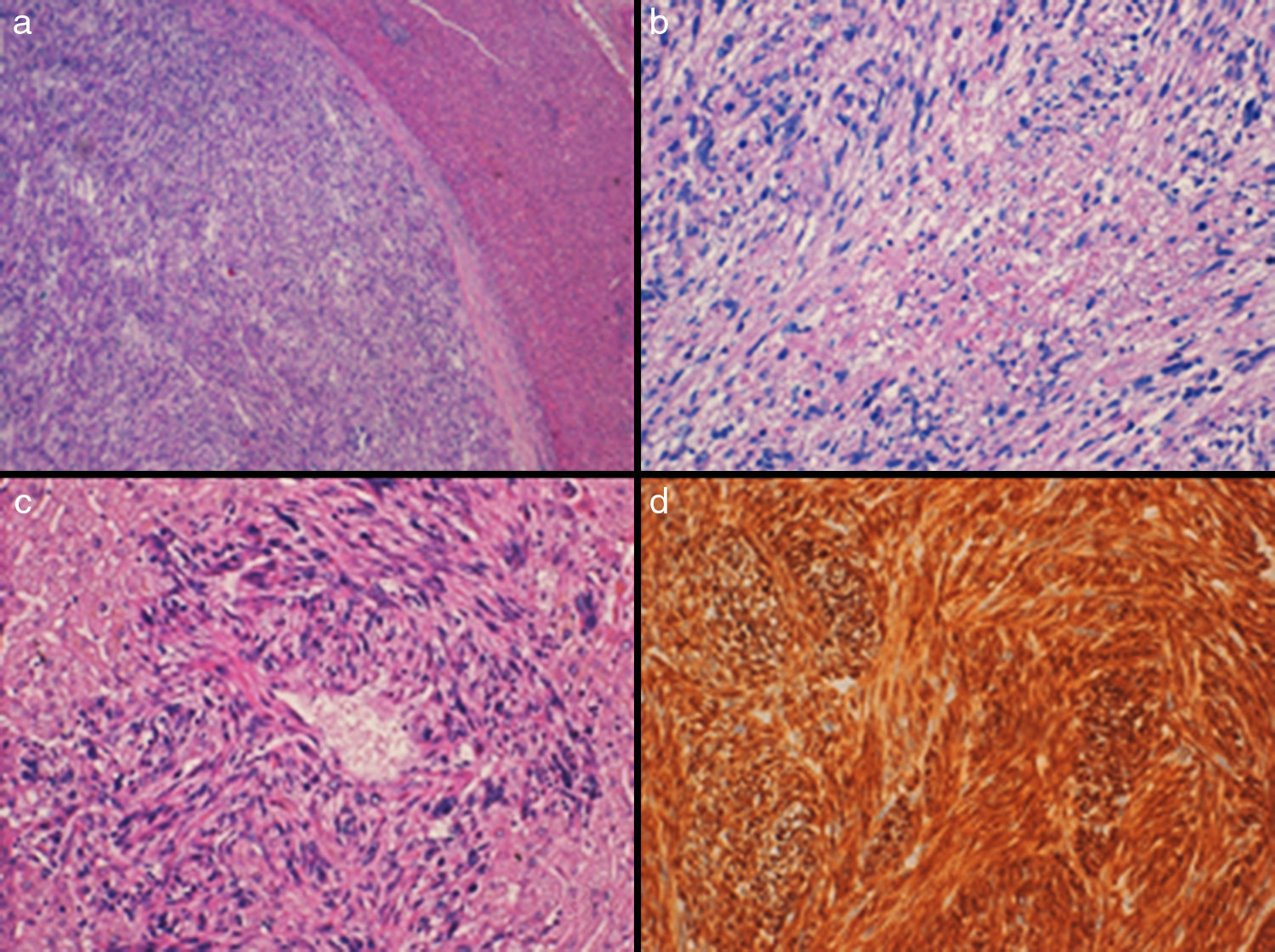
a) Neoplasia sólida encapsulada, bien delimitada del parénquima hepático adyacente (H-E, 4x). b) Está constituida por haces entrecruzados de células fusiformes con marcadas atipias nucleares, figuras de mitosis atípicas y algún foco de necrosis (H-E, 10x). c) Células neoplásicas que emergen de la pared de un pequeño vaso hepático (H-E, 20x). d) Intensa positividad de las células tumorales (desmina 20x).
Los sarcomas hepáticos son excepcionales; representan un 0,1-1% de las neoplasias malignas hepáticas primarias2. Si bien el angiosarcoma es el más frecuente, el LHP constituye un 8-10%3. El leiomiosarcoma puede surgir de las paredes musculares de estructuras vasculares intrahepáticas, de conductos biliares o del ligamento redondo. La mayoría de los leiomiosarcomas hepáticos corresponden a metástasis de leiomiosarcoma de otras localizaciones (útero, retroperitoneo, tracto gastrointestinal4), por ello, su exclusión es esencial para un diagnóstico preciso.
La clínica es inespecífica: se halla más frecuentemente dolor en hemiabdomen superior acompañado de pérdida de peso, febrícula, astenia, ictericia e incluso sangrado intraabdominal agudo secundario a rotura del tumor. En la exploración física se puede apreciar hepatomegalia o una masa abdominal, mientras que los datos de laboratorio (bilirrubina, fosfatasa alcalina, transaminasas, alfafetoproteína u otros marcadores tumorales) no suelen ser útiles para el diagnóstico5.
La TC suele describirse como una gran masa heterogénea, hipodensa, con realce interno y periférico que muestra ocasionalmente necrosis central, similar a los hallazgos en esta paciente6. La RM muestra hipointensidad homogénea en T1 e hiperintensidad homogénea en T27.
Ante la inespecificidad de los datos físicos, analíticos y radiológicos, el estudio histológico preoperatorio (mediante una citología o biopsia percutánea ecodirigida) y postoperatorio es clave en el diagnóstico. Macroscópicamente, la superficie del corte suele ser de color blanco-rosado y amarillo, con áreas de necrosis, o rojo oscuro provocadas por focos hemorrágicos y la neoplasia muestra buena delimitación del parénquima hepático adyacente del que la separa un tejido fibrocolágeno a modo de cápsula. Histológicamente, el tumor se suele componer de fascículos entrecruzados de células de abundantes citoplasmas de núcleos elongados u ovoideos, con variable atipia, y se pueden observar células multinucleadas, y células con citoplasmas vacuolados o eosinófilos. Son frecuentes las figuras de mitosis y suele existir necrosis. El hallazgo histológico de presencia de estas células neoplásicas que emergen de la pared de vasos intrahepáticos apoya su origen en estas estructuras. Expresan marcadores inmunohistoquímicos que apoyan el origen muscular liso como la actina de músculo liso, desmina y H-caldesmon, y son negativas para otros marcadores como CD-117 (C-Kit), DOG-1, S-100 y CKAE1-AE3 que ayudan a excluir otro tipo de neoplasias con las que se establece el diagnóstico diferencial8.
El tratamiento consiste en la resección hepática con una intención de resección R0 como la indicación más ampliamente aceptada. No existe supervivencia de más de 3 años con resecciones R19. La quimioterapia adyuvante en el LHP no está aceptada por la baja tasa de respuestas, aunque en los estadios avanzados la tumorectomía asociada a quimioterapia con doxorrubicina e ifosfamida, o en especial irinotecán, son las opciones más aceptadas10. Otra alternativa es el trasplante hepático, aunque no se recomienda debido a las altas tasas de recurrencia.
La CLAM y la cirugía totalmente laparoscópica se presentan como los abordajes más adecuados en este tipo de tumores. En nuestro caso, el tumor tenía 7cm, por lo que nos inclinamos por emplear la CLAM, ya que la introducción de la mano izquierda permite mediante la exploración manual y ecográfica la localización en la cavidad abdominal de lesiones inadvertidas preoperatoriamente y la distinción entre un tumor primario o la presencia de enfermedad metastásica o diseminación tumoral por la cavidad abdominal.
En conclusión, la CLAM es un abordaje seguro en el tratamiento de LHP que permite una resección R0 con buenos resultados de supervivencia a largo plazo.