Existe una importante controversia en el manejo quirúrgico del cáncer de cardias. Parece unánime que los tumores tipo i de Siewert se intervengan como un cáncer de esófago y los Siewert III como un cáncer gástrico. Sin embargo, sobre el «verdadero» cáncer de cardias o Siewert II no existe consenso. Es obvia la necesidad de un margen proximal y distal libre, así como una correcta linfadenectomía. Para algunos es necesaria la esofaguectomía para realizar una correcta cirugía oncológica radical, pero otros autores defienden que es suficiente con un abordaje abdominal para realizar una gastrectomía total y esofaguectomía distal. Tanto los trabajos publicados con cierta antigüedad como aquellos más recientes no aclaran este dilema y sus resultados son contradictorios. El hecho de realizar un tratamiento quimioterápico previo a la cirugía, puede reducir el tamaño tumoral y la presencia de adenopatías, por lo que las opciones quirúrgicas pueden haber cambiado en los últimos años.
There is significant controversy in the management of cardiac cancer. It seems unanimous that Siewert type I tumors be operated on as cancer of the esophagus and Siewert type III as gastric cancer. However, for “true” cancer of the gastric cardia or Siewert II, the authors do not agree. There is the obvious need for free proximal and distal margins, as well as correct lymphadenectomy. For some, esophagectomy is necessary to perform correct radical oncological surgery, but other authors defend that an abdominal approach is sufficient to perform total gastrectomy and distal esophagectomy. Recent and older papers published do not clarify this issue, and their results are contradictory. Chemotherapy prior to surgery can reduce the size of the tumor and the presence of lymphadenopathies.
En los países occidentales (Europa y Norteamérica), la incidencia del cáncer gástrico ha ido decreciendo progresivamente en los últimos años1, sobre todo a expensas del adenocarcinoma (ADC) clásico, de localización distal. En cambio, el ADC de estómago proximal que infiltra el cardias es cada vez más frecuente, incrementando su incidencia simultáneamente al ADC de cardias y esófago distal1–3, quizás porque todos comparten la principal causa etiológica, la obesidad y el reflujo gastroesofágico.
La primera pregunta que habría que hacer es: ¿qué es un cáncer de cardias? Según la 8.a edición de la clasificación TNM de tumores malignos4, lo define como un ADC de la unión esofagogástrica (UEG) con el centro del tumor a 2cm desde el cardias, tanto en sentido distal como proximal. A este respecto, la clasificación de Siewert5 del cáncer de cardias, basada en la localización principal del tumor, ha ayudado a elegir cuál es el mejor tratamiento quirúrgico. En los tipos i, con la mayor parte del tumor en el esófago distal, la técnica de elección seria la esofagogastrectomía; en los tipos iii, donde el tumor se localiza principalmente en el estómago proximal, sería una gastrectomía total; y en los tipos ii o verdaderos cánceres de cardias, se discute la mejor opción quirúrgica.
Pero esta clasificación tiene algunas desventajas, pues el tumor se clasificará según criterios topográficos (endoscópicos, radiológicos e intraoperatorios), pero a veces, cuando el volumen tumoral es grande o existe una hernia de hiato, no es fácil asegurar donde está la mayor parte del tumor. Otro problema de la clasificación de Siewert es que no siempre el origen celular coincide con el origen tumoral. Es decir, la biopsia de un tumor de la UEG puede informar de un ADC de células en «anillo de sello» (por tanto, sería de origen gástrico, más frecuente en países asiáticos y se trataría de un ADC tipo Siewert III); por el contrario, si la biopsia nos informa un ADC sobre un esófago de Barrett, lo lógico es pensar en un origen esofágico, más frecuente en países occidentales y en un ADC tipo Siewert I6. Así pues, como vemos, con la misma localización serían tumores biológicamente muy distintos.
Hasta hace algunos años para obtener una resección completa de un tumor de cardias con un amplio margen proximal era necesaria la exéresis del esófago distal (con o sin toracotomía). En la actualidad, con la mayor utilización de la quimioterapia7 o radioquimioterapia8 neoadyuvante, se consiguen buenas respuestas con significativa reducción del tamaño tumoral, lo que, en ocasiones, da opción a evitar la esofaguectomía y la toracotomía.
De cualquier manera, la cirugía radical y potencialmente curativa exige una resección completa con márgenes libres (al menos 5cm proximal y distalmente al tumor y un margen circunferencial superior a 1mm) y una linfadenectomía que incluya al menos 15 adenopatías. Las diversas opciones quirúrgicas deben ser comparadas con respecto a su radicalidad, morbimortalidad, calidad de vida y supervivencia a largo plazo (global y libre de enfermedad).
En este trabajo se analiza la evidencia científica de la literatura en las opciones quirúrgicas para el cáncer de cardias, especialmente basada en estudios aleatorizados, metaanálisis y revisiones.
Cáncer de cardias Siewert IDado que la mayor parte del tumor se encuentra en la vertiente esofágica (entre 1-5cm desde el cardias), la mayoría de los autores9–11 proponen realizar una esofagogastrectomía parcial con anastomosis intratorácica según técnica de Ivor Lewis. Este abordaje permite obtener suficiente margen proximal por la resección del esófago torácico, así como una correcta linfadenectomía mediastínica. Como alternativa, otros autores proponen realizar una esofaguectomía transhiatal sin toracotomía y con anastomosis cervical. Este abordaje tiene como desventajas que la realización correcta de la linfadenectomía mediastínica es más dificultosa. Además, en ocasiones, si el tumor es voluminoso, para obtener un margen distal correcto es necesaria una resección gástrica amplia, por lo que la construcción de una plastia gástrica tubular puede quedarse corta para ascenderla hasta el esófago cervical sin tensión, en cuyo caso deberíamos recurrir a reconstruir el tránsito mediante una coloplastia cervical12,13.
El estudio aleatorizado holandés realizado por Hulscher et al. en 20029 comparó la esofaguectomía transtorácica (ETT, n=114) con la esofaguectomía transhiatal (ETH, n=106). Aunque la mortalidad postoperatoria fue similar en ambos grupos (p=0,45), la ETT provocó una mayor morbilidad, especialmente a expensas de complicaciones pulmonares. La supervivencia libre de enfermedad a 5 años fue superior significativamente en el abordaje según técnica de Ivor Lewis (39 vs. 27%), sin diferencias significativas en la supervivencia global a 5 años entre ambas técnicas (39% en ETT vs. 29% en ETH). Cuando los autores publicaron sus resultados a largo plazo, más de 5 años10, las diferencias de la supervivencia global sí alcanzaron diferencias significativas, siendo un 14% superior en el abordaje torácico que en el transhiatal (51 vs. 37%).
Sin embargo, recientemente, Davies et al.11 han publicado un estudio de cohortes comparativo sobre el abordaje transtorácico (n=401) y transhiatal (n=263) en cáncer de esófago distal (Siewert I). Los autores comunican que no encuentran diferencias en la supervivencia global (HR 1,07) y recidiva (22,8 vs. 24,4%) entre ambas técnicas.
Cáncer de cardias Siewert IIISe considera como un cáncer gástrico, por lo que suele tratarse de igual manera, es decir gastrectomía total con exéresis de esófago abdominal, reconstruyendo mediante esofagoyeyunostomía. En muchos de estos tumores aparecen células en anillo de sello, por lo que la agresividad tumoral y el pronóstico de supervivencia son peores que en los otros tumores del cardias6,14.
Cáncer de cardias Siewert IIEste es el que algunos autores denominan, «verdadero» cáncer de cardias15. Dada su localización y posibilidades de diseminación de este tipo de tumores, el abordaje quirúrgico está muy discutido. El objetivo de cualquier cirugía oncológica debe basarse en 3 pilares: 1) resección radical R0, 2) linfadenectomía completa y 3) baja morbimortalidad postoperatoria.
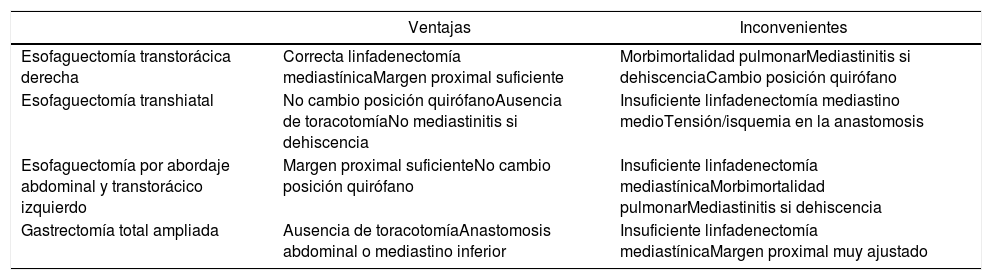
En estos tumores, para alcanzar estos objetivos, por un lado es discutido si es necesario realizar una esofaguectomía, o es suficiente con una gastrectomía total mediante abordaje abdominal. Por otro, cuando se asocia la resección esofágica, la discusión se centra, al igual que en el Siewert I, si se debe elegir la vía transtorácica o la transhiatal (tabla 1).
Ventajas e inconvenientes de los distintos abordajes quirúrgicos en el cáncer de cardias
| Ventajas | Inconvenientes | |
|---|---|---|
| Esofaguectomía transtorácica derecha | Correcta linfadenectomía mediastínicaMargen proximal suficiente | Morbimortalidad pulmonarMediastinitis si dehiscenciaCambio posición quirófano |
| Esofaguectomía transhiatal | No cambio posición quirófanoAusencia de toracotomíaNo mediastinitis si dehiscencia | Insuficiente linfadenectomía mediastino medioTensión/isquemia en la anastomosis |
| Esofaguectomía por abordaje abdominal y transtorácico izquierdo | Margen proximal suficienteNo cambio posición quirófano | Insuficiente linfadenectomía mediastínicaMorbimortalidad pulmonarMediastinitis si dehiscencia |
| Gastrectomía total ampliada | Ausencia de toracotomíaAnastomosis abdominal o mediastino inferior | Insuficiente linfadenectomía mediastínicaMargen proximal muy ajustado |
Blank et al. en 201815 analizaron prospectivamente los resultados postoperatorios y a largo plazo de 2 técnicas quirúrgicas en neoplasia de cardias Siewert II. Los 242 pacientes fueron seleccionados de forma subjetiva, sin criterios estandarizados, a un grupo de ETT según técnica de Ivor Lewis (n=56, 23%) con linfadenectomía D2 abdominal y torácica. La reconstrucción del tránsito se realizó con gastroplastia tubular en el 77% de los casos. En el segundo grupo (n=186, 77%) se realizó solo una laparotomía para la gastrectomía total ampliada con esofaguectomía distal (GTA) con linfadenectomía D2 abdominal y del mediastino inferior. En todos los pacientes se reconstruyó el tránsito mediante esofagoyeyunostomía en «Y» de Roux. Se administró tratamiento con quimioterapia neoadyuvante en el 50% de los pacientes (similar en ambos grupos), la otra mitad fueron inicialmente a la cirugía. Los pacientes mayores de 70 años fueron normalmente seleccionados para la cirugía abdominal, pero no hubo diferencias previas en ambos grupos con respecto a otras características (ASA, neoadyuvancia, TNM). Los autores comunican parecidos resultados postoperatorios con ambas técnicas (ETT vs. GTA) en cuanto a morbilidad (57 vs. 47%), dehiscencias de anastomosis (14 vs. 12%), complicaciones pulmonares (33 vs. 28%), mortalidad hospitalaria (5 vs. 4%), resecciones R0 (84 vs. 86%) y número de ganglios resecados (24 vs. 24). La mayoría de los casos en ambos grupos eran estadios pT3 (46 vs. 60%) y N1+ (66 vs. 71%). En cuanto a la supervivencia, los autores comunican mayor supervivencia (43 meses) en los pacientes sometidos a ETT que en los pacientes con GTA (33 meses, p=0,02). Igualmente, la supervivencia a 5 años fue superior en el grupo del Ivor-Lewis que en el de GTA (57 vs, 40%, p=0,02). En el estudio multivariante, el tipo de cirugía se incluyó como un factor pronóstico independiente (p=0,005) con un hazard ratio de 2,5 en los pacientes operados solo por vía abdominal. A pesar del sesgo de la edad, con pacientes mayores en el grupo sin toracotomía, los autores analizaron los subgrupos de pacientes menores de 70 años, con similares resultados a favor de la ETT. A pesar de todo, la evidencia científica está comprometida al ser un estudio retrospectivo, por lo que lo autores están desarrollando un trabajo prospectivo aleatorizado con las mismas técnicas quirúrgicas y los mismos objetivos.
En otro reciente trabajo, Martin et al.16 realizaron un análisis exhaustivo de 2 grandes bases de datos nacionales estadounidenses, la American College of Surgeons-National Surgical Quality Project (ACS-NSQIP) y la Surveillance Epidemiology and End Results (SEER). El objetivo fue seleccionar a los pacientes con cáncer de cardias, Siewert II, sometidos a gastrectomía o esofaguectomía. Se analizaron los resultados a corto plazo (morbimortalidad) y largo plazo (supervivencia global). Con los datos de la ACS-NSQIP compararon, mediante estudio de cohortes emparejadas, los resultados del postoperatorio en un grupo de 214 pacientes sometidos a gastrectomía total por vía abdominal con otro grupo de 967 pacientes con resección esofágica. No hallaron mas porcentaje de complicaciones en ningún grupo, en cuanto a dehiscencias (1,4 vs. 1,6%), morbilidad (33,2 vs. 35%), neumonía (13,1 vs. 13%), mortalidad a 30 días (3,7 vs. 2,4%) y estancia hospitalaria (10 vs. 10.5 días). En el estudio multivariante sobre mortalidad, la técnica quirúrgica no adquiere significación estadística como factor predictivo (OR 0,54; p=0,221). Tras el análisis de los datos de la SEER sobre supervivencia, los resultados globales muestran una mayor supervivencia en los pacientes sometidos a esofaguectomía (26 vs. 21 meses, p=0,025). Estos datos se consideraron sesgados por la mayor utilización de la radioterapia neoadyuvante en los primeros. Tras la realización del estudio multivariante, el tipo de cirugía no obtuvo significación estadística como factor independiente de supervivencia global (HR 0,95; p=0,259). Con estos resultados, los autores concluyen que la decisión de realizar una esofaguectomía o una gastrectomía en los pacientes con cáncer de cardias debe estar basada en la extensión tumoral, la utilización de protocolos oncológicos y, sobre todo, en la experiencia en ambas técnicas quirúrgicas de cada grupo.
Durante los últimos 20 años, otros muchos estudios comparativos entre los 2 abordajes han sido publicados. Ya es clásico el trabajo retrospectivo de Siewert et at.17 publicado en 2000, basado en 1.000 pacientes operados de cáncer de la UEG. En el subgrupo del Siewert II se incluyeron 271 pacientes que fueron intervenidos mediante 2 técnicas quirúrgicas: ETT (n=48) o GTA (n=223). La resección radical R0 fue el principal factor pronóstico independiente en el estudio multivariante para la supervivencia a largo plazo. Cuando la cirugía fue completa (R0), los autores no encontraron diferencias con ambas técnicas en cuanto la supervivencia global a los 5 años. En cambio, los pacientes a los que se realizó una ETT tuvieron mayores tasas de morbimortalidad postoperatoria.
Otra alternativa a la esofaguectomía por toracotomía derecha es la propuesta por el grupo japonés Japan Clinical Oncology Group18, el cual publicó en 2006 los resultados de un estudio aleatorizado que comparaba la gastrectomía total ampliada con esofaguectomía abdominal (GTA, n=82) frente a una esofagogastrectomía mediante laparotoracotomía izquierda (n=85) en pacientes con cáncer de cardias Siewert II (n=95) y Siewert III (n=63). El estudio fue cancelado tras el primer análisis de resultados por las claras desventajas del abordaje torácico, en base a un mayor porcentaje de neumonía (13 vs. 4%), pérdida de peso y capacidad vital, sin una clara mejoría en la supervivencia a 5 años. Incluso, en el estudio posterior de los resultados tras 10 años de seguimiento19, la laparotoracotomía izquierda mostró un similar porcentaje de supervivencia a 5 (42 vs. 50%, p=0,496) y 10 años (37 vs. 24%, p=0,060) en los pacientes con Siewert II. Los autores recomiendan, en estos tumores, la realización de una gastrectomía total mediante laparotomía, con resección del esófago abdominal y linfadenectomía mediastínica inferior por vía transhiatal.
Esofaguectomía transtorácica vs. transhiatalSi nos decidimos por la esofaguectomía, podría ser, al igual que en el Siewert I, por vía transtorácica (ETT) o transhiatal (ETH).
En 2007 se publicaron los resultados, tras un seguimiento mínimo de 5 años, del estudio holandés referido anteriormente10 sobre estos 2 abordajes quirúrgicos. En el grupo de pacientes con cáncer del UEG tipo Siewert II (n=115), 52 pacientes fueron aleatorizados para el abordaje transhiatal, y 63 pacientes para la vía transtorácica. Ningún paciente recibió tratamiento neoadyuvante. Los autores no comunicaron diferencias con ambos abordajes quirúrgicos en cuanto a la supervivencia a 5 años (31% en ETH y 27% en ETT).
Sin embargo, un metaanálisis más reciente20 comunica resultados diferentes. Tras estudiar 805 artículos potenciales entre 1996 y 2012 sobre «cáncer», «esófago» y «unión esofagogástrica», finalmente seleccionan solo 6 (únicamente 2 son prospectivos) con 647 pacientes diagnosticados de ADC de cardias Siewert I y II, 281 operados con ETT y 366 mediante ETH. Al comparar los resultados a corto y largo plazo, no se hallan diferencias entre ambas técnicas en cuanto a mortalidad postoperatoria, complicaciones pulmonares, dehiscencias de anastomosis, resecciones paliativas R1-R2 y estancia hospitalaria. En cambio, el abordaje torácico mostró de forma estadísticamente significativa mayor número de ganglios resecados (p=0,001), supervivencia global a 5 años (p=0,03) y supervivencia libre de enfermedad a 5 años (p=0,05). En resumen, los autores comunican que en los tumores de esófago distal y cardias la ETT es superior oncológicamente a la ETH, con similares resultados en cuanto a morbimortalidad postoperatoria.
Por lo tanto, en la actualidad los resultados son aún contradictorios y se consideran válidas ambas vías de abordaje, dependiendo de las características del paciente y de la experiencia del cirujano.
LinfadenectomíaOtro punto de importante debate entre el abordaje abdominal y torácico es la calidad y cantidad de la linfadenectomía. Obviamente, si solo se realiza un abordaje abdominal, la posibilidad de extirpar los ganglios mediastínicos está limitada al mediastino inferior a través del hiato. En cambio, con el abordaje torácico podemos realizar también la linfadenectomía mediastínica media e incluso superior. Si esto es decisivo o no sobre la supervivencia no está claro, pero en la actualidad, es sabido que los tumores de cardias tipo ii, aunque metastatizan mayoritariamente en ganglios abdominales (71%), también lo hacen frecuentemente en el mediastino (30%). Incluso en los Siewert III (origen gástrico), un 9% de los pacientes pueden desarrollar adenopatías tumorales en esta localización21,22..
Parry et at.23 publicaron en 2015 un trabajo comparativo entre la esofaguectomía (n=155) y la gastrectomía (n=21) en pacientes con cáncer de cardias Siewert II. El estudio no mostró diferencias en la supervivencia global a 5 años (p=0,606), supervivencia libre de enfermedad (p=0,251) y porcentaje de recidiva (p=0,669), pero, sin embargo, evidenciaron un 11% de adenopatías tumorales en el mediastino superior, por los que los autores proponen que la ETT debe ser de elección en estos tumores. Otros autores24 coinciden con este hecho, informando de un 22% de pacientes Siewert II con adenopatías positivas mediastínicas (subcarinales, paratraqueales y aortopulmonares) tras ETT. Como es lógico, estos pacientes sufrieron un supervivencia inferior estadísticamente (p=0,009) a los que no tenían estos ganglios afectos.
Los estudios japoneses25,26 muestran menor afectación mediastínica en estos tumores. Un trabajo retrospectivo multicéntrico en 315 pacientes con cáncer de cardias Siewert II (pT2-4) comunica una infiltración adenopática tumoral tan solo del 3,8% en el mediastino superior y del 7% en el mediastino medio.
Calidad de vidaUn aspecto a destacar entre ambos abordajes, el abdominal y el torácico, es la calidad de vida. Un reciente estudio alemán27 compara ambos procedimientos en base a cuestionarios de calidad de vida previamente validados por la European Organization for Research and Treatment of Cancer (EORTC), el QLQ C-30 y el módulo específico de cáncer, QLQ OG-25. Los autores comunican una menor incidencia de síntomas pulmonares (p<0,05) y relacionados con el reflujo (p<0,05) en los pacientes con Siewert II gastrectomizados. En el mismo sentido, otros autores28,29 también han comunicado que, aunque no encuentran diferencias sobre la supervivencia a largo plazo entre la esofaguectomía y la gastrectomía, la calidad de vida se ve más seriamente comprometida con la resección esofágica.
Situaciones especiales- 1.
La extensión del tumor por la pared gástrica no permite construir un tubo gástrico con el estómago residual. Hay que hacer una gastrectomía total. Para la reconstrucción tendremos 2 opciones:
- A)
Abordaje abdominal: esofaguectomía distal y esofagoyeyunostomía en «Y» de Roux.
- B)
Abordaje abdominal y torácico derecho: esofaguectomía torácica y coloplastia torácica.
- C)
Abordaje abdominal y cervical izquierdo: esofaguectomía transhiatal y coloplastia cervical.
- 2.
La función respiratoria del paciente desaconseja la toracotomía.
- A)
Abordaje abdominal: gastrectomía total, esofaguectomía distal y esofagoyeyunostomía en «Y» de Roux.
- B)
Abordaje abdominal: gastrectomía parcial proximal, esofaguectomía distal+esofagogastrostomía.
- C)
Abordaje abdominal y cervical izquierdo: gastrectomía proximal, esofaguectomía transhiatal y gastroplastia cervical.
- 3.
ADC precoz sobre esófago de Barrett.
- A)
Esofagogastrectomía parcial transtorácica (Ivor Lewis) o transhiatal30.
- B)
Mucosectomía endoscópica y radiofrecuencia31.
En el cáncer de cardias tipo ii, el abordaje quirúrgico abdominal o torácico no supone diferencias significativas en cuanto a supervivencia a largo plazo. Es claro que la toracotomía permite una mejor linfadenectomía mediastínica y un margen proximal mayor, pero esto no siempre se traduce en curación de la enfermedad. La gastrectomía abdominal suele cursar con menos complicaciones y mejor calidad de vida, por lo que a priori puede ser preferida. Como se ve a lo largo del capítulo el tratamiento de estos tumores sigue siendo controvertido. Pero como conclusión y en último lugar, el tratamiento quirúrgico siempre debe ser individualizado, valorando el riesgo quirúrgico del paciente y la extensión locorregional del tumor a nivel esofágico, gástrico, mediastínico y abdominal.
Conflicto de interesesNingún autor declara financiación ni conflicto de intereses en la realización de este manuscrito.