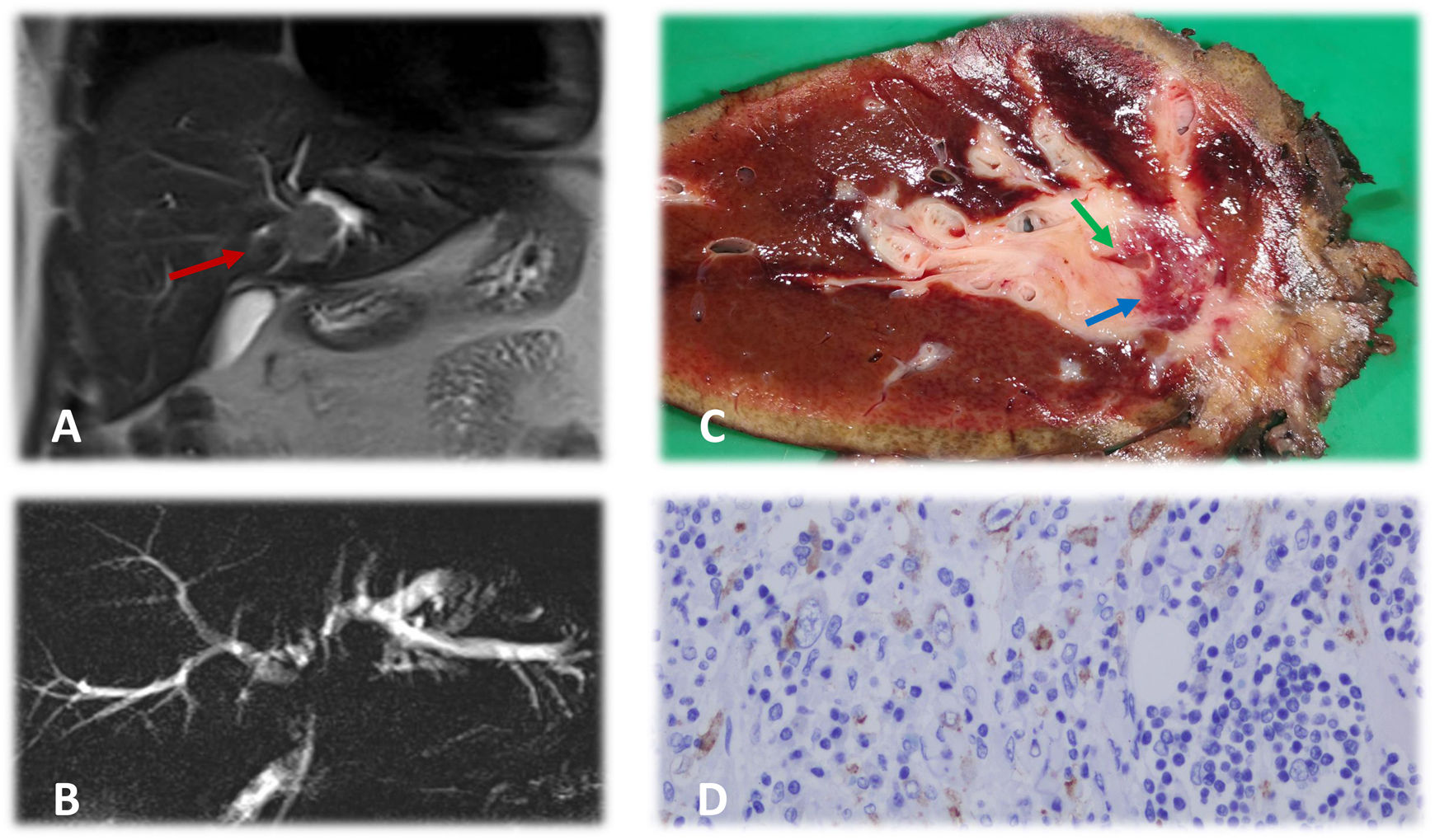
El colangiocarcinoma es la neoplasia maligna más frecuente de la vía biliar. Se trata de una entidad agresiva cuyo único tratamiento potencialmente curativo es la cirugía. Se clasifica, en función de su localización, en intrahepático, distal y perihiliar o tumor de Klatskin. Dada la baja rentabilidad de estudios citológicos preoperatorios, la indicación del tratamiento quirúrgico suele realizarse en base a los hallazgos clínicos y radiológicos. A pesar de ello, hasta un 15% de las estenosis biliares pueden corresponder con otros procesos nosológicos, hecho que a menudo no puede ser corroborado hasta el estudio anatomopatológico definitivo1.
En este contexto, se presenta el caso de un varón de 37 años que ingresa por ictericia indolora, prurito y astenia de 2 semanas de evolución. Como antecedentes de interés, se trata de un paciente fumador de 10 paquetes/año intervenido de apendicitis aguda por laparoscopia un año antes del inicio del cuadro actual. Entre sus valores analíticos destacar: bilirrubina total 3,8mg/dl, bilirrubina directa 3,1mg/dl, GOT 87U/l, GGT 356U/l, fosfatasa alcalina 227U/l, discreta leucocitosis y marcadores tumorales negativos (CEA y CA 19.9). En las pruebas de imagen (TC toraco-abdomino-pélvica y RM hepática y colangiográfica) se aprecia una masa que infiltra el conducto hepático izquierdo con dilatación de la vía biliar intrahepática ipsilateral (figs. 1A y B), sin enfermedad a distancia. Estos hallazgos plantean como primera posibilidad un tumor de Klatskin tipo IIIb1. Tras valoración por comité multidisciplinar se decide tratamiento quirúrgico, el cual se lleva a cabo mediante hepatectomía izquierda ampliada al lóbulo caudado con resección de vía biliar principal y del conducto hepático derecho hasta la bifurcación sectorial, quedando conservada la carina de unión de ambos conductos sectoriales. Se realizó reconstrucción del tránsito biliar mediante una hepático-yeyunostomía en Y de Roux. El postoperatorio transcurrió sin alteraciones destacables, excepto la aparición de fístula biliar de bajo débito que se resolvió con manejo conservador.
A) Estudio de resonancia magnética hepática en el que podemos observar masa de aspecto neoplásico (flecha roja) a nivel perihiliar que infiltra conducto hepático izquierdo, produciendo dilatación del mismo. B) Colangiografía por resonancia magnética nuclear en la que se aprecia marcada dilatación de vía biliar intrahepática izquierda y, en menor grado, de la vía biliar derecha. Destaca la presencia de silencio radiológico a nivel de bifurcación de ambos conductos hepáticos secundario a la masa tumoral. Conducto colédoco de calibre normal. C) Corte macroscópico de pieza de hepatectomía. Se aprecia lesión de 2,3×1,9cm (flecha azul) que rodea parcialmente a conducto biliar (flecha verde) con reacción inflamatoria circundante. D) Corte microscópico de pieza de hepatectomía. La tumoración está formada, en su mayor parte, por un estroma laxo con células epitelioides con nucléolo evidente y áreas de distribución más fasciculada. Ambas zonas presentan infiltrado inflamatorio compuesto de linfocitos, eosinófilos y células plasmáticas. Las células tumorales expresan ALK con un característico patrón de membrana nuclear, típico de este tipo tumoral.
El informe de anatomía patológica indicó la presencia de una lesión de 2,3×1,9cm con márgenes libres formada por un estroma laxo con células epitelioides con nucléolo evidente, áreas de distribución fasciculada e infiltrado inflamatorio, hallazgos compatibles con tumor miofibroblástico inflamatorio (TMI) (fig. 1C). Las células tumorales expresaron Anaplastic Lymphoma Kinase (ALK) (fig. 1D). Otros marcadores inmunohistoquímicos relacionados con neoplasias infrecuentes como CD34, CD21, CD117, CD23 o S100 resultaron negativos. Con esta información se decidió seguimiento sin tratamiento adyuvante, encontrándose un año después de la intervención libre de enfermedad.
El TMI es una neoplasia poco frecuente que presenta predilección por el pulmón y la región abdominopélvica. Aunque ha sido relacionado con otros procesos como el seudotumor inflamatorio o el granuloma de células plasmáticas, es reconocido como una verdadera neoplasia de partes blandas de potencial biológico intermedio por su capacidad de desarrollar recurrencia y metástasis2. Su aparición en el hígado es rara y, cuando lo hace, puede dar lugar a distintas formas de presentación, mimetizando el comportamiento de otros tumores. Por ello debe ser considerado en el diagnóstico diferencial de procesos como el hepatocarcinoma, el colangiocarcinoma, sarcomas y procesos benignos como adenomas, hidatidosis o abscesos hepáticos2–5.
Se ha relacionado con antecedentes infecciosos, inflamatorios y otras enfermedades malignas2, aunque su etiología aún debe ser elucidada. Parece ser más frecuente en varones jóvenes3, hecho que lo diferencia del colangiocarcinoma, en el que la edad de presentación es mayor (excepto en casos de colangitis esclerosante primaria)1. No presenta características clínicas ni marcadores analíticos específicos, destacando únicamente elevación de reactantes de fase aguda como leucocitos o proteína C reactiva en algunos pacientes. Radiológicamente, se podrá sospechar al apreciar una masa de partes blandas con realce heterogéneo que puede infiltrar estructuras vecinas2,3. En caso de afectación de la vía biliar extrahepática es posible el diagnóstico mediante CPRE y colangioscopia4.
Respecto a su histología, está conformado por áreas de proliferación de miofibroblastos mezcladas con fibras de colágeno e infiltración de células inflamatorias2. Macroscópicamente, suele ser solitario, de consistencia firme, bien delimitado, no encapsulado y con coloración blanca-amarillenta2,3. Como hallazgo diferencial, entre un 50-60% de los casos son positivos para ALK, factor que se relaciona con menor incidencia de metástasis6.
En función de la clínica, la localización y el diagnóstico de sospecha se han descrito distintas opciones de tratamiento, desde cirugía hasta manejo conservador. Los trabajos de Tang et al.7 y Yang et al.8 recogen la evolución de 74 pacientes intervenidos de TMI hepático, encontrándose todos libres de enfermedad, con un seguimiento medio de 30 meses. Incluso se comunica un caso de regresión tumoral sin tratamiento8. Sin embargo, existen casos con pocos meses de supervivencia9,10, relacionados con el reordenamiento de los genes RANBP2-ALK, presentación hepática metastásica tras exéresis de tumor primario pélvico y edad avanzada. Por otro lado, la resección con márgenes libres y la positividad para ALK se relacionan con un mejor pronóstico3. En la tabla adjunta se resume la evolución de los pacientes que aparecen en la bibliografía empleada (tabla 1).
Características clínicas y evolución de los pacientes incluidos en la bibliografía empleada en la elaboración del presente artículo y en artículos adicionales
| Artículo | Edad | Sexo | Forma de presentación | Tratamiento | Seguimiento | Supervivencia libre de enfermedad | Supervivencia |
|---|---|---|---|---|---|---|---|
| Watanabe et al.2 | 70 | Mujer | Incidental tras traumatismo | Hepatectomía derecha | 7 meses | No recidiva | Vivo |
| Filips et al.3 | 32 | Mujer | Dolor hipocondrio derecho y fiebre 4 meses tras el parto | Segmentectomía IVa y IVb | Un año | No recidiva | Vivo |
| Sekaran et al.4 | 17 | Mujer | Melenas, ictericia y dolor abdominal de 18 meses | Hepatectomía izquierda | 6 semanas | No recidiva | Vivo |
| Jim et al.5 | 42 | Mujer | Fiebre y fatiga de un mes | Seccionectomía posterior derecha | 32 meses | No recidiva | Vivo |
| Khalil et al.6 | 8 | Varón | Metástasis hepática a los 6 meses de resección de TMI en fosa ilíaca derecha | Crizotinib | 6 meses | No recidiva | Vivo |
| Tang et al.7 | 74 | Varón | Fiebre | Segmentectomía V | Seguimiento medio de 30 meses | No recidiva | Vivo |
| 45 | Mujer | Fiebre | Segmentectomía VII | No recidiva | Vivo | ||
| 59 | Varón | Fiebre y dolor abdominal | Segmentectomía IV y VIII | No recidiva | Vivo | ||
| 53 | Mujer | Dolor abdominal | Segmentectomía V | No recidiva | Vivo | ||
| 45 | Varón | Dolor abdominal | Segmentectomía VI | No recidiva | Vivo | ||
| Chen et al.9 | 34 | Varón | Pérdida de peso y dolor abdominal en hipocondrio derecho | Segmentectomía V-VI | 6 meses | Recidiva (5 meses) | Exitus |
| Shimodaira et al.10 | 81 | Varón | TMI pélvico. Se realiza intervención de Miles. Presenta metástasis hepática a los 2 meses de la cirugía | Vigilancia | 3 meses | Recidiva (2 meses) | Exitus |
| Sinha et al. | 36 | Mujer | Masa inflamatoria que compromete a la vesícula biliar, al hígado, el píloro y la primera porción duodenal | Colecistectomía ampliada con resección de píloro y primera porción duodenalReconstrucción Billroth II | No | No información | No información |
| Shang et al. | 56 | Mujer | Trasplante hepático por cirrosis secundaria a virus de hepatitis B. Cinco meses después del trasplante presenta cuadro de melenas secundarias a varices esofágicas y se detecta masa en porta hepatis. Se realiza biopsia de la misma mostrando que se trata TMI | Tratamiento conservador: esteroides, antibióticos, agentes antivirales, inmunosupresión y ligadura endoscópica de varices | Un mes | Recidiva (un mes) | Exitus |
| Raad et al. | 62 | Mujer | Antecedente de carcinoma endometrial. En seguimiento de imagen se detecta lesión en segmento II hepático compatible con metástasis. El estudio anatomopatológico tras la resección muestra que se trata de TMI | Subsegmentectomía II | No | No información | No información |
| Nagarajan et al. | Un | Varón | Hepatomegalia y anemia. Se detecta masa en lóbulo hepático izquierdo | Seguimiento inicial (sospecha hamartoma). Tras 8 meses se realiza resección quirúrgica por persistencia de la clínica y de la masa | 12 meses | No recidiva | Vivo |
| Sürer et al. | 48 | Varón | Dolor en hipocondrio derecho, fiebre y pérdida de peso | Resección quirúrgica de lesión de 6cm en lóbulo hepático derecho | No | No información | Vivo |
| Berumen et al. | 13 | Varón | Ictericia indolora, astenia. Masa a nivel de hilio hepático que infiltra la bifurcación de ambos conductos hepáticos, arteria hepática, vena porta, y se extiende hasta duodeno y cabeza pancreática | Drenaje biliar transhepático y quimioterapia con crizotinib Desarrolla hepatotoxicidad, por lo que se cambia a celecoxibA los 6 meses se plantea cirugía, pero se comprueba que se trata de una masa irresecableCuatro meses después se realiza trasplante hepático y duodenopancreatectomía cefálica | 12 meses | No recidiva | Vivo |
| Thavamani et al. | 10 | mujer | Dolor abdominal y fiebre. Masa de 5,6cm en porta hepatis que produce hipertensión portal secundaria (trombosis portal, circulación colateral, esplenomegalia) | Laparotomía exploradora, toma de biopsia con diagnóstico de TMI.Tratamiento con meloxicam y prednisona, consiguiéndose reducción de tamaño tumoral a los 2 años | 2 años | La enfermedad persiste desde el diagnóstico | Vivo |
| Chablé-Montero et al. | 23 | Mujer | Dolor hipocondrio derecho, fiebre. Lesión de 7cm en lóbulo hepático derecho, sospecha de absceso hepático | Antibioterapia. Dada la persistencia de la lesión y los síntomas se realiza hepatectomía derecha | No | No información | No información |
| Schnelldorfer et al. | 18 | Mujer | Dolor hipocondrio derecho, vómitos, pérdida de peso. Lesión hepática que produce dilatación biliar izquierda | Seccionectomía lateral izquierda | Un año | No recidiva | Vivo |
| Solomon et al. | 26 | Varón | Dolor hipocondrio derecho, astenia, pérdida de peso | Hepatectomía parcial izquierda | No | No información | No información |
TMI: tumor miofibroblástico inflamatorio.
Nota: la serie de Yang et al.8 no queda reflejada en la tabla porque no se aportan datos individuales de los pacientes en el artículo original.
Referencias adicionales a las presentes en la bibliografía del manuscrito incluidas en la tabla.
-Sinha et al. International Journal of Surgery Case Reports. 2017;31:27-29.
-Shang et al. Medicine (2017) 96:49.
-Raad et al. Clin Nucl Med 2021;46: 47–48.
-Nagarajan et al. JPGN 2013;57: 277–280.
-Sürer et al. Turk J Gastroenterol 2009; 20 (2): 129-134.
-Berumen et al. Pediatric Transplantation 2016; 1–6.
-Thavamani et al. ACG Case Rep J 2019;6:1–4.
-Chablé-Montero et al. Ann Hepatol. Sep-Oct 2012;11(5):708-9.
-Schnelldorfer et al. J Hepatobiliary Pancreat Surg (2007) 14:421–423.
-Solomon et al. Arch Pathol Lab Med (2006) 130 (10): 1548–1551.
En conclusión, siempre que sea posible parece preferible el tratamiento quirúrgico, dado su potencial biológico intermedio. Se recomienda seguimiento a largo plazo y, en caso de recurrencia, se ha descrito buena respuesta al tratamiento con crizotinib, fundamentalmente en casos con expresión de ALK6.