Los tumores quísticos hepáticos son un grupo heterogéneo de enfermedades con distinta etiología e incidencia, y con manifestaciones clínicas similares. Se clasifican en quistes congénitos, traumáticos, parasitarios o neoplásicos. Los tumores quísticos congénitos son los más prevalentes e incluyen al quiste simple y a la enfermedad poliquística hepática. Otras lesiones infrecuentes son el cistoadenoma hepático, el quiste hepático ciliado embrionario, y un grupo miscelánea. Hemos efectuado una revisión de todas lesiones quísticas hepáticas benignas no parasitarias, haciendo hincapié en las estrategias terapéuticas.
Hepatic cystic tumours are a heterogeneous group of diseases with different aetiology and incidence, and with similar clinical signs and symptoms. They are classified as congenital, traumatic, parasitic, or neoplastic cysts. The congenital cystic tumours are the most prevalent, and include the simple cyst and polycystic hepatic disease. Other less common lesions are, hepatic cystadenoma, ciliated embryonic cyst, and a miscellaneous group. We have carried out a review of all benign non-parasitic hepatic cystic tumours, placing special emphasis on therapeutic strategies.
Los quistes hepáticos (QH) son un grupo heterogéneo de enfermedades con etiología y prevalencia diferentes, pero clínica similar1–4. Pueden clasificarse en congénitos, traumáticos, parasitarios o neoplásicos5–10. Los congénitos son el grupo más importante e incluyen el quiste simple (QS) y la enfermedad poliquística hepática (EPH)8,9,11–13. Los QH se diagnostican de forma incidental, ya que suelen ser asintomáticos, benignos y más frecuentes en mujeres2–4,6,14–17. Su incidencia es desconocida pero se ha estimado que un 5% de la población presenta QH no parasitarios7,8,15,17–22.
Quiste simpleEl QS es la lesión más frecuente del hígado, su prevalencia en la población adulta oscila entre el 0,1 y el 7%5,6,9–12,20,22–31. Está relleno de líquido seroso y no tiene comunicación con el árbol biliar10,12,16,23,24. El QS es más frecuente en mujeres con una ratio que oscila del 2:1 en asintomáticos a un 9:1 en sintomáticos2,5,8,17,19,22,24,27,29,31. Probablemente se producen porque un conducto biliar aberrante pierde la comunicación con el árbol biliar1,5,8,10,12,14,18,22,24,27–30,32. Se han descrito casos de desaparición espontánea30.
Macroscópicamente tiene forma esférica u ovoidal, unilocular y sin septos. Su tamaño oscila desde milímetros hasta más de 20cm, y en el 60% de los pacientes la lesión es única6,23,24. Los pacientes con QS múltiples, a diferencia de la EPH, ocupan menos del 50% del hígado6,17. Microscópicamente, el QS presenta un epitelio monocapa columnar similar al biliar que puede necrosarse si la presión intraquística es elevada5,6,23,24,27,29,30. No existe estroma circundante en los QS pequeños y solo una fina capa de tejido conectivo en los grandes6,24.
Habitualmente el QS es asintomático, y se diagnostica incidentalmente9–12,17,22–25,28,29,31–33. Cuando es sintomático (10-15%), el síntoma más frecuente es el dolor abdominal5,14,17,18,22,24,27,28,30,32. Otros síntomas son: náuseas y vómitos, saciedad pospandrial, dolor en hombro, disnea, tumor abdominal palpable, etc.5,11,12,16–18,20,22,24,28,31,32. Los estudios analíticos son normales excepto si hay compresión del árbol biliar9,11,12,24,28,31,32. Algunos QS presentan niveles elevados de CA19-9 intraquísticos9,18,34.
Las complicaciones del QS ocurren en el 5% de los pacientes11,20,23. Las dos más frecuentes son la infección, habitualmente monomicrobiana por E. coli, y la hemorragia2,11,16,20,23,26,32. Otras menos comunes son la rotura traumática o espontánea, la torsión, la compresión de estructuras vecinas: vena cava inferior; vena porta causando hipertensión portal; colédoco, produciendo colestasis, colangitis e ictericia; fistulización al duodeno o árbol biliar y excepcionalmente la malignización2,7–9,11,16,20,22–24,26,28,31,32,35–41.
La hemorragia intraquística suele ocurrir en ancianos con grandes QS13,33. Los síntomas más habituales son: crecimiento rápido y dolor abdominal2,12,31,33. Si la hemorragia es importante puede llegar a causar trombosis compresiva de la vena cava inferior13,20,36. El contenido hemático intraquístico puede mimetizar a un cistoadenoma hepático (CH)13,33,38. La ecografía con contraste y la resonancia magnética (RM) son útiles para el diagnóstico de hemorragia intraquística2,12,42. El tratamiento del QS con hemorragia debe ser quirúrgico para evitar futuras complicaciones13,23, aunque en pacientes con graves comorbilidades se ha utilizado: drenaje percutáneo, embolización, u observación si no se infecta13.
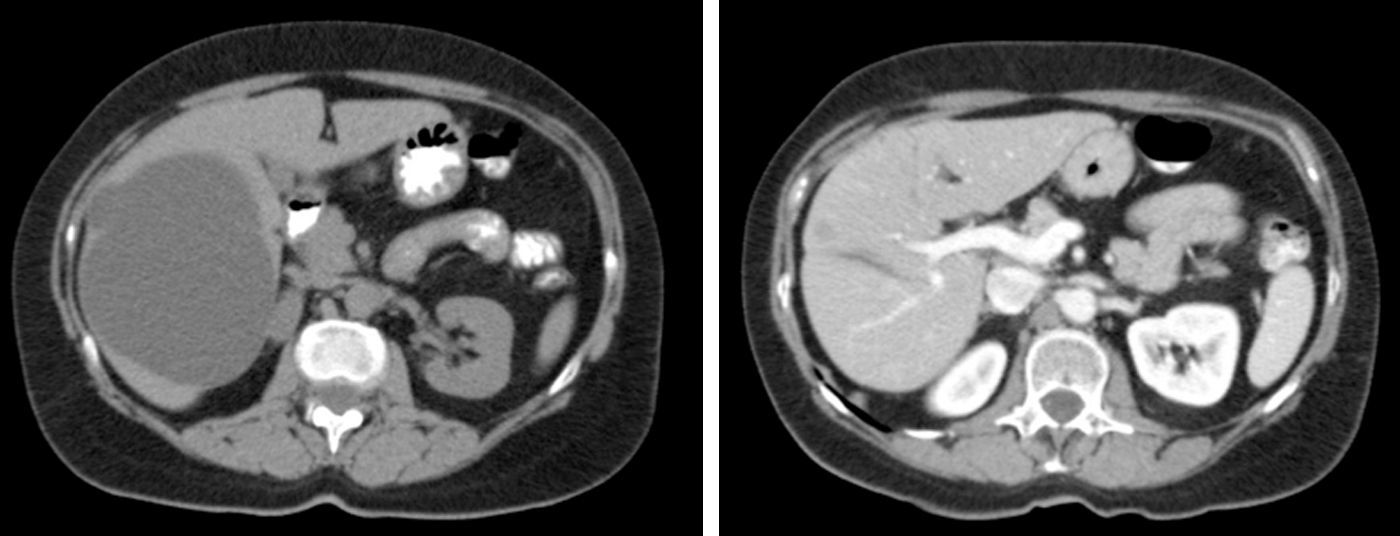
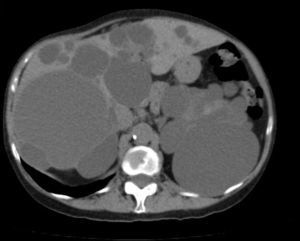
El método de imagen más coste-efectivo en el QS es la ecografía abdominal. Las características radiológicas son típicas3,32,33: lesión anecoica circular u oval no septada con refuerzo posterior por acentuación de los ecos detrás del QS debido al liquído intraquístico5,11,23,24,42. La TAC abdominal confirma la presencia de lesiones quísticas avasculares de densidad agua que no captan contraste (fig. 1)11. La RM es útil para el diagnóstico y la detección de las complicaciones intraquísticas, el QS se observa como lesión hiperintensa homogénea en T2 sin captación de contraste y de baja intensidad en T19,11,23. El diagnóstico diferencial se plantea con el quiste hidatídico, especialmente en áreas endémicas, el CH y las metástasis quísticas1,10,14,18,24,43.
Su tratamiento es necesario solo si se presentan complicaciones, en pacientes asintomáticos solo debe efectuarse observación periódica1,5,12,14,15,17,22,24,25,27–29,31,43. El tamaño del quiste no es per se una indicación de cirugía, aunque los grandes suelen ser sintomáticos2,3,14,18,31. Las opciones terapéuticas se pueden diferenciar en no quirúrgicas (punción aspiración con/sin inyección de agentes esclerosantes) y quirúrgicas14,22,28–30,32,44 que se dividen en: procedimientos conservadores: fenestración, y otros prácticamente abandonados (cistoyeyunostomía o marsupialización); o radicales (quistectomía o resección hepática)3,12,17,25,26,29,32,44.
La aspiración bajo control por ecografía/TAC puede conseguir el alivio de los síntomas pero la recidiva es la norma. Solo tiene lógica aplicarlo a pacientes con alto riesgo quirúrgico, como técnica diagnóstica, en quistes infectados o para demostrar si el quiste causa la sintomatología1–3,5,6,11,12,15,17,18,22,23,28,29,32. La instilación de agentes esclerosantes (alcohol, minociclina, monoetanolamina oleato, pantopaque...) mejora los resultados obtenidos con la aspiración pero presenta una tasa de recidiva elevada (20-90%) y complicaciones: dolor durante el procedimiento, intoxicación alcohólica, colangitis o eosinofilia2,9,11,12,14,16,18,22,28,29,31. La presencia de una alteración de la coagulación, sangrado intraquístico o comunicación del QS con el árbol biliar contraindica la punción1,11,12,14,16,29.
La fenestración es una técnica que puede realizarse mediante laparotomía o laparoscopia12,22,26,28,32,45,46. Su riesgo quirúrgico es bajo, pero los resultados a largo plazo son poco duraderos ya que la recidiva tardía es frecuente. La fenestración laparoscópica fue descrita por primera vez en 1991 por Z¿graggen, y se ha convertido en el procedimiento más habitualmente realizado en el QS único sintomático3,6,17,18,22,27–29,43,47,48.
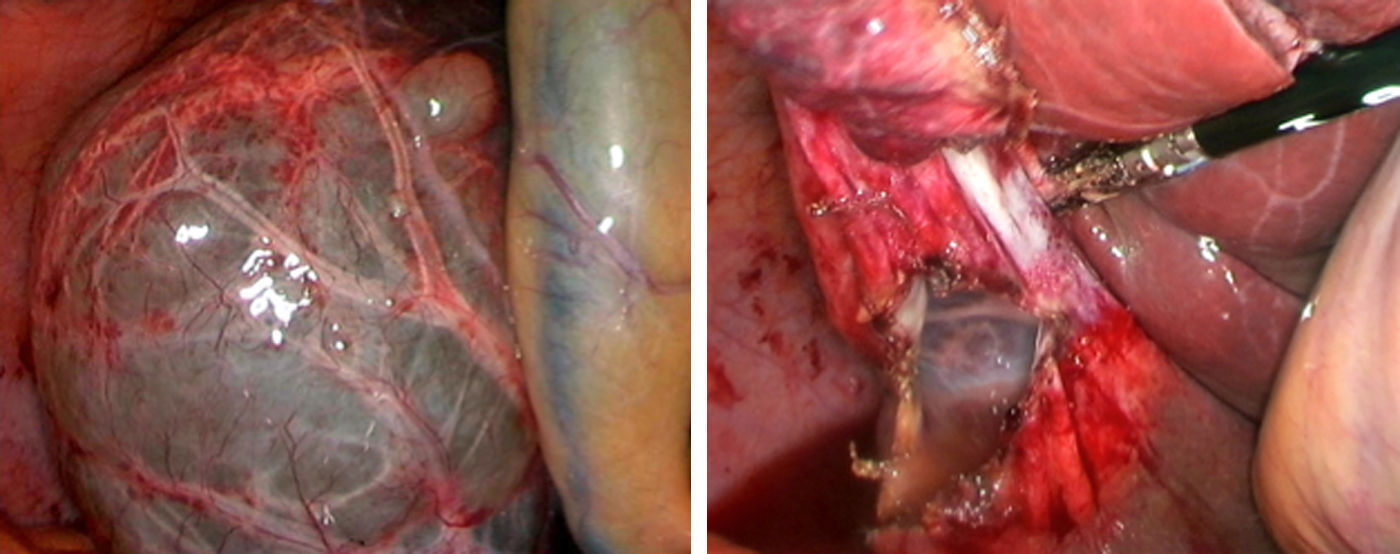
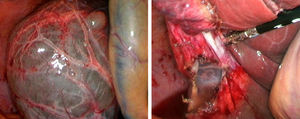
La fenestración laparoscópica (FL) se inicia con la punción del quiste para efectuar estudio analítico (marcadores tumorales, amilasa, bilirrubina y LDH), microbiológico y citológico del líquido intraquístico; posteriormente se reseca la parte visible del QS con gancho, bisturí sellador, grapadora cortadora, que es extraída mediante bolsa para estudio histológico diferido (fig. 2)2,5,27,28,31,32. Si existen varios quistes conectados, se puede realizar fenestración de los quistes profundos a través de los quistes externos11,45. Las ventanas realizadas deben ser grandes para asegurar la permeabilidad de la comunicación y evitar que el QS se rellene6,11,15,28. Se debe biopsiar cualquier nódulo intraquístico sospechoso12,31. Se ha realizado la fulguración del epitelio quístico no resecado con argón, bisturí eléctrico y otros instrumentos similares12,14,25,26,28,29,31,49. La fenestración laparotómica actualmente solo tiene indicaciones marginales31.
El porcentaje de complicaciones tras FL del QS oscila entre el 0 y el 18%5,12,17,18,31. Destacan: diseminación abdominal hidatídica si existe un diagnóstico incorrecto, la ascitis posfenestración, la embolia aérea, derrame pleural, disnea, biloma y hemorragia12,29,43,47. La tasa de recidiva de los síntomas oscila entre el 4 y el 44%5,14,15,17,18,26,28,29,31,43,48. Los factores favorecedores de recidiva tras FL son: quistes localizados centralmente o en el sector posterior derecho, resección escasa de la pared visible del quiste, quistes ya intervenidos y uso del gancho en vez de bisturí sellador para la resección14,15,18,25,28. La muy frecuente recidiva radiológica tras FL no siempre se acompaña de aparición de síntomas17.
La quistectomía total y la resección hepática son técnicas realizadas ocasionalmente2,5,11,12,14,15,22,29,31,44. Hay una publicación sobre tratamiento del QS mediante radiofrecuencia50.
El tratamiento de los pacientes con QS infectado es la punción percutánea y antibioterapia, para conseguir una mejoría sintomática y un diagnóstico fiable planteándose posteriormente el tratamiento más idóneo7.
Poliquistosis hepáticaLa enfermedad poliquística hepática (EPH) es una entidad con una prevalencia entre el 0,05 y el 0,6%. Consiste en la presencia de múltiples quistes hepáticos que ocupan más del 50% del parénquima hepático. Esta enfermedad se hereda de forma autosómica dominante, habitualmente se presenta en combinación con poliquistosis renal o con quistes en otros órganos (páncreas, bazo, ovarios y raramente pulmón)1,2,6,11,31,34,45,46,51–64. Un tercio de los pacientes con EPH no desarrollan nunca quistes renales; estos enfermos presentan alteraciones genéticas en el cromosoma 19p 13,2-13,1 (PRKSCH) y en el 6q (SEC63), diferentes a las de los enfermos con poliquistosis hepatorrenal, localizadas en los cromosomas 4 y 16 (PKD1 y 2)52,55,60,61,65–72. Los enfermos con EPH exclusivamente hepática tienen quistes más grandes pero menos complicaciones que los pacientes con poliquistosis hepatorrenal52,66.
La EPH es más frecuente en mujeres, que además presentan más quistes y más grandes46,60,64,66,73. Los pacientes con EPH presentan una incidencia superior de aneurismas intracraneales11,31,51,62,64,71,72.
Las lesiones hepáticas en la EPH pueden ser microquísticas, macroquísticas y hamartomas biliares (complejos de Von Meyenburgh) distribuidos uniformemente en el hígado y áreas peribiliares52,58,61,69. El parénquima normal presenta fibrosis y cambios vasculares63. Los quistes contienen habitualmente un líquido claro e histológicamente están tapizados por epitelio cuboidal58,61,69. Los quistes van creciendo en tamaño, número y volumen con la edad65.
Los quistes de la EPH habitualmente son asintomáticos45,51,52,57,58,60,61,72. Cuando producen síntomas, se debe a incremento volumétrico o compresión de estructuras adyacentes, y son similares a los del QS31,46,52,54,55,58,60–65,67,72,74,75. Las complicaciones son más frecuentes en enfermos sintomáticos; podemos citar: infección del quiste, rotura, torsión, hemorragia intraquística, hipertensión portal que causa ascitis y/o varices esofágicas, compresión de la vena cava, obstrucción biliar o fístula cistocutánea45,51,52,55,57,58,60,61,65,67,68,72,76. La infección o rotura quística es más frecuente en pacientes con trasplante renal previo posiblemente por la inmunosupresión62. El 75% de los pacientes sintomáticos tienen hepatomegalia palpable54,61,62. Los estigmas de hepatopatía y el fallo hepático agudo son infrecuentes60,77.
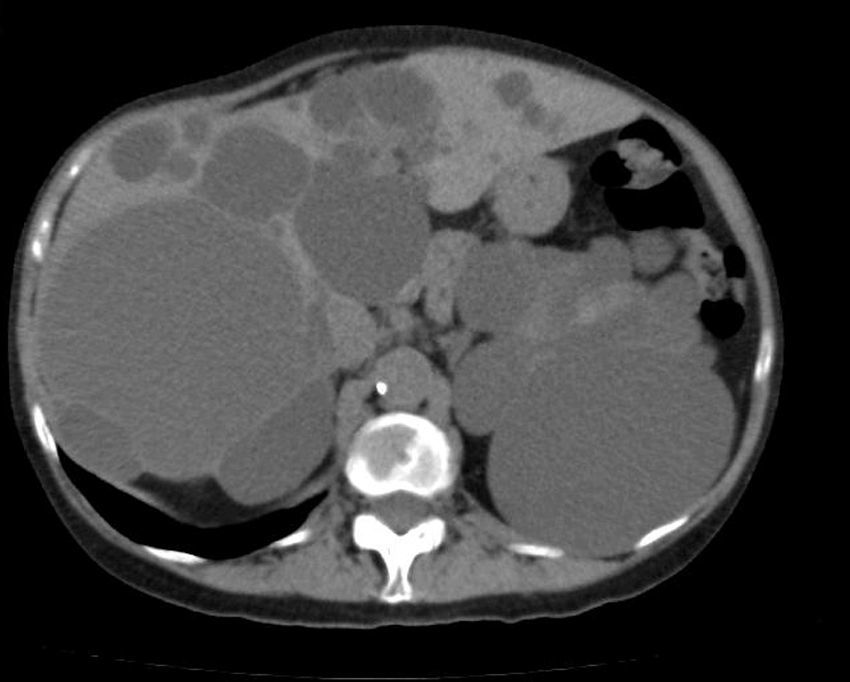
El diagnóstico de EPH se puede efectuar mediante ecografía, TAC helicoidal y RM55,58,60,61,67,72. La TAC define mejor la extensión de la enfermedad hepática y la afectación de órganos adyacentes31. En ella, se aprecian múltiples lesiones hepáticas hipoatenuantes de tamaños diversos con márgenes bien definidos que no captan contraste (fig. 3)60,72. En la RM, son lesiones de baja intensidad en T1 e hiperintensas en T261, y es muy útil para determinar hemorragias intraquísticas63. El perfil bioquímico hepático suele ser normal o estar levemente alterado2,52,55,60,61,64,72. El CA19-9 sérico puede estar aumentado, y el intraquístico suele estar muy elevado, especialmente en los quistes grandes59.
Los pacientes con EPH asintomáticos no requieren tratamiento2,52,53,55,57,58,62,74. No hay consenso en cómo tratar los pacientes sintomáticos2,27,31,45,53,55,57,60,61,63,65,72. El objetivo del tratamiento es disminuir el tamaño de los quistes sin comprometer la función hepática consiguiendo el periodo más largo posible sin síntomas51.
La elección del tratamiento se debe basar en el tamaño y extensión de los quistes y la existencia o no de complicaciones, para ello Gigot ideó una clasificación que define la estrategia terapéutica y divide los quistes en: tipo I: pocos quistes grandes entre 7 y 10cm. Tipo II: múltiples quistes de medio tamaño (5-7cm). Tipo III: múltiples quistes de pequeño y medio tamaño (inferior a 5cm)26,31,51,72,78. Li y Schnelldorf han propuesto nuevas clasificaciones que no se han popularizado51,74.
En los pacientes tipo I, se puede optar por la FL del quiste/quistes dominantes accesibles o la punción1. Con la FL se obtiene una reducción del 12,5% del volumen quístico (rango: 9,4-24,7%) que produce una mejoría clínica (menos distensión abdominal y plenitud pospandrial), y una recidiva del 4,5-16%1,14,25,26,45,60,61,67,74,78. En ciertas ocasiones (quiste infectado, alto riesgo quirúrgico), se puede efectuar punción percutánea para conseguir una mejoría sintomática temporal1,2,26,61,78. Su ventaja es la mínima morbimortalidad, pero el inconveniente es la elevada recidiva y la escasa disminución del efecto masa46,53,58,61,67,72,79.
En los pacientes tipo II, existen dos procedimientos: fenestración y resección hepática, o su combinación. Ambas tienen una importante morbilidad, y no consiguen una buena paliación de los síntomas a largo plazo3,7,15.
Clásicamente, la fenestración se realizaba mediante laparotomía drenando los quistes más internos en los más superficiales45,51,61,72. La fenestración no consigue los resultados esperados por el crecimiento de otros pequeños quistes o de quistes no accesibles, y al no obtener un buen colapso del hígado debido a su rigidez11,31,45,46,61. En los últimos años se han publicado series cortas de FL en pacientes con EPH26,31,45,60,67,78. Comparando ambas vías de acceso encontramos que la fenestración laparotómica obtiene una reducción volumétrica del 43%, una recidiva media del 17% (11-26%), una morbilidad entre el 0-56% y una mortalidad del 0-11%6,25,26,72. La FL obtiene una mejoría inicial de la sintomatología en más del 70% de los pacientes, la recidiva oscila entre el 0 y el 54%26,31,45,60,61, la mortalidad prácticamente es nula, con una morbilidad del 0-67% (ascitis, hemorragia, fístula biliar y derrame pleural)26,45,48,67,72. Los problemas técnicos de la FL son: confundir un quiste con un gran tronco venoso lo que produce una hemorragia cataclísmica, y el difícil acceso a los quistes intrahepáticos o segmentos posteriores25,45,51,53,61,75. Los resultados publicados no permiten claramente decantarse por la fenestración laparotómica o laparoscópica51.
La resección hepática se emplea ocasionalmente, pero es el método de elección cuando el paciente presenta hipertensión portal y/o los quistes se hallan situados en una región anatómica hepática.
La combinación de resección y fenestración de los quistes periféricos y comunicación con los más internos, es la técnica que ha conseguido mejores resultados con disminución volumétrica del 75% y recidiva del 15%1,26,46,51,53,62,63,67,69. Las ventajas son: reducción volumétrica, eliminación de quistes complicados y regeneración del hígado sano63. La morbilidad oscila entre el 20 y el 100%, citaremos: lesiones vasculares, lesiones biliares, ascitis posoperatoria de muy difícil resolución ya que excede la capacidad de absorción peritoneal (900ml/día), volumen hepático posoperatorio insuficiente y dejar un remanente hepático muy móvil (kinking)45,46,51,61–63,67,72,74. La mortalidad es del 0-11%46,51,53,63,67,72,74. Los principales inconvenientes de esta técnica son: morbimortalidad elevada, no aplicable a enfermos con situación hepatorrenal preoperatoria grave, y que cuando fracasa prácticamente abocamos al paciente a un trasplante hepático. Se recomienda siempre realizar colecistectomía con colangiografía para descartar fugas biliares58,63. Es importante fenestrar los quistes cercanos a las venas hepáticas y vena cava para evitar complicaciones compresivas futuras63,74.
El tipo III se puede tratar mediante la combinación de fenestración y/o resección o trasplante hepático1,26,63,74. Si las zonas afectas de EPH están próximas y dejan suficiente parénquima viable, la resección con fenestración es factible, pero cuando la afectación es muy difusa, no hay un volumen remanente mayor del 30%, hay cambios histológicos en el parénquima hepático o presentan insuficiencia renal, el trasplante estará indicado antes de que aparezcan complicaciones31,63,64,68,78.
En 1988, Kwok realizó el primer trasplante hepático por EPH51,80. Desde entonces se han realizado unos 600 casos en Europa y la EPH supone un 0,5% de indicaciones de trasplante hepático51,56,64,68,73,77,80,81. La indicación más frecuente es el síndrome letal exhaustivo (caquexia, fatiga y dolor)72. El 90% de los trasplantados son mujeres, la afectación hepatorrenal del 90%, pero solo un 53% son trasplantados del riñón56,63,64,68,73,74,77,80–83. La morbilidad es del 85%, y la mortalidad perioperatoria es 12,5% debida habitualmente a la mala situación preoperatoria. La supervivencia a 5 años es del 85%56,63,64,67,73,74,77,80–83. La paliación de los síntomas es excelente56,63,64,67,73,74,77,80–83.
Estos trasplantes suelen ser complejos por las cirugías previas y el gran tamaño del hígado63,67,77. Clásicamente se recomendaba iniciar la cirugía por el hilio hepático, usar el bypass venovenoso y la técnica clásica con resección de la vena cava inferior65, pero el piggyback es factible en un amplio porcentaje de pacientes63,81.
Existen varios argumentos contrarios a la realización de un trasplante hepático en EPH: enfermedad benigna, habitualmente no existe insuficiencia hepatocelular, terapia inmunosupresora indefinida, intervención quirúrgica con morbimortalidad asociada y escasez de donaciones1,63,64,77,81. Los argumentos a favor son: buenos resultados y mejora de calidad de vida postrasplante61,64,67. El momento adecuado para efectuar el trasplante hepático y la conveniencia de un trasplante hepatorrenal son una decisión compleja63,64,67,77.
Otras medidas terapéuticas son el tratamiento con octreotido y análogos pero no han obtenido resultados satisfactorios34,74. Un estudio multicéntrico con lanreotido obtuvo una disminución del 2,9% del volumen quístico65. La colocación de una prótesis en la vena cava en pacientes con ascitis intratable causada por la hepatomegalia puede ser efectiva54.
Cistoadenomas hepatobiliaresLos cistoadenomas hepatobiliares (CH) son tumores hepáticos infrecuentes6,84–93. Suponen un 5% del total de quistes hepáticos4,84,85,87–97. Un 85% ocurre en mujeres de mediana edad3,4,84–87,89–94,96,97. Su histogenésis es desconocida90,92–94,97.
En 1985, se definieron dos subtipos de CH según la presencia o no de estroma mesenquimal tipo ovárico4,87,88,90,91,98. Los CH sin estroma son más habituales en varones, y se malignizan más frecuentemente87,94,96,99. Existe una subvariedad de CH sin estroma y con células acidofílicas que solo ocurre en hombres y se considera una variante semimaligna91. No se conoce si la variante maligna (cistoadenocarcinoma) es una evolución desde un CH o un tumor maligno inicialmente87,90,91. La tasa de malignización puede llegar al 30%84.
Los CH son lesiones multiloculadas, bien definidas, únicas, habitualmente con septos internos, con proyecciones papilares o nódulos en la pared del CH o en los septos. A nivel microscópico presentan estas capas: epitelio simple monocapa cuboidal o columnar, estroma mesenquimal (ausente en la variante sin estroma) y una capa externa densa de tejido conectivo4,6,84,86,87,90–94,96–98,100,101. El líquido intraquístico puede ser turbio o claro con aspecto gelatinoso o mucinoso87,94. El CH es de tamaño variable (1,5 a 30cm)85,87,88,93,95. Puede existir ocasionalmente comunicación entre el CH y el árbol biliar. Se asocia a tumores quísticos mucinosos de páncreas86,90,96.
La mayoría de los CH son asintomáticos y su hallazgo es incidental85,87,90–94. Los síntomas que causa son similares a los del QS4,21,85–91,93,94,97,100. Las posibles complicaciones son: hemorragia intraquística, compresión u obstrucción de la vía biliar, ascitis, sobreinfección bacteriana, rotura, recidiva y malignización85,89–91,94,97.
Los estudios analíticos suelen ser normales, con elevación de los parámetros hepáticos si existe compresión del árbol biliar21,93,94,96. Los marcadores realizados en el líquido intraquístico están elevados, especialmente el CA19-984,93,94,102. Se ha demostrado inmunohistoquímicamente la presencia de CA19-9 en el epitelio del CH4,13,86–88,91,92,97,102,103.
En la ecografía, es una masa quística ovoidea anecoica con múltiples septos internos hiperecoicos y proyecciones papilares en los septos o en la pared del quiste4,86,87,91,92. En la TAC, es una masa quística, multilobulada, bien definida, de pared gruesa, con baja densidad, y que suele presentar septos internos, nódulos murales y/o proyecciones papilares que son hipercaptantes en la fase con contraste4,6,87,91,92,97. La RM es útil para evaluar las características del contenido intraquístico94. Se recomienda no puncionarlo por la baja sensibilidad diagnóstica y riesgo de diseminación4,13,91. El diagnóstico preoperatorio correcto oscila entre el 30 y el 95%84. La presencia de un componente sólido significativo (masas sólidas nodulares o engrosamiento marcado parietal), la hemorragia intraquística, calcificaciones en la pared, y la combinación de nódulos y septos son sugestivas de malignidad87,91,95–97.
El tratamiento de CH es la resección quirúrgica completa, ya que es una lesión potencialmente maligna, que recidiva habitualmente tras cirugías parciales y por la imposibilidad de distinguir preoperatoriamente entre CH y cistoadenocarcinoma3,4,6,10,21,84–86,88–90,94,96,97,99,100. La decisión de realizar enucleación completa o resección anatómica dependerá de la localización del CH4,89,91,92,94,99. Los CH con estroma mesenquimal se enuclean más fácilmente91.
Los pacientes diagnosticados preoperatoriamente como QS, a los que se les practica una FL y finalmente es una CH deben ser intervenidos para su completa escisión91,93.
Quiste hepático ciliado embrionarioEl quiste hepático ciliado embrionario (QHCE) es una lesión quística hepática infrecuente, solo se han publicado unos 100 casos104–108 El QHCE se postula que deriva de restos embrionarios intrahepáticos que se diferencian hacia tejido respiratorio en lugar de biliar6,105–107,109.
El QHCE es una lesión casi siempre benigna, solitaria, única, subcapsular y unilocular, localizada habitualmente en el segmento IV, y tamaño variable aunque normalmente inferior a 4cm104–111. Su contenido es viscoso o mucoide104,106,108,109. La edad media de presentación es 48 años con una leve predominancia de varones104,105,110.
Histológicamente presentan cuatro capas: epitelio columnar pseudoestratificado ciliado productor de mucina, tejido conectivo subepitelial, estroma y cápsula fibrosa6,105,107–109,111. Se han descrito tres casos de carcinoma epidermoide en QHCE que se desarrollaron en focos previos de metaplasia escamosa lo que sugiere una progresión de displasia a carcinoma104,105,111–113.
Su diagnóstico suele ser incidental ya que son asintomáticos en el 80%104–106,108,110. El síntoma más típico es el dolor abdominal, también pueden causar ictericia o hipertensión portal104–108,111,112.
En la ecografía, se comportan como una lesión redondeada anecoica o hipoecoica y bien delimitada donde puede apreciarse una masa intraquística ecogénica104,110. En la TAC, son lesiones hipodensas sin captación de contraste. En la RM, es característica la hiperintensidad en T2, y una intensidad variable en T1 según su contenido104,106–109,111. Su punción tiene un valor predictivo positivo del 76%104.
El tratamiento clásico era la punción con aspiración o inyección de agentes esclerosantes, recomendando únicamente el tratamiento quirúrgico en las lesiones sintomáticas y sin diagnóstico cierto106,107. La publicación de tres casos de malignización (3% del total) deja dudas sobre cuál es el tratamiento más adecuado106,111,112. Los QHCE deben ser resecados siempre si son: mayores de 4cm (los tres pacientes con QHCE malignos presentaban quistes grandes), sintomáticos, presentan crecimiento progresivo o cuando existe una masa en la pared del quiste104,106,111. La resección laparoscópica completa del QHCE es una opción interesante111.
Otros lesiones quísticas infrecuentesSe han descrito otras lesiones quísticas:
- -
Pseudoquiste de páncreas intrahepático: solo hay descritos 27 casos hasta el 2006. Habitualmente localizados en el lóbulo hepático izquierdo. No suelen ser sintomáticos, y el diagnóstico es incidental. La confirmación diagnóstica se produce tras punción al existir un líquido rico en amilasa114. El tratamiento efectuado varía entre actitud expectante, drenaje percutáneo o quirúrgico114.
- -
Quiste postraumático: el manejo conservador de los traumatismos hepáticos ha incrementado el número de quistes postraumáticos. Solo se deben intervenir los sintomáticos o ante duda diagnóstica1,5,7,115.
- -
Hamartomas: también llamados complejos de Von Meyenburg, son causados por un fallo en la involución de los conductos biliares embrionarios116. Son lesiones múltiples de 0,1 a 1,5cm no comunicadas con la vía biliar116. Su incidencia en autopsias oscila entre el 0 y el 2,8%. Suelen ser hallazgos incidentales, ya que habitualmente son asintomáticos pero pueden excepcionalmente causar microabscesos o degenerar en colangiocarcinoma116,117. En la TAC pueden confundirse con metástasis hepáticas múltiples pero la RM aporta un diagnóstico correcto116.
- -
Quiste epidermoide.
- -
Linfangiomas.
- -
Biloma: se producen por la rotura del sistema biliar espontánea, traumática o iatrogénica.
- -
Tumor biliar intraductal mucinoso papilar: existen dos tipos la forma quística y la no quística101.
Los autores declaran no tener ningún conflicto de intereses.