Con objeto de promover la elaboración de documentos de consenso sobre temas de actualidad en trasplante hepático de abordaje multidisciplinario, la Sociedad Española de Trasplante Hepático (SETH) ha realizado la V Reunión de Consenso con participación de expertos de todos los programas de trasplante hepático españoles. En esta edición se han abordado los siguientes temas, cuyo resumen ofrecemos a continuación: 1. Receptores de riesgo elevado; 2. Escenarios de inmunosupresión, y 3. Manejo del paciente con hepatocarcinoma en lista de espera.
With the aim to promote the elaboration of consensus documents on state of the art topics in liver transplantation with multidisciplinary management, the Spanish Society for Liver Transplantation (SETH) organized the V Consensus Meeting with the participation of experts from all the Spanish liver transplant programs. In this edition, the following topics were revised, and we present the summary: 1. High-risk receptors; 2. Immunosuppression scenarios; and 3. Management of the patient with hepatocarcinoma in the waiting list.
Con objeto de promover la elaboración de documentos de consenso sobre temas de actualidad en trasplante hepático de abordaje multidisciplinario, la Sociedad Española de Trasplante Hepático (SETH) ha realizado la V Reunión de Consenso con participación de expertos de todos los programas de trasplante hepático españoles. En esta edición se han abordado los siguientes temas, cuyo resumen ofrecemos a continuación: 1. Receptores de riesgo elevado; 2. Escenarios de inmunosupresión, y 3. Manejo del paciente con hepatocarcinoma en lista de espera.
RECEPTORES DE RIESGO ELEVADOCoordinadores: Itxarone Bilbao y Manuel de la Mata
IntroducciónLa supervivencia de los pacientes trasplantados de hígado ha alcanzado en la mayoría de los centros de trasplante cifras del 70 y del 60% a los 5 y 10años, respectivamente. Sin embargo, entre un 10 y un 20% de los pacientes fallecen en el primer año postrasplante debido a complicaciones relacionadas con un fallo del injerto hepático, por complicaciones técnicas, infecciones o por fallo multiorgánico1.
Una proporción elevada de la mortalidad postrasplante temprana se acumula en receptores con factores de riesgo o contraindicaciones relativas. No existe una definición bien establecida de lo que describimos como receptor de alto o de demasiado riesgo. Esta definición puede enfocarse en términos de supervivencia mínima esperada (50% a los 5años)2,3, o de morbilidad y duración de la hospitalización4. La evaluación cuidadosa y exhaustiva de los potenciales candidatos a trasplante hepático es esencial en momentos con creciente demanda de trasplante y amplias listas de espera5.
La probabilidad de acceder al trasplante se sitúa en nuestro entorno alrededor del 50%6. Parece razonable realizar un esfuerzo de selección dirigido a incluir en la lista de espera a los pacientes con mayor probabilidad de superar el procedimiento de trasplante, así como revisar de modo periódico las expectativas de supervivencia7.
El **disbalance entre la demanda de trasplante y la oferta de donantes ha crecido con los años debido a una expansión creciente de las indicaciones de trasplante y a la complejidad de los receptores, derivada de su edad avanzada en proporción creciente, morbilidad acumulada, MELD (Model for End Stage Liver Disease) elevado y status psicosocial comprometido.
La inclusión en lista de espera de un receptor puede regirse por el principio de justicia individual, que concede la máxima prioridad a los pacientes más graves o por el de la utilidad de la donación, según el cual debería prevalecer el beneficio en términos de supervivencia sobre la expectativa de vida sin trasplante. Otros criterios, como el de coste-efectividad, deben también ser considerados8.
La relación de factores de riesgo que pueden reducir la supervivencia postrasplante es larga y creciente9, por añadir de modo progresivo contraindicaciones antes consideradas absolutas y posteriormente relativas. No hay un límite absoluto de edad, la positividad de la serología VIH no es excluyente, se relativiza la duración del tiempo de abstinencia alcohólica, se buscan soluciones técnicas para la trombosis portal y se aceptan los riesgos de trasplantar a pacientes con cirugía previa u obesidad. Solo la enfermedad cardiopulmonar muy grave o un estado de sepsis recabarían suficiente consenso para contraindicar de modo absoluto el trasplante hepático (tabla 1).
El acceso al trasplante de los pacientes más graves se asocia con una mayor probabilidad de muerte postrasplante. Es necesaria la identificación de criterios de exclusión que eviten la pérdida de injertos con mayor potencial de evolución favorable en otros pacientes. Se dispone de diferentes modelos pronósticos que incluyen variables del receptor, del donante y de la cirugía, que pueden ser de utilidad en la identificación de candidatos de riesgo elevado10.
Dada la imposibilidad de revisar en un solo documento los múltiples factores de riesgo, se ha priorizado en esta revisión el asociado a una puntuación MELD elevada, la trombosis portal, la obesidad y la cardiopatía coronaria.
MELD elevadoNo se ha establecido un límite alto en la puntuación MELD por encima del cual pueda considerarse que el trasplante hepático será fútil y, por tanto, deba ser catalogado como una contraindicación absoluta. Se han realizado conferencias de consenso11 y algunos estudios que concluyen que aun en receptores con puntuaciones MELD muy elevadas, por encima de 30 y de 40 puntos12,13, puede obtenerse un beneficio en términos de supervivencia que justifica el trasplante, si bien a expensas de hospitalizaciones prolongadas y un coste elevado. Se ha comunicado que los pacientes con MELD superior a 35 generan costes muy elevados14,15.
Un estudio reciente coincide en el escaso poder predictivo de la puntuación MELD como variable aislada en la predicción de la supervivencia postrasplante y describe que entre los pacientes con MELD<10 y MELD>30 solo se observa un 10% de diferencia en la supervivencia a los 5años4. No obstante, en modelos multivariantes y asociado a otras variables sí puede contribuir a seleccionar a candidatos de mal pronóstico. Esto mismo puede ser reproducido en otros estudios16. En una revisión sistemática que incluye 37 estudios y un total de 53.691 pacientes de 15 países se concluye que solo en 2 de ellos se describe una capacidad predictiva de la puntuación MELD pretrasplante sobre la supervivencia postoperatoria, con una c-statistic >0,717.
La mayoría de los centros de trasplante utilizan la puntuación MELD para priorizar las listas de espera. Este modelo de asignación donante-receptor fue diseñado para favorecer el acceso al trasplante de los pacientes más graves y disminuir la mortalidad en lista de espera18. No obstante, recientemente se ha comunicado que la asignación empírica de puntos a las llamadas excepciones al MELD, principalmente el hepatocarcinoma, puede condicionar que el acceso al trasplante de los pacientes con insuficiencia hepatocelular se retrase, con repercusión en una elevación de la puntuación MELD o una mayor mortalidad pretrasplante19.
Con todo, es cierto que para aquellos receptores que acceden al trasplante se ha descrito que el porcentaje de ellos que reciben un beneficio del mismo aumenta de modo paralelo a la puntuación MELD20,21. De igual modo debemos admitir que este acceso priorizado al injerto puede derivar con frecuencia mayor a la deseada en un trasplante fútil y en la muerte en lista de espera de otro receptor con una mayor probabilidad de supervivencia.
Los pacientes con MELD elevado que fallecen en periodos cortos de tiempo en lista de espera podrían comportarse como los hepatocarcinomas biológicamente muy agresivos que progresan rápidamente y son excluidos de la lista de espera. No se dispone de datos contrastados que nos permitan establecer el periodo de tiempo que un paciente en situación de insuficiencia hepática grave puede conservar sus sistemas vitales con garantías de superar con éxito el procedimiento de trasplante. Es interesante que las diferencias entre centros en términos de supervivencia son probablemente mayores en el subgrupo de pacientes con MELD elevado12,13.
Aplicabilidad de los baremos pronósticosSe ha elaborado un buen número de modelos pronósticos que tratan de predecir la supervivencia postrasplante. Estos modelos están centrados en unos casos en el receptor, en otros en el donante, y hay por último modelos que incluyen variables del paciente y del injerto. Estos diferentes modelos y su utilidad en la distribución de los donantes han sido revisados recientemente10.
Es ampliamente aceptado que aunque la puntuación MELD es útil en la predicción de la mortalidad pretrasplante, no tiene capacidad de estimar la supervivencia postoperatoria, en la que necesariamente intervienen variables dependientes de la calidad del donante, de la técnica quirúrgica y del manejo perioperatorio del paciente. El modelo SOFT, que incluye variables del receptor y del donante, ha sido recientemente validado en cohortes de receptores de riesgo22,23 con razonable capacidad predictiva.
Algunos de los estudios realizados proporcionan análisis multivariantes que recogen variables que perfilan un paciente con requerimientos de cuidados intensivos (diálisis, intubación), de edad avanzada, que recibe donantes añosos, con tiempos de isquemia prolongados24,25.
En uno de estos estudios, mediante análisis multivariante, la necesidad de diálisis pretrasplante y de ventilación mecánica, una puntuación MELD elevada y una edad avanzada resultaron ser predictivos de una estancia hospitalaria postrasplante superior a 60días. Este subgrupo de pacientes con hospitalización prolongada tuvo una supervivencia del paciente y del injerto significativamente inferiores, y el procedimiento de trasplante resultó ser significativamente más costoso4.
Variabilidad en la práctica clínicaExiste una gran variabilidad en la práctica asistencial del trasplante hepático, que se mantiene de modo especialmente relevante en el proceso de selección de los receptores y en el acceso al trasplante hepático. La selección de candidatos se lleva a cabo en sesiones multidisciplinarias donde es patente la influencia de los médicos responsables, el grado de empatía con los pacientes, su previsible adherencia a las recomendaciones de tratamiento y la presión externa ejercida por los propios enfermos, su familia y los médicos de los hospitales de origen. Es también causa de variabilidad la diferente configuración de los equipos quirúrgicos y su predisposición a asumir retos técnicos en pacientes cada vez más complejos. Por último, es innegable el impacto anímico de la evolución positiva o negativa que hayan seguido los trasplantes realizados en el periodo reciente.
¿Cuánto añade a la mortalidad supuestamente asociada a una puntuación MELD cada uno de los factores de riesgo identificados: diabetes, insuficiencia renal, cardiopatía, trombosis portal? Esto es lo que se supone han intentado los diferentes baremos con un éxito limitado, y lo que también se supone que ha tratado de mejorar la aproximación mediante modelos basados en **ANN26.
RECOMENDACIONES- 1
No se ha establecido una puntuación MELD en límite alto para contraindicar el trasplante hepático. Grado de evidencia III-B.
- 2
En estudios con análisis multivariantes, la puntuación MELD, asociada a otras variables relacionadas con requerimientos de cuidados intensivos o con la calidad del donante, puede contribuir a la identificación de receptores de mal pronóstico. Grado de evidencia II-A.
- 3
Los modelos pronósticos de evolución postrasplante tienen una limitada utilidad para excluir a pacientes con acumulación de factores de riesgo en su acceso a la lista de espera. Grado de evidencia II-B.
- 4
La edad avanzada es un factor de riesgo cuyo límite es variable entre las unidades de trasplante, pero debe ser evaluada teniendo en cuenta el incremento de la esperanza de vida. Grado de evidencia III-B.
La trombosis portal constituye una contraindicación relativa para el trasplante hepático, pero no hay unanimidad sobre su condición de absoluta según su grado de extensión.
Existen 2 metaanálisis y algunas revisiones del manejo pre y postrasplante de la trombosis portal y de la conveniencia de instaurar anticoagulación. En un análisis exhaustivo de la literatura desde el año 1986, tan solo 41 artículos cumplían los requisitos de calidad para poder obtener de ellos conclusiones y recomendaciones. Todos los artículos revisados, excepto 3, son estudios retrospectivos27-30.
Incidencia y prevalencia de la trombosis portalLa incidencia de la trombosis portal de novo en el paciente en lista de espera no está bien estudiada, pero podría rondar el 7,4%31. La prevalencia es mejor conocida (9,7%±4,5%), pero con un rango muy amplio que va del 2,1 al 23,3%, que traduce las diferentes políticas de inclusión de pacientes en lista de espera. Los grupos que consideran la trombosis portal como una contraindicación reportarán prevalencias bajas. La diferencia de criterios a la hora de comunicar los eventos también podría contribuir a la diferencia de cifras. Por tanto, a la hora de publicar resultados sería deseable que todos los autores siguieran una misma clasificación o definición del evento.
Tipología y clasificaciónExisten múltiples clasificaciones, algunas basadas en aspectos morfológicos32 y otras basadas en aspectos del tratamiento técnico o quirúrgico requerido33-38. De todas ellas, la más aceptada es la clasificación de Yerdel35, ya que abarca no solo el aspecto morfológico, sino que hace referencia a la presencia de adecuados vasos colaterales que potencialmente pudieran ser usados en una reconstrucción extraanatómica del flujo portal. Se distinguen 4 grados. En el gradoi el trombo afecta parcialmente (<50% de la luz) al tronco principal de la vena porta, con o sin mínima extensión a la vena mesentérica superior. El gradoii representa la trombosis completa o de más del 50% de la luz del vaso, con o sin mínima extensión a la vena mesentérica superior. El gradoiii incluye los casos de trombosis completa de la vena porta y de la vena mesentérica superior proximal, siendo patente la parte distal de la misma. El gradoiv identifica a la trombosis completa de la vena porta y de la vena mesentérica superior tanto proximal como distal.
De acuerdo con clasificaciones morfológicas, el 56,2% de las trombosis reportadas en la literatura son trombosis parciales y el 43,3% son totales. De acuerdo con la clasificación de Yerdel, el 46,4% son gradoi, el 36,4% son gradoii, el 11,1% son gradoiii y el 14% son gradoiv.
Manejo preoperatorioExisten 3 aspectos interesantes en el manejo preoperatorio de la trombosis portal en lista de espera: elegir la prueba diagnóstica de imagen idónea, seleccionar a los candidatos de la lista que requieren un seguimiento más estricto por tener una mayor probabilidad de desarrollar una trombosis portal, y en tercer lugar, lograr revertir el trombo o, como mínimo, evitar su progresión.
Pruebas diagnósticasEcografía, angio-TAC abdominal y resonancia magnética son las pruebas más utilizadas. La ecografía es válida para diagnosticar la trombosis total de la vena porta y de sus ramas intrahepáticas, además de informar sobre la dirección del flujo portal. El angio-TAC proporciona información sobre el estado de la vena mesentérica superior, de la existencia de shunts portosistémicos y del estado de la vena renal y de la vena cava. Entre los grupos de trasplante hepático de nuestro país existe consenso en que la prueba princeps en todo candidato a trasplante hepático es el angio-TAC abdominal, ya que aporta la información más completa sobre la envergadura de la trombosis y da información sobre la estrategia quirúrgica que debe realizarse durante el trasplante hepático. No obstante, la sensibilidad de cualquiera de las 3 pruebas diagnósticas es del 92 al 100% para la trombosis portal gradosiii y iv, y en cambio del 14,3 al 50% para la trombosis gradosi y ii27.
Factores de riesgo que favorecen la trombosis portalMuchos autores tratan de encontrar una asociación de peso entre determinadas mutaciones genéticas asociadas a estados de hipo-hipercoagulabilidad y el desarrollo de trombosis portal, pero solo algunos trabajos aislados han encontrado alguna asociación39,40. Otros factores de riesgo descritos en diferentes artículos son la cirrosis autoinmune y la cirrosis criptogenética41, y la cirrosis alcohólica en varones tratados previamente de hemorragia digestiva alta35. Contrariamente a lo esperado, la trombosis portal no se asocia a MELD elevado, pero en cambio dicha asociación sí afecta a los resultados. Así, la coincidencia de trombosis portal completa y MELD por encima de 25 se asocia a mayor mortalidad42.
No está clara la periodicidad de solicitud de las pruebas de imagen mientras el paciente está en lista de espera. Algunos autores han demostrado que el aumento en la frecuencia de las pruebas de imagen no aumenta la tasa de detección de la trombosis portal43. No obstante, hay unanimidad entre los grupos en que una ecografía cada 3meses y un angio-TAC cada 6meses parece una frecuencia razonable.
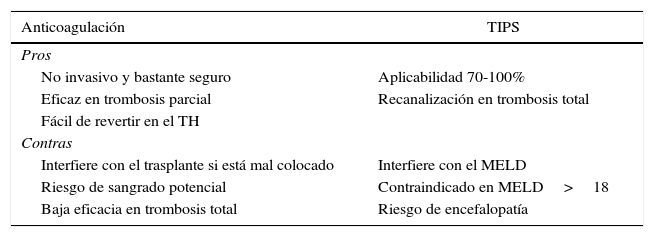
Anticoagulación versus shunt intrahepático percutáneoLa finalidad tanto de la anticoagulación como del shunt intrahepático percutáneo (TIPS) es revertir el trombo o, como mínimo, evitar su progresión. Todos los estudios que recomiendan cualquiera de los 2 procedimientos están basados en pocos pacientes y son estudios no aleatorizados, por lo que el grado de recomendación es bajo (IIIB).
La anticoagulación consigue una recanalización total en el 40-75% de los casos de trombosis portal parcial. En cambio, raramente consigue recanalización en la trombosis completa, si bien logra evitar la extensión del trombo44–46. La efectividad parece ser mayor cuanto menor es el tiempo transcurrido entre el diagnóstico y el inicio de la anticoagulación. Se recomienda que este intervalo sea inferior a 6meses, aunque este dato es a veces imposible de determinar por tratarse de un hallazgo fortuito. Previo al inicio de la anticoagulación es obligatorio excluir una enfermedad cardiaca o pulmonar grave, la presencia de un hepatocarcinoma y un trombo tumoral, y antecedentes de hemorragia digestiva alta reciente. También estaría indicado realizar una endoscopia previa, con ligadura profiláctica de varices y administración de betabloqueantes, ya que el riesgo de sangrado secundario a la anticoagulación es del 5%47.
No hay consenso respecto al mejor tipo de anticoagulación29,30. La heparina de bajo peso molecular tiene el inconveniente de requerir inyecciones subcutáneas y no contar con un antídoto rápido cuando surge el trasplante. Los antagonistas de la vitaminaK tienen el inconveniente de aumentar el **INR e interferir con la puntuación MELD, pero en cambio sí cuentan con un antídoto potente y rápido. Por último los inhibidores de la trombina o del factorX activado ofrecen la ventaja de su administración oral, pero se desconoce la manera de revertir su acción y no hay experiencia en pacientes cirróticos.
La aplicabilidad del TIPS oscila entre el 70 y el 100% de los casos, de acuerdo con las series retrospectivas con mayor número de pacientes48-50. Sin embargo, hay que tener en cuenta que ninguno de estos artículos es prospectivo ni hace un análisis por intención de tratamiento. El TIPS ha de ser colocado en un centro experimentado para evitar la malposición de su extremo distal y su interferencia técnica con un futuro trasplante. Tampoco estaría recomendado en pacientes con MELD>18, por la alta probabilidad de empeoramiento clínico y de la función hepática (tabla 2).
Ventajas e inconvenientes del uso de anticoagulación y TIPS en candidatos con trombosis portal
| Anticoagulación | TIPS |
|---|---|
| Pros | |
| No invasivo y bastante seguro | Aplicabilidad 70-100% |
| Eficaz en trombosis parcial | Recanalización en trombosis total |
| Fácil de revertir en el TH | |
| Contras | |
| Interfiere con el trasplante si está mal colocado | Interfiere con el MELD |
| Riesgo de sangrado potencial | Contraindicado en MELD>18 |
| Baja eficacia en trombosis total | Riesgo de encefalopatía |
Adaptado de Francoz et al.29.
De acuerdo con la literatura27-29, la técnica utilizada depende del grado de la trombosis. Así para los gradosi, ii y iii de Yerdel habitualmente son usadas las llamadas técnicas anatómicas (trombectomía o tromboendovenectomía)51 en el 75% de los casos, la colocación de un injerto venoso desde la vena mesentérica superior del receptor a la vena porta del donante en el 8,4% de los casos, o la anastomosis de la vena porta del donante a una colateral venosa del receptor en el 2,4% de los casos. Para el gradoiv de Yerdel es necesario recurrir a técnicas no anatómicas, como son la hemitransposición en un 3,3%, la anastomosis renoportal en un 1,4% (recomendada sobre todo en pacientes que tienen un shunt esplenorrenal espontáneo o quirúrgico) y la arterialización de la vena porta en un 0,2% del total de casos. La elección de las diferentes técnicas extraanatómicas dependerá de la presencia de un shunt esplenorrenal y de la experiencia del grupo. Por último, no podemos olvidar el trasplante hepatointestinal como alternativa radical cuando la trombosis es muy extensa.
Resultados postrasplante hepáticoEl análisis global de todos los pacientes trasplantados con trombosis portal1-3,52-54 muestra una mayor mortalidad a 30días (10,5%) y a un año (18,8%) en comparación con los pacientes trasplantados hepáticos con vena porta permeable (7,7 y 15,4%, respectivamente). Sin embargo, algunas series más recientes solo muestran estas diferencias en relación con la técnica utilizada, dando importancia a si se trata de técnicas anatómicas o no anatómicas, lo cual a su vez está en clara relación con el grado de la trombosis55. Así, según la clasificación de Yerdel, la mortalidad a 30días es del 2,34, del 5, del 8,6 y del 27% y la mortalidad al año es del 13, del 35, del 33 y del 50% para los gradosi, ii, iii y iv, respectivamente.
En cuanto a la morbilidad1-3,52-54, la evidencia más sólida reside en la mayor probabilidad de re-trombosis en el postrasplante (10,3% de los casos), aunque su incidencia también estaría en relación con los grados de Yerdel: 3,5, 10,7, 22,2 y 17% para los gradosi, ii, iii y iv, respectivamente. La re-trombosis precoz puede conducir a la pérdida del injerto, por lo que parece razonable recomendar la anticoagulación, sobre todo en los grados severos. Sin embargo, no hay evidencia clínica para indicar qué tipo de anticoagulación ni durante cuánto tiempo. Otras complicaciones dignas de mención son la hemorragia gastrointestinal secundaria a la persistencia de hipertensión portal (sobre todo en relación con las técnicas extraanatómicas), la ascitis, la insuficiencia renal y la sepsis.
Aunque los resultados de las series asiáticas56,57 demuestran buenos resultados con una buena planificación de la estrategia quirúrgica, en general, el gradoiv de Yerdel, que requiere técnicas extraanatómicas complejas, no debería constituir una indicación de trasplante hepático de donante vivo.
RECOMENDACIONES- 1
La trombosis portal es un factor de riesgo para la realización del trasplante hepático, pero no puede considerarse una contraindicación absoluta, ni siquiera en sus formas más extensas (trombosis de tipoiv de la clasificación de Yerdel). Grado de evidencia I-B.
- 2
El estudio mediante técnicas de imagen (ecografía doppler y angio-TAC) debe formar parte de modo obligado del protocolo de evaluación de los potenciales receptores de trasplante hepático. Grado de evidencia I-A.
- 3
No hay evidencias sólidas sobre las pautas de anticoagulación en pacientes en lista de espera con trombosis portal, aunque de hacerse, se recomienda que su administración sea precoz con respecto del momento del diagnóstico. Grado de evidencia II-B.
- 4
No hay evidencias sobre la eficacia de la implantación de TIPS en pacientes en lista de espera con trombosis portal, que de llevarse a cabo requerirían equipos con elevada experiencia para evitar dificultades técnicas durante la cirugía. Grado de evidencia III-B.
- 5
La supervivencia de los pacientes trasplantados con trombosis portal completa (gradoiv) es reducida, pero no existe consenso en que de modo aislado implique la exclusión del candidato de la lista de espera. Grado de evidencia III-B.
- 6
La trombosis portal gradoiv requiere una exhaustiva planificación y manejo en unidades de trasplante con suficiente experiencia previa en técnicas de reconstrucción extraanatómicas. Grado de evidencia III-B.
La obesidad es una patología de incidencia creciente en la población general58. España se sitúa en una zona endémica intermedia, con una prevalencia del 10-15% entre los varones y del 15-20% entre las mujeres. Entre los pacientes en lista de espera de trasplante hepático la prevalencia de candidatos con un IMC>30% alcanza tasas entre el 15 y el 35%59-61. Además, entre el 45 y el 64% de todos los pacientes trasplantados hepáticos irán ganando peso de forma progresiva durante los 3-5 primeros años postrasplante, y hasta un 30% se convertirán en obesos. Existe un único metaanálisis62 que analiza un total de 316 artículos publicados en los últimos 20años, de los cuales solo 13 cumplen los criterios de calidad establecidos. No obstante, las recomendaciones extraídas de este metaanálisis tienen un bajo grado de evidencia, ya que todos ellos son retrospectivos y la definición de obesidad no es homogénea.
Abordaje de la obesidad en el candidato a trasplanteLa evaluación nutricional en el candidato a trasplante hepático con hepatopatía terminal es difícil, ya que los parámetros convencionales nutricionales no son siempre aplicables. Casi todos los autores coinciden en que tanto la desnutrición como el sobrepeso son de difícil manejo en el candidato a trasplante hepático63,64. A falta de una clasificación de la obesidad ajustada a la presencia de ascitis, anasarca e hipoalbuminemia dilucional65, la clasificación más aceptada es la de la OMS66, que define el sobrepeso cuando el IMC está entre 25-30kg/m2, la obesidad moderada (clasei) cuando el IMC es de 30-35kg/m2, obesidad severa (claseii) cuando el IMC es de 35-40kg/m2, y obesidad mórbida (claseiii) cuando el IMC>40kg/m2.
No hay consenso sobre un grado de obesidad máximo para acceder a la lista de espera de trasplante hepático, y de hecho ningún autor la considera per se como una contraindicación absoluta. La guía de práctica clínica americana67 establece que el IMC>40kg/m2 es una contraindicación relativa (grado de evidencia II-B).
Diferentes estudios demuestran con un grado de evidencia I-B que los obesos de clasei o superior, según la clasificación de la OMS, han de seguir consejo dietético y nutricional por especialistas en nutrición5. Algunos autores han querido reclamar el impacto que tiene el intervencionismo dietético y nutricional sobre los pacientes en lista de espera, pero solo lo han podido demostrar en casos de desnutrición61. En pacientes con un IMC>45kg/m2 persistente, los resultados de supervivencia para varones (HR: 1,52; IC95%: 1,03-2,24; p=0,035) y mujeres (HR: 0,99; IC95%: 0,65-1,5; p=0,96), fueron bastante similares a los que disminuyeron su IMC<45kg/m2.
No hay consenso ni suficiente experiencia para recomendar un intervencionismo más agresivo, como la cirugía bariátrica en lista de espera. Los estudios descritos hasta la fecha67,68 son retrospectivos, de muy escaso número de pacientes y con casos muy seleccionados, con un periodo ventana entre la cirugía bariátrica y el trasplante de más de un año. La cirugía bariátrica podría tener un papel en pacientes en fases muy precoces de su hepatopatía69, pero no estaría indicada en fases avanzadas de la misma70. Otra opción descrita por algunos autores es la realización de la cirugía bariátrica al finalizar el trasplante hepático71, o meses después del trasplante72,73. En ambos casos se requiere una excelente planificación del procedimiento y del tipo de cirugía bariátrica, para evitar complicaciones como pérdida excesiva de peso, malabsorción de nutrientes e inmunosupresores con mayor riesgo de rechazo, o inaccesibilidad al duodeno y a la vía biliar.
Abordaje de la obesidad en el postrasplante hepáticoLa ganancia ponderal progresiva entre los pacientes trasplantados hepáticos es una realidad sin una clara explicación científica74. Según el registro de diabetes y enfermedades renales (NIDDK) de la base de datos de trasplante hepático en Estados Unidos (SRTR), la ganancia ponderal es de 1kg por año de trasplante75,76. En nuestro medio60 la ganancia ponderal también es de 1kg por año, siendo progresiva durante los 5 primeros años y siendo máxima entre el primer y el segundo años59.
La obesidad postrasplante alcanza al 18-30% de todos los pacientes, según los diferentes autores77, pero aquellos que han sido trasplantados por esteatohepatitis no alcohólica requieren un control muy estricto de la obesidad y el síndrome metabólico, ya que es la patología que tiene una mayor incidencia de ganancia ponderal75.
La supervivencia postrasplante de pacientes obesos tiene resultados contradictorios62,78-80. Mientras algunos autores reportan mayor mortalidad en los pacientes obesos, otros autores demuestran la misma supervivencia. La razón de esta discrepancia podría explicarse, como dice M.T. Foster81, por el hecho de que, en el tema de la obesidad, la calidad es más importante que la cantidad. En cambio, casi todos los autores78 son unánimes en afirmar que el paciente obeso sometido a trasplante hepático requiere mayor estancia hospitalaria, y en UCI80 tiene mayor incidencia de infecciones y de síndrome metabólico79. Tampoco hay estudios que demuestren la mejor pauta inmunosupresora en pacientes obesos sometidos a trasplante hepático.
Como conclusión, y de acuerdo con la revisión de Charlton75, podemos consensuar que la obesidad per se no es una contraindicación absoluta para el trasplante hepático. Sin embargo, es necesario hacer una valoración exhaustiva de la presencia de otras comorbilidades, como diabetes mellitus, hipertensión arterial, dislipidemia y antecedentes cardiovasculares en pacientes añosos, ya que el efecto aditivo de todas estas variables influye negativamente en la supervivencia82.
RECOMENDACIONES- 1
La obesidad no es una contraindicación absoluta para el trasplante hepático, pero debe realizarse una evaluación exhaustiva de factores de riesgo y comorbilidad por su impacto negativo en la supervivencia. Grado de evidencia II-B.
- 2
No se ha demostrado que el intervencionismo dietético y nutricional sobre el paciente en lista de espera mejore los resultados del trasplante hepático. Grado de evidencia II-B.
- 3
Los resultados obtenidos hasta el momento actual no permiten recomendar un tipo de técnica, ni un momento concreto (pre, intra o postrasplante), para un eventual tratamiento quirúrgico de la obesidad en el paciente candidato a un trasplante hepático. Grado de evidencia III-B.
La enfermedad coronaria se ha descrito en el 16,2 al 60% de los pacientes potencialmente candidatos a trasplante hepático, y su presencia aumenta la morbimortalidad peri y postoperatoria83-85. La diabetes mellitus es el factor de riesgo asociado de mayor importancia. El cribado de la enfermedad coronaria debe incluirse en el protocolo de evaluación pretrasplante, especialmente en este grupo de pacientes, en los que se recomienda la realización de angiografía coronaria86.
En pacientes sin factores de riesgo la incidencia de complicaciones cardiacas en el curso del trasplante hepático es baja, pero es difícil conocer la prevalencia de enfermedad coronaria, basada solo en pruebas no invasivas, ya que no se conoce bien la sensibilidad de las mismas, que solo podría testarse frente al patrón oro de la coronariografía87.
Se ha propuesto la realización de coronariografía en aquellos candidatos de alto riesgo, definiendo estos como aquellos que reúnan más de 2 factores de riesgo, de acuerdo con la AHA/ACCF (diabetes mellitus, cardiopatía previa, hipertrofia ventricular izquierda, edad superior a 60años, tabaquismo, hipertensión arterial y dislipidemia)88. La TC coronaria puede detectar calcificaciones y estenosis en los vasos coronarios, pero no se conoce bien su precisión diagnóstica en estudios comparativos con la angiografía coronaria87,89,90. Se ha descrito una asociación entre la etiología cirrótica de causa criptogenética o asociada a esteatohepatitis no alcohólica con la aparición de isquemia miocárdica postoperatoria91. En este estudio, un análisis de regresión logística reveló 3 factores de riesgo relacionados con la aparición de síndrome coronario agudo postrasplante (edad, historia de cardiopatía isquémica y requerimientos pretrasplante de vasopresores). Por otra parte, un análisis multivariante identificó la puntuación MELD y el desarrollo de fallo renal agudo como variables asociadas a mortalidad global de causa cardiológica. Esta información puede ser de utilidad para seleccionar pacientes en los que profundizar en el estudio cardiológico.
RECOMENDACIONES1. Los pacientes candidatos a trasplante hepático deben ser evaluados para descartar enfermedad coronaria. En receptores con acumulación de factores de riesgo, debe considerarse la realización de coronariografía. Grado de evidencia I-A.
ESCENARIOS DE INMUNOSUPRESIÓNCoordinadores: José Ignacio Herrero y Evaristo Varo
En la V Reunión de Consenso se consideraron 4 escenarios en los que la inmunosupresión puede desempeñar un papel importante: las neoplasias de novo, la hepatitisC, el hepatocarcinoma (HCC) y la insuficiencia renal.
Neoplasias de novoLos receptores de trasplantes de órganos sólidos tienen mayor riesgo de desarrollar neoplasia maligna que la población general, sobre todo a medio y largo plazo92. Además, las neoplasias de novo son una causa importante de morbimortalidad tras el trasplante hepático93,94.
El papel de la inmunosupresión en las neoplasias de novo se evaluó en 2 escenarios diferentes: 1)cambios en la inmunosupresión para intentar prevenir el desarrollo de neoplasias de novo, y 2)cambios en la inmunosupresión en los pacientes que ya han desarrollado una neoplasia.
La primera actuación para prevenir el desarrollo de neoplasias de novo debe ser actuar sobre los factores generales de riesgo de neoplasia, como tabaco, alcohol o radiación solar, que son importantes en la población general y en los pacientes trasplantados (publicaciones sobre tabaco, alcohol, radiación solar). La actuación sobre estos factores es eficaz para disminuir el riesgo de neoplasia, como lo demuestra el hecho que los pacientes trasplantados que dejan de fumar tienen un menor riesgo de desarrollo de neoplasia95.
Diversos estudios han valorado la influencia del tipo de inhibidor de calcineurina (ICN) utilizado ciclosporina o tacrolimus en el riesgo de desarrollo de neoplasias, si bien los resultados son contradictorios Así, algunos estudios sugieren mayor incidencia de neoplasias de novo en los pacientes tratados con tacrolimus96,97, mientras que otros estudios la encuentran con la ciclosporina97. Ante la ausencia de evidencia no puede recomendarse qué ICN utilizar para disminuir el riesgo de neoplasia de novo postrasplante.
El papel oncogénico de los agentes antilinfocitarios (OKT3 y ATG) se conoce desde hace años. Su uso se asocia a mayor riesgo de neoplasias en general97 y de linfomas en particular98. Por ello, se recomienda evitar su uso. Esta recomendación no es extensiva a los anticuerpos monoclonales frente a CD25 (basiliximab y daclizumab).
Los inhibidores de mTOR (mammalian target of rapamycin [imTOR]) —sirolimus y everolimus— tienen capacidad antiproliferativa y se usan como quimioterápicos en pacientes con cáncer. Por ello, se han depositado muchas esperanzas en que la inmunosupresión utilizando estos fármacos suponga un menor riesgo de desarrollo de neoplasia. Los pacientes que reciben inmunosupresión con imTOR tienen menos riesgo de desarrollo de neoplasias cutáneas no melanóticas, tanto en trasplante hepático99 como en trasplante renal100, pero este hecho no justifica su uso en la inmunosupresión inicial en todos los pacientes, ya que este tipo de lesiones muy raramente son mortales101. El efecto de estos fármacos sobre el desarrollo de neoplasias no cutáneas es mucho menos claro102. En ensayos clínicos de varios años de seguimiento y con números importantes de pacientes no se han evidenciado diferencias en la incidencia de neoplasias no cutáneas entre pacientes tratados con imTOR y en pacientes que mantienen el tratamiento con ICN100.
No está claro que la intensidad del tratamiento inmunosupresor se asocie a una mayor o menor prevalencia de neoplasia. Algunos estudios sugieren que un tratamiento inmunosupresor más potente puede predisponer a un mayor riesgo de neoplasia98,103. Además, algunos efectos secundarios de la inmunosupresión son dosis-dependientes, como la toxicidad renal, diabetes, dislipidemia, hipertensión arterial. Por ello, la recomendación es evitar una inmunosupresión excesiva.
En pacientes que han desarrollado una neoplasia postrasplante se puede, en algunos casos, plantear cambios en la inmunosupresión, con un efecto beneficioso sobre la evolución posterior. En los pacientes con sarcoma de Kaposi la sustitución de ICN por imTOR influye favorablemente sobre la enfermedad104. También, en los pacientes con linfoma postrasplante, la reducción de la potencia inmunosupresora se asocia a una mejor evolución105. En todos los casos, la reducción de la inmunosupresión debe hacerse de forma individualizada, teniendo en cuenta el tiempo transcurrido desde el trasplante.
En los pacientes con cáncer de piel no melanótico, la sustitución de ICN por imTOR reduce el riesgo del desarrollo de un segundo cáncer de piel106. Sin embargo, debe valorarse el riesgo inmunológico, y no se considera justificado este cambio de inmunosupresión rutinariamente en todos los pacientes, ya que el cáncer de piel no melanótico no supone un riesgo vital para el paciente.
Por último, aunque en la práctica clínica es frecuente la sustitución de ICN por imTOR en los pacientes que han tenido un tumor sólido107, la ausencia de evidencia científica de su utilidad no permite hacer una recomendación. Cuando se usa esta estrategia debe tenerse en cuenta la posible interferencia con el tratamiento antineoplásico, ya que los imTOR pueden aumentar la aplasia medular causada por los quimioterápicos. Por otro lado, puesto que inhiben la cicatrización, pueden dar lugar a complicaciones en caso de tratamiento quirúrgico.
RECOMENDACIONES1. En pacientes que no han desarrollado neoplasia:
- •
Debe actuarse sobre los factores de riesgo de neoplasia. Grado de evidencia I-A.
- •
Debe evitarse el uso de globulinas antilinfocíticas (OKT3 y ATG). Grado de evidencia II-A.
- •
En general, debe evitarse una inmunosupresión excesiva. Grado de evidencia I-A.
- •
No puede recomendarse el uso de un inhibidor de calcineurina (ciclosporina o tacrolimus) sobre otro. Grado de evidencia I-B.
- •
No puede recomendarse el uso generalizado de sirolimus o everolimus. Grado de evidencia II-A.
2. En pacientes que han desarrollado neoplasia:
- •
En pacientes con sarcoma de Kaposi los inhibidores de calcineurina deben sustituirse por everolimus o sirolimus.
- •
En pacientes con síndromes linfoproliferativos postrasplante debe intentar reducirse la inmunosupresión.
No puede recomendarse el uso generalizado en sirolimus o everolimus.
La historia natural de la hepatitisC tras el trasplante hepático es más acelerada que en la población general. Uno de los factores que influyen en esta evolución más acelerada es el tratamiento inmunosupresor. En este sentido, la conferencia de consenso de la SETH de 2010108 y otras revisiones109 han evaluado el papel de los distintos inmunosupresores en la gravedad de la recidiva de la hepatitisC. Las conclusiones de la anterior sesión de consenso siguen siendo válidas: 1)no puede recomendarse la utilización de un ICN determinado (ciclosporina o tacrolimus) por su influencia sobre la evolución postrasplante de la hepatitisC; 2)debe evitarse el uso de altas dosis de esteroides para el tratamiento de episodios leves de rechazo, porque se asocian a recidivas más agresivas; 3)pueden utilizarse regímenes libres de esteroides, pero cuando se usan esteroides deben interrumpirse de forma progresiva, no antes del sexto mes postrasplante, y 4)no hay evidencia de que micofenolato mofetil o los anticuerpos frente a CD25 influyan sobre la evolución de la recidiva de la hepatitisC. En general, la recomendación global de la sesión de consenso de 2010 fue evitar una inmunosupresión excesiva, haciendo especial hincapié en evitar el uso de altas dosis de esteroides.
Los tratamientos frente a la infección por el virus de la hepatitisC con los nuevos antivirales de acción directa cambiarán totalmente esta situación110. Su gran eficacia, con tasas de respuesta viral sostenida por encima del 80-90%, cambiarán el pronóstico de la hepatitisC postrasplante, ya que la respuesta al tratamiento antiviral tras el trasplante se asocia a una evidente mejoría de la supervivencia111. Por ello, la recomendación fundamental es que los candidatos a trasplante hepático puedan recibir tratamiento con los nuevos antivirales de acción directa antes y/o después del trasplante hepático. En una situación de plena disponibilidad de antivirales de acción directa es previsible que la influencia del tratamiento inmunosupresor sobre la evolución de la recidiva postrasplante de la hepatitisC sea mínima.
RECOMENDACIONES- 1.
Evitar un exceso de medicación inmunosupresora. Grado de evidencia I-A.
- 2.
No existe un inhibidor de calcineurina con ventajas frente a la infección por VHC. Grado de evidencia I-B.
- 3.
Las dosis de esteroides deben escalonarse con una reducción progresiva postrasplante. Grado de evidencia I-A.
- 4.
La introducción de nuevos fármacos antivirales modificará la influencia de la medicación inmunosupresora en pacientes con hepatitisC. Grado de evidencia III.
El HCC es una de las principales indicaciones de trasplante en España, llegando a más del 20% de los trasplantes anuales. Así mismo, es el órgano que más frecuentemente se trasplanta por un tipo de cáncer. Por ello, el manejo inmunosupresor en estos pacientes debería ser peculiar y especialmente individualizado.
En estudios retrospectivos se ha objetivado una correlación directa entre los niveles elevados de ICN durante los primeros meses postrasplante y el riesgo de recidiva tumoral en los pacientes trasplantados de acuerdo con los criterios de Milán112. Por eso, se aconseja evitar la sobredosificación de los ICN, aconsejándose niveles valle de tacrolimus <10ng/ml y de ciclosporina <300ng/ml113.
El papel de la inmunosupresión en el HCC se evaluó en 2 escenarios diferentes:
Papel de los imTOR en la prevención de la recidiva del hepatocarcinomaVarios estudios retrospectivos y revisiones sistemáticas muestran que los imTOR reducen el riesgo de recidiva tumoral en los pacientes con HCC. Sin embargo, la evidencia científica es muy baja114,115.
Se ha generalizado en la práctica clínica el uso de imTOR en los pacientes con HCC de alto riesgo de recidiva (alfa-fetoproteína >200ng/ml, HCC que exceden los criterios de Milán en la pieza de explante, invasión vascular, tumor pobremente diferenciado). A pesar de ello, no se ha demostrado que esta práctica clínica suponga un beneficio para el paciente.
No existe evidencia científica suficiente para recomendar el uso generalizado de inhibidores de mTOR para reducir el riesgo de recidiva del HCC en el postrasplante hepático116.
Papel de los imTOR en el tratamiento de la recidiva del hepatocarcinomaNo hay evidencia de que el uso de los imTOR mejore el pronóstico de los pacientes con recidiva de HCC.
Hay pequeñas series en las que la combinación de imTOR y sorafenib se ha usado con seguridad117. No existen ensayos clínicos que demuestren un beneficio en la supervivencia.
RECOMENDACIONES- 1.
Evitar dosis elevadas de inhibidor de calcineurina en el primer mes postrasplante. Grado de evidencia I-A.
- 2.
No existe evidencia suficiente para recomendar el uso de imTOR para la prevención de la recidiva tumoral. Grado de evidencia II-B.
- 3.
No existe evidencia suficiente para recomendar el empleo de imTOR en el tratamiento de la recidiva tumoral postrasplante. Grado de evidencia II-B.
Los candidatos a trasplante hepático tienen con frecuencia cierto grado de insuficiencia renal, ya sea insuficiencia renal funcional, glomerulonefritis asociada a ciertas enfermedades hepáticas (como glomerulonefritis mesangial y cirrosis etílica o glomerunoferitis membranoproliferativa y hepatitisC) o en relación con otras patologías, como nefroangiosclerosis o nefropatía diabética.
La disfunción renal postrasplante hepático es frecuente y tiene efectos adversos sobre la calidad de vida y la sobrevida del paciente. Varios fármacos que se administran de forma rutinaria después del trasplante pueden contribuir a ella. Los ICN pueden producir una reducción reversible del flujo sanguíneo renal y del filtrado glomerular. Este efecto reversible se debe a una vasoconstricción relativa de las arteriolas aferentes glomerulares. Se trata de un efecto fisiológico que de algún modo está relacionado con la concentración plasmática, y la mayoría de las veces es totalmente reversible. El uso de ICN también puede asociarse a fibrosis intersticial renal progresiva y pérdida tubular, y la toxicidad puede acelerarse si existe una patología renal subyacente, hecho que es relativamente frecuente debido al incremento de edad de los receptores. Además, los ICN pueden influir indirectamente sobre la disfunción renal, induciendo hipertensión y alteraciones en la regulación de la glucemia118. También se ha demostrado que los imTOR prolongan la recuperación del daño por isquemia/reperfusión, posiblemente debido a una inhibición de los factores de crecimiento epitelial y endotelial. Aparte de sus efectos directos, los imTOR acentúan la toxicidad de los ICN a través de mecanismos que todavía no se conocen bien. La combinación de un ICN, especialmente ciclosporina, y un imTOR disminuye la **GFR en mayor medida que un ICN solo, y en modelos animales esta combinación aumenta la fibrosis renal asociada al ICN. Por último, los imTOR se asocian a proteinuria y a empeoramiento significativo de la proteinuria preexistente. Esto podría asociarse a toxicidad directa a nivel de podocitos o a toxicidad indirecta, mediante la alteración de la reparación vascular glomerular119.
La incidencia de disfunción renal grave puede llegar a ser del 18% a los 5años postrasplante hepático120, e incluso mayor con el paso del tiempo. La prevención de la insuficiencia renal debe comenzar por el control de los factores de riesgo, como diabetes o hipertensión arterial. En relación con la inmunosupresión, deben analizarse 2 cuestiones fundamentales:
A. Momento del cambio de inmunosupresión en la prevención o tratamiento de la insuficiencia renal
- •
En los pacientes con insuficiencia renal previa al trasplante o en pacientes con alto riesgo de insuficiencia renal postoperatoria se aconseja la reducción de dosis/retraso en el inicio de los ICN, usando (o no) anticuerpos mono- o policlonales y/o micofenolato mofetil (MMF).
- •
Hay evidencia de que la pauta anterior es beneficiosa para la preservación de la función renal a corto y medio plazo, pero no hay consenso acerca de su uso generalizado, fundamentalmente por la falta de estudios acerca de su repercusión global.
B. Uso de imTOR o MMF en la prevención o en el tratamiento de la disfunción renal postrasplante hepático
- •
Las pautas en las que se reducen los ICN utilizando MMF o imTOR (este último a partir del primer mes) han demostrado su eficacia en la preservación de la función renal a medio plazo.
- •
No hay evidencia de que una de estas 2 pautas sea superior a la otra, si bien los pacientes con proteinuria significativa (>0,5g/día) no deberían ser tratados con imTOR, salvo en circunstancias especiales.
- •
A largo plazo es posible reducir o interrumpir los ICN y tratar con monoterapia con MMF o imTOR, teniendo en cuenta que esta estrategia se asocia a un mayor riesgo de rechazo121-123.
- 1.
En receptores con disfunción renal pretrasplante o con factores de riesgo de desarrollar insuficiencia renal postrasplante se recomiendan esquemas de inmunosupresión de protección renal. Grado de evidencia I-A.
- 2.
En esquemas de protección renal no existe diferencia entre el empleo de MMF e imTOR, pudiendo quedar ambos en monoterapia a medio y largo plazo. Grado de evidencia II-A.
Coordinadores: Emilio Ramos Rubio y Martín Prieto Castillo
Este documento resume la práctica clínica habitual y las recomendaciones de los grupos de trasplante hepático (TH) españoles en relación con el «manejo» en lista de espera de TH de los pacientes con HCC.
Las conclusiones y recomendaciones se establecieron mediante la discusión en una reunión presencial con revisión de la bibliografía reciente y las respuestas a un cuestionario elaborado al efecto.
IntroducciónLos temas relacionados con el manejo de los pacientes con HCC en lista de espera de trasplantes son fundamentalmente la priorización, el tratamiento en lista y la rutina de seguimiento. Además, se añadieron a la discusión 2 temas más específicos:
- -
Condiciones de retirada de la lista y actitud frente a pacientes que presentan progresión tumoral, más allá de los criterios de Milán.
- -
Actitud frente a pacientes resecados, pero trasplantables, que presentan criterios histológicos de mal pronóstico en la pieza de resección.
En la literatura no existen evidencias sólidas acerca de cuáles deben ser los protocolos de actuación más adecuados para cada uno de estos temas. Por otra parte, probablemente no exista un protocolo de actuación único e ideal aplicable a todas las poblaciones o grupos de trasplante, ya que en su idoneidad pueden influir aspectos como el número de pacientes en lista de espera, el porcentaje de pacientes con HCC y el tiempo de espera en cada una de las unidades.
Otro aspecto a tener en cuenta y que dificulta la obtención de un consenso es que no todos los grupos españoles aplican los mismos criterios de indicación de TH para los pacientes con HCC. Algunos grupos aplican una moderada ampliación de criterios de Milán para la inclusión en lista y otros no excluyen sistemáticamente del TH a los pacientes que progresan en lista de espera más allá de dichos criterios.
Priorización en lista de esperaLa aplicación del MELD en la priorización de pacientes en lista de espera ha obligado a introducir excepciones al mismo para dar oportunidad de ser trasplantados a los pacientes que presentan una buena función hepática. Los pacientes con HCC representan el paradigma de esta situación. La sistemática habitual consiste en identificar una puntuación MELD que asegure una igualdad de oportunidades de trasplante entre pacientes con patología tumoral y no tumoral124. Esta puntuación se otorga a los casos de HCC con más riesgo de progresión tumoral y, por lo tanto, de ser excluidos de la lista de espera (drop-out). Esta sistemática tiene el inconveniente de que una misma puntuación no es aplicable a todas las poblaciones, y probablemente la puntuación ideal pueda variar a lo largo del tiempo. En este aspecto influye, con seguridad, el significativo aumento de la incidencia de pacientes con HCC en determinadas áreas geográficas.
El sistema de priorización de la UNOS divide a los pacientes que cumplen los criterios de Milán en 2 estadios: T1 (una lesión <2cm) y T2 (lesión única de 2 a 5cm o 2-3 lesiones todas ellas ≤3cm). En la actualidad, y después de varias modificaciones del sistema de priorización, solo los pacientes en estadio T2 son priorizados por la UNOS, recibiendo 22 puntos, lo que es equivalente a un riesgo de mortalidad del 15% a los 3meses. A pesar de ello, los datos sugieren que los pacientes con HC tienen más posibilidades de recibir un injerto que los pacientes con patología benigna. En la opinión de Mehta et al.125, deberían excluirse también de la priorización un subgrupo de pacientes T2 con bajo riesgo de drop-out (1,6% a los 2años). Este subgrupo, que representa alrededor del 20% de los casos, se puede identificar por las siguientes características: diámetro de 2 a 3cm, respuesta completa al tratamiento locorregional (TLR) y valores de alfa-fetoproteína (AFP) ≤20ng/ml.
En el ámbito europeo, la conferencia de consenso que se realizó en Zúrich sobre TH en pacientes con HCC126 no estableció ninguna recomendación en cuanto a la priorización de los pacientes en lista de espera. En cuanto a España, en una encuesta realizada en 17 grupos de trasplante127, 15 decían aplicar algún tipo de priorización en pacientes con HCC. La mayoría utilizaba el sistema MELD y se adjudicaban más puntos a los pacientes con tumores múltiples o solitarios de más de 3cm. La puntuación se incrementaba al prolongarse el tiempo en lista de espera.
Como alternativa a la aplicación del score MELD, se ha propuesto el cálculo de una puntuación específica para cada paciente con HCC mediante la aplicación de una fórmula matemática. De esta manera se obtiene un continuum de puntuaciones que pretende establecer de manera más real el riesgo de progresión de cada paciente. En la publicación de Toso et al.128 el score se elabora mediante una ecuación que incluye las siguientes variables: edad, MELD, diagnóstico, número de nódulos de HCC, tamaño y valores de AFP.
Los autores consideran que la ecuación propuesta podría no ser aplicable en todas poblaciones y pudiera requerir un ajuste si cambian las condiciones de la lista de espera. Por otra parte, la puntuación MELD y la calculada con esta ecuación no son compatibles, por lo que es necesario establecer una correlación en función de la predicción del riesgo de drop-out. Se calcula así el denominado «dropout equivalent MELD» (deMELD), cuya capacidad de predicción de progresión tumoral fue validada posteriormente en un estudio realizado por los mismos autores129.
Además del perjuicio que se ocasiona a los pacientes con patología no tumoral, uno de los inconvenientes de caer en una «priorización excesiva» de los pacientes con HCC es que puede asociarse a un empeoramiento de los resultados de supervivencia y recidiva130 después del TH. Recientemente se han publicado algunos artículos que sugieren que un tiempo corto en lista de espera de los pacientes con HC se asocia a un mayor riesgo de recidiva131. En el estudio de Samoylova et al.132 la incidencia de recidiva al año fue inferior en los pacientes que estuvieron en lista de espera durante más de 120días (2,2% vs 3,9%; p=0,002), por lo que los autores recomiendan que los pacientes con HC permanezcan un periodo mínimo en lista de espera de 3meses. Sin embargo, la publicación de Bitterman et al.133, en la que se analizan datos de la **OPTN, no encuentra que la prolongación del tiempo en lista de espera favorezca una selección de tumores con características histológicas más favorables.
RECOMENDACIONES- 1.
El consenso entre los grupos españoles es que los pacientes en lista de espera de trasplante hepático con tumores con alto riesgo de drop-out deben recibir algún tipo de priorización para evitar su salida de la lista por progresión tumoral. La definición más aceptada de tumor de «alto riesgo» incluye los hepatocarcinomas solitarios de más de 3cm de diámetro y los tumores multinodulares. Sin embargo, no hay consenso en considerar el fracaso de la aplicación de al menos 2 tratamientos locorregionales como un criterio de priorización. Tampoco existe consenso en la actitud frente a los pacientes de bajo riesgo, que son priorizados por algo más del 50% de los grupos. Grado de evidencia I-A.
- 2.
Para la gestión de la priorización se recomienda utilizar la puntuación MELD, asignando un valor que favorezca la equidad en la posibilidad de ser trasplantado entre pacientes tumorales y pacientes con patología benigna. No es posible establecer una puntuación concreta aplicable en todas las situaciones, pero las utilizadas habitualmente en la práctica están entre los 15 y los 19 puntos. Algunos grupos incrementan periódicamente dicha puntuación al prolongarse el tiempo en lista. Grado de evidencia I-B.
- 3.
Considerando la dificultad que implica establecer una puntuación que asegure la condición de equidad, se recomienda comparar periódicamente la incidencia de drop-outs entre pacientes con hepatocarcinoma y con patología benigna. No hay datos para establecer con qué periodicidad debe hacerse la revisión de resultados, y por tanto cada grupo debe valorarlo en función de los posibles cambios que sufra la situación de su lista de espera. Grado de evidencia III.
- 4.
Cuando el tiempo en lista de espera es de corta duración, se considera razonable gestionar la priorización basándose en criterios clínicos, ya que la aplicación rígida de la puntuación MELD no ofrece probablemente ninguna ventaja. Grado de evidencia III.
- 5.
Finalmente, no existe ninguna evidencia consistente para recomendar un tiempo de observación mínimo previo al TH para los pacientes que cumplan los criterios de Milán. Grado de evidencia II-B.
En relación con el tratamiento en lista de espera, a pesar de que no hay evidencias sólidas de su eficacia, en la actualidad sigue recomendándose la quimioembolización (QE) o la radiofrecuencia (RF) en caso de tumores con riesgo alto de recidiva (T2 de la UNOS) y cuando el tiempo estimado en lista de espera va a ser superior a 6meses134. Esta es la recomendación n.°24 de la conferencia de consenso de Zúrich, y tiene probablemente más relevancia en el caso de pacientes con tumores con un tamaño cercano a los 5cm o con niveles elevados de AFP135.
No hay evidencias consistentes a favor del tratamiento neoadyuvante de los tumores con bajo riesgo de progresión135. La recomendación n.°23 de la conferencia de consenso de Zúrich establece que «ante la ausencia de evidencia sólida, no es posible realizar ninguna recomendación en cuanto al «tratamiento puente» en lista de espera de los pacientes en estadio T1 de la UNOS». A pesar de ello, muchos grupos tratan sistemáticamente a todos los pacientes cuyo tiempo en lista de espera se prevé prolongado.
Según la recomendación n.°25 de la conferencia de consenso de Zúrich126 no hay datos que permitan establecer cuál es el mejor método terapéutico neoadyuvante. Sin embargo, los procedimientos de destrucción tumoral consiguen necrosis completa en un mayor porcentaje de casos136-138. Por este motivo, suelen preferirse cuando su aplicación es posible135. Otros TLR, como la **RDT externa o la utilización de esferas de Y-90, requieren más estudios.
En un artículo reciente de DuBay et al.139 la aplicación de RF como terapia puente al TH no proporcionó ninguna ventaja significativa en cuanto a la proporción de drop-outs o recidiva tumoral después del TH. La evolución postTH dependió principalmente de la estadificación tumoral en el explante. Sin embargo, hay que señalar que el grupo de pacientes tratados con RF tuvo un tiempo en lista de espera más prolongado.
Entre los 17 grupos españoles que respondieron a la encuesta antes mencionada137, 7 trataban a todos los pacientes con HCC en lista de espera y 10 solo a los T2 de la UNOS. La elección del método de tratamiento dependió del tamaño y del número de nódulos, aunque 2 de los grupos indicaban siempre QE.
La aplicación de un TLR seguida de un tiempo de observación se considera imprescindible para indicar el TH en pacientes con criterios expandidos. A partir de esta experiencia otros autores han recomendado la aplicación de esta misma estrategia para todos los pacientes con HCC, independientemente de su estadificación140, excepto en aquellos casos en los que no resulte posible aplicar un tratamiento ablativo.
Recientemente se ha sugerido que la administración de sorafenib en lista de espera pudiera retrasar la progresión tumoral en caso de tumores en estadio T2141. Sin embargo, algunas evidencias sugieren que esta estrategia se asocia a un aumento en la incidencia de complicaciones biliares y de rechazo agudo142.
RECOMENDACIONES- 1.
La recomendación de consenso es la de tratar a todos los pacientes cuyo tiempo estimado de espera sea superior a 6meses, independientemente de si el paciente presenta un HCC de alto o bajo riesgo de drop-out. En la práctica esto significa que la mayoría de pacientes de los grupos con tiempos de lista de espera prolongados recibirán tratamiento, mientras que los grupos con tiempos cortos en lista de espera indicarán tratamiento neoadyuvante con menos frecuencia. Grado de evidencia II-B.
- 2.
La mayoría de los grupos apoyan la utilización de los procedimientos de destrucción tumoral mediante radiofrecuencia o microondas siempre que lo permitan las características del tumor y del paciente. Con algunas excepciones, la QE se reserva para los pacientes con tumores multinodulares, de tamaño superior a 3cm o con contraindicaciones para la radiofrecuencia. La imposibilidad de realizar cualquier tipo de TLR no se debe considerar un criterio de priorización. Grado de evidencia II-B.
- 3.
Todos los grupos están de acuerdo en que la obtención de una necrosis completa y mantenida en el tiempo de tumores solitarios menores de 3cm no se debe considerar un motivo para excluir al paciente de la lista de espera. Grado de evidencia II-A.
- 4.
Finalmente, otra conclusión aceptada por todos los grupos es que no existen evidencias para recomendar el tratamiento con sorafenib en lista de espera. Grado de evidencia II-B.
En relación con este aspecto, existe acuerdo en la literatura científica acerca de la necesidad de aplicar un programa de seguimiento mediante técnicas de imagen en los pacientes en lista de espera. La recomendación n.°22 de la conferencia de consenso de Zúrich establece la necesidad de una monitorización periódica de los pacientes en lista de espera mediante TC dinámica o RM. Sin embargo, la revisión del grupo de trabajo de Kneteman et al.143 pone de manifiesto que esta recomendación no está basada en estudios específicos sino en los datos de la precisión de las diferentes técnicas de imagen, en el conocimiento de la historia natural del HCC y en los resultados de los programas de vigilancia. Se concluye que los pacientes en lista de espera deben ser monitorizados cada 3meses con TC multidetector con 3fases o RM. No hay todavía evidencias para recomendar la utilización de otras exploraciones, como la PET/TC.
También se ha destacado en diversas publicaciones la utilidad de realizar determinaciones periódicas de los valores de AFP. La recomendación n.°12 de la conferencia de consenso de Zúrich126 concluye que los niveles de AFP añaden información pronóstica relevante, pero no se establecen unos criterios de aplicación práctica.
Algunas evidencias sugieren que los pacientes con niveles elevados de AFP presentan con más frecuencia invasión vascular y tumores poco diferenciados, por lo que presentan un mayor riesgo de progresión tumoral144. Este podría ser un motivo para priorizar a los pacientes en lista de espera, En la encuesta realizada entre los grupos españoles en 2013127, 5 grupos consideraban como factor de priorización un nivel de AFP mayor de 200ng/ml. Sin embargo, una elevación más importante de los valores de AFP podría implicar una contraindicación para el TH o justificar la necesidad de mantener un periodo de observación después de la aplicación de un TLR.
En el estudio de Hameed et al.145, un nivel de AFP>1.000ng/ml que no se redujo a menos de 500ng/ml a pesar de la aplicación de un TLR resultó ser un marcador pronóstico negativo de la biología tumoral y se asoció a un riesgo elevado de recidiva postrasplante. Por lo tanto, esta circunstancia podría ser considerada como un criterio de exclusión para el TH. Según los autores, la aplicación de este criterio excluiría al 5% de los candidatos y lograría una reducción de la incidencia de recidiva del 20%. Sin embargo, el punto de corte con valor pronóstico más aceptado de los niveles de AFP se sitúa en 400ng/ml. En la revisión de Merani et al.146, los pacientes que presentaban niveles mayores de 400ng/ml en el momento de ser incluidos en lista pero en los que se logró una reducción de los mismos (<400ng/ml) mediante la aplicación de un TLR tuvieron unos resultados de supervivencia por intención de tratamiento similares a los obtenidos en pacientes con niveles de AFP siempre inferiores a 400ng/ml y mejores que aquellos en los que no se logró la reducción de los valores de AFP.
RECOMENDACIONES- 1.
Dadas las características de crecimiento habituales del hepatocarcinoma, se recomienda la reestadificación periódica de los pacientes en lista de espera, con una periodicidad mínima de 3meses. La exploración puede hacerse mediante TC helicoidal o RM. La TC toracoabdominal permite una estadificación más amplia, mientras que la RM tiene un valor añadido en la estadificación hepática. Algunos grupos apoyan la utilización de PET/TC, pero aún faltan datos sólidos que confirmen la utilidad de su aplicación sistemática. Grado de evidencia I-A.
- 2.
Se recomienda la determinación trimestral de los valores AFP en los pacientes en lista de espera. Una elevación «moderada» (200ng/ml) de los mismos representa para el 50% de los grupos un criterio de priorización. Sin embargo, hay un amplio consenso en considerar que una elevación por encima de 400ng/ml o un incremento rápido de los niveles de AFP deberían hacer sospechar una posible progresión tumoral. En esta situación debe realizarse una reestadificación y un seguimiento más estrecho. Finalmente, el 50% de los grupos considera que si los valores de AFP superan los 1.000ng/ml debe valorarse la exclusión temporal o definitiva de la lista de espera. Grado de evidencia II-B.
En esta situación, las posibles estrategias que pueden aplicarse son las siguientes: 1)la exclusión definitiva del paciente de la lista; 2)la aplicación de un TLR y, en caso de que el paciente vuelva a cumplir los criterios de Milán, reincluir al paciente en lista de TH, y 3)mantener al paciente en lista a pesar de la progresión siempre que no supere unos límites determinados.
La estrategia n.°2 es la propuesta en la recomendación n.°26 de la conferencia de consenso de Zúrich126 y en el artículo del grupo de trabajo de Kneteman et al.143. Esta estrategia se basa en que la respuesta al TLR se considera un buen dato para valorar la agresividad biológica de un tumor concreto. La valoración de la respuesta debería hacerse aplicando los criterios mRECIST136.
En la encuesta de 17 grupos españoles publicada en 2013127, 11 grupos excluían de la lista a los pacientes que progresaban más allá de los criterios habituales del grupo. En los otros 6, solo se excluían si aparecía invasión vascular macroscópica, enfermedad extrahepática o se observaba un rápido crecimiento tumoral.
RECOMENDACIONES- 1.
La recomendación de consenso es la de no excluir sistemáticamente a estos pacientes de lista de espera. Sin embargo, más del 50% de los grupos recomienda la exclusión temporal y la aplicación de tratamientos locorregionales. Si se logra que el paciente vuelva a cumplir los criterios de Milán según mRECIST, puede ser de nuevo incluido en lista después de un periodo de observación de 3 a 6meses. Grado de evidencia III.
- 2.
El resto de los grupos también consideran que deben aplicarse tratamientos locorregionales, pero no se excluye al paciente de la lista siempre que no se aprecie la presencia de enfermedad extrahepática, invasión vascular macroscópica, la enfermedad hepática no supere ampliamente los criterios de Milán (de manera tentativa se proponen como límite los criterios «up to seven») y el paciente mantenga un buen performance status. Grado de evidencia III.
La resección parece ser un tratamiento puente seguro antes del TH147, y podría tener aplicación en pacientes seleccionados con tiempos de espera previstos mayores de un año148. Sin embargo, en la actualidad es raramente usada con este objetivo.
Al contrario que los TLR, la resección permite obtener un estudio histológico completo del tumor, facilitando así una mejor valoración del riesgo de recidiva tumoral. Este conocimiento podría ser potencialmente útil para decidir si el paciente debe ser sometido únicamente a seguimiento o si debe ofrecerse el TH de manera preventiva. Aunque esta posibilidad es atractiva149,150, su aplicación en la práctica no parece estar muy extendida
En algunos países los pacientes resecados no pueden ser considerados para TH excepto si presentan una recidiva. Como consecuencia, y al contrario de lo que sucede con la radiofrecuencia, esta estrategia no puede ser aplicada. En la opinión de Majno et al.135, esta norma debería ser revisada.
En la encuesta publicada en 2013, solo 8 de los 17 grupos que dieron su opinión incluían directamente en lista de espera a los pacientes con datos histológicos de mal pronóstico.
RECOMENDACIONESDe la discusión establecida entre los grupos españoles de trasplante puede concluirse que alrededor del 50% de los grupos considera que la cirugía puede ser un tratamiento puente previo al TH en casos seleccionados. Por otra parte, en la actualidad, la casi totalidad de los grupos recomiendan la inclusión en lista de los pacientes con HCC resecados, que presentan signos histológicos de mal pronóstico en la pieza de resección. Estos pacientes no deben recibir otra priorización que la relacionada con los criterios morfológicos de su tumor. Grado de evidencia II-B.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
| Comité Científico de la Sociedad Española de Trasplante Hepático | |
| Secretario | |
| Javier Briceño Delgado | Hospital Universitario Reina Sofia |
| Vocales | |
| Itxarone Bilbao | Hospital Vall d’Hebron |
| Rubén Ciria Bru | Hospital Universitario Reina Sofia |
| José Luis Fernández Aguilar | Hospital Regional Universitario |
| Magdalena Salcedo | Hospital General Universitario Gregorio Marañón |
| Víctor Sánchez Turrión | Hospital Universitario Puerta de Hierro |
| Trinidad Serrano | Hospital Clínico Universitario Lozano Blesa |
| Participantes en la V Reunión de Consenso de la Sociedad Española de Trasplante Hepático | |
| Grupo 01 Receptores de riesgo elevado | |
| Coordinadores | |
| Itxarone Bilbao | Hospital Universitario Vall d’Hebron |
| Manuel de la Mata | Hospital Universitario Reina Sofía |
| Participantes | |
| Manuel Abradelo | Hospital Universitario 12 de Octubre |
| Isolina Baños Pérez | Hospital Universitario Puerta de Hierro |
| Asterio Barrera | Hospital Universitario Río Hortega |
| Manuel Barrera | Hospital Universitario Nuestra Señora de la Candelaria |
| David Calatayud | Hospital Universitario Clínic |
| Delia d’Avola | Clínica Universitaria de Navarra |
| José Luis Fernández Aguilar | Hospital Regional Universitario de Málaga |
| Francisco Galeano | Hospital Universitario Infanta Cristina |
| Francisco Agustín García Gil | Hospital Clínico Universitario Lozano Blesa |
| Daniel Garrote | Hospital Universitario Virgen de las Nieves |
| Mikel Gastaca | Hospital de Cruces |
| Manuel Gómez Gutiérrez | Hospital Universitario Juan Canalejo |
| Manuel López Santamaría | Hospital Universitario La Paz Infantil |
| Javier Nuño Vázquez-Daga | Hospital Universitario Ramon y Cajal |
| Ricardo Robles | Hospital Universitario Virgen de la Arrixaca |
| Gonzalo Rodríguez Laiz | Hospital General Universitario de Alicante |
| Juan Carlos Rodríguez Sanjuan | Hospital Universitario Marqués de Valdecilla |
| Angel Rubín | Hospital Universitario y Politécnico La Fe |
| José Manuel Sousa | Hospital Universitario Virgen del Rocío |
| Santiago Tomé | Hospital Clínico Universitario de Santiago de Compostela |
| F. Javier Xiol | Hospital Universitario de Bellvitge |
| Grupo 02 Escenarios de inmunosupresión | |
| Coordinadores | |
| José Ignacio Herrero | Clínica Universitaria de Navarra |
| Evaristo Varo | Hospital Clínico Universitario de Santiago |
| Participantes | |
| Victoria Aguilera | Hospital Universitario y Politécnico La Fe |
| José María Álamo | Hospital Universitario Virgen del Rocío |
| Pablo Bellot | Hospital General Universitario de Alicante |
| Javier Briceño | Hospital Universitario Reina Sofía |
| Lluís Castells | Hospital Universitario Vall d’Hebron |
| Gonzalo Crespo | Hospital Universitario Clínic de Barcelona |
| Valentín Cuervas-Mons | Hospital Universitario Puerta de Hierro |
| Emilio Fábrega | Hospital Universitario Marqués de Valdecilla |
| Luisa González Diéguez | Hospital Universitario Central de Asturias |
| Javier Graus | Hospital Universitario Ramon y Cajal |
| Paloma Jara | Hospital Universitario La Paz Infantil |
| Carlos Jiménez | Hospital Universitario 12 de Octubre |
| Miguel Jiménez | Hospital Regional Universitario de Málaga |
| Laura Lladó | Hospital Universitario de Bellvitge |
| Esther Molina | Hospital Clínico Universitario de Santiago |
| Isidoro Narvaez | Hospital Universitario Infanta Cristina |
| Jorge Ortiz de Urbina | Hospital de Cruces |
| Elena Otón | Hospital Universitario Nuestra Señora de la Candelaria |
| José Antonio Pons | Hospital Universitario Virgen de la Arrixaca |
| Magdalena Salcedo | Hospital Universitario Gregorio Marañón |
| Gloria Sánchez Antolín | Hospital Universitario Río Hortega |
| Trinidad Serrano | Hospital Clínico Universitario Lozano Blesa |
| Grupo 03 Manejo en lista del hepatocarcinoma | |
| Coordinadores | |
| Martín Prieto | Hospital Universitario y Politécnico La Fe |
| Emilio Ramos | Hospital Universitario de Bellvitge |
| Participantes | |
| Rafael Bañares | Hospital Universitario Gregorio Marañón |
| Rafael Bárcena | Hospital Universitario Ramon y Cajal |
| Gerardo Blanco | Hospital Universitario Infanta Cristina |
| Francisco Javier Bustamante | Hospital de Cruces |
| Fernando Casafont | Hospital Universitario Marqués de Valdecilla |
| Ramon Charco | Hospital Universitario Vall d’Hebron |
| Manuel Delgado | Hospital Universitario Juan Canalejo |
| Javier Fernández Castroagudín | Hospital Clínico Universitario de Santiago de Compostela |
| Teresa Ferrer | Hospital Universitario Virgen del Rocío |
| Yiliam Fundora | Hospital Universitario Virgen de las Nieves |
| Josep Fuster | Hospital Universitario Clínic |
| Carmen García Bernardo | Hospital Universitario Central de Asturias |
| Félix García Pajares | Hospital Universitario Río Hortega |
| Rafael López Andújar | Hospital Universitario La Fe |
| Sara Lorente Pérez | Hospital Clínico Universitario Lozano Blesa |
| José Luis Montero | Hospital Universitario. Reina Sofía |
| Fernando Pardo | Clínica Universitaria de Navarra |
| Sonia Pascual | Hospital General Universitario de Alicante |
| Pablo Ramírez | Hospital Universitario Virgen de la Arrixaca |
| Juan Miguel Rodrigo | Hospital Regional Universitario de Málaga |
| Víctor Sánchez Turrión | Hospital Universitario Puerta de Hierro |
| María Arántzazu Varona Bosque | Hospital Universitario Nuestra Señora de la Candelaria |
El Anexo 1 muestra los equipos de trasplante hepático participantes en la V Reunión de Consenso de la Sociedad de Trasplante Hepático.
De acuerdo con los autores y los editores, este artículo se publica simultáneamente y de forma íntegra en la revista Gastroenterología y Hepatología http://dx.doi.org/10.1016/j.gastrohep.2015.06.008.