Se revisa la importancia del control lipídico global en la prevención cardiovascular. Diversos estudios y metaanálisis demuestran que el control del colesterol LDL mantiene aún un elevado riesgo cardiovascular, que se relaciona con la presencia de lipoproteínas ricas en triglicéridos, y por ello con aumento de los triglicéridos plasmáticos y de los valores de apolipoproteína B que contienen estas lipoproteínas. La importancia de esta relación se debe al cambio ocurrido en los últimos años en el perfil lipídico de nuestra población, relacionado con el aumento de obesidad y de resistencia a la insulina; este perfil se denomina dislipidemia aterogénica. Así, la hipertrigliceridemia debe ser considerada factor de riesgo cardiovascular, especialmente cuando se han alcanzado los objetivos deseables del colesterol LDL. Se describen las indicaciones del tratamiento con fibratos, en prevención primaria y secundaria, basadas en recomendaciones según la medicina basada en la evidencia, así como su importancia en la reducción del riesgo cardiovascular. Finalmente, se establecen las indicaciones del tratamiento combinado estatina-fibrato, siempre tras los cambios del estilo de vida.
The importance of overall lipid control in cardiovascular prevention is reviewed. Several studies and meta-analyses show that the control of LDL cholesterol (LDL-C) still maintains a high cardiovascular risk, which is related to the presence of triglyceride-rich lipoproteins, and therefore with an increase in plasma triglycerides and the values of apolipoprotein B (apoB) containing these lipoproteins. The importance of this relationship is due to the change in the lipid profile of our population in recent years. This is related to the increase in obesity and insulin resistance, and is called atherogenic dyslipidaemia. Thus, hypertriglyceridaemia should be considered a cardiovascular risk factor, especially when the desirable objectives of LDL-C have been achieved. The indications for treatment with fibrates in primary and secondary prevention, using the medical evidence-based recommendations, are described, along with its importance in the reduction of cardiovascular risk. Finally, the established indications of the combined statin-fibrate treatment are presented, always after changes in lifestyle.
Según datos de la OMS la enfermedad cardiovascular arteriosclerosa (ECVA) es la primera causa de muerte en el mundo, siendo más frecuente en los países desarrollados1. La ECVA es una enfermedad multifactorial, producida por el depósito de colesterol (lipoproteínas) en la pared arterial y por una serie de fenómenos inflamatorios de baja intensidad y acumulación de células monocitos, transformados en células espumosas y por proliferación y captación de células musculares lisas que conducen al aumento y proliferación de la placa de ateroma, que junto a la aparición de un estado proinflamatorio dará lugar a la placa complicada y a los posibles episodios cardiovasculares. El depósito de colesterol, vehiculizado por las lipoproteínas, se relaciona con el inicio de la arteriosclerosis y tiene un importante papel en todas las fases de este proceso. Por consiguiente, la aterosclerosis es una enfermedad colesterol dependiente2. Clásicamente, se ha relacionado con el depósito de las LDL, que vehiculizan, en condiciones normales, el 75-80% del colesterol plasmático (colesterol LDL o c-LDL).
Objetivo lipoproteínas de baja densidad en la prevención cardiovascularDiversos estudios de intervención, fundamentalmente con estatinas, han demostrado que una reducción de los niveles plasmáticos del c-LDL lleva a una disminución de la morbimortalidad por ECVA3.
Un metaanálisis del Cholesterol Treatment TrialistsCollaborators con 90.056 sujetos incluidos en 14 estudios aleatorizados de tratamiento con estatinas, demostró que una reducción del c-LDL de 1mmol/l (aproximadamente 39mg/dl) se relacionó con una reducción de la incidencia de episodios cardiovasculares mayores del 21% y de accidentes coronarios en un 23%4. Otro estudio demostró que el tratamiento con estatinas mantenido durante 10 años en sujetos con bajo riesgo cardiovascular se relacionó con disminución del número de episodios de infarto de miocardio, reducción que fue del 23% con la administración de estatinas de baja potencia y una reducción del 53% con el uso de estatinas más potentes, incluyendo, además, una disminución significativa de accidentes cerebrovasculares5.
Además, cifras de c-LDL≤50mg/dl han demostrado una reducción del volumen de la placa de ateroma y un mayor beneficio cardiovascular6. Con estos datos, y muchos más estudios no mencionados en este artículo, la mayoría de sociedades científicas han considerado los niveles de c-LDL como la diana terapéutica en la prevención de la ECVA.
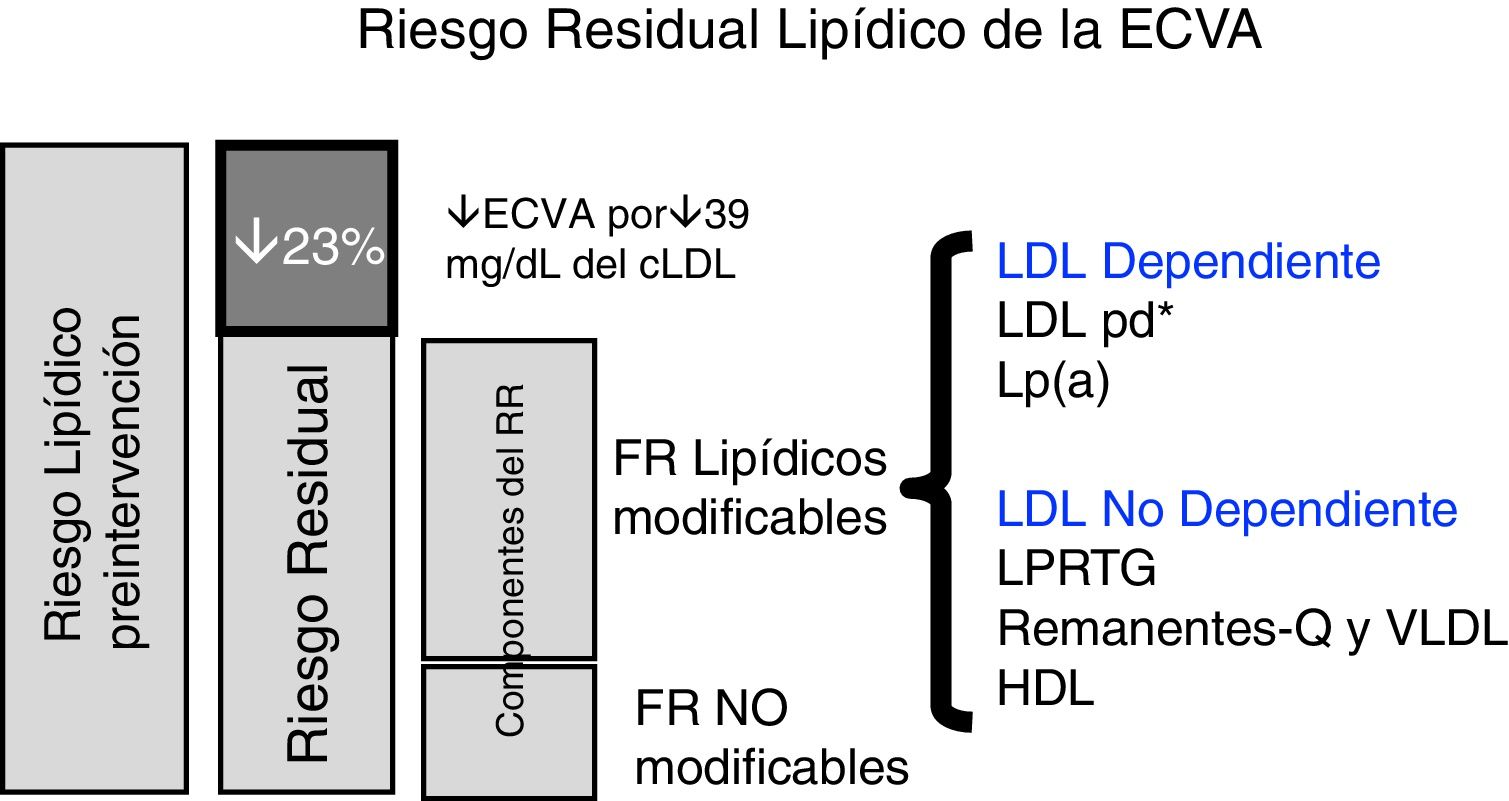
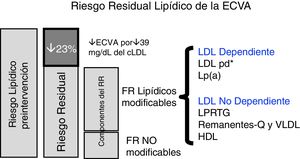
Riesgo residual no relacionado con lipoproteínas de baja densidad, asociado a lipoproteínas con apolipoproteína B y elevado contenido en triglicéridosTras tratamiento con estatinas queda un grupo de pacientes que aun manteniendo niveles relativamente bajos de c-LDL tienen un elevado riesgo cardiovascular y presentan episodios clínicos de ECVA. Este riesgo cardiovascular que persiste en sujetos tratados con estatinas se ha llamado riesgo residual (RR) y se debe, junto a otros factores de riesgo, al riesgo atribuible a factores lipídicos (hiperlipidemia y dislipidemia) diferentes a LDL, como son el aumento de lipoproteínas ricas en triglicéridos y que contienen apolipoproteína B (apoB)7. Este grupo tiene cada vez más importancia clínica por el aumento en la población del número de sujetos con una elevación de lipoproteínas aterogénicas no LDL (fig. 1).
Riesgo residual lipídico de la ECVA.c-LDL: colesterol de las LDL; ECVA: enfermedad cardiovascular arteriosclerosa; FR: factores de riesgo; HDL: lipoproteínas de alta densidad; LDL: lipoproteína de baja densidad; LDLpd: LDL pequeñas y densas; RR, riego residual; Lp(a), lipoproteína (a); LPRTG: lipoproteínas ricas en triglicéridos; Q: quilomicrones; VLDL, lipoproteínas de muy baja densidad.
*LDLpd están relacionadas con los niveles de triglicéridos plasmáticos.
Adaptada de Fruchart et al.41.
El perfil lipídico de la población ha cambiado en los últimos años debido a un cambio en el estilo de vida, fundamentalmente sobrealimentación con gran cantidad de azúcares y sedentarismo, que ha conducido a un aumentado de la prevalencia de la obesidad, especialmente de obesidad abdominal. Según la Encuesta Nacional de Salud 2012, el 17% de la población adulta española padece obesidad y un 37% tiene sobrepeso. Otra consecuencia relacionada con la anterior ha sido el aumento de la prevalencia de diabetes mellitus, especialmente diabetes tipo 2. Un estudio patrocinado por el CIBERDEM (ISCIII) encontró en el conjunto de la población española una prevalencia de diabetes del 14%, y además alteraciones del metabolismo lipídico en el 30% de la población8. Ambas situaciones, la obesidad abdominal y la diabetes tipo 2, se acompañan de numerosos cambios metabólicos que constituyen el síndrome metabólico que afecta aproximadamente al 30% de nuestra población adulta9. Estos sujetos tienen un riesgo de enfermedad cardiovascular que supera en 2 o 3 veces al de la población general10, y suelen presentar una alteración lipídica, conocida como dislipidemia aterogénica11. Esta dislipidemia aterogénica se caracteriza por aumento de los triglicéridos plasmáticos, tanto en situación basal como en posprandial, disminución de los niveles de c-HDL, elevaciones moderadas de c-LDL, con predominio de las partículas LDL pequeñas y densas y elevación de apoB, lo que se traduce en un aumento de las lipoproteínas circulantes con mayor capacidad aterogénica12. Esta dislipidemia, tal como reconoce el grupo de Dislipidemia Aterogénica de la SEA, suele estar infradiagnosticada e infratratada.
La importancia de los triglicéridos como factor de riesgo cardiovascularCada vez existen más evidencias de que las lipoproteínas ricas en triglicéridos, especialmente las de muy baja densidad (VLDL) son capaces de promover y desarrollar arteriosclerosis, transformando así el colesterol unido a VLDL (c-VLDL) y sus remanentes como un potencial objetivo terapéutico. Esto es particularmente importante, por su magnitud, en los sujetos con hipertrigliceridemia13. Podemos señalar, por tanto, que la suma de las lipoproteínas con apoB o aterogénicas, como son c-LDL, c-VLDL y sus remanentes y el colesterol de la lipoproteína(a) o Lp(a), son el conjunto de lipopoteínas aterogénicas y es equivalente al llamado el colesterol-no-HDL (c-no-HDL), que es un potente marcador de riesgo cardiovascular, además la concentración de c-no-HDL no muestra variaciones significativas en el estado de ayunas o posprandial14.
Conocemos la relación entre hipertrigliceridemia y alteración de otras lipoproteínas plasmáticas, así cuando aumentan los triglicéridos plasmáticos, y de forma proporcional a su incremento, se incrementa el colesterol vehiculizado por las lipoproteínas con apoB, especialmente las partículas remanentes, permaneciendo más o menos estable el c-LDL, disminuye el c-HDL y aumenta la proporción de LDL pequeñas y densas15. La existencia de partículas de LDL pequeñas y densas y de partículas remanentes puede cursar con cifras de c-LDL aparentemente normales, similares a las observadas cuando existe un número inferior de partículas LDL de mayor tamaño. En esta situación los valores de c-LDL infraestiman el verdadero problema, ya que no tiene en cuenta el conjunto del aumento del número de las lipoproteínas aterogénicas con apoB, y por ello del colesterol de estas lipoproteínas. Por ello, en los sujetos con dislipidemia aterogénica o hipertrigliceridemia el colesterol-no-HDL (c-no-HDL), calculado con el colesterol total menos el c-HDL, o los valores plasmáticos de apoB informan mejor sobre el riesgo cardiovascular relacionado con la dislipidemia, al ser 2 subrogados del conjunto de lipoproteínas aterogénicas16. Los valores de apoB son un marcador fiable del número de partículas aterogénicas circulantes, capaces de atravesar la pared arterial y depositarse en ella. En aquellos casos discordantes entre c-LDL y apoB, los valores de apoB proporcionan mejor información17,18. En consecuencia, el c-no-HDL se ha transformado en un excelente indicador de colesterol aterogénico, y un objetivo terapéutico primordial en individuos con dislipidemia aterogénica. De acuerdo con los datos proporcionados por ensayos clínicos, estudios epidemiológicos y estudios de base genética, podemos considerar los valores deseables de c-no-HDL para cada situación de riesgo los establecidos para c-LDL+30. Así, en los pacientes de muy alto riesgo el nivel óptimo de c-LDL es<70mg/dl, y de c-no-HDL será inferior a 100mg/dl. Un metaanálisis con 62.154 pacientes incluidos en 8 estudios demostró que el c-no-HDL tenía mejor correlación con el riesgo cardiovascular que el c-LDL19. Por ello, algunos autores apoyan la utilización del c-no-HDL o de la apoB como objetivos generales en la prevención y tratamiento de la ECVA20.
La hipertrigliceridemia, per se, debe ser considerada factor de riesgo, especialmente en los casos donde se ha alcanzado los objetivos deseables del c-LDL, según el riesgo cardiovascular21. Los niveles plasmáticos de triglicéridos en situación posprandial se han relacionado, con una fuerte evidencia estadística, con episodios de infarto de miocardio, ictus y con aumento de la mortalidad total12.
Estudios experimentales han demostrado que los remanentes de las lipoproteínas ricas en triglicéridos (quilomicrones y VLDL) penetran en la íntima arterial, en el espacio subendotelial, y son retenidos por la matriz del tejido conectivo; al igual que pasa con las LDL este cúmulo de remanentes en la pared arterial, que colaboran en el desarrollo de la arteriosclerosis, ha sido demostrado en humanos y en animales de experimentación22.
Además, estas lipoproteínas ricas en triglicéridos producen también fenómenos inflamatorios (producción de citoquinas proinflamatorias), activación de monocitos y disfunción endotelial23.
Los remanentes de las lipoproteínas ricas en triglicéridos son importantes en el desarrollo de la placa y en la producción de un estado trombótico responsable de la formación de trombos, y por ello de eventos clínicos24.
Otro importante factor lipídico inversamente relacionado con la hipertrigliceridemia, como previamente hemos comentado, son las HDL, que disminuyen proporcionalmente al aumento de los triglicéridos plasmáticos.
Desde los estudios epidemiológicos clásicos, como Framingham, MRFIT y otros más recientes como Cholesterol Treatment TrialistsCollaborators y ERFC, con un elevado número de sujetos, se conoce la relación inversa entre los valores del c-HDL y el riesgo de enfermedad cardiovascular, considerando al c-HDL<40mg/dl como un marcador independiente de riesgo cardiovascular.
Hemos de recordar que las HDL tienen múltiples funciones. Como es bien conocido, participan en la extracción de colesterol depositado en los tejidos y en las placas de ateroma y en el llamado transporte reverso del colesterol. Es decir, en el transporte del colesterol desde los tejidos periféricos al hígado. Algunas situaciones cursan no solo con disminución o pérdida de esta capacidad de extracción, sino también de las otras importantes funciones de las HDL como son: actividad antioxidante, antiinflamatoria, vasodilatadora y protectora del endotelio y parecen tener actividad antidiabética25. Se buscan fármacos capaces de aumentar las HDL manteniendo todas sus funciones fisiológicas, es decir, su capacidad antiaterogénica.
Puntos clave: riesgo residual no dependiente de lipoproteínas de baja densidad- •
Para la prevención primaria y secundaria de la enfermedad vascular aterosclerosa es necesario calcular el riesgo cardiovascular global.
- •
El objetivo del control lipídico es muy importante para la prevención y el tratamiento de la enfermedad cardiovascular.
- •
Debe mantenerse el objetivo c-LDL como diana terapéutica. Sin embargo, en sujetos con síndrome metabólico, dislipidemia aterogénica o hipertrigliceridemia el objetivo primario debería ser el cálculo de liproteínas aterogénicas, es decir el c-no-HDL o la apoB, que, en estas situaciones, se relacionan mejor con el riesgo cardiovascular.
- •
La hipertrigliceridemia, tanto en situación de ayuno como en situación posprandial, debe ser considerado un factor de riesgo cardiovascular independiente, fundamentalmente cuando se mantiene tras el control del c-LDL.
En el principal metaanálisis realizado sobre el efecto de los fibratos en prevención cardiovascular, el de Jun26, se observó una disminución de un 10% en el riesgo relativo de sufrir un episodio de enfermedad cardiovascular mayor (IC 95%: 0-18) (p=0,048) y un 13% el riesgo coronario (RR: 0,87 [0,81-0,93]) (p<0,0001), pero no un efecto significativo sobre la mortalidad por todas las causas, la mortalidad cardiovascular o el ictus, aunque sí frente a la necesidad de revascularización coronaria. En este metaanálisis, tras una metarregresión univariada, el mayor beneficio en prevención primaria cardiovascular con fibratos se observó en los pacientes que experimentaron una disminución de los triglicéridos (p=0,026), siendo la magnitud del efecto preventivo proporcional al grado de descenso de los mismos.
Recientemente otra revisión sistemática27 realizada con el objetivo de evaluar en prevención primaria los beneficios clínicos en términos de morbimortalidad por ECV, tanto de los fibratos frente a placebo como de fibratos en combinación con otros fármacos, valoró como objetivo primario el efecto sobre un combinado de los principales eventos de la ECV (muerte por ECV, infarto de miocardio no fatal o accidente cerebrovascular no mortal). De forma resumida este metaanálisis demuestra que frente a placebo los fibratos reducen en un 16% el combinado de los principales eventos cardiovasculares y disminuyen la morbimortalidad coronaria un 21% frente a placebo. Sin embargo, no influyen en la mortalidad total ni en la de origen no cardiovascular. Tampoco su efecto beneficioso se extiende en la generalidad de pacientes sin ECV establecida, ni en el empleo conjunto con estatinas frente al uso de estas en monoterapia.
En general, las revisiones y metaanálisis presentados incluyen grandes ensayos clínicos de prevención primaria controlados con placebo en población con hipercolesterolemia sin diabetes, como el Helsinky Heart Study28, o en población diabética, como el FIELD29 y el ACCORD30, demostrando que el tratamiento con un fibrato disminuye el riesgo de enfermedad cardiovascular en el primero, en el conjunto de la población estudiada y en los otros 2 en pacientes con dislipidemia aterogénica (subgrupo determinado con niveles altos de triglicéridos y bajos de c-HDL).
Para abundar en este punto Lee et al.31 realizaron una revisión sistemática de ensayos clínicos en los que se incluyeron pacientes con dislipidemia aterogénica. El mayor beneficio de los fibratos se observó en los 7.389 pacientes con hipertrigliceridemia, en los que los fibratos disminuyeron el riesgo cardiovascular un 2% (RR: 0,75; IC 95%: 0,65-0,86; p<0,001); y en 5.068 pacientes con hipertrigliceridemia asociada a déficit de c-HDL (RR: 0,71; IC 95%: 0,62-0,82; p<0,001). También se observó un beneficio no tan acusado en los 15.303 pacientes con déficit de c-HDL sin hipertrigliceridemia (RR: 0,84; IC 95%: 0,77-0,91; p<0,001), pero una ausencia de beneficio en los que no presentaron ni un déficit de c-HDL ni una hipertrigliceridemia.
Se recomienda pues la indicación de fibratos para la prevención primaria de la enfermedad cardiovascular en los pacientes de alto riesgo cardiovascular con dislipidemia aterogénica (aumento de triglicéridos y bajo c-HDL) que presentan un c-LDL o un c-no HDL normal, en general tras el tratamiento con una estatina.
¿Y en prevención secundaria?Las revisiones y metaanálisis que incluyen grandes ensayos clínicos de prevención secundaria controlados con placebo, como el BIP y el VA-HIT, demuestran que el tratamiento con un fibrato disminuye el riesgo de enfermedad cardiovascular en los pacientes isquémicos, en el BIP en el conjunto de la población estudiada y en el VA-HIT en los pacientes con dislipidemia aterogénica. En el metaanálisis de Lee et al.31, en los ensayos de prevención secundaria incluidos, se observó que el efecto preventivo de los fibratos en los pacientes isquémicos se daba en los que presentaban hipertrigliceridemia, descensos de c-HDL o ambas alteraciones, pero no en los que no presentaban ninguna de ellas. En otra revisión32 donde se incluyeron todos los ensayos clínicos empleando fibratos en pacientes estrictamente considerados como de prevención secundaria, fuera cual fuera su perfil lipídico inicial o su tratamiento previo, se demuestra que el fármaco tiene un efecto protector, comparado con placebo, principalmente en un objetivo compuesto por infarto e ictus no fatales y muerte de origen vascular, aunque de forma independiente no tenga beneficio en la prevención de ictus, en la mortalidad vascular o en la mortalidad total. El beneficio primordial se centraría en prevenir las recurrencias de infarto de miocardio fatal y no fatal, siendo estos resultados consistentes con un estudio reciente33 en el que se observó una reducción del 20% en los IM no fatales, sin reducción del ictus, ni tampoco de la mortalidad por enfermedad coronaria. La indicación de tratamiento con fibratos para la prevención secundaria de la enfermedad cardiovascular se debe considerar en los pacientes con dislipidemia aterogénica que presenten un c-LDL o un c-no HDL normal, en general tras el tratamiento con una estatina. Ya que se trata de análisis subrogados de grandes ensayos clínicos, la calidad de la evidencia puede definirse como de clase B y establecerse una recomendación IIB.
Puntos clave: fibratos en prevención primaria y secundaria- •
El c-LDL es el principal agente etiológico (no solo factor de riesgo) de la enfermedad ateroesclerótica y su control debe ser prioritario.
- •
Tanto en prevención primaria como secundaria, cuando se asocia elevación de triglicéridos, niveles bajos de c-HDL y alta presencia de partículas LDL pequeñas y densas, se incrementa el riesgo residual.
- •
El riesgo residual puede ser reducido si se asocia fenofibrato, ya que gemfibrozilo junto a estatinas puede originar graves secundarismos (miositis, rabdomiólisis y deterioro de la función renal)34.
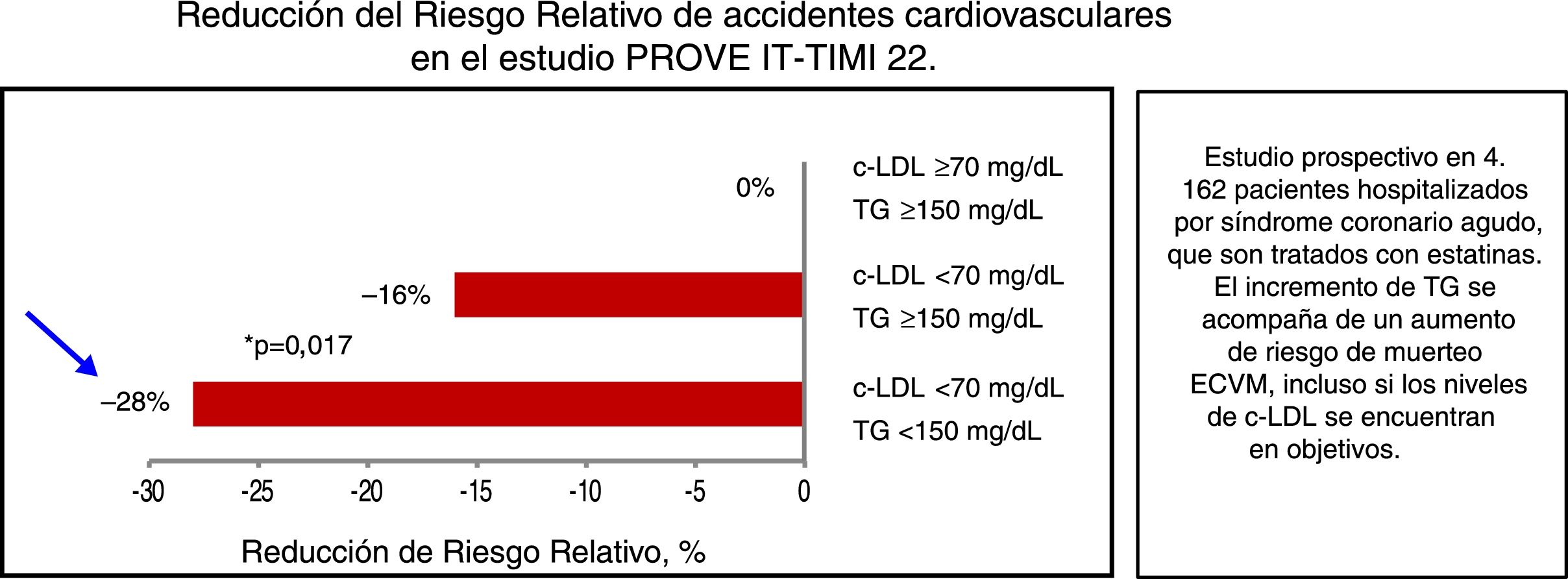
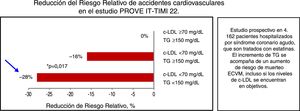
Las estatinas han demostrado un importante beneficio en la prevención cardiovascular, primaria y secundaria, en sujetos con bajo y alto riesgo cardiovascular. Sin embargo, en los sujetos tratados con estatinas, especialmente en aquellos con dislipidemia aterogénica o hipertrigliceridemia, el riesgo de nuevos episodios continúa siendo elevado35. Así pues, tras obtener un adecuado control del c-LDL o mejor del c-no-HDL, fijando objetivos basados en el riesgo cardiovascular global, las siguientes dianas lipídicas serán el control de los triglicéridos y del c-HDL. En el estudio PROVE-IT (fig. 2) se muestra cómo los sujetos con hipertrigliceridemia (TG≥150mg/dl) tienen mayor riesgo cardiovascular a pesar del buen control del c-LDL36.
Reducción del riesgo relativo de accidentes cardiovasculares en el estudio PROVE IT-TIMI 22.
c-LDL: colesterol ligado a lipoproteínas de baja densidad; ECVM: episodios cardiovasculares mayores; TG:triglicéridos plasmáticos.
Modificada de Miller et al.36.
El tratamiento siempre debe establecerse con modificaciones del estilo de vida y control de otros factores de riesgo. Tras establecer el objetivo c-LDL, o en su caso el c-no-HDL, según el riesgo cardiovascular, utilizaremos estatinas, con la potencia y la dosis necesaria para conseguirlo. Este tratamiento, en general bien tolerado, ha demostrado efectividad en la prevención de la enfermedad cardiovascular en todas las poblaciones y edades. En caso de no alcanzarse los objetivos se añadirá ezetimiba o resinas.
En los diferentes estudios con estatinas se demostró una reducción de la morbimortalidad coronaria aproximadamente del 30%, pero queda un alto porcentaje, el 70%, sin beneficio, en parte por modificaciones de las lipoproteínas ricas en triglicéridos, que aumentan el valor de los triglicéridos en plasma y la modificación con reducción de los valores de HDL y de su capacidad funcional; es el llamado riesgo residual lipídico y plantea la necesidad de tratamiento combinado37.
Tras conseguir un adecuado control del c-LDL (c-no-HDL), si los triglicéridos siguen elevados y si el c-HDL plasmático está disminuido, actualmente los fibratos son el fármaco de elección, reducen los triglicéridos plasmáticos entre un 20% y un 50% y elevan el c-HDL un 8% a un 15%. El fibrato más utilizado por sus ventajas, pocas interacciones al asociarlo a estatinas, es el fenofibrato, considerado como el ideal para ser asociado a estatinas.
Una revisión sistemática demostró que los fibratos más potentes para reducir los triglicéridos y aumentar el c-HDL son el gemfibrocilo y el fenofibrato. Sin embargo, el gemfibrocilo tiene mayor número de efectos secundarios al asociarlo a estatinas, elevada posibilidad de rabdomiólisis, por su vía de metabolización, isoenzimas 1A1 y 1A3 de la vía del citocromo, vía compartida por algunas estatinas. Sin embargo, el fenofibrato tiene un mínimo efecto sobre la vía CYP3A4, lo que llevó a la FDA de Estados Unidos a establecer que el gemfibrocilo asociado a estatinas multiplicaba por 15 el número de casos de rabdomiólisis comparado con la asociación fenofibrato estatinas, determinando que el fenofibrato es el fibrato ideal para asociar al tratamiento con estatinas38.
Esta asociación es bien tolerada, aunque los efectos secundarios sobre el hígado y los músculos pueden aumentar, pero la mayoría de los estudios de asociación de estatinas y fenofibrato demuestran un escaso aumento de efectos secundarios39.
En conjunto, los estudios con fibratos han demostrado resultados poco significativos en la reducción de la enfermedad cardiovascular. Sin embargo, al analizar las subpoblaciones con dislipidemia aterogénica (triglicéridos elevados y c-HDL bajo) hay una consistente y significativa reducción de los episodios cardiovasculares40.
Para ello, en casos de dislipidemia aterogénica (TG>150mg/dl y c-HDL <40mg/dl) se pueden obtener beneficios adicionales con la administración de fenofibrato, especialmente en sujetos con dislipidemia aterogénica y alto riesgo cardiovascular o de diabetes30,41.
En un posicionamiento del grupo de Dislipemia aterogénica de la SEA11 se ha establecido que en el tratamiento de la dislipidemia aterogénica se deben establecer cambios en el estilo de vida y calcular el riesgo cardiovascular global, y proceder según este riesgo:
- -
Riesgo moderado, tras cambios en el estilo de vida, si c-no-HDL<145mg/dl y TG≥150mg/dl y c-HDL<40mg/dl, establecer tratamiento con fenofibrato.
- -
Riesgo moderado con c-no-HDL≥145mg/dl o alto riesgo con c-no-HDL ≥130mg/dl, iniciar tratamiento con estatina, si tras esta pauta no cumple los objetivos de TG y c-HDL añadir fenofibrato.
- -
Muy alto riesgo o diabetes con c-no-HDL≥100mg/dl, iniciar tratamiento combinado estatina-fenofibrato.
Para la consecución de los objetivos terapéuticos establecidos es necesario mejorar la cumplimentación y adherencia terapéutica42. Para ello, es adecuada la combinación en dosis fija de estatina y fenofibrato (pravastatina-fenofibrato), ya que simplifica la pauta terapéutica al reducir a una sola toma diaria43.
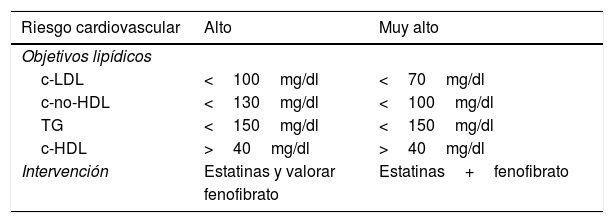
Se establece el tratamiento combinado estatinas-fenofibrato, no solo en la dislipidemia aterogénica, sino en cualquier sujeto con riesgo cardiovascular alto o muy alto y con hipertrigliceridemia (tabla 1).
- •
Los cambios del estilo de vida: dieta hipolipidemiante, control del peso, ejercicio físico y la supresión del tabaco son muy eficaces en todos los pacientes, y el primer paso en el abordaje de la dislipidemia aterogénica y de los sujetos con hipertrigliceridemia.
- •
Tras los cambios en el estilo de vida, el tratamiento inicial seguro y eficaz en la prevención cardiovascular son las estatinas.
- •
Las guías de práctica clínica y la EMA señalan al fenofibrato para el tratamiento de la hiperlipidemia mixta junto a una estatina cuando los TG y el c-HDL no se encuentran adecuadamente controlados.
- •
En prevención secundaria y diabetes, tras tratamiento con estatinas, si siguen altos los TG y bajo el c-HDL, hay beneficio con la asociación de fenofibrato.
Sujetos con hipertrigliceridemia
| Riesgo cardiovascular | Alto | Muy alto |
|---|---|---|
| Objetivos lipídicos | ||
| c-LDL | <100mg/dl | <70mg/dl |
| c-no-HDL | <130mg/dl | <100mg/dl |
| TG | <150mg/dl | <150mg/dl |
| c-HDL | >40mg/dl | >40mg/dl |
| Intervención | Estatinas y valorar | Estatinas+fenofibrato |
| fenofibrato |
c-HDL: colesterol ligado a lipoproteínas de alta densidad; c-LDL: colesterol ligado a lipoproteínas de baja densidad; c-no-HDL: colesterol no ligado a lipoproteínas de alta densidad; TG: triglicéridos.
Los autores declaran no tener ningún conflicto de intereses.
Nota al suplementoEste artículo forma parte del suplemento «Actualidad de la dislipemia aterogénica en 2018», que cuenta con el patrocinio de laboratorios Mylan.
FinanciaciónEl Grupo de Dislipidemia Aterogénica es un grupo de trabajo de la Sociedad Española de Arteriosclerosis (SEA) y recibe financiación de Mylan.
Juan F. Ascaso (Universitat de Valencia, CIBERDEM, INCLIVA, España), Mariano Blasco (C.S. Delicias Sur, Área Sanitaria III, Zaragoza, España), Ángel Brea (Unidad de Lípidos, Servicio de Medicina Interna, Hospital San Pedro, Logroño, España), Ángel Díaz (Centro de Salud de Bembibre, Universidad de León, León, España), Antonio Hernández-Mijares (Universitat de Valencia, España), Juan Pedro-Botet (Unidad de Lípidos y Riesgo Vascular, Servicio Endocrinología y Nutrición, Hospital del Mar, Universitat Autònoma de Barcelona, España), Xavier Pintó (Servicio de Medicina Interna, Hospital de Bellvitge, CIBERobn, Fipec, Universidad de Barcelona, Idibell, España), Jesús Millán (Unidad de Lípidos, Servicio de Medicina Interna, Hospital General Universitario Gregorio Marañón, Facultad de Medicina Universidad Complutense, Madrid, España).