La expresión de PTEC humana en ratones transgénicos reduce el colesterol de las lipoproteínas de alta densidad (cHDL) y aumenta la susceptibilidad a la arteriosclerosis. Por otro lado, el gemfibrozilo, uno de los fibratos más utilizados en clínica, y la rosiglitazona aumentan el cHDL y reducen la susceptibilidad a la arteriosclerosis en modelos murinos. El objetivo principal de este estudio es evaluar el efecto de la expresión de la PTEC humana, el gemfibrozilo y la rosiglitazona en el transporte inverso de colesterol (TIC) específico de macrófagos.
Materiales y métodoPara determinar el TIC específico de macrófagos se aplicó inyección intraperitoneal de macrófagos P388D1 marcados con 3H-colesterol en ratones controles (C57BL/6) y ratones transgénicos de PTEC humana. Este mismo proceso se realizó en ratones transgénicos de apoA-I humana (h) que recibieron una dosis diaria por vía oral de gemfibrozilo (625 mg/kg) o rosiglitazona (10 mg/kg) durante 17 días y se los comparó con los que recibieron la solución vehículo. A las 48 h, se sacrificó a los animales y se determinó el 3H-colesterol en plasma, hígado y heces.
ResultadosLos ratones transgénicos de PTEC humana presentaron una disminución significativa de cHDL en plasma respecto a los ratones controles. El gemfibrozilo incrementó el colesterol total y el cHDL en los ratones transgénicos de apoA-Ih. Sin embargo, ni la expresión de PTEC humana ni los tratamientos farmacológicos alteraron la excreción fecal de colesterol y ácidos biliares. No se encontraron diferencias significativas en el TIC de 3H-colesterol desde los macrófagos P388D1 a heces en los diferentes grupos experimentales.
ConclusionesNi la expresión de PTEC humana en ratones transgénicos ni el tratamiento con gemfibrozilo o rosiglitazona en ratones transgénicos de apoA-Ih modifican el transporte inverso de colesterol especifico de macrófagos in vivo.
Human CETP expression in mice reduces cholesterol from high density lipoprotein (HDLc) and increases atherosclerosis susceptibility. On the other hand, gemfibrozil, one of the most used fibrates in clinical practice, and rosiglitazone, increase HDLc and reduce the atherosclerotic susceptibility in mouse models of atherosclerosis. The main aim of this study was to evaluate the effect of human CETP expression, and the effect of gemfibrozil or rosiglitazone treatment on one of the most important HDL anti-atherogenic properties, the macrophage-specific reverse cholesterol transport (RCT).
Materials and methodTo determinate the macrophage-specific RCT, [3H]cholesterol-labelled P388D1 macrophages were injected intraperitoneally into control mice (C57BL/6) and into human CETP transgenic mice. We performed the same procedure in human apoA-I transgenic mice treated during 17 days with an oral daily gavage dose of gemfibrozil (625 mg/kg), rosiglitazone (10 mg/kg) or vehicle solution. At 48 h, the mice were euthanized and [3H]cholesterol in plasma, liver and faeces were measured.
ResultsHuman CETP transgenic mice showed decreased HDLc compared to control mice. Human apoA-I transgenic mice showed an increase in total cholesterol and HDLc when treated with gemfibrozil, but not with rosiglitazone. Neither the human CETP activity, nor either of the two pharmacological treatments altered faecal cholesterol or bile acid excretion. Furthermore, the [3H]tracer detected in liver, faecal cholesterol and bile acid was not significantly different in any of the animal groups.
ConclusionsNeither human CETP expression in transgenic mice, nor treatment with gemfibrozil or rosiglitazone in human apoA-I transgenic mice modified macrophage-specific reverse cholesterol transport.
Los estudios epidemiológicos han demostrado consistentemente que las concentraciones de colesterol de las lipoproteínas de alta densidad (cHDL) y de la apolipoproteína (apo) A-I están correlacionadas inversamente con la incidencia de enfermedad coronaria1. Los efectos cardioprotectores de las HDL han sido atribuidos, en parte, a su papel en el transporte inverso de colesterol (TIC) desde los tejidos periféricos al hígado, de donde es parcialmente excretado a través de la bilis y las heces1. Por su importancia en la arteriosclerosis, el TIC específico de macrófagos puede ser especialmente importante para la función antiaterogénica de las HDL2.
La acción de la proteína transferidora de ésteres de colesterol (PTEC) en humanos tiene como resultado la transferencia neta de ésteres de colesterol a las partículas ricas en triglicéridos, al mismo tiempo que la transferencia de triglicéridos hacia las lipoproteínas de baja densidad (LDL) y HDL3. Los ratones no tienen esta actividad proteínica en plasma. La sobreexpresión de PTEC humana o de macaco en ratones transgénicos reduce el cHDL4-6 e incrementa la preβ-HDL7. Sin embargo, la magnitud del flujo de colesterol desde la periferia al hígado y su posterior excreción biliar y fecal no parece estar alterada en ratones transgénicos de PTEC de macaco o humana8-10. Desde que se caracterizó la PTEC, se ha discutido ampliamente su posible relación con la arteriosclerosis11. Los ratones transgénicos de PTEC humana o de macaco alimentados con una dieta aterogénica o cruzados con ratones modificados genéticamente por inactivación del gen del receptor de LDL o del gen de la apoE presentan un incremento en el tamaño de la lesión arteriosclerótica12-14. Sin embargo, la expresión de PTEC en ratones transgénicos de apoCIII o de LCAT, en ratones db/db y en ratones deficientes de SR-BI reduce el área de la lesión arteriosclerótica13,15-17. En la actualidad se desconoce si estas diferencias pueden ser explicadas por diferentes efectos en el TIC específico de macrófagos o son debidas a diferencias en otros mecanismos antiaterogénicos de la HDL. Tampoco está totalmente aclarado si la deficiencia genética de PTEC en humanos protege o no de sufrir enfermedades aterotrombóticas1,18. Más recientemente, el estudio ILLUMINATE tuvo que ser interrumpido debido a un incremento en la tasa de mortalidad cardiovascular y total en los pacientes tratados con torcetrapib, un inhibidor de la actividad PTEC, a pesar de inducir un aumento muy notable del cHDL19.
Los receptores activados por los proliferadores peroxisomales (PPAR) son factores de transcripción activados por ligandos que afectan a la expresión de varios genes implicados en el metabolismo lipoproteínico, de la glucosa y en la inflamación20. Aparte de sus ligandos naturales, diversos compuestos sintéticos pueden activar los diferentes tipos de PPAR21. Los fibratos son fármacos activadores de PPARα. Diversos ensayos clínicos avalan la eficacia de la utilidad de los fibratos en incrementar el cHDL y en reducir los eventos cardiovasculares1. Este efecto beneficioso se ha asociado, en parte, al aumento de cHDL, así como a la reducción de triglicéridos que inducen estos fármacos. La activación de PPARα en macrófagos estimula la expresión de LXR y propicia la expresión del transportador ABCA122 y, por lo tanto, el eflujo de colesterol a HDL. También se ha indicado que la activación de PPARα en macrófagos estimula la expresión de SR-BI y reduce la actividad de esterificación del colesterol por ACAT1, evitando así la acumulación de ésteres de colesterol23. Adicionalmente, la activación de PPARα en el hígado podría estimular la excreción de colesterol al canalículo biliar mediante un aumento en la expresión de los transportadores ABCG5 y G824. Por otra parte, las glitazonas actúan mayoritariamente a través de los receptores PPARγ, modificando la transcripción de genes implicados en la diferenciación de adipocitos y en el metabolismo lipídico y de la glucosa1. La terapia con glitazonas incrementa moderadamente el cHDL25, mientras que la inactivación de PPARγ en macrófagos reduce la eliminación de colesterol intracelular mediada por HDL26. Se ha indicado que las glitazonas pueden actuar como inductores de ABCA127 y también de ABCG1 a través de LXRα28, aunque estos cambios no han sido observados en otros estudios22,26. Más recientemente, se ha demostrado que la activación de PPARγ inhibe la formación de células espumosas in vivo a través de ABCG1 y de forma independiente de ABCA122.
Sin embargo, no hay estudios que evalúen la influencia de la expresión de PTEC humana o del tratamiento con gemfibrozilo o rosiglitazona en el TIC desde macrófagos a heces in vivo. Por ello, el objetivo principal de este estudio es evaluar el efecto de dichas intervenciones en esta propiedad antiaterogénica de las HDL.
Materiales y métodosAnimales, dietas y tratamientosLos procesos de experimentación en animales fueron aprobados por el Comité de Ética Animal del Institut de Recerca del Hospital de la Santa Creu i Sant Pau y el Departament d'Agricultura, Ramaderia i Pesca de la Generalitat de Catalunya. Los estudios se realizaron con ratones C57BL/6 (controles), sin actividad PTEC, ratones transgénicos de PTEC humana con un background C57BL/6, obtenidos de Jackson Laboratory (Bar Harbor, #003904) de 10-12 semanas de edad. Para los experimentos con gemfibrozilo y rosiglitazona se utilizaron ratones transgénicos de apoA-I humana con un background C57BL/6, de 4-6 meses de edad, obtenidos también de Jackson Laboratory (Bar Harbour, #001927), ya que se ha descrito que los fibratos tienen un efecto inductor en la expresión de apoA-I humana, mientras que disminuyen la expresión de apoA-I de ratón29. Los ratones fueron alimentados con dieta estándar (A04 Rodent standard diet, Panlab) y mantenidos bajo condiciones óptimas de temperatura (21°C) y humedad relativa (55%), con ciclos programados de luz-oscuridad de 12h y con libre acceso a agua. Los ratones transgénicos de apoA-I humana fueron tratados durante 17 días con una dosis intragástrica de gemfibrozilo (Sigma, 625mg/kg), rosiglitazona (GlaxoSmith-Kline, 10mg/kg) o solución vehículo (0,05% v/v Tween 80 [Sigma], 9,95% v/v PEG 400 [Sigma] y 0,9% w/v de carboximetilcelulosa [Sigma]). Estas dosis fueron seleccionadas por su efecto demostrado tanto en el cHDL como en la susceptibilidad a la arteriosclerosis en ratones modificados genéticamente29,30.
Parámetros lipídicos y fecalesLas concentraciones de colesterol, triglicéridos y cHDL en plasma se determinaron mediante un método comercial de tipo enzimático-colorimétrico adaptado a un autoanalizador Hitachi 911 (Roche Diagnostics)31,32. La concentración plasmática de apoA-I fue determinada mediante un ensayo inmunonefelométrico en el que se utilizan anticuerpos policlonales específicos33. La actividad PTEC humana se determinó a partir de la transferencia de oleato de colesterol radiactivo de las HDL a las LDL, usando para ello lipoproteínas aisladas de pooles de individuos normolipémicos y plasma de ratón como fuente de PTEC32. Se recogieron las heces de ratones colocados en jaulas metabólicas individuales durante 48h y en los que también se controló la ingesta. Se realizó una extracción lipídica a partir de 1g de heces con 10ml hexano:isopropanol (3:2v/v) y se calculó la excreción fecal de colesterol34. A partir de 1g de heces se realizó una extracción con etanol para separar las sales biliares, que fueron determinadas con el método de la 3β-hidroxiesteroide deshidrogenasa (3β-HSD) (Sigma Diagnostic). Dicho método enzimático consiste en la determinación por absorbancia a 530nm del formazán, último producto de la reacción y cuya intensidad de color es directamente proporcional a la cantidad de ácidos biliares de la muestra.
Cultivos celulares y determinación del TIC específico de macrófagos in vivoSe utilizaron macrófagos P388D1 cultivados en placas de 75cm con una densidad de 15 millones de células por placa. Éstos fueron incubados durante 48h con medio RPMI 1640 que contenía 5μCi/ml de [1α,2α(n)-3H]colesterol (Amersham Biosciences Europe GMBH), 100μg/ml de LDL acetilada y el 10% de suero humano libre de lipoproteínas35. Estas células se aislaron, equilibraron con albúmina sérica bovina y se resuspendieron en 0,9% (w/v) de suero fisiológico35. Los macrófagos marcados con 3H-colesterol fueron inyectados intraperitonealmente a los ratones de cada uno de los grupos. Concretamente, en la determinación del TIC en los ratones transgénicos de PTEC humana se utilizaron 8 ratones controles C57BL/6 y 6 ratones transgénicos de PTEC humana. El número de células y el número de cuentas por minuto (cpm) inyectadas en cada ratón fueron 1,2 × 106 y 1,4 × 106, respectivamente. En la determinación del TIC en los ratones transgénicos de apoA-I humana se utilizaron 12 ratones controles C57BL/6 y 10 ratones transgénicos de apoA-I humana tratados con gemfibrozilo y 10 ratones transgénicos de apoA-I humana tratados con rosiglitazona. En este caso, el número de células y el de cpm inyectadas en cada ratón fueron 1,8 × 106 y 1,36 × 106, respectivamente. Una vez inyectados intraperitonealmente los macrófagos marcados radiactivamente, los ratones fueron colocados en jaulas individuales y las heces recogidas durante 48h. En ese momento, los ratones fueron sacrificados y los hígados aislados. El número de cpm en el plasma se determinó a las 48h en un contador de centelleo35,36. Las extracciones lipídicas de hígados y heces se realizaron con alcohol isopropílico y hexano35, donde posteriormente se determinaron las concentraciones de 3H-colesterol. El 3H-colesterol se expresó también como fracción de la dosis inyectada35,36.
Análisis estadísticoSe utilizó el análisis estadístico one-way ANOVA para comparar las diferencias entre grupos experimentales. Se utilizó el programa GraphPad Prism versión 4.00 para Windows (GraphPad Software). Se consideró estadísticamente significativo el valor de p < 0,05. Todos los valores se presentan como media ± error estándar.
ResultadosLos ratones transgénicos de PTEC humana presentaban una actividad PTEC 1,5 veces mayor que la que presentan humanos normolipémicos (la actividad media en humanos normolipémicos es de 120μmol/h)37. No se observaron diferencias significativas en el colesterol total de ratones controles y ratones transgénicos de PTEC humana, pero sí se evidenció una disminución significativa en la concentración del cHDL en los ratones transgénicos de PTEC humana, respecto de los ratones controles, tal y como se ha descrito previamente4 (tabla 1). El tratamiento con gemfibrozilo incrementó significativamente las concentraciones del colesterol total y del cHDL en los ratones transgénicos de apoA-I respecto de los ratones controles, pero dichos cambios no se observaron con el tratamiento con rosiglitazona (tabla 2). Ambos tratamientos, gemfibrozilo y rosiglitazona, disminuyeron significativamente la concentración de triglicéridos. La expresión de PTEC y el tratamiento con gemfibrozilo o rosiglitazona no alteró la ingesta de colesterol de la dieta ni la excreción fecal de colesterol y ácidos biliares (tablas 1 y 2).
Parámetros lipídicos y fecales en ratones controles y transgénicos de PTEC humana a las 10-12 semanas de edad
| Controles (n = 12) | PTEC humana (n = 6) | |
| Peso (g) | 23,6 ± 1,2 | 22,0 ± 1,3 |
| Colesterol total (mmol/l) | 1,7 ± 0,1 | 1,4 ± 0,2 |
| cHDL (mmol/l) | 1,3 ± 0,1 | 0,8 ± 0,1* |
| Actividad PTEC humana (μimol/h) | ND | 183,1 ± 30 |
| Ingesta de colesterol (μimol/día/100g de peso) | 21,1 ± 1,1 | 24,1 ± 1,2 |
| Excreción fecal de colesterol (μmol/día/100g de peso) | 14,4 ± 1,3 | 16,9 ± 1,3 |
| Excreción fecal de ácidos biliares (μimol/día/100g de peso) | 1,8 ± 0,2 | 1,2 ± 0,2 |
cHDL: colesterol de las lipoproteínas de alta densidad; ND: no detectado.
Resultados expresados como media ± error estándar.
Parámetros lipídicos y fecales en ratones controles y transgénicos de ApoA-I humana (apoA-Ih) de 4-6 meses de edad tratados con la solución vehículo, gemfibrozilo o rosiglitazona durante 17 días
| Vehículo (n = 14) | Gemfibrozilo (n = 17) | Rosiglitazona (n = 15) | |
| Peso (g) | 30,7 ± 0,9 | 30,5 ± 0,7 | 30,7 ± 0,7 |
| Colesterol total (mmol/l) | 4,9 ± 0,2 | 6,6 ± 0,4* | 4,2 ± 0,2 |
| cHDL (mmol/l) | 3,9 ± 0,2 | 5,3 ± 0,4* | 3,3 ± 0,2 |
| ApoA-Ih (g/l) | 5,8 ± 0,3 | 7,5 ± 0,5 | 5,0 ± 0,3 |
| Triglicéridos (mmol/l) | 2,1 ± 0,2 | 1,0 ± 0,2 * | 1,2 ± 0,2* |
| Ingesta de colesterol (μimol/día/100g de peso) | 17,5 ± 3,0 | 17,6 ± 0,9 | 18,7 ± 1,6 |
| Excreción fecal de colesterol (μimol/día/100g de peso) | 11,5 ± 1,5 | 11,9 ± 1,1 | 13,6 ± 1,0 |
| Excreción fecal de ácidos biliares (μimol/día/100g de peso) | 3,6 ± 0,4 | 3,2 ± 0,5 | 2,5 ± 0,4 |
cHDL: colesterol de las lipoproteínas de alta densidad.
Resultados expresados como media ± error estándar.
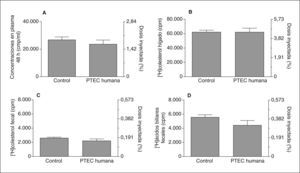
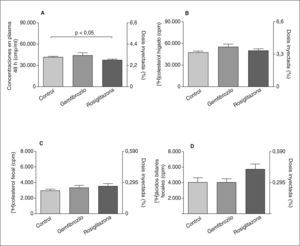
Después de la inyección intraperitoneal de los macrófagos marcados con 3H-colesterol en los ratones transgénicos de PTEC humana, y a pesar de la disminución de cHDL que presentaban, no se observaron diferencias significativas en la cantidad de 3H-colesterol que llegó al plasma, el hígado o las heces, en comparación con los ratones control (fig. 1). Por otro lado, se observó una disminución del 3H-colesterol en plasma de 48h de los ratones transgénicos de apoA-I humana tratados con rosiglitazona respecto de los controles (37.550 ± 1.360 frente a 41.560 ± 1.277cpm; p = 0,045), cosa que no sucedió con los ratones transgénicos de apoA-I humana tratados con gemfibrozilo. Sin embargo, tampoco la rosiglitazona ni el gemfibrozilo alteraron el TIC de 3H-colesterol de macrófagos a hígado y heces (fig. 2). No se encontraron diferencias significativas en la concentración de 3H-ácidos biliares entre ambos tratamientos (gemfibrozilo o rosiglitazona) respecto a la solución vehículo, aunque sí se observó una tendencia no significativa a aumentar en los ratones tratados con rosiglitazona (5.736 ± 597cpm) respecto de los ratones controles (4.040 ± 670cpm).
Transporte inverso de colesterol específico de macrófagos a heces en ratones controles (n = 8) y transgénicos de PTEC humana (n = 6). A: concentraciones de 3H-colesterol total en plasma a las 48h. B: concentraciones de 3H-colesterol en hígado. C y D: concentraciones de 3H-colesterol y 3H-ácidos biliares, respectivamente, en heces a las 48h de la inyección de macrófagos marcados. Los valores se expresan como media ± error estándar.
Transporte inverso de colesterol específico de macrófagos a heces en ratones controles (n = 12) y transgénicos de apoA-I humana (n = 10). A: concentraciones de 3H-colesterol total en plasma a las 48h. B: concentraciones de 3H-colesterol en hígado. C y D: concentraciones de 3H-colesterol y 3H-ácidos biliares, respectivamente, en heces a las 48h de la inyección de macrófagos marcados. Los valores se expresan como media ± error estándar.
La teoría de que el aumento del cHDL conduciría, inevitablemente, a la disminución de la enfermedad cardiovascular ha sufrido un duro golpe con la publicación de los datos del estudio ILLUMINATE, aun cuando los efectos negativos producidos por el torcetrapib puedan ser debidos a efectos negativos específicos del fármaco19. Así pues, pudiera estar indicado no sólo incrementar la concentración de cHDL, sino sobre todo mejorar la funcionalidad de las HDL2,38.
El TIC específico de macrófagos parece ser especialmente importante para la función antiaterogénica de las HDL2. En este estudio, hemos determinado el TIC específico de macrófagos, que es la principal célula que acumula colesterol en las lesiones arterioscleróticas, determinando la cantidad de 3H-colesterol transportado desde los macrófagos a las heces in vivo39. Cabe destacar que el transporte de colesterol centrípeto desde tejidos extrahepáticos o la excreción fecal de colesterol es una medida del TIC total, pero no refleja necesariamente el TIC específico de macrófagos40-42 puesto que este último tan sólo representa el 2% del TIC total. Por lo tanto, los resultados cualitativos (aumento o descenso) de dicho TIC específico de macrófagos no tienen por qué necesariamente coincidir con los datos del TIC total.
Los resultados de nuestro estudio demuestran que el TIC desde macrófagos a heces no se modificó en ratones transgénicos de PTEC humana ni en ratones transgénicos de apoA-I humana tratados con gemfibrozilo o rosiglitazona, a pesar de la reducción y del incremento, respectivamente, del cHDL que se observó durante estas intervenciones. Estos resultados podrían parecer, en principio, sorprendentes ya que se podría pensar que los cambios en el cHDL deberían estar asociados a cambios en el TIC total o en el específico de macrófagos. Sin embargo, buena parte de los estudios realizados en ratones modificados genéticamente no han encontrado los cambios esperados en el TIC de macrófagos a partir de las modificaciones existentes en la concentración plasmática de cHDL2,8-10,43,44.
Se ha descrito que la acción de los fibratos y glitazonas sobre los PPARα y PPARγ, respectivamente, estimula el eflujo de colesterol in vitro desde los macrófagos a través de LXR, que activa la expresión de ABCA1 y otros genes involucrados en el eflujo de colesterol, como ABCG127,45. Por otro lado, la acción de la PTEC disminuye el eflujo del colesterol a HDL maduras46. Por lo tanto, basándonos en estos datos, podríamos haber hipotetizado que el tratamiento con gemfibrozilo o rosiglitazona aumentaría el TIC específco de macrófagos, mientras que la hiperexpresión de PTEC humana podría disminuirlo. Sin embargo, el TIC específico de macrófagos a heces in vivo no sólo está regulado por el eflujo de colesterol, sino también por el catabolismo del cHDL y la excreción hepatobiliar de colesterol y ácidos biliares, así como por su reabsorción intestinal. Por lo tanto, pueden presentarse cambios en estos campos que atenúen o anulen el efec to del primer paso de la vía del TIC específico de macrófagos. Así, por ejemplo, el aumento de la expresión de apoA-I humana o la activación de LXR altera no sólo el eflujo de colesterol desde macrófagos, sino también el catabolismo de las HDL y la excreción hepatobiliar del colesterol y, consecuentemente, incrementa el TIC desde macrófagos a plasma, hígado y heces in vivo24,39,47,48. Es destacable que el gemfibrozilo, a pesar de aumentar la concentración del cHDL, no altera la expresión de apoA-I. Estos datos coinciden con los datos de Staels et al y podrían indicar que el gemfibrozilo actúa como un agonista parcial de PPARα produciendo un efecto marginal en la concentración plasmática de apoA-I29. En el caso de la rosiglitazona, encontramos una disminución en la cantidad de colesterol marcado radiactivamente en plasma que podría ser debido a cambios en la remodelación y el catabolismo de las HDL26. A pesar de esta disminución en la cantidad de 3H-colesterol en plasma, no se encontraron diferencias en hígado ni en heces. En este sentido, es conocido que la concentración en plasma del colesterol marcado radiactivamente y derivado de macrófagos no es por sí misma un marcador del flujo a través del compartimento plasmático y, como se ha comentado anteriormente, la captación en hígado del cHDL y la excreción biliar también influyen en el TIC específico de macrófagos49.
En conclusión, ni la expresión de PTEC humana en ratones ni el tratamiento con gemfibrozilo o rosiglitazona prducen cambios en el TIC específico de macrófagos. Por lo tanto, el posible efecto antiaterogénico de la inhibición de PTEC y la acción antiaterogénica de gemfibrozilo y rosiglitazona no parecen funcionar a través de esta vía.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este estudio ha sido financiado gracias a una beca para investigación básica de la Sociedad/Fundación Española de Arteriosclerosis 2006 a FBV. NR es investigadora en formación del FIS (FI05/00221). CIBER de Diabetes y Enfermedades Metabólicas Asociadas es un proyecto del Instituto de Salud Carlos III.