Si bien carecemos de suficiente evidencia que justifique suplementar con vitaminaD en la prevención y/o tratamiento de la infección por COVID-19, a la fecha resulta cada vez más factible que esta hipótesis sea válida. Dos mecanismos básicos generales deberían ser considerados. Uno sería la acción antiinfecciosa e inmunomoduladora que ejerce mejorando las barreras intercelulares por estímulo de la inmunidad innata, así también por modulación de la inmunidad adaptativa. También, la vitaminaD reduce la producción de citoquinas inflamatorias como IL-2 e interferón gamma (INF-γ). Más recientemente se han demostrado múltiples efectos pleiotrópicos sobre las acciones de la vitaminaD a nivel antiinflamatorio e inmunomodulador. Esto explica resultados positivos en estudios con influenza, coronavirus y otras infecciones respiratorias. Se ha descrito relación inversa entre niveles séricos de vitaminaD y prevalencia de patología infecciosa respiratoria. De interés, otro abordaje mecanístico responde a considerar la inhibición del sistema renina-angiotensina-aldosterona, que se exacerba en la infección por COVID-19 debido a que el virus se une a la enzima ECA2, quedando disponible más angiotensinaII para causar daño. La vitaminaD inhibe mediadores del SRAA —presente en todas las células del organismo—, y al inhibir la actividad ECA y aumentar la ECA2, disminuye los niveles de angiotensinaII. Presentamos estudios con propuestas de dosis recomendadas de vitaminaD, y aunque no quede concretada una única guía, los posibles beneficios son promisorios. Finalmente, el propósito de la presente revisión es compartir esta idea con profesionales de la salud para encender el debate y llamar a la reflexión crítica, de modo tal que se pueda contribuir con el emprendimiento de diseños clínicos adecuados para validar los beneficios de utilizar altas dosis de vitaminaD en beneficio de la salud pública, sobre todo en tiempos de esta emergencia por COVID-19.
Although we lack enough evidence to justify supplementing with vitaminD in the prevention and treatment of COVID-19 infection, it is increasingly feasible that this hypothesis is valid. Two general underlying mechanisms should be considered. One would be the anti-infectious and immunomodulatory action that it exerts by improving intercellular barriers by stimulating innate immunity, as well as by modulating adaptive immunity. Also, vitaminD reduces the production of inflammatory cytokines, such as IL-2 and interferon-gamma (INF-γ). More recently, multiple pleiotropic effects have been demonstrated on the actions of vitaminD at the anti-inflammatory and immunomodulatory level with positive results in studies with influenza, coronavirus, and other respiratory infections. An inverse relationship between serum vitaminD levels and the prevalence of the respiratory infectious disease has been described. Of interest, another mechanistic approach responds to considering the inhibition of the renin-angiotensin-aldosterone system (RAAS), which is exacerbated in COVID-19 infection because the virus binds to the enzyme ACE2, making more angiotensinII available to cause damage. VitaminD inhibits mediators of RAAS — present in all cells of the body — and by inhibiting ACE activity and increasing ACE2, it lowers angiotensinII levels. We present studies with proposals for recommended doses of vitaminD, and although a single guideline is not specified, the possible benefits are promising. Finally, the purpose of this review is to share this idea with health professionals to ignite the debate and call for critical reflection, so that it can contribute to the undertaking of more and better clinical designs to validate the benefits of using high doses of vitaminD for the benefit of public health and especially in times of crisis for COVID-19.
En los últimos meses se han implementado múltiples estrategias terapéuticas —algunas con base científica y otras hasta empíricas— para el abordaje de la afectación pandémica por COVID-19 y que incluyen fármacos antirretrovirales, corticoides, inmunomoduladores, entre otros. De interés, los tratamientos empíricos tienen su base racional debido a la urgencia del caso y también a la falta de evidencia clínico-farmacológica para la COVID-19. No obstante, resulta clave recordar que el empirismo enfatiza el papel de la experiencia y la evidencia y, por lo tanto, construye tarde o temprano al rigor de la evidencia médica o medicina basada en la evidencia. En este sentido, a la fecha, carecemos de suficiente evidencia (varios estudios clínicos) que avale los beneficios de implementar altas dosis de vitaminaD en la población y/o en pacientes expuestos al SARS-CoV-2. Sin embargo, la validación de la hipótesis parece cada vez más próxima.
En rigor, es conocido que los receptores de vitaminaD (VDR) existieron en organismos muy primitivos que carecían de un sistema dérmico apropiado para sintetizar su ligando específico, la vitaminaD. También, estos organismos carecían de aparatos como el osteoarticular, cardiovascular, riñones e inclusive pulmones1. Consecuentemente surge el planteamiento de cuál sería su propósito, y una primera aproximación de respuesta sería la de formar parte de un complejo sistema de defensa. Los VDR fueron originalmente descritos dentro de las células a nivel citoplasmático, pero luego y de especial interés, también se los halló en algunas organelas fundamentales como las mitocondrias2,3. Esta inédita localización reforzó la noción de efectos no genómicos para la vitaminaD, sobre todo si consideramos que sus acciones más conocidas (tanto genómicas como no genómicas) son el producto de la interacción hormona-receptor a nivel citoplasmático. Esta unión que sufre regulación forma un complejo factor de transcripción que, translocado al núcleo celular, produce la modulación de múltiples genes mediadores del metabolismo fosfocálcico4,5.
Para destacar, más de dos décadas atrás fue descrita una diversidad de acciones para la vitaminaD que incluían tanto las relacionadas con el metabolismo fosfocálcico como otras «pleiotrópicas» y que incluían la inhibición de la proliferación de células cancerosas, efectos sobre la secreción hormonal y supresión de la proliferación de célulasT, así como también la modulación de ciertas citocinas6. En este sentido, más recientemente se demostró que la vitaminaD y sus metabolitos participan activamente en la regulación de las respuestas inmunes innatas y adaptativas, por lo que su deficiencia se asocia con una serie de infecciones autoinmunes y alérgicas7. Estos hallazgos justifican las elucubraciones sobre los antecedentes evolutivos y dan soporte a la idea de que probablemente su rol primario sea el de defensa celular y tisular a través de mecanismos inmunológicos y/o la regulación de procesos inflamatorios. Adicionalmente, la evolución también le posibilitó interaccionar con otros sistemas fundamentales en el mantenimiento de la homeostasis celular. Así, la vitaminaD se contrapone y/o modula las vías de señalización de otro sistema ancestral, el sistema renina-angiotensina-aldosterona (SRAA), caracterizado por regular el medio interno y la hemodinamia en organismos superiores, pero y de central interés para la presente revisión, también funciona como un complejo sistema proinflamatorio1. Por ello, no resulta casual que la mayoría de las células de mamíferos expresen tanto VDR como receptores y enzimas del SRAA. La vitaminaD, sus metabolitos y receptores por un lado, y el SRAA por el otro, representarían las dos caras de una misma moneda —el mantenimiento del delicado equilibrio de defensa celular—, siendo mediadores de procesos proinflamatorios y antiinflamatorios.
Paralelamente, a la existencia de VDR en casi todas las células del organismo, y no solo a nivel renal, también se ha demostrado la presencia de la enzima 1-α-hidroxilasa, lo que sugiere cierta independencia entre los niveles circulantes de vitaminaD respecto de los niveles intracelulares8. Este concepto complejiza la comprensión sobre el valor diagnóstico/pronóstico de las determinaciones de vitaminaD circulante y su posible implicación en enfermedades no clásicamente relacionadas con la vitaminaD como el cáncer, la esclerosis múltiple y la preeclampsia, entre otras9.
Acciones de la vitaminaD vinculadas al eje infección, inflamación, respuesta inmune y lesión de órganos blancoVitaminaD como hormona antiinfecciosa e inmunomoduladoraComo previamente fuera mencionado, la vitaminaD puede disminuir el riesgo de infecciones por diversos mecanismos, que incluyen el de participar en la integridad de una barrera física y mejorar la inmunidad innata celular y/o la adaptativa10.
El efecto de barrera se ejercería mediante la estimulación de genes que codifican proteínas relacionadas con la integridad y las uniones celulares tales como ocludina (uniones estrechas), conexina43 (uniones gap) y caderinaE (uniones adherentes)11. Al respecto, cabe aclarar que en general los virus alteran la integridad de esas barreras, lo que aumenta su grado de infectividad12, y por ello resulta promisoria la actividad de mantener íntegra la barrera celular demostrada para la vitaminaD.
Por otro lado, y con relación al sistema inmune propiamente dicho, se ha podido establecer que células especializadas en defensa como macrófagos, monocitos, células dendríticas, linfocitosT yB expresan VDR y enzimas para la síntesis de vitaminaD13,14. El estímulo que ejerce la vitaminaD sobre la inmunidad innata celular se realiza mediante la inducción de péptidos antimicrobianos como catelicidina y beta-2-defensina. Catelicidina altera las membranas y actúa sobre bacterias, virus, hongos y hasta el bacilo de Koch; además, contribuye a disminuir la denominada «tormenta de citoquinas» que ocurre en infecciones virales severas como las descritas para COVID-1915, inhibiendo la producción de citoquinas proinflamatorias de células Th1 como el factor de necrosis tumoral alfa (TNF-α) y el interferón gamma (INF-γ)16. Por su parte, el péptido humano beta-2-defensina es producido por células epiteliales y presenta una potente actividad antimicrobiana contra bacterias gramnegativas y Candida, lo que ha permitido postular que beta-2-defensina podría contribuir a reducir la frecuencia de infecciones en la piel y —de interés para esta revisión— en el tejido pulmonar17.
Con relación a la vitaminaD y su acción sobre la inmunidad adaptativa, esta se realiza por supresión de las respuestas mediadas por célulasT helper tipo1 (Th1), reduciendo la producción de las citoquinas proinflamatorias como interleucina-2 (IL-2) e INF-γ18. Asimismo, promueve la producción de citoquinas antiinflamatorias por las células Th2, colaborando con la inhibición de Th1, y la inducción de células regulatoriasT.
En consideración de los antecedentes citados, resulta oportuno mencionar que múltiples estudios han podido demostrar que las personas con enfermedades crónicas tienen menores niveles de vitaminaD en relación con los sujetos sanos. Inclusive se ha discutido si el déficit es causa o consecuencia de estas afecciones (la vitaminaD puede ser consumida en su papel de defensa frente a la injuria). No obstante, lo que resulta contundente a la luz de la evidencia es que existe una fuerte asociación entre el déficit y la presencia de enfermedades no clásicas para el espectro de la vitaminaD. Con respecto a los estudios de suplementación contra placebo, son escasos y la mayoría de ellos fueron realizados con dosis bajas, durante lapsos de tiempo breve, o en sujetos saludables con valores normales de vitaminaD. Estos diseños difícilmente pudieron establecer beneficios, mientras que, como era de suponer, no demostraron diferencias y/o algún beneficio al comparar individuos de condiciones semejantes19,20. Sin embargo, se ha reportado relación inversa entre el status de la vitaminaD y la ocurrencia de diversas enfermedades virales (dengue, hepatitis, herpes virus, influenza, virus sincitial respiratorio, rotavirus, infecciones del tracto respiratorio alto, entéricas, urinarias, neumonía, otitis media, vaginitis, sepsis, hepatitis y VIH21.
VitaminaD e infecciones viralesGripe (influenza estacional)El virus de la influenza afecta al tracto respiratorio por infección viral directa o por daño a la respuesta del sistema inmune. Además, se ha reportado que un tercio de los pacientes hospitalizados con influenza confirmada desarrollan neumonía, y esto fue más prevalente en niños y ancianos, o en pacientes pulmonares crónicos, cardíacos, fumadores o inmunocomprometidos22. Se conoce que la supervivencia del virus es mayor en las estaciones con bajas temperaturas, pero además se ha sugerido que el aumento de la incidencia en invierno puede responder también a la menor radiación solar y, consecuentemente, a un inferior nivel de vitaminaD23. Luego, y como resultado de un pobre nivel de vitaminaD, serían sintetizados menos péptidos endógenos con propiedades antibióticas (defensinas y catelicidinas) como los citados previamente. Al respecto, la producción de catelicidina es dosis-dependiente del nivel de vitaminaD. Más específicamente, se estableció que 30ng/ml de vitaminaD son requeridos como mínimo para la óptima inducción de catecilidina24. Este mismo nivel de vitaminaD fue establecido como valor de corte (Third National Health and Nutrition Examination Survey) para menor incidencia de infecciones respiratorias altas25.
Posteriormente, en 2018 se revisó el rol de la vitaminaD en la influenza, y como resultado del análisis en estudios de suplementación contra placebo, utilizando distintas metodologías y posologías, se pudieron establecer resultados positivos en la mayoría de ellos26-28. Además, el estudio GrassrootsHealth, basado en cuestionarios a 12.605 participantes donde se confrontaba la presencia o no de síndrome gripal en los últimos 6meses y medición de vitaminaD, estableció que los individuos con niveles del orden de los 60ng/ml de vitaminaD o valores superiores presentaron un riesgo un 43% menor de enfermedades como influenza en relación con los que tenían valores iguales o inferiores a 20ng/ml (p<0,0001)29 (https://www.grassrootshealth.net/project/our-scientists/).
Infecciones por coronavirusLos virus como influenza y coronavirus producen infecciones especialmente en invierno, pudiendo ser particularmente graves y hasta mortales por neumonías. Así, durante la actual pandemia por COVID-19 se ha postulado una promisoria hipótesis sobre mayor casuística y muertes en regiones donde el nivel promedio de vitaminaD resulta bajo30. En acuerdo, durante el invierno chino los casos fatales fueron mayores a mayor edad (14,8% para individuos de 80años o más), más en hombres que en mujeres (2,8% vs. 1,7%) y más frecuente con comorbilidades (mayor edad, más enfermedades crónicas).
Pero también existen otras variables de interés para analizar, como la étnica. Actualmente las tasas de morbimortalidad por COVID-19 en individuos afroamericanos o negros son las más altas en muchos lugares del mundo. Específicamente, una encuesta sobre la comunidad estadounidense y la Universidad Johns Hopkins indicó que la tasa de infección es más del triple y la tasa de mortalidad es 6veces más alta en los condados con predominio de personas negras que en aquellos con mayorías blancas31. Cabe destacar que si bien este hallazgo podría responder a múltiples factores confundidores, como la variable socioeconómica, resulta innegable el dato objetivo de saber que los afroamericanos presentaban niveles séricos bajos de vitaminaD respecto a la población de raza blanca32. Destaca el hecho que dentro de la etnia afroamericana se pudo establecer una mayor casuística en estados con menor exposición solar y con más frío.
En consecuencia, la línea de razonamiento nos orienta a inferir que en todos los casos donde existan niveles de vitaminaD bajos o muy bajos se verán favorecidos los mecanismos mediante los cuales virus como el de la influenza y el coronavirus podrán alterar con mayor facilidad el epitelio pulmonar a través de una mayor producción de citocinas Th1 como parte de la respuesta inmune innata a la propia infección viral16. Del mismo modo, bajos niveles de vitaminaD favorecerían la liberación de INF-γ18, resultando en última instancia responsable de la injuria en la fase tardía de la patología por SARS-CoV-233. Aquí la denominada «tormenta de citoquinas», favorecida por el déficit de vitaminaD, complicará aún más estas infecciones virales, como lo reportado para COVID-19, donde se producen verdaderos estallidos de las citocinas Th2 (IL-4 e IL-10)15.
No obstante los recientes hallazgos sobre posibles efectos antivirales de la vitaminaD, sus complejos mecanismos aún resultan poco conocidos en profundidad. Esto responde a la intrincada relación establecida entre las infecciones virales y la vitaminaD, que incluye, entre otros factores, la inducción del estado antivírico, las características inmunorreguladoras funcionales, la interacción con factores celulares y virales, la inducción de autofagia y apoptosis, alteraciones genéticas y epigenéticas. Al parecer la vitaminaD interfiere de manera transitoria en las vías de señalización intracelular viral, provocando un efecto modulador esencial en la transcripción del gen viral21.
Acciones antiinflamatorias y antioxidantes de la vitaminaD a nivel pulmonarLas células epiteliales pulmonares tienen una alta expresión de la enzima 1-α-hidroxilasa, lo que permite la síntesis local de 1,25-dihidroxivitaminaD, la forma más activa de vitaminaD, también llamada calcitriol. El calcitriol inhibe la producción y la secreción de muchas citocinas de las células del músculo liso bronquial, como el factor de crecimiento derivado de plaquetas, RANTES (regulador en la activación de célulasT normales expresadas y secretadas) y metaloproteinasas de matriz, lo que conduce a una reducción de la proliferación y de la inflamación en las células del músculo liso pulmonar. La vitaminaD estimula la síntesis de IL-10 por las células CD4+, CD25+, Foxp3+ y T-reguladoras. Al mismo tiempo inhibe la activación de las células dendríticas regulando negativamente la expresión de CD80/86 y CD40. Además, y como previamente se hiciera mención, la vitaminaD estimula la expresión de catelicidina y muchas otras moléculas antiinfecciosas34,35.
La suplementación con 1,25-dihidroxivitaminaD suprime el reclutamiento de eosinófilos y linfocitos en las vías respiratorias, disminuye la producción de IL-4 de las célulasT e inhibe la migración de las célulasT atenuando la respuesta inflamatoria36. Además funciona como adyuvante para otras terapias, como la inmunoterapia contra alérgenos37. La administración simultánea de vitaminaD y dexametasona en pacientes asmáticos resistentes a los esteroides aumentó la síntesis de IL-10 a niveles similares a los encontrados en pacientes sensibles a los esteroides tratados solo con dexametasona38.
También se ha descrito la reducción significativa de los niveles séricos de IgE y eotaxina en un modelo de asma por el tratamiento con vitaminaD39. Además, disminuyó la infiltración de células inflamatorias en las vías respiratorias, los niveles séricos de IL-6, el TNF-α y la IL-1β, así como también la expresión de la proteína apoptótica asociada a Bcl2, caspasa3, TLR4, NF-κB y NF-κB p65 fosforilada. Consecuentemente, la vitaminaD elevó los niveles séricos de IL-10 reduciendo la respuesta inflamatoria y apoptótica en ese modelo de ratón asmático40. De interés, la vitaminaD suprimió la síntesis de 8-isoprostano (8-iso), de IL-6 y de factor estimulante de colonias de granulocitos y macrófagos en células epiteliales bronquiales humanas expuestas a partículas contaminantes. Además, aumentó la expresión del gen de la vía antioxidante G6PD y los niveles de glutatión oxidado, por lo que se infiere que la vitaminaD parece proteger pulmones y vías respiratorias en la patología asmática a través de sus efectos antiinflamatorios y antioxidantes41.
En un modelo murino de inflamación pulmonar inducida por bleomicina el calcitriol redujo la inflamación pulmonar temprana al atenuar la infiltración de células inmunes, reprimir la secreción de citocinas inflamatorias, bloquear la translocación nuclear del factor nuclear kappaB (NF-κB) p65, inhibir la fosforilación de p38 MAPK pulmonar y proteína quinasaB (Akt), atenuando la actina alfa del músculo liso (un marcador para la transición epitelial-mesenquimatosa en los pulmones, que promueve la fibrosis), y disminuyó la fosforilación del factor de crecimiento transformante beta1 (TGF-β1) regulada por aumento y Smad42. El calcitriol también causó una reducción del 40% en el reclutamiento de neutrófilos a los pulmones en un modelo animal de lesión pulmonar aguda. Este efecto antiinflamatorio de la vitaminaD puede estar mediado por la inhibición de la secreción de IL-8 a nivel pulmonar43.
La administración de vitaminaD a ratas neonatas con lesión pulmonar inducida por hiperoxia (como modelo de displasia broncopulmonar) causó la atenuación de esta lesión a través de varias acciones protectoras, como preservar la integridad de la estructura pulmonar, disminuir la inflamación al regular negativamente la activación de TLR4, reduciendo la deposición de la matriz extracelular y la inhibición de la apoptosis de las células pulmonares44. La vitaminaD también ha demostrado tener efectos inmunomoduladores y antiinflamatorios en el tratamiento de la fibrosis quística de las vías respiratorias, ya que reduce la expresión de CD279 (PD-1) en las célulasT CD4+ y CD8+. Además, la vitaminaD disminuyó la frecuencia de CD8+T y célulasT invariantes asociadas a la mucosa que co-expresan los marcadores de activación de CD38 y el antígenoD de los leucocitos humanos. Por lo tanto, el tratamiento con vitaminaD evitaría la progresión del daño pulmonar asociado con la fibrosis quística de las vías respiratorias45.
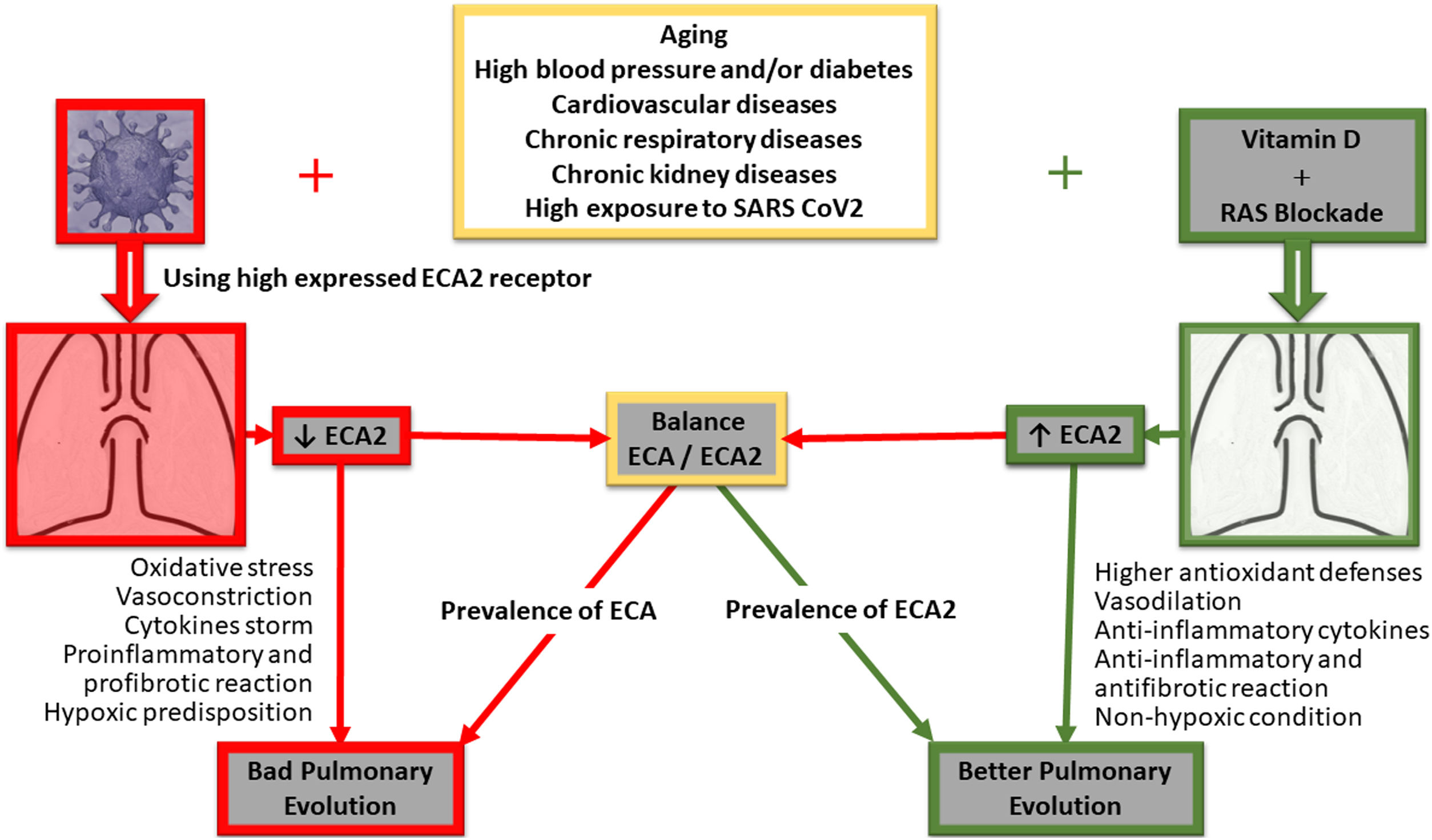
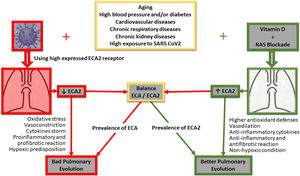
El estrés oxidativo que causa el humo del tabaco empeora la progresión de la enfermedad pulmonar obstructiva crónica (EPOC). En este sentido, la vitaminaD también se ha propuesto como un antiinflamatorio y antioxidante natural capaz de mejorar el pronóstico de esta patología pulmonar en pacientes fumadores46. De hecho, se ha observado que los pacientes con EPOC tienen niveles plasmáticos más bajos de vitaminaD que los pacientes sanos, lo que sugiere una posible correlación entre una defensa antioxidante deficiente y el desarrollo de esta enfermedad pulmonar47. De interés central para el presente trabajo de revisión, hace algunos años nuestro grupo planteó la discusión sobre una pandemia mundial de deficiencia de vitaminaD como una posible explicación a la elevada actividad inflamatoria celular inducida por el SRAA1. La discusión original involucró un número significativo de patologías, principalmente cardiovasculares, pero todas ellas de base inflamatoria similar. En la actualidad, con el enfoque central en la inflamación pulmonar aguda causada por COVID-19, el estudio longitudinal irlandés sobre el envejecimiento (TILDA2020) refuerza la idea de que una suplementación adecuada de vitaminaD, especialmente en personas mayores, puede ser beneficiosa para la población de grupos vulnerables durante este brote pandémico por COVID-1948. En este sentido, la vitaminaD inhibe a la proteína Skp2, que juega un papel central en el mecanismo de replicación viral del COVID1949 y que utiliza el bloqueo de la autofagia para su acelerada replicación e infectividad. El virus induce a la ya mencionada Skp2, que a su vez inactiva a la Beclina1, un componente esencial del proceso autofágico (fig. 1).
La figura resume de manera simple las principales vías implicadas en la evolución clínica a nivel pulmonar de pacientes COVID-19 positivos, su correlato con los receptores ECA/ECA2, y como su desacople condicionaría una mala evolución a nivel pulmonar. Por otro lado, se esquematizan tanto el bloqueo de SRAA como la implementación de vitaminaD, destacando el impacto potencial de vitaminaD en el restablecimiento de vías de señalización y la posible mejor evolución clínica pulmonar del paciente COVID-19 positivo.
La infección por coronavirus produce un riesgo elevado de complicaciones y mortalidad en los ancianos, hipertensos, diabéticos o pacientes que padecen enfermedades cardíacas o pulmonares previas. Los informes iniciales de la evolución de los pacientes en China, donde estalló la epidemia, mostraron que los pacientes con las condiciones clínicas mencionadas anteriormente tenían entre tres y cuatro veces más complicaciones respiratorias, hospitalizaciones y mortalidad que los que no tenían tales condiciones preliminares50,51.
Una de las complicaciones más frecuentes es la hipertensión arterial, y como factor de riesgo relevante condujo a diferentes especulaciones. En este sentido, y con resultados provenientes desde las ciencias básicas, se propuso como hipótesis que los medicamentos que bloquean al SRAA (inhibidores de la enzima convertidora de angiotensina [IECA] y los bloqueantes de receptores de angiotensinaII [BRA]) podrían aumentar el riesgo para los pacientes con COVID-19. Esto se fundamentaría en su mecanismo de acción, que aumentaría la producción de la enzima convertidora de angiotensina tipo2 (ECA2)52. El trabajo experimental demostró que el uso de estos fármacos aumenta los niveles de ECA253. ECA2 es el receptor al que los coronavirus, tanto el SARS-CoV como el SARS-CoV-2 (COVID-19), se unen para ingresar a la célula54,55. La hipótesis planteada por los autores y declarada nuevamente en una carta editorial más reciente es que el aumento de ECA2 podría aumentar la carga viral, lo que a su vez explicaría el aumento de la morbimortalidad.
Tal hipótesis no prosperó debido, entre otros aspectos, a que los primeros informes de China no declararon si los pacientes infectados que recibieron medicamentos del tipo IECA/BRA tuvieron una peor evolución en su curso clínico. De hecho, hasta la fecha se carece de datos que muestren una relación causal entre el aumento de ECA2 y el aumento de la mortalidad por COVID-19. Los estudios disponibles no describen si los pacientes recibían IECA/BRA, y solo por información indirecta se puede inferir que aproximadamente un 33% de ellos estaban bajo dichos tratamientos. Tampoco se ha demostrado que la hipertensión, e inclusive la diabetes, fueran predictores de riesgo independientes56.
Las sociedades científicas internacionales muy criteriosamente acordaron que no hay evidencia que sugiera que se deban modificar los tratamientos con bloqueadores SRAA, de modo tal que se acepta que la interrupción del tratamiento conlleva un riesgo muy alto. De hecho, sí existe evidencia de lo contrario, y convalida la decisión de dichas sociedades. En efecto, se estudiaron pacientes hipertensos hospitalizados por COVID-19, y el uso de IECA/BRA se asoció con un menor riesgo de mortalidad por todas las causas en comparación con los pacientes no tratados con IECA/BRA. Los autores reconocen que la interpretación del estudio debe contemplar posibles factores de confusión; sin embargo, concluyen que es poco probable que el uso de IECA/BRA se asocie con un mayor riesgo de mortalidad en pacientes COVID-19 positivos57.
En contraposición a la hipótesis del no uso de IECA/BRA en hipertensos, otros autores han propuesto una perspectiva diferente. Aquí la hipótesis sería una posible acción protectora de los bloqueadores del SRAA en la infección por COVID-1958,59. En acuerdo, se han registrado dos ensayos clínicos, aún no iniciados, para evaluar la acción de losartán en el curso de la infección viral (# NCT04312009 y # NCT04311177 Clinicaltrials.gov).
La hipótesis sobre la utilidad de los bloqueadores SRAA también proviene de la mecanística que utiliza el virus para ingresar a la célula mediante los receptores ECA2 y la concomitante reducción de los niveles intracelulares de ECA2. La ECA2, a diferencia de la enzima convertidora de angiotensina (ECA) clásica, degrada la angiotensinaII de modo que la reducción inducida por el virus agrava la acción patogénica de la mayor concentración de angiotensinaII en el pulmón60. Los niveles de ECA2 ejercen una acción protectora sobre el parénquima pulmonar. Al respecto, existe evidencia de que niveles elevados de ECA2 a nivel del tejido pulmonar son relevantes en el proceso de defensa contra las infecciones virales respiratorias. El mecanismo dilucidado sería que ECA2 disminuye la liberación masiva de citocinas y el consecuente infiltrado inflamatorio que conduce a las conocidas complicaciones respiratorias graves61. En consecuencia, la sugerencia inicial de descontinuar los bloqueadores de SRAA puede ser una estrategia contraproducente para la evolución del paciente, y esto no solo al desestabilizar sus niveles de presión arterial en un momento clínico complejo sino también a través del posible riesgo de eliminar el factor protector de un aumento de ECA2 en la patogénesis pulmonar por COVID-19.
Paralelamente, existe otra forma de contrarrestar la consecuente exaltación del SRAA, especialmente mediante la inducción de la ECA2. Esto puede lograrse mediante la administración de dosis apropiadas de vitaminaD. Los niveles más altos de cualquiera de los elementos están inversamente asociados con los niveles más bajos del otro. Existe abundante evidencia de que la administración de vitaminaD atenúa la actividad del SRAA a nivel circulante, pero notablemente más a nivel tisular e intracelular1. De esta manera, la vitaminaD bloquearía la cascada inflamatoria por reducción de la actividad del SRAA62.
La vitaminaD reduce la actividad de ECA y aumenta la actividad de ECA2, lo cual tiene un efecto protector a nivel pulmonar, restaurando el equilibrio ECA/ECA2. Esta restauración del equilibrio mediada por la vitaminaD ha resultado clave en la reducción de los eventos respiratorios en modelos experimentales63. Los bajos niveles de vitaminaD están asociados con un aumento de las infecciones respiratorias. En ensayos clínicos controlados la administración de vitaminaD también ha demostrado un efecto protector sobre las infecciones en sujetos sanos y pacientes con enfermedad pulmonar obstructiva crónica (EPOC)26,64-67.
De interés particular, se han publicado diferentes ensayos sobre el tema y también revisiones sistemáticas a través de metaanálisis. En su mayoría informan beneficios en la reducción de afecciones respiratorias, y varios de ellos usaron suplementos de vitaminaD68-77. También se han reportado beneficios potenciales recientemente en infecciones por el virus del dengue78,79 (fig. 1).
Conductas sugeridas acorde a los niveles de vitaminaDAl respecto, se ha demostrado que el grado de protección contra infecciones aumenta a medida que aumentan los niveles de vitaminaD, pero esta relación no ha permitido establecer aún un nivel de corte adecuado. No obstante, un estudio observacional reportó que valores de 38ng/ml resultan apropiados para disminuir el riesgo de infecciones respiratorias agudas virales80. Por otro lado, algunos autores sugieren mantener un nivel de vitaminaD de por lo menos 30ng/ml o incluso mantenerlo en un rango entre 40 y 60ng/ml para reducir los procesos infecciosos. Así se pudo establecer que las infecciones intrahospitalarias posquirúrgicas fueron tres veces mayores con valores de vitaminaD inferiores a 30ng/ml81, y que estas infecciones disminuían un 33% por cada 10ng/ml de incremento en los niveles de vitaminaD82.
Conforme con la evidencia médica, la conducta clínica habitual sugiere que ante un déficit severo de vitaminaD se debe establecer un esquema terapéutico en dos etapas: la primera con una alta dosis de carga y luego otra menor de mantenimiento83. En este sentido, se ha reportado el uso de la denominada «dosis de carga» de vitaminaD para llegar a un nivel objetivo en donde se puede lograr una concentración plasmática de vitaminaD de 30ng/ml empleando distintos regímenes posológicos (diaria, semanal, quincenal, mensual). De interés, en pacientes con elevación de marcadores inflamatorios como los obesos se ha establecido que el aporte necesario debe ser de 2 a 3 veces superior al establecido para la población general, y ante sobrepeso, por lo menos 1,5 veces superior a la población general84.
Las emergentes circunstancias actuales de pandemia por COVID-19 requieren conductas terapéuticas de base científico/racional e inclusive, como se mencionó previamente, empíricas. Con respecto a lo que se conoce de la vitaminaD, resulta aún escaso su protagonismo, pero paulatinamente contamos con más datos que la avalan como estrategia adyuvante para intentar brindar una rápida y efectiva protección frente el riesgo de infección por el SARS-CoV-2. En este sentido, existen distintas posturas, como dosis diarias por un tiempo corto, o bien el empleo de una dosis de carga inicial seguida por dosis altas de vitaminaD durante un periodo corto de tiempo, permitiendo en cada caso, y en tiempos de pandemia, lograr concentraciones dentro de rangos apropiados de van entre 30 y 50ng/ml o superiores. Más específicamente, se han propuesto estrategias, como la sugerida por Grant et al.30, con una dosis de 10.000UI/día durante un mes para poder alcanzar rápidamente el objetivo de niveles entre 40 y 60ng/ml, y luego continuar con 5.000UI/día durante algunas semanas más.
Llama la atención el nivel propuesto de dosis elevadas desestimando los posibles efectos tóxicos; sin embargo, en este sentido existen estudios que demuestran que una dosis de 10.000UI/día durante 4-6meses carece de efectos adversos. En detalle, Amir et al.85 lo comprobaron en mujeres canadienses con cáncer de mama y metástasis óseas. Del mismo modo, el equipo de investigadores dirigido por el Dr. Holick86 —uno de los grupos más destacados en estudios con vitaminaD— suplementó a pacientes oncológicos con altas dosis de vitaminaD y tampoco establecieron toxicidad; por el contrario, mejoró la microbiota intestinal de los pacientes tratados. El mismo grupo trabajó con 10.000UI/diarias durante 6meses —sin provocar hipercalcemia— y logró niveles de vitaminaD del orden de los 78,6±13ng/ml87.
También se trató a pacientes psiquiátricos en un hospital de Cincinnati, Ohio, con dosis de 5.000 o 50.000UI/día durante 16meses, y como resultado no encontraron efectos adversos; solo se recomendó que si el paciente recibía además suplementación de calcio, la dosis del mismo no debería ser alta para minimizar el riesgo de hipercalcemia88.
La apuesta fue superior en otros trabajos con propuestas de dosis inicial de 100.000UI si se desean concentraciones séricas >20ng/ml, dosis inicial de 300.000UI si se desean concentraciones >30ng/ml, e inclusive se ha sugerido el uso de dosis iniciales >500.000UI en adultos sanos89,90.
Como corolario, el Dr. Alipio91 acaba de publicar resultados que proporcionan información sustancial a médicos y formadores de políticas sanitarias. Específicamente, concluyó que la suplementación con vitaminaD mejora la evolución clínica de los pacientes infectados por COVID-19 en función del aumento de la probabilidad de tener un resultado leve cuando aumenta el nivel en suero de vitaminaD, mientras que una disminución sérica de vitaminaD se asocia con peor evolución clínica.
Conclusiones y perspectivasEn consecuencia y ante esta epidemia devastadora para la que carecemos aún de tratamientos efectivos, la presente revisión recopila y propone explorar el efecto potencialmente protector de las altas dosis diarias de vitaminaD para aumentar rápidamente los niveles en sangre y tejidos, con el objetivo de contrarrestar la sobrecarga del SRAA y mejorar así el curso de la infección por COVID-19, sus complicaciones respiratorias (fig. 1) e inclusive de otros órganos. El propósito es abrir la discusión y crear un debate apropiado sobre la conducta de indicar vitaminaD a la población general, particularmente a los más expuestos, y como lo citado, lograr un aumento sérico y tisular para contrarrestar el desequilibrio de algunos de los componentes del SRAA y también manifestar sus propios efectos antiinflamatorios (fig. 1).
Consideramos que esta estrategia a nivel poblacional podría proporcionar una herramienta más en la defensa contra el virus y con nulos efectos adversos, como se demostró en la revisión de más de 76.000 pacientes incluidos en ensayos controlados con ingesta de vitaminaD. Por lo expuesto previamente, una posible dosis para obtener rápidos incrementos en los niveles plasmáticos de vitaminaD podría estar entre las 5.000 y/o 10.000UI diariamente, o bien de 50.000 a 100.000UI por semana92. Dado lo tentativo de la dosis propuesta podría considerarse el uso de dosis más bajas en niños o adultos jóvenes con bajo riesgo de exposición al virus. Al respecto, nuestro grupo de trabajo avanza sobre el desarrollo de protocolos controlados con diferentes poblaciones de personas en riesgo o ya infectadas, evaluando parámetros fisiológicos y eventos clínicos. Asumimos que dicha intervención no pretende eliminar el virus; sin embargo, resulta promisorio su potencial para dificultar el ingreso viral y, en caso de padecerlo, mejorar la evolución del paciente. Es decir, la ingesta de vitaminaD podría mejorar las condiciones de los pacientes para que puedan estar en más adecuadas condiciones para hacer frente y aumentar sus posibilidades contra la COVID-19 e inclusive otros cuadros infecciosos equivalentes.
Como lo descrito previamente, consideramos que la recomendación encuentra respaldo en múltiples informes. En acuerdo, muy recientemente, Grant el al.93 también proponen elevar las concentraciones séricas a través de la suplementación con vitaminaD y aseguran que esto podría reducir la incidencia, la gravedad y el riesgo de muerte por influenza, por neumonía y por la epidemia actual de COVID-19. También, Rhodes et al.94 han propuesto la suplementación con vitaminaD por lo menos para quienes en el hemisferio norte tienen más riesgo de enfermedad grave y muerte. Lo mismo que recomienda la Asociación de Dietistas del Reino Unido95 y editoriales en medios internacionales de rigor científico.
Finalmente, el propósito de compartir esta idea con profesionales de la salud es encender rápidamente el debate y llamar a la reflexión crítica que permita contribuir a emprender sin demoras más y mejores diseños clínicos para validar esta hipótesis en beneficio de la salud pública y sobre todo en tiempos de esta emergencia por COVID-19.
FinanciaciónEste trabajo fue financiado por becas del Consejo de Investigación y Tecnología de la Universidad de Cuyo (SECyT), Mendoza, Argentina, y de ANPCyT FONCyT, ambas adjudicadas a Walter Manucha. Beca n.o PICT 2016-4541.
AutoríaTodos los autores contribuyeron de igual manera en la concepción y diseño de la revisión, con una contribución sustancial sobre los datos, análisis e interpretación de los contenidos, redacción y revisión crítica del artículo para su contenido intelectual.
Conflicto de interesesLos autores declaran que no hay conflictos de intereses potenciales con respecto a la investigación, autoría y/o publicación de este artículo.