La enfermedad renal crónica (ERC) ha de ser considerada como una situación de alto e incluso muy alto riesgo cardiovascular, ya que provoca un aumento de la mortalidad cardiovascular que va incrementándose a medida que progresa la enfermedad.
Es preciso realizar un diagnóstico precoz de la ERC junto con la adecuada identificación de los factores de riesgo, al objeto de frenar su evolución a estadios más severos, evitar las complicaciones y retrasar, en lo posible, la necesidad de tratamiento sustitutivo renal.
La dislipidemia es un factor de progresión de la ERC que aumenta el riesgo de desarrollo de aterosclerosis y sus complicaciones. Su adecuado control contribuye a reducir la elevada morbimortalidad cardiovascular que presentan estos pacientes.
En esta revisión se evalúan las medidas terapéuticas hipolipemiantes necesarias para el logro de los objetivos recomendados, ajustando el tratamiento a la evolución de la enfermedad y a las características del paciente.
En la ERC parece prioritaria una intervención precoz e intensiva de la dislipidemia antes de que se produzca una disminución importante de la función renal. El tratamiento con estatinas ha demostrado ser seguro y eficaz en la disminución del cLDL y en la reducción de episodios cardiovasculares en individuos con ERC o después del trasplante renal; sin embargo, la evidencia en los pacientes dializados es menor.
Chronic kidney disease (CKD) has to be considered as a high, or even very high risk cardiovascular risk condition, since it leads to an increase in cardiovascular mortality that continues to increase as the disease progresses.
An early diagnosis of CKD is required, together with an adequate identification of the risk factors, in order to slow down its progression to more severe states, prevent complications, and to delay, whenever possible, the need for renal replacement therapy.
Dyslipidaemia is a factor of the progression of CKD that increases the risk in developing atherosclerosis and its complications. Its proper control contributes to reducing the elevated cardiovascular morbidity and mortality presented by these patients.
In this review, an assessment is made of the lipid-lowering therapeutic measures required to achieve to recommended objectives, by adjusting the treatment to the progression of the disease and to the characteristics of the patient.
In CKD, it seems that an early and intensive intervention of the dyslipidaemia is a priority before there is a significant decrease in kidney function. Treatment with statins has been shown to be safe and effective in decreasing LDL-Cholesterol, and in the reduction of cardiovascular events in individuals with CKD, or after renal transplant, although there is less evidence in the case of dialysed patients.
La enfermedad renal crónica (ERC) es una situación clínica generada por la pérdida gradual y progresiva de la función renal. La trascendencia de la ERC viene condicionada no solo por el deterioro progresivo de la calidad de vida y de la expectativa de vida cuando evoluciona a fases más avanzadas, sino también por el incremento en la morbimortalidad cardiovascular, principal causa de muerte en estos pacientes1. La mortalidad llega a ser en el estadio final de la ERC 30 veces superior a la de la población general, pudiendo ser 1.000 veces superior cuando afecta a grupos poblacionales de menor riesgo, como los niños y adolescentes2. Su prevalencia está claramente en aumento debido a la mayor esperanza de vida de la población general, al aumento de la diabetes y obesidad, y a la mayor supervivencia de los pacientes que han presentado un episodio cardiovascular o que han sido diagnosticados de insuficiencia renal crónica.
La ERC se define como la presencia de alteraciones en la estructura o función del riñón, durante más de 3 meses, secundaria a la reducción progresiva del número de nefronas, con el consecuente deterioro de la salud derivado de la incapacidad renal para realizar sus funciones excretoras, depurativas y metabólicas.
En la clínica diaria, su diagnóstico y clasificación, además de por su etiología, viene determinado por la disminución del filtrado glomerular estimado (FGe), valores <60ml/min/1,73m2, y/o la presencia de albuminuria3 (tabla 1).
Riesgo cardiovascular en la enfermedad renal crónica según categorías de filtrado glomerular estimado (FGe) y albuminuria
| Albuminuria persistente | ||
|---|---|---|
| A1 | A2 | A3 |
| Normal o leve incremento | Incremento moderado | Incremento severo |
| <30mg/g | 30-300mg/g | >300mg/g |
| Riesgo | ||
| Categorías FGe (ml/min/1,73m2) | |||||
|---|---|---|---|---|---|
| G 1 | Normal o alto | ≥90 | Bajo | Moderado | Alto |
| G 2 | Disminución leve | 60-89 | Bajo | Moderado | Alto |
| G 3a | Disminución leve-moderada | 45-59 | Moderado | Alto | Muy alto |
| G 3b | Disminución moderada-severa | 30-44 | Alto | Muy alto | Muy alto |
| G 4 | Disminución severa | 15-29 | Muy alto | Muy alto | Muy alto |
| G 5 | Fallo renal | <15 | Muy alto | Muy alto | Muy alto |
Fuente: modificado de «KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease»3.
La prevalencia de la ERC en España, según los datos del estudio EPIRCE4, se acerca al 10% al valorar conjuntamente el FGe y la albuminuria, alcanzando el 21,4% de los sujetos mayores de 64 años de edad referido únicamente a un FGe<60ml/min/1,73m2. La edad es el factor de riesgo que prioritariamente se relacionaba con la ERC, observándose el inicio de la pérdida de función desde la tercera década de la vida, con una pérdida importante de la función renal a partir de los 60 años de edad (OR 1,12 [1,10-1,14; p<0,0001] por cada año de incremento en la edad).
La ERC es un factor de riesgo independiente de la enfermedad cardiovascular5, incluso en los niños y adolescentes en los que la exposición a otros factores de riesgo cardiovascular es menor que en adultos2. Es manifiesto que la aterosclerosis en los pacientes con ERC, tanto preexistente como de nueva aparición, presenta una progresión acelerada6, incrementando la aparición de episodios cardiovasculares precoces (en varones <55 años o mujeres <65 años)7. Este efecto estaría relacionado con un patrón inflamatorio difuso que persiste a pesar de la posibilidad de corregir algún factor desencadenante, como pudiera ser la revascularización de la arteria renal en los casos de estenosis de la misma8.
Por todo ello, la ERC ha de ser considerada como una situación de alto e incluso muy alto riesgo cardiovascular, exigiendo un diagnóstico y tratamiento precoces, abordando aquellos factores de riesgo, que identificados a lo largo de la evolución de la enfermedad, pudieran ser modificados.
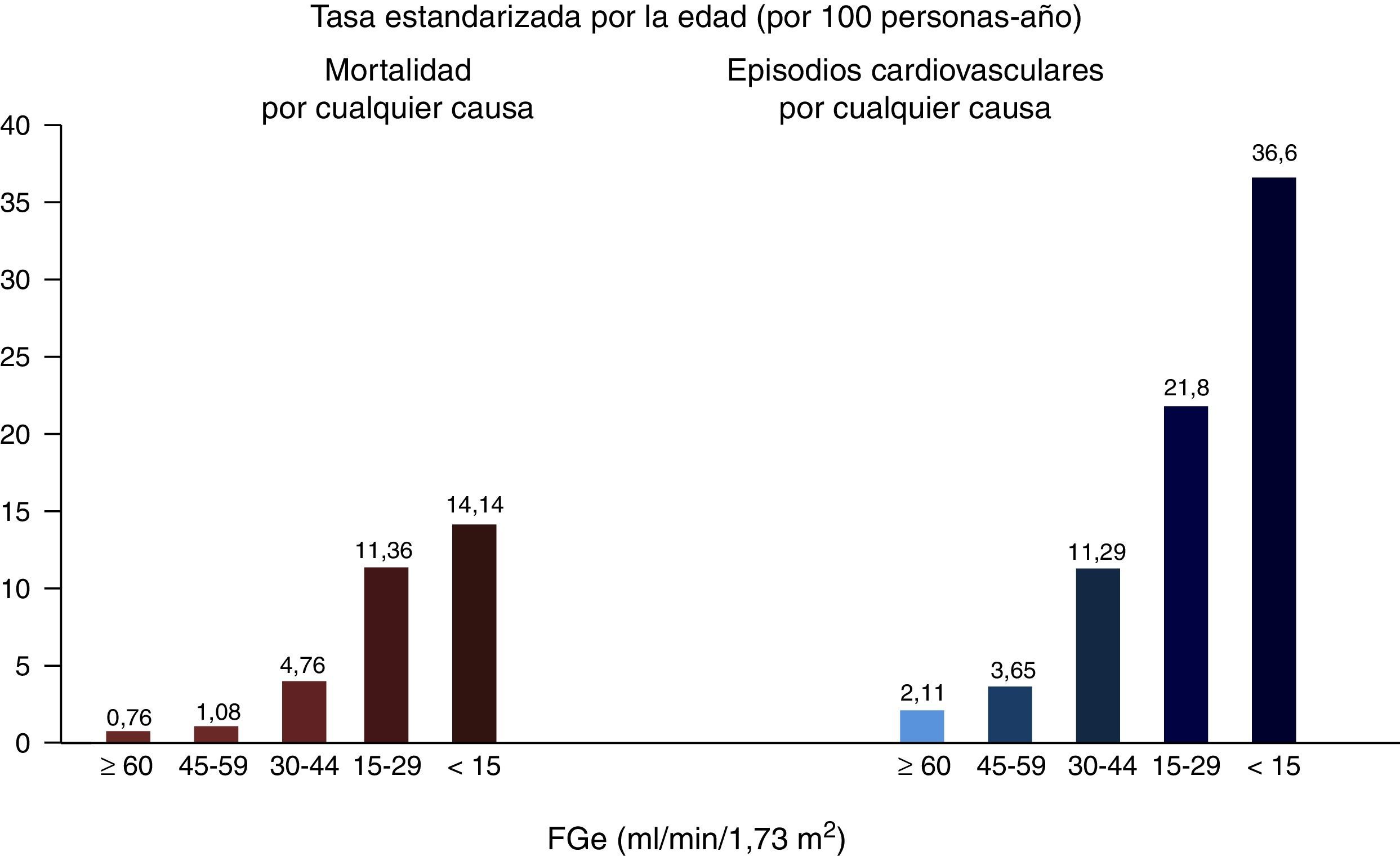
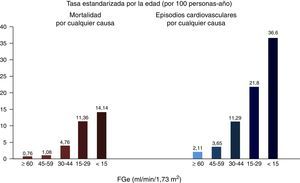
Enfermedad renal crónica y riesgo cardiovascularLa ERC se asocia con la presencia de enfermedad cardiaca coronaria, insuficiencia cardiaca, arritmias cardiacas e ictus, tanto isquémico como hemorrágico9, así como con una mayor incidencia de muerte súbita10, con un aumento de la mortalidad cardiovascular y por todas las causas11, que es exponencial con la mayor reducción del FGe12 (fig. 1). En las fases más avanzadas de ERC, estadios 4-5 (FGe<30ml/min/1,73m2), la mortalidad es mucho mayor que en la población general, y significativamente mayor en los pacientes en diálisis respecto a otros pacientes con ERC, mientras que el riesgo disminuye en los pacientes con el trasplante renal respecto a los pacientes en diálisis13.
Relación entre el FGe y la mortalidad total y cardiovascular.
Fuente: tomado de Go et al.12.
Se ha intentado comparar el riesgo cardiovascular de los pacientes con ERC con el de los sujetos que ya han tenido un infarto de miocardio (IM), y con el de los pacientes diabéticos. A pesar de ser 3 entidades (IM, diabetes mellitus y ERC) con diferentes evoluciones temporales se ha observado que, en pacientes mayores de 65 años, el riesgo de nuevos episodios cardiovasculares a 10 años es similar, tanto en los sujetos afectos de ERC, como en los diabéticos, comparado con los sujetos que habían presentado un IM14. Estas complicaciones cardiovasculares van en paralelo con la mayor pérdida de la función glomerular y con la mayor exposición temporal tanto a la ERC como al resto de factores de riesgo cardiovascular. En cambio, en otro estudio, los pacientes con diabetes mellitus o con ERC no tenían el mismo riesgo de episodios coronarios que los pacientes que habían presentado un IM, pero en pacientes diabéticos con ERC el riesgo sí era similar al de los pacientes que habían sufrido un IM. En este mismo estudio, los pacientes diabéticos tuvieron una menor incidencia de IM que los pacientes con ERC con FGe<45ml/min/1,73m2 acompañado de un incremento severo de la proteinuria15.
La microalbuminuria, per se, incrementa el riesgo relativo de episodios cardiovasculares graves (RR 1,83; IC 95%: 1,64-2,05), la mortalidad total (RR 2,09; IC 95%: 1,84-2,38) y las hospitalizaciones por insuficiencia cardiaca (RR 3,23; IC 95%: 2,54-4,10)16, con similar repercusión tanto en sujetos diabéticos como en no diabéticos. Se ha observado también que la albuminuria y la proteinuria son mejores predictoras del riesgo de ictus que el filtrado glomerular17, aumentando el riesgo a medida que se incrementa la albuminuria18. Es preciso recordar que hasta en el 16% de sujetos con ERC en los que el cociente albumina-creatinina era negativo se encontró un cociente proteína-creatinina positivo. Estos últimos mostraron un mayor riesgo de progresión de la enfermedad renal, de la necesidad de tratamiento sustitutivo y de la mortalidad, siendo aún mayor en los que presentaron proteinuria franca19.
Por lo tanto, la valoración conjunta del FGe y la albuminuria en la ERC mejora la predicción del riesgo cardiovascular frente a la estimada a partir de los factores de riesgo tradicionales20.
Por los datos previamente mostrados, no es de extrañar que el riesgo de un nuevo episodio coronario después de un IM se incremente en los pacientes que previamente tenían ERC, presentando una tasa de 30,8 por 1.000 personas/año frente al 18,8 por 1.000 personas/año en aquellos sujetos que no presentan ERC, siendo esta diferencia significativa21, con incremento tanto del riesgo de progresión a estadios finales de la ERC, como de la mortalidad total22.
Por todo ello, las guías europeas de prevención cardiovascular 201223 consideran de muy alto riesgo cardiovascular a los pacientes con ERC y un FGe<30ml/min/1,73m2; para ellos, se establece el mismo objetivo de control que para los pacientes con enfermedad vascular aterosclerótica (prevención secundaria), fijando el objetivo de cLDL por debajo de 70mg/dl o, al menos, una reducción del 50% respecto al basal. Además, se clasifica de alto riesgo cardiovascular a aquellos pacientes con ERC y un FGe entre 30 y 60ml/min/1,73m2, asignándoles como objetivo un cLDL por debajo de 100mg/dl (tabla 2). Para la consecución de estos objetivos terapéuticos, las estatinas son los fármacos hipolipemiantes de primera elección.
Recomendaciones de objetivos de control de cLDL en pacientes con enfermedad renal crónica según las diferentes categorías de riesgo cardiovascular
| Características definitorias | Objetivo cLDL | |
|---|---|---|
| Muy alto | ERC con FGe<30ml/min/1,73m2 | <70mg/dl o, al menos, reducción ≥50% |
| Otras situaciones de riesgo equivalente: Enfermedad cardiovascular documentada por métodos invasivos o no invasivos IM previo, síndrome coronario agudo, revascularización coronaria o en otras localizaciones, ictus isquémico o enfermedad arterial periférica Pacientes con DM2 y algún factor de riesgo cardiovascular Riesgo a 10 años según SCORE≥10 | ||
| Alto | Pacientes con ERC moderada (FGe 30-60ml/min/1,73m2) Otras situaciones de riesgo equivalente: | <100mg/dl |
| Riesgo a 10 años según tabla SCORE ≥5% y <10% Pacientes con DM2 sin otro factor de riesgo cardiovascular Un factor de riesgo marcadamente aumentado, como dislipidemia familiar o hipertensión grave |
cLDL: colesterol transportado por lipoproteínas de baja densidad; DM2: diabetes mellitus tipo 2; ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado; IM: infarto de miocardio.
Fuente: modificado de Perk et al.23.
En el paciente con ERC, además del FGe y la albuminuria, podremos identificar diferentes factores de riesgo cardiovascular, unos considerados como tradicionales y otros no tradicionales, algunos de los cuales van consolidando su peso específico, en contra de otros, según progresa la enfermedad24-27 (tabla 3).
Factores de riesgo cardiovascular en la enfermedad renal crónica
| Tradicionales | No tradicionales y propios de la ERC |
|---|---|
| Edad Sexo varón Hipertensión arterial Colesterol LDL elevado Colesterol HDL bajo Diabetes mellitus Tabaquismo Sedentarismo Menopausia Historia familiar de enfermedad cardiovascular Hipertrofia ventricular izquierda | Albuminuria, proteinuria Hiperhomocisteinemia Lipoproteína (a) [Lp (a)] Lp (a) e isoformas apolipoproteína (a) [apo(a)] Remanentes de lipoproteínas cLDL pequeñas y densas y modificaciones postranslacionales. cHDL disfuncional Resistencia a la insulina Anemia Alteraciones del metabolismo mineral (Ca-P-PTH-FGF-23-klotho)/calcificación vascular Sobrecarga volumen extracelular Alteraciones electrolíticas Estrés oxidativo y carbamil Inflamación/endotoxemia Malnutrición Factores trombogénicos Alteraciones del sueño Alteración del equilibrio óxido nítrico/endotelina Dimetilarginina asimétrica (ADMA) Toxinas urémicas (índoles, fenoles, TMAO) Hiperactividad simpática Hiperuricemia Alteraciones endocrinas (T3 bajo) |
La ERC es progresiva y en muchos casos irreversible, teniendo un origen multifactorial al igual que su principal complicación, la enfermedad cardiovascular. Es preciso realizar un diagnóstico precoz de la enfermedad junto con la adecuada identificación de los factores de riesgo, al objeto de frenar su evolución a estadios más severos, evitar las complicaciones y retrasar, en lo posible, la necesidad de tratamiento sustitutivo renal.
Algunas indicaciones del tratamiento en la ERC están bien establecidas, como la inhibición del sistema renina-angiotensina en aquellos pacientes con hipertensión arterial o micro/macroalbuminuria, control glucémico, cambios en los estilos de vida que mejoren los componentes del síndrome metabólico, disminución del consumo de sal y de la ingesta de proteínas, así como la corrección de la anemia cuando esté presente. Sin embargo, aún existen insuficientes datos para recomendar el beneficio de la reducción de la uricemia3, a pesar de que hay estudios que demuestran la utilidad del alopurinol o febuxostat en retrasar la progresión de la enfermedad27,28 y la morbimortalidad cardiovascular en la ERC29.
La dislipidemia es un factor de progresión, tanto de la ERC30 como de la enfermedad cardiovascular. Sin embargo, persiste el debate sobre la importancia del tratamiento de la dislipidemia en el paciente con ERC, especialmente en sus fases más avanzadas31.
La diferencia en los objetivos de cLDL en pacientes con ERC y un FGe entre 30 y 60ml/min/1,73m2 expresados en las diferentes guías europeas permite mantener el debate, aunque este puede verse acrecentado por el distinto comportamiento de las estatinas en función del estadio de la ERC. El empleo de estatinas muestra mayor beneficio cuando se utilizan en los estadios iniciales de la ERC, presentando un riesgo relativo de episodios cardiovasculares de 0,69 (0,70-0,85) en los pacientes en estadios 2-3, con un número necesario a tratar (NNT) de 24 (19-32); de 0,78 (0,63-0,96) en los sujetos en estadio 4, con un NNT de 36 (19-330), mientras que en el estadio 5, en función de que el paciente esté o no sometido a diálisis, el riesgo relativo de sufrir nuevos episodios cardiovasculares será de 0,93 (0,86-1,00) o de 0,82 (0,60-1,11), con un NNT de 46 (25-257)32,33. Respecto al efecto de las estatinas en la progresión de la enfermedad renal (reducción del 25% del FGe, duplicar el nivel de creatinina sérica o evolución a estadios finales), el beneficio mostrado ha sido pequeño (RR 0,95 [0,90-1,01])33, a pesar de que en algunos ensayos clínicos se ha observado beneficio con alguna de las estatinas32.
Todo ello nos lleva a la disyuntiva de si es preciso tratar la dislipidemia en la ERC, si tratarla de manera menos intensa en los primeros estadios evolutivos (cLDL<100mg/dl) e intensificar en los estadios finales o, incluso, si suspender el tratamiento en las fases terminales de la ERC. Estas son dudas que, surgiendo en la práctica clínica diaria, es preciso dilucidar. Parece lógico, aunque no hay evidencia al respecto, que actuar de manera intensiva (cLDL<70mg/dl) desde los primeros estadios de la ERC pudiera ser más eficaz, en la prevención de la enfermedad cardiovascular, que hacerlo de manera menos intensiva (cLDL<100mg/dl). Así planteado, sería deseable mantener los niveles de cLDL<70mg/dl a lo largo de toda la evolución, adaptando el tratamiento farmacológico a las características del paciente, recordando que la absorción intestinal de colesterol y de esteroles vegetales se va incrementando en paralelo a la progresión de la ERC34.
Dislipidemia en la enfermedad renal crónicaIndependientemente de las características del paciente, la aparición y evolución de la ERC promoverá cambios en el perfil lipídico.
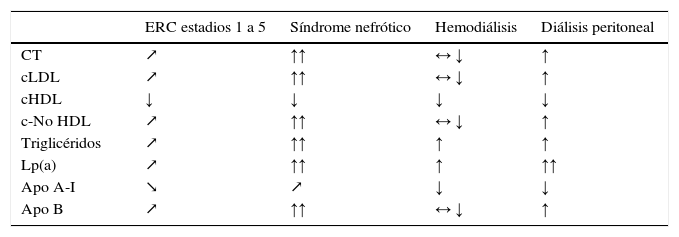
La dislipidemia en la ERC se caracteriza por niveles de cLDL normales o discretamente elevados, cHDL bajo, triglicéridos elevados, mayor proporción de partículas de cLDL pequeñas y densas, y lipoproteína(a) [Lp(a)] aumentada35,36 (tabla 4). Estas modificaciones están relacionadas con el grado de afectación renal, con la etiología primaria de la ERC, con la presencia de síndrome nefrótico y con la técnica de diálisis empleada como tratamiento sustitutivo renal37. Estos cambios en el perfil liproteico son patentes, incluso, en los niños con ERC moderada, asociándose con la mayor severidad en la disminución del FGe, con la existencia de proteinuria en rango nefrótico, además de con la edad y la presencia de obesidad38.
Principales características de las alteraciones lipídicas en la enfermedad renal crónica
| cLDL normal o discretamente elevado |
| cHDL bajo |
| Triglicéridos elevados |
| Partículas de LDL pequeñas y densas aumentadas |
| Modificación postraslacional de lipoproteínas (oxidación, carbamilación) |
| Alteración de la composición y funcionalidad de las partículas de HDL |
| Lipoproteína(a) aumentada |
Los mecanismos por los que se producen estos cambios en el perfil lipídico se van modificando según avanza la enfermedad, y dependiendo del tratamiento sustitutivo renal. La acumulación de triglicéridos se produce, tanto por el exceso de producción de lipopartículas ricas en triglicéridos, como por la disminución de su catabolismo, debido a una disminución en la actividad de la lipoproteinlipasa (LPL) y de la lipasa hepática. Ello se debe a un aumento de los niveles de apoC-III que provoca un aumento de la relación apoC-III/apoC-II, y a la disminución de la síntesis de LPL secundaria, bien al hiperparatiroidismo o bien a la disminución de los niveles de insulina.
Un mecanismo que puede influir en el incremento del riesgo cardiovascular en pacientes con ERC son las modificaciones postranslacionales de las partículas LDL en la ERC que las hacen más aterogénicas. El estrés oxidativo asociado a la uremia puede contribuir al proceso de la aterosclerosis a través de la oxidación y carbamilación de las LDL. La carbamilación de LDL se produce por modificación química espontánea, no enzimática, de la apolipoproteína B, componente proteico de las LDL, por el ácido isociánico derivado de la urea39. La disminución en los niveles de apoA-I y de lecitin:colesterol aciltransferasa (LCAT) relacionada con la ERC conduce a cambios cuantitativos con disminución de la concentración de cHDL y cualitativos con tranformación a partículas de HDL disfuncionantes. Además de todo ello, la actividad de la paraoxonasa presente en las HDL está disminuida, provocando el deterioro de su capacidad antioxidante y antiinflamatoria40,41.
Las HDL de pacientes en hemodiálisis exhiben diversas alteraciones en la composición proteómica y lipídica que están vinculadas a la modificación de la capacidad aceptora de colesterol. Las HDL del paciente urémico están enriquecidas en albúmina, apoC-III, y apoA-IV, así como en proteínas proinflamatorias como amiloide sérica A (SAA) o fosfolipasa A2 asociada a lipoproteinas (Lp-PLA2), y a una disminución de apoA-I y A-II. En el paciente en diálisis existen cambios en la composición lipídica de las HDL manifestados por una disminución en los fosfolípidos y el colesterol libre, además de un aumento en los triglicéridos42; todo ello deteriora la capacidad de HDL para promover el transporte reverso de colesterol de los macrófagos43. En resumen, las alteraciones cuantitativas y cualitativas de las HDL en la ERC reducen sus propiedades ateroprotectoras y pueden contribuir al exceso de mortalidad cardiovascular de los pacientes con ERC; aunque el efecto de la ERC avanzada sobre la composición y función de las HDL, no está completamente esclarecido.
También se han descrito en estos pacientes niveles elevados de Lp(a), que se asocian a un incremento del riesgo cardiovascular, tanto en las fases terminales como en las primeras fases de la ERC, probablemente debido a la disminución de su catabolismo renal44. Este incremento temprano de Lp(a) se producirá, preferentemente, en aquellos sujetos con isoformas de apo(a) de mayor tamaño, que son aquellos que en condiciones normales presentan menores niveles de Lp(a). La elevación de Lp(a) viene especialmente influenciada por el grado de proteinuria y no tanto por la etiología de la enfermedad renal, revirtiendo parcialmente cuando el paciente recibe un trasplante renal44.
Estos cambios en el metabolismo lipídico se ven modificados a lo largo de la progresión de la ERC bajo la influencia de las diferentes situaciones clínicas del paciente (tabla 5) y reflejando el aumento del riesgo de desarrollo de aterosclerosis y sus complicaciones.
Cambios del perfil lipídico en diferentes estadios de la enfermedad renal crónica
| ERC estadios 1 a 5 | Síndrome nefrótico | Hemodiálisis | Diálisis peritoneal | |
|---|---|---|---|---|
| CT | ↗ | ↑↑ | ↔ ↓ | ↑ |
| cLDL | ↗ | ↑↑ | ↔ ↓ | ↑ |
| cHDL | ↓ | ↓ | ↓ | ↓ |
| c-No HDL | ↗ | ↑↑ | ↔ ↓ | ↑ |
| Triglicéridos | ↗ | ↑↑ | ↑ | ↑ |
| Lp(a) | ↗ | ↑↑ | ↑ | ↑↑ |
| Apo A-I | ↘ | ↗ | ↓ | ↓ |
| Apo B | ↗ | ↑↑ | ↔ ↓ | ↑ |
↗ aumentando o ↘ disminuyendo según FGe; ↑ aumentado, ↓ disminuido, ↑↑ muy aumentado o ↓↓ muy disminuido comparado con sujetos sin uremia; ↔ normal.
Fuente: modificado de Kwan et al.40.
Menos conocido es el papel de la absorción intestinal de colesterol y de esteroles vegetales en el riesgo cardiovascular, a pesar de que una rara enfermedad autosómica recesiva, como es la sitosterolemia familiar caracterizada por la elevación de los niveles plasmáticos de esteroles vegetales, facilita la aparición precoz de episodios cardiovasculares45. Hay datos con relación al aumento de la absorción intestinal de colesterol y de esteroles vegetales en los pacientes con ERC. Así, en los pacientes diabéticos con ERC sin tratamiento con estatinas se ha observado que los niveles de campesterol, un marcador de la absorción intestinal de esteroles, están elevados, relacionándose directamente con los mayores valores del cociente albumina:creatinina e inversamente con los menores niveles de FGe34, siendo esto especialmente llamativo en los pacientes en hemodiálisis46. Estos datos justificarían, al menos en parte, los resultados obtenidos del análisis post-hoc del estudio 4D (German Diabetes and Dialysis Study) en el que se comparó el efecto de atorvastatina 20mg frente a placebo en pacientes sometidos a diálisis, mostrando que el tratamiento con atorvastatina solo era beneficioso en los sujetos que eran menos absorbedores, mientras que no mostró beneficio en los hiperabsorbedores47.
Por todo ello, es recomendable realizar el cribado rutinario del perfil lipídico en todos los pacientes con ERC, determinando el colesterol total, triglicéridos, cHDL y cLDL, estableciendo las medidas terapéuticas precisas que permitan el logro de los objetivos de control recomendados, individualizando el tratamiento y ajustándolo a la evolución de la enfermedad y del paciente48.
Abordaje de la dislipidemia en la enfermedad renal crónicaLa dislipidemia en la ERC se caracteriza, como hemos comentado, por un aumento de los triglicéridos plasmáticos, baja concentración plasmática de cHDL, niveles normales o ligeramente elevados de cLDL con incrementos en los niveles de Lp(a), y se asocia con un incremento de la morbimortalidad cardiovascular y con un mayor deterioro de la función renal49. El estricto control de los diferentes factores de riesgo es fundamental para reducir el elevado riesgo cardiovascular que presentan estos pacientes.
Tratamiento con estatinas en la enfermedad renal crónicaLa terapia con estatinas es esencial para la prevención cardiovascular en los pacientes de alto y muy alto riesgo cardiovascular, incluidos los pacientes con ERC, permitiendo el logro del objetivo propuesto en cLDL y reduciendo el riesgo cardiovascular34. En análisis de subgrupos de los estudios con estatinas que incluían pacientes con ERC, se demostró unos beneficios similares entre los sujetos con y sin ERC50. Sin embargo, surgen discrepancias en los resultados obtenidos en pacientes tratados con estatinas en función del estadio de progresión de la ERC. Un metaanálisis, que incluyó a 21.295 participantes de 11 estudios clínicos, concluyó que el tratamiento con estatinas reduce la mortalidad total (p<0,0001) y los episodios cardio y cerebrovasculares (p=0,0001 y p=0,0022, respectivamente) en los pacientes con ERC que no requieren diálisis51. En cambio, el uso de estatinas en pacientes con ERC en diálisis redujo la mortalidad cardiaca y los episodios cardiovasculares (p<0,05 en ambos), pero con un efecto no significativo sobre la mortalidad total y sobre los episodios cerebrovasculares.
La intervención intensiva precoz con estatinas en pacientes con ERC ha mostrado su beneficio en el riesgo cardiovascular. El resultado del subgrupo de pacientes con ERC leve-moderada incluidos en el seguimiento de 5.801 pacientes japoneses en los que se había implantado un stent y que fueron tratados con estatinas de alta intensidad (atorvastatina, pitavastatina o rosuvastatina) mostró una reducción del riesgo de mortalidad cardiovascular frente a los que recibieron una estatina de menor intensidad (pravastatina, simvastatina, fluvastatina)52. Ello apoyaría la conveniencia del tratamiento hipolipemiante de mayor intensidad con estatinas desde las primeras fases de la ERC, sin la necesidad de esperar a un mayor deterioro de la función renal para intensificar el tratamiento.
Otro metaanálisis concluye que la terapia con estatinas en pacientes con ERC leve y moderada reduce un 24% el riesgo de enfermedad cardiovascular, un 23% el riesgo de mortalidad cardiovascular y un 21% el riesgo de mortalidad total; los resultados también son favorables tanto para el riesgo de IM (reducción del 34%) como para el accidente cerebrovascular (reducción del 30%), no siendo significativos los efectos sobre la enfermedad cardiovascular cuando los niveles basales de creatinina superan los 1,5mg/dl53.
En el seguimiento de una cohorte de 14.706 pacientes tras revascularización coronaria, los beneficios de las estatinas no fueron evidentes en los pacientes con ERC y hemodiálisis54. Otra revisión sistemática y metaanálisis, que incluye 31 ensayos clínicos con más de 48.000 pacientes con ERC, investiga los efectos sobre la morbimortalidad cardiovascular de las estatinas y encuentra que la terapia con estatinas reduce el riesgo de episodios cardiovasculares en los diferentes niveles de la función renal. Los episodios cardiovasculares mayores se redujeron un 23% (p<0,001), incluyendo una reducción del 18% de los episodios coronarios. En este metaanálisis, no se encontró que los efectos adversos de las estatinas se incrementen en los pacientes con ERC, lo que confirma la seguridad de su utilización en esta población33. Un hallazgo a destacar de este estudio es que el efecto del tratamiento con estatinas se vio modificado de manera significativa por la función renal. En el análisis de subgrupos se constató que la reducción relativa del riesgo de episodios fue significativamente menor en las personas con ERC avanzada (p<0,001), aunque las reducciones de riesgo absoluto fueron comparables. Parece pues que los pacientes con ERC se benefician del tratamiento con estatinas, pero el beneficio relativo disminuye a medida que empeora la gravedad de la ERC32. No obstante, es importante destacar que las reducciones de riesgo absoluto eran solo un poco menores en las personas con ERC avanzada, lo que sugiere que el tratamiento con estatinas todavía puede conferir importantes beneficios en estos individuos33.
El estudio ALERT incluyó 2.102 receptores de trasplante renal a los que se trató con fluvastatina (estatina que presenta una menor eliminación renal), presentando una reducción no significativa del 17% en el objetivo primario combinado, mientras que la mortalidad de causa cardiaca y el IM mostraron una reducción significativa55,56. Un análisis post-hoc encontró que la introducción precoz de la fluvastatina en el tratamiento tras el trasplante renal presenta un mayor beneficio57.
Cuando se comparó la eficacia de 20mg/día de atorvastatina frente a placebo en 1.255 diabéticos tipo 2 en hemodiálisis, no se logró una reducción significativa de la mortalidad cardiovascular, del IM no mortal ni del ictus, a pesar del similar efecto hipocolesterolemiante en comparación con los pacientes no dializados58. Del mismo modo, un estudio que evaluó el beneficio de rosuvastatina 10mg/día en sujetos en hemodiálisis no consiguió ningún efecto significativo en el objetivo final primario de muerte cardiovascular, IM no fatal o accidente cerebrovascular59. Un metaanálisis de 25 estudios que incluyó 8.289 pacientes en diálisis tampoco encontró beneficio del tratamiento con estatinas en los episodios cardiovasculares, mortalidad cardiovascular, mortalidad por cualquier causa o IM, a pesar de la reducción en la colesterolemia60. En cambio, en el estudio SHARP, realizado en pacientes con ERC, el empleo de simvastatina más ezetimiba frente a placebo redujo de forma significativa los episodios cardiovasculares en el grupo de intervención en el que se incluyeron un número importante de pacientes sometidos a diálisis61, aunque en el análisis de subgrupos no hubo beneficio significativo en los pacientes dializados, mostrando solo una tendencia en la disminución de episodios.
De acuerdo con las evidencias clínicas disponibles, el efecto relativo sobre la morbimortalidad cardiovascular de las estatinas es más modesto en ERC avanzada en comparación con sus estadios más leves, pudiéndose explicar por la sustancial proporción de episodios cardiovasculares en poblaciones con ERC terminal en programa de hemodiálisis que resultan de alteraciones no relacionadas con aterosclerosis, sino con la hipertrofia ventricular izquierda, insuficiencia cardiaca y muerte súbita62,63. Todo ello ha llevado a que en la guía KDIGO 201364 se sugiera que en adultos con ERC en diálisis, el tratamiento con estatinas o su combinación con ezetimiba no deba ser iniciado, aunque no recomienda interrumpir este tratamiento en aquellos pacientes que ya lo están recibiendo en el momento del inicio de la diálisis.
Aunque existe cierta controversia, las estatinas podrían tener efectos beneficiosos sobre la proteinuria y la función renal. En el estudio CARDS se observa un efecto beneficioso de la atorvastatina 10mg/día sobre el FGe, sobre todo en aquellos pacientes con albuminuria65, en cambio en el estudio SHARP, en el grupo que recibió la combinación de ezetimiba y simvastatina no se retrasó la progresión de la ERC, ni se apreció ningún efecto beneficioso significativo en el FGe66. En un metaanálisis que incluyó 41 estudios que incorporaban 88.523 participantes, se apreció que en aquellos que recibieron tratamiento con placebo se reducía el FGe de forma significativa frente al grupo tratado con estatinas, mientras que el grupo tratado con estatinas presentaba un retraso en la progresión de la proteinuria frente al grupo placebo. El grupo de pacientes que recibió estatinas de alta intensidad mantenía niveles de FGe significativamente mayores que aquellos que utilizaron estatinas de intensidad moderada (IC 95%: 0,08 a 0,16; p=0,00001)67.
En el estudio TNT68,69, el tratamiento con atorvastatina mejoró la función renal de pacientes con ERC en estadio 3. El aumento del FGe logrado con atorvastatina 80mg/día resultó significativamente mayor que con 10mg/día (9,9% frente al 6,6%, respectivamente; p<0,005), a la vez que procuraba una reducción del riesgo cardiovascular en los pacientes con ERC cuando se empleó el tratamiento intensivo. En el estudio LIVES, la pitavastatina incrementó el FGe en 5,4ml/min/1,73m2 al cabo de 104 semanas de tratamiento en pacientes con ERC (FGe<60ml/min/1,73m2), lo que supuso una mejora de un 10,5% en el filtrado70. En diabéticos tipo 2 con dislipidemia mixta y ERC moderada, el tratamiento con pitavastatina produjo una mejora significativa del FGe71. No obstante, no todas las estatinas han mostrado igual comportamiento, toda vez que en los estudios PLANET I (pacientes diabéticos) y PLANET II (pacientes no diabéticos), el tratamiento con rosuvastatina 40mg/día se acompañó de un deterioro de la función renal72. La heterogeneidad del comportamiento de las estatinas en el funcionalismo renal y la albuminuria, también se observa en pacientes con nefropatía diabética, en los que la atorvastatina 10mg/día ejerció un efecto renoprotector, ya que, en relación con el grupo que recibió pravastatina 10mg/día, disminuyó significativamente la albuminuria, y el FGe fue mejor entre los pacientes tratados con atorvastatina73. Otra estatina, de menor eliminación renal, como la pitavastatina a una dosis de 2mg/día también ha sido comparada con pravastatina 10mg/día en pacientes diabéticos tipo 2 con ERC. La pitavastatina es más eficaz que la pravastatina para la reducción de la albuminuria presente en estos pacientes74. Un subanálisis del estudio SAGE evidencia que el control intensivo de la dislipidemia en pacientes ancianos (edad entre 65 y 85 años) con enfermedad coronaria estable puede aportar beneficios sobre la función renal. Este estudio examinó, durante 12 meses, el efecto del tratamiento de una estatina de alta intensidad (atorvastatina 80mg/día) frente a una de moderada intensidad (pravastatina 40mg/día) en 893 pacientes aleatorizados (418 tenían ERC). El FGe se incrementó con atorvastatina y se mantuvo estable con pravastatina (2,38 frente a 0,18ml/min/1,73m2, respectivamente; p<0,0001). El aumento de FGe en pacientes sin ERC fue significativamente mayor con atorvastatina (2,08ml/min/1,73m2), mientras que con pravastatina se produjo una disminución (–1,04ml/min/1,73m2)75.
En otro orden de cosas, las estatinas parecen ejercer un papel protector de la lesión renal inducida por la administración de contraste ante la realización de angiografía coronaria. Cuando se examinó específicamente el uso de estatinas en pacientes con diabetes y ERC sometidos a angiografía, se observó una reducción en el riesgo de insuficiencia renal aguda inducida por contraste en el grupo de pacientes que recibieron terapia con estatinas76. Un metaanálisis de 15 ensayos, que evaluaron el efecto de la estatina administrada antes de la angiografía coronaria, mostró una reducción significativa de la lesión renal aguda en los tratados con estatinas de alta intensidad en comparación no solo con los controles del grupo placebo, sino también con los que recibieron estatinas a dosis bajas77.
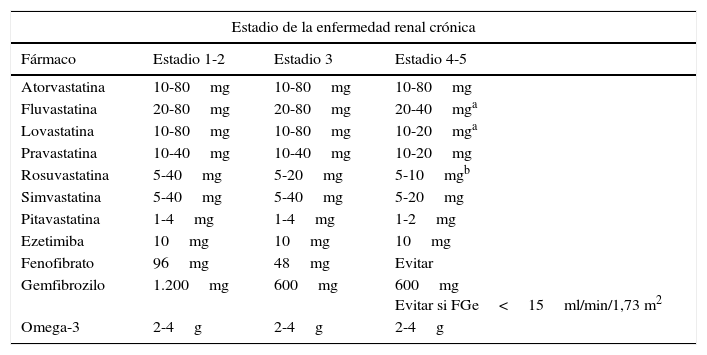
En definitiva, el tratamiento con estatinas puede reducir el riesgo de enfermedad cardiovascular y retrasar la progresión de la ERC, con un sustantivo beneficio en la ERC leve y moderada, persistiendo la controversia en los estadios avanzados de la ERC, especialmente en los pacientes sometidos a hemodiálisis. Estudios recientes sugieren que el beneficio de las diferentes estatinas sobre el riñón puede ser heterogéneo, siendo mayor cuando la intensidad hipocolesterolemiante es máxima. Dada la complejidad del paciente con ERC y la polimedicación a la que está sometido, es preciso valorar minuciosamente la seguridad de las estatinas en todo su contexto. Las estatinas recomendadas por las guías europeas para el tratamiento de la dislipidemia en la ERC78 serían aquellas con una menor excreción renal, como fluvastatina, atorvastatina y pitavastatina. Algunas estatinas necesitan ajuste de la dosis en la ERC; en estadios 4 y 5 es recomendable ajustar las dosis de atorvastatina, pitavastatina y fluvastatina (tabla 6)79,80. Por tanto, es razonable considerar cuidadosamente la dosificación de las estatinas a medida que existe un mayor deterioro de la función renal.
Dosis diarias de estatinas y otros fármacos hipolipemiantes para el manejo de la dislipidemia en la enfermedad renal crónica
| Estadio de la enfermedad renal crónica | |||
|---|---|---|---|
| Fármaco | Estadio 1-2 | Estadio 3 | Estadio 4-5 |
| Atorvastatina | 10-80mg | 10-80mg | 10-80mg |
| Fluvastatina | 20-80mg | 20-80mg | 20-40mga |
| Lovastatina | 10-80mg | 10-80mg | 10-20mga |
| Pravastatina | 10-40mg | 10-40mg | 10-20mg |
| Rosuvastatina | 5-40mg | 5-20mg | 5-10mgb |
| Simvastatina | 5-40mg | 5-40mg | 5-20mg |
| Pitavastatina | 1-4mg | 1-4mg | 1-2mg |
| Ezetimiba | 10mg | 10mg | 10mg |
| Fenofibrato | 96mg | 48mg | Evitar |
| Gemfibrozilo | 1.200mg | 600mg | 600mg Evitar si FGe<15ml/min/1,73 m2 |
| Omega-3 | 2-4g | 2-4g | 2-4g |
Siempre conviene tener presente que las estatinas metabolizadas por la vía del citocromo P450 3A4 (lovastatina, simvastatina y atorvastatina) pueden producir reacciones adversas por su interacción con otros medicamentos habituales en este tipo de pacientes23.
Tratamiento con fibratos en la enfermedad renal crónicaLos fibratos son fármacos utilizados para el tratamiento de la dislipidemia por su capacidad de reducir la trigliceridemia e incrementar el cHDL, 2 de los componentes presentes en la dislipidemia de la ERC. Un metaanálisis en sujetos con ERC corrobora estos efectos sobre el perfil lipídico81.
El estudio VA-HIT en prevención secundaria82 comprobó que el gemfibrozilo incrementaba la creatinina sérica en comparación con el placebo (5,9% frente al 2,8%; p=0,02). No obstante, se puede recomendar su uso a dosis de hasta 600mg/día en la ERC cuando coexista una hipertrigliceridemia grave (triglicéridos por encima de 500mg/dl), siempre que el FGe no sea inferior a 15ml/min/1,73m278,83 se desaconseja su asociación con estatinas por incrementar de manera importante el riesgo de miopatía23.
El fenofibrato provoca un aumento agudo y sostenido de la creatinina plasmática38 que es reversible al interrumpir el tratamiento, pero exige extremar la cautela en pacientes con ERC: con FGe entre 60 y 90ml/min/1,73m2, se recomienda reducir la dosis un 50%, y por debajo de 60ml/min/1,73m2, no superar la dosis diaria de 48mg. Su uso está contraindicado en sujetos con un FGe inferior a 15ml/min/1,73m283. No obstante, el fenofibrato puede reducir el riesgo de progresión de la albuminuria en pacientes diabéticos84,85, asociándose a una reducción de episodios cardiovasculares graves, muerte cardiovascular, ictus y mortalidad por cualquier causa en pacientes con ERC con deterioro moderado de la función renal, pero no en aquellos con FGe>60ml/min/1,73m2. Así pues, a pesar de la elevación de la creatinina sérica con los fibratos, que parece ser debida a una disminución de la secreción tubular de creatinina más que a la reducción del FGe, existe un potencial beneficio cardiovascular y renal que permite su empleo, siempre con precaución, en la ERC. Sin embargo, en las guías KDIGO57 se desaconseja su utilización y en las guías de dislipidemia de las sociedades europeas23 se limita el uso de fenofibrato solo para pacientes con FGe superior a 50ml/min/1,73m2, aunque se acepta el empleo de gemfibrozilo en pacientes con filtrados glomerulares inferiores por su menor eliminación renal, aunque no se aconseja su uso asociado a estatinas.
Tratamiento con niacina en la enfermedad renal crónicaLa niacina tiene un significativo potencial como agente terapéutico renoprotector, a pesar de haberse retirado su asociación con laropiprant en enero 2013 por los resultados del estudio HPS2-THRIVE86 en el que no se demostró efecto significativo en la reducción de episodios vasculares, y el tratamiento de niacina con laropiprant se asoció con una mayor incidencia de efectos secundarios. El tratamiento con niacina presenta efectos favorables sobre el cHDL, la trigliceridemia, el estrés oxidativo e inflamación, y la función endotelial; así mismo, puede disminuir los niveles séricos de fósforo al reducir su absorción en el tracto gastrointestinal87. En un subestudio que examina la utilización de niacina con laropiprant en sujetos con dislipidemia y ERC, el tratamiento con niacina dio lugar a una disminución media de fósforo sérico de 11%, con cambios similares entre aquellos con FGe por encima o por debajo de 60ml/min/1,73m288. Estos efectos pueden retrasar el deterioro del FGe y prevenir el riesgo cardiovascular, especialmente en las fases más avanzadas de la ERC.
La niacina es teóricamente segura en la ERC, al no ser eliminada vía renal. Se ha analizado ampliamente en estudios clínicos de prevención de la enfermedad cardiovascular, pero no específicamente en pacientes con ERC89. Los ensayos clínicos que evalúan la combinación de estatinas con niacina no han demostrado ningún beneficio adicional en la reducción del riesgo cardiovascular en comparación con el empleo de estatinas en monoterapia. Tampoco hubo diferencias significativas en el cambio del FGe entre los participantes de ambos grupos del estudio, pero la mortalidad total fue significativamente mayor en el grupo con niacina89, por lo que se desaconseja esta asociación90. El empleo de niacina tampoco mostró beneficios cardiovasculares o renales cuando se estratifica por la función renal, según los datos de un estudio post-hoc. De los 3.414 participantes incluidos, de los que 505 presentaban un estadio 3 de ERC al inicio del estudio, la aparición de episodios cardiovasculares fue similar entre los participantes con ERC, independientemente de que fueran tratados con estatina o estatina en combinación con niacina91. Así pues, a pesar de sus beneficios potenciales, no es recomendable la utilización de niacina asociada con estatinas en pacientes con ERC.
Tratamiento con ácidos grasos omega-3 en la enfermedad renal crónicaLos ácidos grasos omega-3 pueden ser utilizados en caso de hipertrigliceridemia, alteración del perfil lipídico que frecuentemente se encuentra en la ERC. Al margen de su efecto hipotrigliceridemiante a dosis de 2-4g/día, un metaanálisis con suplementos de omega-3 a dosis bajas no encontró ninguna evidencia en la prevención cardiovascular92. Hay pocos datos sobre su utilidad en la ERC, aunque hay evidencias de posibles beneficios en la ERC terminal, que incluyen efectos antiinflamatorios, antiarrítmicos, estabilizadores de la placa y de mejora de la función endotelial93. En pacientes en hemodiálisis, el tratamiento con un suplemento de omega-3 de 2g/día no ha demostrado reducción de los episodios cardiovasculares o de la mortalidad94. En cambio, en un reciente metaanálisis aparece que el grupo de pacientes en hemodiálisis que recibió un suplemento de aceite de pescado redujo el riesgo de episodios cardiovasculares y mejoró el hiperparatiroidismo secundario y la hipertrigliceridemia95. Los ácidos grasos omega-3, si se utilizan, no precisan ningún ajuste de la dosis en caso de ERC37 y pueden ser utilizados en caso de hipertrigliceridemia o dislipidemia mixta, bien en monoterapia o bien asociados con estatinas, y pueden ser una alternativa a la utilización de fibratos.
Tratamiento con secuestradores de ácidos biliares en la enfermedad renal crónicaLas resinas de intercambio iónico pueden ser utilizadas por su acción hipocolesterolemiante, bien en monoterapia si existe contraindicación o intolerancia a las estatinas, o bien asociadas a ezetimiba y/o estatinas con el objeto de conseguir el adecuado control lipídico propugnado en las guías23. Sin embargo, su uso en la ERC está limitado porque pueden aumentar la trigliceridemia. En caso de utilizarse, no precisan de ajustes de dosis en la ERC de leve a moderada, sin que existan datos que avalen su seguridad y eficacia en la enfermedad renal terminal80.
Tratamiento con ezetimiba en la enfermedad renal crónicaLa ezetimiba inhibe la absorción del colesterol tanto de origen dietético como biliar en el intestino delgado, mediante su acción sobre la proteína de Niemann-Pick C1 like 1 que tiene una mayor expresión en ciertas circunstancias, entre ellas la ERC, especialmente en sus fases más avanzadas. Su efecto reductor del cLDL alcanza hasta un 20%, aunque con una respuesta individualizada, lo que puede contribuir a la consecución de los objetivos de control lipídico estrictos recomendados en pacientes con ERC23. No requiere ningún ajuste de la dosis en la ERC y su utilización ha sido evaluada en el estudio SHARP, en el cual en pacientes con nefropatía crónica se ha comparado el tratamiento de estatinas y ezetimiba frente a placebo, consiguiendo la terapia combinada una reducción de la morbimortalidad cardiovascular61. El estudio IMPROVE-IT96, que incluyó 18.444 pacientes tras un síndrome coronario agudo (un criterio de exclusión fue la presencia de un aclaramiento de creatinina inferior a 30ml/min), ha demostrado que la asociación de ezetimiba 10mg/día con simvastatina 40mg/día reduce de forma modesta, pero significativa, el objetivo principal del estudio, compuesto por muerte cardiovascular, IM, angina inestable, revascularización coronaria e ictus (reducción relativa del 6,4%; p=0,016). En el análisis de subgrupos aparece un especial beneficio entre los pacientes diabéticos.
El tratamiento combinado de estatina y ezetimiba ha demostrado reducir los niveles de proteína quimiotáctica de monocitos (MCP-1) en pacientes con diabetes y ERC, en los que frecuentemente se produce un incremento de la actividad inflamatoria. Este efecto puede ser beneficioso en relación con la progresión de la aterosclerosis y de la nefropatía diabética97.
ConclusionesEn definitiva, los pacientes con ERC presentan un alto/muy alto riesgo cardiovascular, y en ellos ha sido establecida la importancia de la reducción de la colesterolemia en la prevención cardiovascular desde los estadios iniciales de ERC. La tabla 7 muestra las peculiaridades del tratamiento con hipolipemiantes en la ERC, en la que el tratamiento con estatinas ha demostrado ser seguro y eficaz en la disminución del cLDL y en la reducción de episodios cardiovasculares en individuos con ERC o después del trasplante renal; sin embargo, la evidencia en los pacientes dializados es menor. Parece prioritaria una intervención precoz e intensiva antes de que se produzca una disminución importante de la función renal98.
Fármacos hipolipemiantes en la enfermedad renal crónica
| Las estatinas más adecuadas son aquellas que tienen una menor excreción renal: atorvastatina, fluvastatina y pitavastatina |
| Las estatinas metabolizadas por el citocromo P450 3A4 (lovastatina, simvastatina y atorvastatina) pueden producir reacciones adversas por su mayor riesgo de interacción con otros fármacos habituales en este tipo de pacientes |
| Si no se alcanza el objetivo de cLDL con las estatinas en monoterapia a la máxima dosis tolerada, está indicado asociar ezetimiba |
| En caso de hipertrigliceridemia grave se pueden utilizar ácidos grasos omega-3 a dosis de 2-4g/día. Se debe extremar con cautela el uso de fibratos, con vigilancia de las interacciones farmacológicas. Se puede recomendar el uso de gemfibrozilo a dosis de hasta 600mg/día siempre que el FGe no sea inferior a 15ml/min/1,73 m2, pero está contraindicado asociarlo a estatinas. La utilización de fenofibrato en pacientes con ERC se reserva a casos seleccionados, requiere ajuste de dosis y una supervisión estrecha de la función renal del paciente |
En los pacientes que no toleran o tienen contraindicaciones para la terapia con estatinas, puede haber algún beneficio con otros hipolipemiantes. A pesar de la alta frecuencia del tratamiento con estatinas, solo un tercio de los pacientes con ERC alcanza el objetivo de cLDL. Si no se alcanza el objetivo en cLDL, está indicado asociar ezetimiba. En el caso de hipertrigliceridemia aislada se pueden utilizar fibratos y/o ácidos grasos omega-3.
Es preciso implementar un plan intensivo de tratamiento de la dislipidemia en pacientes con ERC desde las fases iniciales para aumentar el logro de la meta de cLDL, y así conseguir una reducción de la morbimortalidad cardiovascular en esta población.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.