Tras un evento cerebrovascular isquémico el riesgo de recurrencias es elevado, por lo que se hace necesario el uso de terapia antitrombótica para disminuir nuevos eventos.
DesarrolloA pesar de su beneficio, estas terapias aumentan el riesgo de sangrado. Por tanto, determinar qué pacientes presentan mayor riesgo de hemorragia es fundamental. Existen diferentes modelos predictores de hemorragia y, en particular, de hemorragia intracraneal, asociados al uso de antiagregantes en pacientes con ictus isquémico o AIT, como las escalas CCSC, Intracranial-B2LEED3S score o la S2TOP-BLEED. No obstante, mientras que las principales guías internacionales recomiendan el uso de escalas, como HAS-BLED, para evaluar el riesgo de sangrado en pacientes anticoagulados, no existe una recomendación específica en el caso del uso de antiagregantes.
ConclusionesEn esta revisión se presentan los principales modelos disponibles en la actualidad para la predicción de sangrado de la terapia antitrombótica en pacientes con ictus o AIT.
After an ischemic cerebrovascular event the risk of new ischemic events is high, therefore antithrombotic therapy are indicated to prevent stroke recurrence.
DiscussionDespite its clear benefit, these therapies increase the risk of bleeding. Therefore, it is essential to identify high hemorrhagic risk patients.
There are different predictive models of hemorrhage, in particular of intracranial hemorrhage, associated with the use of antiaggregants in patients who have presented an ischemic stroke or TIA, such as the CCSC, intracranial scales -B2LEED3S score or S2TOP-BLEED. However, though main international guidelines recommend the use of scales, in particular, the HAS-BLED score, to assess the risk of bleeding in anticoagulated patients, there is no specific recommendation in the case of the use of antiplatelet drugs.
ConclusionsIn this review we present the main models currently available for the prediction of bleeding of antithrombotic therapy in patients who have had a stroke or TIA.
En España el ictus supone un problema de primera magnitud, ya que es una de las principales causas de morbimortalidad y hospitalización, constituyendo la segunda causa de muerte en la población general, la primera en las mujeres, y la primera causa de discapacidad1. Además, solo en el año 2015 se dieron de alta en los hospitales del Sistema Nacional de Salud 119.353 ictus y 14.940 accidentes isquémicos transitorios (AIT)2. Por todo ello, la atención a pacientes con ictus previo es un problema frecuente en la práctica clínica diaria.
Tras un ictus isquémico o AIT el riesgo de aparición de nuevos eventos isquémicos es elevado, hasta el 30% en 5 años3, por lo que se hace necesario el uso de un tratamiento específico que evite la recurrencia. En la actualidad, la terapia antitrombótica es la piedra angular en la prevención secundaria del ictus, ya sea mediante el uso de antiagregantes plaquetarios o de anticoagulantes principalmente en pacientes con ictus cardioembólicos. Ambas terapias disminuyen el riesgo de recurrencia del ictus; así la terapia antiplaquetaria lo hace en un 25%, mientras que la anticoagulación en contexto de una fibrilación auricular (FA) no valvular (FANV) en aproximadamente un 60%4.
A pesar de su claro beneficio, estas terapias aumentan el riesgo de sangrado, algunos de especial gravedad —como la hemorragia intracraneal (HIC)—, lo cual limita en muchas ocasiones el uso de estos fármacos, sobre todo en pacientes con sangrado previo.
En promedio, el riesgo global de sangrado aumenta al doble en pacientes tratados con aspirina en comparación con placebo, o aún más en caso de que usemos terapia antiplaquetaria dual (TAPD), especialmente por aumentar el riesgo de sangrados graves como la HIC5. Por otra parte, la anticoagulación con antagonistas de la vitamina K (AVK) en la FANV aumenta el riesgo de hemorragia mayor en un 0,3-0,5% por año y, en particular, el riesgo de HIC, que es la principal causa de muerte y discapacidad asociada con el tratamiento con AVK, se incrementa en aproximadamente un 0,2% por año en comparación con los controles4.
De hecho, aunque las hemorragias extracraneales, predominantemente de origen gastrointestinal (GI), son mucho más comunes que las HIC, las intracraneales suelen ser más graves. Solo el 5,1% de las hemorragias extracraneales con warfarina causan la muerte a los 30 días, en comparación con una tasa de mortalidad cercana al 50% en pacientes con HIC asociada a warfarina6.
Por tanto, resulta imprescindible hacer una adecuada valoración del riesgo/beneficio del tratamiento antitrombótico en función de las características del paciente, de forma que la predicción del riesgo de sangrado puede ayudar a los médicos a tomar decisiones clínicas, no solo con relación al uso de antitrombóticos, sino también en el uso de agentes gastroprotectores, entre otros.
DesarrolloDado que la terapia antitrombótica es clave en la prevención secundaria del ictus, a continuación se presentan los principales modelos que disponemos en la actualidad para la predicción del riesgo de sangrado en pacientes que han presentado un ictus isquémico o AIT e inician terapia antitrombótica.
Para ello se ha realizado una revisión narrativa de la literatura médica actual mediante una búsqueda avanzada utilizando la plataforma web PubMed.
Riesgo de sangrado con antiagregantesComo hemos comentado, la terapia antiplaquetaria crónica en la fase postaguda del ictus isquémico no cardioembólico está limitada por el riesgo de complicaciones hemorrágicas, en particular de HIC. Así, por ejemplo, con relación al riesgo anual de sangrado mayor, en un metaanálisis de 25 ensayos aleatorios de terapia antiplaquetaria en la prevención primaria o secundaria de la enfermedad cardiovascular7, la aspirina aumentó el riesgo anual absoluto de hemorragia grave en un 0,13% (number needed to harm 769). En particular, y centrándonos en la HIC, en el estudio Swedish Aspirin Low dose Trial (SALT)8, en los pacientes con ictus isquémico o AIT asignados al azar frente a placebo el riesgo a 2 años de HIC fue del 0,34% frente al 1,14% de los tratados con aspirina. En el ensayo Clopidogrel Aspirin in Prevention of Recurrent Ischemic Event (CAPRIE)9, el riesgo a 2 años de HIC varió con base en el antiagregante utilizado: clopidogrel 0,37%, aspirina 0,52% o 1,41% con TAPD (clopidogrel más aspirina).
Existen diferentes modelos predictores de hemorragia y, en particular, de HIC asociada al uso de antiagregación en pacientes que han presentado un ictus isquémico o AIT (tabla 1).
Principales escalas de riesgo de sangrado en pacientes con tratamiento antitrombótico
| Escala | Tipo de hemorragia | Población de estudio |
|---|---|---|
| Antiagregantes | ||
| CCSC | HIC | Ictus isquémico/AIT previo |
| Intracraneal-B2LEED3S | HIC | Ictus isquémico/AIT previo |
| S2TOP-BLEED | Hemorragia mayor | Ictus isquémico/AIT previo |
| Anticoagulantes | ||
| HAS-BLEED | Hemorragia mayor | FA |
| HEMORR2HAGES | Hemorragia mayor | FA |
| ATRIA | Hemorragia mayor | FA |
| ORBIT | Hemorragia mayor | FA |
| ABC | Hemorragia mayor | FA |
| PANWARDS | HIC | FA |
AIT: accidente isquémico transitorio; FA: fibrilación auricular; HIC: hemorragia intracraneal.
El primero se basaba en la base de datos de 8cohortes y 12. 648 pacientes, el Cerebrovascular Cohort Studies Collaboration (CCSC)10. En dicho estudio, en el análisis de regresión multivariante de Cox se identificaron los siguientes predictores relacionados con el riesgo de HIC: edad (> 60 años, razón de riesgo —hazard ratio [HR]— 2,07), presión arterial sistólica (≥ 140mmHg, HR 2,17), uso de fármacos antihipertensivos (HR 1,53) y, como protector, los niveles de glucosa en sangre (≥ 7 mmol/l, HR 0,33). El cuartil de mayor riesgo se asoció a 5veces más riesgo de HIC que el cuartil más bajo.
Posteriormente, se desarrolló el llamado Intracranial-B2LEED3S score (Body mass index, Blood pressure, Lacune, Elderly, Asian Ethnicity, coronary artery or cerebrovascular Disease history, Dual antithrombotic agent or oral anticoagulant, Sex)11 (tabla 2), basado en la cohorte de pacientes del estudio PERFORM12, que incluyó a 19.100 pacientes con AIT o accidente cerebrovascular isquémico no cardioembólico, y que además se validó en un ensayo de similares características, el estudio PRoFESS13, que incluyó a 20.332 sujetos que habían tenido un ictus isquémico no cardioembólico en los últimos 120 días. Donde la edad, la presión arterial y tener un índice de masa corporal bajo fueron los mayores predictores de HIC. La escala se basa en 9 ítems, con una puntuación entre 0 a 13 puntos. En el PERFORM, el riesgo observado de HIC a 2 años varió del 0,75% en los de riesgo bajo (puntuación ≤ 2) al 2,44% en pacientes de alto riesgo (puntuación ≥ 5) con una calibración aceptable pero una discriminación baja tanto en el PERFORM (estadístico C: 0,64; intervalo de confianza [IC] del 95%: 0,61-0,68) como en la validación externa en el PRoFESS (0,58; IC del 95%: 0,55-0,62). Y, aunque la puntuación del Intracraneal-B2LEED3S ayuda a identificar a los pacientes que tienen un alto riesgo de sangrado, los propios autores señalan que se necesitaría incorporar otras variables para mejorar la puntuación, como, por ejemplo, la presencia de microhemorragias en la resonancia magnética.
Escala S2TOP-BLEED
| Factor | Puntos |
|---|---|
| Sexo | |
| Mujer | 0 |
| Varón | 2 |
| Tabaco | |
| No | 0 |
| Sí | 1 |
| Tipo de antiagregante | |
| Clopidogrel | 0 |
| Aspirina (± dipiridamol) | 1 |
| Aspirina-clopidogrel | 5 |
| Pronóstico funcional | |
| mRS 0-2 | 0 |
| mRS 3-5 | 2 |
| Ictus previo | |
| No | 0 |
| Sí | 1 |
| Hipertensión | |
| No | 0 |
| Sí | 1 |
| Índice de masa corporal bajo | |
| < 20 | 2 |
| 20-25 | 1 |
| > 25 | 0 |
| Edad, años | |
| 45-54 | 2 |
| 55-64 | 4 |
| 65-74 | 6 |
| 75-84 | 9 |
| ≥ 85 | 12 |
| Etnia | |
| No asiático | 0 |
| Asiático | 1 |
| Diabetes | |
| No | 0 |
| Sí | 1 |
mRS: escala de Rankin modificada.
Recientemente, se ha publicado otra escala que recoge el riesgo de hemorragia mayor en pacientes con ictus isquémico o AIT tratados con antiagregantes, la S2TOP-BLEED score (male Sex, Smoking, Type of antiplatelet agents, Outcome on mRS, Prior stroke, high Blood pressure, Lower BMI, Elderly, Asian Ethnicity, and Diabetes)14 (tabla 3). La escala calcula el riesgo a 3años de hemorragia mayor. Esta escala se basa en los datos de 6 ensayos clínicos aleatorios (CAPRIE, ESPS-2, MATCH, CHARISMA, ESPRIT y ProFESS) que incluyen a 43.112 pacientes y que posteriormente se ha validado con los pacientes del estudio PERFORM. La puntuación S2TOP-BLEED tiene un estadístico C de 0,63 (IC del 95%: 0,60-0,64). El riesgo de sangrado mayor osciló entre el 2% en pacientes de 45-54 años sin factores de riesgo adicionales a más del 10% en pacientes de 75-84 años con múltiples factores de riesgo. En la validación externa, el modelo mostró un estadístico C de 0,61 (IC del 95%: 0,59-0,63), con un riesgo de sangrado mayor ligeramente subestimado.
Escala Intracraneal-B2LEED3S
| Puntos | |
|---|---|
| Índice de masa corporal bajo | |
| < 25 | 1 |
| ≥ 25 | 0 |
| Hipertensión | |
| No | 0 |
| Sí | 2 |
| Ictus lacunar/enfermedad de pequeño vaso | |
| No | 0 |
| Sí | 1 |
| Etnia | |
| No asiático | 0 |
| Asiático | 2 |
| Enfermedad cardiovascular | |
| No | 0 |
| Sí | 2 |
| Enfermedad cerebrovascular | |
| No | 0 |
| Sí | 2 |
| Doble antiagregación o anticoagulante | |
| No | 0 |
| Sí | 1 |
| Sexo | |
| Mujer | 0 |
| Varón | 1 |
En nuestra experiencia, la escala S2TOP-BLEED es la más útil por diversas razones: porque incluye en el pronóstico todo tipo de hemorragias mayores —no solo las HIC— y por su metodología (es la que se basa en un número mayor de pacientes y en poblaciones de distintos ensayos clínicos aleatorizados). Los grupos de riesgo predefinidos incluyen bajo riesgo (0-10 puntos en la puntuación S2TOP-BLEED), riesgo medio (11-15 puntos) y alto riesgo (> 15 puntos)14. Además, recientemente ha sido validada en 2.072 pacientes con ictus isquémico o AIT en tratamiento con agentes antiplaquetarios en una población inglesa (la OXVASC [Oxford Vascular Study]) con un rendimiento estadístico aceptable —C de 0,69 (IC del 95%: 0,64-0,73)15.
Riesgo de sangrado con anticoagulantesA finales de la década de 1990, al mismo tiempo que fueron apareciendo diferentes esquemas de estratificación de riesgo de ictus en pacientes con FA, se inició el desarrollo de sistemas de puntuación que evaluaban el riesgo de sangrado en esos mismos pacientes.
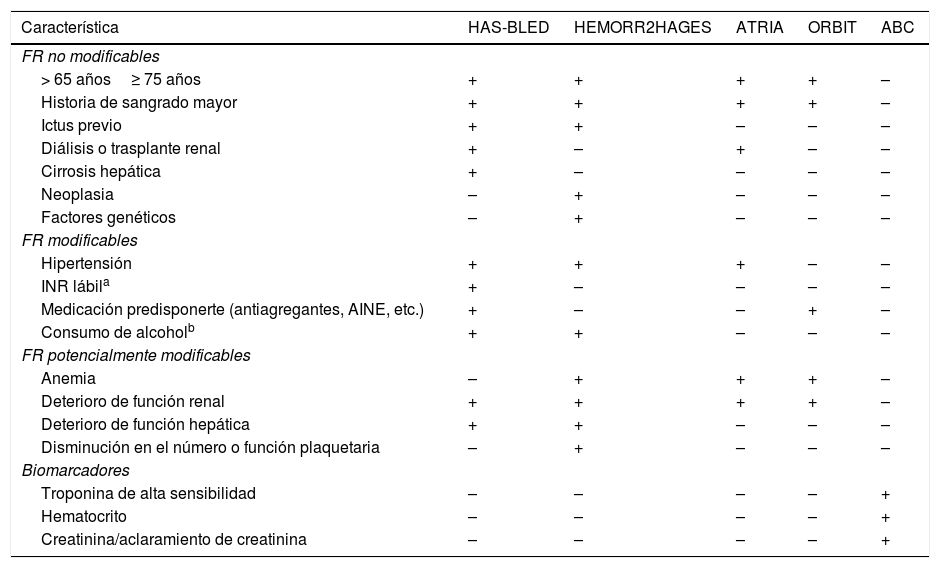
En la actualidad, existen varios sistemas de puntuación validados que pueden usarse para evaluar el riesgo de sangrado en pacientes anticoagulados por FA, incluyendo la puntuación HAS-BLED16 (Hypertension, Abnormal renal/liver function, Stroke, Bleeding history or predisposition, Labile INR, Elderly —>65 years—, Drugs/alcohol concomitantly, disponible online en: https://www.mdcalc.com/has-bled-score-major-bleeding-risk; en APP: https://play.google.com/store/apps/details?id=com.gumptionmultimedia.hasbledcalculator&hl=es;https://itunes.apple.com/us/app/has-bled/id734518338?mt=8), la escala HEMORR2HAGES17 (Hepatic or Renal Disease, Ethanol Abuse, Malignancy, Older Age, Reduced Platelet Count or Function, Re-Bleeding, Hypertension, Anemia, Genetic Factors, Excessive Fall Risk and Stroke, disponible online en: https://www.mdcalc.com/hemorr2hages-score-major-bleeding-risk), la ATRIA18 (Anticoagulation and Risk Factors in Atrial Fibrillation, disponible online en: https://www.mdcalc.com/atria-bleeding-risk-score), la escala ORBIT19 (Outcomes Registry for Better Informed Treatment of Atrial Fibrillation) y, más recientemente, la escala de sangrado ABC20 (Age, Biomarkers, Clinical history), que también hace uso de biomarcadores seleccionados.
Estas puntuaciones se obtuvieron y se validaron en diferentes cohortes de estudio, que van desde cohortes de ensayos clínicos a poblaciones del «mundo real». Así, por ejemplo, la escala HAS-BLED, que se publicó en el año 2010, se diseñó a partir de solo 53 eventos de sangrado mayor en una muestra de 3.978 pacientes del Euro Heart Survey de FA16.
Por lo tanto, el rendimiento y la precisión de clasificación de las diferentes escalas varían dependiendo de su cohorte de derivación21.
Al igual que con la antiagregación, en la mayoría de las escalas los factores de riesgo para el ictus y los de hemorragia se superponen. Por ejemplo, la edad avanzada es uno de los predictores más importantes tanto para el ictus como de sangrado en los pacientes con FA (tabla 4).
FR de sangrado en pacientes anticoagulados por FA según las distintas escalas de riesgo
| Característica | HAS-BLED | HEMORR2HAGES | ATRIA | ORBIT | ABC |
|---|---|---|---|---|---|
| FR no modificables | |||||
| > 65 años≥ 75 años | + | + | + | + | – |
| Historia de sangrado mayor | + | + | + | + | – |
| Ictus previo | + | + | – | – | – |
| Diálisis o trasplante renal | + | – | + | – | – |
| Cirrosis hepática | + | – | – | – | – |
| Neoplasia | – | + | – | – | – |
| Factores genéticos | – | + | – | – | – |
| FR modificables | |||||
| Hipertensión | + | + | + | – | – |
| INR lábila | + | – | – | – | – |
| Medicación predisponerte (antiagregantes, AINE, etc.) | + | – | – | + | – |
| Consumo de alcoholb | + | + | – | – | – |
| FR potencialmente modificables | |||||
| Anemia | – | + | + | + | – |
| Deterioro de función renal | + | + | + | + | – |
| Deterioro de función hepática | + | + | – | – | – |
| Disminución en el número o función plaquetaria | – | + | – | – | – |
| Biomarcadores | |||||
| Troponina de alta sensibilidad | – | – | – | – | + |
| Hematocrito | – | – | – | – | + |
| Creatinina/aclaramiento de creatinina | – | – | – | – | + |
AINE: antiinflamatorios no esteroideos; FA: fibrilación auricular; FR: factores de riesgo; INR: International Normalized Ratio.
En cuanto a la superioridad o no de una escala respecto a otra, los resultados de los diferentes estudios comparativos son variables22.
No obstante, un reciente metaanálisis23 concluye que la escala HAS-BLED debería ser la opción óptima para evaluar el riesgo de hemorragia mayor en la práctica clínica en pacientes anticoagulados con FA. Además, otras escalas, como la HEMORR2HAGES o ABC, se usan menos en la práctica clínica debido a que, por ejemplo, la primera implica numerosos factores y requiere utilizar estudios genéticos, y la segunda precisa de biomarcadores sanguíneos como la troponina C, el hematocrito o el aclaramiento de creatinina.
Debido a su simplicidad y a la inclusión de factores de riesgo modificables (p. ej., hipertensión no controlada, uso de agentes antiplaquetarios concurrentes, fármacos antiinflamatorios no esteroideos o consumo excesivo de alcohol), las directrices europeas y canadienses incorporan en sus guías y recomiendan el uso de la puntuación HAS-BLED para evaluar el riesgo de sangrado en pacientes con FA21,24.
Por tanto, en los pacientes con ictus cardioembólico en contexto de una FANV, una vez se ha establecido la indicación del tratamiento con anticoagulantes orales, se debería calcular el riesgo hemorrágico con la escala HAS-BLED. Una puntuación HAS-BLED ≥ 3 indica «riesgo elevado» de sangrado con dicumarínicos.
No obstante, una puntuación elevada de riesgo de sangrado de un paciente no significa que se deba evitar el uso de anticoagulantes. En su lugar, en la mayoría de los casos, se debe usar un anticoagulante con la debida precaución. Se deben programar citas regulares de seguimiento y tomar medidas para resolver cualquier factor de riesgo modificable que contribuya al elevado riesgo del paciente25.
También se debe valorar la posibilidad de otras alternativas terapéuticas, como los nuevos anticoagulantes directos (ACOD) o la oclusión de la orejuela con dispositivos implantables26.
La seguridad y la eficacia de los ACOD (rivaroxabán, dabigatrán, apixabán y edoxabán) están bien establecidas a partir de estudios de fase iii en pacientes con FANV. No obstante, desde su comercialización han aparecidos múltiples estudios y metaanálisis valorando el riesgo hemorrágico de los ACOD.
En general, los ACOD son igual de efectivos o superiores a warfarina para la prevención de ictus y de embolia sistémicas, y las tasas de sangrado mayor fueron similares o menores en pacientes tratados con ACOD en comparación con los pacientes tratados con warfarina. Sin embargo, el rivaroxabán, las dosis más altas de dabigatrán (150mg 2veces al día) y edoxabán (60mg una vez al día) parecen asociarse con tasas significativamente más altas de sangrado GI mayor27.
Otro metaanálisis28 más reciente, por ejemplo, que valoró el riesgo de sangrado GI e intracraneal reveló que solo la aspirina + clopidogrel aumentaban el riesgo de sangrado GI en comparación con placebo (OR 0,33, IC del 95%: 0,01-0,92), y no se encontraron diferencias estadísticamente significativas en pacientes con FA tratados con aspirina, warfarina o ACOD (dabigatrán, edoxabán, rivaroxabán, apixabán) en comparación con el placebo o entre ellos. Con relación a la HIC, aunque no se encontraron diferencias significativas entre cualquier anticoagulante y placebo, la warfarina confirió un riesgo significativamente mayor de HIC comparado con edoxabán 30mg (OR 3,42, IC del 95%: 1,22-7,24) y dabigatrán 110mg (OR 3,56, IC del 95%: 1,10-8,45). Ningún ACOD aumentó el riesgo de HIC comparado con el tratamiento estándar o el tratamiento con placebo.
Estos resultados también se han comprobado en pacientes con ictus previo. En un reciente metaanálisis sobre 20.500 pacientes con FA e ictus o AIT previos29 se demuestra que, en comparación con warfarina, los ACOD están asociados a una reducción significativa no solo del ictus (reducción del riesgo relativo: 13,1%), sino también de las HIC (reducción del riesgo relativo: 46,1%, reducción absoluta del riesgo: 0,88%, número necesario para tratar [NNT]: 113 pacientes durante 1,8-2,8 años).
De hecho, en las últimas recomendaciones de la Sociedad Europea de Cardiología se recomiendan los ACOD en preferencia a AVK o aspirina en pacientes con FA e ictus previo21.
No obstante, es importante señalar que estas escalas de riesgo de sangrado en pacientes anticoagulados tienen múltiples limitaciones.
Así, en general, el rendimiento de las puntuaciones de predicción clínica para la hemorragia es bajo (estadístico C 0,65), siendo similar para los distintas escalas, 0,65 para HAS-BLED, 0,63 para HEMORR2HAGES y 0,63 para ATRIA23.
También el valor predictivo de las distintas escalas de sangrado cambia si nos referimos específicamente al riesgo de HIC. De manera que, por ejemplo, la capacidad de predecir la HIC de la escalas HEMORR2HAGES y HAS-BLED en la población sueca fueron similares, con un estadístico C aproximado de 0,629. Aunque otros autores demuestran un mayor poder predictivo de HIC de la escala HAS-BLED con respecto a las escalas HEMORR2HAGE y ATRIA30, y, más recientemente, de la ABC respecto a HAS-BLED y ORBIT20, probablemente matizado por la población donde se aplique.
En general, todas estas escalas pronósticas están sesgadas hacia la predicción de hemorragias GI, que son las más comunes.
Por otra parte, también se ha desarrollado alguna escala específica para la predicción del riesgo de HIC en pacientes anticoagulados, como la escala PANWARDS31 (Platelets, Albumin, No congestive heart failure, Warfarin, Age, Race, Diastolic blood pressure, Stroke), derivada de una cohorte de 14.264 pacientes del estudio ROCKET AF.
Es importante destacar que, con frecuencia, los factores de riesgo para sangrado mayor y para HIC son distintos. En particular, los factores de riesgo más importantes para la HIC asociada con el tratamiento anticoagulante son: una mayor edad del paciente, presentar un ictus isquémico previo, la terapia antiplaquetaria concomitante y el uso de warfarina (vs. un ACOD)32.
Así, por ejemplo, en una corte de pacientes en Suecia, el antecedentes de ictus o tromboembolia previa, de eventos hemorrágicos graves (HIC o hemorragia mayor) e hipertensión fueron predictores significativos de HIC y hemorragia mayor, mientras que la insuficiencia cardiaca, la diabetes, la insuficiencia renal, la enfermedad hepática, la anemia o el defecto plaquetario/de coagulación y el cáncer fueron predictores significativos para la hemorragia mayor, pero no de HIC33.
ConclusionesTras un evento cerebrovascular isquémico el riesgo de nuevos eventos vasculares es elevado, por lo que se hace necesario el uso de terapia antitrombótica, antiagregación o anticoagulación, para disminuir el riesgo de nuevos episodios isquémicos. Sin embargo, a pesar de su claro beneficio, estas terapias aumentan el riesgo de sangrado, lo cual limita en muchas ocasiones el uso de estos fármacos. Debido a este hecho, a la hora de indicar el tratamiento antitrombótico resulta imprescindible hacer una adecuada valoración del riesgo/beneficio del tratamiento en función de las características clínicas del paciente. En ese sentido, se han desarrollado diversas escalas de estratificación que permiten calcular el riesgo de hemorragia asociada al tratamiento antitrombótico.
Existen diferentes modelos predictores de hemorragia y, en particular, de HIC asociados al uso de antiagregantes en pacientes que han presentado un ictus isquémico o AIT, como las escalas CCSC, Intracranial-B2LEED3S score o la S2TOP-BLEED. No obstante, mientras que las principales guías internacionales recomiendan el uso de escalas, en particular de la puntuación HAS-BLED, para evaluar el riesgo de sangrado en pacientes anticoagulados, no existe una recomendación específica en el caso del uso de antiagregantes. De cualquier forma, la aplicación de estas escalas de riesgo va a resultar de gran utilidad, no solo a la hora de elegir la mejor alternativa terapéutica para un paciente en concreto, sino también para identificar y controlar los factores de riesgo de sangrado modificables, como el mal control de la presión arterial, el uso concomitante de antiinflamatorios o el exceso de alcohol, entre otros.
Pensamos que un mejor conocimiento de estas escalas y su mayor aplicación en la práctica clínica van a redundar en una mejora en la atención de nuestros pacientes con ictus.
Conflicto de interesesNinguno.