La evidencia irrefutable demuestra que las estatinas reducen el riesgo de eventos cardiovasculares en una magnitud proporcional a la intensidad de la disminución del colesterol transportado por las lipoproteínas de baja densidad; a pesar de este gran avance persiste un riesgo residual de eventos cardiovasculares. Por tal motivo se plantea aumentar los niveles de lipoproteína alta densidad con el fin de potenciar la acción principal de esta lipoproteína, que es el transporte reverso de colesterol.
Distintas clases de evidencia (epidemiológicas, genéticas y fisiopatológicas) muestran que la inhibición y/o modulación de la proteína transportadora de colesterol esterificado aumenta los niveles plasmáticos de colesterol transportado por las lipoproteínas de alta densidad.
El motivo central de la presente revisión es repasar la fisiología de la proteína transportadora de colesterol esterificado, su interrelación con las lipoproteínas de alta densidad y actualizar la situación del desarrollo de las diferentes moléculas inhibidoras/moduladoras de la proteína transportadora de colesterol esterificado.
There is irrefutable evidence that statins reduce the risk of cardiovascular events in a magnitude proportional to the intensity of the decrease in cholesterol transport by the low density lipoproteins. Despite this great advance there is still a residual risk of cardiovascular events. For this reason, an increase in the levels of high density lipoprotein is considered in order to boost the main action of this lipoprotein, which is reverse cholesterol transport.
Distinct classes of evidence (epidemiological, genetic, and pathophysiological) show that the inhibition and/or modulation of cholesterol ester transfer protein increases plasma high density lipoprotein-cholesterol levels.
The main reason for presenting this review is to look at the physiology of cholesterol ester transfer protein, its interrelationship with high density lipoproteins, and to give an update on the development of different cholesterol ester transfer protein inhibitor/modulator molecules.
La aterosclerosis es la primera causa de mortalidad en el mundo occidental, y las proyecciones de los próximos diez años no vislumbran cambios1.
A pesar de que numerosos estudios clínicos demostraron que las estatinas reducen el riesgo de eventos cardiovasculares en una magnitud proporcional a la intensidad de la disminución del colesterol transportado por las lipoproteínas de baja densidad (c-LDL), persiste un riesgo residual importante de eventos cardiovasculares2–4. En consecuencia, se han desarrollado nuevas líneas de investigación con el fin de explorar efectos antiaterogénicos adicionales al descenso de las partículas aterogénicas representadas por el c-LDL. El segundo objetivo lógico es aumentar los niveles de lipoproteína de alta densidad (HDL) con el fin de potenciar la acción principal de esta, que es el transporte reverso de colesterol (TRC)5.
La «funcionalidad» de la HDL cobra una importancia central en el momento de evaluar los efectos protectores de esta lipoproteína.
El rol central de la HDL en el TRC es ampliamente aceptado como ateroprotector; sin embargo, diferentes funciones biológicas adicionales participan de forma conjunta en el TRC.
Efectos antioxidantes, antiinflamatorios, antiinfecciosos, vasodilatadores y antitrombóticos han sido ampliamente evidenciados, colaborando en la comprensión del concepto de «funcionalidad».
Podemos concluir que el concepto del colesterol transportado por HDL (c-HDL) como ateroprotector no tiene discusión, pero la manera de medir este efecto, que se deriva de múltiples funciones más allá del reconocido TRC, es mucho más compleja, dada la heterogeneidad de esta lipoproteína secundaria seguramente a su extenso proteoma.
Estudios epidemiológicos demostraron claramente la relación inversa entre c-HDL y riesgo cardiovascular6,7. Sin embargo, estudios de intervención no revelaron tan eficientemente una relación causal, si bien se reportaron algunos resultados alentadores8–12.
Evidencias epidemiológicas, genéticas y fisiopatológicas mostraron que la inhibición y/o modulación de la proteína transportadora de colesterol esterificado (CETP) aumenta los niveles plasmáticos de c-HDL, con la consecuente probabilidad de favorecer su función en el TRC13–15.
El objetivo del presente trabajo es revisar la fisiología de la CETP, su interrelación con la HDL y actualizar la situación del desarrollo de las diferentes moléculas inhibidoras/moduladoras de CETP.
Características físicas y bioquímicasEn el año 1978 se reporta la existencia de una proteína en el plasma que mediaba el transporte de colesterol esterificado (CE) entre las lipoproteínas plasmáticas, la lipoproteína de muy baja densidad (VLDL), la LDL y la HDL16. Su actividad estaba confinada a la fracción plasmática de d>1.063g/ml, compatible con las HDL, sin embargo no reaccionaba con los anticuerpos contra las apoproteínas de HDL. Los recientes análisis del proteoma de HDL evidenciaron que la CETP es una de las más de 50 proteínas asociadas a las partículas de HDL17.
La purificación de la CETP a partir del plasma permitió identificarla como una glucoproteína con peso molecular entre 66 y 70kDa, conformada por 476 aminoácidos con presencia elevada de residuos no-polares, otorgándole propiedades hidrofóbicas especiales18. La CETP se expresa en varios tejidos, aunque el hígado es la fuente más importante de CETP circulante19. El hallazgo de la CETP en el cerebro evidencia su papel en la distribución de lípidos en el sistema nervioso, de hecho, se propone que variaciones en la secuencia del gen de CETP podrían mediar la susceptibilidad a la enfermedad de Alzheimer20.
El rol fisiológico de la CETP en plasma se estudió a través de su inyección en animales carentes de CETP como las ratas, observando una disminución de las HDL grandes ricas en CE y un incremento de triglicéridos (TG) en las HDL21. Contrariamente, estudios indirectos en animales que sí poseen CETP, como los conejos, mostraron cómo mediante la inyección de anticuerpos contra CETP se suprime completamente la transferencia de CE y TG, resultando en una reducción de TG-HDL y en un significativo aumento de colesterol en las HDL22. Más recientemente, trabajos realizados en hámsters o animales transgénicos revelaron la potencial acción de inhibidores de CETP en la promoción del TRC, desde macrófagos a la excreción fecal23,24.
El gen de la CETP se localiza en el cromosoma 16 (16q13) y abarca 25 pares de bases, incluyendo 16 exones. La clonación del gen de la CETP humano en el año 1990 fue la base para estudios de regulación25, pero recién en 2007 se resuelve su estructura molecular completa, lo cual constituirá un avance significativo para el desarrollo de fármacos más efectivos.
Procedimientos recientemente aplicados, como cristalografía por rayos X, microscopia electrónica y observaciones bioinformáticas, permitieron dilucidar los mecanismos físicos que explican las interacciones CETP/lipoproteínas, evidenciando que la CETP se conecta a 2 lipoproteínas formando un puente o túnel hidrofóbico a lo largo del cual se produce la transferencia de lípidos neutros26. De esta manera, la CETP intercambia tanto CE como TG, de manera simultánea, recíproca y en relación equimolar.
Función de la proteína transportadora de colesterol esterificadoFamilias japonesas deficientes en CETP, debido a una prevalente mutación común en el gen, presentaron un marcado aumento de c-HDL27. La CETP, con su función de transferir lípidos neutros entre lipoproteínas actúa como integradora del metabolismo lipoproteico conectando a las lipoproteínas ricas en TG con las HDL y LDL. Este intercambio es considerado «heterotípico», produciendo un remodelamiento de la composición y estructura de las partículas.
En condiciones normales, la CETP intercambia pequeñas cantidades de CE de HDL por TG de VLDL, resultando en un ligero aumento en el contenido de TG en HDL y mínimos efectos sobre VLDL. En cambio, en la hipertrigliceridemia, la CETP puede alterar profundamente el perfil lipoproteico y su catabolismo. La acumulación de VLDL en el plasma aporta buena cantidad de TG para intercambiar con el colesterol de las HDL y LDL. Las HDL con mayor contenido en TG son menos eficientes para generar eflujo de colesterol28, y las LDL grandes, ricas en TG, son más aterogénicas29. Todos estos cambios derivados de una activa participación de CETP, especialmente en la hipertrigliceridemia, explican su carácter proaterogénico.
Desde otro punto de vista, la acción heterotípica de la CETP puede considerarse antiaterogénica por la transferencia de CE desde HDL hacia LDL, siempre y cuando esta LDL sea captada por los receptores LDL hepáticos y, más aún, si el colesterol proviene originariamente del eflujo desde los macrófagos de la pared arterial30.
Otra función de la CETP es promover la transferencia «homotípica» de CE, es decir, desde las subfracciones de HDL más pequeñas hacia HDL más grandes. Esta acción de CETP, en cuanto favorezca al TRC y recicle a la eficiente pre-ß-HDL, es considerada un rol antiaterogénico31.
Los aspectos proaterogénicos y antiaterogénicos de la CETP, sumados a recientes hallazgos epidemiológicos de una relación inversa entre la actividad de la CETP y la incidencia de enfermedad cardiovascular32, desafían el paradigma de su inhibición como fenómeno cardioprotector.
Finalmente, cabe destacar que la CETP puede unirse a otras proteínas como la incrementadora de permeabilidad bactericida o la ligadora de lipopolisacáridos, determinando funciones antiinflamatorias. La inhibición de la CETP aumentaría el riesgo de infecciones bacterianas, explicando, en parte, las causas de muertes no relacionadas a eventos cardiovasculares detectados con torcetrapib33.
Lipoproteínas de alta densidad, funciones y subfracciones. Relación con la proteína transportadora de colesterol esterificadoLas HDL son las lipoproteínas más pequeñas constituidas, en un 50% por proteínas, siendo las principales las apoproteínas A-I y A-II. De su contenido lipídico alrededor del 20% de es colesterol, casi el 60% son fosfolípidos y el resto son escasos TG. Las HDL tienen diferentes orígenes: pueden provenir de la síntesis hepática e intestinal, o resultar del catabolismo de las lipoproteínas ricas en TG (quilomicrones y/o VLDL) en la circulación plasmática. Las HDL recién sintetizadas o nacientes son discoidales y se las conoce como pre-ß-HDL, constituidas por colesterol libre, fosfolípidos y apoA-I. En el plasma estas partículas maduran adquiriendo forma esférica, constituyendo las subfracciones HDL2 y HDL3 con diferentes roles en el TRC.
Esta ruta metabólica llevada a cabo por las HDL incluye varios pasos: a) eflujo del colesterol libre desde los tejidos periféricos, por ejemplo a través del transportador ABCA1 (de la familia de los ATP binding cassette) y su captación por las pre-ß-HDL; b) esterificación del colesterol libre de las pre-ß-HDL por acción de la lecitina-colesterol aciltransferasa, crucial en el proceso de maduración de las HDL; c) intercambio de CE y TG entre HDL y lipoproteínas con apoB por acción de la CETP, y d) depuración hepática del CE a través de la intervención de receptores scavenger denominados SR-BI. Otra vía de conducción del colesterol hasta el hígado es mediante las lipoproteínas con apoB, que por acción de la CETP se sobrecargaron de colesterol y, por lo tanto, cumplen de manera indirecta con la finalidad del transporte inverso del colesterol5.
Si bien la función más importante de las HDL es transportar el colesterol desde los tejidos periféricos hacia el hígado, para su reciclaje o catabolismo a ácidos biliares, las HDL poseen otras propiedades ateroprotectoras, como: a) inhibición de la oxidación de LDL, en donde la enzima paraoxonasa juega un papel relevante; b) capacidad antiinflamatoria a través de la inhibición de la síntesis y expresión de moléculas de adhesión endoteliales; c) acción citoprotectora, inhibiendo la apoptosis de células endoteliales; d) acción vasodilatadora estimulando el óxido nítrico celular y prostaciclinas, y e) acción antitrombótica inhibiendo la agregación plaquetaria34.
Las partículas de HDL mantienen una relación con la CETP de aproximadamente una molécula cada 500 HDL. Preferentemente, la CETP se une a las partículas de HDL más pequeñas (HDL3) y a las nacientes discoidales (pre-ß-HDL). Experimentos con CE marcado en HDL3 y CETP humana recombinante, demostraron la transferencia de la marcación hacia subfracciones de HDL2 en forma dosis-dependiente35. Otros experimentos coinciden en demostrar que la CETP favorece la formación de pre-ß1-HDL, partícula con gran capacidad aceptora de colesterol35. Este proceso homotípico puede ser inhibido por algunos inhibidores de la CETP, pero no por otros36; por lo tanto, se deduce que la acción moduladora parcial de los inhibidores de la CETP sería la alternativa más favorable.
En los sujetos con deficiencia de CETP se observan partículas HDL de mayor tamaño, con baja proporción de apoA-I y mayormente de apoE37,38. Sin embargo, aún no está dilucidada la capacidad para promover el eflujo o la entrega del colesterol al hígado por parte de las subfracciones de HDL acumuladas en situaciones de deficiencia de CETP.
Es actualmente ineludible el conocimiento de los mecanismos involucrados en la conversión de las subfracciones en el marco del TRC, como base para el desarrollo específico de fármacos.
Inhibidores de proteína transportadora de colesterol esterificado desarrolladosEl comienzo de la historia de los inhibidores de CETP en humanos se inicia con el desarrollo de torcetrapib (Pfizer, NY, EE. UU.; IC50≈50nM) y una serie de 3 grandes ensayos clínicos destinados a comprobar su seguridad y eficacia por diferentes métodos en distintas poblaciones39:
- a)
El estudio Investigation of Lipid Level Management Using Coronary Ultrasound to Assess Reduction of Atherosclerosis –ILLUSTRATE– utilizó ecografía intravascular para medir el volumen y modificación de la placa de ateroma.
- b)
Los estudios Rating Atherosclerotic Disease Change by Imaging with a New Cholesteryl-Ester-Transfer Protein Inhibitor –RADIANCE 1 y 2– midieron el espesor íntima-media carotídeo por ecografía doppler.
- c)
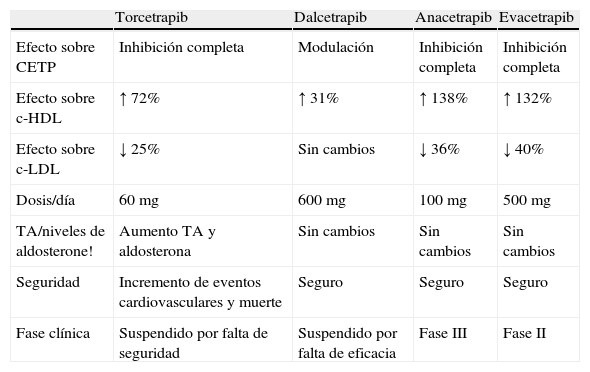
El estudio Investigation of Lipid Level Management to Understand its Impact in Atherosclerotic Events –ILLUMINATE– fue diseñado para evaluar los eventos cardiovasculares. Se dividió en 2 ramas: 60mg de torcetrapib más atorvastatina o placebo más atorvastatina. La rama activa incrementó un 72,1% el c-HDL, disminuyó un 24,9% el c-LDL y la disminución de TG (9%) no fue significativa.
Los tres estudios debieron ser suspendidos a los 18 meses, durante la fase 3, por aumentar un 25% los eventos cardiovasculares y presentar un 40% más de muertes por dicha causa en la rama con torcetrapib. También se identificó un 70% más de muertes por infecciones/sepsis y un 100% más por cánceres. Los efectos del torcetrapib sobre el ateroma fueron similares en los tres estudios, sin evidencia de beneficios en la rama activa39–41.
Las causas probables del aumento de muertes cardíacas y no cardíacas se atribuyen fundamentalmente a la activación del sistema renina-angiostensina-aldosterona, con el consecuente aumento de la tensión arterial sistólica (5,4mmHg), aumento de aldosterona, sodio y bicarbonato, y disminución de potasio. La aldosterona, a través de la activación de su receptor mineralocorticoideo, también tendría efectos vasculares directos, incluyendo disfunción endotelial e inflamación42. Se comprobó que el efecto hipertensivo del torcetrapib fue independiente de la inhibición de la CETP.
Dalcetrapib (Roche, CA, EE. UU.; IC50≈9μM) fue la primera molécula modificadora de CETP en demostrar efecto antiaterogénico in vivo43. Ejerce una acción moduladora sobre la CETP, inhibiendo la transferencia heterotópica de CE desde las HDL a las lipoproteínas que contienen apoB100, sin alterar la transferencia homotípica entre HDL3 y HDL2. La modulación o inhibición parcial de dalcetrapib no afectaría a la vía directa del TRC, pero sí a la vía indirecta a través de las lipoproteínas con apoB100 y el receptor hepático44.
El programa dalcetrapib HDL Evaluation, Atherosclerosis and Reverse cholesterol Transport –dal-HEART– incluyó seis estudios (dal-OUTCOMES, dal-OUTCOMES 2, dal-PLAQUE, dal-PLAQUE 2, dal-VESSEL y dal-ACUTE) para valorar la seguridad y eficacia de dalcetrapib en diferentes escenarios y con diferentes métodos45. Dalcetrapib redujo la actividad de la CETP entre un 40-50%, incrementando el c-HDL un 35%, sin modificar los valores de c-LDL ni de TG.
El estudio dal-OUTCOMES (fase 3), estudio multicéntrico, aleatorizado, doble ciego, placebo controlado, fue diseñado para evaluar a dalcetrapib en pacientes con síndrome coronario agudo. Se aleatorizaron 15.600 pacientes, que recibieron 600mg/día de dalcetrapib o placebo, además de la terapia con estatinas para lograr un nivel de c-LDL óptimo46.
En mayo de 2012 Roche suspendió el programa dal-HEART por falta de beneficios en la rama activa47.
Inhibidores de la proteína transportadora de colesterol esterificado en desarrolloAnacetrapib (Merck, NJ, EE. UU.; IC50 15-57μM), tercer inhibidor de la CETP investigado, comparte, junto a torcetrapib, el efecto inhibitorio sobre la CETP, modificando de forma sustancial al c-HDL, así como también al c-LDL y la lipoproteína(a). Posee características de inhibición tanto homotípica como heterotípica47.
El primer objetivo con este fármaco fue demostrar seguridad; para ello se desarrolló el estudio Determining the EFficacy and tolerability of CETP INhibition with anacEtrapib –DEFINE–, aleatorizado, doble ciego, placebo-controlado, que evaluó pacientes con enfermedad cardiovascular o riesgo equivalente, con valores de c-LDL<100mg/dl y c-HDL<60mg/dl, administrando 100mg/día de anacetrapib versus placebo (ambos grupos tratados con estatinas) durante 18 meses. Se comprobó una reducción de c-LDL del 39,8%, un incremento de c-HDL del 138,1% y una disminución del 36,4% de lipoproteína(a)48,49. El estudio Randomized EValuation of the Effects of Anacetrapib through Lipid-modification –REVEAL–, aleatorizado, placebo-controlado, evalúa los efectos clínicos cardiovasculares (mortalidad coronaria, infarto agudo de miocardio y revascularización miocárdica) de anacetrapib en más de 30.000 pacientes con enfermedad vascular establecida, con 5 años de duración, el cual tiene previsto concluir en el año 201750–52.
Evacetrapib (Eli Lilly, IN, EE. UU.) es una molécula con la característica de ser un inhibidor potente y selectivo de la CETP, similar a anacetrapib y torcetrapib. Su acción sobre la CETP es tanto homotípica como heterotípica53. En 2011, 398 pacientes fueron evaluados en un ensayo aleatorizado, controlado, con diferentes dosis de evacetrapib, con o sin el acompañamiento de estatinas, durante 12 semanas. Con dosis entre 100 y 500mg/día aumentó el c-HDL hasta un 132%, disminuyó el c-LDL hasta un 40%, y con 500mg/día disminuyeron los TG un 20%, sin evidencias de efectos adversos54. El estudio ACCELERATE, actualmente en curso, ofrecerá en un futuro más datos sobre la eficacia clínica de evacetrapib.
BAY 60-5521 (Bayer, Alemania) es la última de las moléculas en desarrollo, con resultados aún tempranos, pero que muestran seguridad y buena tolerancia, a la espera de resultados clínicos55.
DiscusiónEl concepto de riesgo residual condujo al estudio de otras lipoproteínas más allá de la LDL. Luego del control del c-LDL, surge como objetivo terapéutico incrementar el c-HDL con el fin de potenciar sus acciones antiaterogénicas e intentar disminuir el riesgo remanente de eventos cardiovasculares.
La complejidad de la HDL, evidenciada por sus diferentes subfracciones y amplio proteoma, tiene su correlato en la dificultad de valorar sus efectos. Elevados valores de c-HDL asociados a la falta de efectos beneficiosos se suman a reportes e interpretaciones de probables consecuencias deletéreas con HDL disfuncionales y pérdidas de funciones ajenas a lo estrictamente lipídico (enfermedades infecciosas, oncológicas e inmunológicas).
El desarrollo de estrategias para aumentar el c-HDL mediante la inhibición de la CETP se fundamenta en estudios poblacionales que demostraron una relación inversa entre genotipos con menor actividad de la CETP y niveles de c-HDL, escenario asociado a un menor riesgo de enfermedad coronaria56. Los modelos de familias con variaciones genéticas que determinan una actividad deficiente de CETP promovieron el desarrollo de estrategias para aumentar el c-HDL mediante la inhibición de la función de CETP y, de esta forma, aumentar el HDL. Este concepto es avalado por un importante metaanálisis que demostró que individuos con genotipos de CETP asociados a una moderada inhibición de su actividad presentaban menor riesgo de eventos coronarios57. Sin embargo, más allá de esta hipótesis, otros estudios epidemiológicos no pudieron confirmar la relación entre una CETP baja y un riesgo cardiovascular aumentado. Un estudio epidemiológico prospectivo con participantes de la cohorte del Framingham Heart Study demostró que la actividad disminuida de CETP se asoció con mayor riesgo cardiovascular, lo cual desafía el concepto de que la inhibición de la CETP disminuye dicho riesgo58. Finalmente, un ensayo de aleatorización mendeliana publicado recientemente demostró que variantes genéticas de la CETP no se asociaron con recurrencia de eventos cardiovasculares o mortalidad. Los autores, por ende, cuestionan la utilidad de la inhibición de la CETP como objetivo terapéutico en prevención secundaria59. Asimismo, análisis de metarregresión y de aleatorización mendeliana demostraron correlaciones débiles entre niveles plasmáticos de c-HDL y riesgo cardiovascular60,61. Para interpretar estos hallazgos es imprescindible tener en cuenta las múltiples funciones de la HDL, aún no del todo comprendidas, además del amplio y complicado proteoma con roles todavía desconocidos.
El incremento en la mortalidad observado con torcetrapib no se justifica por la inhibición de la CETP, sino por los efectos «off-label» del fármaco: activación del eje renina-angiotensina-aldosterona, con mayor incidencia de casos de sepsis y cáncer en la rama activa.
Dalcetrapib posee un mecanismo de acción más «fisiológico» al inhibir la transferencia heterotípica y no la homotípica, promoviendo así la maduración de HDL, la síntesis de pre-β1-HDL y la excreción de esteroles fecales como marcador indirecto de TRC. Sin embargo, la suspensión precoz del programa dal-HEART por falta de eficacia, y no por efectos adversos como el caso de torcetrapib, agrega un interrogante más a las dudas surgidas en los últimos años, que tratarán de dilucidarse con las moléculas aún en estudio.
Anacetrapib y evacetrapib, ambos inhibidores potentes de la CETP, afectan la transferencia homotípica y heterotípica que, seguramente, aclararán si este mecanismo constituye una estrategia de prevención y/o tratamiento de enfermedad cardiovascular. Los cambios en las diversas lipoproteínas son beneficiosos y el perfil de seguridad aparenta estar garantizado.
La condición basal del paciente, el momento de administración y los fármacos concomitantes son también elementos fundamentales al evaluar el efecto de estos cuatro fármacos. Estados asociados a hipertrigliceridemias, como la diabetes tipo 2 o el síndrome metabólico, serían situaciones en donde inhibir la CETP se asociaría a efectos beneficiosos, dado que se evitaría que las HDL se sobrecarguen en TG y sean degradadas por la lipasa hepática, alterando su funcionalidad.
Con torcetrapib y dalcetrapib se ha transitado parte del camino, mostrando un comportamiento complejo, que debería esclarecerse con el completo conocimiento de la fisiología y fisiopatología de HDL, objetivo de esta estrategia terapéutica. Anacetrapib y evacetrapib, además de incrementar en más del 100% el c-HDL, disminuyen el c-LDL y la lipoproteína(a), constituyendo importantes factores confundidores a la hora de la eventual interpretación de los beneficios clínicos de estas moléculas (tabla 1).
Tabla comparativa sobre diferentes efectos de los inhibidores de la proteína transportadora de colesterol esterificado
| Torcetrapib | Dalcetrapib | Anacetrapib | Evacetrapib | |
| Efecto sobre CETP | Inhibición completa | Modulación | Inhibición completa | Inhibición completa |
| Efecto sobre c-HDL | ↑ 72% | ↑ 31% | ↑ 138% | ↑ 132% |
| Efecto sobre c-LDL | ↓ 25% | Sin cambios | ↓ 36% | ↓ 40% |
| Dosis/día | 60mg | 600mg | 100mg | 500mg |
| TA/niveles de aldosterone! | Aumento TA y aldosterona | Sin cambios | Sin cambios | Sin cambios |
| Seguridad | Incremento de eventos cardiovasculares y muerte | Seguro | Seguro | Seguro |
| Fase clínica | Suspendido por falta de seguridad | Suspendido por falta de eficacia | Fase III | Fase II |
La histórica y simplificadora función asignada a la HDL como lipoproteína encargada meramente del TRC ha sido cuestionada en los últimos tiempos. La definitiva comprensión fisiológica y fisiopatológica de esta lipoproteína llevará finalmente a un conocimiento de sus funciones específicas, más allá de las antiaterogénicas. El desarrollo de nuevos fármacos que actúen sobre los procesos funcionales de la HDL contribuirá al conocimiento final de esta apasionante molécula.
Responsabilidades éticasProtección de personas y animales.Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos.Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado.Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.