La microbiota intestinal tiene un papel determinante en el control del peso corporal. En la presente revisión se exponen las diferentes vías por las que puede modular la homeostasis energética del huésped, en base a su capacidad modificadora del metabolismo del individuo y su contribución en la regulación del aprovechamiento energético. Con las evidencias actuales, no está claro cuál es el perfil de microbiota que se atribuye a la presencia de obesidad, aunque en modelos animales parece relacionarse con una mayor proporción de bacterias del filo Firmicutes, en detrimento de las del filo Bacteroidetes. Otros factores claramente implicados serían la diversidad en la microbiota intestinal o sus posibles cambios funcionales. Son necesarios más estudios en humanos para poder esclarecer cómo la disbiosis puede influir en el control ponderal. Por otra parte, los probióticos afectan directamente la microbiota intestinal, modulando su composición y, posiblemente, su funcionalidad. Un gran número de estudios en humanos han evaluado el impacto de los probióticos en la obesidad. A pesar de que esta intervención puede tener un potencial efecto beneficioso, es preciso esclarecer qué cepas de probióticos deben recomendarse, en qué dosis y durante cuánto tiempo.
Gut microbiota plays a key role in the control of body weight. In the present review the different ways in which it can modify the energy homeostasis of the host are exposed, based on its capacity to modify the metabolism of the individual and its contribution in the energy consumption regulation. With the current evidence, it is not clear what microbiota profile is associated with the presence of obesity, although in animal models it seems to be related to a higher proportion of bacteria of the Firmicutes phylum, to the detriment of those of the Bacteroidetes phylum. Other factors clearly involved would be the diversity in the gut microbiota or its possible functional changes. More studies in humans are needed to clarify how dysbiosis can influence weight control. On the other hand, probiotics directly affect the gut microbiota, modulating its composition and, possibly, its functionality. A large number of studies in humans have evaluated the impact of probiotics on obesity. Although this intervention may have a potentially beneficial effect, more effort is needed to clarify which strains of probiotics should be recommended, at what dose and for how long.
La prevalencia de obesidad está en continuo crecimiento en todo el mundo, especialmente en los países industrializados y representa uno de los problemas de salud global más importantes, al ser vinculada con la aparición de múltiples comorbilidades como la hipertensión arterial, la diabetes mellitus tipo 2, la esteatosis hepática no alcohólica y la enfermedad cardiovascular, entre otras. Según datos del Estudio de Nutrición y Riesgo Cardiovascular en España, estudio poblacional más reciente de factores de riesgo cardiovascular realizado en el país, un 16,5% de la población tiene sobrepeso (índice de masa corporal [IMC] 25-30kg/m2), un 21,7% presenta obesidad leve o moderada (IMC 30-40kg/m2), y un 1,2% obesidad grave o mórbida (IMC > 40kg/m2)1.
Desde un punto de vista simplista, la fisiopatología de la obesidad se puede explicar por un balance energético positivo, con una mayor energía ingerida que consumida, que mantenido durante un largo periodo de tiempo conduce al acúmulo de grasas en los adipocitos y, en consecuencia, un incremento ponderal. Sin embargo, la fisiopatología de esta enfermedad es mucho más compleja, e intervienen factores adicionales como el metabolismo basal, factores genéticos y ambientales. Estos últimos son los que más impacto tienen en la evolución ponderal de los individuos2. De los factores ambientales, los hábitos alimentarios y la actividad física juegan un papel predominante, aunque existen otros aspectos relacionados con el entorno muy implicados en la aparición de la obesidad.
Entre ellos, cabe destacar la composición de la microbiota del individuo y los procesos de disbiosis o desequilibrio que se produzcan y que puedan originar un cambio en la composición y/o función de la misma. En la última década se ha empezado a relacionar de forma muy estrecha tanto la composición como los cambios en la microbiota intestinal con la obesidad, tanto en modelos experimentales como humanos3,4. Además, los microorganismos probióticos han aumentado su popularidad debido al creciente número de estudios que demuestran que ciertas cepas presentan propiedades promotoras de la salud5. A continuación, se revisa el papel de la microbiota en la fisiopatología de la obesidad y el impacto del tratamiento con probióticos.
La microbiota intestinalLa microbiota intestinal se puede definir como el conjunto de comunidades de microorganismos vivos colonizadores del intestino. En el momento previo al nacimiento, el intestino es estéril y se coloniza por completo durante el primer año de vida. El tipo de parto y la lactancia materna desempeñan un papel significativo en la estabilización de la microbiota6. A continuación, la microbiota se modifica con la edad, los hábitos dietéticos y los factores ambientales, entre los cuales cabe destacar la antibioticoterapia7. De forma paralela, investigaciones recientes muestran que el 80-90% de los filotipos de bacterias del intestino humano son miembros de dos filos, Bacteroidetes (gramnegativos, e.g. Bacteroides y Prevotella) y Firmicutes (grampositivos, e.g. Clostridium, Enterococcus, Lactobacillus, Ruminococcus), seguidos de las Actinobacterias (gramnegativas, e.g. Bifidobacteria) y las Proteobacterias (gramnegativas, e.g. Helicobacter, Escherichia)8–10.
La importancia de la microbiota radica en la implicación que tiene en el metabolismo del ser humano11, ya que participa en la modulación de la nutrición del huésped y del consumo de energía a través de la producción de vitaminas (K, ácido fólico y B12), absorción de electrólitos y minerales, fermentación de componentes indigeribles de la dieta por el huésped y producción de ácidos grasos de cadena corta (AGCC)10; además influye en la homeostasis del epitelio intestinal, desarrollo del sistema inmunitario, protección frente a patógenos o metabolismo de fármacos11,12.
Microbiota y obesidadDe entre todas las funciones anteriormente planteadas, desde hace poco más de 10 años está empezando a aumentar la inquietud relacionada con el papel de la microbiota intestinal en la homeostasis energética y, muy especialmente, su comportamiento con enfermedades metabólicas como la obesidad. Existen múltiples estudios, tanto en modelos animales como en humanos, que relacionan la alteración de la microbiota intestinal con la presencia de obesidad.
Estudios en modelos animalesPapel de la microbiota en la regulación del metabolismoLa microbiota por sí sola puede causar aumento de peso. En este sentido, la microbiota derivada de ratones genéticamente obesos o que han desarrollado obesidad a través de la dieta puede provocar la acumulación de grasa, sin que esto esté mediado por un incremento en la ingesta. Las primeras evidencias del papel de la microbiota en la obesidad nacen de los estudios realizados en ratones «germ-free» (GF), el intestino de los cuales es estéril, comparándolos con ratones convencionales13. En condiciones basales, los ratones convencionales tenían un 40% más de grasa corporal que los GF, independientemente de la ingesta. Además, después de la colonización de los roedores GF con la microbiota intestinal de los convencionales, se produjo aumento significativo del peso corporal y un incremento del 60% de la masa grasa, un crecimiento significativo de la síntesis hepática de triglicéridos, de la secreción de leptina y un desarrollo de resistencia a la insulina, independientemente de la ingesta y del gasto energético total. Así mismo, la transferencia de la microbiota intestinal de ratones convencionales a ratones GF provocó un aumento significativo de peso y de masa grasa, comparados con el trasplante de microbiota de ratones delgados14.
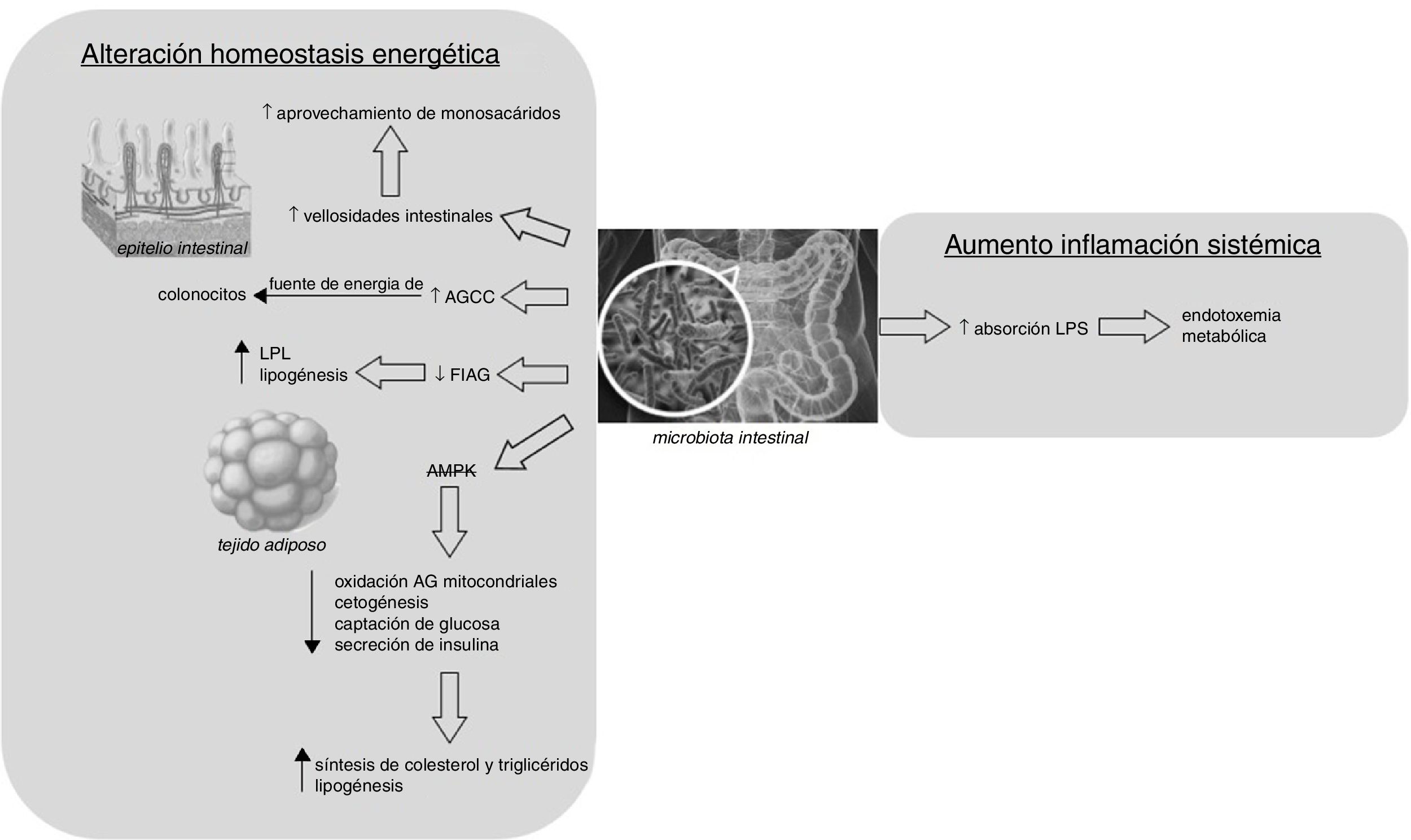
Existen dos principales mecanismos por los que la composición de la microbiota podría ser un promotor de la obesidad: por alteración de la homeostasis energética del huésped y por un aumento de la inflamación sistémica (fig. 1). El primer mecanismo afectaría la predisposición del huésped a aprovechar una mayor cantidad de calorías de los alimentos y, por tanto, al desarrollo de obesidad y de mayor adiposidad13. Esto se puede producir por diferentes vías: a) un mayor aprovechamiento de monosacáridos que habitualmente no serían digeribles, secundariamente a un desarrollo del epitelio intestinal por parte de la microbiota, aumentando la densidad de los capilares de las vellosidades intestinales15; b) una mayor producción de AGCC, que son aprovechados como fuente energética por los colonocitos16; c) promoviendo el depósito de triglicéridos en los adipocitos. Este mecanismo sería causado por la disminución, por parte de la microbiota, de la expresión intestinal de la hormona fasting-induced adipocyte factor, la cual inhibe la lipoproteína lipasa, encargada de la captación celular de ácidos grasos a partir de lipoproteínas y de la acumulación de triglicéridos en los adipocitos13; y d) la supresión, por parte de la microbiota intestinal, de la liberación de la AMP-activated protein kinase lo que conduce a una reducción de la oxidación de AG mitocondriales, cetogénesis, captación de glucosa y secreción de insulina y potenciación de la lipogénesis y síntesis de colesterol y triglicéridos17–19.
El segundo mecanismo que hace referencia a un proceso de inflamación sistémica fue descrito por Cani et al.20, que observó, después de administrar una dieta rica en grasas a un grupo de ratones, un incremento de la proporción de bacterias gramnegativas en la microbiota intestinal y, de esta forma, un aumento de la absorción intestinal de fragmentos de bacterias como, por ejemplo, los lipopolisacáridos, generando la llamada «endotoxemia metabólica», muy relacionada clásicamente con la inflamación crónica y con otras enfermedades metabólicas asociadas a la obesidad.
Tipo de microbiota y su influencia sobre la obesidadUna vez constatado el impacto de la microbiota en el metabolismo del huésped, las investigaciones se centraron en esclarecer qué tipo de microbiota se asociaba de forma más directa con el aumento ponderal. Por una parte, se ha relacionado la presencia de ciertas cepas de microorganismos con la presencia de obesidad. En modelos animales se ha podido concluir de forma más o menos unánime que el aumento en la proporción de bacterias grampositivas (Firmicutes) en detrimento a las gramnegativas (Bacteroidetes, actinobacterias y proteobacterias) se relaciona con la presencia de obesidad4,8,21.
Otros autores parecen indicar que la microbiota puede ser modulable a través de la dieta. Turnbaugh et al.22 colonizaron ratones GF con heces humanas y los alimentaron con una dieta occidental versus una dieta baja en grasas y rica en polisacáridos vegetales durante 2 semanas y, posteriormente, trasplantaron su microbiota a ratones GF. Los ratones GF que recibieron la microbiota de los ratones alimentados con la dieta occidental ganaron más adiposidad que los roedores que se trasplantaron de los alimentados con una dieta baja en grasas. En otro estudio, se obtuvo un aumento de Firmicutes en ratones alimentados con una dieta alta en grasas, además de presentar una menor cantidad de Proteobacterias y Actinobacterias (i.e. Bifidobacterium spp.)23. También se vio un incremento en la ratio entre Firmicutes y Bacteroidetes, tanto en roedores con fenotipo obeso como delgado, cuando eran alimentados con una dieta rica en grasas24.
Estudios en humanosPocos años después del inicio de los estudios en modelos animales, empezaron a aparecer los primeros trabajos centrados en la determinación de la microbiota intestinal en humanos y su relación con la obesidad.
Tipo de microbiota y su influencia sobre la obesidadAsí como en modelos animales se ha podido concluir de forma más o menos unánime que el aumento en la proporción de bacterias grampositivas (Firmicutes) en detrimento a las gramnegativas (Bacteroidetes, Actinobacterias y Proteobacterias) se relaciona con la presencia de obesidad, los estudios en humanos no resultan tan concluyentes. De hecho, existen una serie de trabajos que defienden esta idea. En el 2006, un año después de su primera observación experimental en ratones8, Ley et al.9 confirmaron que los sujetos obesos, en comparación con los delgados, tenían una mayor proporción de Firmicutes y una relativa menor cantidad de Bacteroidetes. Este estudio también mostró que la ratio entre Firmicutes y Bacteroidetes se acercó al perfil de una persona delgada, después de una pérdida de peso a través de una dieta baja en grasas o hidratos de carbono durante 18 meses. De forma similar, Santacruz et al.25 observaron una reducción en el número de Bacteroides y un incremento en la presencia de Estafilococos, Enterobacterias y Escherichia coli en mujeres embarazadas con obesidad comparadas con embarazadas con normopeso. Otros trabajos que avalan esta línea de investigación observaron un aumento significativo en el nivel de especies de Lactobacillus (género perteneciente al filo Firmicutes) en pacientes obesos26. Especialmente, una alta presencia de Lactobacillus reuteri (L. ruteri) y un bajo nivel de Lactobacillus casei/paracasei, Lactobacillus plantarum (L. plantarum) y Bifidobacterium animalis se asociaron a obesidad27. Otros estudios no constatan una relación tan concluyente entre la proporción de estas bacterias y la obesidad. Turnbaugh et al. al analizar una cohorte de parejas de gemelos detectaron una mayor cantidad de Bacteroidetes y Actinobacterias, en sujetos delgados comparados con obesos, pero sin diferencias significativas en la proporción de Firmicutes. Cabe destacar que este estudio también detectó que los sujetos obesos tenían menor diversidad en su microbiota2.
Contrariamente a la hipótesis inicial, figuran múltiples estudios opuestos a la idea de que los Firmicutes son el grupo más abundante de bacterias en el intestino de individuos con sobrepeso. Ducan et al.28 no detectaron diferencias de filos entre sujetos obesos y no obesos. Incluso, no observaron cambios significativos cuando examinaron el porcentaje de Bacteroidetes en las heces de pacientes obesos que seguían una dieta para mantener el peso o un programa de pérdida de peso. En concordancia, otro estudio29 objetivó incluso más Bacteroidetes en sujetos obesos que en individuos con normopeso y evidenció que un género de Bacteroides (i.e. Prevotella) estaban especialmente elevados en sujetos obesos. Por otro lado, se objetivó cómo estas mismas personas, después de una pérdida de peso secundaria a un by-pass gástrico, veían aumentada su proporción de gammaproteobacterias (clase de filo Proteobacteria) y disminuida la de Firmicutes. Del mismo modo, Schwiertz et al.30 y Collado et al.31 identificaron que la ratio entre Firmicutes y Bacteroidetes cambió a favor de los segundos en pacientes con sobrepeso u obesidad. La razón por la cual estos estudios no resultan tan concordantes entre ellos es debido a que presentan una metodología menos estandarizada, una población menos homogénea y un estilo de vida y de alimentación más divergentes en comparación con los modelos animales.
En conjunto, todos estos datos dan credibilidad al hecho de que la relación entre obesidad y microbiota no se deba a la proporción existente entre los grandes grupos de bacterias, sino a pequeños cambios o modulaciones más específicos dentro de cada especie32,33. Es este sentido, hay estudios que apoyan que los niveles bajos de Bifidobacterias (perteneciente a las Actinobacterias)25,30,31,34 y altos en Staphylococcus aureus (S. aureus) (del filo de los Firmicutes)31,34 están relacionados con la presencia de obesidad. Un ejemplo es el trabajo de Kalliomäki et al.34, donde se observó un mayor número de Bifidobacterium spp. en niños con un peso normal a los 7 años, respecto aquellos que empezaban a presentar sobrepeso. La relevancia de este estudio recae en que sus resultados respaldan la idea de que cambios en la composición de la microbiota podrían preceder al sobrepeso34. Paralelamente, también observaron que la cantidad de S. aureus era inferior en niños con normopeso que en aquellos que presentarían sobrepeso años más tarde. Los autores propusieron a S. aureus como un desencadenante de inflamación de bajo grado. En concordancia, Collado et al.31 observaron mayor cantidad de Bacteroides spp. y S. aureus en muestras de heces de mujeres con sobrepeso, frente a mujeres con normopeso. También encontraron una correlación positiva entre el total de Bacteroides spp. y el IMC, tanto antes como durante el embarazo. Cabe destacar una mayor presencia de bifidobacterias no solo en mujeres con peso normal en relación con las que presentaban sobrepeso, sino también en las mujeres con menor aumento de peso durante el embarazo.
¿Solo el tipo de microbiota influye en el control del peso?Recientemente se ha realizado una extensa evaluación de la relación entre el IMC y la composición taxonómica del microbioma intestinal en el conjunto de datos del Human Microbiome Project. Los resultados se compararon con los obtenidos en otro gran estudio metagenómico de la microbiota intestinal, el estudio MetaHit, juntamente con otros dos estudios más pequeños que muestrearon específicamente individuos delgados y obesos. No hubo asociación entre el IMC y la composición taxonómica o diversidad del microbioma en la cohorte del Human Microbiome Project35. Además, hallaron que la variabilidad entre estudios superaba con creces las diferencias en la composición entre individuos delgados y obesos, y concluyeron sugiriendo que no existe una firma taxonómica simple de obesidad en la microbiota intestinal. Idéntica conclusión fue alcanzada en un metaanálisis que analizaba taxones indicadores en el microbioma y características generales de la microbiota asociados a la obesidad36.
Otro punto importante a destacar es que ciertos estudios, en vez de correlacionar el tipo de microbiota presente con el riesgo de desarrollar obesidad, defienden la idea de que es la escasa diversidad de la microbiota intestinal lo que podría predisponer a un aumento de peso37–39. Este hecho, estaría estrechamente ligado a la evidencia de que la pérdida de diversidad en la microbiota intestinal de la población occidental40–42 podría influir en el aumento de las tasas de sobrepeso y obesidad en el mismo entorno.
Finalmente, cabe subrayar que, igual que en modelos animales, en el caso de los humanos también se puede concluir que una dieta hipocalórica modifica la composición de la microbiota, en general aumentando la proporción de Bacteroidetes y disminuyendo la de Firmicutes, además de acompañarse de una pérdida de peso9,43,44. Incluso un estudio realizado en adolescentes con sobrepeso muestra que cierta composición de la microbiota intestinal podría potenciar la eficacia de las intervenciones dietéticas en la pérdida de peso45.
Probióticos y obesidadEl abordaje clásico de la obesidad consiste en instaurar cambios en el estilo de vida y restringir la cirugía bariátrica para los casos más graves. El tratamiento convencional con alimentación y actividad física tiene como principal limitación su escasa eficacia, tanto a corto como a largo plazo46. Por otro lado, la cirugía bariátrica que es el tratamiento más eficaz para la obesidad, puede conseguir la remisión de las comorbilidades47,48. A pesar de ello, la cirugía no está exenta de potenciales complicaciones, por lo que aparece la necesidad de buscar nuevas estrategias terapéuticas para el control de la obesidad, coadyuvantes a la mejora del estilo de vida, como nuevos fármacos o el empleo de probióticos como tratamiento. Es en este contexto en el que se inician los primeros estudios para analizar la eficacia de los probióticos como posible vía para el control de la obesidad.
Los probióticos fueron definidos por la Food and Agriculture Organization y por la Organización Mundial de la Salud como «microorganismos vivos que proporcionan un beneficio a la salud del hospedador cuando son ingeridos en las cantidades adecuadas»49. Estos microorganismos no colonizan de forma permanente el intestino y deben mantenerse vivos a lo largo de todo el trayecto del tubo digestivo; por lo tanto, para ser considerados como buenos candidatos, una cepa bacteriana debe presentar algunas características que contribuyan a su colonización en el huésped: tolerancia al bajo pH gástrico, resistencia a las sales biliares y adhesión al epitelio del hospedador50.
Los probióticos se comunican con el huésped a través de receptores de reconocimiento de patrones de células intestinales, tales como receptores de tipo toll, y estos pueden ejercer múltiples funciones en el organismo del individuo. Los mecanismos de acción de los probióticos asociados al control de la obesidad podrían ser la modulación de las funciones de la microbiota endógena que afecta a su interacción con el huésped, la exclusión competitiva de patógenos, la mejora de la función de la barrera epitelial y otras respuestas inmunes innatas, la modulación de la absorción y excreción de grasa, la reducción de la endotoxemia y la inflamación y la modulación de numerosos genes implicados en la lipogénesis hepática o en la lipólisis de tejido adiposo51–54.
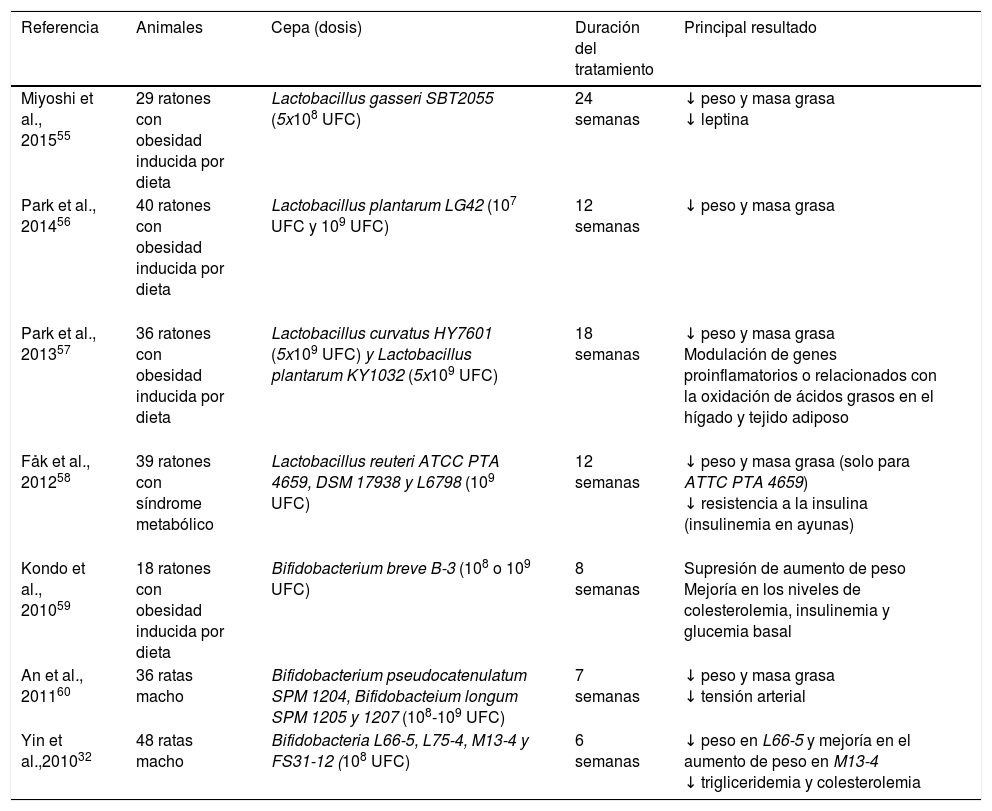
Estudios en modelos animalesExisten gran número de estudios (tabla 1) que observaron una disminución del peso y de la masa grasa en roedores que sufrían obesidad, a través de la introducción de diferentes cepas de Lactobacillus: Lactobacillus gasseri SBT2055 durante 24 semanas55, L. plantarum LG42 durante 12 semanas56, Lactobacillus curvatus HY7601 y L. plantarum KY1032 durante 18 semanas57, L. reuteri ATCC PTA 465958; entre otros11. También se notaron otros cambios metabólicos como un descenso de los niveles de leptina55, reducción de la resistencia a la insulina58 o modulación de genes proinflamatorios o relacionados con la oxidación de ácidos grasos en el hígado y tejido adiposo57.
Uso de los probióticos para el control del peso: estudios en modelos animales
| Referencia | Animales | Cepa (dosis) | Duración del tratamiento | Principal resultado |
|---|---|---|---|---|
| Miyoshi et al., 201555 | 29 ratones con obesidad inducida por dieta | Lactobacillus gasseri SBT2055 (5x108 UFC) | 24 semanas | ↓ peso y masa grasa ↓ leptina |
| Park et al., 201456 | 40 ratones con obesidad inducida por dieta | Lactobacillus plantarum LG42 (107 UFC y 109 UFC) | 12 semanas | ↓ peso y masa grasa |
| Park et al., 201357 | 36 ratones con obesidad inducida por dieta | Lactobacillus curvatus HY7601 (5x109 UFC) y Lactobacillus plantarum KY1032 (5x109 UFC) | 18 semanas | ↓ peso y masa grasa Modulación de genes proinflamatorios o relacionados con la oxidación de ácidos grasos en el hígado y tejido adiposo |
| Fåk et al., 201258 | 39 ratones con síndrome metabólico | Lactobacillus reuteri ATCC PTA 4659, DSM 17938 y L6798 (109 UFC) | 12 semanas | ↓ peso y masa grasa (solo para ATTC PTA 4659) ↓ resistencia a la insulina (insulinemia en ayunas) |
| Kondo et al., 201059 | 18 ratones con obesidad inducida por dieta | Bifidobacterium breve B-3 (108 o 109 UFC) | 8 semanas | Supresión de aumento de peso Mejoría en los niveles de colesterolemia, insulinemia y glucemia basal |
| An et al., 201160 | 36 ratas macho | Bifidobacterium pseudocatenulatum SPM 1204, Bifidobacteium longum SPM 1205 y 1207 (108-109 UFC) | 7 semanas | ↓ peso y masa grasa ↓ tensión arterial |
| Yin et al.,201032 | 48 ratas macho | Bifidobacteria L66-5, L75-4, M13-4 y FS31-12 (108 UFC) | 6 semanas | ↓ peso en L66-5 y mejoría en el aumento de peso en M13-4 ↓ trigliceridemia y colesterolemia |
UFC: unidad formadora de colonias; ↓: disminución.
Se han realizado estudios similares en modelos animales referentes al tratamiento con Bifidobacterias en la obesidad, apreciándose disminución del peso o de la masa grasa: Bifidobacterium breve B-3 durante 8 semanas59, Bifidobacterium pseudocatenulatum SPM 1204, Bifidobacterium longum SPM 1205 y 1207 durante 7 semanas60 o Bifidobacteria L66-5 durante 6 semanas32. También se registró una disminución de la colesterolemia, glucemia e insulinemia59 o disminución de la concentración de leptina o lipasa60, entre otros efectos beneficiosos.
Estudios en humanosA día de hoy, han sido pocos los estudios realizados en humanos para examinar el efecto de los probióticos en el peso corporal. En comparación con los resultados mayoritariamente favorables de los estudios en modelos animales, los trabajos con humanos presentan poca evidencia para recomendar el uso de probióticos en el tratamiento de la obesidad.
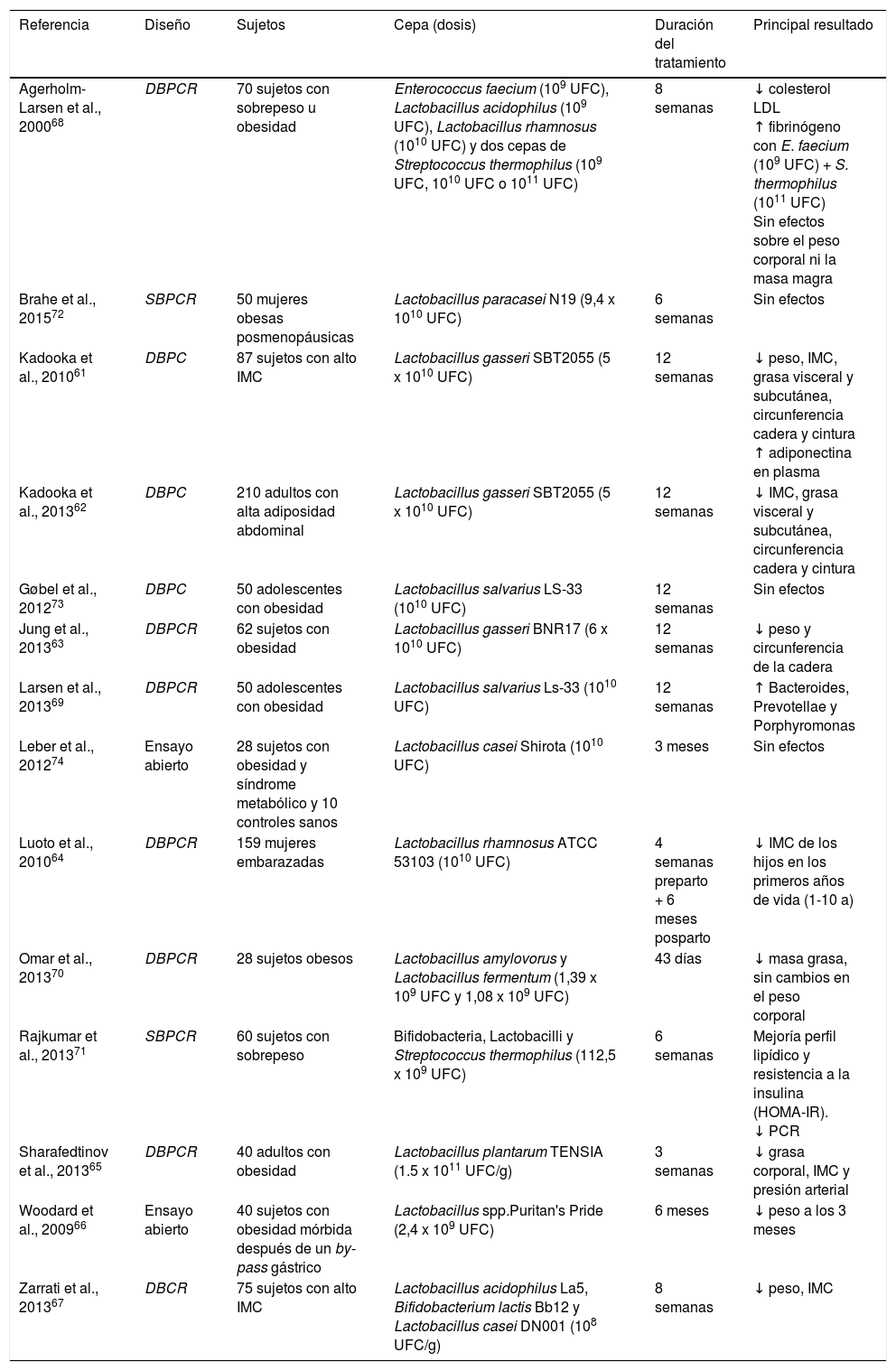
Basado en la larga tradición de uso de bacterias lácticas en humanos sin efectos nocivos para la salud, estas bacterias de los géneros Lactobacillus y Bifidobacterium tienen un historial de seguridad establecido y han recibido el estatus de GRAS (generalmente reconocido como seguro) por la Food and Drug Asministration. Por esta razón, estos dos grupos de bacterias han sido las más evaluadas (tabla 2). No todos los estudios demuestran una relación positiva entre el uso de probióticos y el control de la obesidad. Así, mientras unos relacionan la toma de diferentes cepas de bacterias (L. gasseri SBT2055, L. gasseri BNR17, Lactobacillus rhamnosus ATCC 53103, L. plantarum TENSIA, Lactobacillus spp. Puritan's Pride, Lactobacillus acidophilus La5, Bifidobacterium lactis Bb12 y L. casei DN001) con pérdida de peso61–67, otros observaron cambios metabólicos positivos sin modificación de los parámetros ponderales68–71. Por el contrario, diferentes trabajos no mostraron cambios significativos con el uso de probióticos como tratamiento para la obesidad72–74.
Uso de los probióticos para el control del peso: estudios en humanos
| Referencia | Diseño | Sujetos | Cepa (dosis) | Duración del tratamiento | Principal resultado |
|---|---|---|---|---|---|
| Agerholm-Larsen et al., 200068 | DBPCR | 70 sujetos con sobrepeso u obesidad | Enterococcus faecium (109 UFC), Lactobacillus acidophilus (109 UFC), Lactobacillus rhamnosus (1010 UFC) y dos cepas de Streptococcus thermophilus (109 UFC, 1010 UFC o 1011 UFC) | 8 semanas | ↓ colesterol LDL ↑ fibrinógeno con E. faecium (109 UFC) + S. thermophilus (1011 UFC) Sin efectos sobre el peso corporal ni la masa magra |
| Brahe et al., 201572 | SBPCR | 50 mujeres obesas posmenopáusicas | Lactobacillus paracasei N19 (9,4 x 1010 UFC) | 6 semanas | Sin efectos |
| Kadooka et al., 201061 | DBPC | 87 sujetos con alto IMC | Lactobacillus gasseri SBT2055 (5 x 1010 UFC) | 12 semanas | ↓ peso, IMC, grasa visceral y subcutánea, circunferencia cadera y cintura ↑ adiponectina en plasma |
| Kadooka et al., 201362 | DBPC | 210 adultos con alta adiposidad abdominal | Lactobacillus gasseri SBT2055 (5 x 1010 UFC) | 12 semanas | ↓ IMC, grasa visceral y subcutánea, circunferencia cadera y cintura |
| Gøbel et al., 201273 | DBPC | 50 adolescentes con obesidad | Lactobacillus salvarius LS-33 (1010 UFC) | 12 semanas | Sin efectos |
| Jung et al., 201363 | DBPCR | 62 sujetos con obesidad | Lactobacillus gasseri BNR17 (6 x 1010 UFC) | 12 semanas | ↓ peso y circunferencia de la cadera |
| Larsen et al., 201369 | DBPCR | 50 adolescentes con obesidad | Lactobacillus salvarius Ls-33 (1010 UFC) | 12 semanas | ↑ Bacteroides, Prevotellae y Porphyromonas |
| Leber et al., 201274 | Ensayo abierto | 28 sujetos con obesidad y síndrome metabólico y 10 controles sanos | Lactobacillus casei Shirota (1010 UFC) | 3 meses | Sin efectos |
| Luoto et al., 201064 | DBPCR | 159 mujeres embarazadas | Lactobacillus rhamnosus ATCC 53103 (1010 UFC) | 4 semanas preparto + 6 meses posparto | ↓ IMC de los hijos en los primeros años de vida (1-10 a) |
| Omar et al., 201370 | DBPCR | 28 sujetos obesos | Lactobacillus amylovorus y Lactobacillus fermentum (1,39 x 109 UFC y 1,08 x 109 UFC) | 43 días | ↓ masa grasa, sin cambios en el peso corporal |
| Rajkumar et al., 201371 | SBPCR | 60 sujetos con sobrepeso | Bifidobacteria, Lactobacilli y Streptococcus thermophilus (112,5 x 109 UFC) | 6 semanas | Mejoría perfil lipídico y resistencia a la insulina (HOMA-IR). ↓ PCR |
| Sharafedtinov et al., 201365 | DBPCR | 40 adultos con obesidad | Lactobacillus plantarum TENSIA (1.5 x 1011 UFC/g) | 3 semanas | ↓ grasa corporal, IMC y presión arterial |
| Woodard et al., 200966 | Ensayo abierto | 40 sujetos con obesidad mórbida después de un by-pass gástrico | Lactobacillus spp.Puritan's Pride (2,4 x 109 UFC) | 6 meses | ↓ peso a los 3 meses |
| Zarrati et al., 201367 | DBCR | 75 sujetos con alto IMC | Lactobacillus acidophilus La5, Bifidobacterium lactis Bb12 y Lactobacillus casei DN001 (108 UFC/g) | 8 semanas | ↓ peso, IMC |
DBPC: ensayo clínico randomizado doble ciego; DBPCR: ensayo clínico randomizado doble ciego con placebo; IMC: índice de masa corporal; LDL: low density lipoprotein; PCR: proteína C reactiva; SBPCR: ensayo clínico randomizado simple ciego con placebo; UFC: unidad formadora de colonias; ↓: disminución; ↑: aumento.
Los diferentes hallazgos se podrían atribuir a la diversidad metodológica de los estudios, a la baja homogeneidad de la población analizada, al tamaño muestral, a la gran disparidad de cepas estudiadas y al corto tiempo de intervención empleado.
En conclusión, los estudios realizados han confirmado la influencia de la microbiota en el metabolismo del huésped, destacando su regulación sobre la homeostasis energética y su papel patogénico. A pesar de todo, se requieren extensos estudios epidemiológicos antes de confirmar si la relación entre microbiota y obesidad se debe a la diversidad en la flora bacteriana, a la presencia de especies en concreto en el intestino, a los posibles cambios funcionales de la microbiota intestinal o a una combinación de diferentes factores.
En cuanto al papel de los probióticos como tratamiento para la obesidad, las evidencias disponibles son controvertidas, por lo que son necesarios estudios adicionales para poder valorar el uso terapéutico de probióticos en el tratamiento de la obesidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.