La interacción del factor inductor débil de apoptosis similar al factor de necrosis tumoral (TWEAK) con su receptor Fn14 acelera el desarrollo de la lesión aterosclerótica en ratones deficientes en ApoE (ApoE KO). En este trabajo hemos analizado el efecto de un inhibidor de la HMG-CoA reductasa, la atorvastatina, sobre el desarrollo de la lesión aterosclerótica acelerada por TWEAK en ratones ApoE KO.
Materiales y métodosSe alimentaron ratones ApoE KO de 8 semanas de edad durante 4 semanas con una dieta hiperlipidémica y se aleatorizaron en 3 grupos: ratones tratados i.p. con salino (control), tratados con TWEAK recombinante (10μg/kg/2 veces a la semana) o tratados con TWEAK recombinante más atorvastatina (1mg/kg/día) durante 4 semanas más. Se analizó el tamaño, la composición celular, la respuesta inflamatoria y la expresión de Fn14 en las lesiones ateroscleróticas presentes en la raíz aórtica de los ratones.
ResultadosLa inyección sistémica de TWEAK aumentó el tamaño de la lesión y el cociente colágeno/lípidos así como la respuesta inflamatoria asociada a un aumento en la actividad de NF-κB, expresión de MCP-1 y RANTES y a una mayor presencia de macrófagos en las placas ateroscleróticas de ratones ApoE KO. El tratamiento con atorvastatina fue capaz de prevenir los cambios inducidos por TWEAK en las lesiones ateroscleróticas. Finalmente, el tratamiento con atorvastatina disminuyó la expresión de Fn14 en las lesiones ateroscleróticas de ratones ApoE KO.
ConclusionesLa atorvastatina previene los efectos proaterogénicos inducidos por TWEAK en el ratón ApoE KO, efecto relacionado con la inhibición de la expresión de Fn14. Estos resultados aportan nueva información sobre los efectos beneficiosos de las estatinas en el tratamiento de las enfermedades cardiovasculares.
Interaction of tumor necrosis factor-like weak inducer of apoptosis (TWEAK) with its receptor Fn14 accelerates atherosclerotic plaque development in ApoE deficient mice (ApoE KO). In this work, an analysis has been made on the effect of an HMG-CoA reductase inhibitor, atorvastatin, on atherosclerotic plaque development accelerated by TWEAK in ApoE KO mice.
Materials and methodsEight week-old ApoE KO mice were fed with a high cholesterol diet for 4 weeks. The animals were then randomized into 3 groups: mice injected i.p. with saline, recombinant TWEAK (10μg/kg/twice a week), or recombinant TWEAK plus atorvastatin (1mg/kg/day) for 4 weeks. The lesion size, cellular composition, lipid and collagen content were analyzed, as well as inflammatory response in atherosclerotic plaques present in aortic root of mice.
ResultsTWEAK treated mice showed an increase in atherosclerotic plaque size, as well as in collagen/lipid ratio compared with control mice. In addition, macrophage content, MCP-1 and RANTES expression, and NF-κB activation were augmented in atherosclerotic plaques present in aortic root of TWEAK treated mice compared with control mice. Treatment with atorvastatin prevented all these changes induced by TWEAK in atherosclerotic lesions. Atorvastatin treatment also decreased Fn14 expression in the atherosclerotic plaques of ApoE KO mice.
ConclusionsAtorvastatin prevents the pro-atherogenic effects induced by TWEAK in ApoE KO mice, which could be related to the inhibition of Fn14 expression. The results of this study provide new information on the beneficial effects of statin treatment in cardiovascular diseases.
La aterosclerosis se define actualmente como una enfermedad inflamatoria dado que los principales componentes de la respuesta inflamatoria crónica están presentes durante el desarrollo de la placa de ateroma: reclutamiento celular, proliferación, neovascularización y esclerosis1. Las lesiones vasculares son causadas por una respuesta inflamatoria y fibroproliferativa en respuesta al daño. La interacción entre los ligandos de la superfamilia del factor de necrosis tumoral y sus receptores da lugar a diferentes respuestas biológicas que participan en el desarrollo de la lesión aterosclerótica. Entre otras, los miembros de la superfamilia del factor de necrosis tumoral incrementan la expresión de moléculas de adhesión, citocinas proinflamatorias, metaloproteinasas de matriz y factor tisular, los cuales favorecen la desestabilización de la placa aterosclerótica. En este sentido, el factor inductor débil de apoptosis similar al factor de necrosis tumoral (TWEAK) es una citocina proinflamatoria perteneciente a esta superfamilia que, a través de su único receptor funcional Fn14, está implicado en numerosos procesos fisiológicos y patológicos dependiendo del tipo celular y del ambiente2. Dentro de la vasculatura, TWEAK se expresa en la pared arterial sana3,4 mientras que la expresión de Fn14 es prácticamente ausente4. Sin embargo, tanto TWEAK como Fn14 se expresan abundantemente en la lesión aterosclerótica humana colocalizando con células de músculo liso vascular (CML) y macrófagos4. El eje TWEAK/Fn14 está implicado en diferentes procesos asociados al desarrollo y progresión de la lesión vascular como la inflamación5, proliferación y migración de CML6, trombosis7 y angiogénesis6,7. En este sentido, se ha demostrado que la inyección sistémica y aguda (9 días) de TWEAK en ratones deficientes en la apolipoproteína E (ApoE KO) acelera el desarrollo de la lesión aterosclerótica8. Además, la inhibición de Fn14 mediante el empleo de una proteína de fusión Fn14-Fc reduce el tamaño de la lesión aterosclerótica en el ratón ApoE KO9. Finalmente, la deleción génica o el tratamiento con un anticuerpo bloqueante anti-TWEAK reduce la respuesta inflamatoria así como el tamaño de las lesiones y la carga aterosclerótica en ratones ApoE KO, además de alterar la composición morfológica de la placa hacia un fenotipo más estable10.
Por otro lado, se ha demostrado que el tratamiento con inhibidores de la hidroxi-metil-glutaril CoA (HMG-CoA) reductasa o estatinas reduce el riesgo de sufrir un evento cardiovascular11. Aunque los efectos beneficiosos de estos fármacos se relacionan con su acción hipolipidemiante, distintas líneas de evidencia han sugerido la existencia de diversos efectos beneficiosos sobre la pared vascular más allá de la reducción lipídica observada tras su uso12.Hemos demostrado que el tratamiento con atorvastatina disminuye la expresión de Fn14 en CML humanas en cultivo3. Sin embargo, el efecto de las estatinas sobre los efectos proaterogénicos de la interacción TWEAK/Fn14 in vivo se desconoce. En este trabajo hemos analizado el efecto de un inhibidor de la HMG-CoA reductasa, la atorvastatina, sobre el desarrollo, la morfología y la respuesta inflamatoria acelerada por TWEAK en la lesión aterosclerótica de ratones ApoE KO.
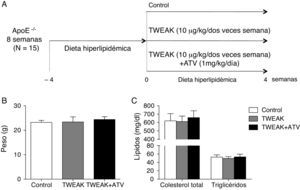
Materiales y métodosModelo animalQuince ratones machos ApoE KO (Jackson Laboratories) de 8 semanas de edad se alimentaron con una dieta hiperlipidémica (21,2% grasa [0,15% colesterol]+16,7% proteínas) durante 4 semanas. Los animales se aleatorizaron en 3 grupos: ratones tratados i.p. con salino (control; n=5), tratados con TWEAK recombinante (rTWEAK) (10μg/kg/2 veces a la semana; n=5) o tratados con rTWEAK más atorvastatina (1mg/kg/día; n=5) durante 4 semanas más (fig. 1A). La dosis de TWEAK se eligió basándonos en estudios in vivo previos8. En el momento del sacrificio, todos los animales se anestesiaron con ketamina (100mg/kg) y xilacina (15mg/kg) y se tomaron muestras de sangre a partir del plexo orbital, tras lo cual se expuso la cavidad abdominal y se canuló el corazón por el ventrículo izquierdo para la perfusión con suero salino. Posteriormente se extirpó la aorta y se incluyó la región cercana al corazón en Tissu-tek OCT (Sakura) para su posterior estudio histológico. El estudio se realizó siguiendo las directrices de la Unión Europea y fue aprobado por el comité ético del IIS-FJD.
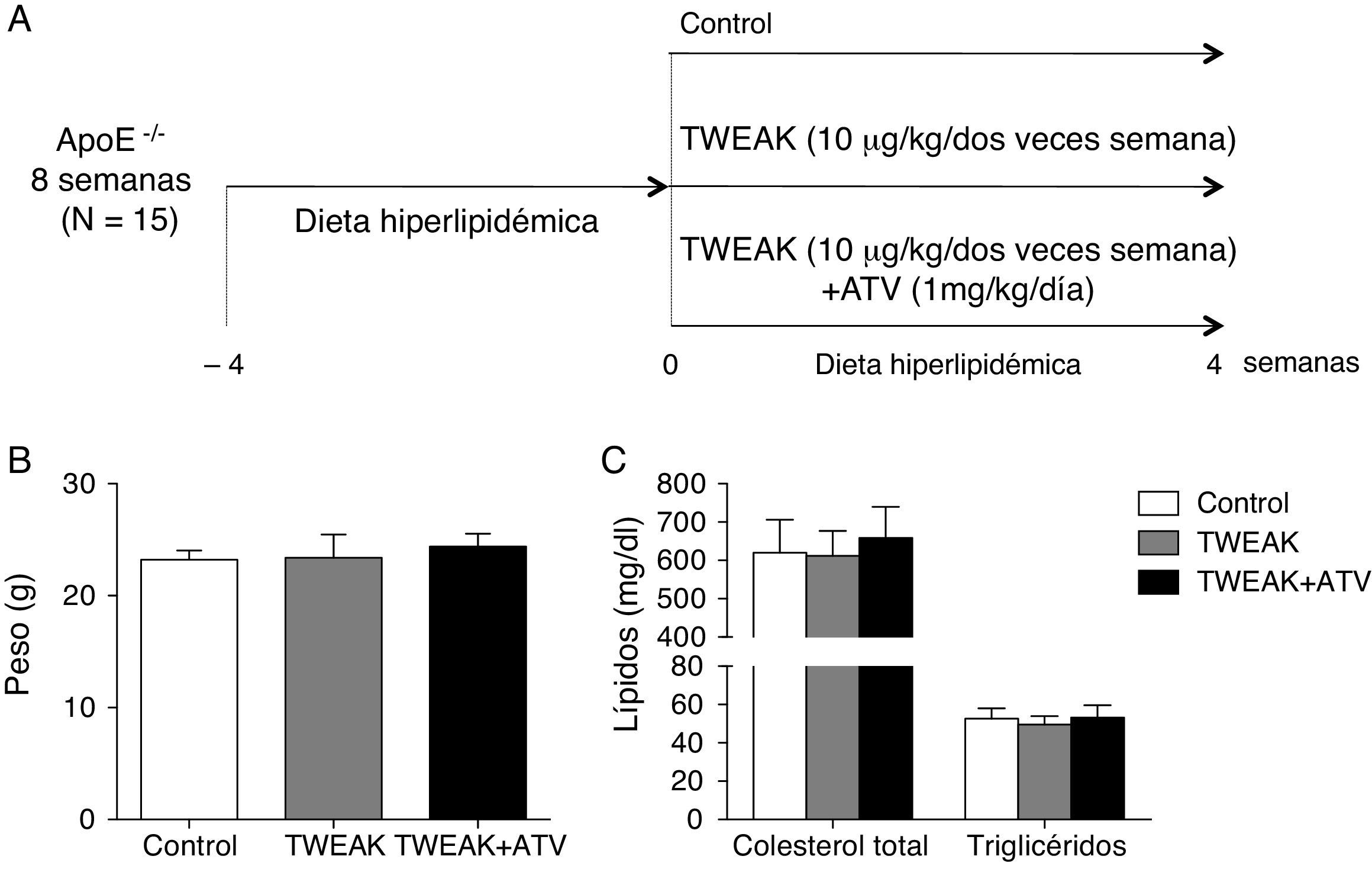
La administración de atorvastatina y/o TWEAK no modifica los parámetros metabólicos en el ratón. A) Representación esquemática del modelo experimental. B y C) Cuantificación del peso y niveles de colesterol y triglicéridos en los diferentes grupos de animales incluidos en el estudio.
Los niveles séricos de colesterol y de triglicéridos se midieron con kits de Thermo Trance y Abcam, respectivamente.
Análisis morfométrico del seno aórticoSe diseccionó la parte superior del corazón y se congeló en OCT. Las válvulas aórticas se cortaron en secciones de 5micras empezando por la sección del corazón en donde se observa por primera vez la presencia de las válvulas en el sitio de unión a la aorta. Los cortes resultantes se tiñeron con Oil Red-O (Sigma-Aldrich) y hematoxilina (Dako) a intervalos de 100micras desde el punto cero hasta llegar a las 1.000micras del punto de inicio. Se calculó el área de máxima lesión de cada ratón a partir de la media de los 3 cortes con mayor lesión, y las áreas de máxima lesión individual se promediaron para determinar el área de máxima lesión para cada grupo. Para evaluar la cantidad de colágeno presente en las placas, los senos aórticos se tiñeron con Sirius Red (Sigma-Aldrich) y medimos la birrefringencia a la luz polarizada.
Análisis inmunohistoquímicoLas muestras incluidas en OCT se fijaron con acetona fría durante 10min. La actividad de la peroxidasa endógena se inhibió sumergiendo los cortes en peróxido de hidrógeno al 3% en metanol-agua (1:1) durante 30min y posteriormente se incubaron con PBS al 6% de albúmina de suero bovino durante 1h a temperatura ambiente para bloquear las uniones inespecíficas. Los anticuerpos primarios se incubaron durante toda la noche a 4°C. Los anticuerpos primarios fueron: el marcador de macrófagos CD68 (Abcam), el marcador de músculo liso α-actina (Clone 1A4; Sigma), las citocinas MCP-1 (sc-1785; Santa Cruz Biotechnology) y RANTES (AB2109P, Chemicon) y anti-Fn14 (4403, Cell Signaling Technology).
Los anticuerpos secundarios biotinilados correspondientes se aplicaron durante 1h a temperatura ambiente a una dilución 1:200 en PBS al 6% albúmina de suero bovino. Después se incubaron las muestras con el complejo ABComplex/HRP (Vector Laboratories) durante 30min. La localización del anticuerpo se determinó mediante la adición del cromógeno diaminobenzidina (DAB) (Dako) durante 3-10min. Por último, se aplicó a las secciones una tinción de fondo con hematoxilina (Dako). Los cortes se montaron directamente con gelatina glicerilada Kaiser (Merck). En cada experimento se realizaron controles negativos con una IgG inespecífica.
Análisis morfométrico de las inmunohistoquímicasLos análisis morfométricos asistidos por ordenador se realizaron con el software Image-Pro Plus (versión 1.0 para Windows). El umbral para la medición del área teñida fue el mismo para todas las imágenes. Las muestras de cada ratón se examinaron de forma ciega. Los resultados de lípidos, colágeno, MCP-1, RANTES, CD68 y α-actina se expresaron como porcentaje de área positiva respecto al área total.
SouthWesternEsta técnica se desarrolló para detectar in situ la activación de factores de transcripción13. En primer lugar se marcó con digoxigenina un oligonucleótido consenso para NFκB procedente del promotor de RANTES(5′-AGTTGAGGGGACTTTCCCAGGC-3’) (Promega) mediante el empleo de una transferasa 3′-terminal (Roche). Las secciones de tejido incluidas en OCT se fijaron en paraformaldehído al 0,5% y después se trataron secuencialmente con 5mM de levamisol en PBS y 0,1mg/mL de DNAsa I (Roche). La unión al ADN se realizó mediante la incubación con 50pmol de sonda de ADN marcada en un buffer con 0,25% de albúmina de suero bovino y 1g/ml de poly (dl-dC). Posteriormente las secciones se incubaron con un anticuerpo antidigoxigenina conjugado con fosfatasa alcalina y el sustrato NBT/BCIP (Roche). La detección colorimétrica se realizó según el protocolo. Como control negativo se utilizaron secciones incubadas sin sonda y se utilizó un exceso de sonda sin marcar para testar la especificad de la técnica. Los resultados se expresan como el porcentaje del área positiva vs. el área total.
Análisis estadísticoEl análisis estadístico se realizó usando el software estadístico SPSS 11.0. Los datos se expresan como la media±el error estándar de la media (EEM). Las diferencias entre grupos se determinaron usando un test de Mann-Whitney. Se estableció un valor máximo de probabilidad del 0,05 para ser estadísticamente significativo.
ResultadosLa atorvastatina previene el aumento del tamaño de la lesión y la disminución del cociente colágeno/lípidos en ratones ApoE KO tratados con TWEAK
Previamente, nuestro grupo ha demostrado que la inyección sistémica de TWEAK es capaz de aumentar el tamaño de la lesión aterosclerótica presente en la raíz aórtica de ratones ApoE KO. Para determinar si el tratamiento con un inhibidor de la HMG-CoA reductasa, la atorvastatina, es capaz de modular este efecto de TWEAK, ratones ApoE KO de 8 semanas de edad se alimentaron con una dieta hiperlipidémica durante 4 semanas y se aleatorizaron en 3 grupos: ratones tratados con salino, rTWEAK (10μg/kg/2 veces a la semana) y tratados con rTWEAK más atorvastatina (1mg/kg/día) durante 4 semanas (fig. 1A). No se observaron diferencias significativas en el peso o en los niveles de lípidos circulantes al final del estudio entre ninguno de los grupos analizados (fig. 1B-C).
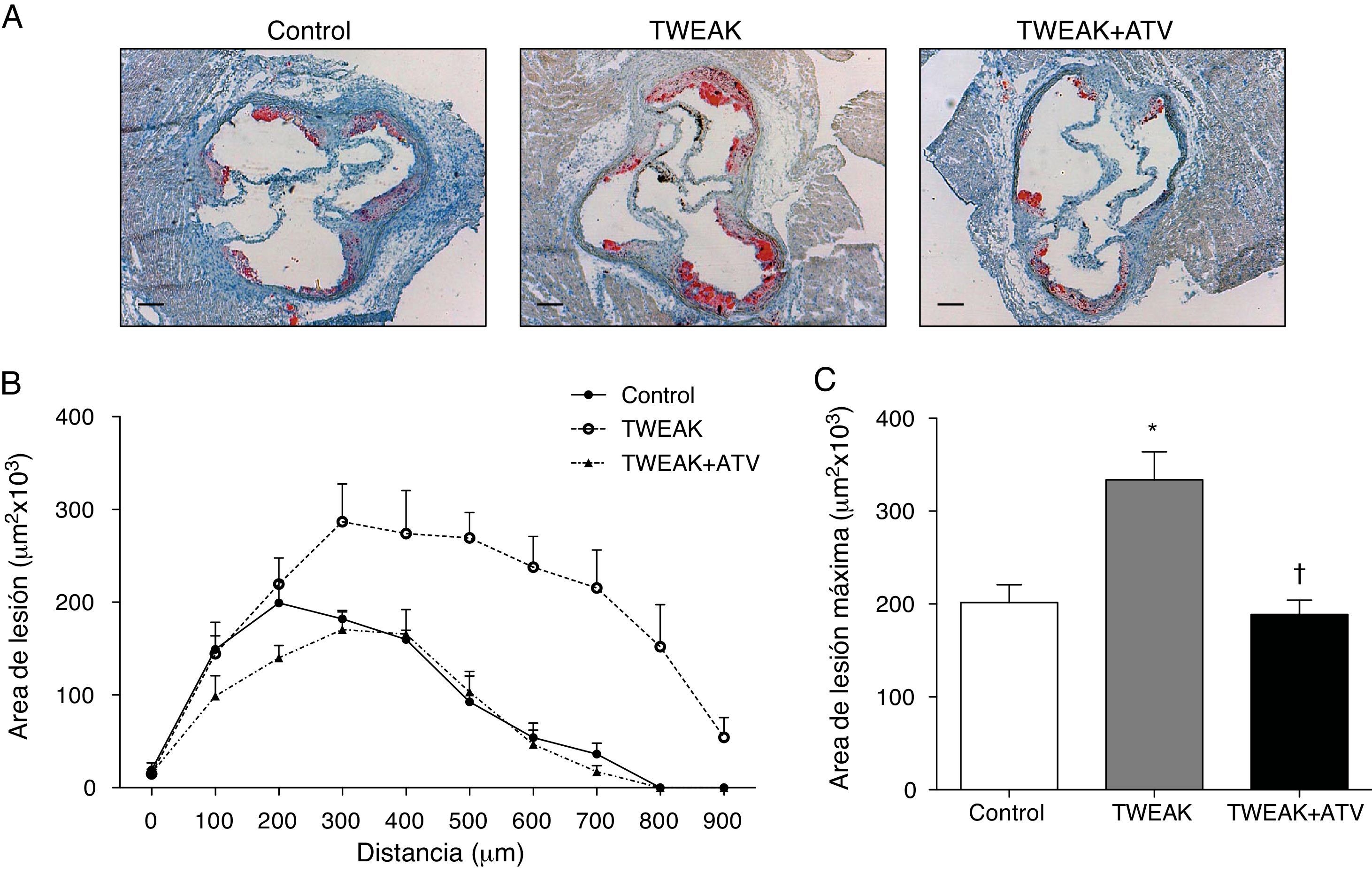
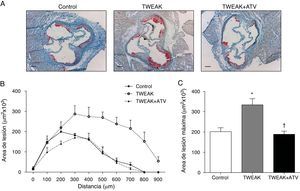
Los animales tratados con rTWEAK presentaron un aumento en el tamaño de las lesiones ateroscleróticas presentes en el seno aórtico comparado con los animales control (334×103μm2vs. 202×103μm2; respectivamente; p<0,01) (fig. 2A-C). Por el contrario, el tratamiento con atorvastatina disminuyó significativamente el tamaño de las lesiones ateroscleróticas en comparación con los ratones tratados con rTWEAK (189×103μm2vs. 334×103μm2; respectivamente; p<0,01) (fig. 2A-C).
La atorvastatina disminuye la progresión de la lesión aterosclerótica acelerada por TWEAK en ratones deficientes para ApoE. A) Imágenes representativas del seno aórtico teñido con Oil Red y hematoxilina, y B) cuantificación del área de la lesión a lo largo de la raíz aórtica de ratones control o tratados con atorvastatina y/o TWEAK durante 4 semanas. Los valores representan la media±EEM de todos los animales incluidos en cada grupo. Escala, 200μm. C) Área de la lesión máxima presente en la raíz aórtica de ratones control o tratados con atorvastatina y/o TWEAK durante 4 semanas. Los valores representan la media±EEM de todos los animales incluidos en cada grupo. * p<0,01 vs. control; ** p<0,01 vs. TWEAK.
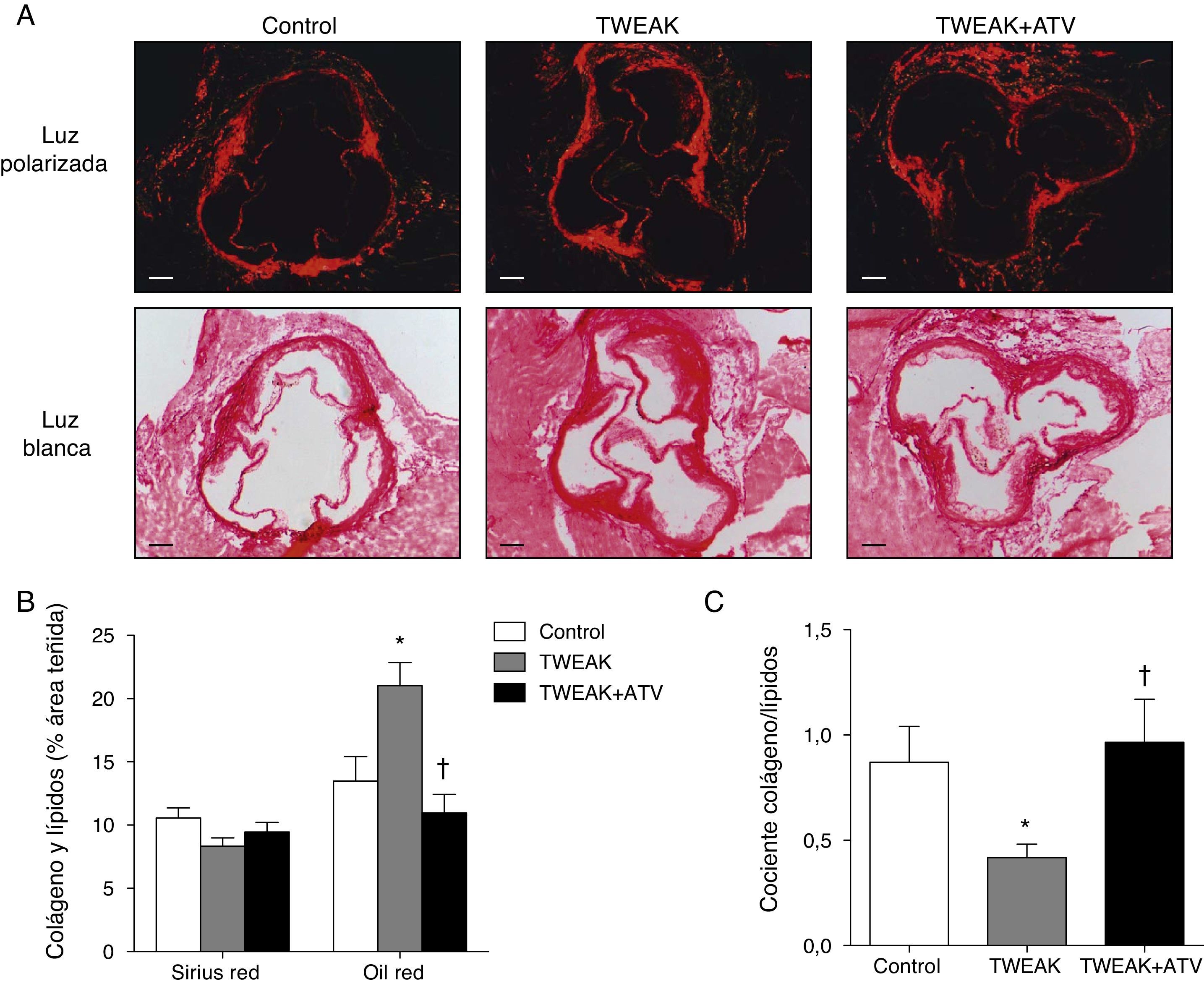
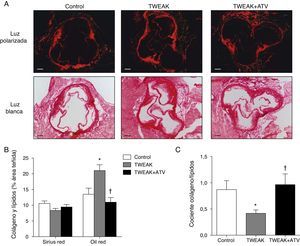
Mientras los depósitos lipídicos hacen que la placa aterosclerótica sea más propensa a la rotura, las fibras de colágeno la estabilizan14. Por este motivo, hemos analizado el contenido de lípidos y de colágeno mediante la tinción de Oil red y de Sirius red, respectivamente. Los animales tratados con rTWEAK presentaron un aumento del 56% en la cantidad de lípidos presentes en las lesiones ateroscleróticas de la raíz aórtica en comparación con los animales control (p<0,05; fig. 2A, 3B). No se observaron cambios en el contenido de colágeno entre los ratones tratados con rTWEAK y los controles (fig. 3A-B). Como consecuencia, el cociente colágeno/lípidos, un marcador de estabilidad de la lesión aterosclerótica, disminuyó en los ratones tratados con rTWEAK respecto a los controles (p<0,05; fig. 3C). Sin embargo, los ratones tratados con rTWEAK y atorvastatina presentaron una reducción del 48% en el contenido de lípidos presente en las lesiones ateroscleróticas comparados con los tratados únicamente con rTWEAK (p<0,05; fig. 3B). No se observaron cambios en el contenido de colágeno entre los ratones tratados con rTWEAK y atorvastatina y los tratados únicamente con rTWEAK (fig. 3A-B). Como consecuencia, el cociente colágeno/lípidos aumentó en los ratones tratados con rTWEAK y atorvastatina respecto a los tratados solo con rTWEAK (p<0,05; fig. 3C). No se observaron diferencias entre los ratones tratados con atorvastatina y los controles en ninguno de los diferentes parámetros analizados (fig. 3B-C).
La atorvastatina disminuye el contenido lipídico en la lesión aterosclerótica inducida por TWEAK en ratones deficientes para ApoE. A) Imágenes representativas y B) cuantificación del contenido de colágeno (Sirius Red) y de lípidos (Oil Red-O) en las lesiones del seno aórtico de ratones control o tratados con atorvastatina y/o TWEAK durante 4 semanas. Los valores representan la media±EEM de todos los animales incluidos en cada grupo. * p<0,05 vs. control; ** p<0,01 vs. TWEAK. Escala, 200μm. C) La estabilidad de la placa se analizó mediante el cociente colágeno/lípidos en cada grupo de animales. * p<0,05 vs. control; ** p<0,05 vs TWEAK.
La atorvastatina previene el incremento del infiltrado de macrófagos en la lesión aterosclerótica de ratones ApoE KO tratados con TWEAK
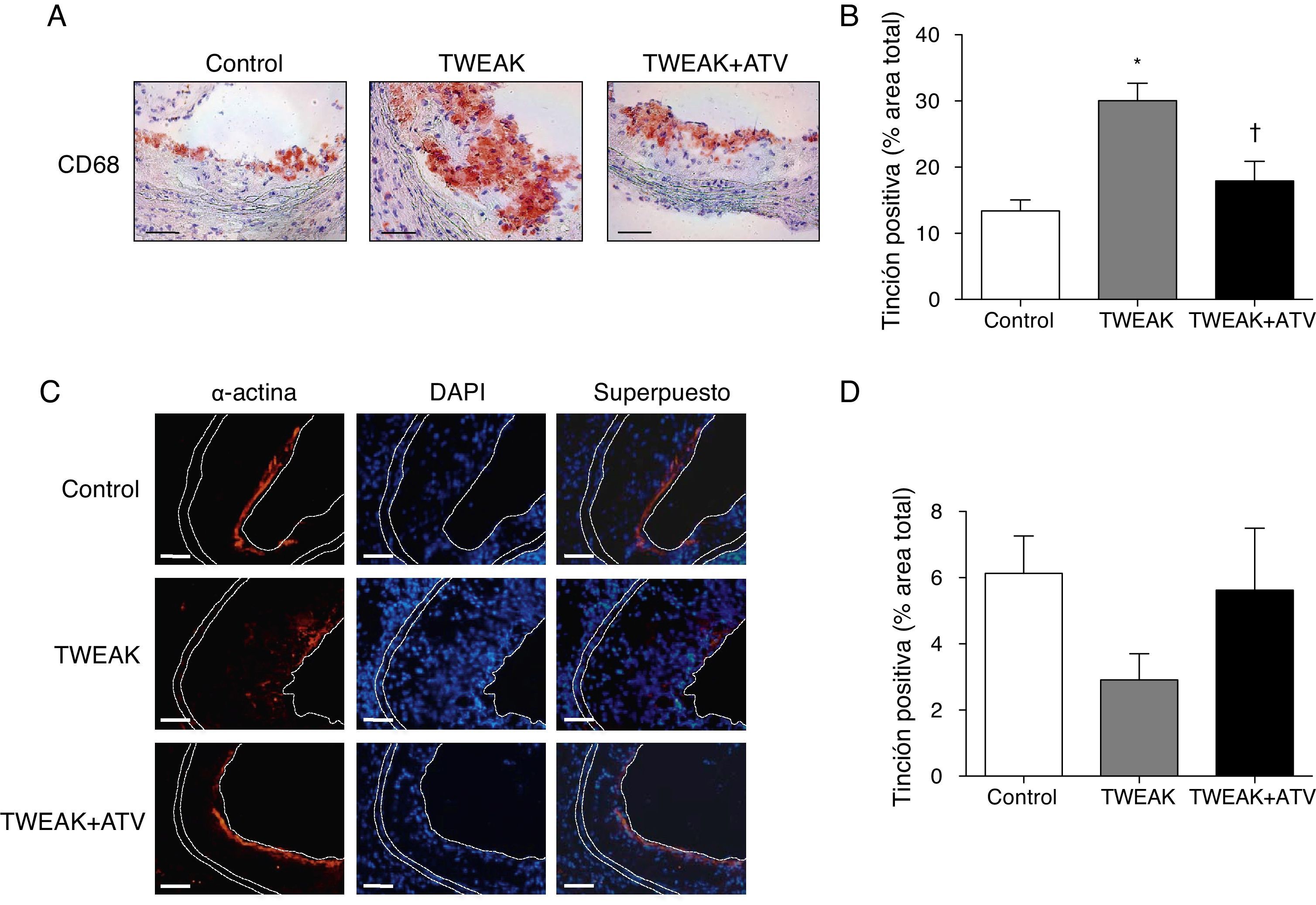
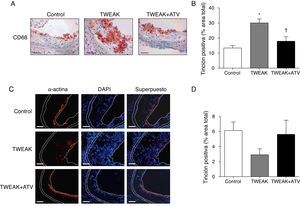
La inflamación tiene un gran impacto en la vulnerabilidad de la placa de ateroma15. Por este motivo, hemos analizado el grado de inflamación, representado como el contenido de macrófagos, en las lesiones ateroscleróticas presentes en la raíz aórtica de los ratones ApoE KO tratados con rTWEAK solo o en combinación con atorvastatina. Los ratones tratados con rTWEAK presentaron un incremento del 125% en el infiltrado macrofagocitario en las lesiones ateroscleróticas del seno aórtico en comparación con los ratones control (p<0,01; fig. 4A). Además, se observó un 53% de reducción en el contenido de CML en los ratones tratados con rTWEAK con respecto a los controles, aunque no se llegó a la significación estadística (fig. 4B). Sin embargo, los ratones tratados con rTWEAK y atorvastatina mostraron una reducción del 40% en el contenido de macrófagos presente en las lesiones ateroscleróticas comparados con los tratados únicamente con rTWEAK (p<0,05; fig. 4A). Además, el contenido de CML aumentó un 93% en los ratones tratados con atorvastatina en comparación con los tratados únicamente con rTWEAK (fig. 4B), aunque esta diferencia no fue significativa. Como consecuencia, el cociente CML/macrófagos disminuyó en los ratones tratados con rTWEAK (p<0,01 vs. control; no mostrado) y aumentó en las lesiones de los animales tratados con atorvastatina (p<0,05 vs. rTWEAK; no mostrado), indicando la existencia de un fenotipo más estable en las placas ateroscleróticas de estos ratones.
La atorvastatina disminuye la presencia de macrófagos en la lesión aterosclerótica inducida por TWEAK en ratones deficientes para ApoE. Imágenes representativas de inmunohistoquímicas frente a CD68 (macrófagos; A) y α-actina (céls. músculo liso vascular; C) y B-D) cuantificación en las lesiones del seno aórtico en ratones control o tratados con atorvastatina y/o TWEAK durante 4 semanas. Escala, 50μm para CD68 y 100μm para α-actina. Los valores representan la media±EEM de todos los animales incluidos en cada grupo. * p<0,01 vs. control; ** p<0,01 vs. TWEAK.
La atorvastatina previene el incremento de la respuesta proinflamatoria en la lesión aterosclerótica de ratones ApoE KO tratados con TWEAK
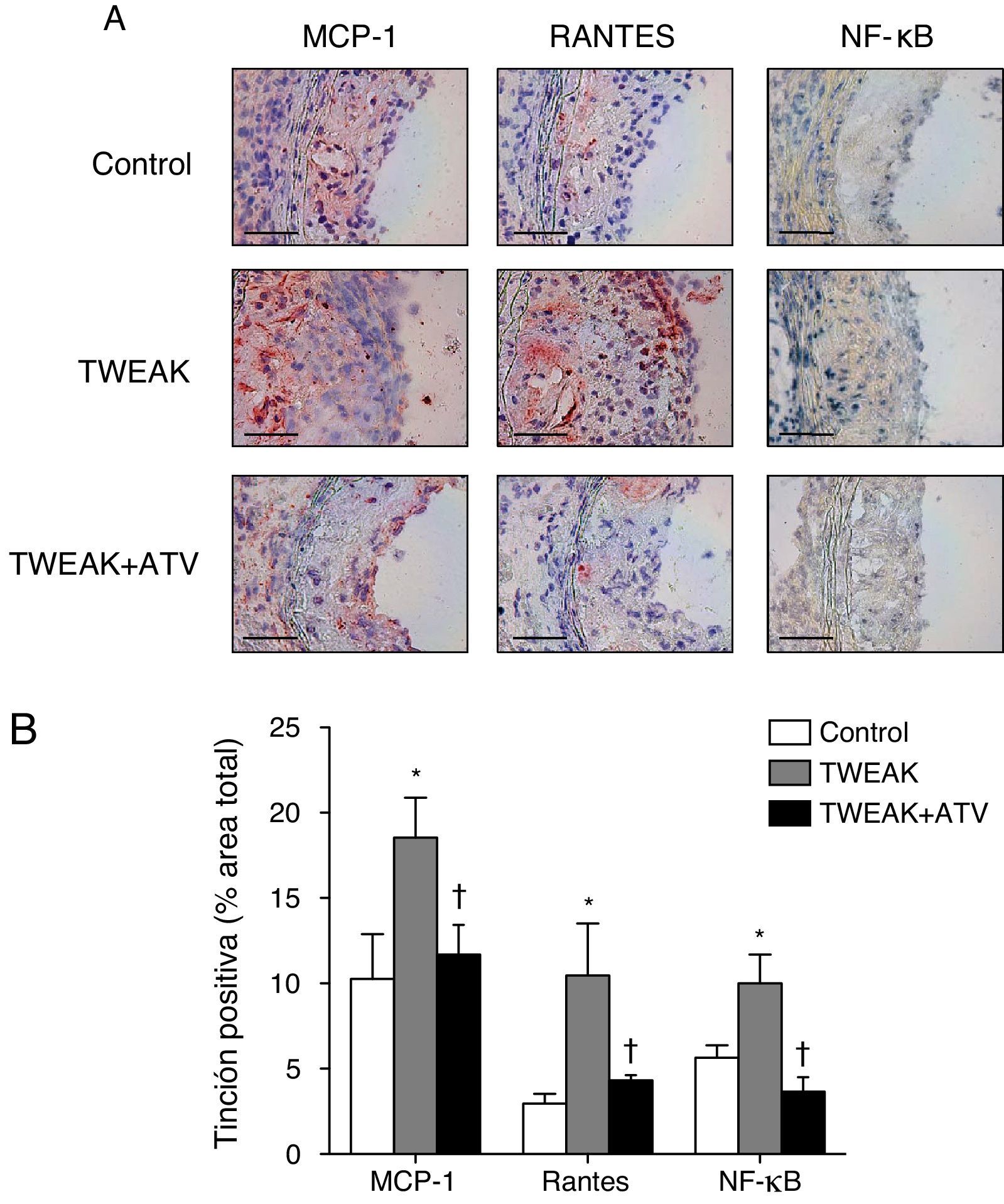
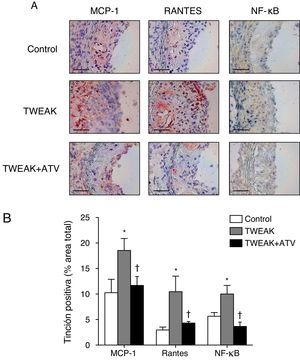
Para determinar los posibles mecanismos por los cuales TWEAK incrementa el contenido de macrófagos en las lesiones ateroscleróticas, hemos analizado la expresión de 2 citocinas que desempeñan un papel principal en la respuesta proinflamatoria asociada a la progresión de la placa aterosclerótica, MCP-1 y RANTES16,17. La expresión de estas 2 citocinas está regulada por el factor de transcripción NF-κB, un factor de transcripción clave en la activación de la respuesta inflamatoria20. El tratamiento con rTWEAK aumentó tanto la actividad de NF-κB como la expresión de MCP-1 y RANTES en las lesiones ateroscleróticas del seno aórtico en comparación con los ratones control (fig. 5A-B). Sin embargo, los ratones tratados con rTWEAK y atorvastatina presentaron una reducción tanto de la actividad de NF-κB como de la expresión de MCP-1 y RANTES en las lesiones ateroscleróticas del seno aórtico comparado con los tratados únicamente con rTWEAK (fig. 5A-B). Estos resultados indican que la atorvastatina inhibe la respuesta inflamatoria inducida por TWEAK en ratones deficientes en ApoE.
La atorvastatina reduce la respuesta inflamatoria inducida por TWEAK en las placas ateroscleróticas presentes en ratones deficientes para ApoE. A) Imágenes representativas y B) cuantificación de MCP-1, RANTES y NF-κB en las lesiones del seno aórtico procedente de ratones control o tratados con atorvastatina y/o TWEAK durante 4 semanas. Escala, 50μm. Los valores representan la media±EEM de todos los animales incluidos en cada grupo. * p<0,01 vs. control; ** p<0,05 vs. TWEAK.
La atorvastatina inhibe la expresión de Fn14 en la lesión aterosclerótica de ratones ApoE KO
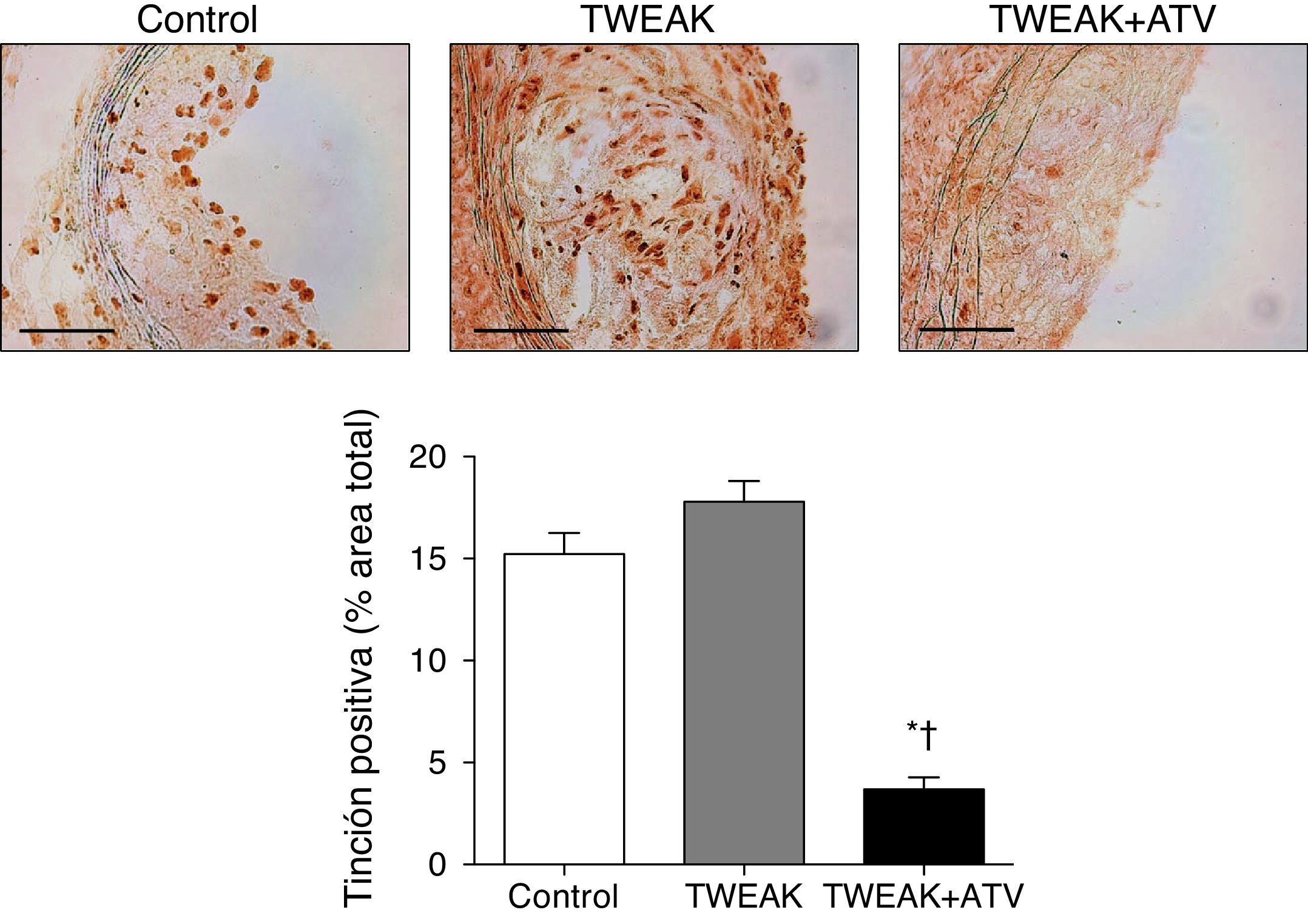
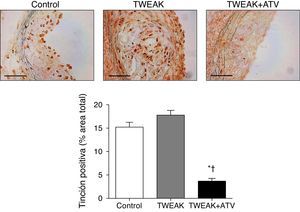
Previamente hemos demostrado que el tratamiento con atorvastatina disminuye la expresión de Fn14 inducida por citocinas proinflamatorias en CML en cultivo3. Para confirmar este efecto in vivo, hemos analizado la expresión de Fn14 en los diferentes grupos incluidos en el estudio. Como se observa en la figura 6, Fn14 se expresa de una manera similar en las lesiones ateroscleróticas presentes en los ratones control y en los tratados con rTWEAK. El tratamiento con atorvastatina disminuyó significativamente la expresión de Fn14 en las lesiones ateroscleróticas presentes en la raíz aórtica en comparación con ratones control o tratados con rTWEAK (p<0,001 para ambos; fig. 6). Estos resultados podrían indicar que el efecto beneficioso observado tras el tratamiento con atorvastatina se debe, al menos en parte, a la reducción de la respuesta inflamatoria inducida por la interacción entre TWEAK y su receptor funcional Fn14.
La atorvastatina disminuye la expresión de Fn14 en las placas ateroscleróticas presentes en ratones deficientes para ApoE. A) Imágenes representativas y B) cuantificación de la expresión de Fn14 en las lesiones del seno aórtico procedente de ratones control o tratados con atorvastatina y/o TWEAK durante 4 semanas. Escala, 50μm. Los valores representan la media±EEM de todos los animales incluidos en cada grupo. * p<0,01 vs. control; ** p<0,05 vs. TWEAK.
Diferentes estudios han demostrado que el uso de estatinas es beneficioso tanto en prevención primaria como secundaria para el tratamiento de enfermedad coronaria11,18,19. En los últimos años se han mostrado diferentes efectos de las estatinas independientes de la disminución en los niveles circulantes de LDL12,20. Así, estudios recientes indican que algunos de los llamados efectos pleiotrópicos de las estatinas implican la mejora de la función endotelial, el aumento de la estabilidad de la lesión aterosclerótica, la disminución del estrés oxidativo así como la disminución de la respuesta inflamatoria y protrombótica21.
En este trabajo describimos un nuevo efecto de la atorvastatina, la inhibición de la progresión de la lesion aterosclerótica inducida por TWEAK en ratones ApoE KO. Hemos demostrado cómo la administración sistémica de TWEAK da lugar a un desarrollo acelerado de la placa aterosclerótica, aumentando la respuesta inflamatoria y dando lugar a un cambio en la estructura morfológica de la lesión hacia un fenotipo más inestable. El tratamiento con atorvastatina fue capaz de revertir los efectos proaterogénicos de TWEAK. La presencia de macrófagos, la expresión de citocinas proinflamatorias y la activación del factor de transcripción NF-κB disminuyó tras el tratamiento con atorvastina. Asimismo, el contenido de lípidos y el tamaño de las lesiones presentes en la raíz aórtica fueron menores en los animales tratados con la estatina.
De acuerdo con estudios previos en los que la inyección sistémica y aguda de TWEAK incrementó y el tratamiento con una proteína de fusión Fn14-Fc disminuyó el tamaño de la lesión aterosclerótica en ratones ApoE KO8–9, hemos observado cómo el tratamiento prologando con rTWEAK aumentó el tamaño de la lesión vascular. Sin embargo, la composición de la lesión aterosclerótica es más importante que el grado de estenosis a la hora de determinar su posible rotura y el consiguiente evento isquémico22. Las placas inestables exhiben una sustancial pérdida de CML y colágeno y son ricas en células inflamatorias23. El tratamiento con rTWEAK provocó un cambio en la composición celular de las placas ateroscleróticas. Así, la presencia de macrófagos aumentó y se observó una tendencia hacia la disminución en el porcentaje de CML en los ratones tratados con rTWEAK comparado con los controles. Atorvastatina fue capaz de revertir este efecto, disminuyendo el contenido de macrófagos y aumentando el de CML. El mecanismo por el cual TWEAK aumenta el contenido de macrófagos está relacionado con su capacidad de aumentar la expresión de diferentes citocinas proinflamatorias en macrófagos y CML en cultivo incluyendo MCP-1, IL-6, IL-8 y RANTES8,24. La expresión de estas citocinas está bajo el control transcripcional de NF-κB25. Hemos observado que el tratamiento prolongado con rTWEAK es capaz de aumentar la actividad de NF-κB y la expresión de citocinas proinflamatorias como MCP-1 y RANTES en las lesiones ateroscleróticas del ratón ApoE KO. Asimismo, atorvastatina fue capaz de disminuir tanto la expresión de citocinas como la actividad de NF-κB, revirtiendo el fenotipo proinflamatorio inducido por rTWEAK. De hecho, se ha demostrado que la atorvastatina disminuye la activación de NF-κB inducida por moléculas proinflamatorias en CML en cultivo, efecto relacionado con la capacidad de inhibir a la IKK, cinasa de la subunidad inhibitoria κB, responsable de la activación de NF-κB26.
La mayor presencia de macrófagos en las placas tratadas con TWEAK debe estar relacionada con el aumento en la cantidad de lípidos que se observan en las lesiones ateroscleróticas. Así, se ha demostrado que TWEAK aumenta la absorción de lípidos por macrófagos in vitro9. Como consecuencia del aumento de lípidos observado en los ratones tratados con rTWEAK, el cociente colágeno/lípidos, un marcador de inestabilidad de la placa aterosclerótica, disminuyó, lo que indica que TWEAK no solo es capaz de modificar la composición de la placa de ateroma sino que además la hace más propensa a la rotura. De nuevo, el tratamiento con atorvastatina fue capaz de disminuir el aumento de lípidos en las lesiones ateroscleróticas y, como consecuencia, aumentar el cociente colágeno/lípidos lo que se tradujo en placas con un fenotipo más estable.
Los efectos observados tras el tratamiento con atorvastatina fueron independientes de su acción hipolipidemiante ya que los niveles séricos de colesterol y triglicéridos no se vieron afectados durante el periodo de estudio. Este resultado está en concordancia con lo observado por otros autores que indican que el tratamiento con estatinas no modifica el perfil lipídico en el ratón ApoE KO27,28. De hecho, hemos observado cómo la expresión del receptor de TWEAK, Fn14, está disminuida en los ratones tratados con atorvastatina, lo que podría indicar un efecto directo de este fármaco sobre el eje TWEAK/Fn14. En este sentido, estudios previos de nuestro grupo demostraron que la atorvastatina disminuye la expresión de Fn14 en CML independientemente de su acción hipolipidemiante3. Este efecto fue dependiente de la isoprenilación proteica y, en particular, de la activación de proteínas G pequeñas de la familia Rho3.
En conclusión, el tratamiento con atorvastatina disminuye la respuesta inflamatoria, el contenido de lípidos y la progresión de la lesión aterosclerótica inducida por TWEAK en ratones ApoE KO. Estos resultados ponen de manifiesto un nuevo mecanismo beneficioso de acción de las estatinas en el tratamiento de las enfermedades cardiovasculares.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo ha sido financiado por la Beca FEA/SEA de Investigación Básica 2009 de la Sociedad Española de Arteriosclerosis, el ISCIII-Subdirección General de Evaluación y Fomento de la Investigación (PI10/00234, PI13/00395, RETICS RD12/0042/0038) y Pfizer.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses