La arteriosclerosis coronaria se ha relacionado con la depleción y la alteración funcional de las células progenitoras endoteliales (EPC). Nos propusimos determinar el número de células CD34+/KDR+ y CD34+/CD144+ en pacientes sometidos a revascularización miocárdica quirúrgica, comparados con pacientes operados de recambio valvular, así como el efecto de su plasma sobre EPC cultivadas de donantes sanos.
MétodosEl número de CD34+/KDR+ y CD34+/CD144+ se determinó por citometría de flujo. Las EPC cultivadas se obtuvieron de residuos leucoplaquetarios transfusionales. La apoptosis se midió por fragmentación de ADN. La expresión de CD34 y CD144 se determinó por Western blot.
ResultadosEncontramos un menor número de CD34+/CD144+ en pacientes revascularizados comparados con los de recambio valvular, pero en ambos casos fue un número mayor que el hallado en sujetos sanos. El plasma de pacientes revascularizados tuvo un efecto antiapoptótico sobre EPC de sujetos sanos (al día 7 de aislamiento), y este efecto fue inhibido por los bloqueadores de la vía del TGF-beta1 SIS3 y SB-431542. Previo a ello, en el día 4, el plasma de los pacientes revascularizados aumentó la expresión in vitro de CD34 y CD1144.
ConclusiónEl plasma de los pacientes revascularizados es antiapoptótico y aumenta la expresión de CD34 y CD144 en EPC de donantes sanos. Por lo tanto, el número subóptimo de CD34+/CD144+ que se observa in vivo sugiere un defecto en su liberación de la médula ósea.
Coronary atherosclerotic disease has been linked to endothelial progenitor cell (EPC) depletion and functional impairment. We assessed the number of CD34+/KDR+ and CD34+/CD144+ cells in coronary artery bypass grafting (CABG) patients, compared to valvular patients, and the apoptotic effect of the plasma from these two groups on early outgrowth cells (EOCs) from healthy donors.
MethodsCD34+/KDR+ and CD34+/CD144+ cell numbers were assessed by flow cytometry. EOCs were obtained from buffy coats from healthy donors. Apoptosis was measured as DNA fragmentation. In vitro expression of CD34 and CD144 was assessed by Western blot.
ResultsWe found a lower number of CD34+/CD144+ cells in CABG patients compared to valvular, but a higher number compared to healthy controls. Plasma from CABG patients decreased apoptosis in cultured EOCs from healthy donors (day 7); this effect was abrogated by the TGF-beta1 blockers SIS3 and SB-431542. Prior to apoptosis protection, in cultured cells from healthy donors (day 4), plasma from CABG increased CD34 and CD144 expression, contrary to what found in the blood of the patients.
ConclusionsCABG patients possess a lower number of CD34+/CD144+ cells than valvular ones. Plasma from CABG patients is antiapoptotic for EOCs from healthy donors and increases the expression of both CD34 and CD144. Suboptimal number of CD34+/CD144+ in vivo may be mediated by a primary bone marrow defect rather than a deleterious effect of plasma.
La arteriosclerosis es la primera causa de mortalidad global1. Investigaciones recientes ponen de manifiesto la importancia de las células progenitoras endoteliales (EPC) en la patogenia de esta enfermedad2. Diversos estudios muestran que existe un menor número, tanto de CD34+/KDR+3 como de CD34+/CD144+4, en los pacientes con enfermedad coronaria. Esta disminución parece estar relacionada no solo con los factores de riesgo clásicos, sino que tiene una relación directa con la obstrucción coronaria medida por coronariografía5, y es capaz de predecir futuros síndromes coronarios agudos6. Sin embargo, otros estudios muestran que hay un mayor número de EPC en relación con la arteriosclerosis7. Esta aparente discrepancia se puede explicar por la oscilación que parece existir en el número de EPC en respuesta a la isquemia8. Se ha postulado que estas células se liberan de la médula ósea en respuesta a la isquemia en los estadios iniciales de la enfermedad, viéndose posteriormente disminuidas a consecuencia de una liberación subóptima9,10. Las EPC pueden cultivarse a partir de la sangre periférica. No obstante, no existe aún una única definición de consenso de las EPC, según los marcadores que presenten y las condiciones de cultivo. En los años recientes se ha ido comprobando que la mayoría de las condiciones de cultivo corresponden a un subtipo de células cuyo papel mayoritario es el apoyo de la angiogénesis por parte de las células endoteliales residentes mediante la secreción de citoquinas2. A pesar de esta limitación, se ha comprobado que el comportamiento in vitro de estas células cultivadas corre paralelo a su función in vivo, y estas células tienen una posible utilidad terapéutica en procesos isquémicos2. Se ha observado una mayor apoptosis en EPC cultivadas de pacientes arterioscleróticos, especialmente de diabéticos11,12. De hecho, en experimentos in vitro se ha comprobado que la hiperglucemia dificulta la adhesión de estas células sobre arterias humanas en condiciones de flujo13. Más aún, las EPC cultivadas a partir de la sangre periférica de pacientes diabéticos tienen alteradas sus capacidades de adhesión y migración, con una menor incorporación a los vasos dañados14.
El factor de crecimiento transformante beta (TGF-β1) es una citoquina que regula múltiples funciones en el organismo, y su fisiología parece estar alterada en la arteriosclerosis. En células endoteliales, el TGF-β1 puede tener un efecto antiapoptótico mediante la señalización por los segundos mensajeros Smad2/315 y ALK-416. En EPC el TGF-β1 se considera un mediador importante, ya que parece promover la supervivencia de las mismas en pacientes con shock traumático17. Sin embargo, se desconoce aún si este mecanismo fisiológico protector tiene lugar en la arteriosclerosis.
Por todo ello, en este trabajo nos propusimos determinar si se produce una liberación subóptima de EPC (CD34+/KDR+ y CD34+/CD144+) en pacientes con arteriosclerosis demostrada mediante coronariografía. También intentamos establecer si el plasma de estos pacientes era capaz de tener un efecto antiapoptótico sobre EPC de donantes sanos, ya que la modulación de este efecto protector podría tener interés terapéutico.
Material y métodosDiseño clínicoSe reclutaron los pacientes del Servicio de Cirugía Cardiaca del Hospital Clínico Universitario San Carlos, Madrid, en el periodo de mayo de 2007 a mayo de 2009. Los criterios de exclusión fueron: insuficiencia renal o hepática severa, cirugía cardiaca previa, ausencia de coronariografía previa, cáncer o enfermedades autoinmunes, cirugía mixta de revascularización miocárdica y de recambio valvular. El objetivo era comparar pacientes sometidos a cirugía de revascularización, con demostración angiográfica de enfermedad coronaria, con pacientes sometidos a recambio valvular, con demostración angiográfica de ausencia de enfermedad coronaria. Se analizaron finalmente los datos de 51 pacientes revascularizados y 49 de recambio valvular. Como cohorte de sujetos sanos (en los que no se hizo cateterismo por razones éticas evidentes), se eligió a un grupo de 27 trabajadores de la compañía Bosch España (Madrid), asintomáticos y sin ningún factor de riesgo cardiovascular. El estudio fue aprobado por el Comité Ético del Hospital Clínico San Carlos, cumpliendo la Declaración de Helsinki. En todos los casos existió consentimiento informado.
Citometría de flujoEl porcentaje de células CD34+/KDR+ y CD34+/CD144+ se determinó en sangre periférica preoperatoria, según un protocolo ya publicado18. Las muestras de sangre se extrajeron antes de la cirugía en tubos EDTA-Vacutainer®. Entonces se añadieron 10μl de los respectivos anticuerpos a cada alícuota de 100μl de sangre. Estos anticuerpos fueron: anti-isotipo IgG1k de ratón (555748 Becton-Dickinson, Franklin Lakes, Estados Unidos), anti-isotipo IgG1k de ratón conjugado con isotiocianato de fluoresceína o FITC (555748 Becton-Dickinson, Franklin Lakes, Estados Unidos), anti-isotipo IgG1 de ratón conjugado con ficoeritrina (IC002P, R&D Systems, Minneapolis, Estados Unidos), anti-isotipo IgG2B de ratón conjugado con ficoeritrina (IC0041P, R&D Systems, Minneapolis, Estados Unidos), anti-CD34 IgG1k de ratón conjugado con FITC (555821, Becton Dickinson), anti-VEGF-R2 IgG1 (anti-KDR) de ratón conjugado con ficoeritrina (FAB357P, R&D Systems) y anti-CD144 IgG2B (anti-VE-cadherina) conjugado con ficoeritrina (FAB9381P, R&D Systems). Las mezclas de sangre y anticuerpo se incubaron durante 30min a 4°C y protegidas de la luz. Posteriormente, los hematíes se lisaron mediante incubación durante 10min con una solución de lisis comercial (347691-MSDS-A, Becton Dickinson), a temperatura ambiente y protegidos de la luz. Se lavaron con PBS y se analizaron dentro de las 24h siguientes. Este análisis se hizo en un citómetro de flujo FACScalibur (número de seire E2295, Becton Dickinson, San Jose, Estados Unidos). Se hizo una selección de células mononucleares, como se muestra en la figura 1, panel A. El análisis se hizo con el programa CellQuestPro®. Los perfiles representativos de citometría en cada condición (control IgG, CD34+/KDR+ y CD34+/CD144+) se muestran en la figura 1, paneles B, C y D. Los técnicos de citometría no conocían el origen ni el grupo de cada muestra.
Porcentaje de células doblemente marcadas en sangre periférica. Panel A: Selección de las células mononucleares por tamaño y complejidad. Panel B: Perfil citométrico representativo para el control IgG. Panel C: Perfil citométrico representativo para CD34+/KDR+. Panel D: Perfil citométrico representativo para CD34+/CD144+. Las células positivas se destacan en el recuadro rojo. E y F muestran la positividad de CD34+/KDR+ y CD34+/CD144+ en distintos grupos de pacientes, respectivamente. CABG: pacientes de revascularización miocárdica. *p<0,05; **p<0,01; ***p<0,001; t de Student.
Los niveles de kit de citoquinas se midieron mediantes kits de ELISA. En el de TGF-β1 se utilizó la medición de la citoquina total (libre y unida a proteína de unión), que ha demostrado mayor reproducibilidad en muestras humanas19. Para el SDF-1 se utilizó plasma pobre en plaquetas, según las instrucciones del fabricante. Se determinó también la concentración plasmática de IL-6 y TNF-α, dado que las concentraciones de estas citoquinas se alteran de forma notable en la cirugía cardiaca20.
Aislamiento y cultivo de EPCLas EPC se cultivaron según un método ya descrito11. Las células mononucleares de sangre periférica se separaron en gradiente de densidad de la solución separadora Ficcoll® (GE-Healthcare, Madrid, España) a partir de residuos leucoplaquetarios, subproductos de material transfusional de donantes sanos (Centro de Transfusiones de la Comunidad de Madrid). Las células mononucleares se sembraron a una densidad de 106células/cm2 sobre placas de cultivo celular recubiertas de una solución de fibronectina a 10μg/ml (Tebu-Bio, Offenbach, Alemania), y mantenidas con medio de cultivo microvascular MV-2 al 5% de suero fetal bovino (PromoCell, Heidelberg, Alemania). En algunos experimentos, las células se incubaron con plasma de pacientes revascularizados o valvulares a una dilución 1:100. El medio se cambió el día 4 tras la siembra. El día 7 los cultivos desarrollaron una morfología típica de EPC, con formación de unidades formadoras de colonias (CFU) y doble positividad para la Dil-Ac-LDL y la lectina de Ulex europaeus, según el modelo descrito11.
Fármacos y reactivosPara inhibir la actividad de Smad3, las células se incubaron con SIS3 a 10μM. Esta concentración ha demostrado inhibir de forma selectiva la actividad de Smad3 en modelos de células vasculares21. Para inhibir la actividad del ALK-4 se usó el compuesto SB-431542, también a 10μM, como se ha descrito22. Ambos fármacos se compraron de Tocris (Bristol, Reino Unido) y se disolvieron a 1:1000 en DMSO.
ApoptosisLa apoptosis se midió mediante un kit comercial de fragmentación de ADN (Roche-Boehringer, Madrid, España). Las células se sembraron en placas de 96 pocillos y se marcaron con 5’-Bromo-2’-deoxi-uridina (BrdU) a 10μl durante toda la noche. Posteriormente se incubaron en presencia o ausencia de plasma a 1:100 de pacientes revascularizados o valvulares, TGF-β1 (50ng/ml), SIS3 o SB-431542 (ambos a 10μM).
Western blotLas células se lavaron con PBS frío y se lisaron en hielo con una solución de lisis (10% glicerol, 2,3% SDS, 62,5mM Tris, pH6,8, 150mM NaCl, 10mM EDTA). Posteriormente se calentaron a 95°C durante 5min. Se cargaron cantidades iguales de proteína en geles de poliacrilamida al 10%. Las proteínas se transfirieron después a membranas de PVDF (GE-Helathcare, Madrid, España), cuyas uniones inespecíficas se bloquearon tras incubación durante toda la noche a 4°C en una solución de leche en polvo desnatada al 5% en tampón TBS-T (25mM Trizma base, 75mM NaCl, pH7,4, 0,1% v/v Tween® 20). Las membranas se incubaron toda la noche a 4°C con anticuerpos anti-CD34 o anti-cadherin-5 (o anti-CD144) (ambos de Becton-Dikcinson, Franklin Lakes, Estados Unidos), diluidos 1:1000 en TBS-T. Se usó un anticuerpo anti-beta actina (Sigma, Madrid, España), control de carga. Las proteínas se visualizaron con ECL+ (GE-Heathcare, Madrid, España).
EstadísticaLos datos se muestran como media y desviación estándar (DE) en las variables continuas. Los análisis se hicieron con t de Student o U de Mann-Whitney. Se usó el test de análisis de la varianza (ANOVA) para las comparaciones entre diversos grupos, y después se hizo un post-test de Tukey. Se consideró significativa una p<0,05.
ResultadosPacientes analizadosComo se muestra en la tabla 1, los pacientes revascularizados resultaron tener una carga mayor de factores de riesgo cardiovascular (diabetes y dislipidemia) y de medicaciones cardiovasculares (antiplaquetarios, nitratos, antidiabéticos, insulina), comparados con los pacientes valvulares. Además, tuvieron una menor fracción de eyección, mayor tasa de infarto previo dentro de los 30días anteriores a la cirugía, y una menor puntuación en la escala euroSCORE. Los pacientes revascularizados, además, tuvieron un mayor número de plaquetas y de monocitos, así como una mayor concentración de fibrinógeno, mientras que las concentraciones plasmáticas de TGF-β, SDF-1, IL-6 y TNF-α no variaron (tabla 2). En la cohorte de pacientes controles (con ausencia de coronariografía por razones clínicas evidentes), la edad media fue de 42,78±1,969 años, y el porcentaje de mujeres fue del 35,71%.
Características clínicas y farmacológicas de los pacientes
| Bypass | Valvular | p | |
| Número | 51 | 49 | |
| Edad | 64,65±13,34 | 72,7±10,4 | 0,106a |
| Sexo (mujeres, %) | 8 (15,69%) | 22 (44,89%) | 0,001b |
| IMC (kg/m2) | 26,91±0,4322 | 26,51±0,5728 | 0,5726c |
| FE (%) | 62,51±1,846 | 69,2±1,409 | 0,006c |
| Tabaco | 12 (23,53%) | 9 (18,37%) | 0,698b |
| Alcohol | 15 (29,41%) | 14 (28,57%) | 0,898b |
| Hipertensión | 31 (60,78%) | 27 (55,10%) | 0,486b |
| Dislipidemia | 31 (60,78%) | 16 (32,65%) | 0,003b |
| Diabetes | 24 (47,06%) | 5 (10,20%) | <0,001b |
| IECA/ARA2 | 25 (49,02%) | 19 (38,77%) | 0,302b |
| Beta-bloqueantes | 16 (31,37%) | 9 (18,37%) | 0,133b |
| Antagonistas del calcio | 8 (15,69%) | 10 (20,41%) | 0,539b |
| Antiagregantes | 33 (64,71%) | 8 (16,33%) | <0,001b |
| Estatinas | 34 (66,67%) | 11 (22,45%) | <0,001b |
| Nitratos | 16 (31,37%) | 2 (4,08%) | <0,001b |
| Antidiabéticos orales | 16 (31,37%) | 2 (4,08%) | <0,001b |
| Insulina | 13 (25,49%) | 1 (2,04%) | <0,001b |
| IM<30 días | 16 (31,37%) | 0 (0%) | <0,001b |
| EuroSCORE | 3,569±0,4194 | 5,735±0,3581 | <0,001b |
IMC: índice de masa corporal; FE: fracción de eyección; IM: infarto de miocardio.
Datos bioquímicos y hematológicos
| Bypass | Valvular | p | |
| Número | 51 | 49 | |
| Glucosa (mg/dl) | 108,2±5,126 | 108,9±6,563 | 0,4258a |
| Creatinina (mg/dl) | 1,2±0,049 | 1,154±0,045 | 0,5003b |
| Plaquetas (por μl) | 240.200±9.392 | 211.100±8.287 | 0,0228b |
| Hemoglobina (g/dl) | 13,09±0,0263 | 13,76±0,0258 | 0,0762b |
| Leucocitos (por μl) | 8.255±298 | 7.525±298 | 0,0871b |
| Neutrófilos (por μl) | 4.939±225,6 | 4.534±319,9 | 0,3008b |
| Monocitos (por μl) | 689,6±36,01 | 566,1±28,20 | 0,0085b |
| Linfocitos (por μl) | 2.273±109,8 | 2.122±125,3 | 0,3667b |
| Fibrinógeno (mg/dl) | 484,4±20,63 | 387,7±11,07 | <0,0001b |
| % Células | 53,00±1,718 | 54,55±1,234 | 0,4690b |
| TGF-β1 (ng/ml) | 55,73±3,552 | 52,48±3,464 | 0,5144b |
| SDF-1 (ng/ml) | 3,525±0,1109 | 3,604±0,1103 | 0,6152b |
| IL-6 (pg/ml) | 3,152±0,8052 | 2,542±0,2950 | 0,4824b |
| TNF-α (pg/ml) | 3,745±0,5524 | 4,099±0,6835 | 0,7216b |
Los valores se determinaron siempre previamente a la cirugía. La concentración de citoquinas se calculó mediante kit de ELISA.
Como puede verse en la figura 1, panel E, los pacientes revascularizados tuvieron una tendencia hacia una menor concentración de EPC de tipo CD34+/KDR+ comparados con los valvulares, si bien no se alcanzó la significación estadística. Sin embargo, el número de CD34+/KDR+ fue notablemente menor en el grupo de sujetos sanos, comparados con ambos grupos de pacientes sometidos a cirugía cardíaca. Los pacientes sometidos a revascularización tuvieron un número significativamente menor de CD34+/CD144+ respecto a los valvulares (figura 1, panel F). Sin embargo, ambos tipos de pacientes tuvieron de nuevo un número de EPC mucho mayor que el grupo control. Es de destacar que, en los pacientes de cirugía cardiaca, el análisis multivariante mostró que pertenecer a uno u otro grupo (revascularizados o valvulares) se asoció con un menor número de CD34+/CD144+ después de que las p se ajustaran al número de comparaciones (p=0,01428 después del ajuste).
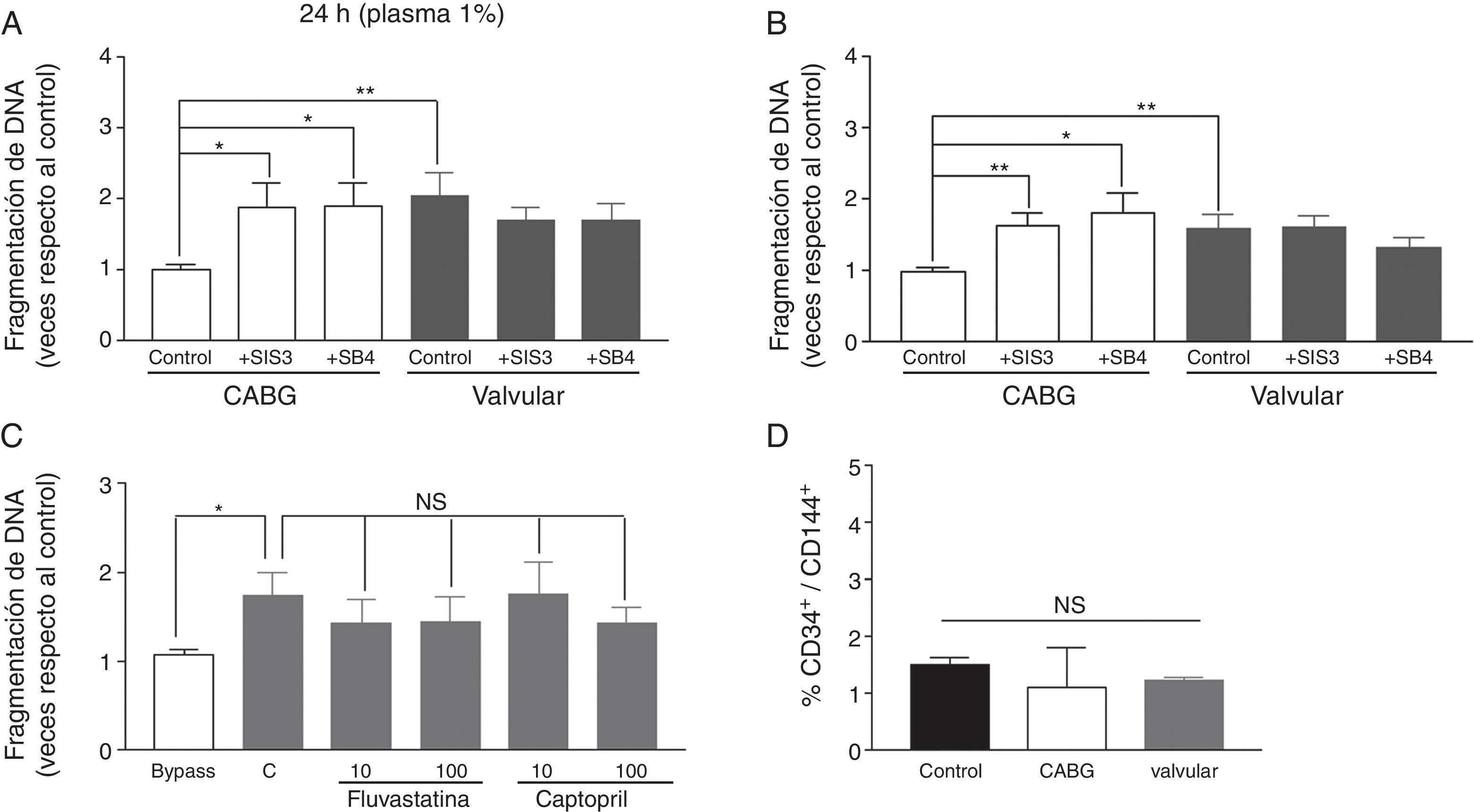
Apoptosis en EPC cultivadasLas EPC se caracterizaron al día 7 del aislamiento mediante la formación de CFU (unidades formadoras de colonias) y la doble positividad para Dil-Ac-LDL y la lectina de Ulex europaeus. Las EPC se obtuvieron a partir de células mononucleares de residuos leucoplaquetarios de donantes sanos. Se incubaron con plasma de pacientes revascularizados o valvulares a una dilución de 1:100. La apoptosis fue mayor en EPC de donantes sanos a las que se añadió plasma de pacientes valvulares a las 24 y 72h (fig. 2, paneles A y B). Esta diferencia se vio anulada cuando se coincubó con los inhibidores SIS3 a 10μM o SB-431542, también a 10μM (fig. 2, paneles A y B). Por lo tanto, estas vías de señalización del TGF-β1 están implicadas en la supervivencia de las EPC inducida por el plasma de pacientes severamente ateroscleróticos. Sin embargo, el TGF-β1 per se, añadido de forma exógena, no tuvo un efecto significativo en la apoptosis (1,000±0,044 vs. 1,179±0,083, p>0,05). Cabe destacar que la fluvastatina (10-100nM) y el captopril (10-100μM), que poseen efecto antiapoptótico sobre células endoteliales23,24, fueron incapaces de ejercer este efecto antiapoptótico sobre las EPC en las condiciones experimentales usadas (fig. 2, panel C, barras grises). De este modo, el efecto antiapoptótico del plasma de pacientes revascularizados no parece deberse a sus medicaciones. Por otro lado, cuando las EPC se cultivaron con plasma de pacientes revascularizados o valvulares, la expresión de CD34+/CD144+ fue baja y no cambió entre los grupos (fig. 2, panel D).
Efecto del plasma de pacientes revascularizados y valvulares sobre cultivos de células progenitoras endoteliales (EPC). Los paneles A y B muestran el efecto de los plasma de estos pacientes añadidos a 1:100 y a 24 y 72h sobre EPC cultivadas de donantes y el efecto de SIS3 o SB-431542, ambos a 10μM. El panel C muestra el efecto del plasma de revascularizados (barra blanca), o valvulares (barras grises), en este último caso, con fluvastatina (10-100nM) o captopril (10-100μM). Panel D: Número de CD34+/CD144+ en EPC de donantes sanos tras la adición de los plasma de los pacientes. *p<0,05; **p<0,01; t de Student.
En las células endoteliales, la proteína de membrana CD144 pertenece al complejo del receptor del TGF-β1 y parece regular la respuesta celular a esta citoquina25. Por lo tanto, se trató de comprobar si el plasma de los pacientes revascularizados era capaz de aumentar la concentración celular de los marcadores endoteliales CD34 y CD144 en EPC (día 4) como paso previo al efecto antiapoptótico (al día 7). Las EPC cultivadas de sujetos sanos se coincubaron con plasma de pacientes revascularizados o valvulares, a una dilución 1:100. Como se muestra en la figura 3 (paneles A, B y C), la expresión de CD34 y CD144 aumentó de forma transitoria tras la incubación con el plasma de pacientes revascularizados, alcanzando un máximo a las 3h.
Efecto del plasma en la expresión in vitro de CD34 y CD144. La expresión de ambas proteínas se determinó por Western blot. El panel A muestra blots representativos. Los paneles B y C muestran la cuantificación de 3 blots diferentes. B: plasma de pacientes sometidos a bypass (revascularizados); V: plasma de valvulares. *p<0,05; t de Student.
Nuestros resultados muestran un menor número de CD34+/CD144+ en pacientes revascularizados con aterosclerosis severa. Sin embargo, el plasma de estos mismos pacientes hizo que las EPC cultivadas de donantes sanos adquirieran resistencia a la apoptosis a través de las vías del TGF-β1 Smad3 y ALK-4. Este efecto se asoció a un previo aumento en la concentración intracelular de CD34 y CD144. Por lo tanto, el presente estudio sugiere que, en pacientes ateroscleróticos, la vía del TGF-β1 parece comportarse como protectora sobre las EPC.
Al contrario que la mayoría de los estudios clínicos sobre EPC realizados hasta la fecha, nuestro estudio se ha llevado a cabo en pacientes en los que la presencia o ausencia de enfermedad coronaria ha sido demostrada mediante angiografía. Es de destacar que la pertenencia al grupo de revascularizados o de recambio valvular se relacionó con una disminución de las CD34+/CD144+ una vez las p fueron ajustadas al número de comparaciones, lo que sugiere que este parámetro se relaciona directamente con la obstrucción coronaria. El número de CD34+/CD144+ en nuestro grupo de pacientes revascularizados fue menor que en los de recambio valvular, pero en estos dos grupos fue mayor que el hallado en el grupo control (fig. 1, panel F). Por lo tanto, nuestros resultados parecen sostener la idea de que las EPC se liberan a la sangre en respuesta a la isquemia y alcanzan niveles diferentes en los pacientes con enfermedad coronaria y en los que no la padecen. Este mecanismo podría explicar los hallazgos realizados por varios grupos, en los que las EPC están reducidas en la enfermedad cardiovascular3-6, mientras que fisiológicamente se movilizan en respuesta a la isquemia2. De hecho, un estudio reciente realizado en una población amplia muestra que el número de CD34+/KDR+ está directamente relacionado con los factores de riesgo cardiovascular (que actuarían como estímulo isquémico), mientras que esta relación es inversa cuando se miden parámetros de daño vascular, como el cociente íntima-media (que serían consecuencia del «agotamiento» en la liberación de EPC)9. Esta idea de una depleción de EPC en la enfermedad cardiovascular avanzada es sugerida por la actual evidencia clínica10.
La disfunción de las EPC que tiene lugar en la aterosclerosis, tanto en número como en función, puede ser contrarrestada por mecanismos protectores. Entre ellos destaca la vía del TGF-β1, que se ha considerado como una citoquina antiaterosclerótica, en lo que se ha llamado la hipótesis de la «citoquina protectora»26. Más aún, la fisiología del TGF-β1 puede regularse mediante muchos fármacos, tanto ya conocidos, como las tiazolidinodionas, la aspirina o las estatinas26, como moléculas de diseño como el SIS-3 (que inhibe la Smad3, segundo mensajero del TGF-β1) o el SB-431542 (que bloquea la ALK-4, una quinasa de su complejo receptor)21,22. La vía del TGF-β1 parece tener un efecto protector sobre células endoteliales15-17. En el presente estudio, demostramos que el TGF-β1 plasmático de pacientes ateroscleróticos tiene un efecto antiapoptótico sobre EPC procedentes de donantes sanos.
Una vez comprobado este hecho nos propusimos comprobar si el plasma de pacientes revascularizados era capaz de alterar la expresión de CD34 y CD144 antes del efecto antiapoptótico. Por lo tanto, se evaluó este efecto sobre EPC de donantes sanos (al día 4). Contrariamente a lo encontrado en la sangre de los pacientes, se observó un aumento en la expresión de CD34 y de CD144 tras la incubación con plasma de pacientes revascularizados (fig. 3, paneles A, B y C). Curiosamente, el mayor efecto se observó a las 3h de incubación, un tiempo muy corto para la expresión de novo de una proteína, lo que sugiere la transmisión directa de CD34 y de CD144 a través de micropartículas endoteliales27. De hecho, se ha demostrado que los restos apoptóticos de células endoteliales estimulan las EPC en cultivo28. Dado que, en células endoteliales, CD144 está integrado en el complejo del recetor de TGF-β125, el aumento de CD144 inducido por el plasma de pacientes revascularizados (día 4) podría mediar el efecto antiapoptótico que se observa después en este mismo modelo de cultivo celular (al día 7, fig. 2, paneles A y B).
En resumen, en el presente estudio mostramos que los pacientes ateroscleróticos poseen un nivel subóptimo de EPC CD34+/CD144+. Sin embargo, en estos pacientes el TGF-β1 plasmático tiene un efecto protector sobre EPC cultivadas de donantes sanos. Por lo tanto, una respuesta anormal de las EPC al TGF-β1 podría mediar la liberación subóptima de EPC que se observa en la enfermedad cardiovascular y ser sujeto de intervenciones futuras.
FinanciaciónNuestros laboratorios reciben financiación pública del Ministerio de Sanidad de España a través de FISS (PI080920) y RECAVA (Red Temática de Investigación Cardiovascular, RD06/0014/1007 y RD06/0014/0027).
AutoríaTodos los autores han participado en distintas fases relacionadas con el trabajo, en la idea, diseño, recogida de datos, análisis, interpretación y elaboración del manuscrito, y han aprobado la versión final.
Conflicto de interesesNinguno de los autores tiene conflicto de intereses.
Agradecemos el apoyo prestado por Fernando Ortego, el personal médico y de enfermería de Cirugía Cardiaca del Hospital Clínico San Carlos, el Centro de Microscopía y Citometría-UCM y el Centro de Transfusiones de la Comunidad de Madrid.
Parte de este trabajo fue presentado como póster en el XXIII Congreso Nacional de la Sociedad Española de Arteriosclerosis (Córdoba, 9-11 de junio de 2010) y galardonado con una Mención Especial (13/30).