Las estatinas tienen un papel fundamental en la prevención cardiovascular de la población general, así como en los pacientes con diabetes mellitus tipo 2 (DM2). Sin embargo, el tratamiento con estatinas predispone a la DM2, especialmente en los pacientes con predisposición a la misma. Algunas estatinas se han asociado a aumentos de la glucemia en pacientes con o sin DM2, y otras han demostrado tener efectos neutros, variando de unas a otras su capacidad hiperglucemiante o diabetogénica. En muchos estudios clínicos con estatinas la incidencia de DM2 no se ha evaluado sistemáticamente, y otros carecen de la potencia necesaria para detectar diferencias entre estatinas. Las evidencias disponibles de mayor calidad provienen de los metaanálisis de los ensayos clínicos controlados. El único ensayo clínico controlado para evaluar la incidencia de DM2 de nueva aparición es el J-PREDICT realizado con pitavastatina en pacientes con tolerancia anormal a la glucosa. Los resultados preliminares de este estudio muestran que la pitavastatina se asocia a una disminución significativa de la incidencia de nuevos casos de DM2 en comparación con la modificación del estilo de vida exclusivamente. Por tanto, la pitavastatina podría constituir una adecuada alternativa terapéutica de elección para disminuir el riesgo vascular del paciente con DM2 o en situación de riesgo de presentarla.
Statins are the cornerstone of cardiovascular prevention for general population, and in patients with type 2 diabetes mellitus (T2DM). However, statin therapy predisposes to type 2 diabetes, particularly in patients with predisposition to this condition. Some statins have been associated with increases in blood glucose in patients with or without DM2, and others have shown to have neutral effects, varying from one another their glucose or diabetogenic capacity. In many statin trials the incidence of DM2 has not been systematically evaluated and others the power to detect differences between statins is lacking. Evidence highest quality available comes from the meta-analysis of controlled clinical trials. The only controlled clinical trial to evaluate the incidence of new-onset T2DM is the J-PREDICT conducted with pitavastatin in patients with abnormal glucose tolerance. Preliminary results of this study show that pitavastatin is associated with a significant decrease in the incidence of de novo T2DM compared to only modification lifestyle. Therefore, pitavastatin may be an appropriate therapeutic alternative of choice to reduce vascular risk in patients with T2DM or at risk of presenting it.
La diabetes mellitus tipo 2 (DM2) es una enfermedad frecuente cuya prevalencia se ha incrementado en los últimos años debido a cambios desfavorables del estilo de vida, al aumento de la edad en nuestra población, así como por la alta prevalencia de sobrepeso/obesidad1. Estas alteraciones conllevan una serie de efectos metabólicos adversos que se relacionan con aumento de la presión arterial, alteraciones del perfil lipídico, hiperglucemia e incremento de la incidencia de DM2, todo ello asociado a un aumento de la enfermedad cardiovascular (ECV)2. En estudios nacionales se ha observado un aumento de la prevalencia de DM2 pasando de un 5-6% en la década de los noventa, hasta el actual 13,8%, de los cuales la mitad se estima como DM2 desconocida3. Además, el conjunto de las alteraciones metabólicas caracterizadas por hiperglucemia, que engloba la denominada prediabetes, tolerancia anormal a la glucosa y glucemia anormal en ayuno, tiene también una elevada prevalencia en nuestro medio, estimada globalmente en un 12,6%3.
La DM2 tiene un elevado riesgo de ECV4,5, y esta es la principal causa de morbimortalidad en esta población específica6. El abordaje global del paciente con prediabetes o diabetes consiste en tratar los factores de riesgo modificables como el tabaquismo, la obesidad, la hiperglucemia, la hipertensión arterial y la dislipemia. Esta estrategia multifactorial ha proporcionado notables beneficios y una apreciable reducción del riesgo cardiovascular en estos pacientes7,8.
La dislipemia típica del paciente diabético, denominada dislipemia aterogénica, se caracteriza por hipertrigliceridemia, concentraciones bajas del colesterol de las lipoproteínas de alta densidad (cHDL) y normales o moderadamente elevadas de colesterol de las lipoproteínas de baja densidad (cLDL), pero con una elevada proporción de partículas LDL pequeñas y densas con un alto poder aterogénico9. Las guías de práctica clínica señalan al cLDL como la piedra angular del tratamiento, estableciendo unos objetivos en función del riesgo vascular individual10. De esta forma, la reducción del cLDL es la medida más eficaz en la prevención primaria y secundaria de la ECV en la DM2. Debemos recordar que la determinación del cLDL tiene limitaciones: su medición habitualmente no es directa y se calcula mediante la fórmula de Friedewald11, subestimando sus valores en presencia de hipertrigliceridemia12; así mismo, la medición del cLDL no aporta datos del tamaño o densidad de las partículas lipoproteicas, características determinantes del potencial aterogénico. La cuantificación de la apolipoproteína B100 (Apo B) como marcador de riesgo aterogénico podría mejorar la aproximación a la dislipemia diabética al reflejar de manera fiel las concentraciones de las lipoproteínas aterogénicas (LDL, IDL y VLDL). Otra forma equivalente de cuantificar el conjunto del colesterol aterogénico que transportan las lipoproteínas es el colesterol no HDL (c-no-HDL), parámetro que se obtiene fácilmente restando el valor del cHDL del colesterol total.
Los inhibidores de la enzima 3-hidroxi-3-metilglutaril coenzima A reductasa (HMG-CoA), conocidos como estatinas, constituyen el grupo farmacológico más efectivo para disminuir las concentraciones de cLDL. Numerosos estudios de intervención han demostrado los beneficios clínicos de las estatinas en distintos escenarios de la prevención cardiovascular. El análisis de los subgrupos con DM2 en los estudios 4S, CARE, LIPID y HSP han mostrado la disminución de episodios cardiovasculares y mortalidad total en pacientes con DM2 tratados con estatinas como la pravastatina o la simvastatina13–15. En el análisis de los subgrupos con DM2 del estudio ASCOT-LLA16 con atorvastatina también se observa una reducción del riesgo de accidentes cardiovasculares, aunque no muestra una clara significación estadística. Sin embargo, en el estudio CARDS17 en pacientes con DM2 e incluso con niveles bajos de cLDL, la atorvastatina sí ha demostrado una reducción de los accidentes cardiovasculares.
Teniendo presente que el descenso del cLDL se asocia de forma directa y lineal con la reducción del riesgo cardiovascular, las guías de práctica clínica para el tratamiento de la dislipemia en los pacientes con DM2 han reducido progresivamente los objetivos terapéuticos de cLDL a alcanzar. Las guías de las Sociedades Europeas de Cardiología y Arteriosclerosis establecen que en los pacientes con ECV manifiesta el objetivo de cLDL debe ser inferior de 70mg/dl (1,8 mmol/L), utilizando estatinas a dosis altas si fuese necesario10.
En paralelo con todo lo anterior, en los últimos años, se ha observado que el uso de estatinas incrementa el riesgo de DM27,18,19. De hecho, la European Medicines Agency publicó en el 2012 unas directrices relacionadas con el aumento del riesgo de DM2 asociado al tratamiento con estatinas20. De ahí el interés de valorar de una forma global y unitaria tanto la diabetogenicidad de las distintas estatinas como las diferencias que puedan existir entre ellas, de cara a un uso más racional en los pacientes diabéticos o con predisposición a la misma.
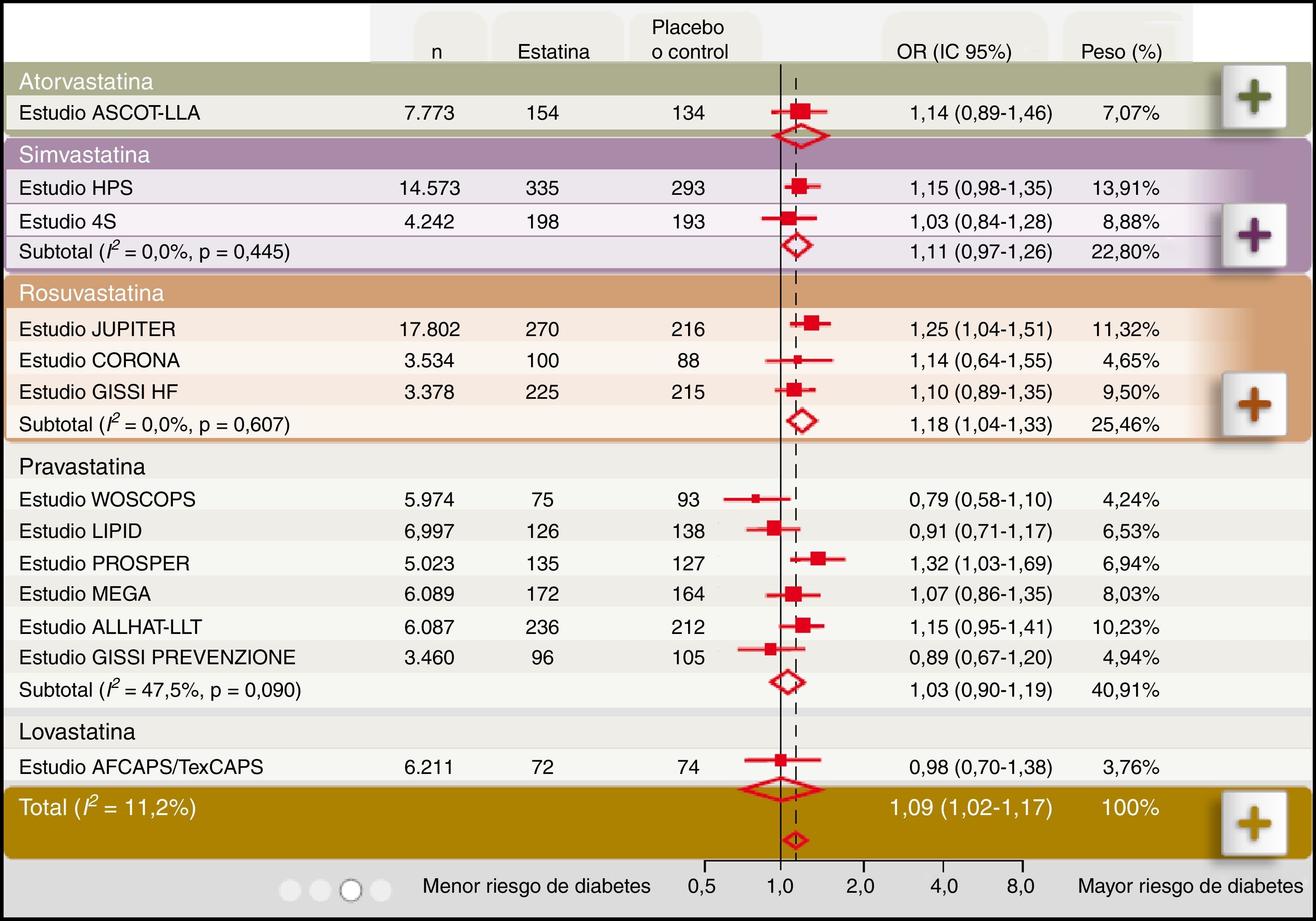
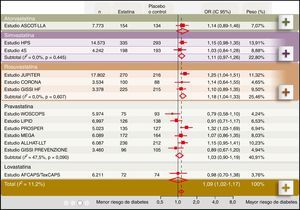
Diabetogenicidad de las estatinasDiferentes metaanálisis indican que las estatinas pueden incrementar el riesgo de DM221,22. En este sentido, el metaanálisis de Sattar et al. (fig. 1), reportó que el tratamiento con estatinas se asocia a un incremento del 9% en el riesgo de aparición de nuevos casos de DM2 a lo largo de cuatro años (OR 1,09; IC 95% 1,02-1,17) y que este riesgo fue mayor en los pacientes de mayor edad. Entre los 13 estudios con estatinas analizados en los que se incluyeron 91.140 individuos, dos mostraron una asociación positiva concluyente entre el tratamiento con estatinas y diabetes, el estudio JUPITER con rosuvastatina23 y el estudio PROSPER con pravastatina24.
Asociación entre el tratamiento con estatinas y el riesgo de desarrollar diabetes. Modificado de Sattar et al22.
En el estudio JUPITER23 con 17.802 sujetos en prevención primaria, se observó que el riesgo absoluto de DM2 después de cinco años de tratamiento fue del 1,3% en el grupo placebo frente al 1,5% en el grupo tratado con rosuvastatina 20mg. Esto representa que el grupo con rosuvastatina tuvo un incremento del 28% del riesgo de nuevos casos de DM2 (OR 1,28; IC 95%:1,07-1,54; p=0,01). Este incremento de DM2 se observó fundamentalmente en aquellos individuos que o bien tenían un síndrome metabólico, que representaba el 41,4% del total; o bien glucemia alterada en ayunas, obesidad (índice de masa corporal [IMC] ≥ 30kg/m2) o una hemoglobina glicosilada (HbA1c) > 6%, parámetros todos ellos asociados al estado de prediabetes.
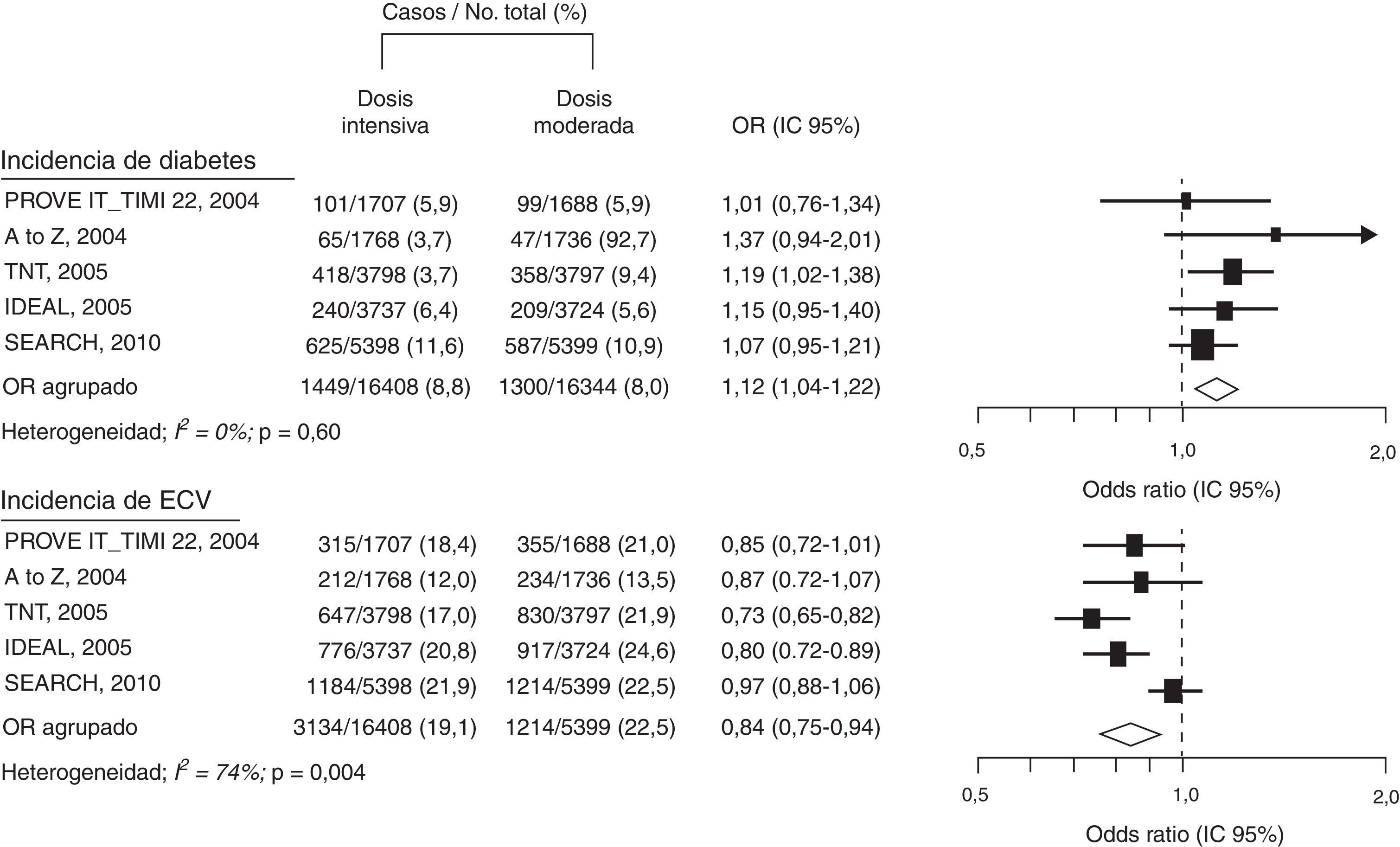
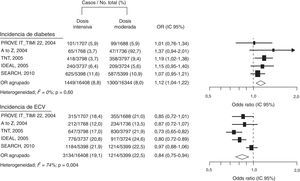
También, en los estudios TNT15 e IDEAL25 el tratamiento con atorvastatina se asoció a un incremento de nuevos casos de DM2 y su aparición se relacionó con el número de factores de riesgo de diabetes existentes en los pacientes incluidos. En el mismo sentido, una revisión con los datos de estos estudios, TNT e IDEAL, y del estudio SPARCL, que incluyó a 15.056 pacientes, mostró cómo los componentes del síndrome metabólico eran predictores de la aparición de DM226. En otro metaanálisis de cinco ensayos clínicos, PROVE IT-TIMI, A to Z, TNT, IDEAL, SEARCH, que abarcó 32.752 pacientes no diabéticos, se reconocía que el tratamiento intensivo con altas dosis de estatinas incrementa el riesgo de nuevos casos de DM2 en un 12% (OR 1,12; IC 95%: 1,04-1,22)27. El riesgo de desarrollar DM2 con estatinas fue mayor para las dosis altas (dosis-dependiente) cuando se utiliza atorvastatina, simvastatina y pravastatina, pero, como era de esperar al comparar con el grupo tratado con bajas dosis de estatinas, los episodios cardiovasculares disminuyeron un 16% (OR 0,84; IC 95%:0,75-0,94), (fig. 2).
Los efectos diabetogénicos de las estatinas parecen estar relacionados con la dosis, pero reducen el riesgo cardiovascular. Modificado de Preiss D et al.27.
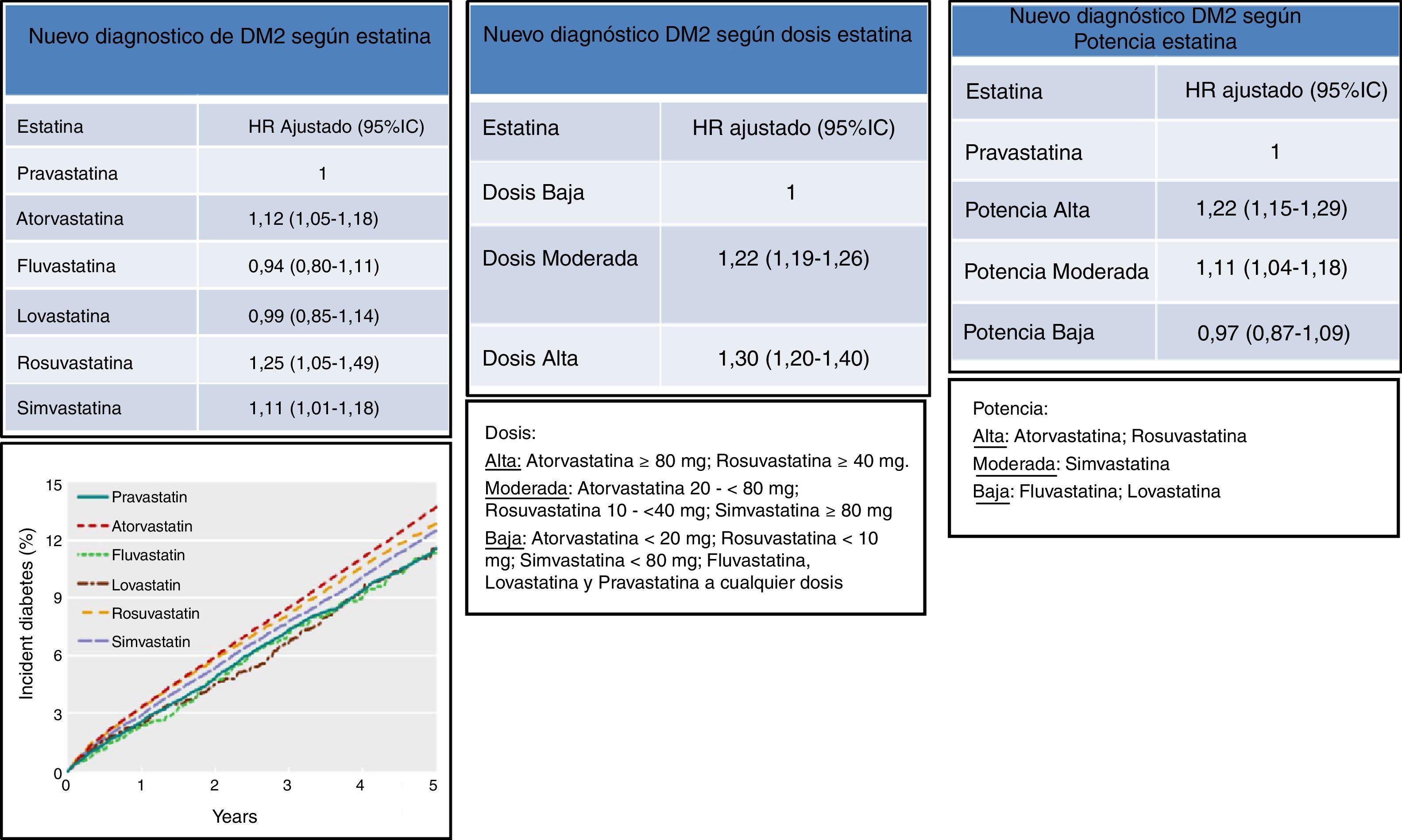
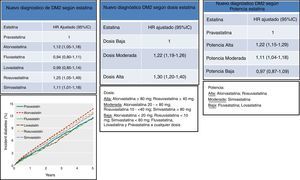
Datos recientes de un estudio canadiense retrospectivo de la práctica clínica real con 471.250 pacientes ≥ de 66 años no diabéticos, tratados con estatinas (el 48,3% en prevención primaria) durante un período de 14 años, mostró también un efecto diabetogénico de las estatinas y lo asoció a aquellas de alta potencia (atorvastatina y rosuvastatina) o de moderada potencia (simvastatina), 22% (OR 1,22; IC 95%:1,15-1,29) y 11% (OR 1,11; IC 95%:1,04-1,18) respectivamente para nuevos diagnósticos de DM2 (fig. 3). Comparando dosis, aquellos tratados con dosis altas (atorvastatina 80mg; rosuvastatina 40mg) y moderadas (atorvastatina 20 a 40mg; rosuvastatina 10 a 20mg; simvastatina < 80mg), mostraron un 30% (OR 1,30; IC 95%:1,20-1,40) y 20% (OR 1,20; IC 95%:1,19-1,26) respectivamente, de nuevos diagnósticos de DM228.
DM2 de nueva aparición según la estatina, dosis y potencia utilizada. Modificado de Carter et al.28.
Otro estudio poblacional retrospectivo en práctica clínica real, realizado en Irlanda con 239.628 pacientes sin diabetes, analizó la frecuencia y el riesgo de aparición de nuevos casos de DM2 con la utilización de distintas estatinas, y mostró un incremento del riesgo del 20% para el conjunto de todas las estatinas, siendo del 25% para atorvastatina (OR 1,25; IC 95%: 1,21-1,28; p<0,0001), del 42% para rosuvastatina (OR 1,42; IC 95%:1,33-1,52; p<0,0001) y del 14% para simvastatina (OR 1,14; IC 95%: 1,06-1,23; p=0,0005), mientras que no fue significativo para fluvastatina y pravastatina29.
Más recientemente, otro estudio poblacional que incluyó a 136.966 pacientes ≥40 años que habían iniciado tratamiento con una estatina entre 1997 y 2011, constató, al igual que los anteriores estudios comentados, que el riesgo de desarrollar DM2 es superior con estatinas de alta potencia que con las de baja potencia a los dos años del inicio del tratamiento (OR 1,15, IC 95% 1,05-1,26). Este riesgo se incrementa ya durante los cuatro primeros meses de uso de estatinas (OR 1,26; IC 95% 1,07-1,47)30.
Finalmente, otro gran estudio poblacional realizado en el Reino Unido con una cohorte de más de dos millones de pacientes de los que 430.890 recibían tratamiento con estatinas, vuelve a mostrar cómo la terapia con estatinas se asocia a un mayor riesgo de DM2 (OD 1,57; IC 95%: 1,54-1,59), y que este aumento es más significativo cuanto mayor es la duración del tratamiento31. Además, se observó en este caso un menor riesgo de DM2 en los pacientes con hipertensión o enfermedad cardiovascular. Aunque este hecho es aparentemente contradictorio, en un reciente análisis retrospectivo, los pacientes hipertensos con o sin diabetes, tratados con estatinas, se asociaban a unos incrementos significativos de los niveles de la HbA1c32. Debería monitorizarse la HbA1c en todos los pacientes hipertensos que reciben tratamiento con estatinas.
De acuerdo con lo expuesto, se puede concluir que el concepto de «diabetogenicidad» de las estatinas está bien fundamentado, que se trata de un efecto de clase atribuible a todos los miembros del grupo de las estatinas, dosis-dependiente y, por tanto, es más acusado en las estatinas de alta potencia, tiene una clara relación con la edad y este riesgo se incrementa en los pacientes con prediabetes o alto riesgo de desarrollar DM2. A la vez que en condiciones reales de uso, el riesgo de diabetes de nueva aparición aumenta a medida que se incrementa el cumplimiento terapéutico con estatinas33.
Recientemente, la European Society of Atherosclerosis ha establecido unas recomendaciones sobre el uso de estatinas en pacientes con alto riesgo de desarrollar DM234. En ellas se indica que todos los pacientes con un riesgo cardiovascular elevado en quienes se considere el uso de estatinas deberían someterse a una evaluación del riesgo de DM2 a 10 años utilizando una puntuación de riesgo validada mediante el cuestionario FINDRISC (FINnish Diabetes RISk Score). En aquellos pacientes con enfermedad cardiovascular establecida o un riesgo vascular elevado, y una puntuación de riesgo de DM2 alta o muy alta (p. ej., una puntuación FINDRISC ≥15), deben medirse los niveles de HbA1c y/o glucemia plasmática en ayunas antes de iniciar el tratamiento con estatinas, y evaluar de nuevo a los tres meses del inicio del tratamiento con estatinas. Otros autores apoyan la circunstancia de que el incremento de peso corporal durante el tratamiento con estatinas debe ser una medida de control para prevenir la aparición de nuevos casos de DM235.
Aunque queda claro que las estatinas aumentan el riesgo de aparición de nuevos casos de diabetes, la relación entre estatinas y el control de la glucemia en individuos con DM2, no ha sido bien caracterizado. No obstante, un reciente metaanálisis36 que incluye nueve ensayos clínicos randomizados y comparativos, entre el grupo que recibe estatinas frente al grupo control con placebo o tratamiento estándar, en pacientes con DM2, ha comprobado que el tratamiento con estatinas se asocia con un modesto incremento de la HbA1c. Se estima que el efecto de las estatinas sobre los valores de la HbA1c, se asocia a un cambio medio de +0,12%, dependiendo del tipo y la dosis de estatina. No obstante y según comentan los autores, estos resultados no deben cambiar la práctica clínica real, en la medida que los beneficios del tratamiento con estatinas en los pacientes con DM2 son superiores a las desventajas, pudiéndose manejar fácilmente37.
Implicaciones clínicasAunque el riesgo de aparición de un nuevo caso de DM2 es relativamente bajo y pueda tratarse en cierta medida de un riesgo sobrestimado38, es obligado evaluar de forma constante el riesgo-beneficio del uso de estatinas en las poblaciones de mayor riesgo39. De forma inequívoca, el uso de estatinas, incluso en prevención primaria, ha mostrado beneficios clínicos cardiovasculares, sin incrementar la mortalidad por otras causas22,28,40. En la actualidad no existe ninguna evidencia que sugiera que un paciente que desarrolla DM2 durante el tratamiento con estatinas deba interrumpir dicho tratamiento, al contrario debe mantenerse para controlar el alto riesgo cardiovascular de estos pacientes. No obstante, se recomienda advertir a los pacientes de dicho riesgo, pero también del efecto beneficioso que supone mantener el tratamiento para reducir su riesgo cardiovascular, incentivando a los pacientes la adherencia a los cambios de estilo de vida y al equipo médico para promoverlos, así como utilizar aquellas estatinas y las dosis con un menor potencial de desarrollar DM2, maximizando la reducción del riesgo cardiovascular41.
Como ya se ha señalado el riesgo de aparición de nuevos diagnósticos de DM2 dependerá de la estatina utilizada, su dosis y de la predisposición del paciente. En función de las evidencias disponibles, se considera que pravastatina no incrementa el riesgo de aparición de diabetes. Considerando a esta como la referente por su efecto neutro sobre el perfil glucémico, los datos que se pueden extraer de los estudios poblacionales nos muestran que atorvastatina, simvastatina y rosuvastatina producen un claro aumento en la aparición de DM2, mientras que no existe una asociación estadísticamente significativa con el resto de las estatinas valoradas.
Aunque son fármacos con un excelente perfil de seguridad, los recientes datos han demostrado que existe un efecto dosis-dependiente de incrementar la aparición de nuevos casos de DM2. Existe un número importante de investigaciones que sugieren este efecto como hemos señalado anteriormente, pero los mecanismos responsables deben esclarecerse42–46 (fig. 3). Aunque la evidencia clínica de los efectos diabetogénicos de las estatinas es consistente y considerable, es necesario disponer de una mayor evidencia y precisar si todas las estatinas se comportan por igual o puedan existir diferencias intraclase. Hasta que se pueda disponer de datos a más largo plazo, los pacientes con alteraciones del metabolismo de la glucosa inducida por el tratamiento con estatinas deben ser tratados de la misma manera que aquellos que desarrollan DM2 de novo. Aunque es necesario que en todos los casos los pacientes deban ser evaluados para el riesgo de desarrollar DM2, antes y durante el tratamiento con estatinas mediante un método sencillo y rápido como es el cuestionario Findrisc.
Existen datos que sugieren que no todas las estatinas causan el mismo grado de intolerancia a la glucosa. La pravastatina quizás sea la menos diabetógena, mientras que rosuvastatina a la dosis de 20mg incrementa de forma muy superior el riesgo de DM2. Además, recientemente en un estudio de randomización mendeliana, se ha observado que ciertos polimorfismos genéticos asociados a una menor actividad del gen HMG CoA reductasa, influyen en la función de la célula beta, así que los pacientes que tienen un polimorfismo adverso tienen más probabilidades de desarrollar obesidad y diabetes. De este estudio se podría deducir que el aumento del riesgo de DM2 con estatinas se puede explicar al menos parcialmente por la inhibición de la 3-hidroxi-3-metilglutaril-CoA reductasa47.
La evidencia reciente del impacto de las estatinas en el metabolismo hidrocarbonado ha justificado analizar qué estatina puede tener más indicación en el paciente diabético.
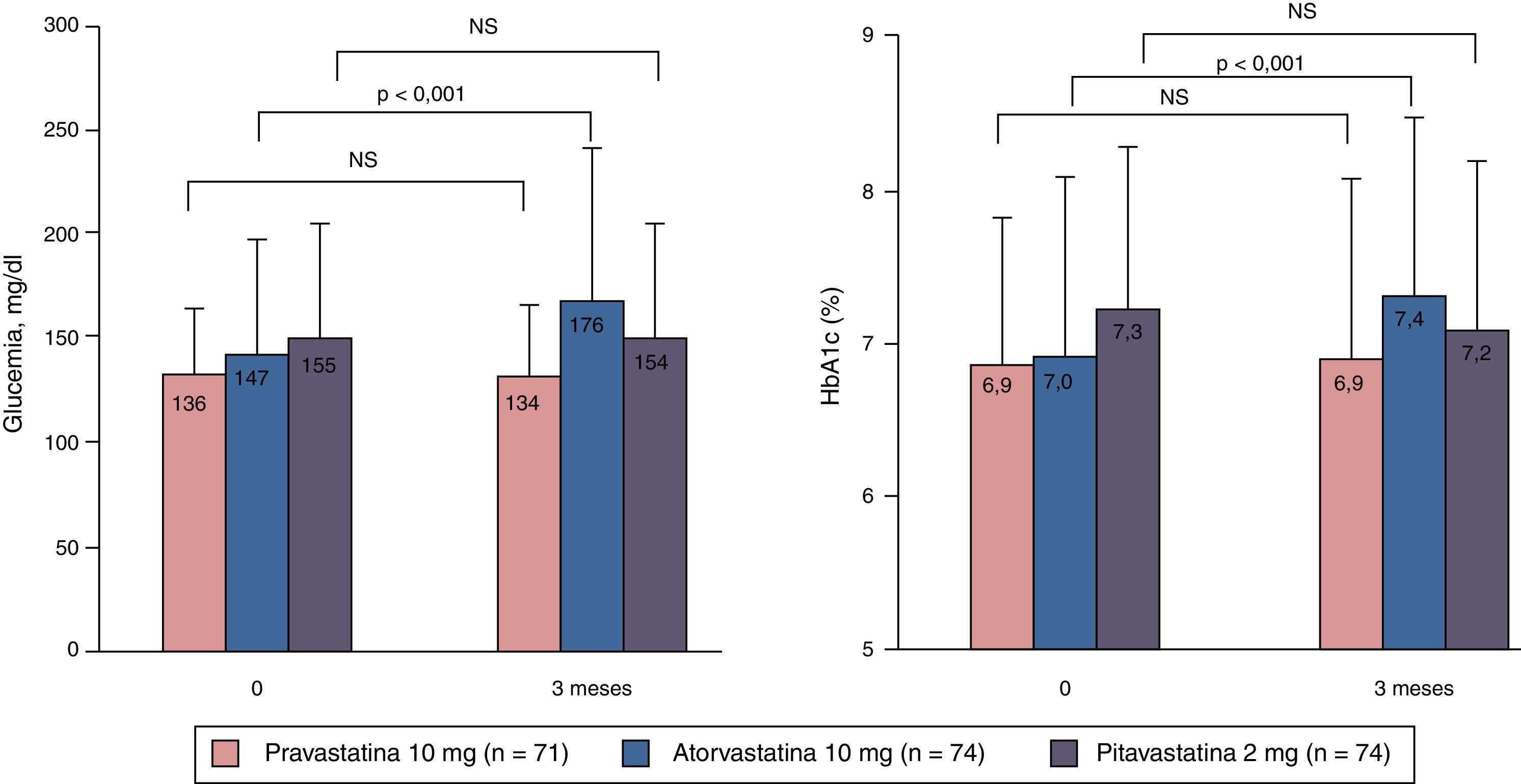
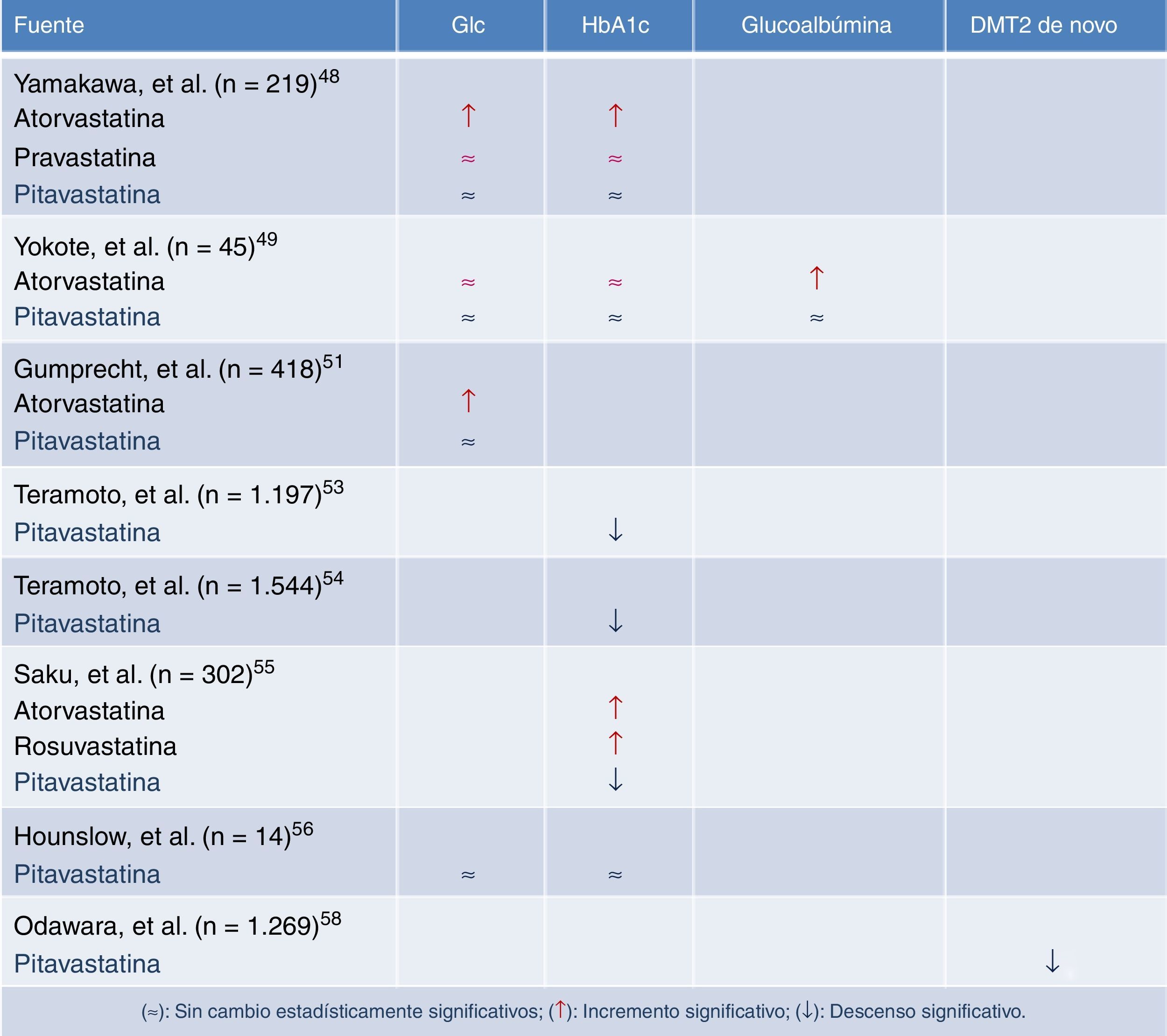
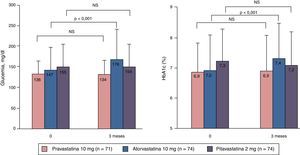
Las estatinas en los pacientes dislipémicos con síndrome metabólico y/o diabetes francaUno de los primeros estudios que abordaron los efectos de las estatinas sobre el metabolismo de la glucosa48, comparó los efectos de atorvastatina 10mg, pravastatina 10mg y pitavastatina 2mg en el control glucémico y los niveles de HbA1c en pacientes diabéticos desde el inicio del tratamiento hasta tres meses después. Para ello recogió de forma retrospectiva los datos de pacientes con DM2 y dislipemia que hubieran empezado con cualquiera de las tres estatinas entre enero del 2000 y julio del 2006. De este modo se crearon tres grupos: grupo atorvastatina (99 pacientes), grupo pravastatina (85 pacientes) y grupo pitavastatina (95 pacientes). Se excluyeron del estudio aquellos sujetos con una variación mayor del 10% en sus niveles de HbA1c, variaciones en los fármacos antidiabéticos o que recibieron educación diabetológica de novo durante los tres meses previos a la inclusión. El número de sujetos que finalmente se incluyeron en el análisis estadístico fue de 74 en el grupo atorvastatina, 71 en el grupo pravastatina y 74 en el grupo pitavastatina. No se observaron diferencias significativas en las dosis de los antidiabéticos utilizados durante el período de seguimiento. Sin embargo, los niveles de glucosa medios tomados al azar se incrementaron en el grupo atorvastatina de 147± 51mg/dl a 176 ± 69mg/dl (p<0,001), siendo el incremento mínimo en los grupos pravastatina y pitavastatina. Asimismo, la HbA1c aumentó de 7,0 ± 1,1% a 7,4 ± 1,2% (p<0,001) en el grupo atorvastatina, sin que se apreciasen cambios significativos en los grupos pravastatina y pitavastatina (fig. 4). Los autores concluían que la pitavastatina es una molécula tan eficaz como la atorvastatina en la reducción de las concentraciones de cLDL, pero a diferencia de esta última, con una influencia positiva en el metabolismo de la glucosa. Estos hallazgos sugieren que mientras que algunas estatinas se asocian con el deterioro del control glucémico, la pitavastatina tiene un efecto neutro, posiblemente beneficioso, efecto que cabe tener muy en cuenta en los pacientes con DM2 o en riesgo de desarrollarla como es el caso de los pacientes con síndrome metabólico.
Cambios de la glucosa plasmática en ayunas y de la HbA1c a los tres meses de iniciar el tratamiento con una estatina. Modificada de Yamakawa et al.48.
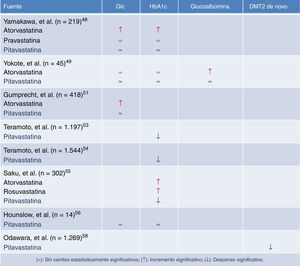
Sin embargo, el estudio de Yamakawa adolecía, no solo de ser retrospectivo, existían ya desde el inicio diferencias significativas con respecto a la terapia hipolipemiante previa al inicio del período de estudio, ocasionando un sesgo de inclusión entre los tres grupos. Por lo tanto, dicho estudio aportaba un bajo nivel de evidencia. En consecuencia, poco después Yokote et al.49,50 presentó un subanálisis del control glucémico del estudio CHIBA, comparando diversos parámetros de control glucémico al inicio y a los tres meses, en 23 pacientes diabéticos que recibieron pitavastatina 2mg y 22 con 10mg de atorvastatina. Los pacientes de ambos grupos presentaban perfiles lipídicos similares y después de 12 semanas de tratamiento mostraron incrementos significativos en los niveles de HbA1c en el grupo tratado con atorvastatina (p<0,026), sin que existiera elevación en el grupo tratado con pitavastatina.
Más recientemente, Gumprecht et al.51 comparaba en estudio clínico de fase 3, randomizado, doble-ciego y multinacional, la eficacia y seguridad de la pitavastatina 4mg frente a atorvastatina 20-40mg en pacientes con DM2 y dislipemia mixta. En el estudio se incluyeron 418 pacientes de distintas etnias y alto riesgo cardiovascular que fueron randomizados con una relación 2:1 a un grupo de tratamiento con pitavastatina 4mg (n= 279) o a otro de atorvastatina 20mg (n= 139) durante tres meses, y posteriormente se ofrecía la posibilidad de incrementar el período de seguimiento con la misma dosis de pitavastatina, atorvastatina 40mg si los objetivos de cLDL no eran adecuados según el NCEP-III. Hubo una reducción similar de cLDL próxima a un 40% en ambos grupos. Tampoco se observaron diferencias en otras variables lipídicas como en c-no-HDL, cHDL o triglicéridos. La incidencia de efectos secundarios o de alteraciones de laboratorio (elevación de AST/ALT > 3 de los valores de la normalidad o de CPK > 5) fueron similares con los dos tratamientos. Mención aparte merece el control glucémico. En el análisis de los niveles medios de glucosa se observó cómo en el grupo con atorvastatina se incrementaban los niveles de glucosa en 9,2mg/dl a las 12 semanas (7,2%; p<0,05) mientras que con pitavastatina no se apreciaba esta elevación significativa (aumento de un 2,1%). Por lo tanto en este estudio señalan la similitud en la eficacia de la pitavastatina frente a la atorvastatina, pero su mejor comportamiento en el control glucémico.
En el estudio LIVES (Livalo Effectiveness and Safety) con pitavastatina52, que se realizó en 19.925 pacientes japoneses con un seguimiento a más de dos años, se confirmaron las principales características de este fármaco: es decir, efectos comparables a atorvastatina en el porcentaje de reducción de cLDL, la capacidad de elevar de forma significativa el cHDL y su seguridad a largo plazo. De los 19.925 pacientes incluidos, 5.133 tenían DM2, y en 1.197 pudieron recogerse datos de HbA1c a las 104 semanas de seguimiento53. Cabe destacar que los pacientes diabéticos presentaban una reducción significativa en los niveles de HbA1c. Se pudo comprobar un descenso de los niveles de HbA1c en los pacientes tratados con pitavastatina y terapia antidiabética de 7,51% a 7,23% (p<0,001, n=992). Los cambios de la HbA1c en el grupo de diabéticos no tratados con fármacos para la diabetes no fueron apreciables, de 6,15 a 6,22% (p=0,13; n=205). El análisis multifactorial para identificar las causas que podían influir la mejoría en la HbA1c y el tratamiento con pitavastatina destacó los siguientes factores: la presencia/ausencia de terapia para la DM2, así como el porcentaje de cambio del cLDL y de los triglicéridos. En el análisis temporal, los niveles de HbA1c disminuyeron gradualmente un 0,28% en el periodo de 104 semanas (p<0,001) y un 0,4% en el periodo de seguimiento de 5 años (p<0,001)54. Aunque este cambio es de poca magnitud, es un hecho relevante y diferenciador con otras estatinas, como la rosuvastatina, pravastatina o atorvastatina. Una observación adicional del estudio LIVES hace referencia a que los pacientes que no recibieron tratamiento antidiabético y que mostraron una reducción de cLDL y triglicéridos son los que mostraron una disminución mayor en HbA1c. En este mismo sentido, en el estudio LIVES de extensión a 5 años de seguimiento52, los niveles de HbA1c descendieron desde niveles basales del 7,2% a niveles finales del 6,8%, observándose que a lo largo del primer año de tratamiento los niveles de HbA1c ya habían descendido del 7,2 al 7%.
Nuevas evidencias sobre el efecto más favorable de la pitavastatina en el control glucémico se pueden encontrar en otro estudio donde se comparó la eficacia hipolipemiante y la seguridad de pitavastatina, atorvastatina y rosuvastatina en pacientes hipercolesterolémicos de alto riesgo cardiovascular a lo largo de 16 semanas de seguimiento55. Del total de los 302 pacientes incluidos en el estudio, no se hallaron diferencias en la reducción del cLDL, ni de efectos secundarios. No obstante, se comprobó cómo atorvastatina y rosuvastatina incrementaban la HbA1c a lo largo del tratamiento, mientras que el grupo tratado con pitavastatina no se modificaba.
En el estudio CAPTAIN realizado en 14 varones entre 30 y 65 años con síndrome metabólico a los que se siguió durante 6 meses en tratamiento con 4mg/día de pitavastatina, no modificó significativamente los parámetros relacionados con el metabolismo de la glucosa, glucosa basal, índice HOMA, niveles de insulina, ratio insulina/glucosa y niveles de HbA1C56. A falta de grandes estudios «definitivos» con pitavastatina que evalúen la incidencia de DM2 de nueva aparición relacionados con el tratamiento de la estatina, se puso en marcha en abril de 2006 el estudio J-PREDICT en pacientes con tolerancia anormal a la glucosa (Japan PREvention Trial of Diabetes by PItavastatin in Patients with Impaired GluCose Tolerance)57, cuyo objetivo fue determinar prospectivamente si pitavastatina (1-2mg/día) en combinación con cambios del estilo de vida pueden reducir la incidencia de DM2, comparando con la sola modificación de hábitos en el estilo de vida. En el estudio participaron pacientes con una glucemia en ayunas > 126mg/dl y con una concentración plasmática a las dos horas tras una sobrecarga de 75g de glucosa de 140-199mg/dl, con una edad comprendida entre 30 y 74 años, cLDL entre 100-159mg/dl o colesterol total de 180-239mg/dl; y, además que presentaran uno o más de los siguientes criterios: glucemia en ayunas entre 100 y 125mg/dl; glucosa plasmática al azar entre 120-199mg/dl; HbA1C entre 5,9 y 6,4%, o que presentaran dos o más de los siguientes criterios: historia familiar de diabetes (familiares de segundo grado); IMC ≥24kg/m2; presión arterial sistólica ≥110mm Hg o diastólica ≥85mm Hg o en tratamiento con antihipertensivos; - TG ≥150mg/d o HDL <40mg/dl45.Los cambios en el peso y el IMC no mostraron diferencias significativas entre los grupos; pero sí una diferencia altamente significativa dentro de cada grupo con respecto al valor basal (p<0,001).En cuanto al objetivo primario del estudio, la incidencia acumulada de diabetes se redujo un 18% con la administración de pitavastatina comparado con el grupo control (OR 0,82; IC 95%: 0,68-0,99; p=0,041)58.
Otras revisiones cualitativas también permiten concluir que la pitavastatina podría ser una alternativa terapéutica de elección en pacientes con intolerancia a la glucosa o DM259 o, que, al margen de su eficacia en la reducción del cLDL, es la que induce una mayor elevación del cHDL, no deteriora el control glucémico en el paciente diabético o lo mejora, especialmente en personas con riesgo elevado de desarrollar DM2, como es el caso de los pacientes con síndrome metabólico60.
Basándonos en estos resultados, parece oportuno señalar que existen diferencias a considerar entre las distintas estatinas con respecto al riesgo de desarrollar DM2 (fig. 5).
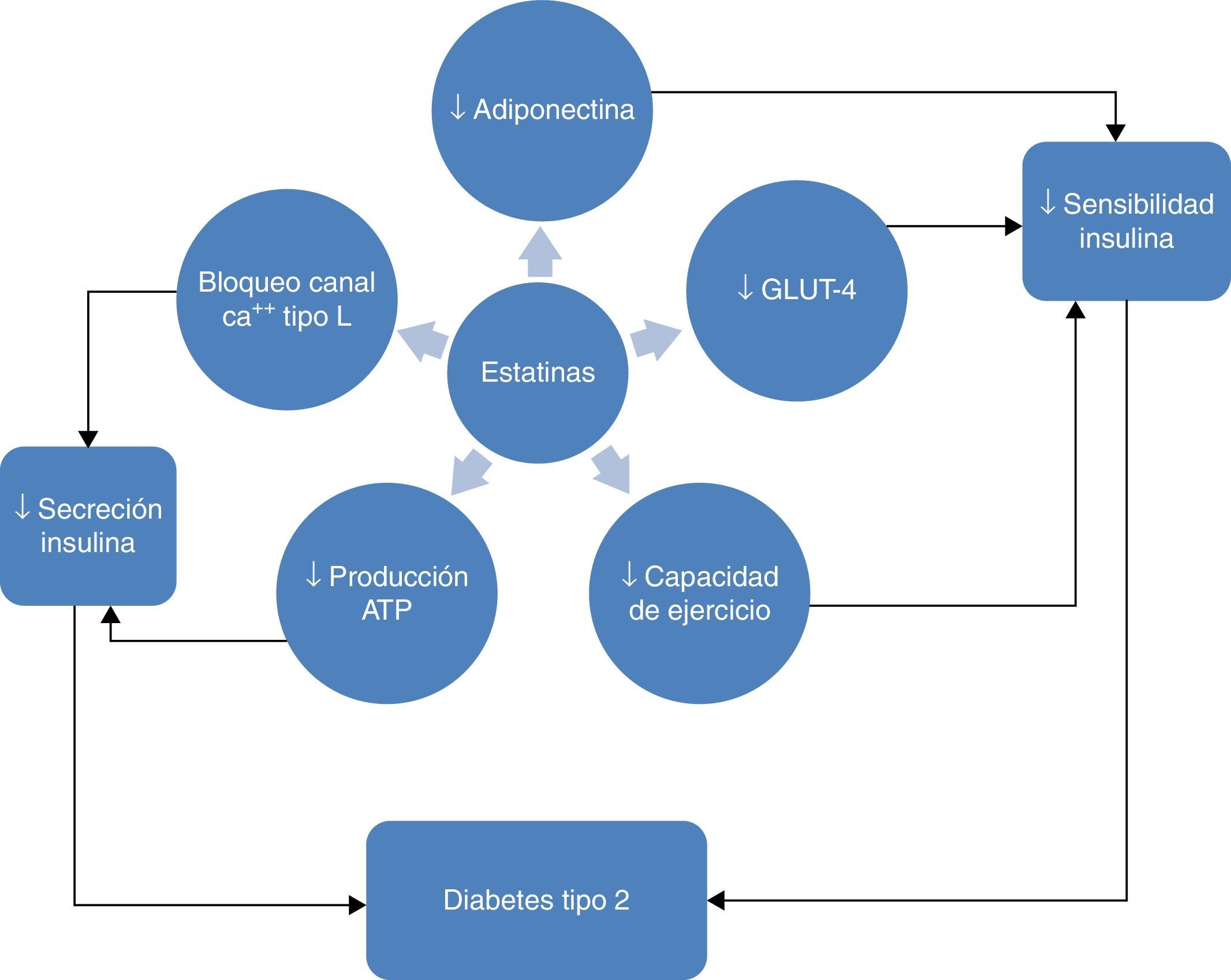
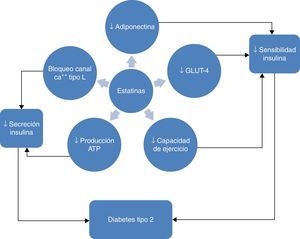
El hecho diferencial que se observa con pitavastatina se puede explicar a partir de los estudios con animales de experimentación que demuestran que pitavastatina disminuye la resistencia a la insulina e incrementa la producción de adiponectina por parte de la célula adiposa, aumentando la expresión de ARNm de adiponectina y αP2 (FABP4) (fig. 6)61–63. Este mecanismo puede explicar el efecto positivo de pitavastatina sobre el metabolismo de la glucosa. Además, pitavastatina en este paciente de elevado riesgo de padecer DM2 o diabético, ha demostrado efectos clínico-analíticos relevantes sobre la dislipemia diabética con una reducción importante del cLDL, un incremento distintivo y mantenido en el tiempo del cHDL, y un descenso medio de los triglicéridos.
ConclusionesLos grandes metaanálisis, estudios post hoc y estudios genéticos, han mostrado que las estatinas pueden aumentar el riesgo de diabetes de nueva aparición, especialmente en pacientes con predisposición metabólica. La dosis y la duración del tratamiento también pueden contribuir a este efecto, aunque el mecanismo todavía no quede claro. De entre las estatinas, solo la pravastatina y la pitavastatina no deterioran los parámetros glucémicos en pacientes con o sin DM2.
De las evidencias actuales se puede concluir que la pitavastatina, a diferencia de otras estatinas, no tiene un efecto desfavorable sobre los parámetros glucémicos. Por tanto, la pitavastatina podría ser de utilidad en los pacientes con DM2 y sobre todo en los que sin ser diabéticos tienen mayor riesgo de serlo, como ocurre en los pacientes con glucosa basal alterada o síndrome metabólico.
Aunque la práctica clínica no debe de cambiar, habida cuenta que el efecto diabetógeno potencial no debe impedir el tratamiento hipocolesterolemiante porque el beneficio clínico cardiovascular supera, con creces, el riesgo absoluto de desarrollar diabetes, y hasta que podamos disponer de mayores evidencias, lo que sí cabe señalar es que la selección de una determinada estatina para tratar una hipercolesterolemia debería considerar tanto aspectos esenciales, como es su eficacia para reducir el cLDL, pero también su seguridad y efectos adicionales sobre el metabolismo hidrocarbonato y la eventual predisposición a padecer una diabetes, o su claro desarrollo.
Conflicto de interesesEl Dr. Joan Rius es empleado a tiempo completo en ESTEVE. El resto de autores no tienen conflicto de intereses.
A los Profesores Juan Ascaso y Luis Masana por sus comentarios y revisión del manuscrito