Algunos de los efectos clínicos de los inhibidores de la HMG-CoA-reductasa (estatinas) pueden no ser estrictamente dependientes del descenso de colesterol y del cLDL. Estos efectos, ajenos al propiamente hipocolesterolemiante, se conocen como efectos pleiotrópicos.
En trabajos previos se ha demostrado que los efectos pleiotrópicos pueden tener como sustrato cambios en el comportamiento celular, valorando la movilidad y la adherencia celular. Ello, unido a los cambios en la tasa de proliferación celular así como la de apoptosis, obliga a pensar que algunos cambios estructurales pueden estar detrás de los efectos no estrictamente lipídicos.
En el presente trabajo se ha intentado valorar los cambios inducidos en el citoesqueleto cuando se incuban células de pared vascular con estatinas. Se han empleado fibroblastos y fibras musculares lisas, y simvastatina y cerivastatina.
Nuestros resultados han permitido confirmar que las estatinas inducen modificaciones en las estructuras actínicas de la célula mediante el empleo de tinciones con inmunofluorescencia y empleando anticuerpos anti-actina.
Estos cambios podrían explicar las modificaciones celulares que se acompañan de variaciones en el comportamiento celular.
Some of the clinical effects of HMG-CoA-reductase inhibitors (statins) may not be strictly dependent on the decrease in cholesterols and LDL-cholesterol. These effects, which are not related to their lipid lowering properties, are known as pleiotropic effects.
In previous studies it has been shown that the pleiotropic effects may have changes in cell behaviour, assessing cell mobility and adhesion as substrate. That, along with the changes in the cell proliferation rate as well as apoptosis, leads to thinking that structural changes may be behind these not strictly lipid effects.
In the present study, an attempt has been made to evaluate the changes induced in the cytoskeleton when vascular wall cells are incubated with statins. Fibroblast and smooth muscle fibres, and simvastatin and cerivastatin have been used.
Our results have been able to confirm that the statins induce changes in the actin structures of the cell by using stains with immunofluorescence as well as anti-actin antibodies.
These changes could explain the cells changes that accompany the variations in cell behaviour.
Aunque el efecto más conocido y de aplicación en la práctica clínica diaria de las estatinas es su capacidad para inhibir la síntesis de colesterol intracelular gracias a la inhibición selectiva de la HMGCoA-reductasa hepática, lo que condiciona su potente efecto hipocolesterolemiante merced a la sustancial y significativa reducción de los niveles de cLDL, a medida que se han empleado en grandes estudios de intervención farmacológica ha sido posible identificar otros efectos, probablemente no relacionados directamente con la disminución de las cifras de colesterol.
De esta manera se han venido definiendo los que se conocen como efectos «pleiotrópicos», que se añaden a los estrictos beneficios clínicos sobre la reducción de la morbimortalidad de origen cardiovascular, en estudios tanto de prevención primaria como secundaria1. El alcance de los efectos pleiotrópicos es de tal interés y diversidad que ha explicado, al menos en parte, algunas de las acciones de las estatinas con potencial aprovechamiento: efecto antiinflamatorio, modulador de la quimioterapia, frente a la osteoporosis o frente a la demencia, incluyendo la enfermedad de Alzheimer2.
Probablemente tales efectos pleiotrópicos tienen lugar gracias al efecto de las estatinas sobre otros órganos diferentes al hígado, y se encuentran relacionados con la biodisponibilidad del fármaco, la permeabilidad de la membrana y la potencia de los metabolitos activos3. Además puede ser determinante la naturaleza intrínseca de la molécula considerada, puesto que la «familia» de las estatinas tiene 2 grandes ramas que se diferencian por su facilidad o mayor dificultad para atravesar las membranas celulares. Esta propiedad —o lo que es lo mismo, la naturaleza lipofílica mayor o menor de cada estatina— es un rasgo diferencial importante a la hora de poder evaluar los diferentes efectos pleiotrópicos. Lo mismo que puede serlo el origen de la molécula: fermentación fúngica en el caso de la pravastatina, la lovastatina y la simvastatina, o la síntesis química en el caso de la atorvastatina, la fluvastatina, la rosuvastatina, la pitavastatina y la cerivastatina3.
El estado actual del conocimiento permite asegurar que las estatinas corrigen las anomalías lipídicas, particularmente los niveles elevados de colesterol total y de cLDL, y que además esta corrección se acompaña de una disminución de la mortalidad cardiovascular, e incluso de la mortalidad total4. Y que esto ocurre así tanto en prevención primaria como secundaria y a cualquier nivel de riesgo cardiovascular. Adicionalmente se ha podido comprobar que tales efectos se acompañan de estabilización de la lesión aterotrombótica y, eventualmente, de una regresión de las lesiones arterioscleróticas. Son precisamente estos efectos los que parecen ser la consecuencia del beneficio extra observable sobre el descenso del colesterol.
Las razones que explicarían la capacidad de las estatinas para estabilizar la lesión aterotrombótica y la menor progresión y/o menor progresión de la lesión vascular arteriosclerótica, se deben encontrar relacionadas con su efecto antioxidante, su capacidad para mejorar la disfunción endotelial, la inhibición de ciertos mediadores inflamatorios, la inhibición de la proliferación celular, la inducción de apoptosis celular y la modificación de factores hemostáticos5. Adicionalmente, y de forma insospechada durante la fase de desarrollo de los fármacos, se han constatado efectos cardioprotectores6.
En el presente estudio nos hemos planteado, una vez conocidos los cambios en el comportamiento celular7, descritos en un trabajo precedente, si tales cambios pueden tener un origen estructural en cambios inducidos por las estatinas en el citoesqueleto. De esta manera se ha intentado dilucidar si se producen modificaciones en la estructura de la actina de la célula, que pudiera ser puesta en relación con los cambios encontrados in vitro en los cultivos celulares.
Material y métodosLas técnicas de cultivo celular, las soluciones y los medios de cultivo han sido descritos previamente8.
Se han empleado cultivos celulares de fibroblastos humanos y de fibras musculares lisas. Los fibroblastos humanos proceden del cultivo primario de amígdalas hipertróficas recién extirpadas. Las amígdalas extirpadas se recogieron en solución salina equilibrada de Dulbecco, suplementada con 200UI/ml de penicilina, 200μg/ml de estreptomicina, 32μg/ml de gentamicina y 40UI/ml de nistatina. Se obtenían mediante sucesivos pases con tripsina y transferencia de las suspensiones celulares a tubos de centrífuga. Finalmente se eliminaron los residuos groseros filtrando la suspensión a través de varias capas de gasa estéril. Se sedimentaron las células centrifugando 10min a 125×G a temperatura ambiente. Se descartó el sobrenadante y se suspendieron las pellas en medio R5a de Iwakata suplementado con suero bovino fetal al 10%, penicilina 100UI/ml, estreptomicina 100μg/ml, gentamicina 16μg/ml y nistatina 20UI/ml. La siembra se realizó utilizando frascos de mucha superficie, a razón de 46.800 células viables por cm2 en medio R5a de McCoy modificado por Iwakata suplementado con suero bovino fetal 10% y antibióticos. Cuando los cultivos estaban en pleno crecimiento logarítmico y en fase confluente laxa se recogieron las células, desprendiéndolas con tripsina al 0,2%, y se prepararon viales conteniendo diferentes volúmenes de suspensión. Los viales para congelación se prepararon conteniendo 2,4×106 células con el medio de mantenimiento suplementado con 7% de dimetilsulfóxido. Los fibroblastos así obtenidos mantienen su capacidad proliferativa a lo largo de unos 15pases consecutivos. A partir de entonces, las células adoptan propiedades y morfología de fibroblastos senescentes. La misma línea celular se ha empleado en trabajos previos7.
Las células musculares lisas proceden de una línea previamente establecida por la American Type Culture Collection (ATCC) y fueron obtenidas a través de la European Collection of Cell Cultures (ECACC). La línea celular comercial previamente establecida fue obtenida en 19929. En nuestro laboratorio se obtuvieron a partir de la ECACC. Adaptamos las células a crecer en medio R5a de Iwakata. Las células TG/HA-VSMC son también células normales que prosperan como cultivos semicontinuos; mantienen su capacidad proliferativa a lo largo de 30-35pases sucesivos. A partir de ese momento disminuye su capacidad de crecimiento y las células se mantienen en estado estacionario7.
Se han ensayado la simvastatina y la cerivastatina. Las soluciones concentradas de estatinas han permitido solubilizar los principios activos a partir de la presentación en comprimidos. Se molturan los comprimidos; las estatinas liposolubles se solubilizan inicialmente en dimetil sulfóxido añadiendo posteriormente agua a partes iguales; las hidrosolubles se solubilizan primero en agua con adición posterior de dimetil sulfóxido también a partes iguales. Las soluciones se preparan ajustadas a concentración final de 2mg/ml de la estatina, y la solución de uso se realiza por dilución en medio de cultivo, utilizando como controles los solventes de la solución madre con el mismo factor de dilución.
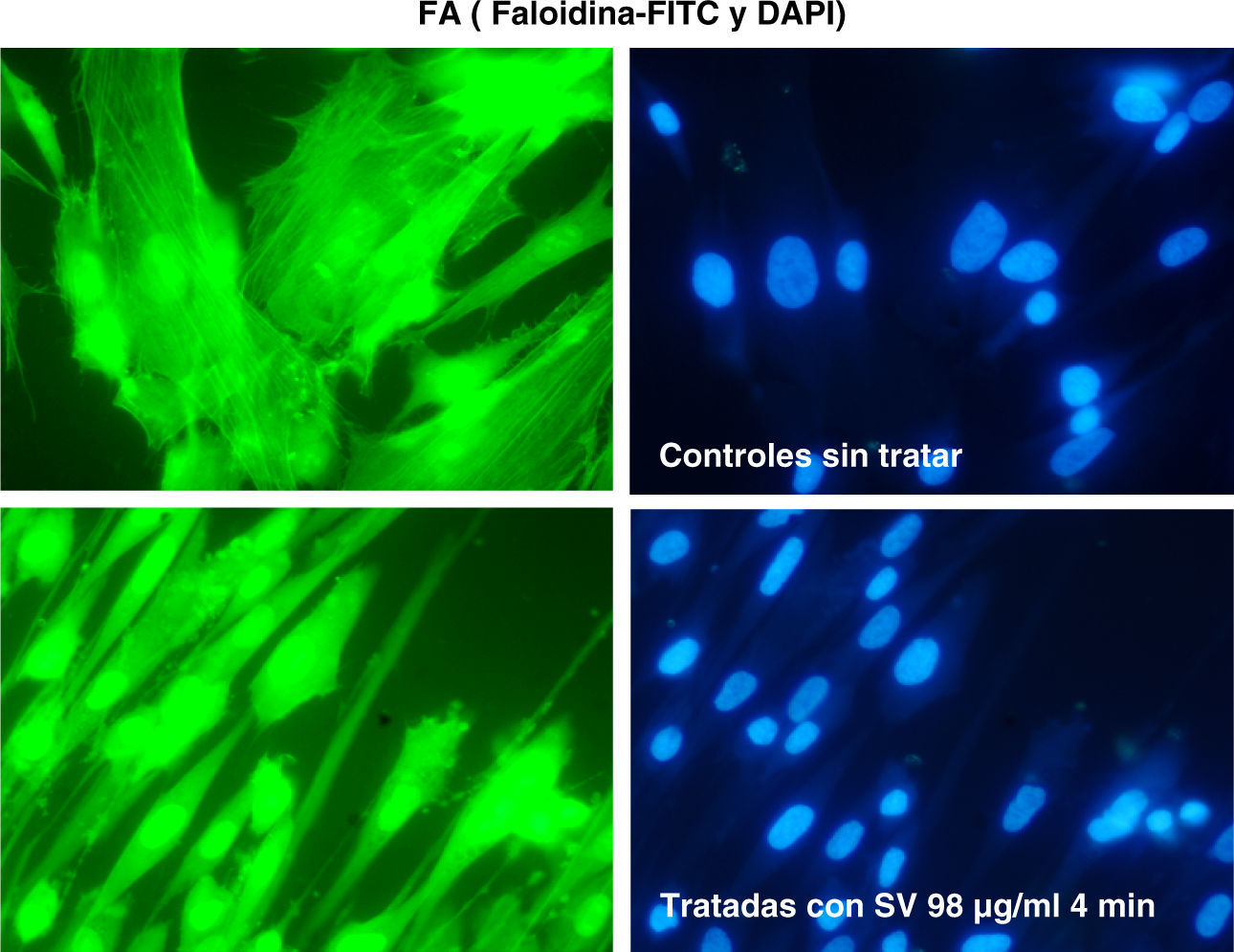
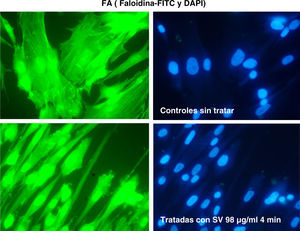
La tinción de las estructuras celulares de actina se ha realizado con inmunofluorescencia con faloidina (FITC y DAPI).
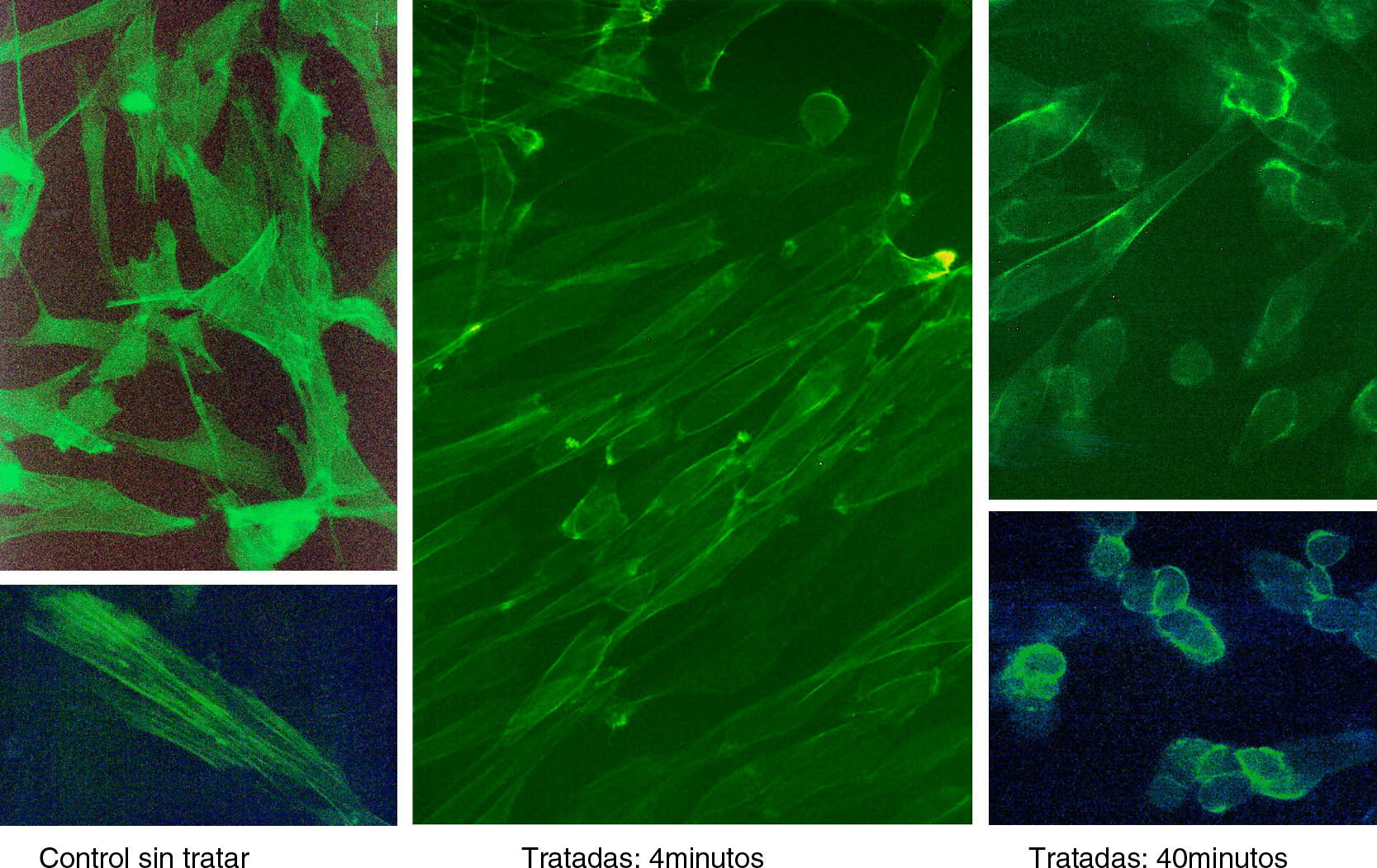
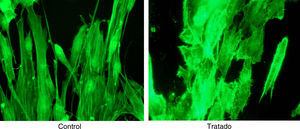
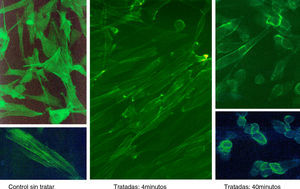
ResultadosLas figuras 1–4 muestran algunas imágenes del esqueleto celular, gracias a la tinción de los elementos de actina correspondientes al fibroblasto, antes y después del tratamiento con estatina.
Como se puede observar, la adición de simvastatina al medio provoca cambios significativos en la estructura de la actina celular, que se manifiesta por filamentos de actina más amorfos y con un cierto grado de condensación.
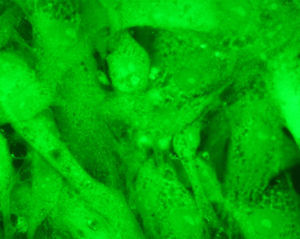
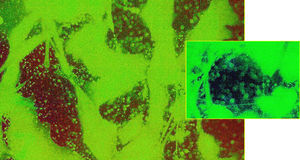
Los resultados empleando tinción con anticuerpos monoclonales han sido muy expresivos. En efecto, los anticuerpos anti-actina marcados con fluoresceína han permitido evidenciar (figs. 5 y 6) que, en efecto, la actina experimenta una desestructuración en su papel constituyente del citoesqueleto celular.
Mención expresa merece la desestructuración de la actina, muy llamativa, que se genera con la cerivastatina y que, de forma singular, se caracteriza por la formación de vesículas (fig. 6).
DiscusiónAlgunos estudios realizados en nuestro grupo5 han permitido estudiar el comportamiento celular y ultraestructural de células que intervienen en el proceso arteriosclerótico cuando son sometidas a un medio con diferentes concentraciones de estatinas. Se han realizado estudios morfodinámicos (con técnicas de microscopia digital de intervalos y de videointervalometría) en cultivos celulares de fibroblastos, monocitos, células endoteliales (HMEC-1) y células musculares lisas (TG/HA-VSMC), todos ellos sometidos a diferentes concentraciones de atorvastatina, fluvastatina, pravastatina y simvastatina. Se han estudiado particularmente los efectos de las estatinas en la proliferación celular, en la viabilidad celular y la inducción de apoptosis, así como en la adherencia y la movilidad celular.
Para valorar el efecto sobre la proliferación celular se determinó la dosis inhibitoria 50 (DI50) de las diferentes estatinas en las diferentes células. En todos los casos se produjo una inhibición de la proliferación celular, más acusada con la fluvastatina y menos llamativa con las restantes. También de forma sistemática se observó la reversibilidad del efecto cuando se añadía mevalonato a dosis de 20μg/ml. Es preciso señalar que cada estirpe celular muestra una sensibilidad distinta a cada una de las estatinas, lo que puede explicar el diferente espectro tanto in vitro como in vivo.
La apoptosis celular se ha estudiado ampliamente bajo el efecto de las estatinas. Nosotros lo hemos hecho mediante intervalometría e inmunofluorescencia. En todas las células estudiadas se produce un incremento de la muerte celular tras la adición al medio de la correspondiente estatina. Recíprocamente, disminuye la tasa de apoptosis cuando la estatina es retirada del medio de cultivo.
Sin embargo, aunque los efectos sobre las distintas estirpes celulares suelen ser los mismos, no todas las estatinas provocan la misma intensidad de tales efectos, ni se consiguen con las mismas concentraciones. Un punto que siempre se ha de considerar es si los efectos comprobados in vitro se consiguen con dosis que son farmacológicamente activas en la clínica, o próximas a las de utilización clínica. En este sentido, la actividad comparada de las distintas estatinas nos permite observar que la actividad antiproliferativa es superior con la fluvastatina que con el resto10.
Adicionalmente, el espectro de estirpes celulares sensibles a los efectos de las estatinas también es variable, alcanzando a ciertas estirpes tumorales11.
En los estudios con microscopia de fluorescencia observamos que buena parte de los efectos desplegados por las estatinas sobre la proliferación y la movilidad celular están estrechamente relacionadas con los procesos que intervienen en la polimerización-despolimerización de la actina, y en este sentido se han descrito a nivel molecular rutas convergentes que podrían ser fundamentales para comprender las interacciones de las señales modificadas por las estatinas: La estimulación del receptor de antígeno de las células T da lugar a la activación de la tirosín-cinasa Zap70, que a su vez induce la fosforilación y la activación de la oncoproteína Vav. Esto conlleva la estimulación de la GTPasa Rac1 y la activación de un estimulador de Ras, el intercambiador de nucleótidos RasGRP1. La activación de RasGRP1 por la ruta de Vav/Rac1 se debe a la convergencia de 2 señales: la estimulación de la fosfolipasa C-gamma1 y la inducción de la polimerización de actina. Estas 2 señales provocan la translocación efectiva de RasGRP1 hacia regiones proximales a la membrana, que es donde está localizado Ras12.
Algunos trabajos han descrito la inducción de resistencias al tratamiento con estatinas13,14.
FinanciaciónTrabajo financiado por la Beca Pfizer otorgada por la Fundación Española de Arteriosclerosis-Sociedad Española de Arteriosclerosis. Convocatoria 2007.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.