Los nuevos marcadores de riesgo vascular constituyen un grupo de herramientas que pueden ser consideradas de utilidad en la reclasificación de pacientes situados en riesgo cardiovascular intermedio, ya que el uso de las escalas de riesgo de las enfermedades cardiovasculares que tienen como base la aterosclerosis (Framingham, REGICOR, SCORE, etc.) no explican completamente la aparición de dichas enfermedades. La detección de estos pacientes implicaría un control más intenso de los factores de riesgo establecidos y, por tanto, es de esperar una disminución en la aparición de las manifestaciones clínicas de la enfermedad aterosclerótica, todavía primera causa de muerte en los países desarrollados. En el presente trabajo se revisan los marcadores implicados en la aparición de la enfermedad aterosclerótica, con especial detenimiento en los que pueden modificar la estratificación del riesgo en los pacientes, sobre todo los situados en el riesgo intermedio.
The new cardiovascular risk markers are a group of tools that can be considered useful in the reclassification of patients at intermediate-risk, since the use of risk scales of cardiovascular disease that are based on atherosclerosis, such as the Framingham, REGICOR, SCORE, etc., risk scores, do not fully explain the appearance of these diseases. The detection of these patients would imply a stronger control of the classic risk factors, and therefore we can expect a decrease in the appearance of clinical manifestations of atherosclerotic disease, still the leading cause of death in developed countries. In this article we review the markers involved in the development of atherosclerosis, with particular scrutiny on those that can modify the risk stratification of patients, especially those at intermediate-risk.
En la actualidad, los factores de riesgo (FR) cardiovascular (FRCV) bien establecidos y utilizados para calcular el riesgo cardiovascular (RCV) en un paciente determinado pueden no estar presentes entre el 101 y el 50% de los casos de enfermedad cardiovascular (ECV) acontecida2, y por tanto, no explicar completamente la aparición de la ECV3, lo que representa una importante limitación. Numerosos estudios han mostrado nuevos factores sensibles y específicos que pueden contribuir tanto a explicar esta diferencia o parte de ella, como a mejorar nuestra habilidad para predecir el RCV global, especialmente en pacientes de alto riesgo. Para que estos nuevos factores presenten relación causal con la aterosclerosis, deben cumplir los criterios de causalidad de Sir Austin Bradford Hill (al menos los más sólidos): fuerza de la asociación (cuanto más alejado esté el riesgo relativo [si esta es la medida de asociación utilizada] de 1, más fuerte es la asociación y menos probable es que esta asociación esté justificada por un sesgo), consistencia (repetición de la asociación en diferentes personas y lugares), precedencia temporal de la causa, asociación independiente de otros FR, el FR debe presentar plausibilidad biológica así como gradiente dosis-respuesta, y que la modificación del FR (en caso que sea modificable) se siga de una disminución del riesgo de enfermedad.
Nos referiremos a estos factores como nuevos marcadores de RCV, también conocidos como factores de riesgo emergentes, los cuales, aun insuficientemente establecidos, pueden influir en el desarrollo de la aterosclerosis —y, por tanto, en la estratificación del riesgo— y cuyo peso podrá establecerse con el progreso de la investigación en curso4.
El objetivo de este estudio es describir los marcadores de riesgo más relevantes, sin incluir las técnicas de imagen, su influencia en el desarrollo de la aterosclerosis y si deben ser utilizados en la valoración de la predicción del riesgo de la ECV.
Marcadores de riesgo cardiovascular consideradosSeguidamente exponemos el orden que se seguirá en el presente estudio. Los 5 primeros apartados corresponden a los factores que podrían contribuir a facilitar la estratificación del riesgo del paciente y, con ello, la actitud preventiva o terapéutica.
- •
Aterosclerosis subclínica.
- •
Marcadores de inflamación.
- •
Homocisteína.
- •
Lipoproteína(a).
- •
Factores de riesgo genéticos.
- •
Otros marcadores de RCV.
Como es conocido, la detección de la enfermedad aterosclerótica en cualquier lecho vascular clasifica al paciente en la categoría del RCV más alto, por lo que cualquier FR presente será abordado como si de prevención secundaria se tratase, intensificando su control. Es decir, se trata de descubrir lesiones ateroscleróticas en individuos aparentemente sanos que las padecen, ya que están en una situación de alto riesgo de padecer ECV.
La detección de la aterosclerosis subclínica se realiza por diversas técnicas. Algunas son asequibles, como el índice tobillo-brazo (ITB), mientras que otras, como las que estudian la pared arterial (grosor íntima-media carotídeo, calcio en arterias coronarias, vasodilatación mediada por flujo, ecografía vascular con contraste, tomografía computarizada multidetector, resonancia magnética e imagen molecular), están menos disponibles o en estudio y son complejas5.
Asociación con la ECVEn este apartado nos referiremos, por su más fácil disponibilidad, al ITB. Los valores patológicos frecuentemente se encuentran asociados con cualquiera de los FR mayores. Así, en población española se ha encontrado en el 91,5% de los casos asociado al menos a un FR mayor (hipertensión, hipercolesterolemia, hábito de fumar o diabetes mellitus)6. Por otro lado, un ITB patológico ha demostrado recientemente ser un factor de riesgo independiente de mortalidad por todas las causas y del combinado morbilidad cardiovascular y mortalidad global7. Se considera patológico un valor menor de 0,9 y mayor de 1,4. Un valor superior a 1,4 indica que la calcificación puede estar presente en las arterias8, y este valor predice la mortalidad por ECV y por todas las causas con la misma intensidad que un valor <0,909.
Importancia clínicaLa determinación del ITB se considera muy útil para la estratificación del riesgo, complementado a los FRCV tradicionales en pacientes con RCV intermedio (entre el 10 y el 20% según clasificación del estudio de Framingham o entre el 3 y el 4% si se utiliza el sistema SCORE)10, ya que su detección asintomática identificaría a sujetos con riesgo elevado. De acuerdo con nuestros resultados, en tanto no se disponga de evidencia de la eficacia de un cribado, se debería medir en todos los pacientes ≥70 años, dada su alta prevalencia y considerar la edad ≥50 años, ya que a esta edad comienza a elevarse la prevalencia de la enfermedad arterial periférica medida por este método4,5,7,11, sobre todo en diabéticos.
Marcadores de inflamaciónLa inflamación está presente en el proceso aterosclerótico. Desde un punto de vista fisiopatológico, en todos los estadios de este proceso (inicio, crecimiento y complicación de la placa aterosclerótica) puede considerarse como una respuesta inflamatoria al daño endotelial, de modo que cada paso en el proceso aterosclerótico implica a moléculas bioactivas características de la inflamación12. Es decir, puede considerarse a la aterosclerosis como una enfermedad inflamatoria que ocurre como respuesta al daño endotelial13.
Por tanto, para identificar y medir estos biomarcadores en la sangre se han realizado numerosas investigaciones y otras están en marcha. Así, podemos considerar marcadores inflamatorios con características predictoras de riesgo cardiovascular los siguientes:
- •
Moléculas de adhesión (molécula de adhesión intracelular 1 [ICAM-1], molécula de adhesión vascular 1 [VCAM-1], selectina-E, selectina P).
- •
Citocinas (interleucinas 1β, 6, 8 y 10 y factor de necrosis tumoral α [TNF-α]).
- •
Reactantes de fase aguda:
- –
Fibrinógeno.
- –
Amiloide A.
- –
Proteína C reactiva.
- –
- •
Recuento leucocitario.
Uno de los principales problemas de estos biomarcadores es la medición de los valores y sus puntos de corte en las determinaciones analíticas. Para que estos FR puedan ser utilizados se ha considerado: estabilidad del análisis, disponibilidad comercial, estandarización (permite la comparación de los resultados) y precisión (medida por el coeficiente de variación [CV]).
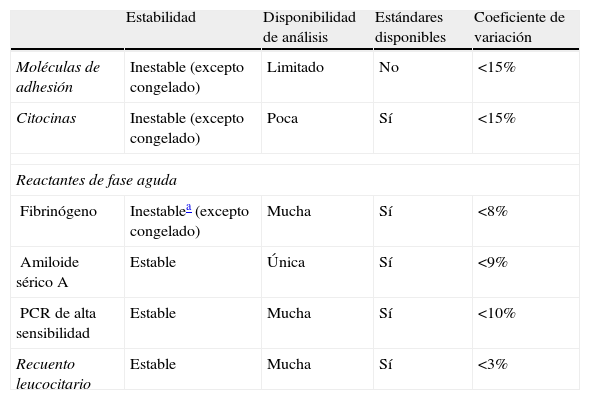
En la tabla 1 se exponen las características de los análisis disponibles de los marcadores de inflamación, y se puede observar que los reactantes de fase aguda presentan aceptables CV. Tanto la determinación de las moléculas de adhesión como de las citocinas presentan imprecisión, pobre estandarización en el caso de las moléculas de adhesión y problemática estandarización en el caso de las citocinas, motivos por los que son excluidas para ser consideradas de uso rutinario en el laboratorio clínico. El fibrinógeno es relativamente inestable, y si no se analiza inmediatamente debe ser rápidamente separado de las células y congelado. El amiloide sérico A presenta un único análisis nefelométrico comercial disponible, utilizado solamente para investigación. La proteína C reactiva de alta sensibilidad (PCRs) o PCR ultrasensible puede ser determinada por varios métodos (radioinmunoensayo, inmunonefelometría, inmunoturbidimetría, inmunoluminometría y ELISA). Su determinación presenta ventajas sobre los marcadores citados anteriormente: a) es muy estable: las muestras sanguíneas son estables 3 días a temperatura ambiente, 7 días refrigeradas y mayor tiempo si están congeladas; b) algunos métodos de determinación automática son comercialmente asequibles, y c) para estandarización de la calibración de los kits hay material sérico de referencia disponible. Todo ello hace que el mejor marcador en la actualidad desde el punto de vista del análisis en laboratorio sea la PCRs14.
Características analíticas de los marcadores de inflamación
| Estabilidad | Disponibilidad de análisis | Estándares disponibles | Coeficiente de variación | |
| Moléculas de adhesión | Inestable (excepto congelado) | Limitado | No | <15% |
| Citocinas | Inestable (excepto congelado) | Poca | Sí | <15% |
| Reactantes de fase aguda | ||||
| Fibrinógeno | Inestablea (excepto congelado) | Mucha | Sí | <8% |
| Amiloide sérico A | Estable | Única | Sí | <9% |
| PCR de alta sensibilidad | Estable | Mucha | Sí | <10% |
| Recuento leucocitario | Estable | Mucha | Sí | <3% |
Modificada de Pearson et al.12
Aunque se conoce desde hace tiempo que un recuento leucocitario elevado se ha asociado a un mayor RCV15, su utilidad presenta limitaciones (aumenta con el hábito de fumar y su elevación no es específica de la ECV, ya que está relacionado con muchas otras enfermedades). Aun así, en un metaanálisis realizado por Danesh et al.16 y comparando el primer tercil de la distribución de los leucocitos (tomado como referencia) con el último tercil, el riesgo relativo (RR) de presentar ECV fue 1,4 (IC 95%: 1,3-1,5).
FibrinógenoSe ha observado desde hace unos 30 años que concentraciones elevadas de fibrinógeno se han asociado con la ECV (enfermedad cardíaca coronaria [ECC] y accidente cerebrovascular [ACV]) como FR independiente17, y también con todas las causas de mortalidad en pacientes de ambos sexos después de ajustar por los FR estándar, situación observada recientemente en población española18. También de publicación reciente, en el estudio SIESTA, junto al NT-proBNP, han sido los dos únicos biomarcadores relacionados con la aparición de ECV durante el seguimiento19. En el metaanálisis de Danesh ya citado16, al comparar el primer tercil (tomado como referencia) de la distribución del fibrinógeno con el último, en 18 estudios tanto en prevención primaria como secundaria, el RR para desarrollar ECV fue de 1,8 (IC 95%: 1,6-2,0). Se considera hiperfibrinogenemia un valor de fibrinógeno >400mg/dl20.
Proteína C reactivaSintetizada en los hepatocitos como respuesta a las citocinas (interleucina 6), la proteína C reactiva puede incrementar sus concentraciones en suero hasta 100 veces, y aunque es conocida desde 1929, su uso ha estado restringido, como marcador poco específico, a las enfermedades infecciosas, enfermedades autoinmunes y cáncer21. Posteriormente, con el desarrollo del análisis ultrasensible, en estudios caso-control anidados se pudo mostrar que valores elevados de PCRs (intervalo 1-5μg/ml) aparecían en prevención primaria como un fuerte predictor de coronariopatía, infarto de miocardio, ACV y arteriopatía periférica después de ajustar por los tradicionales FR22. Valores elevados de la PCRs que también se han relacionado con el hábito de fumar23, la obesidad24 y confirmado con el ACV25 y enfermedad arterial periférica26.
Estas asociaciones se han resaltado en otro metaanálisis27 en el que tanto en prevención primaria como secundaria el RR de padecer ECC, comparando el primer tercil (referencia) con el último tercil de la distribución de la PCRs, fue de 1,9 (IC 95%: 1,5-2,3). Más adelante, en una actualización, ajustando por otros FR, los efectos de la PCRs fueron menores (RR: 1,45 [IC 95%: 1,25-1,68])28, y los autores atribuyeron estos moderados efectos a la aparición de nuevos estudios que, diseñados más específicamente, han demostrado menos consistencia de los efectos de la PCRs como predictor de la ECV. Esta disminución de la influencia de la PCRs en el metaanálisis citado28 muestra lo que suele suceder: que se sobreestime la magnitud del efecto de un nuevo FR en los estudios iniciales, hasta que posteriores estudios, mejor diseñados, se aproximan a su valor real29. En este sentido, aún queda por dilucidar el peso y la especificidad de este marcador, ya que no todos los estudios son concordantes: el estudio SIESTA19 no halló que la PCRs aportara información predictiva adicional, mientras que en el estudio de Zethelius et al.3, sí. El Grupo Multidisciplinario para el Estudio del Riesgo Cardiovascular aconseja su determinación en pacientes con riesgo intermedio30, y en este sentido, recientemente el estudio JUPITER ha mostrado un mayor beneficio en individuos asintomáticos con cifras de colesterol LDL (cLDL) <130mg/dl y PCRs >2mg/dl tratados con rosuvastatina, frente a los que no, y obtuvieron mejores resultados los sujetos que experimentaron un descenso conjunto de la PCRs y el cLDL31, lo cual indica que este biomarcador puede ser objeto de tratamiento farmacológico. Mientras el debate, aún de actualidad, se dilucida, en la práctica clínica las cifras de PCRs se clasifican en 3 categorías, clasificación basada en la distribución de este parámetro en la población (más de 15 estudios poblacionales y una inclusión de más de 40.000 personas): riesgo bajo: <1,0mg/l; riesgo medio: 1,0-3,0mg/l, y alto riesgo: >3,0mg/l. Valores >3,0mg/l, en ausencia de inflamación aguda, incrementan en 2 veces el RR de ECV comparado con el riesgo bajo32.
HomocisteínaLa homocisteína es un aminoácido formado durante la demetilación de la metionina, y en su metabolismo intervienen las vitaminas B2 (riboflavina), B6 (piridoxina), B12 (cobalamina) y el ácido fólico33. El 70% de ella circula por la sangre ligada a proteínas y el 30% en forma libre. La total (Hcy) se suele determinar en el plasma por enzimoinmunoanálisis, de modo automático, y se puede obtener en la mayoría de laboratorios, si bien la estandarización aún no se ha conseguido34. Sin embargo, la concentración de Hcy en plasma o suero es estable35 (4 días a temperatura ambiente, algunas semanas a 4¿C y años en plasma almacenado a –20¿C).
Son muchos los factores que influyen en la concentración de la Hcy36. La tabla 2 muestra estos factores y el grado de afectación en los valores plasmáticos de Hcy37. De ahí la dificultad de definir cuáles serían las concentraciones normales de Hcy. Aunque el valor de referencia se debe interpretar según la edad y el sexo, algunos autores consideran un único punto de corte, que en individuos con un buen estado vitamínico y hábitos de vida saludables estaría en 12μmol/l35,36. La variabilidad intraindividual anual total (biológica y analítica) en individuos sanos es del 8%, similar a la del colesterol total35.
Factores que influyen en los valores plasmáticos de la homocisteína total
| Factores | Efecto |
| Factores genéticos | |
| Homocistinuria | ↑↑↑ |
| Heterocigotos para la CβS | ↑ |
| Síndrome de Down | ↓ |
| Homocigotos MTHFR 677C→T | ↑ |
| Factores fisiológicos | |
| Aumento de la edad | ↑ |
| Sexo masculino | ↑ |
| Embarazo | ↓ |
| Posmenopausia | ↑ |
| Estilos de vida | |
| Ingesta de vitaminas (folato, B12, B6, B2) | ↓ |
| Tabaquismo | ↑ |
| Café | ↑ |
| Situaciones clínicas | |
| Deficiencia de folato | ↑ |
| Deficiencia de cobalamina | ↑↑↑ |
| Deficiencia de vitamina B6 | ↑ |
| Insuficiencia renal | ↑↑ |
| Deficiencia de hormona del crecimiento | ↑ |
| Trastornos hiperproliferativos | ↑ |
| Hipotiroidismo | ↑ |
| Hipertiroidismo | ↓ |
| Estadio temprano de diabetes | ↓ |
| Estadio tardío de diabetes | ↑ |
| Fármacos | |
| Antagonistas del folato (metotrexato, trimetoprim, anticomiciales, fenotiazinas) | ↑ |
| Antagonistas de la cobalamina (óxido nitroso, óxido nítrico, metformina) | ↑ |
| Antagonistas de la vitamina B6 (azaribina, niacina, teofilina) | ↑ |
| Producción de homocisteína (análogos de la adenosina, creatina, L-Dopa) | ↑ |
| Compuestos sulfidrilos (D-penicilamina, N-acetilcisteína, mesna) | ↓ |
| Estrógenos y tamoxifeno | ↑ |
| Andrógenos | ↑ |
| Otros | |
| Ciclosporina | ↑ |
| Diuréticos | ↑ |
| Fibratos (fenofibrato y bezafibrato, pero no gemfibrozil)33 | ↑ |
| Simvastatina | ↓ |
CβS: cistationina-β-sintasa; MTHFR: metilentetrahidrofolato reductasa; ↑: aumento moderado de homocisteína total (Hcy) (16-30μmol/l); ↑↑: aumento intermedio de Hcy (31-100μmol/l); ↑↑↑: aumento severo de Hcy (>100μmol/l)37; ↓: descenso de homocisteína total.
La hiperhomocisteinemia (HHcy) es considerada en la actualidad un factor de riesgo tanto de aterogénesis (en cualquier lecho vascular) como de trombogénesis38, puesto de manifiesto tanto en estudios transversales como de casos-control y prospectivos, si bien hay que reflejar que la fuerza de la asociación ha sido más débil cuando se ha tratado de estudios prospectivos, indicando con ello que la HHcy puede identificar la aterosclerosis, pero también refleja respuestas metabólicas e inflamatorias no predictoras de ECV39, además de que en los estudios prospectivos se parte de una población más sana36. Se ha encontrado asociaciones con ECC40, ACV41,42, insuficiencia cardíaca43, estenosis carotídea44, demencia y enfermedad de Alzheimer45,46, insuficiencia renal47 y complicaciones durante el embarazo y malformaciones congénitas48. Un estudio de base poblacional corrobora estos hallazgos, encontrando incrementos de la morbimortalidad CV y mortalidad por otras causas con niveles elevados de Hcy y asociación de niveles bajos de Hcy con adecuados niveles de folato y vitamina B12, incidiendo en la relación continua entre los valores de Hcy y los factores asociados sin un umbral de corte aparente49.
Igualmente, pacientes con HHcy severa (>100μmol/l) por causas genéticas que afectan al metabolismo de la Hcy presentan aterosclerosis prematura en todos los territorios vasculares arteriales, además de riesgo de trombosis venosa profunda y trombosis venosa recurrente39, así como relacionada con riesgo de ECV50.
De los estudios expuestos anteriormente38,39 se desprende que la HHcy es un FR independiente para la ECV y que la relación es lineal48. El mecanismo que podría explicar esta relación sería el efecto nocivo de la Hcy sobre el endotelio, sobre la modificación oxidativa de las lipoproteínas de baja densidad (LDL) y su actividad protrombótica, si bien se precisan estudios experimentales51,52.
De uno de los metaanálisis citados38, basado en estudios de cohortes, se infiere que la magnitud del descenso de la Hcy en 3μmol/l se asociaría a un descenso del 16% (11-20%) del riesgo de ECC, del 24% (15-33%) del riesgo de ACV y del 25% (8-38%) del riesgo de trombosis venosa profunda. En nuestro medio, el 15-17% de pacientes con tromboembolia venosa presentaban HHcy53. A la inversa, como hemos comentado anteriormente, un aumento de los niveles de Hcy se comporta como un FR para la morbimortalidad por ECV y para la mortalidad por otras causas, así como para enfermedades comunes (hipertensión arterial, dislipidemia…) y estilos de vida49. Es decir, la Hcy se puede considerar un factor pronóstico en ciertos grupos con un perfil de alto riesgo para ECV.
Importancia clínicaDado que la HHcy es sensible al tratamiento con ácido fólico y vitamina B12 (se puede lograr una reducción del 25% de la concentración de Hcy con un suplemento de 0,5-5,7mg de ácido fólico por día, incrementada en un 7% si se añaden 0,5mg diarios de vitamina B12 [0,02-1mg/día])37, podría pensarse que un descenso así obtenido de los niveles de HHcy prevendría la ECV.
En prevención primaria parece adecuado mantener una ingesta continuada de las vitaminas implicadas en la HHcy. Así, un seguimiento de 2.000 finlandeses durante 10años redujo el riesgo de infarto de miocardio a la mitad en el grupo que más folatos ingería54. De modo parecido, otro seguimiento de más de 40.000 varones sin ECV durante 14años disminuyó un 30% el riesgo de ACV en el grupo que también ingería más folatos55.
En prevención secundaria, en cambio, la adición de ácido fólico no parece producir el beneficio esperado. Según los resultados del estudio HOPE2, suplementos combinados de ácido fólico, vitaminas B6 y B12 no demostraron la reducción de muerte por causas cardiovasculares, infarto de miocardio y ACV frente a placebo, en pacientes con enfermedad cardiovascular establecida56, aunque la administración de ácido fólico sí mejoró la disfunción endotelial en pacientes con ECV de modo independiente a la reducción de la Hcy (incrementando la producción de óxido nítrico y eliminando los radicales superóxidos), atribuyendo con ello unos efectos pleiotrópicos al ácido fólico, además de su efecto sobre la HHcy57.
Del análisis de 12 ensayos clínicos se desprende que la fuerza de la asociación de la Hcy con el RCV es más débil de lo que se pensaba, y se espera que la prolongación de estos estudios en el tiempo aporte resultados fiables que relacionen la Hcy con el RCV58.
Lipoproteína(a)La lipoproteína(a) o Lp(a) es una partícula lipoproteica descubierta en 1963 por Kare Berg, que identificó una variante genética de la LDL que definió como un determinante genético al que llamó antígeno (a) de lipoproteína o Lp(a)59.
Químicamente, la Lp(a) está formada por una partícula de LDL y una glucoproteína llamada apo(a) que se encuentra unida a la apoB100 de la LDL por un puente disulfuro, es decir, es una partícula con un contenido lipídico similar a la LDL pero con un contenido proteico mayor, debido a que contiene un mol de apo(a) por mol de apoB100. El estudio de secuencia de aminoácidos y de bases del ADN apreció un alto parecido entre la apo(a) y el plasminógeno, e incluso los genes que codifican ambas proteínas, adyacentes en el cromosoma 6 humano, proceden de un gen ancestral común del que se diversificaron hace más de 80 millones de años60. La región terminal de la apo(a) (terminal carboxilo) es homóloga en un 94% al plasminógeno. Ambos están formados por unidades denominadas kringles (nombre tomado por su parecido estructural a un pastel de Dinamarca, llamado así, kringle), que en el caso del plasminógeno contiene 5 dominios (K1, K2, K3, K4 y K5) y el de la apo(a) presenta múltiples copias de K4 (de 12 a 50).
Esta homología (especialmente en el kringle 4), hace que la Lp(a) compita con el plasminógeno en su capacidad para unirse a la fibrina, cualidad que explicará algunas de las acciones de la Lp(a)1,61. El peso molecular de la apo(a) varía entre 187.000 daltons [para una apo(a) que contiene 12 kringles 4] y 662.000 daltons [para una apo(a) que contiene 50 kringles]62, variación debida a la presencia de una serie de isoformas cuyo peso molecular depende del número de dominios kringle 4 (más peso molecular cuanto más kringle 4) y del grado de glucosilación de la proteína. Se conocen al menos 6 isoformas de apo(a) clasificadas según su movilidad electroforética con respecto a la de la apo B100. La isoforma se llamaría B, cuando migra de modo similar a la apo B100, F (del inglés faster) si la movilidad es más rápida y S (del inglés slower) si la movilidad es progresivamente menor (S1, S2, S3 y S4). Tiene su importancia porque las isoformas con menor número de kringles 4 repetidos (F, B, S1 y S2) son las que más interfieren con la acción del plasminógeno y, por tanto, más se asocian a un mayor riesgo de ECC1.
Las concentraciones plasmáticas de la Lp(a) presentan una amplia distribución (entre 1mg/dl y 200mg/dl), atribuida en parte al polimorfismo genético de estas partículas y a su tamaño, presentando una relación inversa con el peso molecular de la apo(a). Estos niveles, en cada individuo, están determinados por factores genéticos en un 90%, quedando un margen de modificación de solo el 10%61. Se considera que existe un exceso de Lp(a) cuando la concentración plasmática supera los 30mg/dl.
El catabolismo de la Lp(a) no es bien conocido. Esta interactúa con baja afinidad con el receptor de las LDL, y en cambio es captada por los macrófagos (receptor scavenger) de la pared arterial, donde las partículas, especialmente las modificadas (principalmente por oxidación), son internalizadas63. Ambas vías no explican la degradación de la Lp(a) del plasma, por lo que se ha sugerido que podría representar un medio de transporte de las LDL a zonas de reparación de la pared arterial, aportando colesterol a los fibroblastos64 y permitiendo así su proliferación, hecho considerado como una ventaja selectiva en la evolución más que una intervención debida al azar, en opinión de Brown y Goldstein65.
Asociación con la ECVEl potencial aterotrombótico de esta lipoproteína es conocido: su incorporación a los macrófagos transforma a estos en células espumosas con liberación de citocinas, que a su vez estimulan la proliferación de las células musculares lisas en la pared arterial66, contribuyendo a la progresión de la placa de ateroma. Por su similitud con el plasminógeno, compite con este en su capacidad de unión a la fibrina, facilitando con ello los fenómenos trombóticos67.
Esta fisiopatología tiene su reflejo en estudios realizados (casi todos los estudios caso-control realizados han encontrado una fuerte asociación entre niveles elevados de Lp(a) y la ECC): un aumento de Lp(a) (>30mg/dl) se ha asociado de modo independiente a la arteriopatía periférica68, al ACV (excepto en hombres blancos)69 y a la reestenosis coronaria después de angioplastia y bypass coronario1. También ha resultado ser el FR que mejor discrimina la aparición de ECC en pacientes afectados de hipercolesterolemia familiar heterocigota después de ajustar por otros FR70; del mismo modo se ha asociado a patrones severos de aterosclerosis coronaria en individuos jóvenes71, y similar efecto ocurre cuando el aumento de la Lp(a) coincide con valores de colesterol transportado en las LDL (cLDL) superiores a 120-130mg/dl72.
Por otro lado, la persistencia de valores elevados de Lp(a) después de lograr un descenso importante del cLDL contribuye a un avance menor de la aterosclerosis y a un menor riesgo de ECC, postulándose que pacientes en el percentil 90 de la distribución de la Lp(a) no padecen un mayor RCV si se alcanza un control correcto de los valores del cLDL73.
Importancia clínicaPor todo lo expuesto, parece aconsejable una terapia hipocolesterolemiante más agresiva en presencia de niveles de Lp(a) elevados72. Relacionada con la ECC, un metaanálisis de 27 estudios prospectivos ha demostrado una moderada fuerza de asociación entre la Lp(a) y la ECC independiente de los FR establecidos, si bien quedan por dilucidar cuestiones como la asociación de los diferentes polimorfismos de la Lp(a) sobre la ECC, o la ausencia de ensayos clínicos que demuestren el beneficio de disminuir los valores plasmáticos de la Lp(a) con la menor incidencia de ECC74.
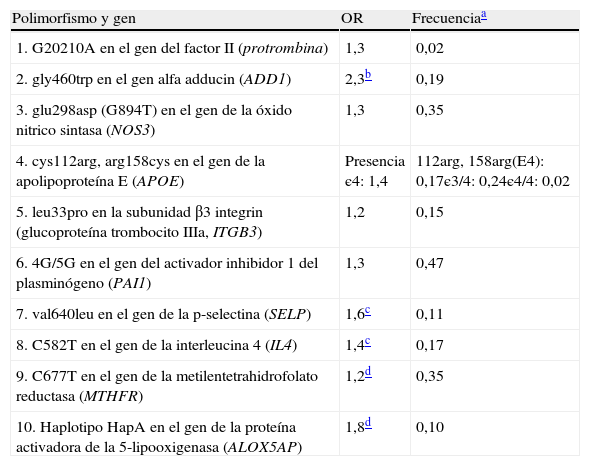
Factores genéticosYa es conocido que una historia precoz de ECV incrementa el riesgo de padecerla. Recientemente, esta relación ha sido establecida en 1,7 veces en mujeres y 2 veces en varones75, pero no debe ser considerada causa única de influencia genética. Polimorfismos genéticos que han demostrado estar implicados en la ECV han sido considerados FR emergentes por la International Task Force for Prevention of Coronary Heart Disease76. La tabla 3 refleja estos polimorfismos, la cual indica las mínimas condiciones precisas en su determinación como para ser incluidos en el manejo del RCV77.
Polimorfismos asociados con el desarrollo de la aterosclerosis
| Polimorfismo y gen | OR | Frecuenciaa |
| 1. G20210A en el gen del factor II (protrombina) | 1,3 | 0,02 |
| 2. gly460trp en el gen alfa adducin (ADD1) | 2,3b | 0,19 |
| 3. glu298asp (G894T) en el gen de la óxido nitrico sintasa (NOS3) | 1,3 | 0,35 |
| 4. cys112arg, arg158cys en el gen de la apolipoproteína E (APOE) | Presencia є4: 1,4 | 112arg, 158arg(E4): 0,17є3/4: 0,24є4/4: 0,02 |
| 5. leu33pro en la subunidad β3 integrin (glucoproteína trombocito IIIa, ITGB3) | 1,2 | 0,15 |
| 6. 4G/5G en el gen del activador inhibidor 1 del plasminógeno (PAI1) | 1,3 | 0,47 |
| 7. val640leu en el gen de la p-selectina (SELP) | 1,6c | 0,11 |
| 8. C582T en el gen de la interleucina 4 (IL4) | 1,4c | 0,17 |
| 9. C677T en el gen de la metilentetrahidrofolato reductasa (MTHFR) | 1,2d | 0,35 |
| 10. Haplotipo HapA en el gen de la proteína activadora de la 5-lipooxigenasa (ALOX5AP) | 1,8d | 0,10 |
OR: odds ratio para la aterosclerosis en portadores del alelo o haplotipo menos frecuente.
Modificada de Assmann et al.76
Ya no se discute la evidente relación entre la hipercolesterolemia (especialmente a expensas del cLDL) y la ECV. De hecho, las guías terapéuticas que tienen como objetivo el control de la hipercolesterolemia se basan en la concentración plasmática del cLDL. Pero resultados de estudios epidemiológicos y ensayos clínicos indican que la concentración plasmática de apolipoproteína (apo)B (única apolipoproteína de las LDL) es superior a la del colesterol total y del cLDL como indicadora de RCV (predice ECC prematura en dislipidemias genéticas78), ya que la determinación total de apoB refleja de una manera directa las lipoproteínas aterogénicas que la contienen (LDL y lipoproteínas de muy baja densidad [VLDL]). De hecho, un grupo de 30 expertos pertenecientes a 10 países abogan por su incorporación en todas las guías como un indicador de RCV, considerando que el límite debería estar en <80mg/dl en pacientes de alto riesgo y no en <90mg/dl, como está admitido en la actualidad79.
No obstante, su determinación está indicada como criterio diagnóstico de la hiperlipidemia familiar combinada1.
InfeccionesEstudios amplios han mostrado asociaciones entre agentes infecciosos de modo crónico como Helicobacter pylori, Chlamydia pneumoniae, citomegalovirus y ECC. Sin embargo, un metaanálisis que valoró la relación de C. pneumoniae, el agente infeccioso que más fuerte relación había demostrado con la ECC, no encontró esta asociación80, permaneciendo la misma incertidumbre largo tiempo planteada de si estos agentes pueden ser causa de la aterosclerosis o meros acompañantes del proceso inflamatorio81. Recientemente se ha observado que cultivos de células implicadas en la aterogénesis son fácilmente infectados por Chlamydia, y los autores indican que la misma puede estar relacionada con la aterosclerosis coronaria, si bien quedan importanes aspectos por dilucidar, incluido el tratamiento antiinfeccioso82.
Biomoléculas de origen cardíacoPéptido natriurético cerebral (BNP)De los tres péptidos natriuréticos conocidos (atrial o tipoA [ANP], cerebral o tipoB [BNP] y tipoC [CNP]), el BNP es el que mayor interés ha despertado83. El BNP, aislado inicialmente del cerebro porcino, deriva de una prohormona (proBNP) que se almacena en los gránulos secretores de los miocitos. Una vez liberada, por efecto de la proteasa furina se divide en el fragmento N terminal (NT-proBNP), molécula inerte, y BNP, molécula biológicamente activa, secretándose en una proporción 1:184. Ambos se encuentran sobre todo en los miocitos del ventrículo izquierdo, liberándose como respuesta a sobrecargas de presión o volumen, aunque también se han detectado en tejido auricular y ventricular derecho85. La vida media del BNP es de 18min y se elimina del plasma por endopeptidasas neutras y por receptores específicos. El NT-proBNP, al ser inerte, no tiene una eliminación activa, y su eliminación corresponde al riñón. Su vida media es de 60-120min, y presenta además una mayor estabilidad que el BNP después de la extracción sanguínea de la muestra86. Entre las funciones del BNP se puede citar la inhibición del sistema simpático y de la secreción de renina, angiotensinaII y aldosterona; produce vasodilatación, descenso de la presión arterial y estimula la secreción de sodio y agua84. Ambos péptidos alcanzan su mayor utilidad como biomarcadores, con utilidad diagnóstica y pronóstica de la insuficiencia cardíaca, única enfermedad cardiovascular cuya prevalencia e incidencia aumentan, constituyendo la principal causa de hospitalización en adultos mayores de 65 años86–88.
Aunque nuevos estudios están en marcha para establecer el peso de las determinaciones de los péptidos natriuréticos tipoB y el modo de introducción en la clínica habitual, también se ha observado que su inclusión en un modelo, conjuntamente con los FRC establecidos, proporciona una mejor predicción de la ECV en prevención secundaria89, también observado recientemente en el estudio SIESTA19, por lo que la información adicional del RCV de este biomarcador puede ser de interés en clínica.
Factor de crecimiento similar a la insulina tipo 1 (insulin-like growth factor tipe 1 [IGF-1])El IGF-1 y sus proteínas reguladoras se secretan por células del sistema cardiovascular. El IGF-1 se une a las proteínas de unión IGFBP permitiendo la unión con el receptor y, por tanto, la acción del IGF-1 (facilita la quimiotaxis de los macrófagos, la captación de cLDL y la liberación de citocinas proinflamatorias en el subendotelio). Alteraciones en este eje (IGF-1-IGFBP-proteasas de las IGFBP) pueden estimular la aterosclerosis coronaria85.
De una de las proteínas de unión (IGFBP-4) se ha aislado una nueva proteasa específica, una metaloproteasa con características proaterogénicas (pregnancy-associated plasma protein-A [PAPP-A] o proteína plasmática A asociada al embarazo), que podría ser un nuevo marcador de identificación de placas ateroscleróticas vulnerables, ya que se ha encontrado elevada en pacientes con angina inestable e infarto agudo de miocardio90.
Por tanto, moléculas de síntesis cardíaca emergen como esperanzadores marcadores cuya importancia y aplicación precisa en clínica aún está por definir.
LDL oxidadasLa oxidación de las LDL, una vez atravesado el endotelio vascular, hace que cambie su comportamiento biológico: se vuelven citotóxicas, quimiotácticas para los monocitos e inducen la expresión de algunas citocinas, como TNF-α o interleucina1. A su vez, son fagocitadas por los monocitos, transformándose en células espumosas y, por tanto, incrementando la aterogénesis91.
Las LDL oxidadas pueden ser medidas mediante técnicas directas, como el uso de anticuerpos monoclonales o autoanticuerpos contra las mismas, o técnicas indirectas, como la concentración plasmática y urinaria de isoprostanos y la determinación de la concentración sérica de dienos conjugados, técnicas de las que aún se desconoce su utilidad en clínica1.
LDL pequeñas y densasLa elevación de este tipo de lipoproteínas está asociada positivamente con el riesgo de ECC, y aunque algún estudio las considera FR independientes, están fuertemente relacionadas con otros FRCV, como la hiperapobetalipoproteinemia, la hipertrigliceridemia, la acumulación de remanentes de las VLDL y la disminución del cHDL y apoAI29,92. Su aterogenicidad se debe a que estas partículas presentan una menor afinidad por los receptores de las LDL y atraviesan fácilmente el endotelio vascular, oxidándose más fácilmente. No se dispone de una metodología de bajo coste que permita valorar estas lipoproteínas29.
Alteración de la glucemia en ayunasYa es conocido y puesto de manifiesto en los primeros 20 años del estudio de Framingham que la incidencia de ECV fue unas dos veces mayor en pacientes con diabetes mellitus (DM) que en los individuos que no padecían la enfermedad93. Al ser la glucemia una variable continua, cabe esperar que la glucemia en ayunas alterada (valores entre 100 y 125mg/dl) pueda intervenir como FRCV, ya que se ha demostrado que estos pacientes presentaron más aterosclerosis coronaria subclínica comparados con individuos sin alteraciones de la glucosa, pero menos que los diagnosticados de DM. También se apreció en este estudio que los pacientes diagnosticados previamente de DM presentaron una OR de 6,0 (IC 95%: 1,4-25,2) frente a 2,1 (IC 95%: 0,8-5,5) de los diabéticos de nuevo diagnóstico, lo que confirma la elevada carga de aterosclerosis subclínica coronaria que presentan los pacientes diabéticos94. Hay consenso en considerar la alteración de la glucemia en ayunas como FRCV, pero de menos entidad que la DM29.
Fosfolipasa A2 asociada a lipoproteína (Lp-PLA2)La Lp-PLA2 pertenece a la familia de las fosfolipasasA2, superfamilia de enzimas que hidrolizan los fosfolípidos. Secretada principalmente por los monocitos-macrófagos en la capa fibrosa endotelial con lesiones propensas a la ruptura, se une a las LDL, especialmente las partículas pequeñas y densas. El 80% es transportada en el plasma unida a las LDL, y el resto es distribuida entre las HDL y las VLDL. Actúa produciendo la hidrólisis de las LDL oxidadas, hecho que ocurre cuando las LDL se oxidan en el espacio subendotelial. La hidrólisis de las LDL oxidadas por la Lp-PLA2 produce lisofosfatidilcolina (lisoFC) (que desempeña un importante papel en la aterogénesis: deteriora la función endotelial, causa muerte celular por rotura de las membranas e induce apoptosis en células musculares lisas y macrófagos) y ácidos grasos oxidados (AGOx), que también son biológicamente activos, presentando función quimiotáctica para los monocitos (ambos, lisoFC y AGOx, presentan propiedades proinflamatorias). Por tanto, la Lp-PLA2 es la enzima responsable del incremento de lisoFC contenida en las LDL oxidadas, las cuales presentan su conocido potencial aterogénico precisamente por el alto contenido en lisoFC95,96.
La Lp-PLA2 circulante es, pues, un marcador de inflamación que estudios epidemiológicos han relacionado con el aumento del riesgo para la ECV, especialmente por su relación con la placa vulnerable. Desde que el estudio WOSCOPS97 comunicó en un diseño caso-control la asociación independiente de la Lp-PLA2 con la ECV, otros estudios de cohortes han corroborado el hallazgo, como el estudio ARIC (la Lp-PLA2 y la PCRs son complementarias para identificar sujetos de alto riesgo para desarrollar ECC98 y ACV99), el estudio Rotterdam (en población general, la Lp-PLA2 es un predictor independiente de ECC y ACV)100, el estudio MONICA Augsburg (elevados valores de Lp-PLA2 predicen una futura ECC, independientemente de la PCRs, la cual puede ser aditiva en la predicción)101 y más recientemente, concentraciones elevadas de Lp-PLA2 pueden predecir futuros episodios cardiovasculares en pacientes que ya presentaban ECC102, así como al mes de padecer un síndrome coronario agudo los valores más elevados de Lp-PLA2 se asociaron con un incremento del riesgo de padecer infarto de miocardio, angina inestable, revascularización, ACV o muerte103.
La masa de Lp-PLA2 puede ser medida por inmunoanálisis (PLAC test), con resultados fiables y reproducibles si se realizan correctamente. La actividad de la Lp-PLA2 también puede medirse en plasma humano.
Por otro lado, la inhibición de la Lp-PLA2 presenta efectos antiaterogénicos, como se ha podido observar en cultivos celulares, donde un inhibidor de la misma abolía los efectos de las LDL oxidadas, al tiempo que disminuía las concentraciones de lisoFC y AGOx. También las estatinas y los fibratos han demostrado disminuir los valores plasmáticos de la Lp-PLA2. Otros fármacos capaces de inhibir la actividad enzimática de la Lp-PLA2 están siendo evaluados104.
Falta por demostrar con nuevos estudios diseñados en esta dirección si estas opciones terapéuticas son capaces de mejorar la estabilidad de la placa aterosclerótica, los resultados clínicos en los pacientes de alto riesgo y la disminución de la morbimortalidad de origen cardiovascular105.
Implicación y valoración conjunta de los nuevos marcadores de riesgo en la prevención de la enfermedad cardiovascularImplicación de los nuevos marcadores de RCVAunque el método para valorar el RCV podrá mejorar en las poblaciones, especialmente en prevención primaria, distará de ser perfecta, de modo que habrá pacientes con múltiples FR que no desarrollarán ECV, mientras que otros sin FR incluidos en las tablas 1-3 de predicción, sí106, mostrando niveles de incertidumbre en cuanto a las predicciones y, en consecuencia, en cuanto a las actividades preventivas a desarrollar. En esta incertidumbre influyen otros factores distintos a los FR clásicos107; de hecho, el NCEP-ATP III ya reconoció que el riesgo para desarrollar ECC está influido por los factores de riesgo emergentes, los cuales, estando presentes en personas seleccionadas, podrían variar el grado del riesgo de ECC y, por tanto, se modularía el juicio clínico y las decisiones terapéuticas108. Así parecen corroborarlo los estudios que se han publicado posteriormente, con las limitaciones expuestas en apartados anteriores. Por tanto, es preciso tener en cuenta estos nuevos factores para una mejor valoración y tratamiento de nuestros pacientes, pero ¿cómo?
En opinión de los miembros de la International Task Force for Prevention of Coronary Heart Disease76, la presencia de FR emergentes permitiría reclasificar a un paciente en riesgo intermedio o alto a la categoría inmediatamente superior del riesgo. Los pacientes asintomáticos se clasificarían inicialmente en riesgo bajo o moderado (<10% de episodios cardiovasculares en los próximos 10 años), riesgo intermedio (10-20% de episodios a los 10 años) y alto riesgo (>20%), mediante ecuaciones de riesgo (Framingham, Framingham adaptado a la población española o SCORE). En caso de utilizar el sistema SCORE, el riesgo intermedio estaría entre el 3 y el 5%10. Los pacientes sintomáticos automáticamente se clasificarían como alto riesgo. En la tabla 4 se exponen los FR requeridos para este propósito, bien entendido que, en ausencia de evidencia epidemiológica, el uso de los puntos de corte propuestos están sujetos a juicio del clínico. Si se utilizan las Guías europeas de reciente aparición75, en la estimación del RCV se hace referencia a que el mismo puede ser mayor (sin que se indique expresamente un cambio de categoría) en las siguientes situaciones (entre otras): valores elevados de PCRs, fibrinógeno, homocisteína y Lp(a). Se incluye el fibrinógeno, no contemplado por los miembros de la International Task Force for Prevention of Coronary Heart Disease76, de modo que el juicio clínico vuelve a ser determinante en la actitud a tomar en estos pacientes.
Nuevos factores de riesgo utilizados en la estimación de la enfermedad cardíaca coronaria
| A | Evidencia de aterosclerosis por medios diagnósticos de imagen no invasivos (p. ej., presencia de calcio en las arterias coronarias por encima del percentil 75 o incremento del grosor de la íntima-media carotídea). Índice tobillo-brazo patológico (menor de 0,9 o mayor de 1,4) |
| B | Lipoproteína(a) ≥30 mg/dl |
| C | Proteína C reactiva de alta sensibilidad >3 mg/l en ausencia de inflamación aguda |
| D | Homocisteína ≥12 μmol/l |
| E | Presencia de 4 o más factores de riesgo genéticos mostrados en la tabla 3, especialmente en pacientes con historia familiar positiva de enfermedad cardíaca coronariaa |
La presencia del factor A y/o dos o más de los factores B, C, D y E inclina la balanza hacia la clasificación del paciente a la categoría del riesgo más alto. (Entiéndase que tanto esta lista como los puntos de corte pueden variar con la aportación de nuevas evidencias.)
Modificada de Assmann et al.76
Los resultados de los ensayos clínicos HPS109, PROVE-IT110 y TNT111 apoyan que la reducción del cLDL a valores de 70mg/dl estaría indicada en pacientes con alto riesgo, con lo que ello implica en la intensidad del tratamiento de estos pacientes (altas dosis de estatinas y/o terapia combinada). Junto a la aparición de otros grandes ensayos clínicos con estatinas (PROSPER112, ALLHAT-LLT113 y ASCOT-LLA114), el objetivo para descender el cLDL se vio modificado a los tres años de la aparición del NCEP-ATP III, especialmente en pacientes de muy alto riesgo, en los que es aconsejable un descenso <70mg/dl115.
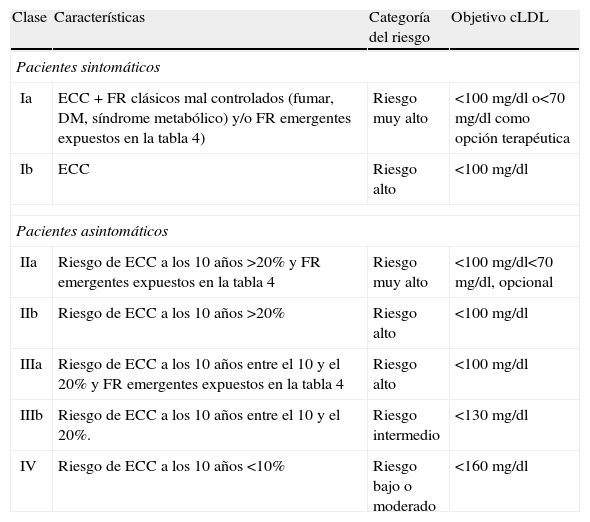
Por tanto, basándose en la utilización de los FR establecidos y los FR emergentes, la International Task Force for Prevention of Coronary Heart Disease76 propone la estratificación del riesgo y las metas a conseguir en el cLDL, tal como se muestra en la tabla 5.
Estratificación del riesgo y objetivos a lograr en los valores plasmáticos del cLDL
| Clase | Características | Categoría del riesgo | Objetivo cLDL |
| Pacientes sintomáticos | |||
| Ia | ECC + FR clásicos mal controlados (fumar, DM, síndrome metabólico) y/o FR emergentes expuestos en la tabla 4) | Riesgo muy alto | <100 mg/dl o<70 mg/dl como opción terapéutica |
| Ib | ECC | Riesgo alto | <100 mg/dl |
| Pacientes asintomáticos | |||
| IIa | Riesgo de ECC a los 10 años >20% y FR emergentes expuestos en la tabla 4 | Riesgo muy alto | <100 mg/dl<70 mg/dl, opcional |
| IIb | Riesgo de ECC a los 10 años >20% | Riesgo alto | <100 mg/dl |
| IIIa | Riesgo de ECC a los 10 años entre el 10 y el 20% y FR emergentes expuestos en la tabla 4 | Riesgo alto | <100 mg/dl |
| IIIb | Riesgo de ECC a los 10 años entre el 10 y el 20%. | Riesgo intermedio | <130 mg/dl |
| IV | Riesgo de ECC a los 10 años <10% | Riesgo bajo o moderado | <160 mg/dl |
cLDL: colesterol transportado por las lipoproteínas de baja densidad; DM: diabetes mellitus; ECC: enfermedad cardíaca coronaria; FR: factores de riesgo.
Modificada de Assmann et al.76
Se puede apreciar que la determinación de los FR emergentes considerados en la tabla 4 no influye en las personas con riesgo bajo o moderado, pero sí en cambio en los individuos asintomáticos con riesgo intermedio, que pasarían de la clase IIIb a la clase IIIa (riesgo alto), con diferentes objetivos terapéuticos. Del mismo modo, tanto los pacientes asintomáticos como los sintomáticos con riesgo alto pasarían a la categoría de riesgo muy alto, con disminución opcional del cLDL a <70mg/dl, si bien después del estudio TNT (este estudio demostró que la morbimortalidad cardiovascular fue un 22% menor en los pacientes con ECC estable que alcanzaron valores de cLDL de 77mg/dl, frente a los que alcanzaron un valor medio de 101mg/dl con un tratamiento menos intenso [80mg de atorvastatina frente a 10mg de la misma estatina]) no se debería dudar mucho en elegir esta opción.
En cuanto a la disponibilidad de los nuevos FR, el diagnóstico por la imagen de la aterosclerosis (aunque su determinación sea a intervalos poco frecuentes) no parece muy accesible, excepto en contados casos y a efectos de investigación. Y la determinación de los FR emergentes de base genética (solo precisan un análisis a lo largo de la vida) por el momento también aparece lejano. Por el contrario, sí son accesibles las determinaciones de la Lp(a), la PCRs, el fibrinógeno y la homocisteína.
Valoración conjunta de los nuevos marcadores de riesgoLa determinación de algunos de los nuevos marcadores de riesgo considerados permite ayudar a identificar pacientes de alto riesgo, los cuales precisan un seguimiento y un tratamiento más intenso de sus FRCV establecidos. Pero hay pocos estudios que combinen varios de estos biomarcadores para predecir la ECV.
Mientras que la PCRs, el fibrinógeno, la Lp(a) y la homocisteína han mostrado asociación con la ECV116, otros estudios han obtenido resultados dispares. Así, Lee et al.117, en un estudio que incluía la PCRs, la interleucina6, el amiloide séricoA y la homocisteína total con los tradicionales FR, hallaron que la interleucina6 y la homocisteína total fueron los biomarcadores independientes relacionados con la mortalidad debida a ECC y todas las causas de mortalidad en una cohorte seguida durante 8,5 años. Folsom et al.118 valoraron 19 nuevos marcadores de ECC, observando los cambios que se producían en las curvas ROC (receiver-operating characteristic) con la introducción de los nuevos marcadores en los modelos que incluían a los FR tradicionales. De los 19 marcadores, la Lp-PLA2, la vitaminaB6, la interleucina6 y la trombomodulina son los que aumentaron el área bajo la curva ROC. No así la PCRs, que no añadió cambios significativos. Wang et al.119, tras una mediana de seguimiento de 7,4 años, hallaron que 10 biomarcadores, entre los que se encontraban la PCRs, el BNP, el fibrinógeno y la homocisteína, contribuyeron adicionalmente a los FR convencionales solo de forma moderada en la predicción del RCV. Sin embargo, Zethelius et al.3 sí encontraron que una combinación de biomarcadores, entre los que se encontraban la PCRs, el BNP y otros que reflejaban lesión miocárdica, mejoraban sustancialmente el riesgo en varones con una media de edad de 71 años, y los resultados del estudio SIESTA19, ya citado, demostraron en prevención secundaria que el fibrinógeno y el NT-proBNP mejoraban la predicción del RCV.
Consideraciones finalesAunque la mayoría de los nuevos FR ha demostrado una relación independiente con la ECV, su aportación a la predicción del RCV ha mostrado resultados dispares, bien es cierto que en poblaciones diferentes, en diferentes situaciones clínicas y en diferentes combinaciones de los nuevos FR. En general, los FR que intervienen en el proceso inflamatorio han demostrado una mayor consistencia, como es el caso de la PCRs, el fibrinógeno o la Lp-PLA2, mientras que otros aparecen como prometedores marcadores de riesgo, como es el caso del NTproBNP y la PAPP-A. De cualquier modo, ninguno de los considerados está incluido en las tablas de predicción del RCV más utilizadas (Framingham y SCORE) para mejorar la predicción individual; sin embargo, las escalas de riesgo Reynolds sí incorporan en el cálculo del riesgo de la enfermedad cardiovascular total tanto la PCRs como la historia familiar de ECV120,121, de modo que estas escalas ya ofrecen la incorporación de uno de estos nuevos marcadores como una información adicional que mejora la predicción del RCV. Sí parece que estos nuevos factores influyen en la progresión de la placa de ateroma, y aunque la medida del cLDL permanece como piedra angular en la prevención de la ECV, más de la mitad de episodios cardiovasculares ocurren en pacientes sin hiperlipidemia manifiesta122, lo que refleja la influencia de otros FR, entre ellos los aquí referidos, como indicábamos en la introducción.
¿Debemos solicitarlos como prueba complementaria en nuestros pacientes?Indudablemente, las guías tienen como función principal informar y no sustituir el sentido clínico del médico, el cual debe considerar individualmente a cada paciente, pero en el momento actual (bien por falta de estandarización en la determinación del FR, bien porque su valor real independiente es cuestionado, bien porque no existe tratamiento específico o bien porque no existe evidencia del beneficio conseguido con su control) podemos contestar a la pregunta que no de modo rutinario en la práctica clínica29,123.
Sí nos pueden ayudar en la estratificación del riesgo. El amplio margen de ECV que las guías no son capaces de predecir y la capacidad de alguno de los marcadores citados de modificar el riesgo hace que los pacientes en riesgo intermedio puedan beneficiarse mediante la determinación de alguno de estos marcadores o de alguna técnica adicional de imagen, la cual no ha sido objeto de esta revisión. Solo hemos abordado el ITB, que debe convertirse en una herramienta accesible para ser utilizada en los pacientes candidatos. Una guía de orientación podría ser considerando lo expuesto en las tablas 4 y 5, solicitando los FR disponibles en el laboratorio de referencia o las pruebas complementarias precisas (y que también estén disponibles), identificando con ello a los pacientes de alto y muy alto riesgo susceptibles de un tratamiento y un control más intensos de sus FRCV establecidos, bien entendido —se insiste sobre ello— que es el sentido clínico del médico frente a un paciente concreto quien guiará la decisión final, en tanto nuevos estudios y el nivel de evidencia logrado sitúen a estos nuevos factores en su línea de flotación correcta, bien salvando unos, bien hundiendo otros, término ingeniosamente utilizado por Mostaza y Lahoz124.
Conflicto de interesesEl autor no tiene ningún conflicto de intereses que declarar.