Además de sus acciones fisiológicas en el ámbito renal en el equilibrio hidroelectrolítico, la aldosterona está implicada en algunas alteraciones cardiovasculares asociadas a la hipertensión arterial, como la hipertrofia ventricular, la fibrosis cardíaca, la insuficiencia cardíaca, etc. El objetivo del estudio fue evaluar el posible papel de los mineralocorticoides en el proceso inflamatorio vascular asociado a la hipertensión en ratas.
MétodosSe utilizaron ratas macho espontáneamente hipertensas (SHR, del inglés spontaneously hypertensive rats) de 18 semanas de edad, tratadas con 2 dosis del antagonista del receptor de mineralocorticoides eplerenona, de 30 y 100 mg/kg/día, durante 10 semanas. Se utilizó un grupo de SHR sin tratar como control, y un grupo de ratas Wistar Kyoto (WKY) se utilizó como grupo de referencia normotenso. Se valoró la presión arterial sistólica (PAS), las concentraciones plasmáticas de interleucina (IL) 1β e IL-6, así como la expression aórtica del ácido ribonucleico mensajero (ARNm) de ambas, del factor de necrosis tumoral alfa (TNF-α), del factor de transcripción nuclear κB (NF-κB), valorando el p105 (precursor de la subunidad p50 del NF-κB) y de su inhibidor (IκB).
ResultadosLas ratas SHR presentaron valores superiores de PAS respecto a las ratas WKY (p < 0,05). Los valores plasmáticos de IL-1β e IL-6, así como su expresión génica y la del TNF-α, aumentaron en las SHR (p < 0,05). Asimismo, las SHR presentaron un aumento en la expresión génica del NF-κB y una disminución del IκB. Solamente el tratamiento con eplerenona 100 mg/kg/día redujo significativamente los valores de PAS. Sin embargo, ambas dosis redujeron los valores plasmáticos y la expresión génica aórtica de las citocinas valoradas (p < 0,05). Asimismo, ambas dosis redujeron la expresión aórtica del ARNm del NF-κB y aumentaron la del IκB (p < 0,05).
ConclusionesLos mineralocorticoides participan en el proceso inflamatorio vascular asociado a la hipertensión en SHR. Este efecto parece estar mediado por un aumento en la expresión vascular de citocinas a través de la modificación del sistema NF-κB/IκB.
Besides its physiological role in the control of hydroelectrolyte balance at renal level, aldosterone plays an important role in cardiovascular alterations associated with hypertension, such as left ventricular hypertrophy, cardiac fibrosis, congestive heart failure, etc. The aim of the present study was to evaluate the effect of endogenous mineralocorticoids on vascular inflammation associated with hypertension in rats.
MethodsMale spontaneously hypertensive rats (SHR) (18 weeks old) were treated with two doses of eplerenone (30 and 100 mg/kg/day) for 10 weeks. A group of (n = 8) untreated SHR was used as a control-vehicle group, and a group of Wistar Kyoto rats (n=8) was used as a reference of normotensive conditions. Aortic mRNA expression and plasma levels of interleukin (IL)-1β, IL-6 and tumour necrosis factor α (TNF-α) were measured. The aortic mRNA expression of the transcription nuclear factor κB (NF-κB) p50 subunit precursor, p105, and its inhibitor (IκB) were also measured.
ResultsSHR showed higher mRNA expression of IL-1β, IL-6 and TNF-α than WKY (p < 0.05) and higher plasma levels of IL-1β and IL-6 than WKY (p < 0.05). SHR also had an increased mRNA expression of NF-κB, and a reduction of I κB. Only the treatment with 100 mg/kg/day eplerenone, significantly reduced SAP. Both doses of the drug reduced plasma levels of IL-1β, IL-6 and aortic mRNA expression of IL-1β, IL-6 and TNF-α to a comparable extent (p < 0.05). In addition, both doses of eplerenone reduced NF-κB mRNA aortic expression and increased IκB mRNA expression in a similar extent (p < 0.05).
ConclusionsMineralocorticoids participate in the vascular inflammatory process associated with hypertension in SHR. This effect seems to be mediated by enhanced vascular expression of cytokines through a modification of the NF-κB/IκB system.
La aldosterona es una hormona mineralocorticoide que participa en el mantenimiento del equilibrio hidroelectrolítico mediante la regulación de la reabsorción de sodio (Na+) y secreción de potasio (K+) en el túbulo colector cortical de la nefrona. Su acción produce un aumento de la permeabilidad de los canales de Na+ y de K+ en la membrana apical de la célula epitelial del tubulo colector, y aumenta el número de bombas Na+/K+−ATPasa en la membrana basolateralbb0005, bb0010.
Desde el punto de vista de la patología, el hiper-aldosteronismo primario produce daño multiorgánico de tipo cardíaco, vascular y renal, lo que se asocia a una incidencia alta de eventos cardiovasculares3. Hay múltiples evidencias que demuestran que el exceso de aldosterona se asocia con disfunción endotelial, aumento del estrés oxidativo, fibrosis vascular y cardíaca, e hipertrofia ventricular4. Asimismo, recientemente se ha descrito que la aldosterona podría afectar a componentes del síndrome cardiometabólico, como la resistencia a la insulina5.
Dos estudios han sido claves en demostrar la importancia de la aldosterona en la morbimortalidad cardiovascular. El estudio RALES (Randomized Aldactone Evaluation Study)6 demostró que la adición del antagonista de los receptores de mineralocorticoides, espironolactona al tratamiento estándar (basado en inhibidores de la enzima de conversión de la angiotensina y diuréticos) en pacientes con disfunción sistólica del ventrículo izquierdo (clases II-IV de la New York Heart Association), reducía en un 30% el número de ingresos hospitalarios y la mortalidad, tanto por progresión de la enfermedad como por muerte súbita. Posteriormente, el estudio EPHESUS (Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study)7 demostró en pacientes con disfunción sistólica postinfarto agudo de miocardio que el bloqueo temprano con eplerenona añadido al tratamiento convencional disminuía un 15% la mortalidad global, un 17% la mortalidad cardiovascular y un 21% la muerte súbita.
Desde el punto de vista experimental, Brilla et albb0040, bb0045 demostraron que la administración de aldosterona y sal causaba hipertensión, hipertrofia cardíaca y fibrosis ventricular en ratas. La administración de dosis bajas de espironolactona revertía la hipertrofia cardíaca inducida por la aldosterona, sin modificar prácticamente los valores de presión arterialbb0040, bb0045. Los efectos cardiovasculares de los antagonistas de los receptores de los mineralocorticoides se han observado también en otros modelos de hipertensión, como la inducida por angiotensina II y sal o en ratas espontáneamente hipertensas (SHR-SP)bb0050, bb0055, bb0060, bb0065.
El daño vascular y el desarrollo aterosclerótico asociados a la hipertensión dependen principalmente de la acción de numerosos factores y el desarrollo de diferentes procesos, como la disfunción endotelial, el estrés oxidativo y la inflamación. Numerosos estudios han demostrado unas concentraciones elevadas de marcadores inflamatorios en pacientes hipertensosbb0070, bb0075, bb0080, bb0085, y elevada expresión de estos marcadores en diversos modelos de hipertensiónbb0090, bb0095, bb0100, bb0105. Por lo tanto, parece evidente la relación existente entre inflamación e hipertensión, que puede considerarse como el nexo entre este factor de riesgo y el desarrollo aterosclerótico. Diversos factores, como el estrés oxidativo, el estrés hemodinámico de la hipertensión y la angiotensina II, se asocian a un aumento de mediadores de inflamación a nivel arterial. Asimismo, la aldosterona se puede considerar como un agente proinflamatorio, ya que su administración aumenta marcadores inflamatorios en el corazón y el riñón en ratas sometidas a una ingesta elevada de salbb0055, bb0110, bb0115. Por ello, y con objeto de profundizar en la posible partici-pación de la aldosterona en el desarrollo de las alteraciones vasculares asociadas a la hipertensión, se llevó a cabo un estudio en el que se valoró la participación de los mineralocorticoides en el proceso inflamatorio vascular presente en la rata SHR.
MétodosEl estudio se realizó en ratas SHR de 18 semanas de edad (n = 16), que se trataron con 2 dosis del antagonista de los receptores de mineralocorticoides eplerenona, 30 y 100mg/kg/día, durante 10 semanas. Se utilizó como control a un grupo de ratas SHR sin tratar, y se utilizó otro grupo de ratas Wistar Kyoto (WKY) como referencia de condiciones normotensas. Los animales tuvieron acceso libre a una dieta estándar (A = 04; Panlab, Barcelona [España]) y al agua. Las dosis del fármaco se obtuvieron en estudios piloto en los que se encontró una dosis que no provocaba un descenso significativo de los valores de presión arterial (30mg/kg/día), y otra con efecto antihipertensivo (100mg/kg/día). Al final del tratamiento se midió de manera indirecta la presión arterial mediante pletismografía en la arteria caudal (Narco Bio-Systems, Houston, Texas [Estados Unidos]). Se realizó una extracción de sangre para valorar marcadores de inflamación plasmáticos. Posteriormente, las ratas se sacrificaron, y la aorta se aisló y manipuló en condiciones estériles para su utilización en estudios de biología molecular, para lo cual se conservó a −80°C hasta su utilización. El protocolo experimental se llevó a cabo según las recomendaciones del comité de uso y manipulación animal de la Universidad Complutense de Madrid, según las guías de la Unión Europea.
Aislamiento de ácido ribonucleicoLas muestras de aorta congelada se pulverizaron en nitrógeno líquido y se homogeneizaron con 1ml de Tri Reagent (Molecular Research Center Inc., Cincinnati, Ohio [Estados Unidos]). El aislamiento de ácido ribonucleico (ARN) se realizó según la metodología descrita por Chomczynski24. El ARN mensajero (ARNm) obtenido se cuantificó por densitometría óptica a 260nm usando un biofotómetro (Eppendorf [Alemania]). El ARN se congeló a −80°C hasta su posterior uso.
Transcripción reversa para la síntesis de ADNcSe utilizaron 5μg del ARN total para la síntesis de ácido desoxirribonucleico complementario (ADNc). La muestra se calentó junto con 2μmol/l de una mezcla de hexámeros a 70°C durante 5min y después se enfrió rápidamente en hielo. A continuación, se añadió una mezcla de inhibidor de RNasa 0,7 U, 25mmol/l Tris/HCl (pH 8,3), 37mmol/l de cloruro de potasio (KCl), 1,5mmol/l de cloruro de magnesio (MgCl2), 10mmol/l de ditiotreitol (DTT), 0,4mmol/l de deoxinucleótidos y 2,5 U de la retrotranscriptasa MMLV. Se incubó la mezcla a 37°C durante 1h y a continuación a 95°C durante 10min, seguidamente se depositó en hielo. La mezcla final se completó con agua estéril hasta un volumen final de 50μl.
Reacción en cadena de la polimerasaLas reacciones en cadena de la polimerasa (MPCR, del inglés multiplex polymerase chain reactions. MPCR Kit for Rat Inflammatory Genes Set-2, Maxim Biotech Inc., San Francisco, California [Estados Unidos]) se realizaron a partir de 5μl de ADNc. Se añadió una mezcla compuesta por tampón de reacción, Taq polimerasa (2,5 U) y cebadores específicos para interleucina (IL) 6, IL-1β, factor de necrosis tumoral alfa (TNF-α), la subunidad p50 del factor de transcripción kappa B (NF-κB), su inhibidor kappa B (IκB) y gliceraldehído 3P deshidrogenasa (GAPDH). Los ciclos de temperatura a los que se sometió cada muestra fueron los siguientes: 2 ciclos a 96°C durante 1min y 58–60°C durante 2min; 27 ciclos para IL-1 p, p105, IkB y GAPDH, y 32 ciclos para IL-6 y NF-kB a 94°C durante 1min y a 58–60°C durante 2min. Por último, se realizó un ciclo a 70°C durante 10min.
El producto obtenido de la reacción se separó por electroforesis en un gel de agarosa al 2% con bromuro de etidio (0,5mg/ml). El tamaño de los amplicones fue el siguiente: 532 pares de bases (pb) para GAPDH, 453 pb para IL-6, 396 pb para p105, 351 pb para TNF-α, 294 pb para IL-1β y 167pb para IκB. La intensidad de las bandas se midió usando un programa informático de análisis de geles (Syngene, Cambridge [Reino Unido]). Los resultados se normalizaron según la expresión de GAPDH.
Contenciones plasmáticas de citocinasLa concentración plasmática de IL-1β, IL-6 y TNF-α se midió utilizando kits comerciales (R&D Systems, Inc., Minneapolis [Estados Unidos]), basados en una técnica cuantitativa de enzimoinmunoanálisis.
Análisis estadísticoTodos los resultados se expresaron como la media ± error estándar de la media (EEM). La comparación estadística de los resultados se realizó mediante un análisis de la varianza de una vía, seguido de una comparación múltiple de medias (test de Newman-Keuls) cuando se encontraron diferencias. La hipótesis nula fue rechazada cuando p < 0,05. La elaboración de todas las pruebas estadísticas se realizó con el apoyo informático del paquete estadístico SPSS (SPSS Inc., Chicago, Illinois [Estados Unidos]).
ResultadosLas ratas SHR presentaron unos valores de presión arterial sistólica (PAS) significativamente mayores que los de las ratas WKY (189 ± 3 frente a 152 ± 3mmHg). El tratamiento con 30mg/kg/día de eplerenona no modificó la PAS (186 ± 5mmHg), mientras que el tratamiento con la dosis de 100mg/kg/día redujo significativamente la PAS (152 ± 3mmHg).
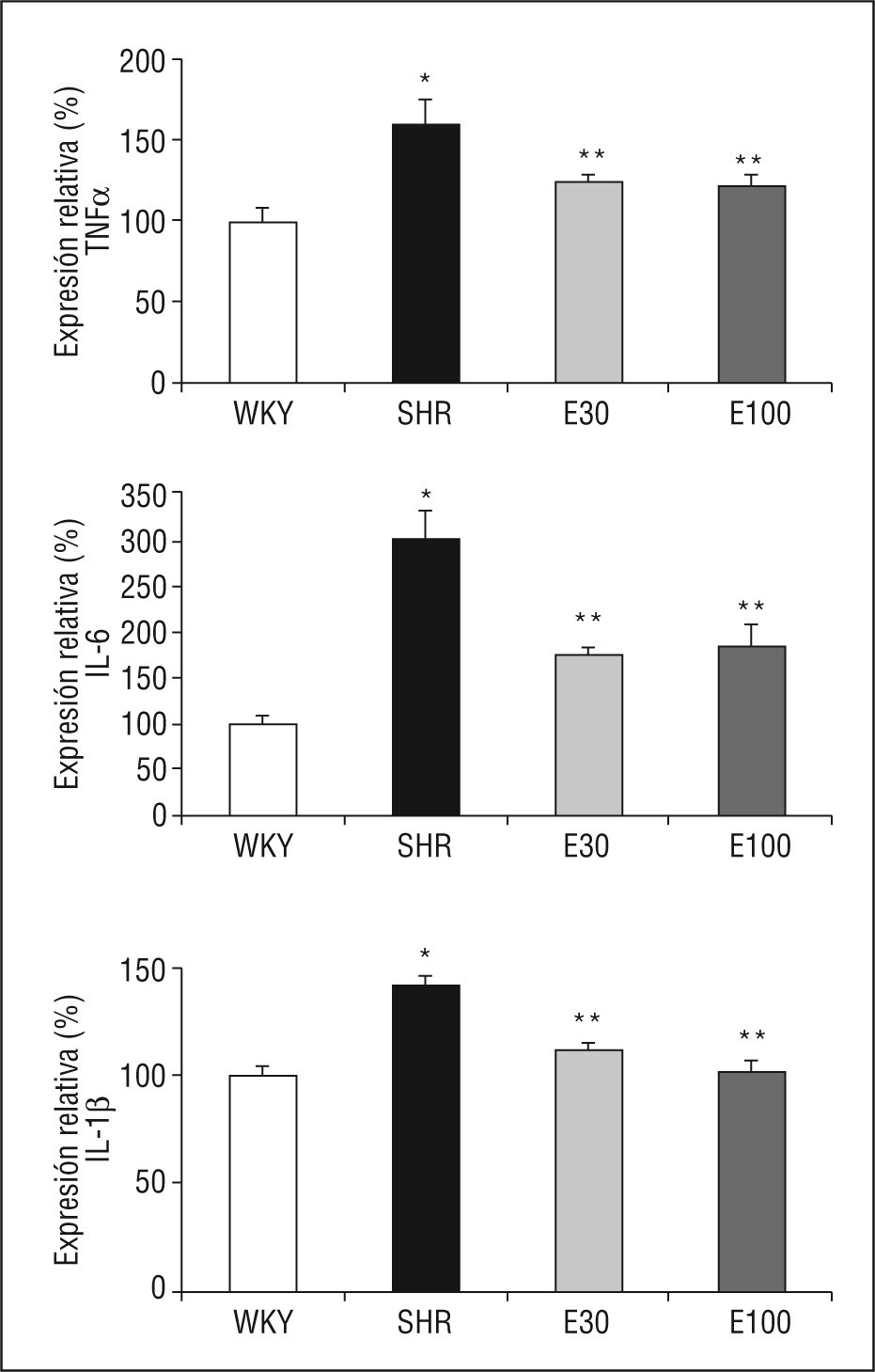
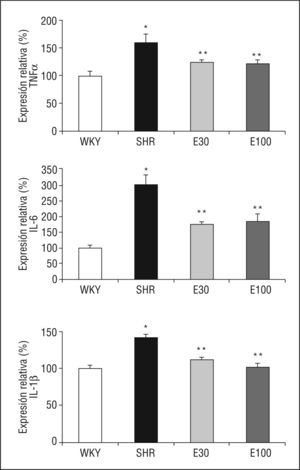
La expresión de ARNm de IL-1β, IL-6 y TNF-α fue superior en SHR que en las ratas control (Figura 1). El tratamiento con las 2 dosis de eplerenona redujo significativamente la expresión génica de estas citocinas, sin encontrarse diferencias entre las 2 dosis del fármaco empleadas (Figura 1).
Figura 1. Expresión génica de ácido ribonucleico mensajero de factor de necrosis tumoral alfa (TNF-α), interlucina (IL) 6 e IL-1β. E30: eplerenona 30mg/kg/día; E100: eplerenona 100mg/kg/día; SHR: spontaneously hypertensive rats; WKY: rata Wistar Kyoto. *p < 0,05 frente a WKY; **p < 0,05 frente a SHR.
Las ratas SHR tratadas con las 2 dosis de eplerenona mostraron una disminución (p < 0,05) en la concentración plasmática de IL-1β e IL-6, y los valores se normalizaron respecto a los obtenidos en ratas WKY (Tabla 1). En el caso del TNF-α, ni la hipertensión, ni los tratamientos modificaron sus valores plasmáticos (datos no mostrados).
Tabla 1. Concentraciones plasmáticas de IL-1β e IL-6
| Grupo | IL-1 p (pg/ml) | IL-6 (pg/ml) |
| WKY | 38,5 ± 3,3 | 106,6 ± 3,2 |
| SHR | 79,3 ± 6,6 a | 149,0 ± 4,5 a |
| SHR + E30 | 45,0 ± 3,6 b | 112,5 ± 4,1 b |
| SHR + E100 | 48,6 ±2,3 b | 110,3 ± 4,0 b |
E30: eplerenona 30mg/kg/día; E100: eplerenona 100mg/kg/día; IL: interleucina; SHR: spontaneously hypertensive rats; WKY: rata Wistar Kyoto.
a p < 0,05 frente a WKY.
b p < 0,05 frente a SHR.
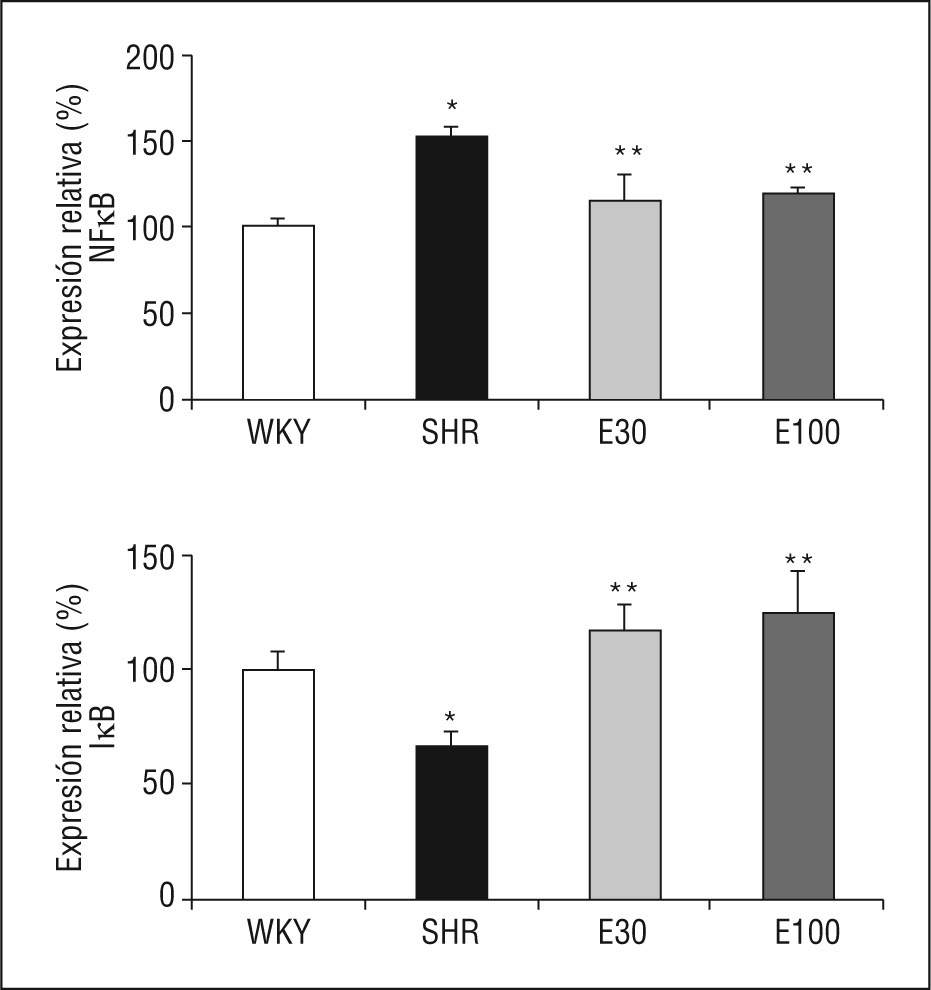
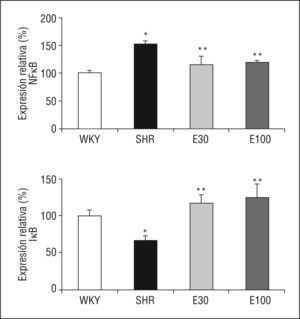
En comparación con las ratas normotensas, las SHR mostraron un incremento significativo en la expresión génica del p105, precursor de la subunidad
p50 del NF-κB, así como una reducción en la expresión de su inhibidor, IκB. El tratamiento con eplerenona redujo los valores de p105 e incrementó los de IκB (p < 0,05), sin que se encontraran diferencias entre las 2 dosis del fármaco empleadas (Figura 2).
Figura 2. Expresión génica de ácido ribonucleico mensajero de factor de transcripción kappa B (NF-κB) e IκB. E30: eplerenona 30mg/kg/día; E100: eplerenona 100mg/kg/día; SHR: spontaneously hypertensive rats; WKY: rata Wistar Kyoto. *p < 0,05 frente a WKY; **p < 0,05 frente a SHR.
DiscusiónLos resultados obtenidos muestran que el tratamiento con el antagonista de los receptores de mineralocorticoides, eplerenona, es capaz de reducir los valores de citocinas vasculares y plasmáticos en SHR. Esta reducción se acompañó de una disminución de la expresión génica aórtica del NF-κB y un aumento de su inhibidor, el IκB. Estos resultados indican que los mineralocorticoides participan en el proceso inflamatorio vascular asociado a la hipertensión, con la modulación del sistema NF-κB/IκB.
El proceso inflamatorio se encuentra íntimamente relacionado con el proceso de daño vascular y desarrollo aterosclerótico asociado a la hipertensión. La presencia subendotelial de macrófagos estimula la producción de citocinas, como la IL-1β y el TNF-α, que amplifican los fenómenos inflamatorios locales, activando a otras células como linfocitos, que participan en la cascada inflamatoria con otras interleucinas, como la IL-6. Estas citocinas son capaces de inducir disfunción endotelial, incrementar el estrés oxidativo y activar diversas metaloproteasasbb0125, bb0130, bb0135, bb0140. En estudios previos de nuestro grupo20 hemos observado un incremento de citocinas plasmáticas en SHR, lo que confirma la asociación entre el proceso inflamatorio y la hipertensión en esta cepa de ratas. El aumento de marcadores inflamatorios plasmáticos se correlaciona con un proceso inflamatorio en el ámbito vascular, ya que se observa también un aumento en la expresión génica de estos marcadores en la aorta. Sin embargo, estos agentes también se sintetizan en tejidos diferentes al vascular, como el TNF-α, que también se sintetiza en el tejido adiposo y algunas células sanguíneasbb0145, bb0150. Esta podría ser la explicación de la falta de paralelismo entre la expresión génica y la concentración plasmática del TNF-α observada en nuestro estudio.
El NF-κB desempeña un papel central en las vías de señalización intracelular que ponen en relación factores como el estrés oxidativo, el estrés hemodinámico en la pared arterial, la angiotensina II y mediadores de inflamación (IL-1β y TNF-α). Cuando se produce la activación de este factor, se pone en marcha una cascada de señales de transducción que conducen a la degradación del IκB en los proteosomas31. El NF-κB se transloca al núcleo e induce la transcripción de una gran variedad de genes, entre los que se encuentran citocinas inflamatorias, moléculas de adhesión y enzimas encargadas de la producción de especies reactivas de oxíge-nobb0165, bb0170, bb0175, bb0180. Los resultados obtenidos muestran que la hipertensión se asocia con un aumento en la expresión vascular del NF-κB y una disminución de la expresión de su inhibidor, el IκB. Esto indica que la hipertensión estimula el proceso inflamatorio vascular, afectando a ambos componentes del sistema, y apoya estudios previos acerca del papel central de las citocinas y del sistema NF-κB/IκB en las al-teraciones vasculares asociadas a la hipertensiónbb0090, bb0100, bb0105, bb0180, bb0185.
La aldosterona participa en diferentes alteraciones del sistema cardiovascular, incluidas la disfunción endotelial, la hipertrofia y la hiperplasia de células musculares lisas y la fibrosis cardíacabb0055, bb0190. Además, la aldosterona induce estrés oxidativo e inflamación vascular, así lo han demostrado estudios in vitro y diversos modelos animales.
La administración de antagonistas de los receptores de los mineralocorticoides, como la eplerenona o la espironolactona, reduce la expresión cardíaca y renal de diferentes mediadores inflamatorios en hipertensión inducida por administración de la angiotensina II o el ácido glicirrícico, y en modelos experimentales de insuficiencia cardíacabb0190, bb0195, bb0200. Los resultados obtenidos indican que los mineralocorticoides están implicados en el proceso inflamatorio vascular asociado a la hipertensión, ya que la administración de eplerenona redujo los valores plasmáticos de las citocinas estudiadas y su expresión génica vascular. Además, el hecho de que la eplerenona reduce la expresión génica del NF-κB y aumenta la de su inhibidor, el IκB, indica que el efecto proinflamatorio de los mineralocorticoides está mediado por el sistema NF-κB/IκB. Es importante mencionar que el presente estudio demuestra por primera vez que los mineralocorticoides podrían afectar no sólo al NF-κB, sino también a su inhibidor.
Los efectos antiinflamatorios de la eplerenona fueron similares con las 2 dosis del fármaco empleadas, tanto con 30mg/kg/día (dosis que no producía una variación en la PAS), como con 100mg/kg/día (que producía un descenso significativo de la PAS). Por lo tanto, los resultados obtenidos indican que los mineralocorticoides desempeñan un papel importante en la regulación del proceso inflamatorio vascular asociado a la hipertensión en SHR. No obstante, no se puede descartar totalmente un efecto hemodinámico en todas las alteraciones cardiovasculares asociadas a la hipertensión.
En conclusión, los resultados obtenidos muestran que los mineralocorticoides participan en el proceso inflamatorio vascular asociado a la hipertensión en SHR, mediante la estimulación de la producción de citocinas a través de la modificación del sistema NFκB/IκB. Estos resultados apoyan el concepto de la participación de múltiples factores vasoactivos como mediadores del proceso inflamatorio asociado con la hipertensión, y contribuyen a aumentar el conocimiento sobre los efectos vasculares de los antagonistas del receptor de los mineralocorticoides.
Agradecimientos
Agradecemos la asistencia técnica de Antonio Carmona y Sandra Ballesteros.
* Este trabajo ha sido posible gracias a la Comisión Interministerial de Ciencia y Tecnología (SAF 2004-0188 y SAF 2005-03378), al Fondo de Investigaciones Sanitarias (PI06/0133) y a la Red Cardiovascular del FIS (RD06/0014/0007).
Recibido 7 Junio 2007
Aceptado 8 Julio 2007
Dr. V. Lahera Juliá. Departamento de Fisiología. Facultad de Medicina. Universidad Complutense. Avda. Complutense, s/n. 28040 Madrid. España. vlahera@med.ucm.es