Las estatinas disminuyen significativamente los niveles de colesterol unido a lipoproteínas de baja densidad (cLDL) y reducen el riesgo de enfermedades cardiovasculares (ECV) sin un límite inferior a partir del cual la disminución de los lípidos no es beneficiosa. Las guías actuales recomiendan niveles de cLDL inferiores a 100mg/dl en pacientes con ECV establecida e inferiores a 70-80mg/dl en pacientes de muy alto riesgo. En los pacientes que alcanzan las cifras de objetivo en términos de cLDL, el riesgo cardiovascular solo se reduce aproximadamente una tercera parte, permaneciendo un importante riesgo residual, debido en parte a dislipemia aterogénica y sus componentes. Por lo tanto, se deduce que las estatinas más eficaces son las que se dirigen al control del perfil lipídico en general, además de una reducción potente del cLDL.
Dentro del grupo de las estatinas que cumplan con lo anterior, la pitavastatina, una estatina sintética, moderadamente lipofílica, que se absorbe de forma amplia sin interaccionar con los alimentos y dotada de una elevada biodisponibilidad, tiene un notable impacto en el perfil lipídico global, con una significativa potencia en la reducción del cLDL. A dosis equivalentes a las de otras estatinas potentes consigue reducciones de cLDL de hasta el 45%, y alrededor del 90% de los casos logran los valores terapéuticos objetivo de la European Atherosclerosis Society (EAS), eleva el colesterol unido a lipoproteínas de alta densidad (cHDL) hasta en un 14% (incluso un 24,6% en pacientes con HDL muy bajo), disminuye los triglicéridos un 17% y modifica favorablemente el resto de parámetros lipídicos a largo plazo. No se metaboliza de forma significativa con el CYP4503A4, por lo que presenta escasas interacciones medicamentosas, minimizando el riesgo de efectos adversos en el paciente polimedicado (anciano, diabético, nefrópata, hipertenso, cardiópata, pacientes con elevado riesgo cardiovascular). Posee efectos pleiotrópicos de clase y efectos pleiotrópicos específicos a nivel del metabolismo de los hidratos de carbono, filtrado glomerular, liposidad, etc., más allá de la disminución de lípidos, que se pueden añadir a la reducción del riesgo residual. Los perfiles de tolerabilidad y de toxicidad parecen óptimos y están avalados por un importante número de pacientes tratados en la actualidad.
Statins decrease LDLc levels significantly and reduce the risk of cardiovascular disease (CVD). There is no lower threshold from which the lipid-lowering effect is not beneficial. Current guidelines recommend LDLc levels below 100mg/dL in patients with established CVD and less than 70-80mg/dL in very high risk patients. In patients at LDLc target, the risk of major cardiovascular events is only reduced about one third, remaining an important residual risk, due in part to atherogenic dyslipidemia and its components. It therefore follows that the most effective statins have a general lipid profile and a strong reduction in LDLc.
Pitavastatin belongs to the statin group that fulfils the above-mentioned requirements. Pitavastatin is a synthetic statin, moderately lipophilic with a good oral absorption and low risk of drug-food interaction and a high biodisponibility. It produces an important change in the overall lipid profile with a significant reduction in LDLc levels. Pitavastatin, at equivalent doses to other strong statins, gets decreases in LDLc up to 45%, about 90% of patients treated with pitavastatin reach the EAS treatment target, it increases HDLc up to 14% (even to 24,6% in patients with a very high level of HDLc), decreases TG by 17% and positively changes the rest of other lipid parameters, in the long term. Pitavastatin is not metabolized in significant by CYP4503A4, therefore it has a low drug-drug interaction profile, especially in the polymedicated patients (elderly, diabetic, nephropathic, hypertensive, heart disease and patients with a high risk cardiovascular). Also, pitavastatin has statins class pleiotropic effects and specific ones effects about carbohydrate metabolism, glomerular filtration, adiponectin… beyond lipid lowering, which can be added to the reduction of residual risk. Pitavastatin is well tolerated, not toxicity and safety data are supported by a significant number of patients currently treated.
La enfermedad cardiovascular (ECV) es la principal causa de mortalidad en España1,2 y en la mayoría de los países industrializados. En los últimos años, diferentes evidencias experimentales, epidemiológicas y clínicas han subrayado el papel de la dislipemia en la ECV3. El control del perfil lipídico se ha convertido en una medida preventiva de primer orden al ser factores de riesgo cardiovascular independientes que poseen gran valor predictivo en el riesgo cardiovascular4.
Esta realidad ha contribuido al éxito de fármacos inhibidores de la HMG-CoA reductasa (estatinas). Las estatinas son los hipolipemiantes más avalados, tanto por ensayos clínicos aleatorizados como por metaanálisis, demostrando su eficacia para reducir significativamente los niveles de colesterol unido a lipoproteínas de baja densidad (cLDL), reducir el riesgo de ECV, la morbilidad y la mortalidad cardiovascular sin que se haya encontrado un límite por debajo del cual la disminución de lípidos no se mostrara beneficiosa.
La relación entre los niveles de cLDL y el riesgo relativo para enfermedad coronaria, en escala logarítmica, es consistente entre muchos estudios clínico-epidemiológicos. Estos datos sugieren que por cada disminución de 30mg/dl en cLDL, el riesgo relativo para la enfermedad coronaria disminuye proporcionalmente en un 30% y para el ictus en un 20%5. En un metaanálisis posterior se demostró que una reducción del cLDL de 1mmol/l (39mg/dl) se acompaña de una reducción de los episodios coronarios del 23% y una reducción de los episodios vasculares del 21%6. Otro metaanálisis de 20 estudios de intervención con estatinas en monoterapia mostró que cada mmol/l de reducción de cLDL se asociaba con una reducción significativa del 20% en el riesgo de ECV7. En este estudio, el control de cLDL fue el determinante más fuerte de reducción del riesgo, y era independiente de la concentración basal de cLDL, lo que pone de manifiesto la importancia de lograr los objetivos de cLDL para la reducción del riesgo cardiovascular.
Actualmente se dispone de suficiente evidencia en los pacientes con enfermedad coronaria de riesgo muy elevado para poder afirmar que cuanto más bajo es el cLDL, mejor.
Las Guías de tratamiento actualmente utilizadas en nuestro país recomiendan como objetivos para prevención primaria cLDL <130mg/dl8, para prevención secundaria cLDL <100mg/dl, y en los pacientes de muy alto riesgo, cLDL <80-70mg/dl5,8,9.
En España, el 20% de la población tiene una colesterolemia ≥250mg/dl, y el 50-69% la tienen ≥200mg/dl2,10,11, de los cuales el 50% no sabe que es hipercolesterolémico11. El grado de tratamiento farmacológico de la dislipemia en las consultas españolas es moderadamente alto (72,6%), pero el grado de control es muy bajo, oscilando entre el 15 y el 50% según diferentes estudios11-17, y es más bajo en los pacientes de alto riesgo, contrariamente a lo deseable.
En Europa, el estudio EUROASPIRE III puso de manifiesto que solo el 88,8% de los pacientes con cardiopatía isquémica estaban recibiendo tratamiento hipolipemiante, y que, de estos, casi el 43% no alcanzan los objetivos de control18. Del mismo modo, el segundo Proyecto de Evaluación de Tratamiento de Lípidos (LTAP-2) mostró que la proporción de pacientes que no han alcanzado los objetivos de cLDL según las directrices nacionales se sitúa entre el 16 y el 53% en 9 países de todo el mundo19.
Por ello es importante seguir un protocolo orientado a la consecución de objetivos, con visitas sistematizadas a las consultas médicas y de enfermería de atención primaria, así como realizar una adecuada educación sanitaria. Pero tan importante, o más, es disponer de fármacos de primera línea de tratamiento seguros y bien tolerados que nos permitan prescribir a nuestros pacientes estatinas de alta eficacia, que puedan reducir la necesidad de la titulación para lograr los objetivos terapéuticos, aumenten el grado de adherencia al tratamiento por la baja incidencia de efectos adversos y reduzcan el riesgo potencial de interacciones farmacológicas en los pacientes polimedicados20.
Incluso en los pacientes que alcanzan el objetivo recomendado de cLDL, el riesgo de episodios vasculares graves solo se reduce en torno a la tercera parte. Por tanto, persiste un riesgo residual muy alto de nuevos episodios, atribuible, entre otros factores, a la dislipemia aterogénica, caracterizada por elevación de los triglicéridos, descenso del colesterol unido a lipoproteínas de alta densidad (cHDL), presencia de partículas LDL pequeñas y densas, aumento del colesterol no-HDL y de apoB. Por ello, las estatinas más eficaces son las que permiten controlar no solo el cLDL sino el perfil lipídico en su totalidad, sin olvidar que en muchos pacientes, y especialmente en los diabéticos, será preciso recurrir a la terapia combinada para conseguir tanto el objetivo de cLDL como el de cHDL y de triglicéridos.
Aunque el efecto clínico de estos fármacos se atribuye principalmente a la reducción del cLDL, algunos estudios clínicos y muchos estudios experimentales indican que parte de su actividad cardioprotectora puede deberse a una combinación de efectos pleiotrópicos21. Estos efectos, independientes de la reducción de colesterol, pueden ser debidos a un efecto de clase por inhibición de la vía del mevalonato modulando la biodisponibilidad de otros compuestos que intervienen en diversas funciones celulares, e incluyen: efectos antiinflamatorios, mejoría de la función endotelial y estabilización de la placa ateromatosa. Estos efectos pleiotrópicos de clase dependerán de la eficacia de la estatina y de la dosis empleada. Pero además podemos identificar otros efectos pleiotrópicos propios de cada estatina que suponen un valor añadido.
A continuación, dada la reciente comercialización en España de la pitavastatina, hemos considerado de interés científico realizar una revisión de esta nueva estatina, destacando sus características diferenciales con las estatinas ya disponibles.
Mecanismo de acción y acciones farmacológicasLa pitavastatina es una estatina desarrollada en Japón, donde se comercializa desde el año 2003. En el año 2009 la Food and Drug Administration autorizó su uso22 y en el año 2011 fue autorizada por la Agencia Europea de Medicamentos, comercializándose en nuestro país a las dosis de 1, 2 y 4mg. Está indicada para el tratamiento de las hipercolesterolemias primarias y la dislipemia mixta cuando la respuesta a la dieta y a las modificaciones del estilo de vida no sean suficientes.
Tiene una estructura característica, con un heptonato en su estructura básica y un anillo quinolínico. En comparación con otras estatinas, la pitavastatina está diseñada específicamente para inhibir la HMG-CoA reductasa con un novedoso grupo ciclopropilo sintético en su cadena lateral que le confiere una serie de ventajas farmacodinámicas y farmacocinéticas, que tienen una gran trascendencia en su perfil de eficacia y seguridad23,24.
Esta novedosa estructura incluye una inhibición más potente de la HMG-CoA reductasa, de forma competitiva, parcial y reversible, bloqueando la síntesis hepática del colesterol en dosis muy inferiores a las requeridas por otras estatinas. El efecto final es la potente reducción de la concentración del colesterol total y del cLDL. Adicionalmente, disminuye la concentración de triglicéridos, aumenta de forma consistente y mantenida los niveles de cHDL y aumenta la síntesis de apoA-I reduciendo su catabolismo25, disminuye los niveles de apoB y el cociente apoB/apoA-I, junto con los niveles de colesterol no-HDL, que constituyen marcadores potenciales de todas las lipoproteínas aterogénicas.
Independientemente de estos efectos en el perfil lipídico, la pitavastatina ha mostrado poseer una serie de efectos pleiotrópicos propios que pueden aportar un beneficio añadido en función de las características de los pacientes.
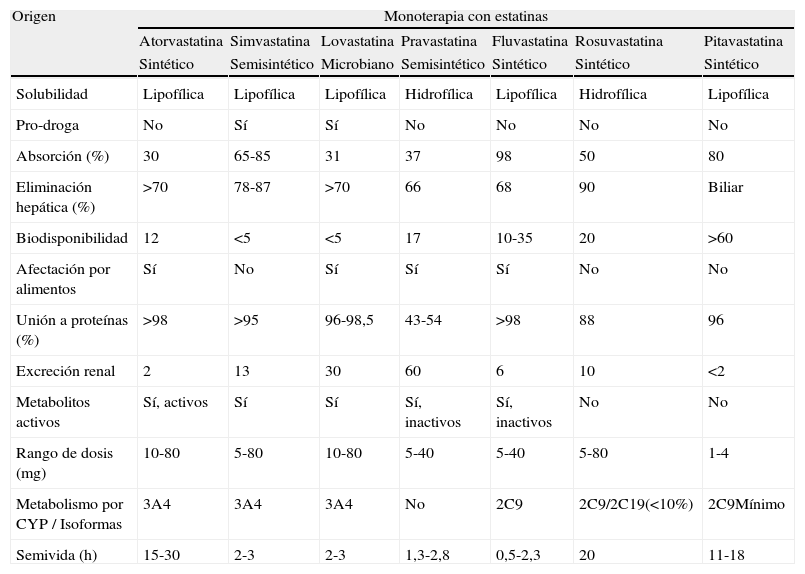
Farmacocinética y farmacodinámica de la pitavastatinaLa pitavastatina es una estatina sintética, como la atorvastatina, la fluvastatina y la rosuvastatina. La simvastatina y la pravastatina son semisintéticas, Y la lovastatina es de origen microbiano.
La pitavastatina tiene un carácter lipofílico, al igual que la atorvastatina, la simvastatina, la lovastatina y la fluvastatina. En cambio, la pravastatina y la rosuvastatina son hidrofílicas. La pitavastatina es la estatina lipófila que posee las propiedades más hidrófilas; en este sentido, ofrece un equilibrio entre ambos, y su grado de lipofilia es una de sus características más destacadas, lo que le otorga la capacidad de entrar en las células hepáticas de forma eficaz con el fin de inhibir el colesterol, con un nivel de hidrofilia que evita una mayor exposición sistémica y absorción por los tejidos no hepáticos.
Se administra como un fármaco activo, un compuesto original en forma de ácido libre, y ejerce su acción de forma directa sobre la enzima, al igual que otras estatinas de segunda y tercera generación (anillo abierto), como la pravastatina, la fluvastatina, la atorvastatina y la rosuvastatina. En cambio, las primeras estatinas comercializadas (la lovastatina y la simvastatina) se administran como profármacos, tienen el anillo cerrado y, por lo tanto, deben sufrir una hidrólisis en el hígado para poder ejercer sus efectos farmacológicos.
La pitavastatina se absorbe de forma amplia (80%) sin interacciones con los alimentos, al igual que la simvastatina y la rosuvastatina. Los alimentos disminuyen la biodisponibilidad de la atorvastatina en un 13%, la de la fluvastatina entre un 15 y un 25%, y la de la pravastatina en un 30%. En cambio, aumentan la biodisponibilidad de la lovastatina en un 50%. Al igual que las otras estatinas, actúa rápidamente inhibiendo la HMG-CoA reductasa en pocas horas, consiguiendo más del 90% del efecto reductor de cLDL en 4 semanas de tratamiento, de forma estable, sin que se observe fenómeno de tolerancia en los tratamientos crónicos. Además, estimula la captación hepática de cLDL de la circulación aumentando el número de receptores hepáticos de LDL, reduciendo el cLDL de la circulación general en mayor medida que la atorvastatina y la simvastatina26 mediante la inducción de la expresión de gen del receptor de LDL.
Mecanismos de transporte intrahepáticoEl transporte de las estatinas al interior de los hepatocitos está mediado por un conjunto de proteínas transportadoras que participan en la absorción hepática de varios fármacos con los que las estatinas pueden interaccionar por un mecanismo de tipo competitivo, localizadas en la membrana de los hepatocitos humanos. Los principales tipos de proteínas transportadoras son los polipéptidos transportadores de aniones orgánicos (OATP), el polipéptido cotransportador de Na y taurocolato (NTCP), el transportador de aniones orgánicos 2, y el transportador de cationes orgánicos 1.
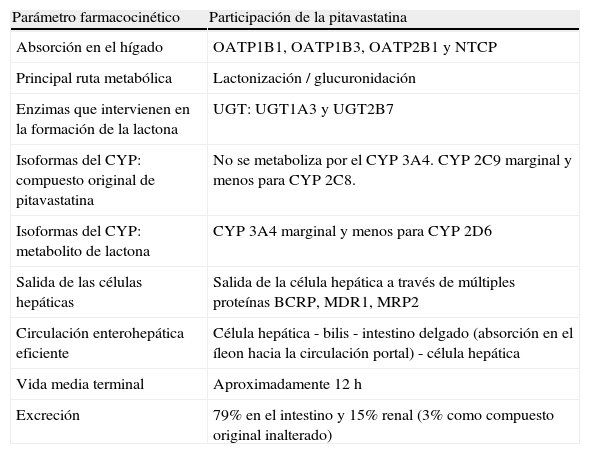
La pitavastatina es transportada activamente a los hepatocitos humanos por múltiples transportadores hepáticos; principalmente provienen del grupo de proteínas OATP (proteínas transportadoras de aniones orgánicos), y son OATP1B1, OATP1B3 y OATP2B1. Esto es importante, porque existen varias rutas hacia la célula por las que la pitavastatina puede entrar en ella para inhibir la síntesis de los esteroles. Los fármacos coadministrados también pueden competir por estas proteínas transportadoras e inhibirlas, disminuyendo la captación hepática de la pitavastatina y aumentando su concentración plasmática. La existencia de varias vías alternativas hacia las células hepáticas puede contribuir a minimizar estas interacciones. Las escasas interacciones que presenta la pitavastatina son por esta vía. La interacción más fuerte por esta vía es con la ciclosporina, y su utilización conjunta está contraindicada de forma absoluta. Otra interacción fuerte es con la eritromicina y en menor medida con los otros macrólidos, por lo que cuando se coadministre con eritromicina se recomienda suspender el tratamiento con pitavastatina durante su empleo. Otras interacciones de tipo intermedio por este mecanismo son con la rifampicina y el gemfibrocilo, por lo que ha de tenerse precaución con su uso concomitante. La pitavastatina no interacciona —o presenta interacciones leves— con el fenofibrato, el ezetimibe, los anticoagulantes orales, la digoxina y los inhibidores de la proteasa, por lo que puede usarse asociada a ellos.
El OATP1B1 es el transportador más utilizado por todas las estatinas comercializadas. El OATP1B3 interviene en el transporte de la fluvastatina, la rosuvastatina, la pravastatina y la simvastatina. El OATP2B1 interviene en el transporte de la atorvastatina, la fluvastatina, la pravastatina y la rosuvastatina, y el OAT1A2, en el trasporte de la lovastatina y de la rosuvastatina. El transporte activo de las estatinas por estos y otros transportadores al interior del hepatocito es el responsable de las múltiples interacciones farmacológicas de todas estas estatinas.
Metabolismo hepáticoLa pitavastatina presenta un mínimo metabolismo hepático por efecto de primer paso (circulación enterohepática), lo que contribuye a una semivida prolongada y a una alta biodisponibilidad —mayor del 60%—, a diferencia del resto de estatinas, que presentan muy baja biodisponibilidad sistémica. Se une a proteínas en más de un 96%, tiene una vida media de entre 11 y 12h, prácticamente no se metaboliza, se elimina mayoritariamente por vía biliar y su excreción renal como fármaco activo es mínima (menos del 2%), lo que la convierte en un hipolipemiante ideal en los pacientes con alteración de la función renal.
La principal ruta metabólica de la pitavastatina es la lactonización/glucuronización, por lo que una vez dentro del hepatocito es rápidamente glucuronizada al menos por cinco isoformas de la uridin difosfato-glucuroniltransferasa diferentes (UGT). Las principales UGT implicadas son UGT1A1, UGT1A3 y UGT2B7, que se convierten en pitavastatina lactona, una forma inactiva por la reacción de eliminación del ácido glucurónico27.
La pitavastatina, a pesar de ser lipofílica, no interactúa con el CYP4503A4 por la presencia del grupo ciclopropilo en su estructura24, a diferencia de otras estatinas lipofílicas, como la atorvastatina, la simvastatina y la lovastatina, que se metabolizan a través del CYP3A4. La fluvastatina se metaboliza principalmente a través del CYP2C928. Entre las estatinas hidrófilas, la rosuvastatina utiliza el CYP2C9 y CYP2C19 en un bajo porcentaje (<10%), mientras que la pravastatina no se metaboliza por la vía del CYP, sino que lo hace a través de otras vías enzimáticas (glucuronización) del hepatocito29. El metabolismo por el CYP3A4 de la pitavastatina tiene propiedades similares a las estatinas hidrófilas, por lo que se clasifica como una estatina tipo no metabolizable por el CYP3A4 (tabla 1)30, y aunque interactúa con el CYP2C9 y el CYP2C8, es mínimamente metabolizada por el CYP2C931, y clínicamente no es detectable32.
Variables farmacocinéticas de las estatinas
| Origen | Monoterapia con estatinas | ||||||
| Atorvastatina | Simvastatina | Lovastatina | Pravastatina | Fluvastatina | Rosuvastatina | Pitavastatina | |
| Sintético | Semisintético | Microbiano | Semisintético | Sintético | Sintético | Sintético | |
| Solubilidad | Lipofílica | Lipofílica | Lipofílica | Hidrofílica | Lipofílica | Hidrofílica | Lipofílica |
| Pro-droga | No | Sí | Sí | No | No | No | No |
| Absorción (%) | 30 | 65-85 | 31 | 37 | 98 | 50 | 80 |
| Eliminación hepática (%) | >70 | 78-87 | >70 | 66 | 68 | 90 | Biliar |
| Biodisponibilidad | 12 | <5 | <5 | 17 | 10-35 | 20 | >60 |
| Afectación por alimentos | Sí | No | Sí | Sí | Sí | No | No |
| Unión a proteínas (%) | >98 | >95 | 96-98,5 | 43-54 | >98 | 88 | 96 |
| Excreción renal | 2 | 13 | 30 | 60 | 6 | 10 | <2 |
| Metabolitos activos | Sí, activos | Sí | Sí | Sí, inactivos | Sí, inactivos | No | No |
| Rango de dosis (mg) | 10-80 | 5-80 | 10-80 | 5-40 | 5-40 | 5-80 | 1-4 |
| Metabolismo por CYP / Isoformas | 3A4 | 3A4 | 3A4 | No | 2C9 | 2C9/2C19(<10%) | 2C9Mínimo |
| Semivida (h) | 15-30 | 2-3 | 2-3 | 1,3-2,8 | 0,5-2,3 | 20 | 11-18 |
Modificada de Saito et al.30.
Después de que la pitavastatina haya ejercido su efecto farmacológico en la célula hepática, el hígado secreta la pitavastatina y su lactona principalmente hacia la bilis a través de diversos transportadores (MDR1, MDP2, BCRP). La pitavastatina activa lo hace a través de la MDP2 y la BCRP, mientras que la forma lactona lo hace a través de la MDR133.
La pitavastatina, al no metabolizarse por el CYP3A4, no interviene en las interacciones farmacológicas por esta vía34, lo que junto con otras características farmacocinéticas (tabla 2), puede contribuir a una eficacia y seguridad más estables, especialmente en pacientes polimedicados, minimizando el riesgo de efectos adversos en comparación con otras estatinas lipofílicas que utilizan la vía del CYP3A4. Por otro lado, la pitavastatina es segura, bien tolerada y más eficaz que la pravastatina en pacientes ancianos35.
Resumen de la farmacocinética y la farmacodinámica de la pitavastatina
| Parámetro farmacocinético | Participación de la pitavastatina |
| Absorción en el hígado | OATP1B1, OATP1B3, OATP2B1 y NTCP |
| Principal ruta metabólica | Lactonización / glucuronidación |
| Enzimas que intervienen en la formación de la lactona | UGT: UGT1A3 y UGT2B7 |
| Isoformas del CYP: compuesto original de pitavastatina | No se metaboliza por el CYP3A4. CYP2C9 marginal y menos para CYP2C8. |
| Isoformas del CYP: metabolito de lactona | CYP3A4 marginal y menos para CYP2D6 |
| Salida de las células hepáticas | Salida de la célula hepática a través de múltiples proteínas BCRP, MDR1, MRP2 |
| Circulación enterohepática eficiente | Célula hepática - bilis - intestino delgado (absorción en el íleon hacia la circulación portal) - célula hepática |
| Vida media terminal | Aproximadamente 12h |
| Excreción | 79% en el intestino y 15% renal (3% como compuesto original inalterado) |
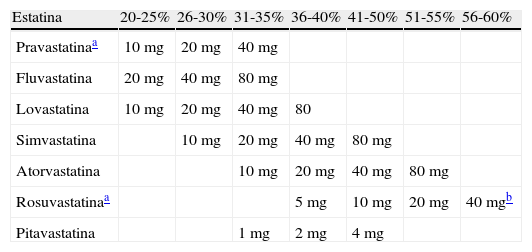
El efecto reductor del cLDL de las estatinas es dependiente de la dosis y la seguridad disminuye con el aumento de la dosis. Por lo tanto, el efecto reductor del cLDL con la dosis inicial es muy importante, y las estatinas se clasifican en potentes cuando consiguen descensos significativos de cLDL con la dosis inicial. Dentro del grupo de las estatinas «potentes» existen tres estatinas comercializadas en España, la atorvastastina, la rosuvastatina y la pitavastatina, que puedan aportar dichos valores. Es por esto que deberían considerarse las estatinas más representativas, porque se dirigen eficazmente a la modificación y/o control global del perfil lipídico, con una significativa potencia en la reducción del cLDL; a dosis equivalentes consiguen reducciones de entre el 40 y el 50% sobre el cLDL (tabla 3)36 y establecen en más del 75% de los casos el alcance de los valores terapéuticos objetivo.
Porcentaje de reducción de colesterol unido a lipoproteínas de baja densidad (cLDL) de las estatinas
| Estatina | 20-25% | 26-30% | 31-35% | 36-40% | 41-50% | 51-55% | 56-60% |
| Pravastatinaa | 10mg | 20mg | 40mg | ||||
| Fluvastatina | 20mg | 40mg | 80mg | ||||
| Lovastatina | 10mg | 20mg | 40mg | 80 | |||
| Simvastatina | 10mg | 20mg | 40mg | 80mg | |||
| Atorvastatina | 10mg | 20mg | 40mg | 80mg | |||
| Rosuvastatinaa | 5mg | 10mg | 20mg | 40mgb | |||
| Pitavastatina | 1mg | 2mg | 4mg |
Modificado de: Mahley y Bersot36.
Los resultados de los estudios clínicos realizados con la pitavastatina demuestran que es eficaz en la reducción de cLDL en el tratamiento a corto y largo plazo en pacientes con hipercolesterolemia primaria (incluyendo hipercolesterolemia familiar) y dislipemia mixta, siendo una alternativa interesante al tratamiento con otras estatinas. Las reducciones de cLDL medias se sitúan entre el 31 y el 45%37, que en pacientes con hipercolesterolemia familiar pueden llegar hasta el 48%38.
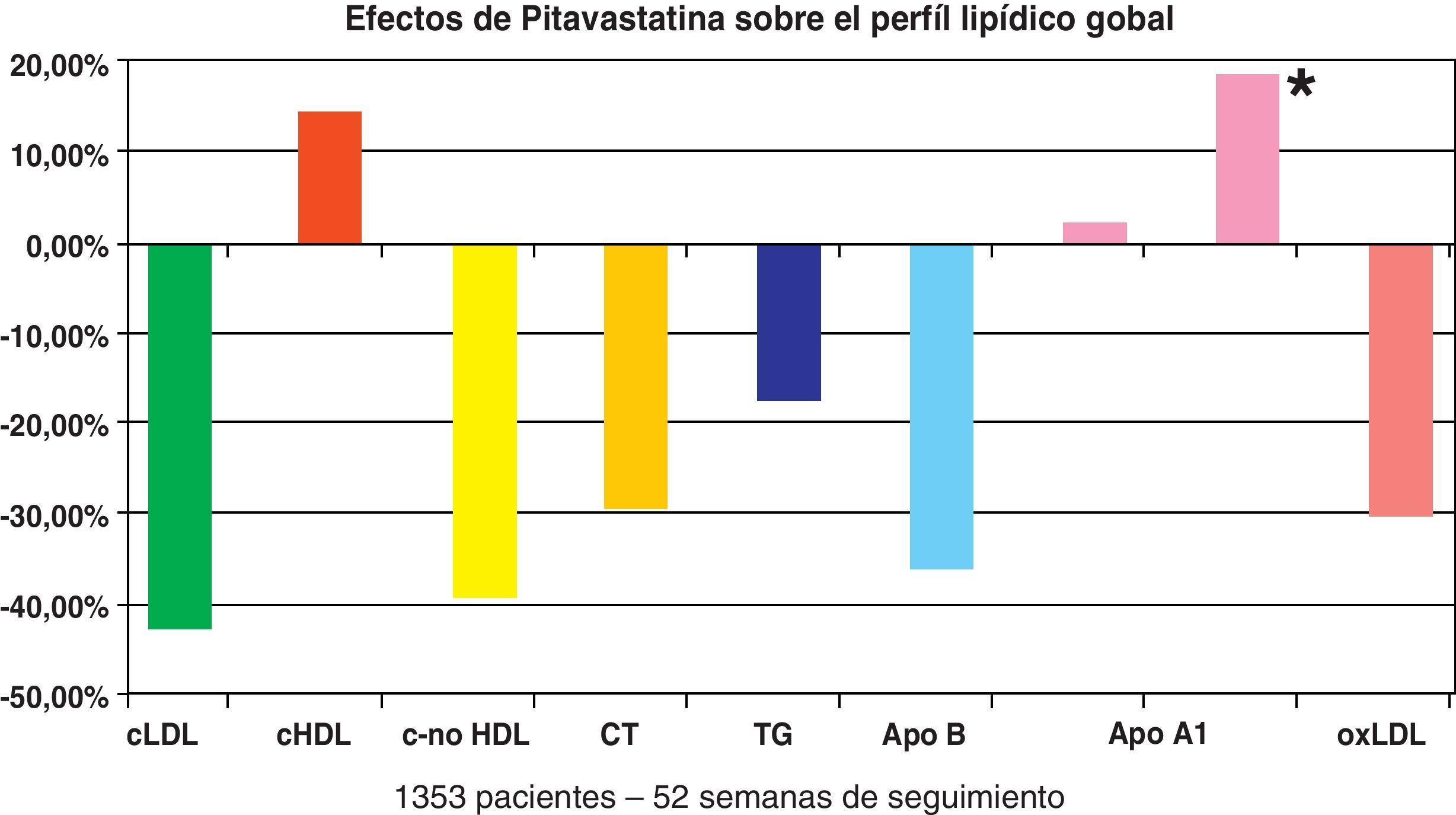
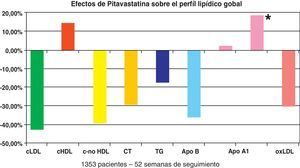
Tras el control del cLDL se propugna la mejoría de los otros componentes del perfil lipídico con el objeto de reducir el riesgo residual que subyace tras la dislipemia aterogénica y otras alteraciones del perfil lipídico6,39. La pitavastatina modifica de forma muy favorable el perfil lipídico: desciende el cLDL un 42,89%, el colesterol total un 29,89%, los triglicéridos un 17,45%, el colesterol no-HDL un 39,60%, la apoB un 36,25% y el cLDL oxidado un 30,08%, y aumenta el cHDL en un 14,32% y la apoA-I un 2,4%40. En otro estudio reciente, el incremento de la apoA-I se sitúa en el 18,5%41 (fig. 1).
El incremento del cHDL se produce de forma sostenida en el tiempo, llegando al 13,6% a las 52 semanas42; las cifras son aun mayores en el estudio LIVES, en el que las concentraciones de cHDL aumentaron en un 14,0 y un 24,9%, respectivamente, después de 12 y 104 semanas de tratamiento en pacientes con niveles muy bajos de cHDL (<1,0mml/l; <39mg/dl)43. Este fuerte incremento del cHDL es atribuible a un mecanismo propio a través de tres vías de interacción25: a) induciendo la expresión de apoA-I en mayor medida que la atorvastatina y la simvastatina; b) aumentando la expresión del transportador de casete de unión a ATP (ABCA1) protegiendo a la apoA-I de su catabolismo, y c) suprimiendo la actividad de Rho y Rho-cinasa, lo que aumenta los niveles de apoA-I a través de una vía adicional.
Esta elevación del cHDL por un mecanismo conocido y de forma mantenida en el tiempo es un rasgo diferencial de la pitavastatina sobre el resto de estatinas que se produce en una amplia variedad de pacientes (ancianos, polimedicados, diabéticos y pacientes con alto riesgo cardiovascular)40,44.
Eficacia en ancianos y polimedicadosEn los pacientes ancianos (≥65 años) las enfermedades concomitantes, la polimedicación y el aumento de efectos secundarios relacionados con el tratamiento con estatinas conducen a su infrautilización y a la falta de adherencia al tratamiento.
Los datos del estudio PROSPER, los subanálisis de los principales estudios de intervención, así como varios ensayos clínicos pequeños, respaldan los beneficios del tratamiento con estatinas en los ancianos y en pacientes con diabetes. A pesar de esto, las estatinas se utilizan muy poco en estos grupos de riesgo. Estos dos grupos, así como los pacientes más jóvenes sin diabetes que requieran tratamiento con varios fármacos, tienen un mayor riesgo de presentar interacciones farmacológicas.
En un estudio clínico con 942 pacientes ≥65 años (434 tratados con pitavastatina 1, 2 o 4mg y 301 tratados con pravastatina 10, 20 o 40mg) con hipercolesterolemia primaria y dislipemia mixta, los valores de cLDL disminuyeron en un 31, un 39 y un 44,3%, respectivamente, y alrededor del 90% de los pacientes lograron el objetivo del tratamiento de la European Atherosclerosis Society (EAS). Más del 80% de los pacientes tomaban medicación concomitante, pero la incidencia de reacciones adversas fue similar en todos los grupos de tratamiento45.
Efectos en pacientes con diabetesUn metaanálisis reciente ha puesto de manifiesto que el tratamiento con estatinas se asocia con un incremento del 9% en el riesgo de diabetes, y que el riesgo de desarrollar diabetes con estatinas fue más alto en los estudios con pacientes de más edad46. El efecto se centra especialmente en el uso de rosuvastatina, que incrementa ligeramente la incidencia de diabetes en comparación con el grupo que no recibe estatinas.
En un reciente estudio realizado con rosuvastatina se describe un incremento significativo de un 0,1% de la HbA1c en los pacientes tratados con rosuvastatina en comparación al grupo tratado con placebo. Los pacientes pre-diabéticos (glucemia en ayunas: 5,6-6,9mmol/l) tratados con rosuvastatina están expuestos a un ligero incremento de riesgo de desarrollar diabetes mellitus47, si bien los beneficios del tratamiento con la rosuvastatina superan claramente los riesgos.
La pitavastatina tiene una influencia positiva en el metabolismo de la glucosa, en comparación con la atorvastatina. El efecto reductor de la concentración de cLDL de los dos medicamentos fue comparable, pero se observó que la pitavastatina no inducía alteraciones sobre el metabolismo de la glucosa, mientras que la atorvastatina indujo un incremento de HbA1c48. Datos de diversos ensayos clínicos realizados con pitavastatina indican que en general no afecta los parámetros glucídicos, e incluso sugieren que puede disminuir los niveles de HbA1c49,50. En el subanálisis sobre un subgrupo de población diabética del estudio LIVES se observó un descenso moderado pero significativo del porcentaje de HbA1c en los pacientes diabéticos tratados con pitavastatina51.
Efectos en pacientes con insuficiencia renalAunque el papel renoprotector de las estatinas no está bien definido, los enfermos renales crónicos en pre-diálisis deberían recibir tratamiento con estatinas con objetivos de prevención secundaria, ya que han demostrado reducir la morbimortalidad. El estudio SHARP ha demostrado que los pacientes con enfermedad renal crónica se benefician del tratamiento hipocolesterolemiante reduciendo su morbimortalidad cardiovascular. El efecto en pacientes en diálisis es menos evidente, aunque se benefician de esta terapia si presentan enfermedad ateroesclerótica.
Cuando la enfermedad renal se asocia a factores de riesgo mayores, el riesgo cardiovascular se multiplica y el tratamiento con estatinas es más efectivo. La asociación de enfermedad renal y diabetes multiplica por veinte la patología cardiovascular.
Los resultados de los estudios PLANET I y II sugieren la ausencia de protección renal de la rosuvastatina en el paciente diabético y no diabético52, y ponen de manifiesto que el posible efecto protector de las estatinas sobre la función renal no se debe a un efecto de clase, como se creía, y se detectan diferencias clínicamente significativas entre las distintas estatinas.
En un subanálisis de los pacientes con insuficiencia renal (FG <60ml/min/1,73m2) procedentes del estudio LIVES se pudo observar que el uso de pitavastatina se asociaba a un incremento de 5,4ml/min/1,73m2 del filtrado glomerular a las 104semanas de tratamiento51.
En un estudio reciente se examinó si la coadministración de ezetimiba con pitavastatina podría aumentar las propiedades de pitavastatina como renoprotector en pacientes con enfermedad renal crónica no diabéticos con dislipemia. El tratamiento con ezetimiba más pitavastatina produjo una reducción significativa de la proteinuria incremental asociada a la terapia con pitavastatina sola53. Estos datos están en consonancia con los resultados del estudio SHARP, donde la combinación de simvastatina y ezetimiba también reduce la proteinuria en los pacientes con insuficiencia renal54.
Por lo tanto, podemos considerar la atorvastatina y la pitavastatina, junto con la fluvastatina, como las estatinas con mejor perfil de protección renal. Cuando la tasa de filtrado glomerular es inferior a 15ml/min/1,73m2 es preciso ajustar las dosis de la atorvastatina a 10-40mg/día, la pitavastatina a 1-2mg/día o la fluvastatina a 40mg/día. Si no se alcanza el objetivo cLDL, está indicado añadir ezetimiba.
Efectos en pacientes con cardiopatía isquémica y reducción/estabilización de la placa ateromatosaDiversos estudios han puesto de manifiesto que el tratamiento con estatinas a dosis superiores a las consideradas convencionales y el descenso intensivo del colesterol proporcionan un beneficio significativo sobre el tratamiento estándar en la prevención cardiovascular.
La aterosclerosis suele estar en estadios avanzados cuando surge la clínica. Los parámetros vasculares del tipo evaluación de la regresión o no progresión del volumen de la placa de ateroma se utilizan para analizar el impacto del tratamiento hipolipemiante. Según las evidencias, la estabilización de la placa de ateroma precede a la reducción de los episodios cardiovasculares. El descenso del colesterol se asocia también a una mayor reducción del volumen de la placa. Es decir, este descenso lipídico se correlaciona no solo con los principales marcadores, sino también con marcadores subrogados, como puede ser el volumen de la placa.
En este sentido, el estudio ACS-JAPAN, tras comparar el efecto de la pitavastatina con el de l0a atorvastatina en la reducción del volumen de la placa de ateroma determinado por IVUS, mostró que la pitavastatina 4mg induce regresión de la placa de ateroma en pacientes con síndrome coronario agudo, de forma similar a la atorvastatina 20mg (–16,9 vs. –18,1, pitavastatina vs. atorvastatina, ambas con una p<0,001 respecto al valor basal)55. Otros estudios, como el TOGETHAR, mediante endoscopia vascular, u otros que utilizaron técnicas de IVUS e histología virtual, han demostrado una significativa reducción de las características propias de las placas inestables56.
La pitavastatina reduce el volumen de la placa de ateroma tan eficientemente como otras estatinas potentes (atorvastatina). A la espera de resultados de morbimortalidad, el efecto sobre la placa sugiere que el papel de la pitavastatina sobre la enfermedad ateromatosa es homologable al del resto de las estatinas.
Efectos pleiotrópicosLa pitavastatina, además de su capacidad para mejorar de forma muy favorable el perfil lipídico, presenta una serie de efectos pleiotrópicos que le confieren un mayor valor. Al igual que las estatinas más potentes, tiene importantes efectos antioxidantes, antiinflamatorios, inmunomoduladores y antitrombóticos, mejora la función endotelial y disminuye la proliferación celular. Los efectos pleiotrópicos de las estatinas son aditivos a los del descenso del colesterol. De hecho, está claro que el descenso del cLDL es clave en los efectos beneficiosos de las estatinas, pero los efectos pleiotrópicos de algunas de ellas tienen un efecto mayor y actúan sobre la placa, la función endotelial, la inflamación y la trombosis. Estos efectos adicionales, muchas veces sinérgicos con los hipolipemiantes, son capaces de converger para la disminución del riesgo cardiovascular.
Además de los efectos pleiotrópicos descritos, la pitavastatina presenta efectos pleiotrópicos propios57, entre los que cabe destacar la disminución de los niveles de resistina —adiponectina que interviene en la resistencia a la insulina y el desarrollo de la aterosclerosis58,59, la mejora en el filtrado glomerular (GFR)51, la disminución de los niveles de albuminuria en pacientes con hiperlipidemia60, la mejora en la función diastólica60 y la disminución de los valores de HbA1c en los pacientes diabéticos59, como se ha señalado anteriormente.
Seguridad y tolerabilidadLos estudios de vigilancia post-comercialización en Japón muestran que el número de reacciones adversas notificadas durante los tres primeros meses de tratamiento con la pitavastatina (6,1%, n=19.921)44 fue menor a lo reportado por los estudios que utilizaron otras estatinas, como la rosuvastatina (11,1%, n=8.795)61 o la atorvastatina (12%, n=4.805)62.
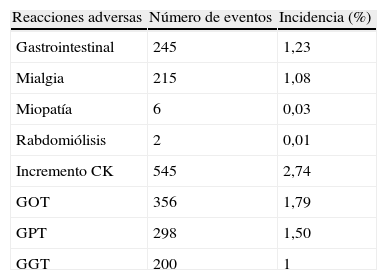
Más recientemente, datos del estudio LIVES a 104 semanas de seguimiento con pitavastatina confirman un bajo índice de reacciones adversas medicamentosas computadas en el estudio post-autorización (10,4%), inferior al de otras estatinas y detalladas en la tabla adjunta (tabla 4), de las cuales el 2,4% fueron incrementos de la creatinfosfocinasa, el 1,79% fueron elevaciones de la ALT, el 1,8% fueron mialgias y el 1% fueron elevaciones de la AST y la gamma-GT. El perfil global de seguridad de la pitavastatina está en línea con el resto del grupo terapéutico44.
Seguridad y tolerabilidad de la pitavastatina
| Reacciones adversas | Número de eventos | Incidencia (%) |
| Gastrointestinal | 245 | 1,23 |
| Mialgia | 215 | 1,08 |
| Miopatía | 6 | 0,03 |
| Rabdomiólisis | 2 | 0,01 |
| Incremento CK | 545 | 2,74 |
| GOT | 356 | 1,79 |
| GPT | 298 | 1,50 |
| GGT | 200 | 1 |
Elaborado a partir de Kurihara et al.44.
Una acción global en el perfil lipídico mediante la reducción del cLDL y de los triglicéridos, junto con un incremento de cHDL, promueve claros beneficios que conllevan la disminución de los episodios cardiovasculares. Las estatinas han mostrado, en estudios aleatorizados con 5 años de seguimiento, incuestionables beneficios en la reducción del riesgo cardiovascular, aunque es preciso insistir en la necesidad de alcanzar los objetivos marcados según el riesgo del paciente, para lo que es preciso incrementar la eficacia de la estatina —bien aumentando la dosis o cambiando a estatinas más eficaces—, insistir en la correcta cumplimentación del tratamiento por parte del paciente y fomentar la combinación de fármacos hipolipemiantes cuando sea preciso.
La elección y la adecuación de la estatina a las necesidades y características del paciente conducirán, sin duda alguna, a una mejor cumplimentación del tratamiento por su parte, además de beneficiarse de los efectos pleiotrópicos propios de las estatinas y de los específicos de algunas de ellas.
Basándose en lo expuesto, lo ideal es utilizar, siempre que sea posible, una estatina segura que no interaccione con otros fármacos, potente para reducir los valores de cLDL, que actúe sobre el riesgo residual, que aumente el cHDL y disminuya la trigliceridemia, y que además tenga una actividad cardioprotectora por sus efectos pleiotrópicos, independiente de su acción sobre el perfil lipídico, para proporcionar un valor añadido a su efecto estrictamente hipolipemiante.
La pitavastatina reúne todas estas características y constituye una alternativa segura y eficaz en relación con las actuales alternativas terapéuticas, ya que presenta menores interacciones farmacológicas, y es de especial interés en pacientes de poblaciones especiales, como ancianos, polimedicados, pacientes de alto riesgo, diabéticos, hipertensos, pacientes renales, pacientes en tratamiento con inhibidores de la proteasa o anticoagulantes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Revisores externos: Joan Pedro-Botet Montoya, Lluís Masana Marín. Sociedad Española de Arteriosclerosis.