En ratas, dietas ricas en fructosa producen hipertrigliceridemia y esteatosis hepática, como consecuencia de una reducción en la actividad transcripcional del receptor activado por proliferadores peroxisómicos alfa, junto con un estado de resistencia parcial a la leptina. En el presente trabajo, hemos estudiado cómo la fructose afecta a la vía de señalización de la leptina.
Material y métodosSe distribuyeron de forma aleatorizada 16 ratas Sprague-Dawley macho en 2 grupos: control y fructosa (10% peso/volumen en agua de bebida, durante 14 días). Se valoraron los valores plasmáticos de triglicéridos, glucosa, leptina, insulina y adiponectina. En el hígado se determinaron: contenido de triglicéridos, actividad de β-oxidación, actividad AMPK (del inglés AMP-activated protein kinase) y valores de expresión proteica y de ácido ribonucleico mensajero de diferentes genes de la vía de señalización de la leptina.
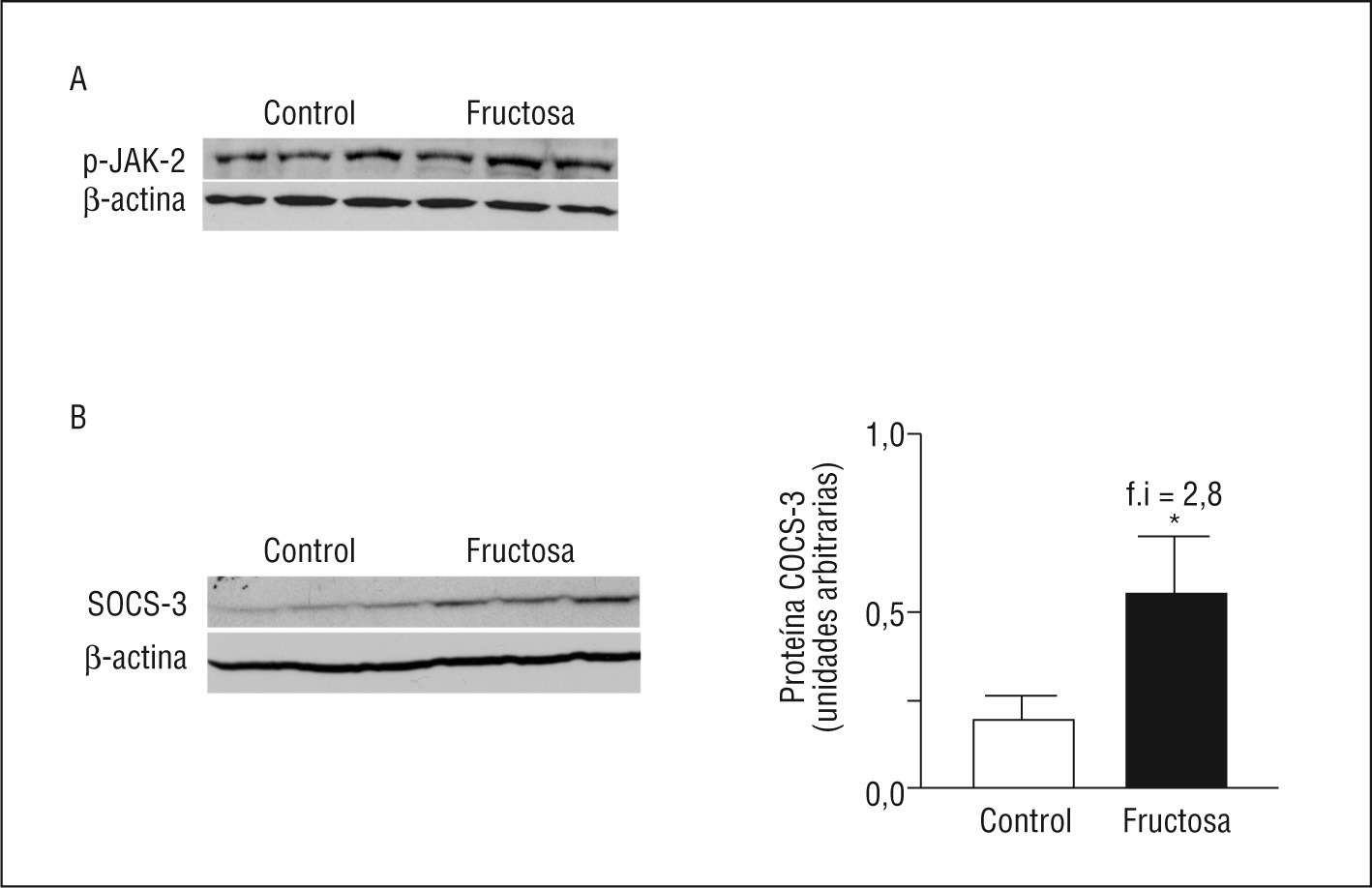
ResultadosLas ratas fructosa presentaron un incremento en los valores de leptina plasmática (1.9X) y de la expresión proteica de STAT-3-PTyr705 (1.9X) respecto las ratas control. No se observaron diferencias en las formas fosforilada y activas de STAT-3-PSer727 y de AMPK. Estas 2 fosforilaciones están controladas por la vía de las MAPK (del ingles mitogen activated protein kinase), que tampoco presentaba modificaciones entre los 2 grupos de estudio. El déficit de fosforilación es consecuencia de una alteración en la señalización del receptor a la leptina (ObRL) que no se fosforila en el residuo Tyr985, ni fosforila a JAK-2 (del ingles Janus-activated kinase 2), posiciones que controlan la vía de las MAPK. SOCS-3 (del inglés supresor of cytokine signaling 3), que presenta un incremento en su expresión proteica (2.8X) en las ratas fructosa, puede ser la causa de la falta de activación de ObRL-PTyr985 y de JAK-2.
ConclusionesLa administración de fructosa provoca un incremento en la expresión proteica de SOCS-3. Como consecuencia, se observa la falta de fosforilación de los residuos Tyr985 de ObRL y de JAK-2, que parecen ser la causa de la falta de actividad de la vía de las MAPK y, por lo tanto, del déficit de actividad de AMPK y de STAT-3.
High-fructose diets induce hypertriglyceridemia and hepatic steatosis in rodents as a result of a deficit in hepatic PPARα transcriptional activity and a partial impairment of the leptin pathway. In the present study, we have investigated the mechanism involved in the fructose derangement of leptin signal transduction pathway.
Material and methodsSixteen Sprague-Dawley male rats were randomised to 2 treatment groups: control and fructose (10% w/v fructose in drinking water for 14 days). Plasma levels of triglycerides, glucose, leptin, insulin and adiponectin were measured. Triglyceride content, fatty acid β-oxidation activity, AMPK activity and expression of mRNA and protein levels from genes involved in leptin pathway were determined in liver samples.
ResultsFructose-fed rats showed high plasma concentrations of leptin (1.9X) and an increase in STAT-3-PTyr705 protein levels (1.9X), with no significant changes in the phosphorylated and active forms of STAT-3-PSer727 and AMPK. These phosphorylations are dependent on the MAPK pathway; MAPK pathway was also unchanged in liver samples from fructose-fed rats. Thus, the absence of increased MAPK activity in livers of fructose-fed rats can be attributed to an impairment of the leptin receptor activation, because neither the amount of P-Tyr985-ObRL, nor the amount of P-JAK-2, that control the MAPK pathway, were modified in livers of fructose-fed rats. Fructose fed-rats showed an increase in SOCS-3 protein expression (2.8X) that can be the responsible for the absence on phosphorylation of JAK-2 and ObRL at Tyr985.
ConclusionsThe fructose administration induces an increase in SOCS-3 protein expression. As a consequence, fructose-fed rats showed no differences in JAK-2 and ObRL at Tyr985 phosphorylation, which may explain the lack of activation of the MAPK pathway and finally the deficit observed in STAT-3 and AMPK activity.
El consumo de fructosa constituye una parte importante de la ingesta calórica total en las dietas occidentales, básicamente debido al aumento del consumo de bebidas refrescantes que contienen valores altos de fructosa. Durante las últimas 2 décadas, el incremento en el consumo de fructosa ha coincidido con un aumento en la prevalencia de obesidad y síndrome metabólico, importantes factores de riesgo para la enfermedad cardiovascularbb0005, bb0010. Ha habido un debate intenso para determinar si la incorporación masiva de fructosa en las dietas occidentales representa sólo otro ingrediente de valor calórico alto, o si además de esto la fructosa provoca cambios cualitativos en el metabolismo energético que favorecen la aparición de enfermedades metabólicasbb0015, bb0020. Además, la fructosa incluida en la dieta en forma líquida provoca hipertrigliceridemia en un grado mayor que si ésta se administra en forma sólida5. Un aumento del 10% de la energía total obtenida en la dieta en forma de hidratos de carbono no es suficiente para inducir hipertrigliceridemia, a menos que este 10% se consuma en forma líquida y sea rico en monosacáridos6. Además, en una revisión reciente de Bray et al7, los autores explican que en modelos de obesidad y resistencia a la insulina en roedores, el consumo de fructosa, añadida en el agua de bebida, induce a los roedores el deseo de consumir soluciones edulcoradas y calóricas, lo que reduce el consumo de comida sólida, aunque no en un grado suficiente como para prevenir un equilibrio calórico positivo y, por lo tanto, la aparición de obesidad. Respecto a este tema tan importante, todavía falta conocer el mecanismo molecular que causa las alteraciones metabólicas provocadas por la ingestión de fructosa.
Recientemente, nuestro grupo ha demostrado que la administración de fructosa al 10% en el agua de bebida a ratas macho provoca hiperleptinemia y un estado de resistencia a la leptina, debidas a una disfunción parcial en el factor de transcripción STAT-3 (del inglés signal transducer and activator of transcription 3). Las ratas suplementadas con fructosa, aun presentando valores elevados de leptina en plasma, no presentan diferencias en la expresión proteica de STAT-3 fosforilada en serina (STAT-PSer727), forma con máxima actividad transcripcional, respecto a las ratas control (CT). Esta falta de actividad puede explicar los cambios metabólicos inducidos por la fructosa cuando ésta se toma en forma líquida8. Aunque no hay pruebas experimentales de que este fenómeno también ocurra en humanos, hay estudios que explican que la administración de fructosa al 20% en solución, a varones sanos voluntarios durante 4 semanas, induce, entre otros efectos, un incremento significativo de la concentración plasmática de la leptina9.
En el presente trabajo, demostramos que la administración de fructosa en el agua de bebida a ratas macho Sprague–Dawley provoca un estado de resistencia parcial a la leptina como consecuencia de la falta de fosforilación y activación de STAT3-PSer727 y AMPK (del inglés AMP-activated protein kinase). La falta de estas actividades se debe al déficit de activación de JAK-2 (del inglés Janus-activated kinase 2) y a una disfunción en la activación del receptor de la leptina que tiene como consecuencia la falta de actividad de la vía de las MAPK (del inglés mitogen activated protein kinase). Parece ser que el incremento observado en la expresión proteica de SOCS-3 (del inglés supresor of cytokine signaling 3), que bloquea la fosforilación y la activación de JAK-2 y del receptor a la leptina (ObRL) en la posición Tyr985, puede ser la causa que provoca la falta de estas actividades.
Material y métodosAnimales y diseño experimentalPara este estudio, se utilizaron 16 ratas macho Sprague-Dawley, que fueron proporcionadas por Harlan (Barcelona [España]) y se mantuvieron con agua y comida ad líbitum, a temperatura y humedad constante, con un ciclo de luz/oscuridad de 12h. Después de 5 días, los animales se distribuyeron de forma aleatorizada en 2 grupos: un grupo CT y un grupo suplementado con fructosa. La fructosa se proporcionó en el agua de bebida en forma de solución al 10% (peso/volumen) durante 2 semanas. Los animales CT no recibieron ningún suplemento de hidratos de carbono. Los animales se sacrificaron por decapitación con anestesia por isoflurano entre las 10.00 y las 11.00h. Todo el proceso se realizó de acuerdo con la guía establecida por el Comité de Bioética de la Universitat de Barcelona, según se indica en la Ley (5/1995) (21 de julio) de la Generalitat de Catalunya.
Preparación de muestrasLas muestras sanguíneas de los animales se recogieron en el momento del sacrificio, en tubos con ácido etilendiaminotetraacético [EDTA] al 5%; el plasma se obtuvo por centrifugación y se conservó a −20°C hasta su utilización. Los hígados de las ratas se extrajeron y perfundieron en cloruro sódico (NaCl) al 0,9%; 1g de tejido hepático de cada rata se homogenizó en tampón 150mM de NaCl, 1mM de dicloro-difenil-tricloroetano (DTT), 30mM EDTA, 50mM de fosfato de potasio (KH2PO4), pH 7,4 para obtener la fracción de sobrenadante posnuclear, que se conservó a −80°C hasta su utilización. Se congelaron 10–100mg de tejido hepático en nitrógeno (N2) líquido de forma inmediata y conservados a −80°C hasta su utilización para la extracción del ácido ribonucleico (ARN) total. Dos muestras adicionales de tejido hepático (250mg) se conservaron a −80°C para cuantificar los lípidos hepáticos y para obtener los extractos nucleares y de proteína total.
Análisis de lípidos, glucosa, insulina y leptinaLos valores plasmáticos de triglicéridos, ácidos grasos libres y glucosa se midieron mediante los ensayos colorimétricos de Wako Chemicals GmbH (Neuss [Alemania]) Triglyceride L-Type, NEFAC y Glucose kit, respectivamente. La concentración plasmática de insulina se determinó con el Rat Insulin RIA kit (RPA547) de Amersham Biosciences Europe GmbH, y los valores plasmáticos de leptina y adiponectina con el kit RL83K RIA y MADP-60HK RIA, respectivamente, ambos de Linco Research (Missouri [Estados Unidos]). Los lípidos hepáticos se extrajeron y midieron según se ha descrito previamente10.
Ensayos enzimáticosβ-oxidación de los ácidos grasosLa actividad hepática de β-oxidación de ácidos grasos se determinó según el método descrito previamente11, utilizando 30μg de sobrenadante posnuclear de hígado de rata como muestra.
5’-AMP-activada proteína cinasaLa AMPK se estudió en la fracción 6% PEG 8000, en la que se analizó la incorporación de [γ32P] ATP en el péptido SAMS (Upstate Biotechnology, Lake Placid, NY [Estados Unidos]), tal como describen Kudo et al12. Brevemente, 100mg de tejido congelado se homogeneizó en 0,4ml de tampón 50mM de Tris–HCl (pH 7,5), 0,25M de manitol, 1mM de ácido etilenglicoltetracético (EGTA), 1mM de EDTA, 1mM de DDT, 50mM de fluoruro sódico (NaF), 1mM de fluoruro de fenilmetilsulfonilo (PMSF), 5mM de ortovanadato y 1mM de benzamidina. El homogeneizado se centrifugó a 14.000 × g durante 20min a 4°C, y el sobrenadante obtenido se llevó hasta un 2,5% (w/v) PEG 8000 utilizando una solución stock 25% (w/v) PEG 8000. La mezcla se mantuvo en agitación durante 10min y se centrifugó a 10.000 × g durante 10min. El sobrenadante se llevó a un 6% PEG 8000. Después de la centrifugación, el pellet se lavó con tampón de homogeneización al 6% PEG 8000 y posteriormente se resuspendió en tampón 100mM de Tris–HCl (pH 7.5), 1mM de EGTA, 1mM de EDTA, 1mM de DDT, 50mM de NaF, 1mM de PMSF, 1mM de benzamidina, 0,02% de azida sódica y 10% de glicerol. La concentración proteica de cada muestra se estudió mediante el método Bradford13.
La reacción para analizar la actividad AMPK se realizó a 30°C durante 5min en un volumen final de 25μl compuesto por 40mM de Hepes-NaOH (pH 7,0), 80mM de NaCl, 8% glicerol, 0,8mM de EDTA, 200μM de péptido SAMS, 0,8mM de DTT, 5mM de cloruro de magnesio (MgCl2), 200μM de [γ32P] ATP, 200μM de 5’-AMP y 0,5μg de la fracción proteica 6% PEG 8000. La reacción se inició con la adición de [γ32P] ATP/mg. Después de la incubación a 30°C, se añadieron 15μl del producto de reacción a filtros de papel Whatman P81, que se lavaron 4 veces con 150mM de ácido fosfórico durante 30min. El último lavado se realizó con acetona, los filtros se dejaron secar y se contaron en un contador de centelleo. El blanco de la reacción se realizó utilizando todos los componentes y añadiendo proteína inactivada. La actividad AMPK se calculó como la diferencia entre la radiactividad de las muestras menos la del blanco. Se han realizado experimentos preliminares para determinar los tiempos óptimos de incubación y para establecer la cantidad de proteína a utilizar.
Preparación y análisis del ácido ribonucleicoEl ARN total se aisló mediante el reactivo Trizol® (Invitrogen Biotechnologies), de acuerdo con las instrucciones del fabricante. Los valores relativos de cada ARN específico se determinaron por la reacción de la transcriptasa reversa-reacción en cadena de la polimerasa (RT-PCR), como se ha descrito previamente9. Se utilizó aprt (del inglés adenosyl phosphoribosyl transferase) como control interno. En la Tabla 1 aparecen el número de ciclos, las secuencias de los oligonucleótidos y los pares de bases (pb). Los valores de ARN mensajero (ARNm) se expresan siempre en relación con los valores de ARNm de aprt.
Tabla 1. Oligonucleótidos específicos usados para la reacción en cadena de la polimerasa (PCR)
| N.° GenBank™ | Secuencias específicas | Producto de PCR (bp) | Ciclos de amplificación | |
| APRT | L04970 | Forward: 5’-AGCTTCCCGGACTTCCCCATC-3’ | ||
| Reverse: 5’-GACCACTTTCTGCCCCGGTTC-3’ | 329bp | 23 | ||
| c-fos | X06769 * | Forward: 5’-CATCGGCAGAAGGGGCAAAGTAGAG-3’ | ||
| Reverse: 5’-TGCCGGAAACAAGAAGTCATCAAAG-3’ | 463bp | 31 | ||
| FAS | M76767 | Forward: 5’-GTCTGCAGCTACCCACCCGTG-3’ | ||
| Reverse: 5’-CTTCTCCAGGGTGGGGACCAG-3’ | 214bp | 20 | ||
| G6pc | NM013098 | Forward: 5’-GATCGCTGACCTCAGGAACGC-3’ | ||
| Reverse: 5’-AGAGGCACGGAGCTGTTGCTG-3’ | 197bp | 20 | ||
| SCD-1 | J02585 | Forward: 5’-GCTCATCGCTTGTGGAGCCCAC-3’ | ||
| Reverse: 5’-GGACCCCAGGGAAACCAGGAT-3’ | 521bp | 18 | ||
| SOCS-3 | NM053565 | Forward: 5’-TTTTCGCTGCAGAGTGACCCC -3’ | ||
| Reverse: 5’-TGGAGGAGAGAGGTCGGCTCA-3’ | 250bp | 25 |
APRT: adenosyl phosphoribosyl transferase; SOCS-3: supresor of cytokine signaling 3.
* Hsieh et al 15 .
Los extractos nucleares y de proteína total se obtuvieron según el método descrito previamente14. La cuantificación de la concentración proteica de cada fracción se realizó mediante el método de Bradford13.
Ensayos de Western blotSe sometieron 30μg de proteína total o extractos nucleares hepáticos a electroforesis en geles poliacrilamida-SDS al 8-10%, según el tamaño de las proteínas. Posteriormente, las proteínas se transfirieron a membranas immobilon polyvinylidene diflouride (PVDF) (Millipore, a Bedford, MA, Estados Unidos) y se bloquearon durante 1h a temperatura ambiente en solución de TBS-0,1% Tween-20 con un 5% de leche en polvo desnatada. Las membranas se incubaron siguiendo el protocolo descrito anteriormente8. La detección se realizó utilizando el reactivo ECL chemiluminescence kit HRP (Amersham Biosciences). Como control de carga, se incubaron las membranas con β-actina (Sigma-Aldrich). El tamaño de las proteínas se comprobó utilizando marcadores de peso molecular (Invitrogen, Life Technologies). Todos los anticuerpos se obtuvieron de Santa Cruz Technologies, excepto p-STAT-3, ERK (del inglés extracellular signal-related activated kinase) 1/2, p-ERK1/2, MEK (del inglés mitogen activated kinase) 1/2 y p-MEK 1/2, que se obtuvieron de Cell Signaling.
EstadísticaLos resultados se expresan como media ± desviación estándar. Las muestras de plasma se estudiaron por duplicado. Las diferencias estadísticas se valoraron mediante la prueba de la t de Student para muestras no apareadas, utilizando el programa informático GraphPad InStat (GraphPad Software V2.03). Cuando el número de muestras era pequeño o las desviaciones no fueron homogéneas, se aplicó un test no paramétrico (Mann–Whitney o Kruskal-Wallis). Se consideró significación estadística un valor de p < 0,05.
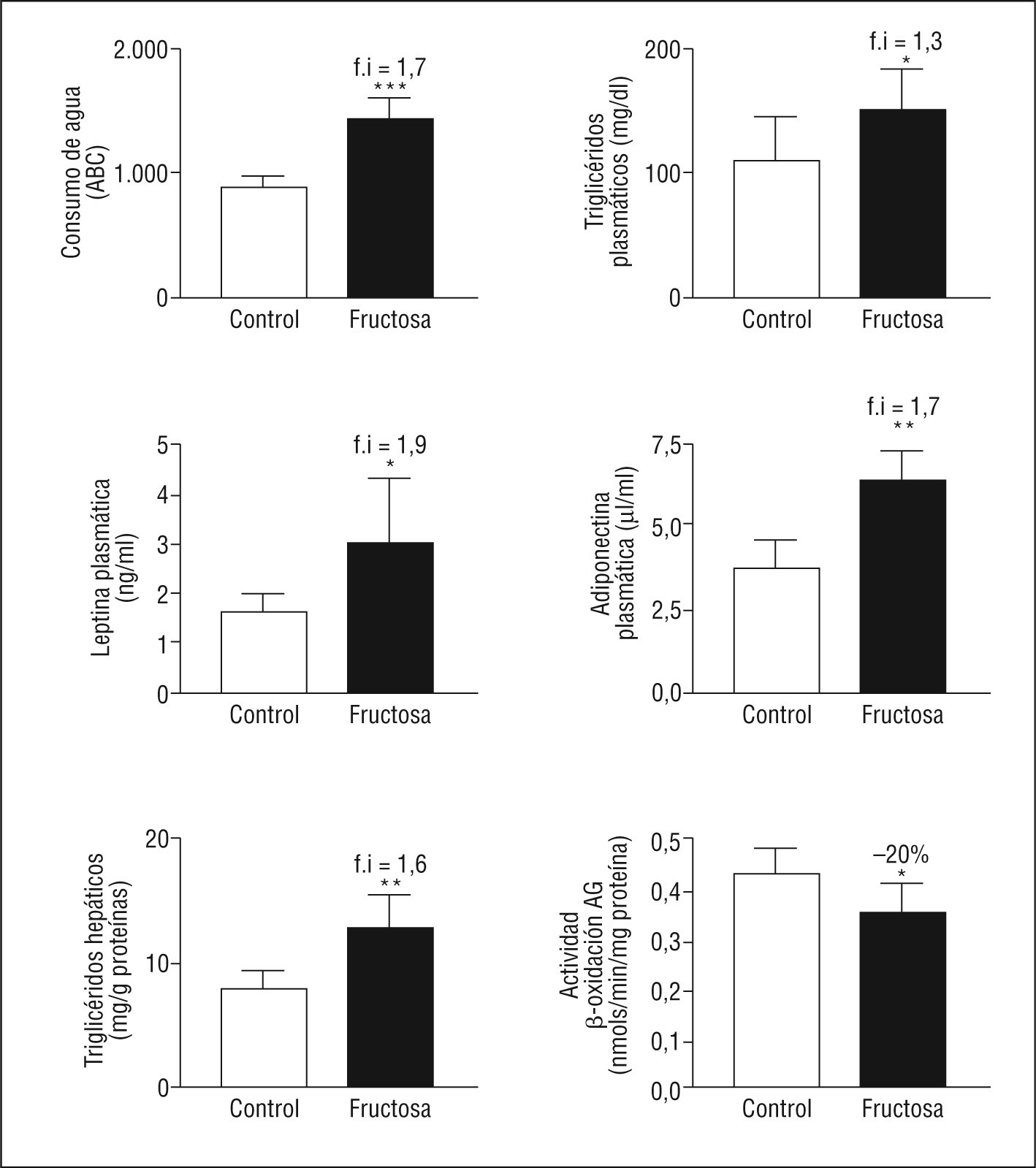
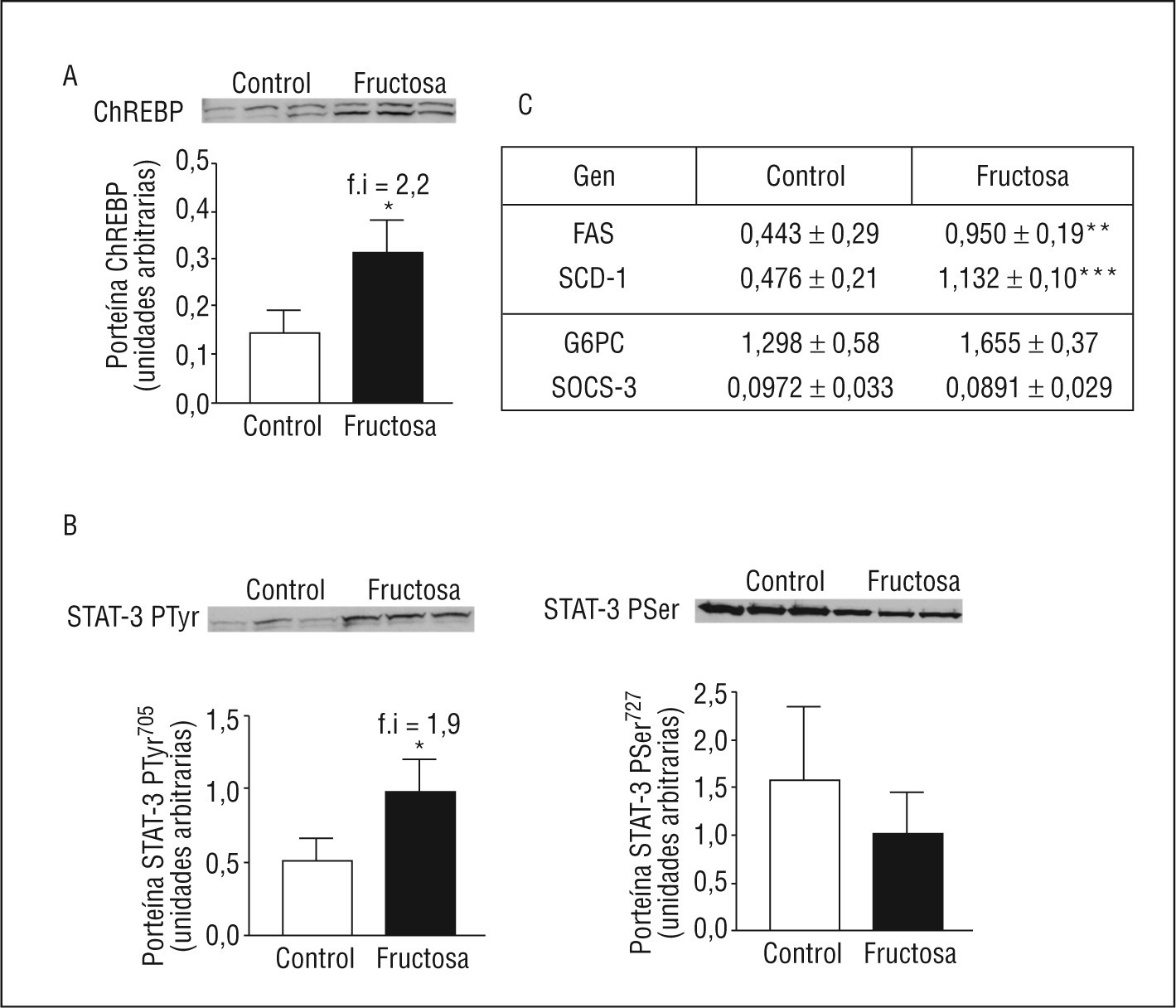
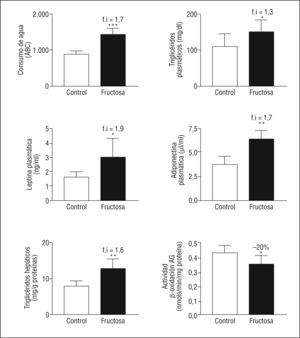
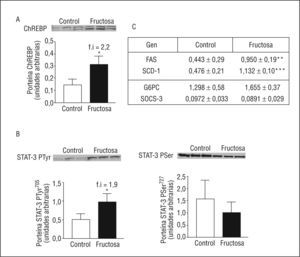
ResultadosEl consumo de fructosa induce hiperleptinemia, hipertrigliceridemia, esteatosis hepática y un déficit de fosforilación de STAT3-PSer727Las ratas FR al 10% presentan un incremento en el consumo de agua (1,7X), sin presentar cambios significativos en el peso corporal ni en el consumo de dieta sólida. Las ratas FR son hipertrigliceridémicas (1,3X) y presentan concentraciones plasmáticas elevadas de leptina (1,9X) y adiponectina (1,7X). Además, las ratas FR presentan unos valores de triglicéridos hepáticos elevados (1,6X) y una reducción en la actividad de β-oxidación de los ácidos grasos (0,8X), respecto a las ratas CT (Figura 1). Tal como se observa en la Figura 2, las ratas FR presentan un incremento en la expresión de ChREBP (del inglés carbohydrate response element binding protein, 2X) y de genes relacionados con la síntesis de ácidos grasos. Por otro lado, las ratas FR también presentan un incremento en la expresión de STAT-3-PTyr705 (1,9X), mientras que no muestran ningún cambio en la fosforilación de STAT-3-PSer727 ni en la expresión de diferentes genes regulados por la leptina. Estos resultados son prácticamente idénticos a los que presentamos en una publicación previa8, con lo que así se confirma que la suplementación de la dieta con fructosa al 10% en el agua de bebida en ratas provoca la inducción de hiperleptinemia y de un estado de resistencia a la leptina.
Figura 1. Valores del consumo de bebida y análisis de lípidos, leptina, adiponectina y de actividad hepática de β-oxidación de los ácidos grasos. Las gráficas muestran los valores plasmáticos y hepáticos de ratas control (barra blanca) y ratas suplementadas con fructosa (barra negra). Los resultados corresponden a la media ± desviación estándar para 6 animales por grupo de tratamiento. La bebida se expresa como la media ± desviación estándar de 4 jaulas de 2 animales cada una. *p < 0,05; **p < 0,01; ***p < 0,001.
Figura 2. Expresión de ChREBP, fosfo-STAT-3 y genes relacionados, en muestras hepáticas de ratas suplementadas con fructosa. A. Gráfica de los valores proteicos de ChREBP en tejido hepático. Cada barra representa la media ± desviación estándar para 6 animales por grupo de tratamiento. En la parte superior de la gráfica se puede observar la autorradiografía representativa del ensayo de Western blot, en el que se muestran las bandas correspondientes a 3 ratas control y 3 ratas fructosa. La uniformidad de carga se comprobó con el reactivo Rojo Ponceau. B. Gráfica de los valores de STAT-3-PTyr705 (izquierda) y de STAT-3 fosforilada en serina (STAT-3-PSer727) (derecha) en muestras hepáticas de ratas control y fructosa. Cada barra representa la media ± desviación estándar para 6 animales por grupo de tratamiento. La uniformidad de carga se comprobó con el reactivo Rojo Ponceau. C. Valores relativos de ácido ribonucleico mensajero para el gen de la FAS, SCD-1, G6pc y SOCS-3 (del inglés supresor of cytokine signaling 3) de muestras hepáticas control y fructosa. Cada valor representa la media ± desviación estándar de 6 animales por grupo, expresado en unidades arbitrarias. *p < 0,05; **p < 0,01; ***p < 0,001.
El consumo de fructosa impide que la leptina active AMPK a través de la vía MAPKLa leptina y la adiponectina controlan el catabolismo de los ácidos grasos y la producción de glucosa en el tejido hepático, en parte a través de la activación de AMPK16. Nuestro grupo ha demostrado anteriormente que las ratas FR no presentan cambios en la expresión proteica de la forma fosforilada y activa de AMPK (AMPK-PThr) en el ámbito hepático8. Los datos actuales confirman los resultados anteriores, las ratas FR presentan unos valores de AMPK-PThr similares, pero también presentan un valor de actividad AMPK similar a las ratas CT (6,636 frente a 7,974cpm/μg proteína/min, actividad de pools de 6 muestras FR y CT de tejido hepático, respectivamente), cuantificados utilizando el péptido comercial SAMS (Upstate) como sustrato de la reacción.
La fosforilación y la activación de AMPK es inducida por una cinasa serina/treonina, LKB1 cinasabb0085, bb0090. Al mismo tiempo, la activación de LKB1 también depende de su fosforilación en el residuo Ser431 a través de la vía de las MAPK, concretamente de la última efectora de esta vía, que es ERK19.
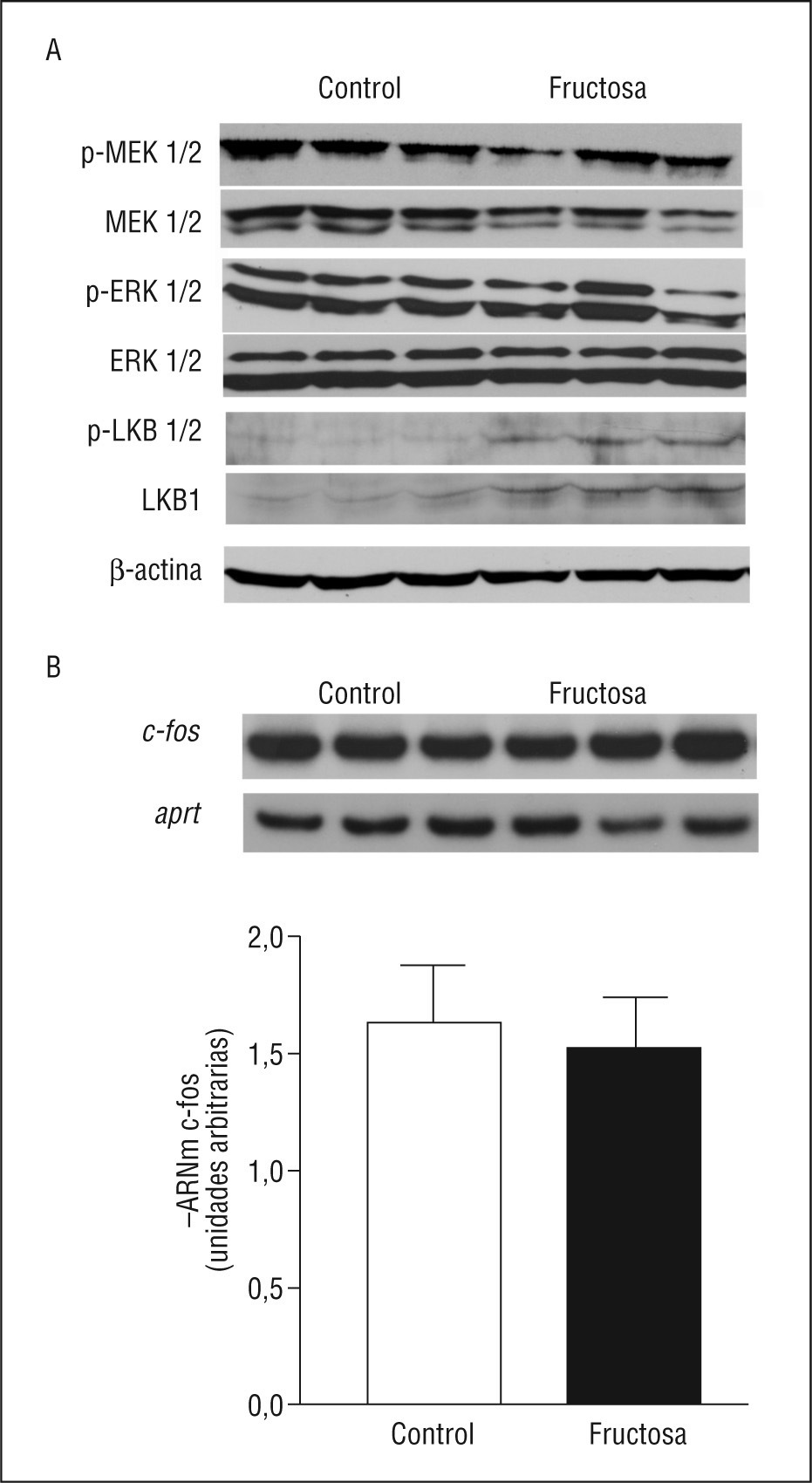
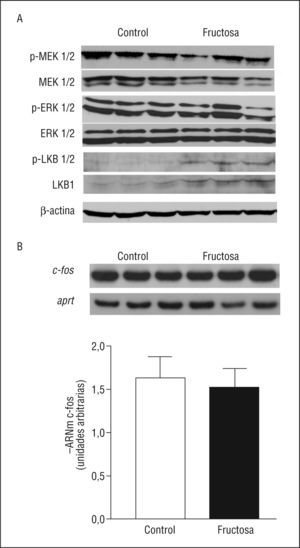
Como la leptina es capaz de activar la vía de las MAPK a través de la unión a su receptor ObRL20, hemos querido analizar de qué forma el consumo de fructosa afecta a estas actividades. Aun presentando valores de leptina plasmática incrementados 1,9X respecto a las ratas CT, las ratas FR no presentan cambios en la expresión proteica de las formas fosforiladas y activas en posición serina de LKB1, MEK y ERK (Figura 3). Aunque la expresión hepática de LKB1 (fosforilada y total) está incrementada en las ratas FR, la relación entre las formas fosforilada y total de LKB1 no presenta ningún cambio (0,43 ± 0,23 frente a 0,47 ± 0,06, n = 6 para ratas CT y FR, respectivamente), indicando que la actividad de esta enzima no está modificada por la ingestión de fructosa. Además, la expresión hepática de cfos, gen activado directamente por la vía de las MAPK20, tampoco presenta diferencias entre las ratas CT y FR, dato que nos confirma la falta de actividad de la vía de las MAPK (Figura 3). Por lo tanto, la falta de activación de la vía de las MAPK por parte de la leptina puede ser la causa de la falta de actividad hepática de AMPK en las ratas FR.
Figura 3. Actividad hepática de la vía de las MAPK (del inglés mitogen activated protein kinase) en ratas suplementadas con fructosa. A. Western blots de las formas total y activas de MEK 1/2, ERK 1/2 y LKB1 en muestras hepáticas de ratas control y fructosa. La uniformidad de carga se comprobó con la determinación de la señal de β-actina. B. Valores relativos de ácido ribonucleico mensajero (ARNm) de c-fos en muestras hepáticas de ratas control y fructosa. Cada barra representa la media ± desviación estándar del ARNm para 6 animales por grupo, expresado en unidades arbitrarias. En la parte superior de la gráfica, se puede observar la autorradiografía representativa del ensayo de reacción en cadena de la polimerasa para 3 ratas control y fructosa, correspondientes al gen c-fos y al gen aprt, utilizado como control interno para normalizar los resultados.
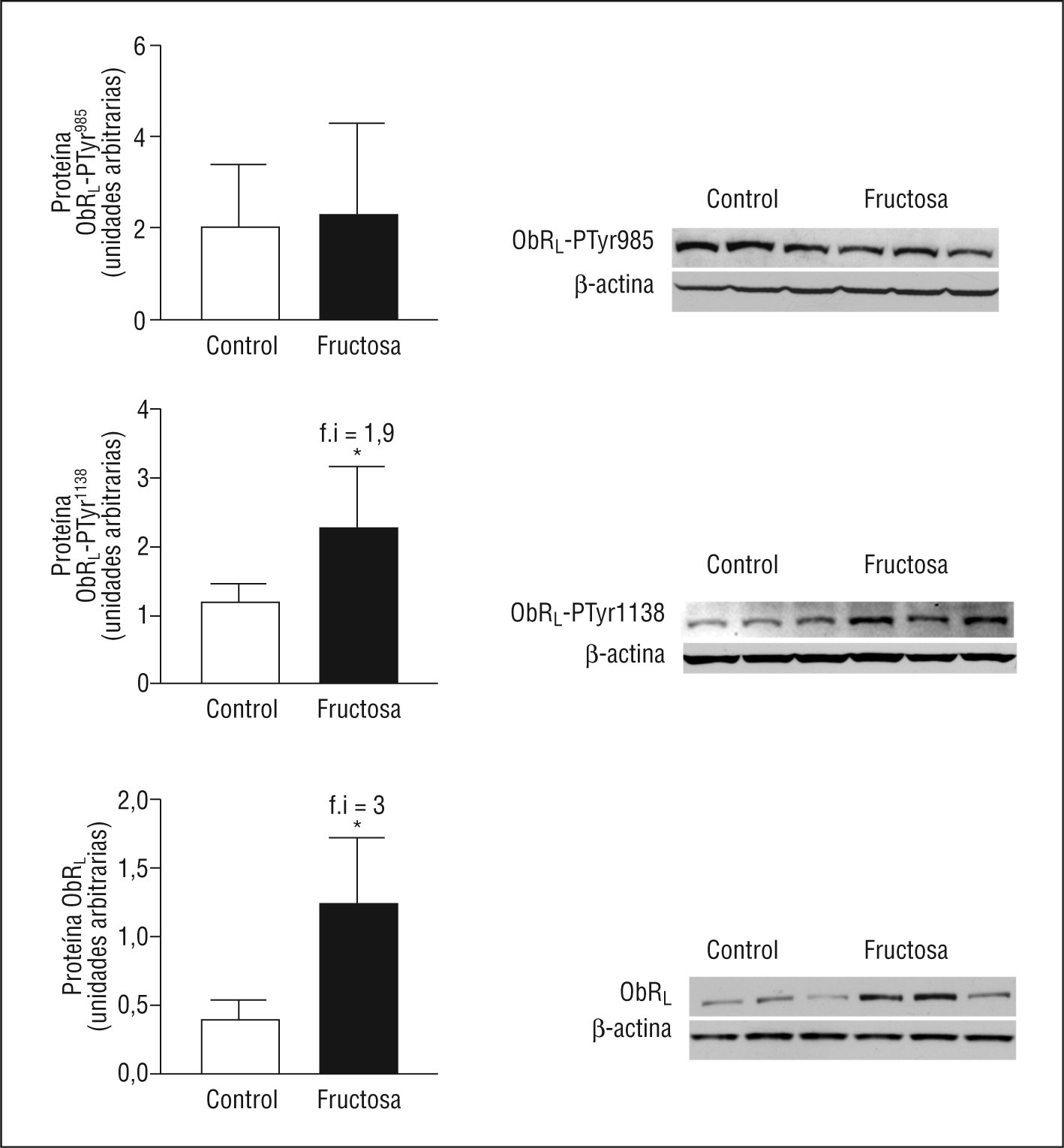
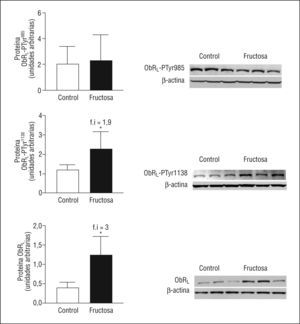
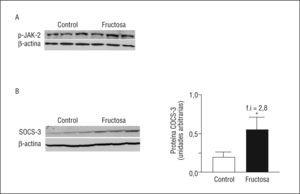
La falta de activación de la vía de las MAPK en las ratas fructosa se debe a una disfunción en el receptor de la leptina (ObRL)Cuando la leptina se une a su receptor induce, entre otros cambios, la fosforilación y la activación de JAK-2 y también fosforila, entre otros, 2 residuos tirosina, Tyr985 y Tyr1138, ambos se encuentran en la parte citosólica del receptor, y se involucran en la transducción de la señal de la leptina20. Mientras que la leptina activa la vía de las MAPK a través de JAK-2-PTyr o ObRL-PTyr985, la activación de STAT-3 mediante su fosforilación en STAT-3-PTyr705 y su dimerización posterior se controlan mediante ObRL-PTyr1138,19. La expresión de ObRL está incrementada en las ratas FR (3X) así como la cantidad de ObRL-PTyr1138 (1,9X), que aumenta de forma parecida a la leptina plasmática y a la forma de STAT-3-PTyr705 (Figura 4). En cambio, ni la expresión de ObRL-PTyr985 ni de JAK-2-PTyr presentan diferencias entre las ratas FR y CT, indicando que la falta de actividad de la vía de las MAPK en las ratas FR, aun presentando valores elevados de leptina en plasma, se debe a una alteración en la vía de señalización de esta hormona, en el ámbito del ObRL. Hay estudios que demuestran que un incremento en la expresión de SOCS-3 actúa bloqueando la fosforilación de JAK-2 y ObRL-PTyr985,21. Aunque los valores de SOCS-3 ARNm no están modificados en las ratas FR, sí se observa un incremento en la expresión proteica de SOCS-3 (2,8X), respecto a las ratas CT (Figura 5).
Figura 4. Valores proteicos de ObRL en muestras hepáticas de ratas suplementadas con fructosa. Las gráficas muestran los valores proteicos de ObRL-PTyr985, ObRL-PTyr1138 y de ObRL total en ratas control y fructosa. Cada barra representa la media ± desviación estándar de 6 animales por grupo. En la parte derecha de cada gráfica, se muestra el ensayo de Western blot de las formas fosforiladas y total de ObRL, correspondientes a 3 ratas control y fructosa. La uniformidad de carga se comprobó con la determinación de la señal de β-actina. *p < 0,05.
Figura 5. Valores proteicos de JAK-2 (del inglés Janus-activated kinase 2) y SOCS-3 (del inglés supresor of cytokine signaling 3) en muestras hepáticas de ratas suplementadas con fructosa. A. Western blot de la forma fosforilada y activa de JAK-2 en ratas suplementadas con fructosa. La uniformidad de carga se comprobó con la determinación de la señal de β-actina. B. Western blot de SOCS-3 en muestras hepáticas de ratas control y fructosa. La uniformidad de carga se comprobó con la determinación de la señal de β-actina. En la parte derecha de la figura se muestra la cuantificación de los valores proteicos de SOCS-3, expresados como la media ± desviación estándar de 6 animales por grupo. *p < 0,05.
DiscusiónRecientemente, nuestro grupo ha demostrado que la administración de fructosa al 10% en el agua de bebida a ratas induce hipertrigliceridemia y esteatosis hepática, junto con un estado de resistencia hepática a la leptina y de hiperleptinemia8, y que este estado de resistencia es la causa de la falta de actividad de AMPK y PPARα. Además, hemos proporcionado pruebas de que la diferencia importante entre la ingestión de cantidades similares de fructosa y glucosa en el agua de bebida es el hecho de que, mientras ambos azúcares incrementan de forma similar la lipogenia hepática, sólo el primero es capaz de reducir de forma significativa la actividad hepática de β-oxidación de los ácidos grasos. En el presente trabajo, proporcionamos datos experimentales que revelan un posible mecanismo capaz de explicar las alteraciones metabólicas que aparecen en el hígado cuando se suplementa la dieta de ratas con fructosa al 10% en el agua de bebida.
Cuando la leptina se une a su receptor, éste se fosforila en diferentes posiciones, una de las cuales es la causa de la fosforilación de STAT-3 en posición tirosina (STAT-3-PTyr705). Esta primera forma fosforilada formará un homodímero y volverá a fosforilarse esta vez en posición serina (STAT-3-PSer727). Es esta forma doblemente fosforilada la que tiene la máxima actividad transcripcional22.
El estado de resistencia a la leptina que presentan las ratas FR puede deberse a la falta de fosforilación y activación de STAT-3-PSer727 que hemos observado, ya que, como hemos comentado anteriormente, esta fosforilación es necesaria para su máxima actividad transcripcional. En otros estudios en los que se utilizan macrófagos estimulados con leptina, se ha observado que la adición de un inhibidor de ERK 1/2 (última proteína efectora de la vía de las MAPK), como el PD98059, provoca una reducción en la fosforilación de STAT-3-PSer727 junto con una disminución en su actividad transcripcional, mientras que no se observan cambios en la fosforilación de STAT-3-PTyr705,23. En nuestro estudio, hemos podido observar que, aunque las ratas FR presentan hiperleptinemia respecto a las CT, no presentan ningún cambio en la expresión de proteínas pertenecientes a la vía de las MAPK, como MEK 1/2 y ERK 1/2. También hemos visto que c-fos, gen que se activa a través de la vía MAPK, tampoco presenta ningún tipo de modificación.
Por lo tanto, la falta de activación de la vía de las MAPK, observada en las ratas FR, probablemente es la causa de la falta de fosforilación de STAT3PSer727 y, por lo tanto, de la falta de modificación de genes regulados en condiciones normales por la leptina.
Además, la leptina a través de la vía de las MAPK también es capaz de activar AMPK, que como hemos observado tampoco presenta diferencias entre las ratas CT y FR. El ERK 1/2 es capaz de activar por fosforilación a LKB-1-PSer431, último encargado de la activación y la fosforilación de la AMPK y que tampoco se encuentra modificado en las ratas FR.
En condiciones normales, cuando la leptina se une a su receptor, éste se fosforila en posiciones diferentes; una de ellas, ObRL-PTyr985, es necesaria para la activación de la vía de las MAPK, también denominada Ras/Raf/ERK20.
Aunque la activación de ERK es mediada mayoritariamente por ObRL-PTyr985, también puede regularse por JAK-2, que también se activa por fosforilación en posición tirosina cuando la leptina se une a su receptor19. Las ratas FR, aun presentando valores elevados de leptina en plasma, no presentan diferencias en la expresión proteica, tanto de ObRL-PTyr985 como de JAK-2-PTyr, respecto a las ratas CT. En cambio, la expresión proteica de ObRL-PTyr1138, posición que media la fosforilación de STAT-3-PTyr705, sí presenta un incremento significativo en las ratas FR.
Por lo tanto, la falta de fosforilación de los residuos tirosina de ObRL-PTyr985 y de JAK-2-PTyr, parecen ser la causa de la falta de actividad de la vía de las MAPK y, como consecuencia, también del déficit de actividad de AMPK y de STAT-3. Esta disfunción en el receptor puede deberse al incremento observado en la expresión hepática de la proteína SOCS-3, ya que se ha descrito que SOCS-3, la expresión de la cual está controlada por la leptina, actúa uniéndose a residuos específicos de tirosina, con lo que así bloquea la fosforilación de ObRL-PTyr985 y de JAK-2 o facilita su degradación21, mientras que se mantiene la fosforilación de ObRL-PTyr1138, único encargado de la activación inicial de STAT-3-PTyr705 y posterior dimerización.
Esta situación explicaría los valores iguales que hemos observado en los valores de leptina plasmática (1,9X), y expresión proteica de ObRL-PTyr1138 (1,9X) y de STAT-3-PTyr705 (1,9X), que se encuentran incrementados en las ratas Fr respecto a las CT.
En resumen, la acumulación proteica de SOCS-3 sería la causa de la falta de activación de ObRL-PTyr985 y de JAK-2 observada en las ratas FR. Como consecuencia, se observa el déficit de actividad de la vía de las MAPK, que es la causa final de la falta de actividad de AMPK y de STAT-3 y, por lo tanto, del estado de resistencia parcial a la leptina.
El hecho de que el metabolismo de la fructosa sea similar entre personas y ratas26, y que se haya descrito que la administración de fructosa en humanos sanos provoca hiperleptinemia9, hace verosímil que una situación similar a la descrita en este trabajo pueda estar sucediendo en las poblaciones que consumen grandes cantidades de bebidas edulcoradas con fructosa.
Agradecimientos
A CIBERDEM, una iniciativa del Instituto de Salut Carlos III.
* Este trabajo ha sido financiado por una beca FEA/SEA Manuel de Oya, investigación en Nutrición, convocatoria 2007 y por los proyectos FIS PI070875// PI060247
Recibido 18 Septiembre 2008
Aceptado 25 Septiembre 2008