La presente guía es un proyecto compartido de la Sociedad Española de Arteriosclerosis (SEA) y la Sociedad Española de Angiología y Cirugía Vascular (SEACV) dirigido a médicos y cirujanos implicados en el manejo de pacientes con aneurisma de aorta abdominal (AAA). Esta es la primera guía sobre esta entidad realizada en nuestro país.
Si bien ya existen guías europeas y norteamericanas sobre este tema1–3, hace casi 5 años que se publicaron las últimas. Además, el incremento progresivo de las publicaciones sobre el AAA en los últimos años, los avances médicos y los progresos técnicos en el manejo de estos pacientes hacen necesario unas recomendaciones basadas en la mejor evidencia posible, que desgraciadamente no siempre son ensayos clínicos aleatorizados.
1.2ObjetivoNuestro objetivo es proponer un conjunto de recomendaciones desarrolladas de manera sistemática, con el objetivo de guiar a los profesionales en el proceso de la toma de decisiones sobre qué intervenciones sanitarias son más adecuadas en el diagnóstico y tratamiento del AAA. Con ellas intentamos apoyar a los profesionales para que conozcan, evalúen e implanten la cada vez mayor cantidad de evidencia científica disponible y para que puedan tomar sus decisiones basadas en la mejor práctica clínica.
Deseamos que esta guía sea una herramienta de ayuda a la hora de tomar decisiones clínicas en la práctica diaria, pero que, en ningún caso, sustituye al juicio clínico. Dado que no existen respuestas para todas las cuestiones que se plantean en la actividad diaria, la decisión final sobre un procedimiento diagnóstico o terapéutico de un paciente concreto dependerá de las características de este y de las circunstancias que le rodeen.
1.3Niveles de evidencia y grados de recomendaciónLa fuerza de las recomendaciones y la calidad de la evidencia están basadas en el sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation)4,5. La graduación de la fuerza de las recomendaciones en este sistema solo considera 2 categorías: recomendaciones fuertes a favor o en contra (cuando los efectos beneficiosos superan claramente a los perjudiciales o viceversa) y recomendaciones débiles a favor o en contra (cuando los efectos beneficiosos probablemente superan a los perjudiciales o cuando los efectos adversos probablemente superan a los beneficiosos) (tabla 1). A la hora de ponderar la fuerza y dirección de una recomendación hay que considerar: el balance entre los beneficios y los riesgos, los valores y preferencias de la población, la calidad de la evidencia y los costes.
La calidad de la evidencia científica se clasifica en alta, moderada, baja y muy baja (tabla 2). Se valora como calidad alta a los ensayos clínicos aleatorizados y como calidad baja a los estudios observacionales u otras evidencias. Sin embargo hay una serie de factores que pueden disminuir la calidad de la evidencia, como son: las limitaciones en el diseño y/o en la ejecución del estudio, los resultados inconsistentes, la ausencia de evidencia directa, la imprecisión de los resultados y el sesgo de publicación. Asimismo, también existen factores que pueden incrementar la calidad de la evidencia, como son: la existencia de una asociación fuerte o muy fuerte y consistente entre la intervención y el efecto observado o la existencia de un gradiente dosis-respuesta.
El comité de redacción ha estado formado por miembros del grupo de prevención secundaria de la SEA y del grupo de medicina vascular de la SEACV. Todos los capítulos han sido revisados al menos por 2 personas diferentes del comité y la versión final ha sido revisada y aprobada por todos sus miembros.
2DefiniciónUn aneurisma en la terminología médica es una dilatación permanente localizada de un vaso sanguíneo. La dilatación se relaciona con un debilitamiento de la pared aórtica, que ocurre con mayor frecuencia en la aorta abdominal por debajo de las arterias renales y se conoce como un AAA infrarrenal, mientras que los AAA del segmento suprarrenal representan solo el 5% de los casos6. El diámetro normal de la aorta abdominal varía dependiendo de la edad, el sexo y el peso corporal, y disminuye progresivamente hasta la bifurcación de las arterias ilíacas7. En un varón de edad avanzada, el diámetro de la aorta infrarrenal varía entre 15 y 24 mm8. No existe un consenso definitivo sobre la definición del proceso, sin embargo, la definición más aceptada de aneurisma es la de una dilatación de la aorta con un diámetro > 30 mm, que representa más de 2 derivaciones estándar sobre el diámetro medio para varones y mujeres6. Existen otras definiciones no tan aceptadas, como la de considerar como AAA una dilatación de la aorta infrarrenal al menos 1,5 veces más grande que el diámetro esperado como normal9.
En un AAA, la dilatación afecta a toda la pared aórtica incluyendo las 3 láminas, en otros casos de afectación parcial de la pared hablaremos de seudoaneurismas. Según la forma se pueden caracterizar como saculares, cuando solo afectan a parte de la circunferencia del vaso, o fusiformes, cuando afectan a todo el diámetro del vaso.
3EpidemiologíaMás del 1% de los fallecimientos en varones por encima de los 55 años están causados por la rotura de un AAA, siendo la décima causa de muerte en este grupo de edad10. Dado que la mayoría son asintomáticos y que la rotura es la primera manifestación clínica, la tasa de mortalidad es muy alta (entre un 65 y un 85%). Alrededor de la mitad de las muertes causadas por la rotura ocurre antes de que el paciente sea intervenido quirúrgicamente11,12.
Los primeros datos epidemiológicos fueron obtenidos de necropsias. En un estudio realizado en Suecia se encontró una prevalencia del 4,7% en varones y del 1,2% en mujeres de entre 65 y 74 años13. La prevalencia estimada mediante estudios de cribado varía dependiendo de las áreas geográficas, el sexo, la edad y los criterios usados para definir el AAA14. Se han publicado 4 ensayos clínicos de cribado, con una prevalencia de AAA de entre el 4 y el 7,9% en varones y del 1,2% en mujeres, de entre 60 y 80 años10,12,15,16. En un reciente metaanálisis de 56 estudios epidemiológicos se encontró una prevalencia del 4,8% en población general (el 6% en varones y el 1,6% en mujeres)17. La frecuencia varía entre los diferentes estudios y países entre un 1,3 a un 8,9% en los varones y entre un 1 y un 2,2% en las mujeres18–20. Al igual que la enfermedad coronaria, en las mujeres el pronóstico es peor que en los varones y el riesgo de rotura del aneurisma es más alto21,22. Generalmente, los AAA son pequeños y solo en un 7% son > 5 mm, aumentando su prevalencia y tamaño con la edad23.
Aunque la incidencia anual es difícil de estimar, estudios de cribado realizados en Estados Unidos y en Reino Unido han estimado una incidencia media en varones mayores de 50 años de entre 3,5 y 6,5 por 1.000 personas/año23,24. La incidencia de AAA se incrementó durante las 2 últimas décadas del siglo xx debido, en parte, al envejecimiento de la población25 y al aumento del número de fumadores26. Sin embargo, desde el comienzo del presente siglo en la mayoría de los países occidentales ha existido un descenso de la incidencia y se han alcanzado unas reducciones de entre el 38 y el 56% de nuevos casos de AAA, el mayor descenso se da en el grupo de edad por debajo de los 75 años27. Esta reducción de la incidencia ha sido paralela al descenso del tabaquismo28, factor de riesgo fundamental para el desarrollo del AAA y responsable del 75% del exceso de prevalencia de AAA > 4 cm29. En algunos países ha existido un aumento de la incidencia de AAA en mujeres que, al contrario que en los varones, han incrementado el tabaquismo30. También se han apuntado otras razones para el descenso de la incidencia en los últimos años, como el uso de estatinas31.
En nuestro país existen algunos estudios de prevalencia del AAA con pocos cientos de participantes, varones con diferentes edades, realizados en distintas áreas geográficas32–34. La prevalencia del AAA en varones mayores de 65 años oscila entre el 3,3 y el 4,7%. El conocimiento de la prevalencia real del AAA en varones y mujeres de nuestro país tiene gran interés, ya que estos datos influyen sobre el coste-efectividad del cribado del AAA35.
El AAA es una de las enfermedades con más común afectación familiar. Hay un aumento de incidencia en los familiares de los pacientes con AAA de hasta 4 veces mayor que en la población general. La prevalencia de aneurisma en familiares de primer grado es del 15-19% comparado con el 1-3% en población general36.
4EtiologíaLa etiopatogenia del AAA es compleja y todavía no está bien aclarada. El AAA es una patología multifactorial donde intervienen factores bioquímicos, físicos, metabólicos, hereditarios y/o alteraciones en la actividad proteolítica en la pared aórtica. La influencia de factores biomecánicos se ha relacionado con la formación, el crecimiento y la rotura aneurismática. La mayoría de estos factores tiene una influencia directa en la estructura de la pared aórtica provocando una degeneración de los elementos estructurales y un remodelado de la media, con evidencia de inflamación crónica, destrucción de la lámina elástica y depleción del músculo liso.
4.1Factores de riesgo para el desarrollo y ruptura del aneurisma de aorta abdominalSe han descrito varios factores asociados a un mayor riesgo de desarrollar AAA. La edad avanzada parece asociarse con un mayor riesgo37. En un estudio que incluyó 4.345 sujetos se concluyó la menor probabilidad de desarrollar un AAA en edades entre 25 y 54 años que en mayores de 75 años38. Los familiares de primer grado de sujetos con AAA tienen el doble de riesgo de desarrollar un AAA que los que no tenían familiares afectados39. En un estudio canadiense con 245 familiares de pacientes con AAA se encontró que la prevalencia de AAA era hasta 8 veces más frecuente que en sujetos sin familiar afectado40. En algunos estudios, las mujeres parecen tener una menor prevalencia de AAA41, aunque no en todos42. Los fumadores tienen un riesgo hasta 7 veces mayor de desarrollar un AAA que personas que nunca fumaron43, además de una mayor rapidez en el crecimiento del AAA44 y un riesgo doble de ruptura45. Se ha descrito que la elevación de la presión arterial puede aumentar el riesgo de padecer un AAA, aunque es un tema controvertido38,44,46,47. La asociación entre la hipertensión arterial y la formación y crecimiento del AAA es débil, como se describió en la cohorte de Tromsø27. En un estudio transversal con más de 5.000 participantes de ambos sexos se encontró que los pacientes hipertensos tenían un 50% más de probabilidades de ser diagnosticados de AAA que los no hipertensos48. En cuanto a la diabetes mellitus existen datos que sugieren su efecto protector para la formación y desarrollo del AAA49, pero no así en cuanto al riesgo de ruptura50. En un reciente metaanálisis de 7 estudios retrospectivos se encontró una reducida incidencia de diabetes en pacientes con AAA51. Por otra parte, queda bien demostrado que ni el peso52–57 ni los lípidos plasmáticos54,58 ni la enfermedad pulmonar obstructiva crónica (EPOC)59,60 influyen en el crecimiento aneurismático.
El United Kingdom Small Aneurysm (UKSAT) reportó 103 aneurismas rotos en 2.257 pacientes en un período de 7 años, con una relación anual de ruptura del 2,2%44. Entre los factores significativamente asociados de manera independiente con un incremento del riesgo de ruptura se incluían: el sexo femenino (de 2 a 4 veces más que los varones), el diámetro inicial del aneurisma, el bajo volumen espiratorio (FEV1), el hábito tabáquico y la hipertensión arterial44. Un reciente metaanálisis ha confirmado que el riesgo de ruptura está aumentado en mujeres, fumadores e hipertensos42.
4.2Factores involucrados en la etiopatogenia del aneurisma de aorta abdominal4.2.1Factores bioquímicosHistológicamente, una alteración constante en la pared aórtica de los AAA es la destrucción de la capa media y la pérdida de la arquitectura de las fibras de colágeno, que a su vez son reemplazadas por matriz extracelular. Este tejido débil y con poca elasticidad condiciona la situación que lleva a la dilatación progresiva de la pared61.
En diferentes estudios se ha observado una mayor actividad proteolítica mediada por enzimas como las elastasas y metaloproteinasas (MMP-2), así como un aumento en la actividad macrofágica y de citocinas, que sugieren un componente inflamatorio de la enfermedad62,63. Se ha demostrado también una importante relación de asociación entre AAA y la existencia de EPOC, que se atribuye a la degradación de la elastina provocada por el tabaco64. Sin embargo, otros estudios concluyen que la relación entre AAA con EPOC depende en mayor grado de la medicación utilizada para el tratamiento de los enfermos respiratorios que de los mecanismos fisiopatológicos comunes65. El tratamiento con doxiciclina se asocia con el descenso de las concentraciones plasmáticas de MMP-9 en pacientes afectados de AAA asintomáticos, por lo que podría ser útil en el control de pequeños aneurismas66.
4.2.2Factores hereditariosSe ha demostrado en diferentes estudios una predisposición genética en la frecuencia de aparición del AAA67. En los hijos de los pacientes que han sufrido ruptura del AAA encontraron dilataciones aórticas > 3 cm en el 21% de los varones y el 4% de las mujeres68. En parientes de primer grado de consanguinidad, la prevalencia de AAA oscila entre un 15 y un 18%68,69. En varones de primer grado de consanguinidad, el riesgo relativo es entre 3 y 4 veces mayor que en la población general70. Por todo ello se propone la existencia de un gen dominante responsable del AAA, aunque todavía no se ha identificado. A pesar de que la presencia de AAA en familiares tiende a presentarse en edades más tempranas, la velocidad de crecimiento es similar a la de los no familiares70.
4.2.3Factores congénitosDiferentes enfermedades de origen congénito están asociadas a la presencia de AAA mediado por una degeneración quística de la capa media aórtica que causa pérdida de las fibras elásticas, necrosis del músculo y aparición de cavidades quísticas rellenas de material mucoide. La enfermedad que mejor caracteriza estas lesiones es el síndrome de Marfán71,72. Si bien en la gran mayoría de estos pacientes los aneurismas se presentan en la aorta ascendente. Otras enfermedades como el síndrome de Ehlers-Danlos y la enfermedad poliquística renal se asocian también con la presencia de AAA73,74.
4.2.4Aneurismas inflamatoriosExiste un pequeño porcentaje de pacientes con AAA, entre el 4 y el 6%, que presenta un cuadro inflamatorio grave, en el que destaca el marcado engrosamiento de la pared aórtica acompañado de una fibrosis blanquecina periaórtica con densas adherencias a las demás estructuras abdominales y retroperitoneales75. No se conoce una causa directa de esta reacción inflamatoria, si bien se asocia con una gran afectación arteriosclerótica en otras arterias del organismo76,77.
4.2.5Aneurismas infecciososSe han descrito 2 mecanismos principales con la presencia de AAA infecciosos: por un lado, la siembra directa de un microorganismo a nivel de la pared aórtica o en una placa ateromatosa y, por otro, la siembra hematógena de un microorganismo en un AAA preexistente. Producen principalmente aneurismas saculares de crecimiento rápido y se aíslan con frecuencia gérmenes como Staphylococcus -aureus y Salmonella y, en menor grado, Mycobacterium tuberculosis78. Hasta en un 30-50% de los casos se han aislado también anticuerpos anti Chlamydia pneumoniae en placas ateroscleróticas y aneurismas, sin que se haya podido demostrar que este agente sea el causante de los cambios arteriales descritos79,80.
4.2.6Alteraciones de la pared aórticaLa biomecánica de la aorta presenta modificaciones en relación con los cambios estructurales y de la geometría arterial. Aunque la ley de Laplace se ha utilizado para explicar la relación entre presión tangencial, radio y presión arterial, este modelo solo es aplicable para estructuras cilíndricas, mientras que en los AAA, el crecimiento hace adoptar una conformación esférica. Este cambio de morfología reduce la tensión en la pared respecto a la que se obtiene a partir de dicha ley81. El diámetro máximo y el riesgo de rotura, por otro lado, no pueden considerarse como sinónimos en todos los casos, pues la composición de la pared y la morfología del aneurisma no son uniformes, y los puntos de mayor tensión no coinciden con el de mayor diámetro81,82.
4.3Otras patologías asociadasLa cardiopatía isquémica, la insuficiencia renal (IR) crónica, la EPOC, las enfermedades cerebrovasculares junto con la arteriosclerosis generalizada, la hipercolesterolemia y la hipertensión arterial son las patologías más comunes que están asociadas al desarrollo y complicaciones del AAA24,83,84.
5Historia natural5.1Progresión del aneurismaLa historia natural del AAA es expandirse de forma progresiva, debido a la degeneración biológica de la pared arterial ocasionada por la pérdida de sus proteínas estructurales, lo que conlleva una merma en su resistencia85–88. La celeridad de esta dilatación es variable, en función del diámetro del aneurisma —a mayor diámetro, mayor velocidad de crecimiento— y de los factores de riesgo o patologías concomitantes45,47,50,58,89–91. Tres metaanálisis recientes42,92,93, pero desarrollados por el mismo grupo —RESCAN collaborators—, muestran que los aneurismas pequeños (3-5,4 cm) tienen un crecimiento medio anual que se sitúa en torno a los 2,2 mm. Dentro de este rango, cada 0,5 cm de tamaño mayor implica un crecimiento adicional de 0,5 mm anual y una duplicación del riesgo de ruptura. Esto significa que de promedio, un aneurisma de 3,0, 4,0, 4,5 y 5,0 cm tarda en alcanzar los 5,5 cm 9,6, 4,0, 2,3 y 1,1 años, respectivamente. Los autores hacen notar que los estudios tiene un alto grado de heterogeneidad y que de forma consistente reportan una amplia variación interindividual del crecimiento aneurismático. No obstante, estos datos justifican un seguimiento más estrecho en los pacientes con diámetros de AAA más elevados.
5.2Ruptura del aneurismaEl diámetro del aneurisma es el factor más importante que predispone a su ruptura50,90,94–97. Cuando un AAA supera los 5,5 cm, el riesgo de ruptura se incrementa dramática y progresivamente44,94,95,98,99 (tabla 3). Como ocurre cuando se examina el crecimiento aneurismático, los estudios son muy heterogéneos y sus tasas de ruptura muy variables. Tres metaanálisis estiman que en los aneurismas de entre 3,0-5,4 cm, por cada 0,5 cm más de tamaño, la probabilidad de que el AAA se rompa se multiplica por entre 1,6 y 2 veces42,92,93. El tiempo necesario para adquirir una probabilidad de ruptura del 1% anual es proporcional al diámetro basal. En los varones con un aneurisma de 3,0-4,5 cm fue de 2 años, disminuyendo a 1,2 años si medía 5,0 cm. La mujer requiere entre 2 y 2,5 veces menos tiempo a igualdad de tamaño93. De otros estudios previos se puede deducir que si la tasa de dilatación supera la velocidad de 0,5 cm en 6 meses, el riesgo de ruptura aneurismática también aumenta99–101, aunque este dato no queda ratificado en los estudios de seguimiento poblacional102–104.
*Recomendaciones sobre progresión y ruptura del aneurisma basadas en su historia natural:
• La tendencia natural del AAA es al crecimiento continuo. La velocidad de progresión y la posibilidad de ruptura dependen fundamentalmente de su diámetro, a mayor tamaño mayor velocidad de crecimiento. Este hecho justifica el seguimiento periódico de los pacientes con AAA.
- -
Nivel de recomendación: fuerte.
- -
Calidad de la evidencia: alta.
• Se recomienda fijar como dintel de alarma cualquier diámetro del AAA > 5,5 cm, o una velocidad de crecimiento mayor de 0,5 cm en 6 meses, ya que de superarse el riesgo de ruptura es máximo.
- -
Nivel de recomendación: fuerte.
- -
Calidad de la evidencia: alta.
El diagnóstico de certeza del AAA se establece con los estudios de imagen. Estos se pueden llevar a cabo como una prueba de cribado, o bien como método de confirmación de la sospecha de su existencia sobre la base de síntomas clínicos, de los hallazgos del examen físico o de la presencia de factores de riesgo concomitantes. No es infrecuente que su diagnóstico sea incidental en el transcurso de una técnica radiológica solicitada para evaluación de otras patologías. La frecuencia de estos hallazgos varía del 0,5 al 3% según el método empleado. Es importante señalar que esta información a menudo no pasa al médico de referencia y que hasta un tercio de los pacientes con aneurismas detectados no tiene un seguimiento posterior, lo que multiplica por 3 el riesgo de morir105.
El AAA se ha definido como “un tumor pulsátil que se presenta en el hipocondrio izquierdo o la región epigástrica”. Aproximadamente, en el 30% de los AAA asintomáticos se puede hacer un diagnóstico de presunción cuando se palpa una masa abdominal pulsátil en el examen físico de rutina106. La exploración clínica puede diagnosticar de forma fiable un gran aneurisma (> 5,5 cm), pero el diagnóstico mediante la palpación abdominal solo se realiza en el 38% de los pacientes con un AAA107. Por otra parte, los aneurismas que se palpan tienen un diámetro medio significativamente mayor. Dos revisiones sistemáticas encuentran que la sensibilidad de la palpación abdominal según el diámetro del AAA es del 29-61% para los que miden de 3,0 a 3,9 cm, del 50-69% de 4,0 a 4,9 cm y del 76-82% para los ≥ 5,0 cm106,108. Otra revisión más reciente y precisa encuentra que la sensibilidad de la exploración física para diagnosticar un AAA varía del 33 al 100%, la especificidad del 75 al 100% y el valor predictivo positivo del 14 al 100%109. Destaca también que las tasas de detección aumentan en función del tamaño del aneurisma, de su prevalencia en la población de estudio, del perímetro de la cintura del paciente —por debajo de los 100 cm se detectan todos—, de la experiencia del examinador y de si la exploración va dirigida específicamente a la detección del AAA109.
6.2Marcadores bioquímicosLos trombos se originan por la hemaglutinación de los eritrocitos y la captura de los neutrófilos, un proceso que libera hemoglobina al espacio vascular, lo que induce a la activación de las plaquetas y la puesta en marcha de la cascada de la coagulación, que culmina en la generación de trombina con formación y depósito de fibrina, causando lesiones proteolíticas y oxidativas de la pared arterial. La interacción intraluminal trombo-pared arterial conduce a la liberación de marcadores circulantes, cuya actividad podría medirse periféricamente. Estos marcadores reflejarían los ciclos de formación y fibrinólisis de los trombos murales no oclusivos dentro del saco aneurismático, cuya existencia es casi constante110–112. Sin embargo, no se dispone de estudios de laboratorio que identifiquen la presencia de AAA con certeza y que separen con precisión a sus portadores de la población sana. Esta afirmación es válida tanto para marcadores hemostáticos como para otros no hemostáticos113.
6.2.1Marcadores hemostáticosAunque los marcadores hemostáticos pueden estar elevados en pacientes con AAA, no son específicos y pueden ser anormales en una variedad de otras condiciones trombóticas114,115. Bajo esta premisa, no obstante, un metaanálisis puso de manifiesto que ante un AAA, los valores de fibrinógeno y de dímero D se encontraban significativamente elevados116. En una revisión sistemática más reciente, sobre 22 estudios no aleatorizados que abarcaron un total de 9.862 pacientes, se comparó los marcadores derivados de la coagulación en pacientes con y sin AAA, demostrando una asociación significativa entre la presencia de un aneurisma y los valores plasmáticos elevados de fibrinógeno, dímero D y del complejo trombina-antitrombina III117. Además, mediante un análisis de metarregresión se puso de manifiesto que la concentración de dímero D se correlaciona fuerte y significativamente con el diámetro del aneurisma. Esta condición, junto al hecho conocido de que los marcadores plasmáticos de la coagulación disminuyen drásticamente después de la reparación del aneurisma118, sugiere que el propio aneurisma impulsa los cambios observados, al reflejar el tamaño y la remodelación continua del trombo intraluminal119. Ello podría implicar la potencial utilidad de la determinación seriada de los valores de dímero D para el seguimiento de los pacientes con un AAA conocido. No obstante, el papel que en el futuro pudiera tener el dímero D como biomarcador del AAA precisa una confirmación mediante estudios de investigación específicos.
Aunque en estudios previos se ha encontrado asociación entre los AAA y algunos marcadores de la coagulación —como el tPA (activador tisular del plasminógeno), el PAI-1 (inhibidor del activador del plasminógeno 1), los PDF 1+2 (fragmentos de protombina 1+2); el complejo proteína C activada-inhibidor de la proteína C y el número de plaquetas—, este metaanálisis no encuentra diferencias significativas entre su concentración plasmática y la presencia o no de aneurismas120–124.
6.2.2Marcadores no hemostáticos• Elastasa. Se ha encontrado una correlación modesta pero significativa entre esta proteasa, que rompe la elastina aórtica, y la tasa de crecimiento de los AAA, sin aportar valor predictivo para discriminar quién requeriría tratamiento quirúrgico125. Se necesitan estudios más grandes con técnicas avanzadas (ELISA) para establecer su función exacta.
• Interleucina 6 (IL-6). Se ha demostrado que los valores circulantes de IL-6 son significativamente más altos en portadores de AAA que en controles126,127, correlacionándose con el tamaño del aneurisma en ausencia de inflamación sistémica, determinada por una proteína C reactiva (PCR) normal128,129, aunque no con la velocidad de crecimiento130.
• PCR. La mayoría de los estudios demuestran su falta de utilidad en este campo, pues hay datos controvertidos de su asociación con el tamaño aneurismático, coincidiendo mayoritariamente en que no refleja la tasa de expansión131–134. Por otra parte se cuestiona la modulación de las estatinas sobre la PCR y su correlación con el diámetro del AAA135.
• Lipoproteína (a) [Lp(a). Un metaanálisis demostró que los pacientes con AAA tendrían concentraciones plasmáticas de Lp(a) superiores a los controles. Sin embargo ratificó la inutilidad de su determinación para establecer una probabilidad de ruptura del aneurisma136.
• Homocisteína. Un reciente metaanálisis reveló que los valores de homocisteína circulante multiplican por 3 el riesgo de presentar un AAA. Sin embargo, esta asociación no fue significativa en los varones, aunque se atribuyó a su pequeña representación en los estudios analizados137.
Otros marcadores como selenio, factor de crecimiento insulin-like-1, peoxiredoxina-1, sTWEAK, podrían jugar algún papel en el diagnóstico y pronóstico de los AAA, que aún no se ha establecido138–141.
6.3Pruebas de imagen6.3.1Radiografía simpleLa radiografía simple de abdomen tiene poco valor para el diagnóstico de un AAA, dada la dificultad de su identificación mediante este método. No obstante posee la capacidad de visualizar las calcificaciones que se producen en ellos. Estas se localizan generalmente en la parte exterior de la media arterial, delimitando así el lado externo de la dilatación aneurismática. Su hallazgo puede alertar sobre la presencia de un AAA, si bien parece que la calcificación ejerce un efecto protector en la evolución de los AAA de pequeño tamaño, probablemente vinculado a la mayor resistencia del tejido calcificado a la proteólisis, tal como se ha demostrado por otras técnicas142. Donde la radiografía abdominal con proyecciones anteroposterior y lateral se muestra de utilidad es en la evaluación de la migración, fracturas, deformaciones o desconexiones del anclaje de los dispositivos de reparación vascular y de la dilatación progresiva de los vasos nativos —como parte de los protocolos estandarizados—, dada su precisión para mostrar estos hallazgos143–145. Obviamente, las radiografías simples son de valor limitado para la evaluación del diámetro del aneurisma o de las fugas de las endoprótesis. Por tanto, no es una prueba que pueda llevarse a cabo de forma aislada durante el seguimiento posquirúrgico, pero es la piedra angular de la vigilancia de las endoprótesis aórticas145.
6.3.2Ecografía abdominalEn la actualidad, la identificación y evaluación del AAA se realiza fundamentalmente mediante la ecografía o la tomografía computarizada (TC) del abdomen. El diámetro aórtico axial u ortogonal máximo es el método más utilizado para el diagnóstico y estratificación del riesgo de los aneurismas. Se considera al diámetro aórtico como el predictor independiente más preciso de la tasa de expansión aneurismática42,92,93. En los pacientes asintomáticos con sospecha de AAA, se recomienda la ecografía abdominal como método de diagnóstico inicial, dadas sus propiedades de técnica no invasiva, de bajo coste, con una sensibilidad de entre el 87,4-98,9% y una especificidad del 99%146–148. Esta precisión puede verse reducida de manera significativa por la obesidad del paciente, la profundidad aórtica, la superposición de asas o la presencia de gases intestinales, que impiden la obtención de imágenes adecuadas en el 1-2% de los casos12,149,150. En consecuencia, la evaluación puede estar sujeta a relevantes errores de medición intra e interobservador, y se estima que solo un 65% de las exploraciones se consideran altamente fiables, con una variación interobservador < 2 mm151–154.
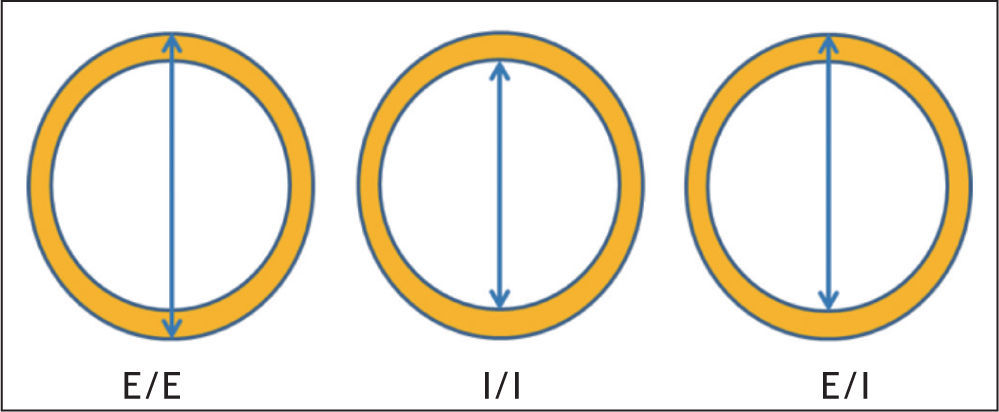
En la valoración ecográfica rutinaria de la aorta se determinan los diámetros anteroposterior, ortogonal y longitudinal, así como las dimensiones transversales de la aorta suprarrenal, yuxtarrenal, pararrenal e infrarrenal. Dada la correlación entre el AAA y los aneurismas de las arterias ilíacas, el examen debiera incluir también imágenes de estas. Aunque ya de por sí, la ecografía comparada con la TC infraestima el tamaño de la aorta155,156, si además la sonda de ultrasonido no está orientada perpendicular a la línea central, el margen de error en la estimación del diámetro anteroposterior aórtico puede ser aún mayor157,158. Las medidas pueden hacerse de borde exterior a borde exterior de la pared aórtica, de borde interno a borde interno y de borde anterior externo a borde interior (fig. 1). Todas son igual de precisas y reproducibles, independientemente del explorador o del tamaño de la aorta, si bien algunos estudios han observado que las dimensiones de borde interno a borde interno sobrestiman hasta en 5 mm la longitud real, por lo que su empleo puede tener implicaciones en el resultado de los programas de cribado159–161. Merece la pena destacar que la evidencia para establecer el umbral del tamaño de los AAA con vistas a su seguimiento (> 3 cm de diámetro) en el programa de cribado del servicio nacional de salud americano, se basó en la determinación del diámetro aórtico interno establecido por el estudio MASS15, mientras que el límite superior que indicaría su tratamiento quirúrgico (5,5 cm), se estableció con las medidas del diámetro externo empleadas en el estudio UKSAT90. Dada la diversidad de métodos y su repercusión en la atención de los pacientes y en la investigación clínica, se ha sugerido que las publicaciones deberían informar claramente del procedimiento de medida156.
El diagnóstico del AAA queda establecido en la ecografía, como en cualquier otra técnica de imagen, por un diámetro aórtico externo > 3 cm, aunque también se ha empleado el diámetro aórtico interno, o un aumento del diámetro de la aorta > 50% del tamaño normal, que es el equivalente a 2 veces la desviación estándar del diámetro medio aórtico para ambos sexos9,162. La portabilidad de algunos ecógrafos modernos facilita el diagnóstico del AAA a pie de cama en pacientes con síntomas que hagan sospechar una ruptura. Es reseñable que cada vez más servicios de urgencias disponen de esta técnica, con tasas de sensibilidad del 94-100% y de especificidad del 98-100% en la detección de los AAA163,164. Asimismo es un instrumento excelente para el cribado del AAA y su vigilancia posterior91,165. Cuatro estudios poblacionales10,15,16,166, con 3 revisiones sistemáticas de estos167–169, demuestran, en términos de reducción de la morbimortalidad, la utilidad de la identificación sistemática del AAA (ver sección 7).
*Recomendaciones sobre la ecografía abdominal en el manejo del AAA:
• Se recomienda la ecografía abdominal como método de diagnóstico inicial, cribado y vigilancia posterior de los AAA.
- –
Nivel de recomendación: fuerte.
- –
Calidad de la evidencia: alta.
• El diagnóstico ecográfico del AAA queda establecido por un diámetro aórtico externo > 3 cm.
- –
Nivel de recomendación: fuerte.
- –
Calidad de la evidencia: alta.
La aortografía fue hasta mediados de la década de los ochenta el método de elección para la valoración de los AAA, pero hoy en día ha sido sustituida en la mayoría de los casos por la TC.
La aortografía es una prueba invasiva, que puede presentar complicaciones en relación con la punción arterial, precisa ingreso hospitalario, utilización de radiación y el uso de contrates yodados. Mediante esta técnica podemos valorar el tamaño y morfología de la luz aórtica, pero no es posible la correcta valoración del tamaño real del aneurisma ni de su pared170,171. Una ventaja de esta técnica frente a otros métodos de imagen es que es posible la correcta valoración del tamaño de las lesiones y de la morfología de las ramas colaterales de la aorta, en particular de las arterias renales172.
Una de las principales indicaciones de la arteriografía en los AAA era la medición y planificación del tratamiento previo a la reparación endovascular. En un estudio observacional173, que compara la efectividad y precisión de la angio-TC con reconstrucción tridimensional con la arteriografía en 196 pacientes consecutivos, ambas técnicas tienen resultados equiparables, por lo que parece posible la valoración de los AAA sin necesidad de realizar arteriografía preoperatoria; así se evitan las posibles complicaciones asociadas.
En estudios realizados posteriormente, parece que la angio-TC es superior respecto a la reproductibilidad de las medidas para realizar la reparación endovascular del aneurisma de aorta (EVAR)174 e incluso en la correlación de la medición de la longitud y diámetro de los vasos175.
La angio-TC presenta una buena correlación intra e interobservador y menor sobreestimación que la aortografía de la longitud del aneurisma, especialmente en casos de tortuosidad ilíaca.
La aortografía ha visto muy limitadas sus indicaciones en los últimos años, pudiendo realizarse en los pacientes que presentasen contraindicación para la realización de TC y resonancia magnética (RM).
6.3.4Tomografía computarizadaLa angio-TC es una técnica útil en el diagnóstico del AAA, que permite la visualización de toda la longitud aórtica y una medición bastante exacta del aneurisma176. Presenta una alta sensibilidad, cercana al 100%177, para el diagnóstico y determinación del tamaño del aneurisma. Estas medidas son además altamente reproducibles, con una diferencia intraobservador < 2 mm en el 94% de los casos154. Respecto al diagnóstico ecográfico, los resultados de la TC son más reproductibles, más exactos y, en general, se obtienen unas medidas 2-4 mm superiores a las mediciones ecográficas75,165.
Las imágenes obtenidas mediante la angio-TC aportan también información de las estructuras circundantes, de la anatomía de las ramas aórticas y de la calcificación de la pared, que ayuda al diagnóstico etiológico, como en el caso de los aneurismas inflamatorios o micóticos. En los aneurismas inflamatorios es frecuente observar adelgazamiento de la pared y fibrosis periaórtica178. Los aneurismas micóticos suelen ser saculares, irregulares, sin calcificación mural y es muy característica la presencia de gas periaórtico en un paciente que no ha sido intervenido179.
Otra de las ventajas de esta prueba de imagen es que proporciona información morfológica180 y de las estructuras adyacentes, que se puede relacionar con inestabilidad del aneurisma y riesgo de su ruptura. Los parámetros más útiles para evaluar el riesgo de ruptura son la forma, el tamaño179, la presencia de trombo intramural181 y el estrés de la pared182. Este último parece ser más sensible (el 94 frente al 81%) y específico (el 81 frente al 70%) incluso que el diámetro del aneurisma para predecir el riesgo de ruptura183.
Los principales signos radiológicos asociados a inestabilidad del aneurisma que se pueden observar con la TC son el signo de la media luna y la discontinuidad del calcio de la pared aórtica. El “signo de la media luna” es una imagen bien definida, hiperdensa, con forma de semiluna, que representa una disección del trombo o pared del aneurisma. Es el signo más precoz y específico de las roturas, ya que tiene unas altas sensibilidad (77%) y especificidad (93%) en el diagnóstico de estos pacientes184,185. La discontinuidad del calcio de la pared del aneurisma es otro signo radiológico relacionado con el riesgo de ruptura, aunque es un hallazgo poco frecuente, presente en menos del 8% de los casos178.
En la TC también se pueden observar datos de rotura contenida como la presencia de hematoma en retroperitoneo o el “signo del abrazo aórtico”. Este signo consiste en la pérdida del plano entre la aorta y los cuerpos vertebrales, lo que sugiere insuficiencia de la pared aórtica186.
Por la posibilidad de visualizar todo el segmento aórtico así como las arterias renales, la relación con el sistema venoso y la coexistencia de otras patologías, la TC se considera el principal método de imagen para la planificación de la cirugía. Quizás, el principal inconveniente de esta técnica es que precisa radiación ionizante y el uso de contraste yodado.
6.3.5Resonancia magnéticaLa RM también se puede utilizar para el diagnóstico del AAA. Al igual que la TC, aporta información morfológica del aneurisma y de los tejidos circundantes. Según datos obtenidos de un estudio prospectivo, comparativo de 50 pacientes, donde se compara TC frente a RM, ambas tienen la misma exactitud en el diagnóstico y medición del diámetro del AAA187, y presenta una buena concordancia intra e interobservador188. Por este motivo se acepta que la RM es el método de elección cuando la TC no se puede realizar, como en pacientes con alteración de la función renal187.
Las principales ventajas que ofrece la RM respecto a la TC es que no es preciso usar contraste, aunque este, cuando se utiliza, mejora las imágenes. Tampoco utiliza radiación y además presenta mejor realce de los tejidos blandos. Con la RM es posible valorar el movimiento de la pared arterial, cuantificar el flujo y controlar tanto la luz como la pared aneurismática189. El principal inconveniente de la RM, y por el que en algunos casos no es adecuada, es que no es posible disponer de ella de forma inmediata, por lo que los pacientes que precisen un diagnóstico urgente deben ser valorados con otra prueba de imagen.
7Programas de cribado del aneurisma de aorta abdominal7.1Detección precozEl AAA es una patología que reúne una serie de características que la hacen especialmente atractiva para ser el motivo de un programa de cribado en la población: presenta un desarrollo progresivo y silente, su historia natural evoluciona hacia el crecimiento y sus posibles complicaciones, entre ellas la muerte, es fácilmente detectable con los métodos diagnósticos habituales y se puede tratar con buenos resultados. A pesar de todas estas premisas, el cribado del AAA no está instaurado en la mayoría de países.
7.2Métodos de cribadoLa ecografía abdominal ha demostrado ser el mejor método para realizar el cribado del AAA debido a sus elevadas sensibilidad y especificidad, próximas al 100%147,167, y a su elevada reproducibilidad190. Además se trata de una prueba inocua para el paciente y de bajo coste. Al tratarse de una exploración que depende de la pericia del explorador, es muy importante la formación de estos para poder ser válida y reproducible.
7.3Eficacia del programa de cribadoSe han publicado 4 estudios que evalúan la eficacia del cribado del AAA:
• Estudio Chichester166. Realizado en Gran Bretaña y publicado el año 1995. Se estudiaron 15.775 varones y mujeres (único trabajo que incluyó mujeres) de 65-80 años. El grupo de varones cribados fue de 3.205 y el de mujeres de 4.682. El seguimiento medio fue de 30,5 meses. El porcentaje de asistencia al cribado, respecto al total de personas convocadas, fue del 68,4% y la prevalencia de AAA fue del 4%, un 7,6% en varones. La última publicación del estudio, con datos a 15 años de seguimiento191, informó de 63 roturas de aneurisma en el grupo control frente 54 en el grupo de pacientes cribados, con una mortalidad debida al aneurisma en el grupo control del 1,8% (54/1.045) frente a un 1,6% en el grupo cribado (47/2.995). Ello significa un 11% de reducción de mortalidad, no significativa, con hazard ratio [HR de 0,89 (intervalo de confianza [IC del 95%, 0,6-1,32). Esta diferencia en la mortalidad debida a aneurismas se hizo significativa a partir de los 4 años de inicio del programa y en este estudio, a los 15 años, ya no lo es. Es interesante destacar que entre las muertes debidas al aneurisma en el grupo cribado, 20 casos no acudieron a la prueba, en 10 casos el diámetro aórtico en el momento de la exploración era normal (entre 2,0 y 2,9 cm) y se rompieron entre 3,8 y 15 años tras la exploración, la edad media en el momento de la exploración fue de 70 años y de 80 años cuando murieron.
Esta disminución del beneficio del programa en términos de reducción de mortalidad debido al AAA a los 15 años comparado con el de los 4 años192 (que fue del 52%) y 10 años (que fue del 21%) era de esperar, según los autores, debido a que los supervivientes más jóvenes al inicio del programa ahora tienen 80 años, siendo cada vez menos aptos para tratamiento reparador con la edad. A pesar de ello, los autores justifican que no existe una significación estadística debido al escaso número de pacientes.
• Estudio Viborg16. Publicado en el año 2005 y realizado en Dinamarca. Se estudiaron 12.639 varones (6.333 en el grupo de cribado) de 65-73 años. El seguimiento medio fue de 61 meses. El porcentaje de asistencia al cribado, respecto al total de personas convocadas, fue del 76% y la prevalencia de AAA fue del 4%. Este estudio, a diferencia de los otros 3, solo recogió la mortalidad hospitalaria y no las muertes extrahospitalarias. Es por ello que los resultados no son comparables a los demás estudios. Además, los pacientes en los que se detectó un aneurisma pequeño fueron incluidos en diversos ensayos clínicos80,193. Los resultados a largo plazo de este estudio reportaron un 73% de reducción de la mortalidad en el grupo de cribado a los 10 años194 del programa y del 66% a los 14 años195.
• Estudio MASS196. Publicado en el año 2002 y realizado en Gran Bretaña. Se estudiaron 67.800 varones (33.839 pertenecientes al grupo cribado) de entre 65-74 años. El seguimiento medio fue de 49 meses. El porcentaje de asistencia al cribado, respecto al total de personas convocadas, fue del 80,2% y la prevalencia de AAA fue del 4,9%. Este es el único estudio de los 4 que consideró situaciones de exclusión de pacientes: pacientes considerados de alto riesgo por sus médicos de atención primaria, enfermos terminales, con patologías graves o previamente intervenidos de aneurisma. El estudio MASS publicó en el año 2012 los que considera sus resultados finales197, informando de un total de 224 muertes debidas al aneurisma en el grupo cribado comparadas con un total de 381 en el grupo control, lo que significó una reducción del 42% (IC del 95%, 31-51). Otro de los datos de interés que aporta es un número necesario a cribar (NNC) de 216, que significa que será necesario cribar ese número de varones de entre 65-74 años para salvar una muerte debida al aneurisma en los próximos 13 años.
• Estudio Western Australia10. Publicado el año 2004. Se aleatorizaron 41.000 varones de entre 65-79 años. De todos ellos, 2.296 murieron entre la aleatorización y la invitación al cribado, ya que en algunos casos pasaron diversos meses. Por ello, tanto el grupo control como el de cribado se compusieron de 19.352 varones. El seguimiento medio fue de 43 meses. El porcentaje de asistencia al cribado, respecto al total de personas convocadas, fue del 63,1% y la prevalencia de AAA fue del 7,2%. Fallecieron por el AAA 18 sujetos en el grupo de intervención y 25 en el control (tasa de mortalidad 0,61; IC del 95%, 0,33-1,11). La disminución de la mortalidad fue significativa en el grupo de entre 65 y 75 años (odds ratio [OR: 0,19; IC del 95%, 0,04-0,89).
Se puede observar que existen 2 ensayos, Chichester y Western Australia, en los que la prevalencia de aneurismas (considerando aortas ≥ 30 mm) es mayor del 7% y en los otros 2 estudios la prevalencia fue menor del 5%. Ello se puede deber a que en los 2 primeros la edad media de los reclutados fue mayor de 70 años y menor en los otros 2. Sin embargo, la prevalencia de aneurismas considerados quirúrgicos (con diámetros ≥ 50 mm) es similar en todos los estudios, alrededor del 0,5%.
Los resultados de cada uno de los programas de cribado en términos de disminución de la mortalidad, en varones, se pueden consultar en la tabla 4. En mujeres, el estudio Chichester obtuvo una ausencia de beneficio, tanto en la muerte por todas las causas (OR: 1,06; IC del 95%, 0,93-1,21) como en la mortalidad debida al aneurisma (OR: 1,99; IC del 95%, 0,36-10,88). En una publicación posterior del estudio MASS a 10,1 años de seguimiento (entre 8,9 y 11,2 años), el resultado de muerte debida al aneurisma de los varones cribados fue de OR de 0,52 (IC del 95%, 0,43-0,63)41. La mortalidad por todas las causas obtuvo una OR de 0,97 (IC del 95%, 0,95-1,00). Esta ausencia de beneficio en la mortalidad por todas las causas se debe a que la mortalidad debida al aneurisma representa solo un 2% de todas las causas de muerte en dicho grupo.
Resultados de los diferentes estudios en la población de varones cribados respecto a los no cribados.
| Chichester166 | Viborg16 | MASS196 | Western Australia10 | Cochrane169 | |
|---|---|---|---|---|---|
| Mortalidad debida al AAA | 0,59 (0,27-1,29) | 0,31 (0,13-0,79) | 0,58 (0,42-0,78) | 0,72 (0,39-1,32) | 0,60 (0,47-0,71) |
| Mortalidad por todas las causas | 1,07 (0,93-1,22) | No evaluada | 0,97 (0,93-1,02) | 0,85 (0,8-0,9) | 0,95 (0,85-1,07) |
AAA: aneurisma de aorta abdominal. Datos expresados en odds ratio y su intervalo de confianza del 95%.
Estos datos han sido analizados en una Revisión Sistemática Cochrane publicada en el año 2007169 (tabla 4). La mortalidad debida al AAA en varones (incluyendo muertes por rotura de aneurisma y por cirugía de este, tanto electiva como urgente) ofrece en el metaanálisis un beneficio positivo del cribado, con una OR de 0,60 (IC del 95%, 0,47-0,78). En referencia a la posibilidad de rotura de aneurisma, el cribado previene este acontecimiento en varones con una OR de 0,45 (IC del 95%, 0,21-0,99). Finalmente, respecto a la necesidad de cirugía del AAA, los datos combinados reflejan una mayor proporción en el grupo cribado, como es de esperar, con una OR de 2,03 (IC del 95%, 1,59-2,59).
En otro metaanálisis realizado en 2010198 se concluye que es necesario cribar a 238 personas para evitar una muerte debida al aneurisma en 10 años de seguimiento. El mismo documento compara estas cifras con un NNC de 1.339 en las del cáncer de mama a 13 años199 o de 671 en el cáncer colorrectal200, ambos datos basados en revisiones Cochrane. Es necesario comentar que el NNC determinado por la revisión Cochrane comentada es de 915.
Según los datos del estudio MASS a 10 años195, asumiendo un porcentaje de asistencia del 80% de los varones citados entre 65 y 74 años y una mortalidad del 5% en la cirugía electiva de los aneurismas detectados, podemos afirmar que es necesario invitar a 240 varones (acudirán unos 192) para salvar una muerte en 10 años. Por otro lado, de cada 2.080 varones invitados a cribado (acudirán 1.660) se morirá 1 varón de más debido a la cirugía electiva. Desde otro punto de vista, a lo largo de 10 años y cada 10.000 varones cribados, se prevendrán 65 roturas de aneurisma de aorta, salvando 52 vidas, pero también se provocarán 6 muertes adicionales por cirugía electiva de los varones cribados.
7.4Coste-efectividadEste mismo estudio MASS, con seguimiento a 10 años195, desglosa datos sobre el coste-efectividad del programa. El coste económico global fue de 100 £ (84,7 €) (IC del 95%, 82-118) mayor en el grupo de varones cribados respecto al grupo de no cribados (108 £ en el grupo control respecto a 208 en el grupo cribado). Por otro lado, la supervivencia en días del grupo cribado fue de 2.747,8 respecto a 2.743 en el grupo control (diferencia de 4,8 días; IC del 95%, 2,9-6,7).
Todos estos datos generan un coste por año de vida ganado de 7.600 £ (IC del 95%, 5.100-13.000). Estas cifras han sufrido una reducción significativa a lo largo de los años, desde 41.000 £ a los 4 años del inicio del programa de cribado hasta 14.000 £ a los 7. Los autores de dicho estudio destacan que el IC está por debajo de las 25.000 £ que exige el National Health Service para aceptar cualquier tecnología o intervención.
Por otro lado, los programas de cribado que ya están en marcha desde hace años en otros países han observado un cambio significativo en los resultados detectados. Ello se debe a la menor exposición de la población a los factores de riesgo cardiovascular, una estabilización de los resultados de la cirugía de la aorta abdominal y una mejora de la longevidad, tanto desde el punto de vista de cantidad de años vividos como de calidad. Estos datos han llevado a cuestionarse el actual modelo sugiriendo una revaluación201 y algunos cambios, como el aumento del diámetro a considerar para el seguimiento, cribar a población mayor de 65 años o a poblaciones con mayor prevalencia de aneurismas, como por ejemplo fumadores195. Además, algunos estudios han publicado simulaciones de programas de cribado en grupos de alto riesgo (con factores de riesgo cardiovascular), obteniendo como resultado que estas estrategias permiten cribar a menos pacientes, pero a costa de prevenir menos muertes202. Cabe destacar que en los análisis de subgrupos de los programas de cribado, no existen diferencias en los resultados del cribado en pacientes mayores de 66 años respecto a los más jóvenes (64-65 años)202.
Sobre la base de estos posibles inconvenientes, los datos del programa de cribado del National Health Service han sido recalculados y ajustados tomando como base los datos del estudio MASS antes comentado y añadiendo variables de la práctica clínica actual, datos de metaanálisis recientes y datos actuales del propio programa nacional de cribado de aneurisma35. Los datos continúan reflejando un coste incremental por año de vida ganado de 5.758 £ (IC del 95%, 4.285-7.470) a 10 años del programa. En este mismo sentido, los responsables del programa sueco de cribado publicaron en 2013 un modelo de Markov con datos de ensayos, bases de datos actuales y resultados de la cirugía, afirmando que el programa de cribado sigue siendo coste-efectivo a pesar de la disminución progresiva de la prevalencia de aneurisma en su país (1,7%)203.
7.5Situación del cribado del aneurisma de aorta abdominal en el mundoVarios países, incluidos Inglaterra, Gales, Escocia, Irlanda del Norte, Suecia, Italia y Estados Unidos, han puesto en marcha programas de cribado de AAA, aunque no se dispoga de datos sobre la evolución de todos ellos204. Finlandia ha realizado un estudio de coste-efectividad y Dinamarca y Noruega están realizando ensayos controlados aleatorizados. En Dinamarca se combina el cribado de aneurismas con el de hipertensión y arteriopatía de miembros inferiores. Todos estos programas se centran en los varones de 65 o más años excepto Estados Unidos, Nueva Zelanda e Italia, que también criban mujeres de alto riesgo. Nueva Zelanda se centra en personas de alto riesgo cardiovascular y Estados Unidos en varones y mujeres que hayan fumado a lo largo de su vida.
7.6Situación actual del cribado del aneurisma de aorta abdominal en EspañaEn España, según un estudio realizado en Navarra205, existirían más de 200.000 personas mayores de 65 años portadoras de un AAA, que pueden presentar un total de 30.000 roturas. Ello supondría unos 25.000 fallecimientos; el 1% de la mortalidad en este grupo de personas. El mismo autor publicó en 2007 un estudio de eficacia y efectividad del cribado de AAA206 mediante una revisión de la evidencia científica. La conclusión fue que el programa de cribado en la Comunidad de Galicia evitaría en los 4 primeros años de su implantación un total de 37 muertes por AAA y un total de 263 roturas, lo que disminuiría también el número de cirugías urgentes. Este mismo estudio llegó a la conclusión de que, debido a los costes del programa de cribado, se debe recomendar el estudio de alternativas que puedan ofrecer mejores expectativas de resultados coste-efectividad, como la posibilidad de aprovechar la ecografía para monitorizar otras enfermedades o realizarla en atención primaria. También recomienda que, previamente a la puesta en marcha de un programa de cribado poblacional de AAA, se ajuste la evidencia disponible a la realidad demográfica, cultural y de nuestro Sistema Nacional de Salud, mediante la realización de estudios piloto previos de factibilidad en áreas sanitarias determinadas. Por lo tanto, la aplicación de un programa de cribado estaría condicionada por la realidad local, básicamente la población a cribar y los recursos empleados. Por ello, sería esencial evaluar el coste-efectividad en nuestro medio, tanto los recursos que se han de emplear al aplicar el programa de cribado, como el proceso que sufrirán los pacientes en los que se detecta un aneurisma y los resultados de las reparaciones indicadas.
*Recomendaciones sobre el cribado del AAA:
• Se recomienda la aplicación de un programa de cribado poblacional de AAA en varones de entre 65 y 75 años para disminuir la mortalidad debida al aneurisma.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: alta.
• No se recomienda la aplicación de un programa de cribado poblacional de AAA en varones de entre 65 y 75 años para disminuir su mortalidad global, sea cual fuere la causa.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: alta.
• No se recomienda la aplicación de un programa de cribado poblacional en mujeres.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: moderada.
La descripción y valoración de las diferentes técnicas de imagen para el estudio de los AAA ya se ha realizado anteriormente. Al plantear el método idóneo de seguimiento de aquellos AAA que no alcanzan el rango necesario para su reparación, no encontramos evidencia científica sólida que avale el uso de un método por encima de otro. Sin embargo, la ecografía Doppler es la técnica de imagen más utilizada por la mayoría de autores y en la práctica clínica habitual, por ser un método fiable, barato y sin efectos secundarios176,207.
Dos grandes estudios controlados y aleatorizados en Europa y Estados Unidos, el UK Small Aneurysm Trial (UK-SAT)208 y el estudio ADAM209, realizados en AAA asintomáticos de pequeño tamaño (entre 30 y 54 mm de diámetro máximo) y con más de 1.000 participantes en cada estudio, compararon los resultados de la cirugía electiva inicial frente al seguimiento ecográfico y cirugía solo en los AAA que alcanzaran los 55 mm de diámetro durante el seguimiento. Ambos trabajos demostraron que los AAA de pequeño tamaño se beneficiaban de un manejo conservador frente a la intervención quirúrgica, ya que la cirugía no mejoraba la supervivencia a largo plazo de los pacientes.
La llegada y desarrollo de la EVAR se asoció a una disminución en la mortalidad precoz respecto a la cirugía abierta convencional210,211. Como los estudios UK-SAT y ADAM compararon el seguimiento con la cirugía abierta, se plantea la duda de si los AAA de pequeño tamaño sí podrían beneficiarse de la EVAR frente al seguimiento. Para despejar esta duda encontramos 2 estudios clínicos aleatorizados, aunque con menor tamaño de muestra que los previos, que comparaban la EVAR con el seguimiento ecográfico en los AAA de pequeño tamaño. El estudio PIVOTAL212, que incluyó 728 pacientes con AAA de entre 40 y 50 mm, y el estudio CAESAR213, que incluyó 360 pacientes con AAA de entre 41 y 54 mm. Ambos trabajos llegan a conclusiones similares; al igual que ocurría con la reparación abierta del AAA, la reparación endovascular precoz no ofrece ventajas sobre el seguimiento periódico con técnicas de imagen en los AAA asintomáticos de pequeño tamaño.
Aunque está demostrado que los AAA de entre 30 y 54 mm deben someterse a seguimiento ecográfico periódico, no existen estudios clínicos aleatorizados que ayuden a establecer cuál es el intervalo óptimo entre exploraciones. Los intervalos utilizados en los ensayos clínicos de seguimiento, aunque varían de unos estudios a otros y dependen del tamaño del AAA, se sitúan en torno a los 6 meses, pero no existe un consenso que establezca el intervalo adecuado. La tasa de crecimiento debe ser uno de los factores más importantes a tener en cuenta para recomendar un intervalo de seguimiento de los AAA de pequeño tamaño. Varios autores relacionan claramente el mayor diámetro inicial con una tasa de crecimiento más rápida, por lo que los intervalos de seguimiento varían en función del diámetro máximo del AAA214–216.
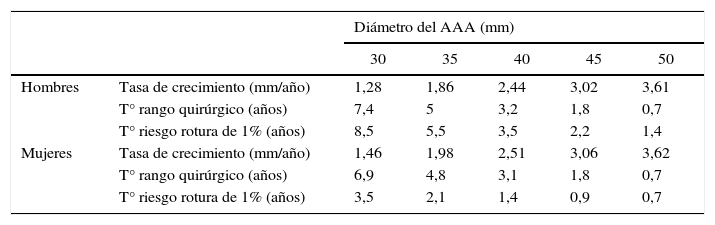
Son múltiples los estudios observacionales que describen las tasas de crecimiento y de rotura de los AAA, así como los factores asociados con ellas. Cabe destacar el trabajo de análisis y revisión de todos estos estudios, publicados previamente a 2010, por parte del grupo RESCAN, que recoge los datos individuales de 15.471 pacientes (13.728 varones) con AAA de entre 30 y 54 mm, de 18 estudios observacionales con más de 100 pacientes cada uno217. Solo consideran los AAA de entre 30 y 54 mm y calculan la tasa de crecimiento y el riesgo de rotura en función del diámetro del AAA mediante un modelo lineal que considera las variaciones aleatorias individuales, analizando por separado varones y mujeres (tabla 5). En esta revisión se incluye el trabajo de Vega de Céniga et al, el único de tasas de crecimiento de AAA realizado en nuestro medio con un número importante de pacientes218. Sus resultados no difieren de forma significativa con los del resto de trabajos, por lo que podemos considerar que las observaciones realizadas en la revisión del grupo RESCAN podrían ser aplicables también en nuestro medio. Con los resultados de su revisión, el grupo RESCAN propone ampliar los intervalos de seguimiento aceptados actualmente en la mayoría de las guías de práctica clínica; extendiéndose hasta 3 años para AAA de entre 30 y 39 mm, 2 años para aquellos de entre 40 y 44 mm y anualmente para los AAA de entre 45 y 54 mm. Con estos intervalos calculan un riesgo de rotura < 1% con un IC del 95%217. Por otro lado, el estudio observacional sobre 3.268 pacientes realizado en Suecia, y no incluido en el análisis del grupo RESCAN, muestra que a los 5 años, el 50% de los pacientes con un diámetro aórtico de entre 25 y 54 mm acaba alcanzando el rango quirúrgico y esta cifra se eleva hasta el 83,3% en los pacientes con AAA de entre 40 y 54 mm216. Si además tenemos en cuenta que el método de seguimiento ecográfico es barato e inocuo y la ansiedad que genera en nuestro medio el conocer que se tiene una enfermedad potencialmente mortal, creemos que está justificado recomendar unos intervalos de seguimiento más reducidos que los propuestos por el grupo RESCAN, especialmente en los AAA con diámetro de entre 40 y 54 mm.
*Recomendaciones:
• Se recomienda realizar seguimiento periódico con un método de imagen de los AAA de entre 30 y 54 mm de diámetro.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: alta.
• Se recomienda la ecografía como método de imagen de elección para el seguimiento de los AAA ≥ 30 mm de diámetro.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: baja.
• El intervalo de seguimiento del AAA estará en función de su diámetro máximo. Si está entre 30 y 39 mm se recomienda su seguimiento cada 2-3 años, si está entre 40 y 49 mm cada 1-2 años y si está entre 50 y 54 mm cada 6-12 meses.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: baja.
Tasas estimadas de crecimiento y rotura del aneurisma de aorta abdominal (AAA) en varones y mujeres (IC del 95%).
| Diámetro del AAA (mm) | ||||||
|---|---|---|---|---|---|---|
| 30 | 35 | 40 | 45 | 50 | ||
| Hombres | Tasa de crecimiento (mm/año) | 1,28 | 1,86 | 2,44 | 3,02 | 3,61 |
| T° rango quirúrgico (años) | 7,4 | 5 | 3,2 | 1,8 | 0,7 | |
| T° riesgo rotura de 1% (años) | 8,5 | 5,5 | 3,5 | 2,2 | 1,4 | |
| Mujeres | Tasa de crecimiento (mm/año) | 1,46 | 1,98 | 2,51 | 3,06 | 3,62 |
| T° rango quirúrgico (años) | 6,9 | 4,8 | 3,1 | 1,8 | 0,7 | |
| T° riesgo rotura de 1% (años) | 3,5 | 2,1 | 1,4 | 0,9 | 0,7 | |
Adaptada de metaanálisis del grupo RESCAN.
Las recomendaciones de derivación al cirujano vascular en los países occidentales, dejando a un lado a nuestro país, se basan en criterios de indicación quirúrgica, ya que la especialidad en esos entornos es eminentemente quirúrgica. Sin embargo, en nuestro medio, la especialidad en angiología y cirugía vascular abarca tanto el tratamiento quirúrgico de los AAA como el manejo médico, el control de los factores de riesgo y el diagnóstico no invasivo219. Por lo tanto, los criterios de derivación en España tendrán características diferentes a las de los países de nuestro entorno.
Para establecer criterios de derivación para cirugía, como en cualquier intervención, se debe valorar el balance entre el riesgo y el beneficio de dicha actuación, teniendo en cuenta que la complicación más grave de los AAA es la rotura. En un reciente análisis retrospectivo de corte transversal, que evaluó la mortalidad hospitalaria asociada a la reparación de los AAA rotos y no-rotos en 101.978 pacientes a lo largo de 11 años (de 2000 a 2010), se describió que la mortalidad asociada a la reparación de AAA rotos es 13 veces superior que la de los AAA no-rotos220. En este estudio no se consideraron los pacientes con AAA rotos que no llegaron a ser intervenidos, por lo que debemos suponer que el incremento de mortalidad del AAA roto en relación con la reparación electiva de AAA no-rotos es aún mayor. En el ensayo clínico aleatorizado EVAR TRIAL 2 se observó una tasa de rotura del 12,4% por año en pacientes con AAA ≥ 55 mm no intervenidos quirúrgicamente221. Otros estudios observacionales en pacientes no candidatos a reparación de su AAA, como el de Lederle et al en 198 pacientes222 o el de Brown et al en 476 pacientes223, aunque con posibles sesgos de información, mostraron una tasa de rotura ≥ 10% por año en AAA > 55 mm de diámetro máximo. Dicho estudio, en el que se incluye en el mismo intervalo los AAA de 50 a 59 mm, describió, para este rango de tamaño, una tasa de rotura anual de tan solo el 1% en varones, pero 4 veces mayor (4%) en el grupo de mujeres223. Por otro lado, otro estudio poblacional realizado en Nueva Inglaterra, detectó, con significación estadística, que en las mujeres la rotura del AAA se produce con menores diámetros que en los varones224. Todos estos datos avalan la premisa de que los AAA rotos se deben derivar de forma emergente a cirugía vascular.
Por otro lado, se puede conocer el riesgo asociado a la reparación electiva de los AAA, tanto de cirugía abierta como de EVAR, con los datos obtenidos en los 4 grandes ensayos clínicos aleatorizados que compararon las 2 técnicas. En todos ellos, la mortalidad peroperatoria se mantuvo por debajo del 5%, en torno al 4% en la reparación abierta y al 1-2% en la EVAR210,225–227. Estas tasas de mortalidad peroperatoria también las encontramos en el “mundo real”, fuera de los ensayos clínicos. Así, 2 grandes estudios observacionales de la última década en países occidentales, muestran una mortalidad peroperatoria < 4% tras reparación abierta o endovascular de los AAA220,228. Por lo tanto, se puede concluir que en AAA > 55 mm en varones y, probablemente, > 50 mm en mujeres, el riesgo asociado al AAA es mayor que el de su reparación electiva, abierta o endovascular.
Por otro lado, 4 estudios aleatorizados ya analizados en apartados anteriores de esta guía, 2 en cirugía abierta208,209 y 2 en EVAR212,213, establecieron con suficiente evidencia que en AAA < 55 mm en varones, la reparación precoz no ofrece ninguna ventaja respecto al seguimiento periódico con técnicas de imagen.
Cuando un AAA de cualquier tamaño se acompaña de dolor en la espalda o abdominal no justificado por otra causa se considera sintomático. Aun sin estudios que lo avalen, los síntomas en los AAA se consideran un signo de expansión y posible rotura, por lo que se deben derivar para valoración urgente por un cirujano vascular229,230.
Como se comentaba al principio, la peculiaridad de la especialidad en angiología y cirugía vascular en nuestro medio219 hace que los criterios de derivación recomendados no sean solo para tratamiento quirúrgico, sino también para el manejo médico y el seguimiento de estos pacientes. Por lo tanto, en España, tras el diagnóstico de un AAA de cualquier tamaño, el paciente puede ser derivado para valoración y seguimiento a un servicio de angiología y cirugía vascular.
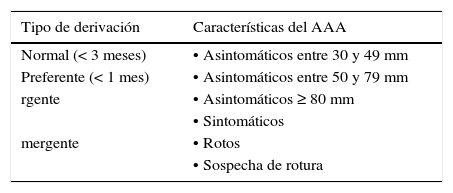
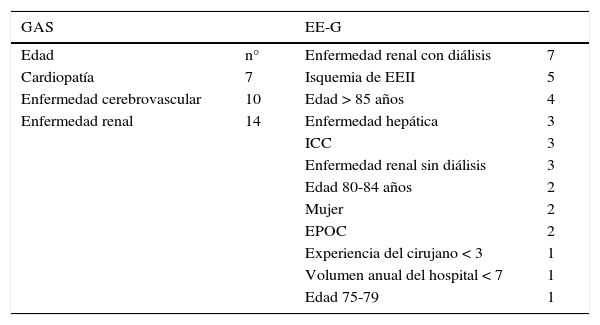
Tiene especial interés marcar pautas en cuanto a los tiempos de espera para ser atendido por un cirujano vascular en los AAA asintomáticos (tabla 6). Las tasas de crecimiento anual de los AAA con un diámetro ≤ 45 mm son < 3 mm/año217. Por lo tanto, en estos pacientes, la derivación al cirujano vascular puede seguir la vía normal, siempre y cuando los pacientes sean vistos en un plazo inferior a 3 meses. A partir de 50 mm, la velocidad de crecimiento y el riesgo de rotura, especialmente en mujeres, aumenta217, por lo que recomendamos una derivación más rápida, con un tiempo máximo de demora para ser valorado por cirugía vascular de 4 semanas. Los AAA con diámetro > 60 mm se acompañan de un riesgo relativo de rotura de hasta el 14,3% en varones y del 22,6% en mujeres223, por lo que recomendamos la valoración por cirugía vascular en un plazo máximo de 4 semanas. Por último, aunque no hay un criterio estandarizado, en general, en AAA con un diámetro ≥ 80 mm se recomienda un manejo hospitalario, por lo que la derivación debe ser inmediata para valoración por cirugía vascular.
*Recomendaciones:
• Los pacientes con diagnóstico de AAA de cualquier tamaño pueden ser derivados a un servicio de angiología y cirugía vascular para valoración y seguimiento.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: muy baja
• En los AAA con un diámetro ≥ 50 mm, se recomienda la derivación preferente a cirugía vascular.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• Los AAA con un diámetro ≥ 80 mm y los AAA sintomáticos deben derivarse urgentemente para manejo hospitalario.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: baja.
• Se recomienda la derivación emergente de los AAA rotos o con sospecha de rotura.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: alta.
Intervalos de derivación recomendados según las características del aneurisma de aorta abdominal (AAA).
| Tipo de derivación | Características del AAA |
|---|---|
| Normal (< 3 meses) | • Asintomáticos entre 30 y 49 mm |
| Preferente (< 1 mes) | • Asintomáticos entre 50 y 79 mm |
| rgente | • Asintomáticos ≥ 80 mm |
| • Sintomáticos | |
| mergente | • Rotos |
| • Sospecha de rotura |
Los potenciales beneficios cardiovasculares generales del control de los factores de riesgo vascular no se han evaluado de modo sistemático en pacientes con AAA2,3,231. Las más recientes guías de prevención cardiovascular suplen esta carencia asimilando la presencia de AAA al resto de patología vascular aterosclerosa como “equivalentes coronarios”. Las guías europeas232 se refieren explícitamente al AAA, mientras que las norteamericanas231 mencionan la “patología aterosclerosa de la aorta abdominal” en el contexto del abordaje general de la enfermedad arterial periférica. Es notorio que una estricta revisión Cochrane reciente no pudo realizar un metaanálisis del tratamiento de factores de riesgo vascular en pacientes con AAA, al detectar un único ensayo que cumpliera criterios de inclusión233 entre más de 3.000 registros evaluados.
Por otro lado, no podemos ignorar que la mortalidad de los pacientes con AAA es extraordinariamente elevada (> 5% anual)234. Más de dos tercios de las muertes son por causa cardiovascular (68%). La mortalidad cardiovascular de cualquier territorio (47%) duplica ampliamente la mortalidad directamente atribuible a la rotura del AAA o a complicaciones asociadas a su cirugía (21%). Por todas estas razones, un control estricto de los factores de riesgo vascular es imperativo. No existen razones que indiquen que el control de los factores de riesgo vascular deba ser diferente al de otros pacientes en prevención secundaria231,232,235–237. Por tanto, los pacientes deben realizar una dieta cardiosaludable, tipo mediterránea, no fumar, realizar ejercicio físico regular, controlar la glucemia, la presión arterial y el cLDL (colesterol unido a lipoproteínas de baja densidad) de acuerdo con las guías correspondientes. La consideración exhaustiva de las recomendaciones de prevención secundaria desbordan el foco de la presente revisión, por lo que no se detallarán aquí.
No obstante, el tratamiento hipolipemiante merece un comentario específico. Un estudio de 2006 evaluó el efecto del tratamiento perioperatorio con fluvastatina frente a placebo en 497 pacientes sometidos a cirugía vascular (236 cirugías de AAA)238. El tratamiento con fluvastatina se asoció con una reducción del riesgo de infarto de miocardio (HR: 0,55; IC del 95%, 0,34-0,88; p = 0,01) o de mortalidad cardiovascular (HR: 0,47; IC del 95%, 0,24-0,94; p = 0,03) en el mes siguiente a la intervención. Una revisión sistemática de estudios observacionales mostró que el uso crónico de estatinas en pacientes con AAA encontró un riesgo significativamente menor de mortalidad por cualquier causa 5 años después de la reparación del AAA en comparación con pacientes que no tomaban estatinas (OR: 0,57; IC del 95%, 0,42-0,79)56.
10.1.2¿Podemos modificar la historia natural de la enfermedad?La mayoría de las guías específicas sobre pacientes con AAA han abordado la necesidad de cribado por un lado y las opciones de tratamiento quirúrgico/endovascular por otro2,3.
No obstante, unos pocos estudios han evaluado el efecto del tratamiento médico sobre la evolución natural del AAA (crecimiento y riesgo de rotura)239–241.
10.1.2.1TabacoEl tabaquismo tiene una intensa asociación con el desarrollo y rotura del AAA2,242,243. No existen estudios específicos de intervención sobre el efecto del abandono del tabaco en la evolución del AAA, y es improbable que pueda haberlos en el futuro. Los beneficios adicionales del cese del tabaco hacen que esta sea una recomendación fuerte, si bien la evidencia de los beneficios de la intervención en el caso del AAA solo se puede considerar como moderada.
10.1.2.2Ejercicio físicoEl ejercicio moderado no parece aumentar el riesgo de crecimiento o rotura del AAA, mejora la aptitud física de los pacientes y presenta otros efectos saludables244,245. Estudios retrospectivos muestran que los sujetos con mejor situación física tienen una mejor evolución tras cirugía del AAA246. Finalmente, el ejercicio moderado no parece influir en el crecimiento del AAA ni en el riesgo de rotura244,245.
10.1.2.3Bloqueadores betaLos efectos hemodinámicos son el mecanismo principal por el que se ha propuesto el empleo de bloqueadores beta. Diversos estudios experimentales y observacionales retrospectivos han sugerido un posible efecto beneficioso247,248. No obstante, estudios controlados más recientes no han demostrado que el tratamiento con bloqueadores beta a medio-largo plazo reduzca el ritmo de crecimiento o el riesgo de ruptura del AAA193,240,249, por lo que no se recomienda el uso de estos con esta indicación. Otro aspecto de interés es el posible papel del tratamiento con bloqueadores beta en el perioperatorio del AAA en un intento de reducir el riesgo de complicaciones coronarias. Un estudio evaluó el efecto del metoprolol frente a placebo en 377 pacientes (227 con AAA) en el perioperatorio de cirugía vascular (AAA o bypass axilofemoral o infrainguinal)250. No hubo diferencias significativas en la mortalidad ni en el número de complicaciones cardiovasculares al mes o a los 6 meses de la intervención. Este estudio se alinea con la revisión crítica reciente del papel del tratamiento con bloqueadores beta en pacientes coronarios o de alto riesgo vascular sometidos a cirugía no coronaria251.
10.1.2.4Bloqueo del sistema renina-angiotensinaDiversos estudios experimentales sugieren que el bloqueo del sistema renina-angiotensina (SRA) puede reducir el crecimiento de los aneurismas por mecanismos relacionados con la inflamación y proteólisis más que por su acción hipotensora252. Estudios observacionales han mostrado resultados contradictorios respecto del uso de inhibidores de la enzima de conversión de la angiotensina (IECA) y el desarrollo, crecimiento y rotura del AAA253,254. Por otro lado, el uso de bloqueadores del SRA es más frecuente en diabéticos, circunstancia que se asocia con menor riesgo de desarrollo de AAA, lo que introduce un claro factor de confusión en estudios observacionales. En el momento actual, diversos ensayos clínicos están evaluando el papel del bloqueo del SRA per se o en comparación con otros hipotensores.
10.1.2.5Otros hipotensoresEl uso de antagonistas del calcio o diuréticos no parece asociarse con cambios en el crecimiento del AAA255.
10.1.2.6EstatinasLas estatinas pueden tener efectos antiinflamatorios e inhibir la expresión de metaloproteasas256, con efectos beneficiosos en modelos experimentales257. Estudios epidemiológicos también han sugerido un efecto protector en pacientes258, aunque con resultados controvertidos en metaanálisis recientes52,56,239,240. En todo caso se trata de estudios observacionales (cohortes y retrospectivos) que limitan la posible fuerza de la recomendación239. El Heart Protection Study no mostró efectos significativos de simvastatina en la tasa de cirugía de AAA entre 6.748 pacientes con enfermedad arterial periférica259 (el 1,2 frente al 1,1%; p = 0,7) seguidos durante 5 años. No se han proporcionado datos de la prevalencia de AAA o de su tamaño en la población del estudio.
10.1.2.7AntibióticosLa asociación de diversas infecciones (especialmente C. pneumoniae)260 con la presencia de AAA y una cierta acción antiinflamatoria de los macrólidos han sugerido un posible efecto de estos en la evolución del AAA. En tal sentido, 2 pequeños ensayos clínicos (n = 92 y 84, respectivamente) han sugerido que el empleo de roxitromicina puede atenuar el crecimiento del AAA80,261. Sin embargo, el limitado número de pacientes evaluados, la dudosa relevancia clínica del efecto detectado y los posibles efectos secundarios a largo plazo del uso de roxitromicina no permiten realizar una recomendación consistente para su uso en pacientes con AAA. Otro ensayo clínico aleatorizado y controlado evaluó el efecto del tratamiento con azitromicina frente a placebo durante 15 semanas en 247 pacientes y no mostró diferencias en la tasa de crecimiento del AAA262.
Las tetraciclinas han demostrado un efecto protector del crecimiento del AAA en modelos experimentales263, quizás atribuible a su efecto inhibidor de las metaloproteasas264. El estudio PHAST evaluó el efecto de doxiciclina frente a placebo durante 18 meses en la “estabilización” del AAA en 286 pacientes265. Paradójicamente, el empleo de doxiciclina se asoció a un ligero incremento (4,1 frente a 3,3 mm) del crecimiento del AAA, sin efectos sobre complicaciones o la tasa de cirugía del AAA. La escasa adherencia y la alta tasa de abandonos y efectos secundarios limitan la utilidad de este ensayo clínico265. No obstante, el estudio ilustra claramente los inconvenientes de extrapolar los estudios en animales a la práctica clínica. Otro ensayo clínico, con dosis más elevadas de doxiciclina (200 mg/día) con inclusión de 248 pacientes, está en fase de realización en Estados Unidos (ClinicalTrials.gov NCT01756833).
10.1.2.8Tratamiento antiplaquetarioLa formación de trombos puede modular teóricamente el riesgo de crecimiento, hemorragia y rotura de los AAA. Pequeños estudios epidemiológicos han sugerido un efecto protector de dosis bajas de ácido acetilsalicílico en el crecimiento del AAA266, pero no se han visto confirmados en estudios más amplios267. Ningún ensayo clínico ha evaluado de modo directo el posible efecto del tratamiento con ácido acetilsalicílico en la evolución del AAA, pero está previsto un ensayo con ticagrelor (ClinicalTrials.gov NCT02070653).
10.1.2.9Otros antiinflamatoriosEl infiltrado inflamatorio y la actividad de proteasas son elementos clave en el desarrollo y rotura del AAA135,268. Modelos experimentales apoyan la posible utilidad del tratamiento “antiinflamatorio” en la limitación del crecimiento del AAA269. Un estudio de 15 casos que tomaban antiinflamatorios no esteroideos (AINE) por problemas reumáticos y 63 controles mostró una menor tasa de crecimiento de AAA270. La naturaleza del estudio, el pequeño número de casos, el deficiente apareamiento entre casos y controles y los efectos secundarios de los AINE no permiten realizar una recomendación de este tratamiento en la prevención del crecimiento del AAA. Varios ensayos clínicos en curso evaluarán fármacos antiinflamatorios inmunosupresores como ciclosporina y anticuerpos monoclonales frente a IL1B, entre otros.
10.1.2.10Fármacos antiangiogénicosLa angiogénesis dentro del AAA puede desempeñar un papel en la progresión y rotura del AAA. Algunos autores sugieren que los fármacos antiangiogénicos son otra diana terapéutica a evaluar en pacientes con AAA271.
En resumen, desde el punto de vista de prevención cardiovascular el tratamiento médico de los pacientes con AAA no difiere sustancialmente del indicado en otros casos de prevención secundaria. No obstante carecemos de estudios específicos en pacientes con AAA que indiquen con más precisión cuál es el tratamiento óptimo. Mientras no existan estudios específicos, las recomendaciones generales de “prevención secundaria” deben ser la referencia, individualizándolas para pacientes concretos en el contexto de la comorbilidad vascular y sistémica que con frecuencia coexiste en estos pacientes.
*Recomendaciones:
• A los pacientes con AAA se les debe realizar un control estricto de los factores de riesgo vascular, análogo al de los pacientes en prevención secundaria por afectación de otros territorios vasculares.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• A todo paciente fumador con AAA se le debe recomendar el abandono del tabaco.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• En los pacientes con AAA no estaría recomendada la utilización de fármacos bloqueadores beta para disminuir el crecimiento y/o el riesgo de ruptura del AAA.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: alta.
• Se debería recomendar el tratamiento con antagonistas del SRA en pacientes con AAA para reducir el crecimiento y el riesgo de ruptura.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: baja.
• Todo paciente con AAA debería recibir tratamiento con estatinas para disminuir el crecimiento y el riesgo de ruptura.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: baja.
• El tratamiento con antiagregantes plaquetarios podría reducir el riesgo de crecimiento del AAA.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: muy baja.
• El tratamiento con macrólidos podría reducir el crecimiento y el riesgo de ruptura en los pacientes con AAA.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: baja.
• No está recomendado el uso de doxiciclina para prevenir el crecimiento y el riesgo de ruptura del AAA.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: baja.
El estudio preoperatorio de los pacientes que van a ser sometidos a una reparación de un AAA debe incluir una recogida de sus antecedentes personales, una exploración física y unos estudios básicos que incluyan la radiografía de tórax en 2 proyecciones y una analítica general. En cualquier caso, las escalas de riesgo publicadas señalan como factores predictivos mayores del resultado de la intervención el estado cardiológico, la función renal y la EPOC, razón por la que se debe incidir especialmente en la evaluación de estas condiciones y patologías.
Los pacientes que van a ser intervenidos de AAA tienen que ser adecuadamente valorados, ya que es un procedimiento de alto riesgo272 en una población cada vez más envejecida y que presenta numerosas comorbilidades.
10.2.1.1Escalas de riesgo preoperatorioUna de las herramientas más útiles para evaluar el riesgo de estos pacientes es el uso de escalas de riesgo preoperatorio. Estas escalas se diseñaron inicialmente para identificar pacientes de alto riesgo para cirugía abierta, siendo la escala de aneurismas de Glasgow la que ha presentado mejores resultados273. EN 2009 se desarrolló una escala específica para tratamiento endovascular de AAA (EE-G)274 (tabla 7).
Escalas de riesgo preoperatorio.
| GAS | EE-G | ||
|---|---|---|---|
| Edad | n° | Enfermedad renal con diálisis | 7 |
| Cardiopatía | 7 | Isquemia de EEII | 5 |
| Enfermedad cerebrovascular | 10 | Edad > 85 años | 4 |
| Enfermedad renal | 14 | Enfermedad hepática | 3 |
| ICC | 3 | ||
| Enfermedad renal sin diálisis | 3 | ||
| Edad 80-84 años | 2 | ||
| Mujer | 2 | ||
| EPOC | 2 | ||
| Experiencia del cirujano < 3 | 1 | ||
| Volumen anual del hospital < 7 | 1 | ||
| Edad 75-79 | 1 |
EE-G: escala de Egorova y Giacovelli; EEII: extremidades inferiores; EPOC: enfermedad pulmonar obstructiva crónica; GAS: escala de Glasgow; ICC: insuficiencia cardíaca congestiva. Cardiopatía: infarto agudo de miocardio, revascularización, angina, enfermedad valvular severa, arritmia. Enfermedad cerebrovascular: ictus, accidente isquémico transitorio. Enfermedad renal: creatinina > 1,2 mg/dl o aclaramiento de creatinina < 60 ml/min.
Más recientemente se ha publicado un estudio cuyo objetivo era validar nuevas escalas de riesgo preoperatorio, tanto en cirugía abierta como endovascular, que parecen bastante precisas para determinar el riesgo de mortalidad intrahospitalaria de estos pacientes275.
10.2.1.2Evaluación cardíaca10.2.1.2.1Evaluación generalLa valoración cardíaca en estos pacientes es de especial interés, puesto que presentan un alto riesgo de complicaciones cardíacas, ya que la arteriosclerosis es un proceso que también afecta a las arterias coronarias. La cardiopatía isquémica es una causa importante de mortalidad perioperatoria en estos pacientes, que puede ser reducida con la adecuada valoración276.
En general hay menor incidencia de complicaciones cardíacas perioperatorias con EVAR que con cirugía abierta277,278, debido a que se evita el pinzamiento aórtico y el menor daño tisular evitando el íleo postoperatorio, aunque no todos los estudios describen esta diferencia. Según datos del estudio DREAM228, la incidencia de complicaciones cardíacas es similar con ambas técnicas. Más importante que la técnica quirúrgica utilizada, uno de los determinantes más importantes de la supervivencia a largo plazo de estos pacientes es la presencia de enfermedad cardíaca subyacente279.
Todos los pacientes deben tener historia clínica, electrocardiograma (ECG) y valoración de los síntomas cardíacos. Se deben recoger los antecedentes de infarto agudo de miocardio (IAM), angina, insuficiencia cardíaca congestiva (ICC), diabetes mellitus, IR, accidente cerebrovascular (ACV) y/o accidente isquémico transitorio, ya que afectan al pronóstico de estos pacientes.
*Recomendación:
• Los pacientes con patología cardíaca activa (angina inestable, insuficiencia cardíaca descompensada, enfermedad valvular grave o arritmia significativa) deben ser evaluados por cardiología antes de la cirugía de aorta abierta o EVAR.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
La determinación de la capacidad funcional es un paso en la evaluación preoperatoria del riesgo cardíaco. En cirugía torácica, una baja capacidad funcional (< 4 METS o la imposibilidad de subir 2 tramos de escaleras) se asocia a aumento de mortalidad. Sin embargo, tras cirugía no cardíaca no se observa esta asociación280. En general se acepta que la capacidad de subir 2 tramos de escaleras o correr una pequeña distancia implica una buena capacidad funcional, no siendo necesarios otros estudios, ya que hay una débil relación entre la capacidad funcional y las complicaciones cardíacas postoperatorias de cirugía no torácica281.
10.2.1.2.3.BiomarcadoresNo hay datos que sugieran el uso de marcadores inflamatorios como la PCR como marcador de riesgo en estos pacientes276. La determinación del péptido natriurético cerebral (BNP) y la del fragmento N-terminal del PNB (Nt-pro-BNP) son útiles para determinar el pronóstico, la mortalidad a largo plazo y los episodios cardíacos mayores tras cirugía vascular no cardíaca281,282. En un reciente estudio en pacientes intervenidos de forma abierta y electiva de AAA, los valores preoperatorios de BNP resultaron ser un factor predictivo de episodios cardíacos, muerte de origen cardíaco y mortalidad de cualquier causa, tanto a corto como a largo plazo283.
10.2.1.2.4.Tests no invasivosSe deben determinar la fracción de eyección del ventrículo izquierdo (FEVI), la isquemia miocárdica y las alteraciones valvulares.
10.2.1.2.4.1Electrocardiograma.En pacientes con enfermedad coronaria establecida, el ECG de reposo aporta información pronóstica importante respecto a la morbilidad y la mortalidad a largo plazo284. No obstante, el ECG puede ser normal o no específico en pacientes con cardiopatía isquémica crónica, por lo que la realización sistemática en todos los procedimientos quirúrgicos es un tema controvertido. En un estudio retrospectivo con más de 23.000 pacientes285, las alteraciones del ECG preoperatorio se correlacionaron con mayor incidencia de muerte de origen cardiovascular (el 1,8 frente al 0,3%) en cirugía de alto riesgo, entre la que se encontraría la cirugía abierta de aorta abdominal. En los pacientes que fueron intervenidos de cirugía de riesgo bajo o intermedio (EVAR), no se observaron tales diferencias (0,5%). Aunque el intervalo desde la realización del ECG y la cirugía no está establecido, en los 30 días anteriores a la cirugía parece adecuado284.
*Recomendaciones:
• El ECG está recomendado en pacientes con al menos 1 factor de riesgo en cirugía de alto riesgo.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• El ECG es razonable solicitarlo en pacientes sin factores de riesgo en cirugía de riesgo intermedio o bajo.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
Un metaanálisis demostró que una FEVI < 35% mediante ecocardiografía tiene una sensibilidad del 50% y una especificidad del 91% en la predicción de IAM y fallecimiento de origen cardíaco286, por lo que el ecocardiograma de rutina no está recomendado durante el estudio preoperatorio de pacientes asintomáticos que van a ser intervenidos de esta patología.
10.2.1.2.4.3Tests no invasivos de isquemia cardíaca.La ergometría o test de esfuerzo estudia la capacidad funcional, la respuesta cardíaca y detecta alteraciones isquémicas mediante cambios en el segmento ST276. En un metaanálisis287 se observó que la prueba de esfuerzo en pacientes vasculares tiene menor sensibilidad y especificidad que en otros pacientes. Además, esta prueba no es adecuada en pacientes que tienen limitada su actividad al ejercicio físico, ya que no llegan al umbral de isquemia. En estos casos, las pruebas farmacológicas de estrés, como las de perfusión nuclear o la ecocardiografía de estrés, son más adecuadas281.
La ecocardiografía de estrés con dobutamina o dipiridamol nos aporta más información, ya que combina el estudio de la función ventricular izquierda en reposo, las alteraciones valvulares y la presencia de isquemia inducida por el estrés288. Esta prueba es segura y presenta buena tolerancia por parte del paciente, aunque hay que tener en cuenta que tiene un elevado valor predictivo negativo (cercano al 100%), pero un valor predictivo positivo relativamente bajo (entre el 25 y el 45%)281.
Otras técnicas disponibles para el estudio de isquemia miocárdica son la RM y la TC de las arterias coronarias. Aunque recientemente se han realizado estudios de series de casos de valoración del riesgo preoperatorio mediante la medición del calcio coronario previo a la cirugía no cardíaca289, no hay suficiente evidencia sobre la estratificación del riesgo quirúrgico con estas técnicas281.
*Recomendaciones:
• Deben plantearse tests de esfuerzo no invasivos en pacientes con 3 o más factores de riesgo (enfermedad coronaria, insuficiencia cardíaca, enfermedad cerebrovascular, diabetes mellitus, IR crónica) y capacidad funcional pobre (< 4 METS) o desconocida, si el resultado va a cambiar el manejo.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• Los pacientes antes de la cirugía abierta, en presencia de factores de riesgo o de enfermedad cardíaca previa, deben realizarse una ecocardiografía de estrés o una angiografía coronaria mediante TC.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: muy baja.
• En los pacientes antes de EVAR, en presencia de factores de riesgo o de enfermedad cardíaca previa, puede considerarse ecocardiografía de estrés o una angiografía coronaria mediante TC.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: baja.
Es una prueba invasiva diagnóstica que raramente está indicada en la valoración del riesgo en cirugía no cardíaca. Según datos de ensayos clínicos aleatorizados en pacientes que iban a ser intervenidos de cirugía mayor vascular, la revascularización coronaria previa y la tasa de IAM a los 30 días fueron similares en ambos grupos, sin hallar tampoco diferencias en la mortalidad de cualquier causa a largo plazo290,291. Datos de un estudio epidemiológico reciente coinciden en que esta técnica no disminuye la mortalidad de estos pacientes287.
En pacientes isquémicos, las indicaciones de la coronariografía y de la revascularización son similares que en un contexto no quirúrgico292,293.
10.2.1.3Evaluacion respiratoriaLas enfermedades respiratorias y especialmente la EPOC se han identificado como una de las comorbilidades que incrementan el riesgo de cualquier procedimiento quirúrgico3. La evaluación respiratoria es especialmente importante en estos pacientes debido a que el tabaquismo es la principal causa de la EPOC294 y el mayor factor de riesgo para el desarrollo de AAA295,296. La EPOC es, además, un factor independiente predictor de rotura de AAA.
10.2.1.3.1Radiografía de tóraxLa radiografía de tórax es una de las pruebas solicitadas de forma rutinaria durante el estudio preoperatorio de la mayor parte de las intervenciones, aunque no es predictor de complicaciones respiratorias en la mayoría de los casos272. Según datos de un metaanálisis de 2006, en solo el 3% de los casos el resultado de la radiografía cambia el manejo de los pacientes, aunque en más del 23% se detecta alguna patología como cardiomegalia297. Asimismo, en una revisión sistemática de 2005298, se objetivó que la tasa de complicaciones pulmonares es similar en el grupo de pacientes con radiografía preoperatoria y en los pacientes sin dicha prueba. En general, esta prueba se recomienda en pacientes de alto riesgo de desarrollar complicaciones pulmonares y en cirugía de alto riesgo299.
10.2.1.3.2Pruebas funcionales respiratorias:espirometría Estudios recientes en pacientes intervenidos de AAA han relacionado la EPOC con la presencia de más complicaciones mayores y respiratorias y una supervivencia a 5 años significativamente inferior respecto a la población general (el 42 frente al 78%; p < 0,001), además es un predictor independiente de mortalidad hospitalaria300. Otros estudios consideran parámetros como un volumen máximo espirado en el primer segundo o una capacidad pulmonar forzada bajos, indicadores independientes de mortalidad a largo plazo tras la cirugía301. Estos estudios tienen aún poca evidencia científica para poder recomendar su uso generalizado.
10.2.1.3.3TabaquismoEl abandono del hábito tabáquico produce una mejoría inicial de la función respiratoria, lo que puede disminuir la tasa de complicaciones cardiovasculares y respiratorias y aumentar la estancia hospitalaria302,303. Debido a la baja vida media de la nicotina y del monóxido de carbono, el abandono del hábito tabáquico produce, ya desde los primero días, disminución de las complicaciones cardiovasculares, aunque la mayoría de los estudios sugieren que hacen falta semanas o meses para que también disminuyan las complicaciones respiratorias. Según los resultados recientes, las complicaciones de las heridas quirúrgicas también son más frecuentes entre fumadores, efecto que mejora a partir de las 4 semanas tras haber dejado de fumar304.
10.2.1.3.4Optimización preoperatoria respiratoriaDebido a la alta tasa de complicaciones respiratorias que se pueden presentar en la población general y más aún en pacientes diagnosticados de EPOC, es recomendable que todos los pacientes, antes de la cirugía de AAA, sean valorados desde el punto de vista respiratorio y, si se considera necesario, sean remitidos a un médico especialista.
La fisioterapia respiratoria puede mejorar la función respiratoria y, por lo tanto, disminuir las complicaciones. En un ensayo clínico de 2010, en el que se enseñó a los pacientes a utilizar el incentivador respiratorio antes y después de la cirugía o solamente tras la intervención, se observó que los pacientes del primer grupo presentaban mejoría de las pruebas de función respiratoria305.
Una característica de los pacientes con EPOC es el grado relativo de desnutrición que aumenta las complicaciones generales y respiratorias275. Los valores bajos de albúmina sérica (< 30 g/l) son un factor de riesgo independiente para desarrollar complicaciones respiratorias306.
*Recomendaciones:
• A todos los pacientes que van a ser intervenidos de AAA se les debe valorar la función respiratoria, incluso con valoración por neumólogo si se considera necesaria.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: baja.
• La fisioterapia respiratoria puede reducir las complicaciones postoperatorias.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
La IR preoperatoria es un factor de riesgo mayor que determina el pronóstico tras reparación abierta o EVAR del AAA307–309. Aunque en algunos casos solo se observa un ligero empeoramiento de la función renal, los pacientes con IR tienen mayor tasa de complicaciones310, incluso con pequeñas alteraciones preoperatorias ya se pueden observar estos resultados311. La función renal es, además, un factor pronóstico de mortalidad311–313. Según un estudio reciente, los pacientes con IR grave presentan una tasa de mortalidad mayor del doble que la de los pacientes con grados moderados de insuficiencia, tanto en cirugía abierta como endovascular de AAA (EVAR, el 2,6% de mortalidad a 30 días en pacientes con IR moderada frente al 5,7% en IR grave, p = 0,0081; cirugía abierta, del 4,1% con IR moderada frente al 9,9% en IR grave, p < 0,0057)308.
10.2.1.4.2Nefropatía por contraste yodadoLa nefropatía por contraste se define como la elevación del 25% de la creatinina sérica o de 0,5 mg/dl de forma absoluta tras 2 a 7 días después de la administración de contraste2. En los últimos años se han realizado diferentes estudios para hallar tratamiento profiláctico. La hidratación antes y después del procedimiento parece ser beneficiosa en estos pacientes314. La utilidad de la N-acetilcisteína en el manejo de esta patología no está tan clara, ya que según los datos de ensayos clínicos312–314 recientes en pacientes a los que se les realiza una angiografía periférica, parece que no hay suficiente evidencia de que la administración de N-acetilcisteína disminuya el riesgo de desarrollar nefropatía por contraste.
En la actualidad se está estudiando el papel de las estatinas como tratamiento profiláctico de la nefropatía por contraste. Según los resultados de 3 ensayos clínicos de este año315–317, estatinas a altas dosis podrían ser eficaces en la prevención de esta patología.
10.2.1.4.3Insuficiencia renal crónicaEn estos pacientes hay que monitorizar la función renal para determinar si se ha producido deterioro de esta. Durante el período perioperatorio, alteraciones de la volemia pueden empeorar aún más la función renal, por lo que en estos casos mantener la euvolemia es especialmente importante310.
En los pacientes que reciban previamente tratamiento con IECA o antagonistas de los receptores de la angiotensina II (ARA II), estos deben ser suspendidos en la mañana de la cirugía y solo se deberán reintroducir una vez que el paciente recupere su volemia normal, ya que poseen alta acción vasodilatadora318.
*Recomendaciones:
• Los bloqueadores del SRA no deben administrarse la mañana de la cirugía y solo deben ser reintroducidos tras esta cuando el paciente está euvolémico.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: baja.
• La hidratación preoperatoria está recomendada en pacientes con IR antes de la cirugía.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
Antes de una intervención quirúrgica de AAA se deben valorar, principalmente, 2 aspectos: las alteraciones de la coagulación y la presencia y manejo de la anemia preoperatoria.
10.2.1.5.1Estudio de coagulaciónEn todos los pacientes se debe realizar una exploración física completa y una historia clínica que recoja los antecedentes hemorrágicos, el tratamiento que recibe el paciente y los posibles factores de riesgo319. En principio, los estudios exhaustivos de coagulación no están recomendados si no existen factores de riesgo específicos, ya que la prevalencia de alteraciones hereditarias de la coagulación es muy baja, y en pacientes con la alteración de la coagulación más frecuente (enfermedad de Von Willebrand) estos estudios pueden ser normales319. En cualquier caso, en pacientes adultos que van a ser intervenidos de AAA, sí que debe considerarse realizar estudio de coagulación.
10.2.1.5.2Estudio de la anemia preoperatoriaLa determinación de las cifras de hemoglobina previas a la intervención de AAA está indicada en todos los casos, ya que es el trastorno hematológico más frecuente en estos pacientes320. El hallazgo de una baja concentración de hemoglobina preoperatoria se considera un factor predictivo de una mayor necesidad de transfusión perioperatoria y de pobres resultados en la intervención. Incluso un grado moderado de anemia se asocia de forma independiente a una mayor morbimortalidad a 30 días en cirugía mayor no cardíaca321.
Según datos de una reciente revisión sistemática, los pacientes con anemia preoperatoria y deficiencia de hierro recuperan más precozmente las cifras de hemoglobina con hierro intravenoso que con hierro oral. Un corto ciclo de eritropoyetina e incluso una sola dosis junto con hierro administrado en el período pre o intraoperatorio puede reducir la tasa de transfusión322.
*Recomendaciones:
• Se recomienda determinar las cifras de hemoglobina 4-8 semanas antes de la cirugía.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• En pacientes que presenten anemia se recomienda estudiar su causa.
- –
Fuerza de la recomendación: fuerte,
- –
Calidad de la evidencia: moderada.
• Los suplementos de hierro preoperatorios, oral o intravenoso, pueden ser considerados para corregir la anemia ferropénica prequirúrgica.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
La terapia con estatinas es altamente efectiva en la prevención secundaria de episodios cardiovasculares. Diversos estudios han demostrado que en pacientes de alto riesgo o con antecedentes de IAM, el tratamiento con estos fármacos reduce la incidencia de IAM, ACV y muerte323.
Según datos de 2 ensayos clínicos, el tratamiento con estatinas es un factor independiente de supervivencia tras reparación abierta o endovascular de AAA238,324. Se han realizado estudios con diferentes estatinas y dosis, pero la duración del tratamiento, el momento de inicio y la dosis necesaria no están bien definidos.
Recientemente se ha realizado un ensayo aleatorizado para comparar el efecto del tratamiento preoperatorio combinado de ezetimibe y rosuvastatina frente a rosuvastatina. La asociación redujo la incidencia de episodios cardiovasculares en los primeros 12 meses tras la cirugía vascular comparado con la rosuvastatina325.
A pesar de estos resultados, según una revisión sistemática de 2013326, la evidencia es aún insuficiente para concluir que el uso de estatinas provoque reducción o incremento del riesgo de complicaciones, dolor, calidad de vida o estancia hospitalaria.
*Recomendaciones:
• Las estatinas se deben iniciar 1 mes antes de la cirugía para disminuir la morbilidad cardiovascular.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: alta.
• En pacientes que van a ser intervenidos de cirugía vascular, con o sin factores de riesgo, el uso de estatinas es razonable.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: moderada.
La terapia con bloqueadores beta en el período preoperatorio de cirugía vascular mayor no cardíaca se ha revisado en varios metaanálisis y se considera que este tratamiento supone un beneficio sobre la morbilidad y mortalidad de origen cardíaco327–330. En una revisión sistemática se observó una disminución del número de episodios isquémicos tras la cirugía, disminuyendo de forma significativa el riesgo de IAM no fatal y la mortalidad328. En 2011, en un metaanálisis de revisiones sistemáticas, se determinó la seguridad y eficacia del esmolol en pacientes que van a ser intervenidos de cirugía mayor no cardíaca329. Este fármaco parece seguro y eficaz desde el punto de vista hemodinámico, ya que disminuye el riesgo de isquemia miocárdica.
*Recomendaciones:
• Se sugiere el uso de bloqueadores beta en pacientes que van a ser intervenidos de cirugía vascular en los que los estudios preoperatorios identifican enfermedad coronaria.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• Se sugiere el uso de bloqueadores beta en los pacientes en los que los estudios preoperatorios para cirugía vascular identifican más de un factor de riesgo.
- –
Fuerza de la recomendación: fuerte,
- –
Calidad de la evidencia: baja.
La terapia antiagregante es un tratamiento efectivo en las prevenciones primaria y secundaria en pacientes con enfermedad vascular periférica, ya que disminuye el riesgo de IAM no fatal, de mortalidad de origen cardíaco y de ACV sin aumentar de forma significativa los episodios hemorrágicos331. En un ensayo clínico reciente332, el uso de aspirina en el período perioperatorio en cirugía no cardíaca fue útil para disminuir los episodios cardíacos mayores sin incrementos de la tasa de hemorragia. En otro estudio, a mayor efecto preoperatorio de la aspirina sobre la agregación plaquetaria, menor número de episodios cardiovasculares en el postoperatorio333.
10.2.2Tratamiento quirúrgico y endovascular10.2.2.1Tratamiento quirúrgico10.2.2.1.1AntibióticosEs necesario realizar profilaxis antibiótica en todos los pacientes sometidos a procedimientos de reconstrucción arterial para evitar la infección precoz del injerto y de la herida quirúrgica. Se administran de forma sistémica 30 min antes de realizar la incisión cutánea y, aunque no existe clara evidencia relacionada con el tipo de antibiótico, son las familias de las cefalosporinas, penicilinas o aminoglucósidos las más utilizadas334,335.
10.2.2.1.2Temperatura corporalLa hipotermia (< 36 °C) es un factor de riesgo para el desarrollo de complicaciones perioperatorias como la alteración de la respuesta cardiovascular y de la hemostasia, la disminución de la disponibilidad de oxígeno, del metabolismo y de los fármacos. La utilización de mantas de aire o la inhalación de gases calientes es beneficiosa en los pacientes intervenidos de AAA336,337.
10.2.2.1.3Reposición perioperatoria de volumen y hemoderivadosLa pérdida de líquidos durante la reparación aórtica y el postoperatorio inmediato es secundaria a la hemorragia y al edema tisular que se producen. Si bien existen numerosos estudios aleatorizados que analizan cuál es la mejor terapia de fluidos en el manejo perioperatorio del AAA, no hay suficiente evidencia al respecto, las más utilizadas son las soluciones de cristaloides y coloides338.
También es frecuente el uso del autotransfusor, aunque este sistema no excluye la necesidad de la transfusión de hemoderivados339,340. Se recomienda utilizar el autotransfusor en caso de que se prevea una hemorragia cuantiosa y/o exista un elevado riesgo de complicaciones postransfusionales. Si se produce una pérdida sanguínea continua o si el paciente presenta un hematocrito < 30%, se aconseja la transfusión de hemoderivados340.
*Recomendaciones:
• No hay una pauta específica de reposición de líquidos que haya demostrado ser superior a las otras en el manejo perioperatorio del AAA, la más utilizada es la combinación de cristaloides y coloides.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia:moderada.
• Se aconseja la transfusión de hemoderivados si se produce una pérdida sanguínea continua o si el paciente presenta un hematocrito < 30%.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
El programa quirúrgico fast-track se emplea para reducir el número de complicaciones perioperatorias y para facilitar una pronta recuperación. Consiste en llevar a cabo una adecuada preparación preoperatoria del paciente, reducir la estancia preoperatoria a 2 h, no realizar preparación intestinal, subir la temperatura del quirófano a 22 °C, conseguir un correcto control del dolor perioperatorio mediante la colocación de un catéter epidural, pautar nutrición enteral y deambulación la noche previa a la intervención y restringir la fluidoterapia intravenosa a 1 l/24 h. Varios autores han aplicado este concepto a la reparación quirúrgica del AAA obteniendo una menor estancia hospitalaria, tanto en las unidades de cuidados intensivos como en las plantas de hospitalización, y una menor morbilidad postoperatoria341–344.
*Recomendación:
• Un adecuado estudio preoperatorio y una corta estancia preoperatoria asociadas a una correcta fluidoterapia perioperatoria y a una movilización precoz del paciente, pueden permitir una menor estancia hospitalaria y una menor morbilidad postoperatoria.
- –
Fuerza de la recomendación: fuerte
- –
Calidad de la evidencia: moderada.
Hay 2 tipos de abordaje abdominal en la reparación del AAA: transperitoneal (laparotomía vertical o transversa) y retroperitoneal. Hace 20-25 años se publicaron varios ensayos clínicos que comparaban la laparotomía vertical y el abordaje retroperitoneal, con diferentes resultados345–347. Existe un ensayo clínico más reciente, en el que la laparotomía transversa redujo la incidencia de hernia ventral348, y otro que concluyó que la minilaparotomía es segura y se asocia con una mejor recuperación y una menor estancia hospitalaria349. En los últimos años, a consecuencia del desarrollo de la EVAR, no se han llevado a cabo nuevos ensayos clínicos que comparen los diferentes tipos de abordaje quirúrgico3.
10.2.2.1.6Tipo de injertoExisten diferentes tipos de material: Dacron® (tejido o trenzado) o PTFE (politetrafluoroetileno). Ambos presentan una buena permeabilidad y resultados a largo plazo, por lo que la elección depende de la preferencia del cirujano y de los costes asociados350–352.
La extensión del AAA determina el tipo de injerto. El tubo recto disminuye el tiempo operatorio y reduce la disección, que cuando es extensa puede provocar la lesión de estructuras vecinas (uréter, vena ilíaca o sistema parasimpático). En caso de que el paciente asocie aneurismas ilíacos o enfermedad arterial oclusiva, se utiliza un tubo bifurcado (ilíaco o femoral). El injerto aortobifemoral presenta mayores tasas de infección de herida quirúrgica, especialmente inguinal, trombosis de injerto y/o aneurisma anastomótico353.
10.2.2.1.7Circulación pélvicaEs necesario realizar un estudio preoperatorio de la circulación pélvica para evitar determinadas complicaciones postoperatorias como la disfunción eréctil, la claudicación/necrosis glútea, la isquemia colónica y/o la isquemia medular. La arteria mesentérica inferior (AMI) está permeable en más del 50% de los pacientes con AAA354. La ligadura de la AMI es controvertida, ya que es la causa más frecuente de isquemia colónica postoperatoria en la reparación del AAA355. La AMI se puede ligar si presenta buen reflujo, si existe pulso satisfactorio en las ramas de la arcada de Riolano o si una de las 2 arterias hipogástricas está permeable. Si no se da ninguno de los supuestos anteriores es necesario reimplantar la AMI356.
*Recomendación:
• La conservación de al menos 1 arteria hipogástrica o de la AMI es necesaria para evitar complicaciones postoperatorias. Si existe lesión de las arterias esplácnicas o de las arterias hipogástricas, se debe reimplantar la AMI durante la reparación del AAA.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: baja.
Los pacientes intervenidos de AAA deben realizar el postoperatorio inmediato en una unidad de reanimación o de cuidados intensivos especializadas en el manejo de la fluidoterapia necesaria para la correcta reposición de líquidos. Una adecuada monitorización invasiva y no invasiva reduce el riesgo de morbimortalidad postoperatoria y de estancia hospitalaria en pacientes sometidos a reparación quirúrgica de AAA357. Además, el diagnóstico y el tratamiento precoz de las complicaciones postoperatorias reducen significativamente la mortalidad en estos pacientes358.
10.2.2.2Tratamiento endovascular10.2.2.2.1Criterios morfológicosAunque inicialmente el desarrollo de la EVAR estuvo influenciado por ciertas limitaciones técnicas, en los últimos años la evolución en el diseño de los dispositivos ha permitido un incremento del porcentaje de AAA susceptibles de reparación endoluminal. Realizar una adecuada planificación preoperatoria es crucial para obtener un buen resultado a corto y largo plazo. De acuerdo con las instrucciones de las principales casas comerciales, en la tabla 8 se recogen los requerimientos anatómicos mínimos para la EVAR3.
Requerimientos anatómicos mínimos para la reparación de aneurisma de aorta abdominal.
| Cuello aórtico proximal |
| Diámetro > 17 mm, < 32 mm |
| Longitud > 10 mm |
| Ángulo entre aorta suprarrenal y yuxtarrenal < 60° |
| Ángulo entre aorta yuxtarrenal y saco aneurismático < 60-90° |
| Trombo circunferencial < 50% |
| Calcificación circunferencial < 50% |
| Bifurcación aórtica |
| Diámetro > 18 mm si endoprótesis bifurcada |
| Arteria Ilíaca |
| Diámetro > 7 mm |
| Diámetro cuello distal < 22 mm |
| Longitud cuello distal > 15 mm |
| Ángulo entre AAA y arteria ilíaca < 60° |
| Calcificación no circunferencial |
Hoy en día existen varios modelos de endoprótesis para la reparación endoluminal de AAA. Sus diferencias estriban en el diseño, la composición, el tipo de stent y la presencia o ausencia de métodos de fijación a la pared aórtica3.
La comparación de la endoprótesis aortouniilíaca con la biilíaca no es rigurosa, por los factores de confusión frecuentemente asociados al primer grupo (pacientes de mayor edad y aneurismas más complejos, entre otros); el estudio RETA concluye que es mayor el número de complicaciones, reintervenciones y conversiones tras el implante de un modelo aortouniilíaco que biilíaco359. El Registro Europeo EUROSTAR establece que los nuevos modelos de endoprótesis presentan menor riesgo de migración, oclusión, reintervención y/o conversión360.
Generalmente se recomienda sobredimensionar la medida del endoinjerto un 15-20% respecto al diámetro del cuello aórtico para conseguir un sellado óptimo3.
No existen ensayos controlados aleatorizados que comparen los diferentes tipos de endoprótesis, por lo que no es posible establecer recomendaciones en la selección del tipo de injerto361.
10.2.2.2.3Tipo de anestesiaEl tipo de anestesia más utilizada en la EVAR es la general (61%), seguida de la regional (34%) y de la local (8%)362. Sin embargo, en las últimas publicaciones se objetiva una mayor preferencia por el uso de anestesia local, ya que es una opción segura y bien tolerada, que reduce el número de complicaciones postoperatorias y asocia una menor estancia hospitalaria363–365.
10.2.2.2.4Acceso percutáneoHoy en día disponemos de dispositivos que permiten reparar con una sutura percutánea la arteriotomía realizada por los introductores de gran calibre. Su utilización reduce el tiempo quirúrgico y disminuye la estancia hospitalaria366–368. Algunos autores han obtenido un éxito del 96% con este tipo de cierre369–372, sin encontrarse diferencias estadísticamente significativas de coste-efectividad al compararlo con la incisión inguinal370. Los factores de riesgo asociados al fallo de estos dispositivos son la obesidad, la calcificación femoral, la existencia de cicatriz inguinal previa y la elongación o plicatura del sector aortoilíaco373–375.
10.2.2.2.5Manejo de las arterias renales accesoriasAproximadamente el 15-30% de los pacientes con AAA tiene arterias renales accesorias376. Varios estudios han demostrado que la presencia de estas arterias no incrementa el porcentaje de endofugas y que su oclusión durante la EVAR no se asocia con síntomas ni signos de infarto renal, ni siquiera en pacientes con IR crónica leve o moderada377,378.
*Recomendación:
• La presencia de arterias renales accesorias en pacientes sometidos a EVAR no incrementa el porcentaje de endofugas, y su oclusión no se asocia con la aparición de síntomas o signos de infarto renal, por lo que no es necesaria su embolización preoperatoria.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: muy baja.
Alrededor del 40% de los pacientes sometidos a EVAR presenta aneurismas ilíacos. Este hecho compromete el anclaje distal de la endoprótesis y el éxito del resultado del procedimiento379–382. La embolización con coils de la arteria hipogástrica asociada al anclaje distal de la endoprótesis en la arteria ilíaca externa evita el desarrollo de endofugas tipo II. Para preservar la mayor cantidad de circulación colateral, se aconseja implantar los coils en el ostium de la arteria. Este procedimiento se suele llevar a cabo en el mismo tiempo quirúrgico que la EVAR383.
Un tercio de los pacientes sometidos a embolización hipogástrica presenta síntomas de isquemia pélvica: claudicación glútea (80%), disfunción eréctil (10%) e isquemia colónica (6-9%). Para evitar estas complicaciones, la mayoría de los autores recomienda preservar al menos 1 de las 2 arterias hipogástricas384–390. Hoy en día existe una alternativa para conservar la arteria hipogástrica en la EVAR: la endoprótesis ramificada ilíaca, que según los resultados de los últimos estudios realizados es una opción válida y segura391–394.
*Recomendaciones:
• Se recomienda preservar al menos 1 arteria hipogástrica en la EVAR.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• Para evitar las endofugas tipo II, preservando la circulación colateral existente, se aconseja embolizar la arteria hipogástrica en su origen, en caso de que sea necesario.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: muy baja.
La existencia de un cuello aórtico corto o patológico en pacientes con AAA es la principal causa de exclusión en la indicación de EVAR (40%)381,395. El desarrollo de endoprótesis fenestradas y/o con escotaduras para las arterias viscerales ofrece resultados prometedores, fundamentalmente en centros con amplia experiencia en EVAR. Varios autores han obtenido una mortalidad operatoria < 8,5% y una tasa de reintervención del 7,9-24%396–399.
La utilización de técnicas alternativas (sandwich, chimenea, snorkel) y el desarrollo de endoprótesis ramificadas para el tratamiento de aneurismas suprarrenales o toracoabdominales en los últimos años requieren mayor número de estudios que valoren su seguridad y eficacia3.
10.2.2.3Resultados del tratamiento quirúrgico y endovascularExisten numerosos estudios que analizan la influencia de determinados factores en el resultado de la reparación quirúrgica electiva de AAA341,400–413. Por otro lado, en los últimos años se han llevado a cabo varios ensayos clínicos que comparan los resultados de la reparación quirúrgica electiva de AAA con la reparación endovascular225,226,279,414–416.
10.2.2.3.1MortalidadDependiendo del diseño del estudio y de la selección de los pacientes, la mortalidad precoz o a corto plazo (< 30 días) tras la reparación electiva del AAA mediante cirugía abierta oscila entre el 1 y el 8%341,400–413. Uno de los estudios que ha obtenido mejores resultados al respecto, informa de una tasa de mortalidad del 1,2% y concluye que la edad > 75 años, el sexo masculino y el antecedente de ICC, EPOC o IR, se asocian con una mayor mortalidad a largo plazo345. Varios autores han establecido también que el antecedente de cardiopatía isquémica, el pinzamiento suprarrenal y el sexo femenino, incrementan la mortalidad perioperatoria tras la reparación abierta. Asimismo, se ha publicado una mayor mortalidad a los 5 años en pacientes más añosos, diabéticos con antecedentes de ICC o de enfermedad cardiovascular (ECV) intervenidos de AAA414.
Se han realizado 4 grandes estudios aleatorizados que comparan la cirugía abierta con la endovascular del AAA con una metodología similar.
En el año 2004 se publicaron los resultados de los 2 primeros, el EVAR1 y el DREAM, que comparaban la reparación quirúrgica con la EVAR, en pacientes con AAA > 5-5,5 cm de diámetro279,416. Ambos obtuvieron una mortalidad a corto plazo (a 30 días) menor en pacientes sometidos a EVAR: el 4,8 frente al 1,2% (p < 0,001) en el grupo abierto frente al endovascular del estudio DREAM, y el 4,7 frente al 1,7% (p = 0,009) en el grupo abierto frente al endovascular del estudio EVAR1. Posteriormente, el estudio OVER publicó una mortalidad del 0,5 frente al 3% en EVAR frente a cirugía abierta225. Sin embargo, el ensayo ACE es el único que no encontró diferencias significativas en la mortalidad postoperatoria: el 0,6% en cirugía abierta frente al 1,3% en la endovascular. Los propios autores reconocen que estos resultados pueden deberse al diseño del estudio y a la población seleccionada226 (tabla 9).
Un metaanálisis reciente concluye que la EVAR se asocia con una mortalidad precoz significativamente inferior que la reparación quirúrgica (OR: 0,33; IC del 95%, 0,20-0,55; p < 0,0001) en los pacientes considerados adecuados para cirugía convencional414. La tasa de mortalidad a corto plazo informada para el grupo EVAR en este metaanálisis es similar al 1,3% observada en el estudio RETA415. Por lo que respecta a la mortalidad a más largo plazo, aunque la EVAR se asocia a una mortalidad precoz significativamente inferior que la reparación quirúrgica, este beneficio no persiste en el seguimiento a medio plazo, debido al número de muertes posteriores registradas secundarias a complicaciones cardíacas y otras causas no relacionadas414.
10.2.2.3.2Complicaciones generales y reintervenciónLas complicaciones, tanto de la cirugía abierta como de la endovascular, incluyen la ruptura del AAA, el defecto técnico, las complicaciones locales (infección o linforrea de herida quirúrgica, seudoaneurisma, rotura arterial, hematoma pospunción, isquemia de extremidades o embolización distal), las relacionadas con el injerto (infección, oclusión, seudoaneurisma anastomótico y endofugas) y la morbilidad (cardíaca, respiratoria, fallo renal, ECV, trombosis venosa profunda, embolia pulmonar, isquemia intestinal, disfunción sexual, etc.)3. Uno de los estudios con mayor tamaño muestral publicado al respecto, registró un 17,3% de complicaciones perioperatorias y solamente un 0,4% de complicaciones relacionadas con el injerto durante el seguimiento a largo plazo de pacientes sometidos a reparación quirúrgica abierta electiva del AAA345.
El defecto técnico tras la EVAR es cada vez menos frecuente debido al desarrollo de dispositivos de última generación y a la mayor experiencia en este tipo de procedimiento3. Un metaanálisis llevado a cabo antes del año 2003, objetivó una tasa de conversión de EVAR a cirugía convencional del 3,8%417. Sin embargo, en los últimos ensayos y metaanálisis realizados, esta cifra ha disminuido significativamente, registrándose una tasa < 1,6% de conversión a cirugía abierta225,227,416.
Debido a que la EVAR es una alternativa menos invasiva para la reparación del AAA, algunos autores concluyen que asocia menor morbilidad que la cirugía convencional279,418–428. Ahora bien, según un metaanálisis publicado en 2014, ambos tipos de procedimiento presentan incidencias similares de ECV y fallo renal, sin encontrarse diferencias significativas en la calidad de vida y la disfunción sexual. Aunque no se ha registrado ninguna diferencia significativa en la tasa general de muerte por causa cardíaca entre EVAR y reparación quirúrgica, los datos del EVAR1 revelan que la EVAR se asocia con una menor incidencia de muertes cardiovasculares en los primeros meses de seguimiento, debida al menor estrés cardíaco perioperatorio que sufren estos pacientes. Además, a pesar de identificarse una tasa mayor de complicaciones respiratorias en el grupo de cirugía convencional (p = 0,006), no se ha encontrado diferencia significativa (p = 0,08) en la muerte por causas pulmonares entre EVAR y reparación quirúrgica414.
Aunque la EVAR tiene como ventajas un menor tiempo quirúrgico, menor pérdida sanguínea, menor necesidad de transfusión sanguínea, menor tiempo de ventilación mecánica, menor estancia hospitalaria y menor estancia en unidad de cuidados intensivos, requiere exposición a radiación y utilización de contraste414.
La liberación de citocinas tras la trombosis del saco aneurismático en EVAR es responsable del síndrome postimplante. Este proceso suele durar alrededor de 10 días, y consiste en fiebre, malestar general, dolor abdominal o lumbar, elevación de PCR y leucocitosis. Se recomienda vigilancia y tratamiento sintomático429.
La EVAR asocia una tasa de reintervención precoz (< 30 días) 5 veces mayor que la cirugía convencional: el 9,8% en EVAR1 y el 18% en EVAR2, y de reintervención tardía (6 años de seguimiento) significativamente mayor que la reparación quirúrgica414,419. La alta tasa de reintervención está relacionada con la presencia de endofugas, complicación exclusiva de EVAR. Mientras que la tipo I y la tipo III requieren reparación inmediata, para la tipo II se aconseja seguimiento porque es posible su resolución espontánea420–424.
Los resultados sobre el uso de EVAR en pacientes considerados inadecuados para la reparación quirúrgica se extraen del EVAR2. Este estudio concluye que en los pacientes considerados no candidatos a cirugía abierta convencional por alto riesgo quirúrgico, el tratamiento endovascular no mejora la supervivencia frente a la no intervención del aneurisma. Sin embargo, este estudio presenta varias limitaciones metodológicas que convierten a los resultados obtenidos en “no definitivos”418.
*Recomendaciones:
• La EVAR se asocia a una mortalidad precoz significativamente inferior que la reparación quirúrgica; sin embargo, este beneficio no persiste en el seguimiento a medio y a largo plazo.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• La EVAR se asocia a una tasa de reintervención mayor que la cirugía convencional.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
Tras una reparación abierta exitosa de un AAA se pueden desarrollar algunas complicaciones tardías que hay que tener en cuenta a lo largo del seguimiento de estos pacientes.
10.2.2.4.1.1Aneurisma paraanastomótico.Los aneurismas paraanastomóticos en pacientes intervenidos de AAA incluyen los seudoaneurismas anastomóticos y los aneurismas adyacentes a la anastomosis. Su etiología es multifactorial: la rotura de la sutura, el tipo de material protésico, la degeneración arterial y la infección3. En un estudio prospectivo de 138 pacientes intervenidos de AAA, controlados anualmente mediante ecografía Doppler, se objetivó una incidencia de aneurismas anastomóticos del 10% a los 10 años de seguimiento430.
No existen estudios que valoren la evolución natural de este tipo de complicación debido al elevado riesgo de ruptura que asocia430. En la mayor parte de los casos es necesaria su reparación quirúrgica electiva mediante endoprótesis o injerto protésico431,432.
*Recomendación:
• Para detectar el desarrollo de seudoaneurisma anastomótico o de aneurisma paraanastomótico durante el seguimiento de pacientes intervenidos de AAA, es necesario llevar a cabo pruebas de imagen complementarias como la ecografía Doppler o la TC.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: baja.
La elección del tipo de injerto (recto o bifurcado) es controvertida. Los autores partidarios del injerto bifurcado establecen que su realización evita el desarrollo de aneurismas de arteria ilíaca primitiva durante el seguimiento3. Sin embargo, un estudio retrospectivo con 438 pacientes y 715 aneurismas ilíacos publicó que la tasa de crecimiento de un aneurisma ilíaco es de 0,29 cm/año433. Además, un estudio multicéntrico con 147 casos, concluyó que ningún paciente al que se había realizado un injerto recto por AAA y que presentaba aneurisma de ilíaca primitiva < 25 mm precisó reparación quirúrgica posterior tras 4,8 años de seguimiento434. Asimismo, otro estudio prospectivo, publicado en 2008, estableció que no se observa un crecimiento significativo ni una ruptura de aneurisma de ilíaca primitiva < 25 mm durante 7 años de seguimiento tras la realización de un injerto recto435.
10.2.2.4.1.3Infección de injerto.La incidencia de infección de injerto protésico oscila entre el 0,3 y el 6%436–439, < 1% en los injertos aortoaórticos o aortobiilíacos, y del 2-4% en los aortobifemorales440,441. La infección del injerto puede ser temprana durante el implante, o tardía por diseminación hematógena tras la realización de determinados procedimientos invasivos como endoscopia o procedimientos dentales. Otros factores de riesgo son la reintervención quirúrgica o la cirugía urgente.
El microorganismo más frecuentemente aislado es Staphylococcus epidermidis, seguido de S. aureus y de Escherichia coli442.
La clínica es diversa y puede incluir signos de sepsis, drenaje purulento inguinal, seudoaneurisma y/o fístula enteroprotésica (FEP)443. La incidencia de FEP es < 1%, y su causa es mecánica por decúbito de la prótesis en la pared del duodeno, que provoca infección secundaria del injerto por continuidad444–446. El diagnóstico definitivo de la FEP es difícil y tardío, y las pruebas más utilizadas son la TC y la endoscopia. Presentan una sensibilidad del 50%, por lo que un resultado negativo no excluye la existencia de FEP447,448. La TC tiene una sensibilidad y especificidad del 90-100% para diagnosticar una infección avanzada del injerto449,450. Pero cuando la infección es incipiente o de baja virulencia, esta cifra disminuye hasta el 65%451. La RM puede diferenciar el hematoma de las colecciones y de la inflamación. Varios autores han publicado la utilidad de combinar la gammagrafía con leucocitos marcados y la TC452, aunque es necesario llevar a cabo más estudios que valoren su eficacia.
Aunque el tratamiento convencional consiste en la revascularización extraanatómica y la escisión del injerto con desbridamiento del campo infectado, algunas publicaciones recientes han cuestionado esta máxima quirúrgica al tener en cuenta varios factores: en primer lugar, si el microorganismo aislado es S. epidermidis, de baja virulencia, frente a S. aureus, de gran virulencia; en segundo lugar, el éxito que han obtenido algunos autores que no han realizado escisión completa del injerto infectado; en tercer lugar, la aparición de la técnica de criopreservado, que permite utilizar in situ un injerto de vena femoral o un aloinjerto aortoilíaco, y, por último, la disponibilidad de un injerto protésico cubierto con antibiótico, que ofrece prometedores resultados.
La cirugía convencional asocia una tasa de mortalidad del 11-44%, de reinfección del injerto del 3-37% y de estallido de muñón aórtico del 3-24%453–455. La mortalidad de la revascularización in situ con aloinjerto aórtico oscila entre el 9 y el 56%, con una tasa baja de amputación, pero con un riesgo elevado de estenosis, dilatación aneurismática y/o ruptura de la anastomosis aórtica456–462. Según varios autores, la mortalidad de la revascularización in situ con injerto venoso femoral oscila entre el 7 y el 32%, con una tasa baja de reinfección del injerto463–465. Algunos estudios recientes recomiendan restringir el uso de la revascularización in situ para pacientes hemodinámicamente estables, con microorganismos poco virulentos, que no asocien FEP466. Los pacientes inestables, con signos de sepsis y hemorragia activa, se pueden beneficiar del implante de endoprótesis de forma temporal, como procedimiento puente antes de plantear una reparación quirúrgica definitiva467. Un metaanálisis reciente, que comparó las diversas alternativas terapéuticas, establece que la revascularización extraanatómica seguida de la escisión del injerto asocia la tasa más elevada de complicaciones perioperatorias, seguida de la revascularización in situ con vena femoral, del aloinjerto aórtico y del injerto protésico cubierto con antibiótico468–471. Esta afirmación hay que tomarla con cautela debido a que son estudios retrospectivos, con algunos factores de confusión y varios sesgos en la selección de pacientes.
*Recomendaciones:
• En pacientes portadores de injerto protésico es aconsejable pautar profilaxis antibiótica previa a la realización de endoscopia y/o procedimiento dental, debido al riesgo potencial de infección tardía del injerto por diseminación hematógena.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: muy baja.
• Es necesario descartar la existencia de fístula enteroprotésica en pacientes portadores de injerto protésico aórtico con hemorragia digestiva.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• En los pacientes hemodinámicamente estables con fístula enteroprotésica o infección extensa del injerto por gérmenes virulentos, se aconseja realizar revascularización extraanatómica seguida de escisión del injerto.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• La revascularización in situ utilizando vena femoral o aloinjerto aortoilíaco, debe reservarse para los pacientes con infección protésica sin fístula enteroprotésica.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: moderada.
• La utilización de injerto protésico cubierto con antibiótico en revascularización in situ se reserva para casos seleccionados con limitada infección.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: moderada.
• Los pacientes hemodinámicamente inestables con hemorragia activa por rotura de injerto se pueden beneficiar del implante de endoprótesis de forma temporal.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: muy baja.
Una de las ventajas de la reparación quirúrgica abierta de AAA es su alta permeabilidad. Hallett et al registraron una tasa de oclusión del injerto del 3% a los 10 años de seguimiento472, Conrad et al del 2,6% a los 7 años473 y Biancari et al del 5,3% a los 8 años de seguimiento, debido a que su serie registraba un 49% de injertos aortofemorales474. El tratamiento incluye la fibrinólisis locorregional o la trombectomía quirúrgica, con reparación endoluminal o quirúrgica posterior.
10.2.2.4.1.5Disfunción sexual.La eyaculación retrógrada o la impotencia son complicaciones frecuentes tras la repareparación quirúrgica de AAA, debido a la lesión del sistema nervioso parasimpático durante la disección aortoilíaca475. En el estudio ADAM, el 40% de los varones presentaba impotencia previa a la cirugía y menos del 10% desarrolló impotencia durante el primer año de seguimiento476. Sin embargo, más del 60% de los pacientes presentó impotencia a los 4 años de seguimiento, lo que traduce su etiología multifactorial. La conservación del sistema nervioso parasimpático periaortoilíaco izquierdo reduce la incidencia de esta complicación477. Otra causa de impotencia en este grupo de pacientes es la disminución de la circulación pélvica secundaria a la embolización u oclusión de las arterias hipogástricas.
10.2.2.4.1.6Complicaciones tardías relacionadas con la herida quirúrgica.La reparación quirúrgica de AAA asocia riesgo de hernia incisional y/u obstrucción intestinal por adherencias. La revisión realizada por Takagi et al encontró que la tasa de hernia incisional que requiere reparación a los 4 años de seguimiento es mayor en el grupo de pacientes intervenidos por AAA que por enfermedad oclusiva aortoilíaca (el 5,8 frente al 2,8%; p < 0,001)478. También se ha observado el desarrollo de eventraciones y herniación por hipotonía muscular tras realizar un abordaje retroperitoneal para reparación de AAA346.
10.2.2.4.1.7Protocolo de seguimiento.A pesar de todos estos datos, no existe un protocolo de seguimiento consensuado tras la reparación electiva abierta del AAA. Son habituales varios controles durante el primer año, con una revisión anual posterior. Es recomendable completar la anamnesis con una exploración física periódica y pruebas complementarias (ecografía, índice tobillo-brazo, TC o ecografía Doppler) en caso de que los datos clínicos sugieran el desarrollo de alguna de las complicaciones mencionadas409,410,473. Algunos grupos aconsejan la realización de TC periódicas en pacientes asintomáticos, como cribado de complicaciones paraanastomóticas silentes. El patrón más habitual de estas TC es cada 5 años433.
*Recomendación:
• Se aconseja incluir en el seguimiento de pacientes sometidos a reparación quirúrgica de AAA la anamnesis, la exploración física, una ecografía Doppler continua con índice tobillo-brazo anual, y una ecografía Doppler o una TC a los 5, 10 y 15 años del procedimiento quirúrgico.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: baja.
De forma similar al tratamiento quirúrgico convencional, tras una reparación endovascular de un AAA se pueden desarrollar algunas complicaciones tardías durante el seguimiento de estos pacientes.
10.2.2.4.2.1.Endofugas.La incidencia de endofugas tras la EVAR alcanza el 25%479–481. Su existencia implica un aumento de presión en el saco aneurismático, con el consiguiente riesgo de ruptura del AAA482. Se han descrito 4 tipos de endofugas y la endotensión420,483,484.
El desarrollo de endofugas tipo I se debe a un anclaje inadecuado de la endoprótesis o a una dilatación del cuello del aneurisma durante el seguimiento. En un subgrupo del EVAR1, la tasa de dilatación del cuello del AAA fue mayor en pacientes sometidos a EVAR que a reparación quirúrgica abierta485. La incidencia de endofugas tipo I aumenta en los casos con anatomía desfavorable (cuellos cortos o angulados y/o zonas de anclaje con elevada calcificación). Junto con la tipo III asocia un elevado riesgo de ruptura del AAA486. Cuando no se objetiva migración del endoinjerto, la endofuga tipo IA se puede tratar mediante dilatación con balón o implante de stent tipo Palmaz487. Pero, si se observa migración, las alternativas son el implante de una extensión endoprotésica proximal o de una endoprótesis fenestrada, y la conversión a cirugía abierta488. El tratamiento de la endofuga tipo IB consiste en implantar una extensión con anclaje en ilíaca primitiva distal o ilíaca externa, teniendo en cuenta la potencial necesidad de embolizar la hipogástrica ipsilateral o de utilizar una ramificación ilíaca (si la hipogástrica contralateral está ocluida) para prevenir una nueva endofuga. Para evitarla se aconseja extender la endoprótesis al menos 3 cm en ilíaca primitiva o en ilíaca externa.
La incidencia de endofugas tipo II alcanza el 20%489,490. Son de bajo flujo, y en torno al 50-80% se resuelven espontáneamente durante los 6 primeros meses postoperatorios, sin requerir tratamiento491–494. Se aconseja reparar las endofugas tipo II cuando se objetiva crecimiento del saco aneurismático489,495,496. Las alternativas terapéuticas incluyen la embolización con coils de las ramas mediante cateterización supraselectiva423,497 o mediante punción guiada con TC del saco aneurismático498 y la ligadura de ramas mediante laparoscopia retroperitoneal499 o mediante laparotomía. En ocasiones, con la TC convencional su diagnóstico y el de las endofugas tipo IV es difícil y es necesario realizar una RM o una TC en fase arterial tardía500,501.
La desconexión modular en la endofuga tipo III se puede deber a un escaso solapamiento entre el cuerpo y las extensiones, que se soluciona mediante el implante de una extensión o un stent recubierto, o a una migración, angulación o rotura del endoinjerto, en cuyo caso es necesario plantear la conversión a cirugía abierta3.
La endotensión se define como la presión intrasaco necesaria para causar la ruptura del AAA, sin evidencia de las endofugas descritas. Se acepta que se puede deber a la presencia de una endofuga de bajo flujo, indetectable con los métodos de imagen disponibles502. Los métodos de detección de la presión intrasaco son poco fiables, por lo que la mayoría de los autores recomiendan el implante de una nueva endoprótesis, o la conversión a cirugía abierta en caso de crecimiento del saco aneurismático sin evidencia de las endofugas convencionales.
*Recomendaciones:
• Es necesario tratar las endofugas tipo I debido al elevado riesgo de ruptura aórtica que conllevan.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• Para detectar las endofugas tipo II se aconseja realizar una TC en fase arterial tardía.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• Se recomienda un manejo conservador y seguimiento como primera opción ante endofugas tipo II sin crecimiento de saco aneurismático.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• Se recomienda tratamiento endovascular o laparoscópico de las endofugas tipo II cuando se objetiva un crecimiento de saco aneurismático > 10 mm, aconsejando reconvertir a cirugía abierta en caso de fracaso del tratamiento.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: baja.
• Se recomienda la reparación de las endofugas tipo III debido al elevado riesgo de ruptura aórtica que conllevan.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• Se recomienda tratamiento conservador y seguimiento de las endofugas tipo IV.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• Se recomienda el implante de una nueva endoprótesis o la conversión a cirugía abierta tras EVAR en caso de crecimiento del saco aneurismático > 10 mm sin evidencia de las endofugas convencionales.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
La migración de la endoprótesis tras EVAR se define como el desplazamiento > 10 mm objetivado con la reconstrucción a través del centerline en la TC503,504. La mayoría de los autores han observado una mayor prevalencia a los 24 meses del procedimiento y se ha descrito en todos los tipos de endoprótesis: aortouniilíaca, aortobiilíaca, con fijación infrarrenal y con fijación suprarrenal505–507. Puede ser asintomática y se manifiesta como la presencia de una endofuga tipo IA. Los factores que influyen en su desarrollo son la anatomía del cuello del aneurisma (longitud, angulación, diámetro, morfología y trombo), la posible dilatación del cuello tras EVAR, el cálculo erróneo de la sobredimensión del endoinjerto, un fallo en la fijación proximal y las características específicas de cada tipo de endoprótesis505–509. Los estudios llevados a cabo para analizar la influencia de la dilatación del cuello aneurismático en la migración de la endoprótesis tienen una metodología pobre, sin poder confirmar la existencia de una relación entre una incorrecta sobredimensión del endoinjerto y la presencia de una migración510–516.
10.2.2.4.2.3Desconexión modular de la endoprótesis durante el seguimiento.Se han descrito casos de desconexión de los endoinjertos modulares, lo que provoca endofugas tipo IIIA. Se objetiva en la TC realizada durante el seguimiento y puede deberse a las presiones que se generan entre el saco aneurismático y los ejes ilíacos, a la migración del endoinjerto, a la fatiga del material o a la fractura de la endoprótesis516,517.
10.2.2.4.2.4Oclusión de la endoprótesis.El estudio EVAR1 establece que las endoprótesis se asocian con una tasa mayor de oclusión que las prótesis utilizadas en la reparación quirúrgica del AAA (el 2,3 frente al 0,2%; OR: 12,02; p = 0,003)416. La plicatura del endoinjerto se describe en un 3,7% de los casos y se asocia a endofuga tipo I y tipo III, a trombosis y a migración de la endoprótesis518. Las alternativas terapéuticas incluyen el implante de un nuevo endoinjerto tras fibrinólisis o la reparación quirúrgica abierta anatómica o extraanatómica (injerto femorofemoral o axilobifemoral), ya que la trombectomía del endoinjerto no es eficaz en estos casos.
10.2.2.4.2.5Infección de la endoprótesis.La tasa de infección del endoinjerto tras EVAR es baja. Tanto el registro EUROSTAR como el estudio EVAR1 establecen una incidencia similar, en torno al 0,1-0,2%416,481. Al igual que en la cirugía convencional se puede asociar a la aparición de FAE519. La prevención se realiza utilizando los mismos principios de asepsia establecidos para la reparación quirúrgica de AAA.
10.2.2.4.2.6Insuficiencia renal tras reparación endovascular del aneurisma abdominal.Mientras que algunos autores han descrito un mayor deterioro del filtrado glomerular durante el seguimiento tras EVAR que tras cirugía convencional520, otros no han hallado diferencias al respecto521. Su etiología es multifactorial y, aunque son necesarios más estudios que lo confirmen, se incluyen la nefrotoxicidad por contraste tras las TC de repetición y el daño potencial sobre las arterias renales por la fijación suprarrenal de la endoprótesis o por la manipulación endoluminal en la zona del cuello del AAA como las principales causas de esta complicación.
10.2.2.4.2.7Protocolo de seguimiento.Es necesario que a todos los pacientes sometidos a EVAR se les aplique un protocolo de seguimiento para detectar las posibles complicaciones descritas (endofuga, dilatación del cuello aórtico, migración de la endoprótesis y desconexión modular del endoinjerto). Se aconseja completar la anamnesis con una exploración física, una ecografía Doppler continua con índice tobillo-brazo y una prueba de imagen complementaria522,523. Las alternativas incluyen: radiografía simple de abdomen, ecografía Doppler, angio-TC, RM, métodos de medición de la presión intrasaco y pruebas basadas en medicina nuclear.
• Radiografía simple de abdomen. Las proyecciones anteroposterior y lateral permiten valorar la presencia de fracturas, migración o desconexión modular del endoinjerto. No tiene validez para evaluar la presencia de endofugas ni para realizar mediciones del diámetro del saco aneurismático, por lo que precisa asociar otra prueba complementaria145.
• Ecografía Doppler. Según Mirza et al, la ecografía Doppler tiene una sensibilidad del 77% y una especificidad del 94% para detectar endofugas, frente al 98 y el 88%, respectivamente, de la ecografía-Doppler con contraste. Aunque estos datos se deben tomar con cautela por la heterogeneidad de la muestra, parece que la ED con contraste puede ser una prueba diagnóstica segura y sensible para detectar endofugas524. Una de las ventajas frente a la TC es que permite precisar la dirección del flujo de la endofuga. Así, varios autores establecen una asociación entre el tipo de curva arterial y la evolución de la endofuga tipo II (cierre espontáneo o persistente). No tiene validez para evaluar la migración ni la integridad del endoinjerto, por lo que precisa asociar otra prueba complementaria525.
• Angio-TC. La angio-TC en fase arterial tardía es la prueba diagnóstica más utilizada para detectar endofugas y para medir el diámetro del saco aneurismático tras EVAR. Existe controversia al respecto, porque mientras algunos autores sugieren que la sensibilidad de la angio-TC es superior a la ecografía Doppler para detectar las endofugas526–528, otros concluyen que la ecografía Doppler con contraste supera a la angio-TC529. Ahora bien, la detección de las endofugas por angio-TC se ve influenciada por el protocolo establecido. Así, el estudio EUROSTAR sugiere que la angio-TC en fase arterial tardía con cortes a 3 mm es la mejor prueba para detectar endofugas tipo II530. Los inconvenientes de la angio-TC son la posibilidad de desarrollar nefrotoxidad por contraste, la exposición a un exceso de radiación ionizante con el riesgo a medio-largo plazo de favorecer un proceso canceroso y el elevado coste asociado531,532. Por lo tanto puede ser la prueba de elección, sin precisar ninguna otra prueba complementaria, pero teniendo en cuenta el riesgo de nefrotoxidad y de exposición a la radiación ionizante.
• RM. La RM y la angio-RM son buenas alternativas a la angio-TC, ya que permiten realizar medidas del diámetro del saco aneurismático y detectar endofugas, con un mejor análisis de estas, asociando menor posibilidad de nefrotoxicidad y sin exposición a radiación ionizante533. Los inconvenientes son la disponibilidad hospitalaria, la dificultad para valorar la integridad de la endoprótesis y la contraindicación en pacientes portadores de marcapasos, de determinados componentes metálicos y de algunos endoinjertos. Por lo tanto precisa asociar otra prueba complementaria para llevar a cabo un completo estudio y seguimiento tras EVAR.
• Métodos de medición de la presión intrasaco. Aunque se han descrito métodos invasivos y no invasivos, tienen poca fiabilidad, ya que el trombo mural aórtico puede influir en su resultado534–537.
• Pruebas complementarias basadas en medicina nuclear. Se han realizado estudios que valoran la eficacia de la TC con tecnecio 99 y con marcadores serológicos (MMP-9, P-plasmina-antiplasmina, etc.), sin poderse establecer indicaciones al respecto538.
*Recomendaciones:
• El seguimiento de pacientes sometidos a EVAR debe incluir la anamnesis, la exploración física y una ecografía Doppler continua con índice tobillo-brazo.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: baja.
• Se debe realizar una angio-TC en fase tardía y una radiografía simple de abdomen en proyecciones anteroposterior y lateral de control a los 30 días del procedimiento en todos los pacientes sometidos a EVAR.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• Si se objetiva una endofuga (tipo II o IV) o un escaso solapamiento de los componentes modulares de la endoprótesis se recomienda angio-TC y radiografía simple de abdomen a los 6 y a los 12 meses del procedimiento y, posteriormente, control anual, mientras no haya otras complicaciones y el paciente se mantenga asintomático.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• Si no se identifican endofugas y existe un correcto solapamiento de los componentes modulares de la endoprótesis, se puede omitir la angio-TC a los 6 meses, y se debe llevar a cabo una angio-TC y una radiografía de abdomen a los 12 meses del procedimiento.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• Si al año no se identifica ninguna complicación tras EVAR, se recomienda control anual con ecografía Doppler y radiografía simple de abdomen en proyecciones anteroposterior y lateral. Si la anatomía del paciente resta validez a la ecografía Doppler, se recomienda TC sin contraste y radiografía de abdomen de forma anual.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• Si se identifica cualquier complicación de nueva aparición, se recomienda angio-TC.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
• En pacientes con IR crónica, se recomienda el seguimiento con ecografía Doppler, TC sin contraste o RM y radiografía simple de abdomen.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: baja.
La rotura es la principal complicación de los AAA y da lugar a una hemorragia masiva con shock hipovolémico que amenaza la vida del paciente de forma inmediata. La ruptura de la aorta dilatada puede darse a la cavidad peritoneal o al retroperitoneo. En esta última circunstancia, los diferentes tejidos pueden taponar de forma transitoria la hemorragia permitiendo una pérdida de volumen sanguíneo menos rápida.
Es importante diferenciar un aneurisma roto de un aneurisma sintomático, ya que este último hace referencia a los aneurismas que producen dolor pero en los que no existe pérdida sanguínea. Este dolor se asocia de forma frecuente a aneurismas rápidamente expansivos y son un signo de ruptura inminente. Es importante diferenciar entre los estudios que hacen referencia a aneurismas rotos exclusivamente y los que hacen referencia a aneurismas rotos y sintomáticos intervenidos de urgencia, ya que estos últimos tienen habitualmente un mejor resultado.
La mortalidad de la reparación quirúrgica convencional de los AAA rotos oscila entre un 25-50% en función de las series539–542. Un metaanálisis publicado en el año 2002 mostró cómo la optimización de los cuidados pre y posquirúrgicos había influido poco en las cifras de mortalidad543.
La EVAR se ha mostrado como un método de eficacia similar a la cirugía abierta convencional y con una menor morbilidad cuando se emplea en los casos apropiados. Es de esperar que la introducción de técnicas endovasculares disminuya estas cifras de morbimortalidad también en los casos de aneurismas rotos y sintomáticos.
11.2Manejo preoperatorio11.2.1Realización de una tomografía computarizada preoperatoriaLa llegada de un paciente a urgencias con signos y síntomas compatibles con ruptura de un AAA, habitualmente permite realizar una ecografía diagnóstica en la propia sala de urgencias y la realización de una TC para una correcta planificación de la cirugía.
En el año 2004 se publicó un estudio en el que se analizaba el tiempo medio que pasaban los pacientes con un AAA roto desestimados para cirugía desde que ingresaban en urgencias hasta que fallecían. La mayoría de los pacientes (87,5%) estaba más de 2 h en urgencias, con un tiempo medio hasta el fallecimiento de 10 h 45 min. Por tanto, y según estos resultados, en la mayoría de los casos hay tiempo suficiente para la realización de una TC preoperatoria544.
Por otra parte, el estudio IMPROVE mostró cómo en la mayoría de los casos era posible la realización de una TC preoperatoria, y solo en el 10% de los casos intervenidos mediante reparación convencional no pudo realizarse esta prueba debido a inestabilidad hemodinámica del paciente545.
11.2.2Hipotensión inducidaPublicaciones recientes recomiendan un manejo con restricción de aporte de volumen para mantener una hipotensión controlada e inducida que disminuya la pérdida sanguínea en estos pacientes546.
En un estudio retrospectivo se analizaron 248 pacientes intervenidos por AAA roto, la mayoría de ellos por medio de una intervención quirúrgica convencional547. Los autores dividieron la muestra en 2 grupos en función de que se situaran por encima o por debajo de la media de volumen de líquido administrado durante el preoperatorio. Los autores encontraron una correlación positiva entre el volumen de líquido administrado preoperatoriamente y la mortalidad a 30 días. Cada litro de más sobre la media administrado al paciente antes del pinzamiento se asociaba a un aumento de riesgo de muerte a los 30 días del 60%. El nivel de hipotensión inducida recomendado por Crawford, ya en la década de los noventa, es de 60-70 mmHg548, aunque no hay estudios aleatorizados dirigidos que puedan mostrar cuáles son estas cifras ideales.
En cuanto al empleo de coloides o cristaloides para la administración preoperatoria de líquidos, no existen estudios aleatorizados que nos puedan aportar luz en este sentido. No obstante, en el estudio de Dick et al547, el empleo de coloides se asocia a una mayor mortalidad que cuando se emplearon cristaloides.
*Recomendación:
• Se recomienda un empleo restrictivo de aporte preoperatorio de volumen, con la finalidad de mantener una hipotensión inducida hasta el momento del pinzamiento. Se sugiere el empleo de cristaloides frente a coloides para este fin.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: baja.
Los pacientes con un aneurisma roto son, a priori, los que más se deben beneficiar del empleo de técnicas de reparación endovascular. Sin embargo, no se ha producido la disminución esperada de mortalidad cuando se realizan estudios comparativos con la cirugía convencional.
Las principales causas que imposibilitan el empleo de esta técnica son la inestabilidad hemodinámica, que impide incluso la realización de una TC preoperatoria, y los requerimientos anatómicos, que dificultan la aplicación de esta técnica en numerosos casos. Desde el punto de vista de la técnica hay que valorar varios puntos: el empleo de anestesia local para la reparación, el uso de balón de oclusión aórtica, la elección del tipo de fijación de la prótesis (supra o infrarrenal), así como la disposición aortouniilíaca o aortobiilíaca.
11.3.1Empleo de anestesia localDurante la inducción anestésica se produce una pérdida del tono muscular de la pared abdominal, por tanto se pierde ese efecto de taponamiento sobre la hemorragia. Por ello se ha abogado por el uso de la anestesia local en estos procedimientos, a pesar de que supone un mayor estrés y un peor control del dolor para el paciente. Sin embargo, el empleo de la anestesia general permite anular los movimientos del paciente durante la cirugía; así se consigue una mejor calidad fluoroscópica de cara al correcto implante de la prótesis.
En el estudio IMPROVE, que analizó los resultados de la cirugía abierta frente a la EVAR, el empleo de anestesia general se asoció a una mayor mortalidad a 30 días (33,7%) frente al empleo de anestesia local (13%). Sin embargo, los resultados fueron similares entre los pacientes que recibieron inicialmente anestesia local y luego se reconvirtieron a anestesia general, que presentaron una mortalidad del 30%. Los autores concluyen que el empleo de anestesia local disminuye la mortalidad frente a los pacientes intervenidos bajo anestesia general (OR ajustada: 0,27; IC del 95%, 0,10-0,70)549.
En una serie retrospectiva publicada en el año 2009 se mostraron unos excelentes resultados de un único centro tras la reparación endovascular de 102 pacientes con AAA roto. La mortalidad a 30 días fue de tan solo el 13%, y entre los factores que se proponían como causantes de esa excelente tasa de mortalidad estaba el uso casi sistemático de anestesia local, que fue empleada en el 70% de los casos546.
11.3.2Endoprótesis aortomonoilíaca frente a endoprótesis bifurcadaEn el tratamiento endovascular de los aneurismas rotos se pueden emplear tanto prótesis aortounilíacas como bifurcadas. El empleo de las primeras ofrece la ventaja de un más rápido control de la hemorragia, al ser implantadas de forma más rápida, y de una mayor posibilidad de tratamiento en función de las características anatómicas del paciente, ya que solo uno de los ejes ilíacos debe cumplir los criterios necesarios para el implante550,551.
Como contrapartida precisa de la necesidad de realizar un bypass femorofemoral, que se asocia a una mayor tasa de oclusiones y a una mayor tasa de infección protésica, además de dificultar la realización del procedimiento con anestesia local.
Se han realizado estudios que muestran cómo los resultados a corto y medio plazo de las endoprótesis uniilíacas son peores que los de las prótesis bifurcadas en la cirugía electiva del AAA359,552. A pesar de estos resultados, el empleo de las endoprótesis aortouniilíacas tienen sus indicaciones en casos en los que no es posible el implante de una prótesis bifurcada.
En el estudio IMPROVE, el uso de prótesis bifurcadas se asoció con mayor frecuencia al empleo de anestesia local que cuando la exclusión del aneurisma se realizó mediante una prótesis aortouniilíaca implantada preferentemente bajo anestesia general. Esto explica la menor mortalidad que se obtiene con las prótesis bifurcadas (el 21 frente al 33%). Si bien, no existió aleatorización en cuanto al empleo de técnica al ajustar estas variables, el estudio concluye que no hay diferencias de mortalidad entre ambos grupos549.
En un metaanálisis reciente con 1.397 pacientes, en el 57% de los casos se empleó una prótesis bifurcada y en el 41% una prótesis aortouniilíaca. De todos los factores que se analizaron en este metaanálisis, solo el empleo de prótesis bifurcadas se asoció a una disminución significativa de la mortalidad553. Por otra parte, en una serie retrospectiva del año 2012 con 42 pacientes con AAA se concluyó que el empleo de una prótesis aortouniilíaca era un factor asociado fuertemente a una mayor mortalidad a los 30 días554.
A la vista de estos estudios, no existe suficiente evidencia para recomendar fehacientemente el empleo de una u otra prótesis para la reparación de estos aneurismas. Se puede recomendar el empleo de las prótesis bifurcadas sobre la base de 2 premisas. Por una parte, los peores resultados contrastados que tienen en la cirugía electiva las endoprótesis aortouniilíacas y, por otra, los resultados obtenidos en el metaanálisis de Karkos y en series retrospectivas. Sin embargo, las prótesis aortouniilíacas tienen sus indicaciones, sobre todo en función de las condiciones anatómicas y específicas de cada paciente.
*Recomendación:
• Se sugiere el empleo de endoprótesis bifurcadas en el tratamiento de los AAA rotos, siempre que las condiciones anatómicas sean adecuadas para estos dispositivos. En caso contrario, las endoprótesis aortouniilíacas son una alternativa.
- –
Fuerza de la recomendación: débil.
- –
Calidad de la evidencia: moderada.
El empleo de un balón de oclusión aórtica durante la cirugía endovascular del AAA roto permite la estabilización hemodinámica en los pacientes que se encuentran muy inestables, al disminuir la hemorragia que se produce a través del aneurisma. Sin embargo tiene como contrapartida la posibilidad de producir una isquemia renal o visceral, no controlar absolutamente la hemorragia, ya que permite la hemorragia retrógrada a través de ilíacas, puede producir embolizaciones y dificultar la realización de angiografías. Se recomienda su colocación a un nivel supracelíaco a través del acceso contrario al que va a ser empleado para la introducción del cuerpo principal de la prótesis. Una vez que este está colocado se puede retirar el balón y colocarlo dentro de la propia prótesis mientras se cateteriza la rama contralateral. Estas maniobras no serían necesarias en caso de endoprótesis aortouniilíacas555.
No existen estudios aleatorizados y controlados que analicen este aspecto técnico. La mayoría de autores abogan por su uso solo en el caso de inestabilidad hemodinámica grave. Mehta et al, en un estudio reciente encuentran que en los AAA rotos hemodinámicamente inestables intervenidos se emplea de manera más frecuente el balón de oclusión aórtica para estabilizar a los pacientes. Este subgrupo presenta una mayor mortalidad a 30 días, pero esto no se puede atribuir al empleo del balón, sino a las condiciones del enfermo556.
Se analizaron los resultados de un estudio retrospectivo, pero con datos registrados prospectivamente, en 90 pacientes intervenidos de forma endovascular por AAA roto. El balón de oclusión solo se empleó en el 26% de los casos por inestabilidad hemodinámica de difícil control (el 61% del total de pacientes presentó inestabilidad hemodinámica). El empleo de balón se asoció a peores resultados a 30 días, pero de nuevo esto se puede atribuir al estado de los pacientes y no al empleo del balón557.
11.3.4Empleo de endoprótesis con fijación supra o infrarrenalLas endoprótesis con fijación suprarrenal tienen la teórica ventaja de una mayor fijación en cuellos cortos, lo que puede ser de interés en el tratamiento endovascular de los AAA rotos, con cuellos frecuentemente en el límite de cumplir criterios de tratamiento endovascular.
No existen estudios aleatorizados que comparen el empleo de dispositivos con fijación supra o infrarrenal en estas circunstancias, por lo que lo único que se puede hacer es aplicar lo aprendido del empleo de estos dispositivos en cirugía electiva.
Las endoprótesis con fijación suprarrenal presentan una mayor tasa de complicaciones renales en forma de infartos o empeoramiento de la función renal respecto a las prótesis sin esta fijación558–561. Por otra parte, recientemente han aparecido estudios que no encuentran diferencias en la incidencia de endofugas tipo I durante el seguimiento de endoprótesis con fijación supra o infrarrenal. Así, en una serie retrospectiva de 1.379 endoprótesis implantadas en aneurismas con cuello corto, no hubo diferencias en términos de fuga tipo I ni en términos de crecimiento del saco del aneurisma entre los pacientes a los que se implantó una endoprótesis con fijación supra o infrarrenal562.
Por tanto, no se puede recomendar el empleo de un dispositivo u otro al no existir suficiente evidencia para hacerlo. La prótesis a emplear en cada caso dependerá del cirujano y de la familiaridad que tenga con cada dispositivo, ya que en el caso de los aneurismas rotos, la rapidez en la colocación de la prótesis es clave para la evolución del paciente.
11.4Cirugía abierta de los aneurismas de aorta abdominal rotosA pesar de que las técnicas endovasculares sean hoy en día de uso preferente en estos pacientes debido a su menor morbimortalidad546, todavía se encuentra vigente la reparación abierta convencional de estos aneurismas. Esto se debe a que, a pesar de la mejora de los dispositivos, todavía se requieren unos parámetros anatómicos estrictos para que el tratamiento endovascular sea eficaz a largo plazo. Así, en los casos en los que hay cuellos cortos, angulados o ambos, el tratamiento endovascular tiene una peor evolución a medio plazo que los casos en donde se respetan de forma escrupulosa los requerimientos descritos en las guías y en las instrucciones de uso de los fabricantes563.
Un estudio multicéntrico y prospectivo mostró cómo solo se pudieron aleatorizar el 35,5% de los pacientes a técnicas endovasculares. Esto se debió a varias razones, entre las que destacan la inestabilidad hemodinámica, que impide incluso la realización de una TC (21,7%), o anatomía no válida para el tratamiento endovascular (42,8%)564.
11.5Síndrome compartimental abdominal postoperatorioEl síndrome compartimental se define como el aumento de la presión en una cavidad orgánica cerrada que pone en peligro la viabilidad de los órganos contenidos en dicha cavidad. Al hablar de síndrome compartimental abdominal se hace referencia a un aumento de la presión intraabdominal (PIA) por encima de 20 mmHg (habitualmente medida en la vejiga) junto a una disfunción de órganos intraabdominales. Esta disfunción se manifiesta mediante presiones crecientes respiratorias, oligoanuria y disminución del gasto cardíaco.
El síndrome compartimental abdominal es una causa importante y conocida de morbimortalidad postoperatoria en las reparaciones abiertas de los AAA rotos. Con el advenimiento de las técnicas endovasculares, este síndrome cobra especial importancia, dado que mediante estas técnicas no es posible evacuar el hematoma retroperitoneal como se hace con la cirugía abierta.
La incidencia de este síndrome en los pacientes intervenidos mediante abordaje abierto es del 30% y se asocia a una mortalidad en torno al 70%565,566. La incidencia en los casos intervenidos mediante un abordaje endovascular es menor y se establece en torno al 8% en un estudio prospectivo y comparativo con 30 pacientes. En este trabajo, el tratamiento abierto se asoció, además, a una mayor tasa de fallo orgánico y a un mayor estado inflamatorio que los pacientes intervenidos mediante abordaje endovascular567.
En los pacientes intervenidos mediante un abordaje endovascular, la indicación y el momento de la descompresión pueden ser cruciales en la supervivencia. Recientemente se ha publicado un metaanálisis en el que se objetiva una incidencia de síndrome compartimental que puede llegar al 20%. Si bien no se produce una asociación estadísticamente significativa de este síndrome con la muerte a 30 días del paciente, sí se observa cómo la mitad de los casos que lo presentan fallecen568.
En cuanto al manejo de esta complicación hay que diferenciar el manejo en cirugía abierta y en cirugía endovascular. En cirugía abierta se aboga actualmente por realizar un cierre diferido en los casos en los que el cierre se realice a tensión. En los casos en los que el cierre se realice sin aparente tensión se recomienda la monitorización periódica de la PIA. Así, Mayer et al publicaron que en cirugía abierta aproximadamente en el 20% de los pacientes se cerraban en un segundo tiempo569.
En el caso de la cirugía endovascular se recomienda la medición sistemática de la PIA. En el caso de que la PIA se establezca de forma permanente entre 12 y 20 mmHg se instaurarán medidas para disminuir la administración de albúmina, forzar la diuresis con hemofiltración si fuese necesario o el bloqueo neuromuscular en pacientes intubados. En los casos en los que la PIA esté por encima de 20 mmHg habrá que intensificar estas medidas y si se produce cualquier signo de disfunción orgánica o no se consigue reducir esta PIA se procederá a la laparotomía descompresiva570.
*Recomendaciones:
• Se debe medir la PIA en todos los pacientes intervenidos de AAA roto.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: baja.
• Se recomienda la laparotomía descompresiva en los pacientes con un síndrome compartimental abdominal establecido que no responde al tratamiento médico optimizado.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: baja.
Pocos estudios prospectivos aleatorizados han analizado si una de las 2 técnicas (abierta o endovascular) es mejor que la otra en el tratamiento de los AAA rotos. En el año 2006 se analizaron de forma prospectiva, controlada y aleatorizada 32 pacientes (17 mediante cirugía abierta y 15 mediante cirugía endovascular). No se encontraron diferencias en cuanto a la mortalidad a 30 días entre ambos grupos (el 43% en cirugía abierta frente al 46% en EVAR), con un nivel similar de complicaciones mayores entre ambos grupos539. En el año 2007564 se publicó otro estudio prospectivo y aleatorizado en el que se incluyeron pacientes hemodinámicamente estables. A todos se les realizó una TC preoperatoria. Todos los procedimientos endovasculares se realizaron mediante el implante de una endoprótesis aortomonoilíaca. En este estudio, la tasa de aplicabilidad de las técnicas endovasculares en los AAA rotos fue del 35,5% (38/105) debido a inestabilidad o invalidez anatómica (a pesar de que usaban la configuración aortomonoilíaca y admitían longitudes del cuello de hasta 10 mm)564.
En el año 2013 se publicó un estudio prospectivo y aleatorizado con 116 pacientes. No hubo diferencias en cuanto a mortalidad a 30 días, que fue del 21% en el grupo EVAR frente al 25% en el grupo de cirugía abierta, ni en cuanto a morbimortalidad a 30 días, que fue del 42% en el grupo endovascular frente al 47% en el grupo de cirugía abierta571. Los autores concluyen que no existen diferencias entre ambas técnicas.
Recientemente se han publicado los resultados del estudio IMPROVE545. Se aleatorizó a 623 pacientes para tratamiento endovascular o tratamiento quirúrgico convencional. No se encontraron diferencias en cuanto a mortalidad a los 30 días (el 35,4% en el grupo de cirugía endovascular frente al 37,4% en el grupo de cirugía abierta, incluidos los casos de aneurisma sintomático y roto). Si analizamos únicamente los casos de aneurismas rotos se obtienen cifras similares, sin diferencias significativas (el 36,4% en el grupo de cirugía endovascular frente al 40,6% en el grupo de cirugía convencional). El tratamiento endovascular fue más eficaz cuando se trataba de pacientes del sexo femenino, con una mortalidad del 37 frente al 57% en las mujeres que fueron intervenidas mediante cirugía convencional. Tampoco hubo diferencias en cuanto a la mortalidad en las primeras 24 h ni en cuanto a los costes repercutidos en los primeros 30 días. El tratamiento endovascular sí que se asoció a una menor estancia en la unidad de cuidados intensivos y hospitalaria545.
Se han publicado series de casos retrospectivas que adjudican una menor mortalidad a 30 días para los casos intervenidos mediante una técnica endovascular. En un estudio multicéntrico, prospectivo, observacional, no aleatorizado hubo una menor mortalidad a los 30 días en el grupo EVAR (26%) frente a los pacientes intervenidos mediante cirugía convencional (40%). Es importante considerar que los pacientes del grupo EVAR estaban estables, lo que permitía la realización de una TC, mientras que en el grupo de cirugía convencional se encontraban todos los pacientes inestables. Si en este grupo se incluyen solo los pacientes estables, la mortalidad a 30 días fue del 37%542.
En otro estudio retrospectivo publicado en el año 2009 con 567 aneurismas rotos intervenidos, de nuevo se obtuvo una menor mortalidad en el grupo de EVAR (24%) frente a cirugía convencional (36%)572.
Por tanto, no se puede recomendar ninguna de las 2 técnicas como de elección. Parece lógico recomendar la aplicación de técnicas endovasculares cuando el paciente presente unos requerimientos anatómicos adecuados para el tratamiento endovascular y estabilidad hemodinámica. Los casos que tienen peores resultados con estas técnicas son aquellos en los que se aplican, a pesar de no cumplir con unos requerimientos mínimos que han sido claramente descritos en las guías europeas de manejo de aneurismas3 y que vienen incluidos en las instrucciones de uso de las diferentes casas comerciales, y especialmente referidos a los casos que presentan un cuello corto o una angulación excesiva del cuello o ambos a la vez. En estos casos, no estaría indicado de entrada el tratamiento endoluminal en cirugía programada y mucho menos en cirugía de urgencia.
*Recomendación:
• Se recomienda el empleo de técnicas endovasculares para el tratamiento de los AAA rotos siempre y cuando el estado hemodinámico del paciente y las características anatómicas del aneurisma permitan un adecuado tratamiento con esta técnica. En el caso de inestabilidad hemodinámica o anatomía desfavorable para el implante de una endoprótesis se recomienda el tratamiento abierto convencional.
- –
Fuerza de la recomendación: fuerte.
- –
Calidad de la evidencia: moderada.
Hay poca información sobre la influencia que tienen la genética, el ejercicio, el empleo de alcohol o fármacos, las comorbilidades cardiovasculares o las características del trombo en el saco aneurismático acerca del crecimiento y ruptura de los AAA.
En cuanto a los biomarcadores, no está claro el papel que en el futuro pudiera tener el dímero D en el diagnóstico y, sobre todo, en el seguimiento del AAA. Además sigue pendiente la confirmación de algunos biomarcadores propuestos y la búsqueda de nuevos marcadores más específicos.
Respecto al diagnóstico ecográfico del AAA, queda por definir el patrón de referencia universal que debería adoptarse internacionalmente para una mejor reproductibilidad de las medidas tomadas mediante la ecografía. Aunque el diámetro del aneurisma es el indicador aceptado para plantear la reparación quirúrgica de los AAA, no todos los AAA se rompen con un mismo diámetro. Por otro lado, en los últimos años ha habido un gran desarrollo de las técnicas de imagen y de la tecnología para su procesamiento, que nos plantea la posibilidad de dar un paso más en la valoración morfológica de los AAA y no quedarnos simplemente con la medición del diámetro para buscar signos que nos indiquen qué aneurismas tienen mayor riesgo de romperse. De esta forma, se ha correlacionado el riesgo de rotura del AAA con su volumen y no con el diámetro, con la presencia o no de trombo mural y el volumen que este ocupa, y se han buscado, mediante programas informáticos capaces de hacer cálculos de elementos finitos sobre la pared del AAA, puntos de mayor estrés que pudieran indicar un aumento del riesgo de rotura.
Por la menor prevalencia de AAA en mujeres que en varones, todos los estudios obtienen conclusiones válidas para varones, pero en menor medida para mujeres. Se sabe que las mujeres tienen una tasa de expansión de AAA no diferente de la de los varones, pero asocian mayor riesgo de rotura de los AAA y esta se produce con diámetros menores. Probablemente, los criterios de derivación e indicación quirúrgica en mujeres deberían fijarse en diámetros menores que los de los varones.
En lo referente al tratamiento médico, la evidencia del posible efecto protector del crecimiento/rotura del AAA con fármacos como estatinas, IECA y ARA II es débil y se requieren estudios adicionales para poder recomendar su uso de modo general. Los bloqueadores beta no han demostrado utilidad en la prevención del crecimiento y complicaciones del AAA. Son necesarios estudios adicionales para valorar la utilidad de antibióticos y otros fármacos antinflamatorios en la evolución natural del AAA. Es importante destacar que no basta que un tratamiento muestre una reducción del crecimiento del AAA. Por tanto, todos los tratamientos a largo plazo que atenúen el crecimiento del AAA deben demostrar un claro balance riesgo/beneficio en ensayos clínicos adecuadamente diseñados, con particular énfasis en la seguridad cardiovascular.
Los AAA que consideremos sintomáticos deben derivarse de forma urgente para valoración por cirugía vascular, pero no está claro si se deben someter a una cirugía de emergencia, igual que los AAA rotos, o es más beneficioso manejarlos como una “urgencia diferida” que se realice lo antes posible pero, que a su vez, permita optimizar la condición preoperatoria del paciente.
En los últimos años, debido al desarrollo de la EVAR, no se han llevado a cabo nuevos ensayos clínicos que comparen los diferentes tipos de abordaje quirúrgico para establecer indicaciones al respecto. Tampoco existen ensayos controlados aleatorizados que comparen los diferentes modelos de endoprótesis existentes para la EVAR y es necesaria una mayor investigación para establecer recomendaciones en la selección del tipo de injerto. También se requieren nuevos estudios para valorar la seguridad y eficacia de la utilización de técnicas alternativas (sandwich, chimenea, snorkel) y el desarrollo de endoprótesis ramificadas para el tratamiento de aneurismas suprarrenales o toracoabdominales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Abreviaciones y acrónimosAAA aneurisma de aorta abdominal accidente cerebrovascular antiinflamatorios no esteroideos arteria mesentérica inferior antagonista del receptor de la angiotensina II péptido natriurético cerebral electrocardiograma enfermedad cardiovascular enfermedad pulmonar obstructiva crónica reparación endovascular del aneurisma de aorta fístula enteroprotésica fracción de eyección del ventrículo izquierdo Grading of Recommendations Assessment, Development and Evaluation infarto agudo de miocardio intervalo de confianza insuficiencia cardíaca congestiva inhibidor de la enzima de conversión de la angiotensina interleucina 6 insuficiencia renal lipoproteína (a) metaloproteinasas fragmento N-terminal del péptido natriurético cerebral proteína C reactiva presión intraabdominal resonancia magnética Sociedad Española de Arteriosclerosis Sociedad Española de Angiología y Cirugía Vascular sistema renina-angiotensina tomografía computarizada